席夫碱的合成 ppt课件
席夫碱缩合反应

席夫碱缩合反应席夫碱缩合反应是一种有机合成反应,常用于构建碳-碳键的方法之一。
在这篇文章中,我将对席夫碱缩合反应进行深入探讨,包括该反应的机理、条件、应用和局限性。
一、席夫碱缩合反应的机理席夫碱缩合反应是通过在酮或醛化合物与含活泼甲基的化合物(如甲醛、丙酮等)反应过程中生成亲核碱与活泼甲基化合物中的羰基进行缩合来实现的。
该反应机理如下所示:1. 亲核加成:亲核碱进攻羰基碳上的电子,形成一个中间体。
2. 消除:中间体发生消除反应,生成一种称为席夫碱的中间产物。
3. 脱水:通过脱水反应,席夫碱中间产物失去一个水分子,生成最终的缩合产物。
二、席夫碱缩合反应的条件席夫碱缩合反应需要满足以下条件:1. 亲核碱:常用的亲核碱包括胺、硬脂酸钠等。
2. 活泼甲基化合物:活泼甲基化合物是席夫碱缩合反应中重要的组成部分,常见的活泼甲基化合物有甲醛、丙酮、乙酮等。
3. 溶剂:反应中常用的溶剂包括甲醇、乙醇、二甲基亚砜等。
4. 酸催化:为了促使席夫碱缩合反应进行,常需要在反应过程中加入酸性催化剂,如盐酸、硫酸等。
三、席夫碱缩合反应的应用席夫碱缩合反应在有机合成中具有广泛的应用价值,可以用于构建碳-碳键的扩大分子结构的范围。
以下是席夫碱缩合反应的几个应用领域:1. 药物合成:席夫碱缩合反应可用于药物合成的关键步骤,如合成抗生素、抗肿瘤药物等。
2. 天然产物合成:很多具有生物活性的天然产物分子中含有席夫碱结构,席夫碱缩合反应可以用于天然产物的全合成。
3. 功能材料合成:席夫碱缩合反应在合成有机光电材料和涂料方面具有潜在应用,可以用于构建材料的分子结构和功能性。
四、席夫碱缩合反应的局限性尽管席夫碱缩合反应具有广泛的应用,但也存在一些局限性:1. 可能产生副反应:在席夫碱缩合反应中,一些羰基化合物可能会与亲核碱发生其他副反应,导致反应不完全或产物不纯。
2. 手性产物选择性不高:在一些情况下,席夫碱缩合反应对手性产物选择性不高,导致产物的外消旋。
席夫碱的合成PPT精选文档

.
8
质谱分析:
席夫碱配体结构较为简单,可以得到准确的分子 式和分子量,通过比对配体,配合物和聚合物三 者的图谱可以判断是否生成了配合物或聚合物。
.
7
• 紫外光谱:如果席夫碱的配体中含有苯环、双键 等对紫外光吸收明显的基团时,可以得到一系列 的吸收谱带。
• X−射线衍射
若得到单晶产物并经过初步测试判断为所期望的席 夫碱配合物或配位聚合物,则可进一步作X−射线 单晶衍射分析,得出完整的晶体结构和晶体学数 据。
席夫碱化合物的合成
• 席夫碱是是含有亚胺或甲亚胺特性基团 (C══N)的一类有机化合物,通常席夫碱 由胺和有活性羰基的化合物(醛、酮等)缩 合而成,改变连接的取代基及其位置,变化 给电子基团的位置,可以开拓出许多从链状 到环合,从单齿到多齿、结构多变、性能迥 异的席夫碱配体。席夫碱不仅可以和过渡金 属形成配合物,还可以和镧系、锕系及部分 主族金属元素形成稳定的配合物。
.
3
• 单席夫碱
由单胺类和单羰基类化合物缩合而成,经 常作为阴离子型二齿配体和中性的单齿配体。
.
4
• 双席夫碱
由一分子的二胺类和两分子的羰基化合物缩合所 得,常用的二胺有邻苯二胺,乙二胺,丙二胺, 当R5,R6为羟基时,便得到了缩乙二胺(Salen)
.5ຫໍສະໝຸດ • 大环席夫碱由芳香二醛(苯,吡啶,呋喃,噻吩等)或二酮
化合物与一系列多胺缩合得到,形成含有不饱和官 能团的席夫碱的杂原子大环化合物。
.
6
• 结构表征:
元素分析:
通过元素分析测定产物的C、H、N含量,推测配体 的分子式和分子量,用元素分析仪来测定。
红外光谱:
席夫碱的C══N具有明显而特殊的红外吸收,可 作为合成配体的初步判断依据,通过红外光谱吸 收峰的位置、吸收峰的数目及其强度可以确定产 品所含的官能团,进一步分析产物的组成。
席夫碱Cu催化剂的合成及催化性能分析

当代化工研究Modern Chemical R esearch 192019•06综述与专论席夫碱Cu催化剂的合成及催化性能分析*朱剑波(绍兴上虞华伦化工有限公司浙江312369)摘耍:工业废水的主要来源就是印染行业产生的印染废水,而印染废水最大的污染物之一来自于有机染料.有机染料具有三致毒性,通过自然降解的方法难以除去,染料污■染问题成为了印染行业发展面临餉最大的瓶颈.近年来有关金属配合物的研究成为热点,尤其是关于Cu餉配合物,据报道席夫碱配合物拥有可以逆向性吸附氧分子以及催化、氧化等性能.本文主要针对席夫碱Cu催化剂的合成及其性能方面做简要分析.关键词:席夫碱;催化剂合成;催化性能中EB分类号:T文献标识码:ASynthesis and Catalytic Performance Analysis of Schiff Base Cu CatalystZhu Jianbo(Shaoxing Shangyu Warren Chemical CO.,LTD.,Zhejiang,312369)Abstract:The main source of i ndustrial wastewater is the printing and dyeing wastewater p roduced by the p rinting and dyeing industry,and one of t he greatest p ollutants in the printing and dyeing wastewater comes f rom organic anic dyes have triple toxicity,"which is difficult to remove by natural degradation.Dye pollution has become the biggest bottleneck in the development of p rinting and dyeing industry.In recent years, the research on metal complexes has become a hotspot,especially on copper complexes.It is reported that Schiff b ase complexes have the p roperties of r eversible adsorption of o xygen molecules,catalysis and oxidation.In this paper,the synthesis and p roperties of S chiff b ase Cu catalyst are briefly analyzed.Key words:Schiff b ase;catalyst synthesis;catalytic p erformance到目前为止,人们所知道的处理工业有机废水的方法主要有三种。
无溶剂合成席夫碱的方法

无溶剂合成席夫碱的方法席夫碱是一种含有吡咯烷环的化合物,具有广泛的药理活性,被广泛应用于医药领域。
在有溶剂合成方法中,通常会使用有机溶剂如甲醇、乙醇等作为反应介质。
但随着对环境污染的关注以及对低毒性合成方法的需求,无溶剂合成方法逐渐受到研究者的关注。
1.固相合成法固相合成法是一种无溶剂合成方法,它将反应物固定在固相载体上,通过反应自由基进行反应。
该方法具有反应速度快、操作简单的优点。
例如,可以将已经固定在固相载体上的碘代烷基和炔烃反应得到席夫碱。
2.机械法机械法是一种利用机械力促进反应的无溶剂合成方法。
例如,可以将碘代烷基和炔烃放入球磨瓶中,通过高速旋转的球磨瓶使两者发生反应,并形成席夫碱。
3.微波辐射法微波辐射法是一种利用微波辐射加速化学反应的方法。
在合成席夫碱的过程中,可以将碘代烷基和炔烃放入微波反应器中,通过微波辐射加热反应物,使其在较短的时间内发生反应,得到席夫碱。
值得注意的是,无溶剂合成方法虽然具有环境友好、高效等优势,但也存在一些挑战。
例如,由于无溶剂条件下反应物之间的接触受限,反应速率可能较慢。
此外,一些具有较低溶解度的反应物可能不适合在无溶剂条件下进行反应。
因此,在无溶剂合成席夫碱的过程中,需要进行反应条件的优化,选择适合的反应物和催化剂,以提高反应效率和产率。
总之,无溶剂合成席夫碱是一种具有环境友好、高效的合成方法。
通过固相合成法、机械法、微波辐射法等方式,可以在无溶剂条件下合成席夫碱。
这些方法为开发更多绿色合成方法提供了新的思路,并有望在药物化学、有机合成等领域得到广泛应用。
需要进一步研究优化反应条件,提高无溶剂合成方法的适用性和产率。
全面席夫碱的合成.ppt

.....
8
化合物与一系列多胺缩合得到,形成含有不饱和官 能团的席夫碱的杂原子大环化合物。
.....
6
• 结构表征:
元素分析:
通过元素分析测定产物的C、H、N含量,推测配体 的分子式和分子量,用元素分析仪来测定。
红外光谱:
席夫碱的C══N具有明显而特殊的红外吸收,可 作为合成配体的初步判断依据,通过红外光谱吸 收峰的位置、吸收峰的数目及其强度可以确定产 品所含的官能团,进一步分析产物的组成。
席夫碱化合物的合成
• 席夫碱是是含有亚胺或甲亚胺特性基团 (C══N)的一类有机化合物,通常席夫碱 由胺和有活性羰基的化合物(醛、酮等)缩 合而成,改变连接的取代基及其位置,变化 给电子基团的位置,可以开拓出许多从链状 到环合,从单齿到多齿、结构多变、性能迥 异的席夫碱配体。席夫碱不仅可以和过渡金 属形成配合物,还可以和镧系、锕系及部分 主族金属元素形成稳定的配合物。
.....
3
• 单席夫碱
由单胺类和单羰基类化合物缩合而成,经 常作为阴离子型二齿配体和中性的单齿配体。
.....
4
• 双席夫碱
由一分子的二胺类和两分子的羰基化合物缩合所 得,常用的二胺有邻苯二胺,乙二胺,丙二胺, 当R5,R6为羟基时,便得到了缩乙二胺(Salen)
.....
5
• 大环席夫碱
由芳香二醛(苯,吡啶,呋喃,噻吩等)或二酮
质谱分析:
席夫碱配体结构较为简单,可以得到准确的分子 式和分子量,通过比对配体,配合物和聚合物三 者的图谱可以判断是否生成了配合物或聚合物。
.....
7
• 紫外光谱:如果席夫碱的配体中含有苯环、双键 等对紫外光吸收明显的基团时,可以得到一系列 的吸收谱带。
席夫碱及其金属配合物的合成与表征

振仪以 N DQ 1; \ O DQ为内标测得 =>的 # 为溶剂 5 氢 谱M 用 => 型 联 用 仪 测 得 => ! ! !E ^ ^ ]$ . DQ D_ 的质谱 & 表3 表’ 5 + " 电 子 光 谱 用 ‘a; 4 " 3 " ’ $ ’ ! 4 > .型 紫 外 光 谱 仪 S3 S4 对 所合 成的 化 合 物 在 浓 度 为 4 " ! R4 ! 2E () * 的 甲 醇 溶 液 中5 从 4 T ! WT ! !@ ( 范围内连续扫描 得到电子光谱 & 表$ + "
水杨醛及其 衍 生 物 与 某 些 伯 胺 类 化 合 物 缩 合 形 成 的席 夫 碱 及 其 金 属 螯 合 物 / 具 有 特 殊 的 抗 癌= 抗炎= 杀菌 抑 霉 等 活 性 / 同时由于其结构类似于卟 啉环和酞箐环 / 有较好的载氧和模拟生物酶的催化
& G 作 用/ 已 经 引 起 了 各 国 化 学 家 的 广 泛 兴 趣F 对水 ’
物< 的合成 ; &分水解 5 故采 用 ’ & ! 7 乙醇 测定 + " 配 体 在 =>的 电 子 光 谱 中 & 见表 $ 的 + 5. c, ; d
e 在红外光谱中& 见表 0 6 #@ + 5 d 跃迁出现在 0 (" S4 的 出 现 在 在 4# $ 4X 4# C 6 f => ( 5 f c c, c c1 . . S4 S4 可 ’ 0X ( "在 =>的 质 谱 图 中 5 X ( 5f 1S /在 03 以看到很强的分子离子峰 ’ 基峰 6 # C & T 4 " # C 7+ M $ 是 分 子 离 子 经 过 多 次 断 裂 后 形 成 的 & 4 ! ! 7+ g 其余碎片离子峰见表 3 从 => 的 4 " /$ Q 10 M / 图谱可以看出 亚胺质子 的化 学 5 &. ,DY /c , +
水杨醛缩乙二胺席夫碱及金属配合物的合成
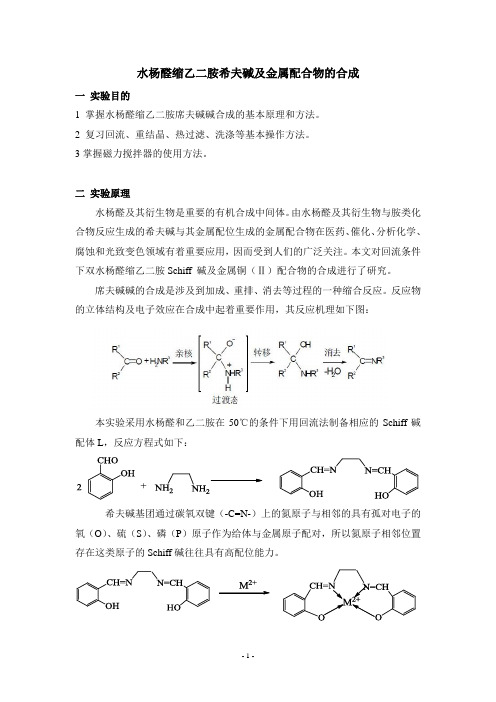
水杨醛缩乙二胺希夫碱及金属配合物的合成一实验目的1 掌握水杨醛缩乙二胺席夫碱碱合成的基本原理和方法。
2 复习回流、重结晶、热过滤、洗涤等基本操作方法。
3掌握磁力搅拌器的使用方法。
二实验原理水杨醛及其衍生物是重要的有机合成中间体。
由水杨醛及其衍生物与胺类化合物反应生成的希夫碱与其金属配位生成的金属配合物在医药、催化、分析化学、腐蚀和光致变色领域有着重要应用,因而受到人们的广泛关注。
本文对回流条件下双水杨醛缩乙二胺Schiff 碱及金属铜(Ⅱ)配合物的合成进行了研究。
席夫碱碱的合成是涉及到加成、重排、消去等过程的一种缩合反应。
反应物的立体结构及电子效应在合成中起着重要作用,其反应机理如下图:本实验采用水杨醛和乙二胺在50℃的条件下用回流法制备相应的Schiff碱配体L,反应方程式如下:希夫碱基团通过碳氧双键(-C=N-)上的氮原子与相邻的具有孤对电子的氧(O)、硫(S)、磷(P)原子作为给体与金属原子配对,所以氮原子相邻位置存在这类原子的Schiff碱往往具有高配位能力。
M2+为金属离子(M2+分别为Cu2+、Zn2+、Ni2+、Mn2+、Ni2+等离子)二仪器和药品1 仪器100mL三口烧瓶恒压滴液漏斗磁力搅拌器玻璃塞抽滤瓶烧杯2 药品水杨醛(相对分子质量122.12,密度1.17g/cm³乙二胺(相对分子质量60.10,密度0.90g/cm³无水乙醇乙酸铜、硝酸钴、乙酸锰、乙酸锌、硝酸锌、氯化镍三实验步骤1 希夫碱配体(L)的合成步骤移取5.2mL(0.05mol)的水杨醛与15 mL的无水乙醇溶于三口瓶中,再量取1.8mL(0.025mol)的乙二胺与10mL的无水乙醇于烧杯中搅拌溶解。
将三口瓶固定在搅拌器上,开启仪器,将乙二胺的无水乙醇溶液逐滴滴加到三口瓶中,恒温55℃反应1小时。
反应结束。
抽滤得黄色的固体,干燥称重并计算产率。
反应装置图如下:乙二胺的无水乙醇溶液2 希夫碱配体(L)与金属离子(M2+)的反应步骤称取1.34g(0.005mol)配体L,与20 mL的无水乙醇混合溶解于三口瓶中,在称取金属盐,若为乙酸铜时质量为1g(0.005mol)。
席夫碱的合成 ppt课件

通过元素分析测定产物的C、H、N含量,推测配体 的分子式和分子量,用元素分析仪来测定。
红外光谱:
席夫碱的C══N具有明显而特殊的红外吸收,可 作为合成配体的初步判断依据,通过红外光谱吸 收峰的位置、吸收峰的数目及其强度可以确定产 品所含的官能团,进一步分析产物的组成。
质谱分析:
精品资料
• 你怎么称呼老师?
• 如果老师最后没有总结一节课的重点的难点,你 是否会认为老师的教学方法需要改进?
• 你所经历的课堂,是讲座式还是讨论式? • 教师的教鞭
• “不怕太阳晒,也不怕那风雨狂,只怕先生骂我 笨,没有学问无颜见爹娘 ……”
• “太阳当空照,花儿对我笑,小鸟说早早早……”
• 分类 按齿数分类:单齿,二齿,多齿 按结构分类:单席夫碱,多席夫碱,大环席夫碱 按对称性来划分:对称席夫碱,不对称席夫碱
• 单席夫碱
由单胺类和单羰基类化合物缩合而成,经 常作为阴离子型二齿配体和中性的单齿配体。
• 双席夫碱
由一分子的二胺类和两分子的羰基化合物缩合所 得,常用的二胺有邻苯二胺,乙二胺,丙二胺, 当R5,R6为羟基时,便得到了缩乙二胺(Salen)
• 大环席夫碱
由芳香二醛(苯,吡啶,呋喃,噻吩等)或二酮 化合物与一系列多胺缩合得到,形成含有不饱和官 能团的席夫碱的杂原子大环化合物。
席夫碱配体结构较为简单,可以得到准确的分子 式和分子量,通过比对配体,配合物和聚合物三 者的图谱可以判断是否生成了配合物或聚合物。
席夫碱的合成席夫碱化合物的合成?席夫碱是是含有亚胺或甲亚胺特性基团cn的一类有机化合物通常席夫碱由胺和有活性羰基的化合物醛酮等缩合而成改变连接的取代基及其位置变化给电子基团的位置可以开拓出许多从链状到环合从单齿到多齿结构多变性能迥异的席夫碱配体
席夫碱(亚胺)还原

席夫碱(亚胺)还原
席夫碱(又称亚胺)是一种有机化合物,常用于有机合成反应中。
它可以通过还原反应转化为相应的胺化合物。
席夫碱还原通常使用还原剂(如氢气、金属钠、金属锂或亚硫酸钠等)在适当的条件下进行。
这些还原剂可以将席夫碱中的双键或三键还原为单键,并且将氮原子上的羰基还原为氨基。
席夫碱还原反应的条件和选择的还原剂取决于具体的化合物和反应要求。
在有机合成中,席夫碱还原反应常常用于合成胺类化合物,因为胺是许多生物活性分子和药物的重要结构单元。
从化学角度来看,席夫碱还原是通过断裂碳-氮双键或碳-氮三键,生成相应的胺化合物。
这种还原反应在有机合成中具有重要的应用价值,可以构建碳-氮键,生成具有生物活性的化合物。
此外,从实验操作的角度来看,席夫碱还原需要注意反应条件的控制,如温度、溶剂选择、反应时间等。
还原剂的选择也需要根据反应底物的特性和反应条件进行合理的考虑。
在实验操作中,需要注意安全防护措施,避免还原剂的挥发和火灾等安全隐患。
总的来说,席夫碱还原是有机合成中常见的重要反应之一,具
有广泛的应用前景和重要的理论和实际意义。
在进行席夫碱还原反应时,需要综合考虑化学、实验操作和安全等多个方面的因素,以确保反应能够高效、安全地进行。
水杨醛及其席夫碱类二芳基乙烯的合成及性质研究PPT课件

2+ 2+
Cd Ca
2+ 2+
Pb Hg
2+ 2+ 2+ 3+
Sr Cu Co Cr
3+
Fe
None
C
None
Al 3+ Zn 2+
K+
Mn Mg Ba Ni
2+ 2+ 2+ 2+
Cd Ca Pb
B D
2+ 2+ 2+
Hg Sr Cu Co Cr Fe
2+ 2+ 2+ 2+ 3+ 3+
Emission intensity (a.u.) Emission intensity (a.u.)
600 500 400 300 200 100
0 400
Vis UV
450
500
550
Wavelength (nm)
C
A
B
0.4
Free and other metal ions
1.0
0.3 0.8
0.2
0.6
Absorbance A/A
席夫碱型共价有机骨架的合成

席夫碱型共价有机骨架的合成1.引言1.1 概述席夫碱型共价有机骨架的合成是一种重要的有机合成方法,它在有机化学领域具有广泛的应用前景。
席夫碱型共价有机骨架是指一种具有特定空间结构和化学活性的有机分子骨架,在化学反应中能够发挥重要的催化作用。
席夫碱型共价有机骨架合成的特点主要包括以下几个方面。
首先,这种合成方法能够通过简单的化学反应步骤将不同的有机碳源与合适的功能基团连接起来,从而构建具有特定结构和功能的有机分子骨架。
其次,席夫碱型共价有机骨架的合成方法具有高度的选择性和效率,能够在温和的反应条件下实现高产率的合成。
此外,该方法还能够实现对合成过程中的反应条件和催化剂种类的调控,从而进一步提高目标产物的纯度和收率。
席夫碱型共价有机骨架的合成方法主要包括两个重要的步骤:骨架的构建和功能基团的引入。
在骨架的构建过程中,可以利用多种有机反应,如缩合反应、加成反应和环化反应等,通过化学键的形成将相邻的碳原子连接在一起,形成碳骨架的主干。
而功能基团的引入则是通过改变合成中使用的官能化合物或催化剂的种类,将所需的功能基团引入到有机骨架中。
席夫碱型共价有机骨架的合成方法具有广泛的应用前景。
一方面,席夫碱型共价有机骨架可以作为新型的有机催化剂,在有机合成中发挥重要的催化作用,提高反应的速率和选择性。
另一方面,席夫碱型共价有机骨架还可以作为新型的有机功能材料,具有特殊的物理和化学性质,有望在药物合成、材料科学和生物化学等领域展现出巨大的应用潜力。
综上所述,席夫碱型共价有机骨架的合成是一种重要的有机合成方法,具有重要的应用前景。
通过对骨架的构建和功能基团的引入,可以构建具有特定结构和功能的有机分子骨架,从而在化学反应中发挥重要的催化作用。
这种合成方法在有机化学领域得到广泛应用,并为开发新型的有机催化剂和功能材料提供了新的思路和途径。
1.2 文章结构本文将按照以下结构进行展开讨论席夫碱型共价有机骨架的合成方法:第一部分为引言部分,将对席夫碱型共价有机骨架的定义和特点进行概述,以引入读者对这一概念的基本了解。
希夫碱的合成方法

希夫碱(Schiff-base)简介:希夫碱(Schiff-base)是德国化学家Hugo Schiff 在1879年发现的,并以自己的名字命名的;希夫碱(Schiff-base)是指含有甲亚胺(-HC=N-)或者亚胺特性基团(-RC=N-)的一类有机化合物,因此也称亚胺或亚胺取代物,通常希夫碱主要是由胺和活性羰基缩合形成碳氮双键(>C=N-)化合物[1]。
希夫碱是一类非常重要的有机化合物,其种类繁多,按配体结构分:单希夫碱、双希夫碱、大环希夫碱;按缩合物质不同分:缩胺类希夫碱、缩酮类希夫碱等。
希夫碱的早期研究为缩胺类,后来发展为缩酮类、缩胺类、缩氨基脲类、胍类、氨基酸类及氨基酸酯类等。
根据希夫碱的结构的特征,能灵活地选择各种羰基化合物和不同的胺类反应,改变连接的取代基,变化给予体原子的位置,可以得到从单齿到多齿,链状到环状,对称到不对称等种类繁多、结构复杂的希夫碱。
希夫碱的合成方法根据希夫碱的结构的特征,其合成相对容易,能灵活地选择各种羰基化合物和不同的胺类反应,改变连接的取代基,变化给予体原子的位置,可以得到从单齿到多齿,链状到环状,对称到不对称等种类繁多、结构复杂的希夫碱[2]。
希夫碱的合成是一种缩合反应,涉及加成、重排、消去等过程,反应物立体结构及电子效应起着重要的作用。
a.直接合成法或称“现场合成法”(insitu synthesis)氨基氮上的孤对电子进攻羰基碳,羰基的碳氧双键中的一个电子给氧原子,形成一个碳四中间体。
原来碳原子上的双键变成两个单键,一个单键连接氧负原子,另一个单键连在-NH2R3基团上。
随后氧负原子结合氢变成羟基,-NH2R3失去氢,成为-NHR3,接着羟基和-NHR3中的氢结合脱去一分子水,形成含碳氢双键的亚胺,及希夫碱。
其合成通式及缩合反应机理如下[3]:R1C R2O+H2NR1C2ONHRHR1CR2OHNHR2R1CR2NR3过渡态b.模板合成法(template synthesis)当反应物活性低或产物不稳定不能得到预期的Schiff碱时,可将金属离子作为模板试剂加入到拨基化合物中与二胺反应,则可能形成含金属离子的schiff碱配合物,也可以用其他金属离子取代此金属,例如重斓系对成环数小的14元环是有利的模板试剂,而对18元环不利;轻斓系对形成18元环或开环衍生物却是良好的模板试剂。
席夫碱的制备(甲苯制备但己烷和二氯甲烷重结晶)

Organic Syntheses, Coll. Vol. 8, p.586 (1993); Vol. 65, p.108 (1987).AMBIENT-TEMPERATURE ULLMAN REACTION: 4,5,4',5'-TETRAMETHOXY-1,1'-BIPHENYL-2,2'-DICARBOXALDEHYDE [1,1'-Biphenyl]-2,2'-dicarboxaldehyde, 4,4',5,5'-tetramethoxy-]Submitted by F. E. Ziegler, K. W. Fowler, W. B. Rodgers, and R. T. Wester1.Checked by Tetsuji Oshima and Ryoji Noyori.1. ProcedureCaution! Aqueous sodium cyanide is used in this procedure. All operations should be conducted in a well-ventilated hood and rubber gloves should be worn.A. 6-Bromo-3,4-dimethoxybenzaldehyde cyclohexylimine(1). A 2-L, three-necked flask is equipped with a Dean–Stark trap, a reflux condenser, a magnetic stirrer, and a nitrogen inlet. The vessel is purged with nitrogen and charged with 40.0 g (0.16 mol) of 6-bromo-3,4-dimethoxybenzaldehyde(6-bromoveratraldehyde) (Note 1). 22.4 mL (0.20 mol) of cyclohexylamine(Note 2), and 800 mL of toluene. The mixture is refluxed for 16 hr (Note 3). The solution is cooled to room temperature and the solvent is removed on a rotary evaporator. The residual crystalline mass is recrystallized from a 3 : 1 hexane–methylene chloride mixture (1.5 L) to provide 48.4–51.4 g of the imine 1 as white crystals in two crops (mp 172–172.5°C)2(Note 4).B. Cuprous iodide-triethyl phosphite complex (2). (Note 5). A 1-L, round-bottomed flask equipped with a magnetic stirrer and reflux condenser is flame-dried under nitrogen . The vessel is charged with 38.2 g (0.20mol) of cuprous iodide , 33.4 mL (0.20 mol) of triethyl phosphite (Note 6) and 400 mL of dry toluene (distilled from CaH 2). The mixture is stirred at 80°C for 8 hr, cooled to room temperature, and filtered under reduced pressure on a pad of Celite. The solvent is removed from the filtrate successively with a rotary evaporator and briefly (15 min) under high vacuum. The residual solid is recrystallized from ether (25 mL) to yield 41.1–49.9 g (57.4–69.8%) of cuprous iodidetriethyl phosphite complex in two crops, mp 114–115°C.C. 6-Iodo-3,4-dimethoxybenzaldehyde cyclohexylimine (3). A 1-L, three-necked flask is equipped with a Claisen adapter (Note 7), a Trubore stirrer, a nitrogen inlet, and glass stoppers. The flask is thoroughly flame-dried under nitrogen . To the cooled flask is added 14.0 g (0.043 mol) of cyclohexylimine 1 and the glass stoppers are replaced by an alcohol thermometer and a rubber septum. Tetrahydrofuran (400 mL) (Note 8) is added via syringe through the septum and the resultant mixture is stirred at room temperature (27°C) for 30 min to effect solution. The solution is cooled to −78°C in dry ice–acetone bath (Note 9). A solution of butyllithium in hexane (30.9 mL, 1.53 M , 0.047 mol) (Note 10) is added by syringe over 10 min at such a rate as to maintain the temperature below −75°C (Note 11). As the butyllithium is added the precipitate slowly dissolves, leaving a clear, golden-yellow solution that is stirred for 15 min after the addition is complete. A solution of 27.0 g (0.11 mol) of iodine dissolved in 50 mL of dry THF is added via syringe to the reaction mixture at such a rate as to maintain the temperature below −70°C. The iodine solution (20–25 mL) is added until the red iodine color persists; precipitation also occurs. The mixture is warmed to room temperature, poured into 400 mL of water, and extracted with methylene chloride (5 × 400 mL). The combined organic extracts are dried (anhydrous MgSO 4), filtered and concentrated on a rotary evaporator to 200 mL, and then washed with 200 mL of aqueous saturated sodium sulfite solution. The organic phase is redried, filtered, and concentrated. The solid residue is recrystallized from a 1:4 chloroform –hexane mixture (300 mL) to afford 12.6–13.5 g (78.6–85.0%) of 6-iodoveratraldehyde cyclohexylimine as white crystals, mp 180–181°C 2 (Note 4).D. 4,5,4',5'-Tetramethoxy-1,1'-biphenyl-2,2'-carboxaldehyde (4). The metalation procedure described in Section C is repeated using a 3-L flask, 18.4 g (0.056 mol) of 6-bromoveratraldehyde cyclohexylimine (1), 575 mL of tetrahydrofuran , and 40.6 mL (1.53 M , 0.062 mol) of butyllithium . After the metalation is complete at −78°C, the septum is replaced by a glass stopper. Solid cuprous iodide –triethyl phosphite complex (30.3 g, 0.085 mol) is added to the vessel at −78°C in one portion, immediately giving a green solution. The mixture is stirred for an additional 30 min. After the first 15 min, the solution turns a brownish-orange to red color. Solid 6-iodoveratraldehyde cyclohexylimine (3) (21.0 g, 0.056 mol) is added in one portion to produce an orange suspension. The reaction mixture is allowed to warm to room temperature (27°C), during which time the mixture becomes dark brown. The reaction mixture is stirred for 18 hr at room temperature. The reaction mixture is diluted with 600 mL of methylene chloride and 850 mL of 15% aqueous acetic acid and stirred vigorously for 17 hr. The yellow solution is transferred to a 4-L separatory funnel and the layers are separated. The organic layer is dried (anhydrous magnesium sulfate ), filtered, and concentrated on a rotary evaporator to 800 mL and then transferred to a 2-L separatory funnel. The organic solution is washed with 5% aqueous hydrochloric acid (5 × 100 mL) and saturated aqueous sodium bicarbonate solution (10 × 50 mL).(Caution: The final washings must be alkaline to avoid the liberation of hydrogen cyanide in the subsequent step.) The organic layer is washed twice with 500 mL of 10% aqueous sodium cyanide solution, once with 500 mL of saturated aqueous sodium bicarbonate , and twice with 500 mL of water. (Caution: The sodium cyanide washes should be bottled separately and labeled appropriately for approved disposal.) The organic layer is dried (anhydrous magnesium sulfate ), filtered, and concentrated to provide 16.3–20.3 g of residue. Crystallization from a 1 : 3 methylene chloride –hexane mixture at 5°C affords 13.1–16.9 g (70.4–90.7%) of beige crystals of the biphenyl, mp 215–216°C (lit.3 214–215°C) after drying under high vacuum (0.1 mm) (Note 4).2. Notes1. 6-Bromo-3,4-dimethoxybenzaldehyde was purchased from the Aldrich Chemical Company, Inc.(Milwaukee) or readily prepared by bromination of veratraldehyde (Aldrich Chemical Company, Inc. or Tokyo Kasei).4 2. Cyclohexylamine (Aldrich Chemical Company, Inc. or Nakarai Chemicals) and all solvents and reagents (reagent grade) were used as received, unless otherwise specified. 3. The water level in the trap remains constant after this period of time. 4. Spectral characterization: 1H NMR (CDCl 3). 6-Bromoveratraldehyde cyclohexylimine, δ: 1.07–1.82 (m, 10 H), 3.30 (m, 1 H, NCH), 3.89 (s, 3 H, OCH 3) 3.92 (s, 3 H, OCH 3), 6.97 (s, 1 H), 7.55 (s, 1 H), 8.54 (s, 1 H, N=CH); 6-Iodoveratraldehyde cyclohexylimine, δ: 1.07–1.82 (m, 10 H), 3.31 (m, 1 H, NCH), 3.88 (s, 3 H, OCH 3), 3.92 (s, 3 H, OCH 3), 7.22 (s, 1 H), 7.53 (s, 1 H), 8.32 (s, 1 H, N=CH). 4,5,4',5'-Tetramethoxy-1,1'-biphenyl-2,2'-dicarboxaldehyde, δ: 3.96 (s, 6 H, OCH 3), 4.01 (s, 6 H, OCH 3), 6.80 (s, 2 H), 7.56 (s, 2 H), and 9.67 (s, 2 H, CHO). 5. This method was adapted from the procedure of Nishizawa.5 The complex is reported to have mp 109–110°C.6 6. Cuprous iodide was purchased from Alfa Products, Johnson Mathey Co., or Kishida Chemicals and triethyl phosphite from the Aldrich Chemical Company, Inc. or Nakarai Chemicals. 7. The offset neck of the adapter was fitted with the nitrogen inlet and the other neck with a glass stopper that was eventually replaced with a thermometer. 8. Tetrahydrofuran (THF) was distilled from sodium benzophenone ketyl under nitrogen in all applications. 9. The bromide, 1, precipitated during the cooling. 10. Butyllithium was purchased from Alfa Products, Johnson Mathey Co., or Mitsuwa Pure Chemicals and was standardized by the method of Kofron.7 11. Alcohol thermometers were found not to read temperatures accurately. A temperature of −78°C designates the lowest temperature to which a large dry ice–acetone bath cools the reaction mixture. The temperature −75°C signifies a 3° rise in temperature.3. DiscussionThe Ullman reaction has been traditionally conducted at elevated temperatures (100–250°C), with or without solvent, in the presence of copper powder. Often the quality of copper can be extremely important to the success of the reaction.8 Aromatic bromides and halides that bear ortho -substituted electron-withdrawing groups undergo coupling at the low end of the temperature range. Cross-coupling is best accomplished when only one of the aryl halides bears an electron-withdrawing group.9 In such instances, an excess of the aryl halide without the electron-withdrawing group may have to be employed.10Nickel(0) reagents have been employed in the symmetric coupling of aryl halides in sterically unencumbered cases.11,12 An efficient cross-coupling reaction between an arylzinc halide and an ortho -iodoarylimine under mild conditions mediated by Ni(0) has been reported.13 Thallium(III) trifluoroacetate has been employed in the symmetrical coupling of aromatic ethers.14 The use of diazonium salts in the formation of unsymmetric biphenyls has been reviewed.15The present method permits both symmetric and unsymmetric coupling to occur at room temperature. It is necessary for a substitutent (nitrogen or sulfer ) to be situated ortho to the halogen so that the heteroatom can chelate well with copper . This requirement must be fulfilled in both reacting partners. The organolithium species may be generated by metal–hydrogen or metal–halogen exchange. The coupling works well in sterically congested compounds, and only for aryl iodides. o-Iodoaldehydes may also be prepared by direct iodination of aromatic aldehydes.12,16 Representative applications of this reaction are provided in Table I.TABLE IA MBIENT -T EMPERATURE U LLMAN R EACTIONOrganocopper Iodide Biphenyl Yield (%)ref57244276(62)26328812542482References and Notes1.Sterling Chemistry Laboratory, 225 Prospect Street., P.O. Box 6666, Yale University, NewHaven, CT 06511-8118. 2.Ziegler, F. E.; Chliwner, I.; Fowler, K. W.; Kanfer, S. J.; Kuo, S. J.; Sinha, N. D. J. Am. Chem. Soc. 1980, 102, 790.3.Bick, I. R. C.; Harley-Mason, J.; Sheppard, N.; Vernengo, M. J. J. Chem. Soc. 1961, 1896.4.Pschorr, R. Justus Liebigs Ann. Chem. 1912, 391, 23.5.Nishizawa, Y. Bull. Chem. Soc. Jpn. 1961, 34, 1170.6.Arbusott, A. Ber. 1905, 38, 1171.7.Kofron, W. G.; Baclawski, L. M. J. Org. Chem. 1976, 41, 1879.8.Newman, M. S.; Dali, H. M. J. Org. Chem. 1977, 42, 734.9.Ikeda, T.; Taylor, W. I.; Tsuda, Y.; Uyeo, S.; Yajima, H. J. Chem. Soc. 1956, 4749; Jeffs, P. W.;Hansen, J. F.; Brine, G. A. J. Org. Chem. 1975, 40, 2883; Koizumi, J.; Kobayashi, S.; Uyeo, S. Chem. Pharm. Bull. 1964, 12, 696.10.Brown, E.; Robin, J.-P. Tetrahedron Lett. 1977, 2015.11.Semmelhack, M. F.; Helquist, P. M.; Jones, L. D. J. Am. Chem. Soc. 1971, 93, 5908; Kende, A.S.; Liebeskind, L. S.; Braitsch, D. M. Tetrahedron Lett. 1975, 3375.12.Kende, A. S.; Curran, D. P. J. Am. Chem. Soc. 1979, 101, 1857.rson, E. R.; Raphael, R. A. Tetrahedron Lett. 1979, 5041.14.McKillop, A.; Turrell, A. G.; Young, D. W.; Taylor, E. C. J. Am. Chem. Soc. 1980, 102, 6504. 15.Bachmann, W. E.; Hoffman, R. H. "Organic Reaction"; Wiley: New York, 1944, Vol. II, p. 224. 16.Janssen, D. E.; Wilson, C. V. Org. Synth., Coll. Vol. IV 1963, 547.AppendixChemical Abstracts Nomenclature (Collective Index Number);(Registry Number)sodium benzophenone ketylCuprous iodide-triethyl phosphite complexcuprous iodidetriethyl phosphite complex6324,5,4',5'-Tetramethoxy-1,1'-biphenyl-2,2'-carboxaldehyde 1,1'-Biphenyl]-2,2'-dicarboxaldehyde, 4,4',5,5'-tetramethoxy-hydrochloric acid (7647-01-0)acetic acid (64-19-7)ether (60-29-7)sodium sulfite (7757-83-7)chloroform (67-66-3)sodium bicarbonate (144-55-8)sodium cyanide (143-33-9)hydrogen cyanide (74-90-8)nitrogen (7727-37-9)sulfer (7704-34-9)copper (7440-50-8)nickel(0) (7440-02-0)iodine (7553-56-2)toluene (108-88-3)Biphenyl (92-52-4)methylene chloride (75-09-2)cuprous iodide (7681-65-4)magnesium sulfate (7487-88-9)Veratraldehyde (120-14-9)iodide (20461-54-5)cyclohexylamine (108-91-8)butyllithium (109-72-8)Tetrahydrofuran (109-99-9)hexane(110-54-3)Triethyl phosphite (122-52-1)cyclohexyliminethallium(III) trifluoroacetate (23586-53-0)6-bromo-3,4-dimethoxybenzaldehyde,6-bromoveratraldehyde (5392-10-9)6-iodoveratraldehyde cyclohexylimine,6-Iodo-3,4-dimethoxybenzaldehyde cyclohexylimine (61599-78-8)6-bromoveratraldehyde cyclohexylimine,6-Bromo-3,4-dimethoxybenzaldehyde cyclohexylimine (73252-55-8) 4,5,4',5'-TETRAMETHOXY-1,1'-BIPHENYL-2,2'-DICARBOXALDEHYDE (29237-14-7) Copyright © 1921-2005, Organic Syntheses, Inc. All Rights Reserved。
西弗碱配合物的合成及表征

L-谷氨酰胺席夫碱配合物的合成及其结构解析摘要席夫碱亦被称作西佛碱(Schiff base),其特有的官能团为亚胺或甲亚胺基(—RC=N—)。
席夫碱是活性羰基和氨基通过化学反应缩合而成的产物,可作为有机试剂、液晶材料、磁学材料等在医药抗肿瘤、抗病毒、抑菌、荧光、色谱分析等领域均得到了广泛的应用并取得了巨大的进展[1]。
而L-谷氨酸是生命体重要的氨基酸,其在自然界中有着广泛的存在。
L-谷氨酰胺的锂盐与草酸二乙酯以及大茴香醛所形成的配位化合物亦具有席夫碱在药理学和生理活性上良好的表现。
在本文中主要介绍L-谷氨酰胺的钾盐、锂盐与草酸二乙酯、大茴香醛所形成的配体其与多种金属盐特别是铜盐所形成的配合物的结构及药理特性。
通过借助化学软件ChemcalDraw,oringe等对其进行结构分析和红外谱图的分析,对其结构特性进行表征[2]。
以下为实验工作过程:(1)L-谷氨酰胺为主的配体与多种金属盐离子形成多样的金属配合物.通过查阅资料和借助化学仪器得知L-谷氨酰胺所形成的配体在不同的反应条件下所形成的配合物亦不相同,而本文主要介绍其配体与金属盐离子按照1:1的比例进行反应,羰基失质子与铜、镍、锌等金属离子结合,α-氨基与金属盐离子以共价键的形式结合所形成的配合物。
(2)L-谷氨酰胺与氢氧化锂或氢氧化锂反应所形成的盐与以草酸二乙酯和大茴香醛等有机物反应形成配体,在通过探索配体与铜、镍、锌、镁等金属盐在一定条件下形成金属配合物。
通过红外光谱分析、元素分析和借助抗菌试验等对合成的配合物进行表征和分析。
关键词:L-谷氨酰胺草酸二乙酯大茴香醛配体Schiff base配合物铜、锌、镁金属盐Abstrac tL-glutamine Schiff base complexes Synthesis and structural analysis thereofSchiff bases are also known as Schiff base (Schiff base), its unique functional groups imine or azomethine (-RC = N-). Schiff base is a product of reactive carbonyl groups and amino condensation formed by a chemical reaction can be used as organic reagents, liquid crystal materials, magnetic materials, etc. in the pharmaceutical anti-tumor, anti-viral, antibacterial field, fluorescence, chromatography, etc. have been widely application and has made tremendous progress. And L-glutamic acid is an important amino acid beings, which has been widely exist in nature. L-glutamine coordination compounds with lithium diethyl oxalate salt and anise aldehyde formed Schiff base also has the pharmacological and physiological activity of a good performance.In this article describes the structure and the pharmacologicalproperties of the ligand L-glutamine potassium, lithium diethyl oxalate, anisic aldehyde formed with various copper salts, especially the formed complexes . By means of chemical software ChemcalDraw, oringe be analyzed, such as structural analysis and infrared spectra, and its structural properties were characterized. The following is an experimental work processes:(1)L-glutamine-based ligands with various metal ions to form avariety of metal complexes by means of chemical equipment and access to information that the ligand L-glutamine formed at different reaction conditions under the complex formed is not the same, and this paper describes its ligand and metal ions react in accordance with the ratio of 1:1, in combination with proton loss carbonyl copper, nickel, zinc and other metal ions, α-amino and salt ion in the form of covalently binding complexes formed.(2)L-glutamine and lithium hydroxide or lithium hydroxide, salts formed by reaction with diethyl oxalate and anisic aldehyde to form organic ligand and the ligand by exploring copper, nickel, zinc, magnesium salts under certain conditions form metal complexes.By infrared spectroscopy, elemental analysis and antimicrobial testing and other means of synthesized complexes were characterized and analyzed.Keywords: L-glutamine Anisaldehyde diethyl oxalate ligand Schiffbase complexes of copper, zinc, magnesium salts第一章绪论1.1氨基酸的介绍及其研究意义氨基酸是含有氨基的羧酸,氨基酸分子中同时具有羰基和氨基,是组成蛋白质必不可少的一类有机化合物。
席夫碱

席夫碱也称西佛碱,Schiff base席夫碱主要是指含有亚胺或甲亚胺特性基团(-RC=N-)的一类有机化合物,通常希夫碱是由胺和活性羰基缩合而成。
具有优良液晶特性。
用作有机合成试剂和液晶材料。
C=N键长约0.124~0.128nm,偶极矩约0.90D。
有顺(Z)-、(E)-两种构型。
亚胺是由醛或酮与氨或胺缩合而成的,又可分为醛亚胺和酮亚胺。
亚胺基是极活泼的基团。
与氰氢酸反应生成α-氨基酸,与丙二酸二乙酯反应生成β-氨基酸,还原反应生成胺,与格利雅试剂反应生成胺的衍生物,水解生成醛或酮和胺。
醛酮与伯胺(RNH2)生成含碳氮双键的亚胺:R2C=O + R'NH2 ——R2C=NR' + H2OR、R’都是脂肪族烃基的亚胺不稳定。
R、R’其中一个为芳基的亚胺为稳定的晶体,由于平衡偏右,制备相对容易。
应用席夫碱类化合物及其金属配合物在医学、催化、分析化学、腐蚀以及光致变色领域的重要应用。
在医学领域,席夫碱具有抑菌、杀菌、抗肿瘤、抗病毒的生物活性;在催化领域,席夫碱的钴和镍配合物已经作为催化剂使用;在分析领域,席夫碱作为良好的配体,可以用来鉴别,鉴定金属离子和定量分析金属离子的含量;在腐蚀领域,某些芳香族的希夫碱经常作为铜的缓蚀剂;在光致变色领域,某些含有特性基团的希夫碱也具有独特的应用。
医药方面由于某些席夫碱具有特殊的生理活性,近年来,越来越引起医药界的重视。
据报道,氨基酸类、缩氨脲类、缩胺类、杂环类、腙类席夫碱及其应用的配合物具有抑菌、杀菌、抗肿瘤、抗病毒等独特药用效果。
催化方面席夫碱及其配合物在催化领域的应用也很广泛,概括而言,席夫碱做催化剂主要是应用于聚合反应,不对称催化环丙烷化反应以及烯烃催化氧化方面和电催化领域。
分析化学在分析化学中,许多席夫碱用来检测、鉴别金属离子,并可借助色谱分析、荧光分析、光度分析等手段达到对某些离子的定量分析。
腐蚀方面长期以来,许多金属及其合金在工业、军事、民用等各个领域得到了广泛的应用,但是该金属及其合金在大气中、海水中很不稳定,因此研究寻找有效的缓蚀剂,引起了众多科学家的重视。
席夫碱的合成及其铋、铈配合物的合成及表征

应用
抗肿瘤
抗菌活性 抗菌活性
医药方面
催化方面
抗O2-活性
光致发光方面
LOGO
研究方法
采用两步合成工艺,先合成配体,对配体进行提纯,保证配体 的纯度,再合成配合物,减少表征的难度。 用元素分析仪测定配体及配合物中C、H、N元素的含量,用 EDTA滴定配合物中金属的含量,确定配合物的组成。
LOGO
实验部分
试剂: 邻香草醛、4,4-二氨基-二苯醚,无水乙醇,甲醇,二氯甲烷 ,甘露醇,五水硝酸铋,氯化铈(试剂均为分析纯) Avatar 360傅立叶红外光谱分析仪(美国尼高力公司),PE2400型元素仪、HCT-1型微机差热天平,DDS-120w电导率 仪,80-2离心机,SHZ-D循环水式真空泵,DF-11型热式恒 温搅拌器。
LOGO
40
45
50
55
60
65
70
75
80
85
90
95
4000 3500
3268.86
3000
2932.70
2500
2360.89 2338.93
Wavenumbers (cm-1) 2000 1500
1091.10
1650.02 1457.85 1376.11 1331.87 1251.11 1193.89 1025.46 932. 55 1054.03 966. 85 889. 63 873. 52 712. 42 624. 14
HO OCH3
O N O N O O OCH3 O N O O O N NO3
Bi
O
OCH3
LOGO
结果与讨论
元素分析
C(理论值/实验值):38.86%(38.93%) H (理论值/实验值):2.67%(2.78%) BiL(NO3)3 N(理论值/实验值):7.93% (8.11%) Bi(理论值/实验值):24.36%(24.22%)
席夫碱的合成实验原理

席夫碱的合成实验原理席夫碱(Schiff碱)是由饱和芳香胺与醛反应形成的亲铵化合物,其合成实验原理主要涉及亲核加成和亲电加成两种反应类型。
1. 亲核加成反应:亲核加成反应是碱与醛之间的反应类型,其中饱和芳香胺作为亲核试剂,向醛的亲电中心攻击,形成一种亲铵中间体。
这一步的反应可以由饱和芳香胺的孤对电子与醛的空轨道之间的配对反应来进行。
亲核试剂与醛之间的反应可以发生在碱性条件下,也可以在酸性条件下进行。
2. 亲电加成反应:亲电加成反应是醛与亲核试剂形成的亲铵中间体经过质子转移反应后失去氢离子,从而生成席夫碱的步骤。
在这一步中,质子转移反应可以通过亲核试剂与溶剂中的质子相互作用来实现。
在酸性条件下,亲电试剂吸收质子,并由此产生相应的酸。
总体而言,席夫碱的合成实验原理可以概括为饱和芳香胺与醛反应形成亲铵中间体,然后通过质子转移反应生成席夫碱。
席夫碱的合成实验通常包括以下步骤:1. 摄入饱和芳香胺与醛反应物。
2. 在合适的反应条件下进行反应,如在酸性或碱性条件下进行。
3. 观察反应进行情况,通常通过监测反应物的变化、生成物的形成、反应物消耗的程度等进行。
4. 进行实验室操作、精确控制反应条件、处理副产物等。
5. 通过实验结果分析,得出席夫碱的合成情况。
6. 进行纯化、结晶、干燥等处理,得到纯度较高的席夫碱产物。
在实验过程中,可以进行一系列的实验改进,以提高席夫碱的产率和纯度。
例如,可以通过优化反应温度、反应时间、溶剂选择、反应物比例等方法来改善合成情况。
此外,可以通过其他试剂对席夫碱进行线性或非线性修饰,以实现特定性质的目标产物。
此外,实验者还需要考虑安全性问题,并采取必要的实验室安全措施,如佩戴个人防护设备、使用适当的实验室设备、遵循化学废物处理规范等。
请注意,实验过程需要严格按照实验室的相关规定和指导进行操作。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
• 单席夫碱
由单胺类和单羰基类化合物缩合而成,经 常作为阴离子型二齿配体和中性的单齿配体。
• 双席夫碱
由一分子的二胺类和两分子的羰基化合物缩合所 得,常用的二胺有邻苯二胺,乙二胺,丙二胺, 当R5,R6为羟基时,便得到了缩乙二胺(Salen)
• 大环席夫碱
由芳香二醛(苯,吡啶,呋喃,噻吩等)或二酮 化合物与一系列多胺缩合得到,形成含有不饱和官 能团的席夫碱的杂原子大环化合物。
• 结构表征:
元素分析:
通过元素分析测定产物的C、H、N含量,推测配体 的分子式和分子量,用元素分析仪来测定。
红外光谱:
席夫碱的C══N具有明显而特殊的红外吸收,可 作为合成配体的初步判断依据,通过红外光谱吸 收峰的位置、吸收峰的数目及其强度可以确定产 品所含的官能团,进一步分析产物的组成。
质谱分析:
席夫碱的合成
席夫碱化合物的合成
• 席夫碱是是含有亚胺或甲亚胺特性基团 (C══N)的一类有机化合物,通常席夫碱 由胺和有活性羰基的化合物(醛、酮等)缩 合而成,改变连接的取代基及其位置,变化 给电子基团的位置,可以开拓出许多从链状 到环合,从单齿到多齿、结构多变、性能迥 异的席夫碱配体。席夫碱不仅可以和过渡金 属形成配合物,还可以和镧系、锕系及部分 主族金属元素形成稳定的配合物。
• 分类 按齿数分类:单齿,二齿,多齿 按结构分类:单席夫碱,多席夫碱,大环席夫碱 按对称性来划分:对称席夫碱,不对称席夫碱
• 合成: 直接合成法:按一定比例将醛与胺直接混合 反应 ,合成通式:
优点:产率较高,反应简便 缺点:副反应多,副产物多,产品后处理麻烦,
不易分离纯化出产品
分步反应法:通过控制反应条件,先制成 新鲜的席夫碱溶液,接着再加入金属盐 模板合成法:反应物活性低或产物不稳定 时,用金属离子作为模板剂,合成大环席 夫碱时操作简易、产率和转化率较高、易 分离纯化、选择性好 逐滴加入法:先将伯胺类化合物与金属离 子溶液混合,再逐滴加入醛或酮溶液,剧 烈搅拌,少量配体形成,然后立即与已存 在的大量金属离子络合成配合物。
席夫碱配体结构较为简单,可以得到准确的分子 式和分子量,通过比对配体,配合物和聚合物三 者的图谱可以判断是否生成了配合物或聚合物。
