免疫细胞的分离和保存技术
免疫细胞的分离和保存技术

第二节 淋巴细胞及其亚群的分离 1、纯淋巴细胞群的采集
原理:利用单核细胞在37℃和Ca 离子存在条件下,能主动粘附在玻璃、 塑料、尼龙毛、棉花纤维或葡聚糖凝 胶的特性,据此建立许多从单个核细 胞中除去单核细胞的方法,以获得高 纯度的淋巴细胞群。
(1)粘附贴壁法 因B细胞也有贴壁现象,因此,本 法分离的淋巴细胞群中B细胞有所 损失。
第 免疫细胞的分 二 离和保存技术
十
章
何
印
蕾
概述
临床上的各种类型的免疫缺陷、自身
免疫病以及肿瘤等疾病均可出现淋巴细胞 或淋巴亚群的数量和功能的变化。因此用 体外方法对机体具有免疫反应的外周血淋 巴细胞及其亚群的数目或比例以及它们所 显示的功能的强弱进行检测,是判断机体 细胞免疫水平的一种重要手段。这对于临 床认识疾病、探讨其发病机制、观察病情 变化、判断预后、考核疗效和防治疾病等 方面均有重要意义。
淋 T细胞:CD2、CD3、CD4、CD8、 巴 CD25等 细 胞
B细胞:CD19、CD20、CD21、 CD22、CD29等
(1)E花环沉淀法 方法:淋巴细胞+SRBC悬液→加 入分层液→T细胞形成E花环而沉 于管底→悬液中为B细胞。 (2)尼龙毛分离法 方法:淋巴细胞→通过聚酰胺纤 维管→洗脱下来的是T细胞
胞,是一种单次密度梯度离心分离法。 其主要成分为聚蔗糖(商品名为Ficoll ) 其密度为1.020。可将血液分成四层, 从上到下依次是:血浆、单个核细胞、 粒细胞和红细胞。
2、Percoll分层液 是一种连续密度梯度离心分离法, 其主要成分为:硅胶颗粒,其原液 密度为:1.135。可将血液分成四层, 从上到下依次是:死亡细胞和血小 板、单核细胞、淋巴细胞、粒细胞 和红细胞。
临床医学检验技师考试辅导临床免疫学和免疫检验 第十四章 免疫细胞的分离及其表面标志检测技术练习题

第十四章免疫细胞的分离及其表面标志检测技术一、A11、已知细胞中的黏附能力最大的为A、树突状细胞B、单核细胞C、B细胞D、T细胞E、红细胞2、免疫细胞检测技术中外周血单个核细胞指的是A、有核细胞B、淋巴细胞C、单核细胞D、淋巴细胞和单核细胞E、幼稚细胞3、下列关于T细胞亚群的分离,说法错误的是A、原理是根据相应细胞的不同标志加以选择性纯化B、凡根据细胞的表面标志进行纯化得到所需要的细胞群是阳性选择法C、选择去除不需要的细胞群,仅留下所需要的细胞为阴性选择法D、E花环沉降法是最先进的细胞分选技术E、尼龙毛柱分离法是常用的分离方法4、下列有关转化的淋巴细胞的形态描述中,错误的是A、细胞变大B、出现空泡C、核仁消失D、染色质疏松E、胞质扩大5、检测T细胞数量的试验是A、溶血空斑试验B、SmIg荧光抗体染色试验C、巨噬细胞或白细胞移动抑制试验D、E玫瑰花环试验E、计算盘直接计数6、溶血空斑形成试验中,空斑的大小表示A、抗体生成细胞的多少B、抗体生成细胞的种类C、细胞的大小D、抗体生成细胞产生抗体的多少E、吞噬细胞的活性7、做自然杀伤细胞毒试验,敏感而常用的是哪种细胞株A、小鼠T细胞肿瘤细胞株B、人肺癌细胞C、K562细胞系D、小鼠细胞毒T细胞系E、L929细胞株8、具有抗肿瘤效应的第一道防线是A、TC细胞B、中性粒细胞C、TH细胞D、B细胞E、NK细胞9、下列不属于自然杀伤(NK)细胞检测方法的是A、酶释法和放射性核素法B、酶释法和荧光分析法C、放射性核素法和荧光分析法D、放射性核素法和荧光分析法和酶释法E、反向溶血空斑实验和酶释法10、可刺激B淋巴细胞增殖转化的刺激物是A、PWMB、PHAC、ConAD、MHCE、BCG11、用于临床评价病人免疫状况的试验中,评价T细胞功能的试验是A、血清免疫球蛋白检测B、溶血空斑试验C、淋巴细胞转化试验D、膜表面Ig测定E、EA花环试验12、关于单个核细胞说法错误的是A、单个核细胞包括淋巴细胞、单核细胞B、单个核细胞的体积、形态、比重与其他细胞不同C、可利用单个核细胞的体积不同,按照密度梯度来分离D、在进行密度梯度分离时,单个核细胞比重比溶液的比重大E、多核粒细胞比重比单个核细胞比重大13、采用密度梯度分离法分离得到的细胞主要为A、单核细胞和粒细胞B、单核细胞C、淋巴细胞D、淋巴细胞和单核细胞E、淋巴细胞和粒细胞14、利用E花环沉降法可分离A、单核细胞和B细胞B、浆细胞和粒细胞C、B细胞和T细胞D、B细胞和粒细胞E、B细胞和吞噬细胞15、对分离细胞的保存说法错误的是A、用适量的10%~20%小牛血清的Hanks等培养液重悬B、以二甲亚砜作为保护剂C、短期保存中,放4℃保存D、短期保存中,迅速改变细胞所处的温度,以免造成温度休克E、长期保存中,放在液氮中,-196℃16、从单个核细胞悬液中分离出单核细胞的方法不包括A、E花环沉降法B、贴壁黏附法C、吸附柱过滤法D、磁铁吸引法E、Percoll分离液法17、下列关于淋巴细胞分离的说法错误的是A、进行细胞免疫的检测,一般须将待检淋巴细胞从血液中或组织中分离出来B、外周血细胞单个核细胞包括淋巴细胞、粒细胞和红细胞C、利用外周血的细胞的理化特性的差异可以分离不同的细胞群体D、淋巴细胞的理化特性与其他细胞差异很小,用简单的方法不易分离纯化E、淋巴细胞的分离利用专门的淋巴细胞分离纯化技术18、细胞活力测定常用的简便方法是A、伊红染色B、美蓝染色C、台盼蓝染色D、抗酸染色E、HE染色19、LPS可激发哪种细胞转化A、B细胞B、T细胞C、自然杀伤(NK)细胞D、杀伤细胞E、巨噬细胞20、可刺激T细胞增殖的刺激物是A、ConAB、MHCC、SPAD、AFPE、LPS21、自然杀伤(NK)细胞具有A、对TI抗原应答效应B、ADCCC、对TD抗原应答D、主要分泌细胞因子作用E、特异杀伤肿瘤细胞作用22、属于非抗原刺激物的物质是A、SRBCB、BCGC、LPSD、类毒素E、抗毒素血清23、关于溶血空斑试验的叙述错误的是A、1个空斑代表1个抗体生成细胞B、需要绵羊红细胞和补体参与C、空斑大小代表抗体产生的多少D、是可检测B淋巴细胞功能的一种体外试验方法E、只可检测IgG类抗体24、下列哪项不是T细胞表面标志的检测方法A、SmIg的检测B、抗体致敏细胞花环法C、免疫金银染色法D、免疫荧光法E、ABC法25、溶血空斑试验检测的是哪类细胞的功能A、T淋巴细胞B、巨噬细胞C、自然杀伤(NK)细胞D、B淋巴细胞E、LAK细胞答案部分一、A11、【正确答案】B【答案解析】单核细胞具有在37℃和Ca2+存在时,能主动黏附在玻璃、塑料、尼龙毛、棉花纤维或葡聚糖凝胶的特性。
项目十六 免疫细胞的分离

项目十六免疫细胞的分离一、抗凝血的制备【实验原理】常用的抗凝剂如肝素能阻止凝血酶的形成;乙二胺四乙酸(EDTA)和柠檬酸能与Ca2+结合;机械脱纤维使血液中血小板和纤维蛋白凝聚;从而都能阻止血液凝固。
实验室常用的抗凝方法有如下几种:肝素抗凝、EDTA抗凝、脱纤维抗凝及Alsever液抗凝等方法。
【试剂和器材】1.试剂肝素、EDTA-Na2、Alsever液、生理盐水等。
2.器材三角烧瓶、玻璃珠、试管或离心管、采血器具。
【步骤和方法】1.肝素抗凝法将肝素用生理盐水配制成250U/ml或其它浓度的溶液,115℃灭菌10min(或112℃15min),置-20℃可保存数月。
实验中常用的肝素抗凝浓度为20~50U/ml血液,实际当肝素浓度为5~10U/ml血液时已显出良好的抗凝效果。
2.EDTA法常用EDTA二钠盐(EDTA-Na2),用生理盐水配制成浓度为27g/L的溶液。
配制时将溶液调至pH7.2,否则EDTA-Na2不溶解。
用时取0.05ml即可使1ml血液抗凝。
EDTA-Na2有效抗凝浓度为1~2mg/ml血液。
3.脱纤维法在三角烧瓶中放入一些小玻璃珠(放入数目视采血量多少而定,通常放30~40粒),将血采入后立即轻轻顺一个方向旋转,直到血纤维凝聚为止。
4.Alsever液抗凝法血液与Aalsever液混合比例为1:1~1:2。
【结果判定】除玻璃珠脱纤维法有血纤维凝聚之外,抗凝血中不能有血凝块出现,否则应重新制备。
【注意事项】1.采血所用器具、抗凝剂、操作过程均应无菌。
2.加入血液后应轻轻混合,直到与抗凝剂均匀混合为止。
常采用旋转混合的方法混匀。
3.抗凝血放4℃保存。
【方法评价】肝素制备的抗凝血不易长期保存(保存时间12h)。
EDTA 法能保持血小板与白细胞的正常形态,避免聚集。
脱纤维法可使少量淋巴细胞丢失,但是悬液中细胞活力好,而且血小板污染甚少。
Alsever可较长时间保存血液,一般可保存2~3周。
临床免疫学检验-第十三章细胞免疫学技术

Ficoll分离法
聚蔗糖-泛影葡胺分层液的制备
6%聚蔗糖溶液 (Ficoll溶液)密度1.020
34%泛影葡胺溶液 (Hypaque溶液)密度1.2
酸性磷酸酶测定 非特异性酶的测定
巨噬细胞功能检测
炭粒廓清试验
正常小鼠肝中枯否细胞可吞噬清除90% 炭粒,脾巨噬细胞约吞噬清除10%炭粒。据 此给小鼠定量静脉注射印度墨汁(炭粒悬液), 间隔一定时间反复取静脉血,测定血中炭粒 的浓度,根据血流中炭粒被廓清的速度,判 断巨噬细胞的功能。
吞噬功能检测
鸡RBC
l液 密度1.135
细胞混悬液
高速离心 密
度
6小时
梯 度
低速离心 密 度 梯 度
死细胞残片和血小板 富含单核细胞的组分
富含淋巴细胞的组分 红细胞与粒细胞组分
淋巴细胞亚群的分离
T细胞和B细胞的分离
E花环分离法 尼龙棉分离法
E花环分离法
E受体
T
SRBC
B
E花环 T
离心
B
E花环
聚蔗糖-泛影
形成溶血空斑
可以检测致敏红细胞的各种抗原所对应的抗体,临 床应用比较广泛
反向空斑形成试验
反应物: 琼脂凝胶
SPA致敏的SRBC B细胞 补体 抗Ig抗体
形成溶血空斑
体外检测人类Ig分泌细胞的方法,与抗体的特异性 无关
酶联免疫斑点法
反应物:
包被在固相载体上的抗原 B细胞 酶标二抗
加底物显色
计数斑点形成细胞
免疫细胞存储的操作流程

免疫细胞存储的操作流程引言:免疫细胞存储是一种重要的生物医学技术,它可以帮助人们保存和利用免疫细胞以进行免疫治疗。
本文将介绍免疫细胞存储的操作流程,包括细胞采集、处理、贮存和使用等环节。
一、细胞采集1. 选择合适的采集源:免疫细胞可以从多个来源采集,包括外周血、骨髓、脐血等。
根据具体需求,选择合适的采集源很关键。
2. 采集方法:根据采集源的不同,采用相应的采集方法。
例如,外周血可以通过静脉抽血,骨髓可以通过穿刺抽取,脐血可以通过脐带剪断后采集。
3. 采集样本处理:采集的细胞样本需要尽快处理,以避免细胞失活或受污染。
通常,采集后的样本会被送往实验室进行下一步处理。
二、细胞处理1. 细胞分离:采集到的样本中可能存在其他细胞或物质,需要进行细胞分离。
可以通过离心、流式细胞术等方法将目标细胞分离出来。
2. 细胞富集:为了提高目标细胞的纯度和浓度,可以采用细胞富集技术,如磁珠富集、流式细胞术等。
3. 细胞检测:对处理后的细胞进行质量控制,确保细胞的存活率和纯度达到要求。
可以使用细胞计数仪、细胞培养等方法进行检测。
三、细胞贮存1. 冷冻保存:为了延长细胞的存活时间,通常会选择冷冻保存。
将处理后的细胞用特定的冷冻液冷冻保存,以确保细胞在低温下保持稳定。
2. 冷冻管标识:为了方便细胞的识别和管理,冷冻管需要进行标识。
可以使用标签或条码等方式标记细胞的相关信息,如样本编号、采集日期等。
3. 贮存条件:细胞贮存需要在恒定的温度和湿度条件下进行,通常选择液氮罐或液氮制冷器进行贮存。
同时,注意避免细胞受到震动或其他不良环境因素的影响。
四、细胞使用1. 细胞解冻:在使用前,需要将冷冻的细胞解冻。
解冻的过程需要控制温度和时间,以避免细胞受损。
2. 细胞培养:解冻后的细胞需要进行培养,以促进其生长和增殖。
通常使用适当的培养基和条件进行培养。
3. 细胞应用:培养后的细胞可以用于免疫治疗、疫苗制备等领域。
根据具体需求,细胞可以进行进一步的处理和应用。
免疫细胞分离及检测技术

第十三章免疫细胞分离及检测技术本章考点1.免疫细胞的分离2.淋巴细胞表面标志的检测3.淋巴细胞功能检测技术4.免疫细胞检测的临床意义第一节免疫细胞的分离一、外周血单个核细胞的分离1.原理:外周血中单个核细胞(淋巴细胞和单核细胞)的比重与红细胞、多核白细胞及血小板不同,介于1.075~1.090之间,红细胞及粒细胞在1.092左右,血小板在1.030~1.035之间。
因而可利用一种比重介于1.075~1.092之间,而近于等渗的溶液作密度梯度离心,使一定比重的细胞按相应密度梯度分布而加以分离。
2.试剂:常用的分层液有Ficoll与Percoll两种(1)Ficoll分层液法:主要用于分离外周血中单个核细胞,是一种单次密度梯度离心分离法,其分布由上到下依次为:稀释的血浆层,单个核细胞层,粒细胞层和红细胞层。
Ficoll分层液即聚蔗糖-泛影葡胺,是一种较理想的细胞分层液,其主要成分是一种合成的蔗糖聚合物,具有高密度、低渗透压、无毒性的特点。
操作时,将分层液置于试管下层,然后将肝素化的全血或白细胞悬液以Hanks或PBS液稀释后,轻轻铺于分层液面上,经2000rpm15-20min离心后,红细胞与粒细胞因比重大于分层液,故较快沉于管底。
血小板则比重小于分层液而悬浮于血浆中。
唯有与分层液比重相当的单核细胞和淋巴细胞密集于血浆层和分层液的界面中。
其分布由上到下依次为:稀释的血浆层,单个核细胞层,粒细胞层和红细胞层。
见下图。
图聚蔗糖-泛影葡胺分层液密度梯度离心法外周血小分布示意图引自陶义训主编:免疫学和免疫学检验,人民卫生出版社1995年9月第1版第4次印刷(2)Percoll分层液法:是一种连续密度梯度离心分离法,其分布由上至下依次为:死细胞层,富含单核细胞组分层,富含淋巴细胞的组分层及红细胞与粒细胞组分层。
图连续密度梯度离心法分离单个核细胞中各细胞成分的分布示意图引自陶义训主编:免疫学和免疫学检验,人民卫生出版社1995年9月第1版第4次印刷二、淋巴细胞的分离1.纯淋巴细胞群的采集:利用单核细胞在37℃和Ca2+存在时,能主动粘附在玻璃、塑料、尼龙毛、棉花纤维或葡聚糖凝胶的特性,从单个核细胞悬液中除去单核细胞,从而获得纯淋巴细胞群。
成人外周血免疫细胞存储pbmc存储条件_解释说明

成人外周血免疫细胞存储pbmc存储条件解释说明1. 引言1.1 概述成人外周血免疫细胞(Peripheral Blood Mononuclear Cells,简称PBMC)是一类重要的免疫细胞种类,包括淋巴细胞、单核细胞和多能干细胞等。
存储PBMC样本并保持其完整性和功能对于后续的实验研究非常关键。
本文将详细探讨成人外周血免疫细胞存储条件,并介绍存储条件对实验结果的影响。
1.2 文章结构本文分为五个主要部分:引言、成人外周血免疫细胞存储条件、PBMC存储条件的关键因素、PBMC存储容器和保存方法的比较以及结论。
在成人外周血免疫细胞存储条件部分,将介绍什么是PBMC存储条件、其重要性以及它对实验结果产生的影响。
接着,在PBMC存储条件的关键因素部分,将讨论温度控制和冷冻速率、冷冻介质的选择和配方以及冷冻管和标签的使用注意事项。
随后,在PBMC存储容器和保存方法的比较中,我们将对使用液氮罐进行长期保存和使用液态氮注射式冷冻器保存PBMC样本的优缺点进行比较,并介绍相应的注意事项。
最后,通过结论部分,将总结回顾PBMC存储条件并提出存在的问题及改进建议。
1.3 目的本文旨在提供科学准确、可靠可行、易于操作的PBMC存储条件,帮助研究人员保存和利用成人外周血免疫细胞样本,以确保后续实验结果的准确性和可重复性。
通过详尽地探讨PBMC存储条件的重要因素和适用方法,希望能为科研工作者提供有关成人外周血免疫细胞存储方面的指导与建议。
同时,在最后一节中,我们还将针对现有存储条件存在的问题提出改进建议,希望能够引起更多学者对该领域的重视并共同推动该领域的进展。
2. 成人外周血免疫细胞存储条件2.1 什么是PBMC存储条件PBMC即成人外周血单个核细胞,是一种重要的免疫细胞类型,它在免疫反应中起着至关重要的作用。
为了确保PBMC的完整性和保存时间,需要遵循特定的存储条件。
PBMC存储条件指的是在收集和分离后将PBMC保存下来的环境设置和技术规范。
免疫细胞提取方法-详细解释说明

免疫细胞提取方法-概述说明以及解释1.引言1.1 概述免疫细胞提取方法是一种技术手段,用于从生物样本中提取和分离免疫细胞。
免疫细胞是免疫系统中的重要组成部分,能够识别和消除入侵的病原体以及异常细胞,起到维护机体免疫平衡和保持正常生理功能的关键作用。
随着对免疫细胞的研究不断深入,越来越多的科研和临床应用需要对免疫细胞进行进一步的分析和研究。
免疫细胞提取方法的发展和优化对于免疫学领域的研究人员和医生来说具有重要意义。
本文旨在综述和分析免疫细胞提取方法的背景、问题以及未来的发展方向。
首先,我们将对免疫细胞提取方法的背景进行概述,包括该技术的起源、发展历程以及目前已有的主要提取方法。
其次,我们将探讨免疫细胞提取方法的重要性,包括在研究领域的应用前景和临床诊断治疗中的重要作用。
最后,我们将着重讨论目前存在的免疫细胞提取方法的问题,如提取效率、纯度、损伤等方面的局限性,并对未来的免疫细胞提取方法进行展望,探讨可能的改进和突破。
通过本文的分析和总结,我们将能够更全面地了解免疫细胞提取方法的现状和挑战,并为未来的研究和应用提供思路和参考。
希望本文能够对免疫学领域的研究人员和医学工作者提供有益的信息,推动免疫细胞提取方法的发展和应用。
1.2 文章结构文章结构部分的内容可以进行如下编写:文章结构部分旨在介绍本篇长文的组织和内容。
本篇文章主要探讨免疫细胞提取方法,并对该研究领域进行概述、分析和总结。
首先,在第一部分的引言中,我们将提供对本文的概述。
我们将对免疫细胞提取方法的背景和重要性进行简要介绍,并阐述本文的目的。
通过这一部分,读者可以对免疫细胞提取方法有一个整体的了解,以及对本文的研究目标有所把握。
接下来,在第二部分的正文中,我们将深入探讨免疫细胞提取方法的背景、重要性以及目前存在的问题。
我们将指出免疫细胞提取方法的基本原理和技术,并分析其在免疫学研究和临床应用中的重要性。
同时,我们也将讨论目前存在的免疫细胞提取方法的问题,如提取效率、纯度和可重复性等方面的种种挑战。
第15章 免疫细胞标志与功能检测技术总结

细胞内大分子物质 的合成增加 T细胞形态变化
齐齐哈尔医学院免疫
同位素法 形态法
(1)形态学检查法
+
刺激物:常用PHA
PHA 无PHA
标本:外周血单个核细胞
37℃
72h
取培养细胞涂片染色镜检 观察细胞形态学改变
齐齐哈尔医学院免疫
未转化和转化淋巴细胞的形态特征
转化的淋巴细胞 未转化的淋巴细胞 淋巴母细胞 细胞大小(直径μm) 核大小、染色质 12-20 增大、疏松 过渡型 12-16 增大、疏松 6-8 不增大、密集
第三节 抗原提呈细胞的表面标志
抗原提呈类细胞表面标志
齐齐哈尔医学院免疫
CD1a,CD11c,CD83
一、单核-吞噬细胞系统
组织部位 骨髓 骨髓和血液 各种组织 (巨噬细胞)
熟悉
细胞名称 干细胞—单核母细胞—前单核细胞 单核细胞 组织细胞(结缔组织),枯否细胞(肝) 破骨细胞(骨)、小胶质细胞(神经 组织)、
五、其他免疫细胞功能检测技术
六、免疫细胞表面标志和功能检测的临床 应用
齐齐哈尔医学院免疫
齐齐哈尔医学院免疫
掌握
第一节
免疫细胞的分离
一、外周血单个核细胞分离
二、淋巴细胞的分离
三、T、B细胞和T细胞亚群的分离 四、不同分离方法的评价
齐齐哈尔医学院免疫
一、外周血单个核细胞分离
掌握
外周血单个核细胞(perpheral blood mononuclear cells, PBMC):包括淋巴 细胞和单核细胞。
对分离介质的要求
熟悉
1.对细胞无毒 2.基本等渗 3.不溶于血浆等分离物质 4.有要求的比重 2份6%聚蔗糖蒸馏水溶液+1份34% 泛影葡胺比重为1.077±0.002
《免疫细胞存储》课件

目录
• 免疫细胞存储概述 • 免疫细胞的种类与功能 • 免疫细胞存储的方法与流程 • 免疫细胞存储的应用与前景 • 免疫细胞存储的挑战与解决方案 • 实际案例分享
01
免疫细胞存储概述
免疫细胞存储的定义
免疫细胞存储是指将人体内的免疫细 胞,通过特定的技术手段,进行分离 、检测、培养、扩增和储存等一系列 操作,以便在将来需要时进行使用。
再生医学是指利用生物学和工程 学原理来修复、替代或再生人体
组织和器官的技术。
免疫细胞存储可以为再生医学和 组织工程提供高质量的细胞来源
,促进组织再生和修复。
存储的免疫细胞可以与干细胞等 其他类型的细胞共同培养和应用
,促进组织再生和功能恢复。
新药研发与疫苗制备
新药研发和疫苗制备是预防和治疗疾病的重要手段。
免疫细胞存储可以为新药研发和疫苗制备提供实验材料和研究对象,加速新药研发和疫苗制 备的进程。
存储的免疫细胞可以用于研究免疫细胞的生理和药理特性,以及筛选和评估新药和疫苗的效 果和安全性。
05
免疫细胞存储的挑战与解决方案
免疫细胞的活性保持
1 2 3
低温环境
维持免疫细胞活性需要低温环境,一般在-180℃ 左右的液氮中存储,以降低细胞代谢率,延长细 胞存活时间。
封闭式存储
采用封闭式存储容器,避免与外界接触,降低交叉感染的风险。
定期检测
在存储过程中定期对免疫细胞进行检测,及时发现和处理污染源。
提高存储效率与降低成本
优化存储容器设计
通过改进存储容器的设计,提高细胞的装载密度,从而提高存储效 率。
自动化操作
采用自动化技术进行免疫细胞的分离、检测、补充等操作,降低人 工操作的误差和成本。
免疫细胞储存SOP
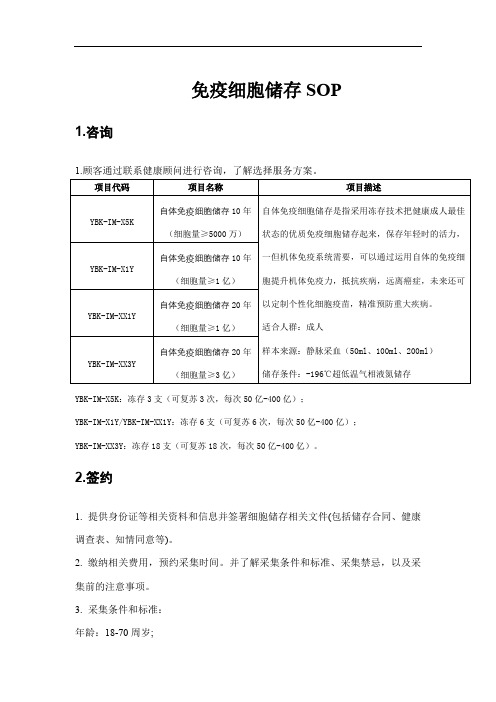
免疫细胞储存SOP1.咨询1.顾客通过联系健康顾问进行咨询,了解选择服务方案。
YBK-IM-X5K:冻存3支(可复苏3次,每次50亿-400亿);YBK-IM-X1Y/YBK-IM-XX1Y:冻存6支(可复苏6次,每次50亿-400亿);YBK-IM-XX3Y:冻存18支(可复苏18次,每次50亿-400亿)。
2.签约1.提供身份证等相关资料和信息并签署细胞储存相关文件(包括储存合同、健康调查表、知情同意等)。
2.缴纳相关费用,预约采集时间。
并了解采集条件和标准、采集禁忌,以及采集前的注意事项。
3.采集条件和标准:年龄:18-70周岁;体重:男≥50kg,女≥45kg;体温:正常;血压:90mmHg-140mmHg/60mmHg-90mmHg;脉压差不低于30mmHg;脉搏:节律规整,60-100次/分钟,高耐力的运动员不低于50次/分钟;血象正常:白细胞≥4*10^9个/L,淋巴细胞≥0.8*10^9个/ L;一周内没有感冒和急性胃肠炎,没有服药,24小时内没有饮酒;与上次采集时间相隔3个月以上;采血前做血常规、传染病学检测(乙肝、丙肝、梅毒、艾滋等)。
4.提供正规体检机构或二级以上医院相应体检报告,体检内容如下:5.采集禁忌1)凝血功能严重异常;2)近期有明显的活动性出血病史;3)重大脏器功能不全的供者;4)患有各种传染性疾病:如艾滋与梅毒患者;5)T细胞淋巴瘤患者;6)败血症及其他未有效控制的感染;7)女性在月经期和前后三天不宜采集;8)小手术后未满半个月,一般手术后未满三个月,较大手术后未满半年者不宜采集等。
6.采集前注意事项1)采集前一天晚餐不要进食过饱,少吃肉、鱼、蛋、牛奶、豆制品以及油腻食物,不要大量饮水,以免稀释血液,影响采集质量;2)采集前一晚要保持良好的睡眠,充足的休息;3)采集前不要空腹,可提前吃一些清淡饮食,如稀饭、馒头、面包等,可适当补充水分。
4)采集前一周内不宜服用任何药物。
免疫细胞分离技术

免疫细胞分离技术免疫细胞分离技术是一种重要的生物学和医学研究工具,广泛应用于生物样本中细胞的分离和纯化。
通过利用细胞表面的特异性标记,免疫细胞分离技术可以实现对不同类型细胞的高灵敏度、高特异性的分离。
在免疫学研究领域,免疫细胞分离技术被广泛应用于研究免疫细胞的功能和相互作用,对于深入理解免疫系统的机制具有重要意义。
免疫细胞分离技术的基本原理是利用抗体与特定细胞表面标记结合的高度特异性,通过各种分离方法将该细胞与其他非特异性细胞分离开来。
免疫细胞分离技术通常包括两个关键步骤:抗体与目标细胞的特异性结合和分离纯化。
在抗体结合的过程中,通过将抗体与目标细胞共孵育,使抗体与目标细胞表面标记结合形成抗原-抗体复合物。
而在分离纯化的过程中,可以通过多种方法将抗原-抗体复合物与其他非特异性细胞分离开来,如磁性珠分离、流式细胞仪分离等。
免疫细胞分离技术的关键是选择合适的特异性抗体。
抗体是由机体免疫系统产生的一种高度特异性的蛋白质,具有与目标抗原结合的能力。
在选择抗体时,需要考虑以下几个因素:第一,抗体的特异性;第二,抗体的亲和力和亲和常数;第三,抗体的结合位点;第四,抗体的格式和标记。
合理选择和设计抗体可以提高免疫细胞分离技术的效率和准确性。
在免疫细胞分离技术中,常用的方法之一是磁性珠分离法。
该方法利用表面覆有特定抗体的磁性珠与目标细胞结合,通过磁外场将目标细胞分离出来。
磁性珠分离法具有分离效率高、操作简便、适用范围广等优点,被广泛用于体外培养细胞、临床诊断和基础研究等领域。
另一种常用的免疫细胞分离技术是流式细胞仪分离法。
流式细胞仪是一种高速流动和高灵敏度激光共聚焦技术,可以对单个细胞进行多参数检测和鉴定。
在流式细胞仪分离中,通过合适的荧光染料或荧光标记抗体,结合流式细胞仪对细胞进行定量、快速分析和筛选。
流式细胞仪分离技术具有分离速度快、高通量、对样本体积要求小等优点,广泛应用于细胞表型分析和免疫学研究。
除了磁性珠分离法和流式细胞仪分离法,还有其他依赖于抗体与抗原结合的分离方法,如免疫磁珠分离法、免疫离心法、免疫亲和层析法等。
免疫细胞的储存及运输方法[发明专利]
![免疫细胞的储存及运输方法[发明专利]](https://img.taocdn.com/s3/m/f7d572224531b90d6c85ec3a87c24028905f8552.png)
(10)申请公布号(43)申请公布日 (21)申请号 201511031752.5(22)申请日 2015.12.31C12N 5/0781(2010.01)C12N 5/0783(2010.01)A01N 1/02(2006.01)(71)申请人北京弘润天源生物技术股份有限公司地址100085 北京市海淀区安宁庄西路9号金泰富地大厦709(72)发明人宫喜魁 李若鲲 马艳 马艳玲郝丽敏(74)专利代理机构北京恩赫律师事务所 11469代理人赵文成 刘守宪(54)发明名称免疫细胞的储存及运输方法(57)摘要本发明公开了一种免疫细胞的储存及运输方法,属于生物技术领域。
本发明包括如下步骤:采集外周血或脐带血,稀释,获得细胞悬液;将含有海藻糖,超低粘度海藻酸钠和氨基酸的分离液加入到离心管中,细胞悬液细胞悬液平铺到分离液上,离心,吸取上层血浆备用,吸取白膜层细胞获得淋巴细胞;将所述淋巴细胞与冻存液等比例混合分装于细胞冻存管中;冻存;复苏后将液态细胞悬液移至含有4~8℃生理盐水的离心管中,混匀,离心;在淋巴细胞中加入含有2%海藻糖的保存液中;移入无菌管或转运袋中转运。
本发明从分离到冻存再到保存运输均选用符合静注级原料药标准的原料,原料不确定性小,安全性高。
(51)Int.Cl.(19)中华人民共和国国家知识产权局(12)发明专利申请权利要求书1页 说明书10页CN 105543168 A 2016.05.04C N 105543168A1.一种免疫细胞的储存及运输方法,其特征在于,包括如下步骤:1)采集外周血或脐带血,加入等体积的生理盐水或无血清培养基稀释,获得细胞悬液;2)将含有海藻糖,超低粘度海藻酸钠和氨基酸的分离液加入到离心管中,所述细胞悬液细胞悬液平铺到分离液上,在8-25℃,200g-800g,10~30min条件下离心,吸取上层血浆备用,吸取白膜层细胞获得淋巴细胞;3)将所述淋巴细胞与含有12%DMSO+18%所述上层血浆+5%海藻糖+5%甘油+60%注射用生理盐水的冻存液等比例混合分装于细胞冻存管中;将所述冻存管管口密封置于装有异丙醇的冻存盒中;先于-80℃冷冻,然后转入液氮中冻存;4)将恒温水浴箱温度调节至37℃~39℃,从液氮中取出冻存管立即投入恒温水浴箱中轻轻晃动,直至冻存管中的固态变为液体状态;将此液态细胞悬液移至含有4~8℃生理盐水的离心管中,混匀,细胞悬液的浓度为1~6×106细胞/ml,4-8℃,500g-800g,10~30min 条件下离心收集淋巴细胞;5)在淋巴细胞中加入含有2%海藻糖的保存液中,调整细胞浓度为1~6×106细胞/ml;检查淋巴细胞存活率及细菌、内毒素、支原体;进行免疫学检查;移入无菌管或转运袋中,使用2~8℃恒温保温箱在时间小于等于24小时内运输至使用单位。
NBt还原实验(“细胞”相关文档)共60张

2、黏附分离法 3、荧光激活分离法 4、磁性分离法 5、其他分离法
密度梯度离心法
稀释抗凝血
淋巴细胞分离液
离心前
血浆
单个核细胞
粒细胞
红细胞 离心后
沉降速度 =
2r2(Q—Q0) x g
9
Q =颗粒比重 Q0 =溶质比重 r =颗粒半径
= 形状因子 = 颗粒摩擦系数/同体积球型颗粒摩擦系数
激光束
细胞收集管
荧光激活分离法(FACS)
流式细胞仪
磁性分离法
磁铁吸引法
磁式细胞分类术法
N
S
MACS (阳性选择法)
N
S
MACS (阴性选择法)
其他分离法
1、T细胞介导的细胞毒试验
补体依赖的细胞毒试验(CDC) 细胞吞噬与杀伤功能试验 2、补体依赖的细胞毒试验(CDC)
花环沉降法
凋亡信号——凋亡受体——信号传导——凋亡基因启动——编码程序性死亡蛋白——细胞结构解体——细胞凋亡
第三节 免疫细胞功能测定
2、免疫细胞的膜分子特征
细胞吞噬与杀伤功能试验 二、细胞凋亡的检测方法
细胞活化克隆法
09
13
荧光激活分离法(FACS)
免疫细胞膜分子检测的原理与类型
09
13
荧光显微镜检测——溴化丙锭染色
SmIg的荧光抗体检测法
MHC分子四聚体法
普通光镜检测——HE染色
抗原肽-MHC分子四聚体技术
N=N-R- MACS (阳性选择法)
免疫细胞膜分子检测的原理与类型
补体依赖的细胞毒试验(CDC)
二、细胞凋亡的检测方法
MACS (阴性选择法)
SPA-SRBC溶血空斑试验
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
免疫细胞的分离和保存技术用体外方法对机体各种具有免疫反应的细胞分别作鉴定、计数和功能测定,是观察机体免疫状态的一种重要手段。
为此,须将各种参与免疫反应的细胞从血液或脏器中分离出来。
参与免疫反应的细胞主要包括淋巴细胞、巨噬细胞、中性粒细胞等。
由于检测的目的和方法有同,分离细胞的需求和技术也异。
有的仅需分离白细胞,有的则需分离单个核细胞(mononuclearcell),其中含淋巴细胞和单核细胞(monocyte),有的则需分离T细胞和B细胞以及其亚群。
分离细胞选用的方法应力求简便可行,并能获得高纯度、高获得率、高活力的细胞。
现用分离细胞群的原则,一是根据各类细胞的大小、沉降率、粘附和吞噬能力加以组分,另一则按照各类细胞的表面标志,包括细胞表面的抗原和受体加以选择性分离。
一、白细胞的分离(一)血液中红细胞与白细胞比例约600~1000:1,两者的比重不同其沉降速度亦异,通常用两种方法加以分离。
本法是利用血细胞自然沉降率的分离法,采集血液后应及时抗凝,通常选用肝素抗凝法。
肝素能阻止凝血酶原转化为凝血酶,从而抑制纤维蛋白原形成纤维蛋白而防止血液凝固。
操作原则是将含抗凝血的试管直立静置室温30~60min 后,血液分成明显三层,上层为淡黄色血浆,底层为红细胞,紧贴红细胞层上面的灰白层为白细胞,轻轻吸取即得富含白细胞的细胞群,离心洗涤后加入少量蒸馏水或含氯化铵的Gey溶液,经短时间的低渗处理,使红细胞裂解,经过反复洗涤可得纯度较高的白细胞悬液。
(二)聚合物加速沉淀法本法是利用高分子量的聚合物如明胶、右旋糖酐、聚乙烯吡喀烷酮(polyvinylpyrolidone,PVP)等使红细胞凝集成串,加速红细胞沉降,使之与白细胞分离。
本法的细胞获得率比自然沉降法高。
二、外周血单个核细胞的分离外周血中单个核细胞包括淋巴细胞和单核细胞,其体积、形态和密度与其他细胞不同,红细胞和多核白细胞密度较大,为1.090左右,而淋巴细胞和单核细胞密度为1.075~1.090,血小板为1.030~1.035。
为此利用一种密度介于1.075~1.092之间而近于等渗的溶液(分层液)做密度梯度离心,使一定密度的细胞按相应密度梯度分布,从而将各种血细胞加以分离。
常用的分层液有Ficoll和Percoll 两种。
(一)Ficoll分层液法主要用于分离外周血中的单个核细胞,是一种单次密度梯度离心分离法。
聚蔗糖-泛影葡胺是一种较理想的细胞分层液,其主要成分是一种合成的蔗糖聚合物称聚蔗糖(商品名为Ficoll),分子量为40kD,具有高密度、低渗透压、无毒性的特点。
高浓度的Ficoll溶液粘性高,易使细胞聚集,故通常使用60g/L的低浓度溶液,密度为1.020,添加比重为1.200的泛影葡胺(urografin)以增加密度。
国外常用商品Isopaque或Hypaque,故又称Ficoll-Hypaque分层液,将适量340g/L 泛影葡胺加入Ficoll溶液中即可配制成密度合适分层液。
分离人外周淋巴细胞以密度为1.077±0.001的分层液最佳,因为人的红细胞密度为1.093,粒细胞密度为1.092,单个核细胞在1.076~1.090之间。
而不同动物血中的单个核细胞对分离液的密度要求各不相同,如小鼠为1.088,马为1.090。
分离时先将分层液置试管底层,然后将肝素化全血以Hanks液或PBS液作适当稀释后,轻轻叠加在分层液上面,使两者形成一个清晰的界面。
水平式离心后,离心管中会出现几个不同层次的液体和细胞带(图20-1)。
红细胞和粒细胞密度大于分层液,同时因红细胞遇到Ficoll而凝集成串钱状而沉积于管底。
血小板则因密度小而悬浮于血浆中,唯有与分层液密度相当的单个核细胞密集在血浆层和分层液的界面中,呈白膜状,吸取该层细胞递经洗涤高心重悬。
本法分离单个核细胞纯度可达95%,淋巴细胞约占90%~95%,细胞获得率可达80%以上,其高低与室温有关,超过25℃时会影响细胞获得率。
(二)Percoll分层液法这是一种连续密度梯度离心分离法。
Percoll是一种经聚乙烯吡喀烷酮(PVP)处理的硅胶颗粒,对细胞无毒性。
利用Percoll液经高速离心后形成一个连续密度梯度的原理,将密度不等的细胞分离纯化。
用Percoll原液(密度1.135)与约等量双离子强度的磷酸缓冲液均匀混合,高速离心后,使分层液形成一个从管底到液面密度逐渐递减的连续密度梯度,再将已制备的单个核细胞悬液轻轻叠加在液面上,低速离心后,便得四个细胞层。
表层为死细胞残片和血小板,底层为粒细胞和红细胞,中间有两层,上层富含单个核细胞(75%),下层富含淋巴细胞(98%)(图-2)。
该法是纯化单核细胞和淋巴细胞的一各较好的方法,但操作流程较长,手续较多。
图-2 连续密度梯度离心法分离单个核细胞中各细胞成分的分布示意图三、淋巴细胞及其亚群的分离为研究免疫细胞的功能,常需高纯度的淋巴细胞或其亚群,分离方法介绍如下。
(一)、纯淋巴细胞群的采集通常利用单核细胞在37℃和Ca2+存在条件下,能主动粘附在玻璃、塑料、尼龙毛、棉花纤维或葡聚糖凝胶的特性,据此建立许多从单个核细胞悬液中去除单核细胞的方法,藉以获得高纯度的淋巴细胞群。
(1)粘附贴壁法将已制备的单个核细胞悬液倾于玻璃或塑料平皿或扁平小瓶中,移至37℃温箱静置1h左右,单核细胞和粒细胞均贴于平皿壁上,而未贴壁的非粘附细胞几乎为纯淋巴细胞,继用橡皮刮下贴壁的细胞即为纯单核细胞群。
因B细胞也有贴壁现象,用本法分离的淋巴细胞群中B细胞有所损失。
(2)吸附柱过滤法将单个核细胞悬液注入装有玻璃纤维或葡聚糖凝胶SephadexG10的柱层中,凡有粘附能力的细胞绝大部分被吸附而粘滞在柱层中,从柱上洗脱下来的细胞主要是淋巴细胞。
此法简单易行,对细胞极少损害。
(3)磁铁吸引法利用单核细胞具有吞噬的特性,在单个核细胞悬液中加直径为3μm的羰基铁颗粒,置37℃温箱内短时旋转摇动,待单核细胞充分吞噬羰基铁颗粒后,用磁铁将细胞吸至管底,上层液中含较纯的淋巴细胞。
(二)、淋巴细胞亚群的分离分离相当纯化的淋巴细胞亚群是细胞免疫检验的基本技术。
其原则是根据相应细胞的特性和不同的标志加以选择性纯化。
凡根据细胞的特性和标志选择纯化所需细胞的方法是阳性选择法;而选择性去除不要的细胞,仅留下所需的细胞是为阴性选择。
常用以下几种方法:(1)E花环沉降法本法是将淋巴细胞与一定比例的绵羊红细胞混合,待淋巴细胞形成E花环后,继用淋巴细胞分层液分离细胞。
浮悬在分层界面而不形成E花环的群则富含B细胞,而沉降在管底的形成E花环的细胞用低渗法处理,使围绕细胞周围的绵羊红细胞快速裂解,则获得纯的T细胞。
(2)尼龙毛分离法本法利用B细胞和单核细胞具有易粘附于尼龙纤维表面的特性,可将T和B 细胞分开。
操作原则是取松散而经过处理的尼龙毛(聚酰胺纤维),均匀充填在内径5~6nm的聚乙烯塑料管(饮料管即可)内,经Hanks液浸透保温,将单个核细胞悬液加入柱内,放37温箱静置1~2h。
用预温的含10%~20%小牛血清培养液灌洗,洗脱液内含有非粘附的T细胞,重复灌洗几次以除去管内残留的T 细胞。
再用冷或温培养液边冲边洗边挤压塑料管,此时洗脱液内富含B细胞。
如此得到的T细胞纯度在90%以上,B细胞纯度可达80%。
(3)亲和板结合分离法利用亲和层析法分离淋巴细胞亚群,其原理是各种淋巴细胞亚群具有不同的抗原性,将相应抗体结合于塑料平板上,继加细胞悬液,凡抗原阳性的细胞则与相应抗体结合,抗原阴性的细胞可从未吸附的细胞悬液中获取(图-3)。
同样若用特异性抗原交联在塑料板上,则可分离得具有特异抗原受体的淋巴细胞。
淋巴细胞受体与特异抗原或抗体接触,可引起细胞激活,因此,凡欲去除细胞悬液内某一细胞亚群时,本法更适用。
如要分离CD4+或CD8+细胞,则可用抗CD4或CD8单克隆抗体吸附。
用抗Ig抗体则可分离B细胞。
同样,用活化的C3包被,可分离出有C3受体的细胞。
图-3 亲和分离法图解(4)荧光激活细胞分离仪分离法荧光激活细胞分离仪(fluorescenceactivatedcellsorter,FACS)主要由4部分组成:①细胞流动系统及气压流速控制系统,②激光系统,③检测与讯号处理系统,④细胞分选系统。
其主要原理是细胞经荧光染色后,通过高速流动系统,细胞排成单行,逐个流经检测区进行测定。
当细胞从流动室喷嘴处流出时,超声振荡搅动液流,使液流断裂成一连串的均匀小滴(40000个/s),每小滴内最多含一个细胞(其中只有百分之几的液滴中含细胞),细胞经激光束照射产生荧光和散射光,由光电倍增管接收,转换成脉冲信号,数据经电脑处理,分辨细胞的类型。
如识别的是预计所需的细胞时(如T细胞、B细胞要其亚群),在细胞样品流断裂成小滴时,使液滴瞬即感应阳电荷、阴电荷或不带电荷,使所需的细胞在电场偏转下进入不同的收集管(图-4)。
用FACS分离细胞准确快速,能保持细胞活力,并可在无菌条件下进行,但仪器昂贵,极少用于常规,而多数仅作为研究的手段。
图-4 荧光激活细胞分离仪简图四、吞噬细胞的分离和收集人外周血中单核-巨噬细胞可通过Pecoll密度梯度分离法获取,但数量较少,用血量多。
用斑蝥敷贴法可从人体组织液中获取较纯的巨噬细胞,不需作进一步体外分离,细胞量损失较少。
该法是用滤纸蘸取10%中药斑蝥酒精浸出液,贴敷在臂内侧皮肤表面,4~5h后皮肤局部充血,48h后局部形成水疱,吸取疱中的组织液,内含巨噬细胞。
但此法对病人皮肤有一定损伤,有时可引起局部感染,应慎用。
欲获取小鼠、大鼠、豚鼠等小动物的巨噬细胞,可经腹腔内注入少许石蜡油,3~4天后冲洗出腹腔渗出液,所得细胞悬液中70%~80%为巨噬细胞。
五、淋巴细胞的保存和活力测定(一)、分离细胞的保存在某些情况下,分离所得细胞需要加以保存,否则活力迅速下降,甚至死亡。
(1)短期保存技术将分离到的细胞用适量含10%~20%灭活小牛血清的Hanks、Tc-199、RPMI1640或其他培养液稀释重悬。
所用培养液要求等渗,具缓冲作用,并对细胞无毒性。
通常置4℃保存较好,可减低细胞代谢活动。
要注意不要迅速改变细胞所处的温度,以免造成细胞“温度”休克。
(2)长期冷冻保存技术利用液氮深低温(-196℃)环境保存细胞,是当前世界上通用的细胞长期保存技术。
其原理在于深低温环境可中断细胞的代谢,但在降温过程由于冰晶的形成和渗透压的改变均可导致细胞的损伤和部分死亡,所以在冷冻过程中一定要加用冷冻保护剂,常用的保护剂为二甲亚砜(dimethylsulfoxide,DMSO)。
冷冻时的降温速度和细胞解冻时的升温速度对细胞活力的保存有很大影响。
条件合适时,冻存细胞一旦复苏,恢复37℃培养,其形态和代谢活动均可恢复正常。
