溶胶的光学性质
溶胶的制备及性质——实验报告

溶胶的制备及性质【实验目的】1. 学习溶胶的多种制备方法。
2. 学习溶胶的光学性质,观察溶胶的丁达尔现象。
3. 了解电解质对溶胶稳定性的影响。
【实验原理】一.溶胶的制备溶胶的制备方法有分散法和凝聚法两大类。
分散法是把大颗粒的物质用适当的方法粉碎为胶体大小的质点而获得胶体;凝聚法是把小分子或离子聚集成胶体大小的质点而制得溶胶。
例如,Fe(OH) 溶胶就是采用凝聚法制备的:通过水解 FeCl 溶液生成难溶于水的 Fe(OH) ,3 3 3然后在适当的条件下,过饱和的 Fe(OH) 溶液析出小的颗粒而形成 Fe(OH) 溶胶。
3 3一般制备的溶胶中会含有过多的电解质,会影响溶胶的稳定性。
为除去过多的电解质纯化溶胶,通常采用的方法有半透膜渗析、电渗析和超过滤法。
二.溶胶的光学性质当把一束可见光投射到分散系统上时,如果分散系统的粒径大于入射光的波长,粒子对光主要起反射作用;胶体分散系统对可见光主要起散射作用。
粗分散系统对可见光主要起反射作用,胶体分散系统对可见光主要起散射作用。
当一束可见光通过胶体时,在光线的垂直方向观察,可以看到胶体中有一明亮的光柱,这就是丁达尔现象。
三.溶胶的稳定性和电解质对溶胶的聚沉作用溶胶是热力学不稳定系统,胶粒粒子可相互接近产生凝聚作用,颗粒逐渐增大而聚沉。
适量的电解质可以作为溶胶的稳定剂,过量的电解质可以使溶胶聚沉。
电解质使溶胶聚沉的能力通常用沉聚值表示。
沉聚值是使溶胶发生沉聚时需要电解质的最小浓度,单位为 mol·L-1。
聚沉值与溶胶电荷相反的离子价数 6 次方成反比,即+ 2+ 3+ 6 6 6M :M :M =(1/1) :(1/2) :(1/3) =100:1.6:0.14这就是舒尔茨-哈代规则。
由此可知,电解质中与溶胶电荷相反的离子价数越高,它的聚沉能力就越强。
【仪器和试剂】1. 仪器25ml 和 100ml 量筒,50ml、200ml 和 1000ml 烧杯,250ml 三角烧瓶,电炉,温度计(100℃),试管,移液管。
溶胶的物理化学性质

28
三、 溶胶的电学性质
(一) 电动现象 (1) 电泳
在外加电场作用下,带电 在外加电场作用下, 的分散相粒子在分散介质 中向相反符号电极移动的 现象叫电泳。 现象叫电泳。
29
外加电势梯度越大,胶粒带电越多,胶粒越小, 介质的粘度越小,则电泳速度越大。 通过电泳试验可以确定胶粒的电荷符号。 溶胶的电泳现象证明了胶粒是带电的,实验证明, 若在溶胶中加入电解质,则对电泳会有显著影响。 随溶胶中外加电解质的增加,电泳速度常会降低 以致变为零(等电点),甚至改变胶粒的电泳方向, 外加电解质可以改变胶粒带电的符号。 研究胶粒电泳的仪器称为电泳仪。
11
12
13
沉降速率公式的应用: 沉降速率公式的应用:
2 2 g υ = r ( ρ ρ0 ) 9 η
粘度测定
在被测液体中让一定半径一定密度的小球降落, 在被测液体中让一定半径一定密度的小球降落, 测定通过一定距离的时间求得沉降速度, 测定通过一定距离的时间求得沉降速度,由沉降 速率公式计算粘度η 速率公式计算粘度
沉降分析装置图
15
一、 溶胶的运动性质
(2) 在离心力场中的沉降
胶粒很小,在重力场中的沉降速度极为缓慢,有时无法测 定其沉降速度。 1924年,瑞典人Svedberg发明了超离心机,转速10~16 万 r/min,离心力约为地心引力的106倍。 (普通离心机转速一般为3000~5000 r/min) 利用超离心机加快沉降速率,大大扩大了测定沉降速率的 范围。可把它应用于胶团的摩尔质量或高聚物的摩尔质量 的测定上。
5
一、 溶胶的运动性质
1905年,Einstein研究了布朗运动中,粒子的平均位移与 粒子半径、介质粘度、温度和位移时间之间的关系,得到 著名的“Einstein布朗运动”公式。
胶体与表面化学-胶体的光学性质

2.3 溶胶的光学性质
胶体系统的光学性质, 胶体系统的光学性质,是其高度的分散性和多相的不均匀性 特点的反映。 特点的反映。
2.3.1 光散射现象
光束通过粗分散系统,粒子直径 入射光波长 主要发生反射 入射光波长, 反射, 光束通过粗分散系统,粒子直径>入射光波长,主要发生反射,系统呈现 粗分散系统 混浊。 混浊。 光束通过胶体溶液,胶粒直径 可见光波长 主要发生散射 可见光波长, 散射, 光束通过胶体溶液,胶粒直径<可见光波长,主要发生散射,可以看见 胶体溶液 乳白色的光柱。 乳白色的光柱。 光束通过小分子溶液,溶液均匀,散射光相互干涉而完全抵消,看不见 光束通过小分子溶液,溶液均匀,散射光相互干涉而完全抵消, 小分子溶液 散射光。 散射光。
动态光散射仪
散射光强度的影响因素
散射光的强度 与入射光波长 的四次方成反 比。
不同波长光的散射强度
天空为什么是蓝色的? 天空为什么是蓝色的?
解释蓝天的色彩
自然界的瑞利散射
石头里的瑞利散射现象
作业:朝霞不出门,晚霞行千里。 作业 朝霞不出门,晚霞行千里。 朝霞不出门
丁达尔现象的自然之美
丁达尔现象的自然之美
汽车灯光的丁达尔现象
教堂里的丁达尔现象
交通指示灯颜色选择中的科学
Байду номын сангаас
2.3.3 瑞利公式
2.3.3 瑞利公式
• 1871年,Rayleigh研究了大量的光散射现象,对于粒子半 研究了大量的光散射现象, 年 研究了大量的光散射现象 的溶胶, 计算公式, 径<47nm的溶胶,导出了散射光的强度 I 计算公式,称为 的溶胶 Rayleigh公式 公式
2 24π cv n2 − n0 I= × 2 4 n + 2n2 × I0 λ 0 3 2 2
药剂学知识点归纳:溶胶剂的概念、构造及性质

药剂学知识点归纳:溶胶剂的概念、构造及性质
药剂学虽然是基础学科,但是很多学员都觉得药剂学知识点特别多,不好复习。
今天就带着大家总结归纳一下药剂学各章节的重点内容,以便大家更好地记忆。
溶胶剂的概念
系指由多分子聚集体作为分散相的质点,分散在液体分散介质中组成的胶体分散体系,微粒大小一般在1-100nm之间,属于非均相分散体系。
溶胶的构造与性质
1.溶胶的双电层构造
溶胶剂中的固体微粒具有双电层结构,双电层之间的电位差称作电位,溶胶剂电位越大,其物理稳定性越好。
电位降低至25mv 以下时,胶粒间产生聚结,稳定性下降。
2.溶胶剂的性质
(1)光学性质
具有丁达尔效应,即对光的散射作用。
(2)电学性质
具有电动(电泳)现象与动电(流动电位)现象,其根本原因是微粒因吸附带电,具有双电层结构。
(3)动力学性质
因溶胶剂微粒粒径小(纳米级),因而表现出激烈的布朗运动,溶胶粒子的扩散速度、沉降速度与介质的黏度都与溶胶的动力学性质有关。
(4)稳定性
溶胶剂属于热力学不稳定体系,对电解质非常敏感,少量电解质可供其产生聚沉,其原因是电解质的加入破坏或降低溶胶微粒的电位。
例题:
下列关于溶胶剂的正确叙述是?
A.溶胶剂属于热力学不稳定体系
B.溶胶剂中加入电解质会产生盐析作用
C.溶胶粒子具有双电层结构
D. 电位越大,溶胶剂的稳定性越差
E.溶胶粒子越小,布朗运动越激烈,因而沉降速度越小正确答案:ACE。
第三节 溶 胶

例如, 例如, NaCI 、 CaCI 、 AICI 三种电解质对 As 2S3溶胶(带负电荷)的聚沉能力 溶胶(带负电荷) 的比例为: 的比例为:
2 3
Na : Ca
+
2+
: AI3 + = 1 : 80 : 500
2. 加入带相反电荷的溶胶 相互聚沉现象: 相互聚沉现象:两种带相反电荷 的溶胶按适当比例混合, 的溶胶按适当比例混合,也能引起 溶胶聚沉 。 用明矾净水就是溶胶相互聚沉的 实际应用。 实际应用。
3. 加热 很多溶胶加热发生聚沉。 很多溶胶加热发生聚沉。 例如, 溶胶加热至沸, 例如,将 As 2S3溶胶加热至沸, 就折出黄色的硫化砷沉淀。 就折出黄色的硫化砷沉淀。
应用: 应用: 蛋白质、 蛋白质、氨基酸和核酸等物质 的分离和鉴定方面有重要的应 例如在临床检验中, 用。例如在临床检验中,应用 电泳法分离血清中各种蛋白质, 电泳法分离血清中各种蛋白质, 为疾病的诊断提供依据。 为疾病的诊断提供依据。
(二) 胶粒带电的原因 二 1. 选择性吸附 胶核总是选择性的 吸附与其组成相类似的离子。例如, 吸附与其组成相类似的离子。例如, 用水解法制备Fe(OH)3溶胶时,反 溶胶时, 用水解法制备 应式为: 应式为:
mmoI ⋅ L
−1
聚沉能力是聚沉值的倒数, 聚沉能力是聚沉值的倒数,聚沉值 越小,聚沉能力越大。 越小,聚沉能力越大。
使溶胶聚沉的电解质有效部分是与 胶粒带相反电荷的离子。实验表明, 胶粒带相反电荷的离子。实验表明, 与胶粒带相反电荷的同价离子聚沉 能力几乎相等; 能力几乎相等;当反离子的价数增 高时,聚沉能力急剧增加。 高时,聚沉能力急剧增加。
达到沉降平衡所需的时间与胶粒的 大小有密切关系, 大小有密切关系,为了加速沉降平衡 的建立,使用超速离心机, 的建立,使用超速离心机,可使溶胶 或蛋白质溶液迅速达到沉降平衡。 或蛋白质溶液迅速达到沉降平衡。目 前超速离心机广泛用于医学研究中, 前超速离心机广泛用于医学研究中, 以测定各种蛋白质的分子量及病毒的 分离提纯。 分离提纯。
大气中气溶胶的光学性质与源解析

大气中气溶胶的光学性质与源解析气溶胶是空气中悬浮的微小颗粒,是大气中重要的组成部分。
它们对大气的光学性质有着重要影响,同时也是大气组成与污染源解析研究的重要对象。
本文将从气溶胶的光学性质及其与源解析两方面进行探讨。
首先,气溶胶的光学性质是指气溶胶颗粒对光的吸收、散射和透射特性。
这些性质受到气溶胶颗粒的形状、大小、化学成分等多种因素的影响。
对于大气环境而言,气溶胶的光学性质直接影响到大气的辐射平衡和能量分布。
例如,某些气溶胶颗粒对太阳辐射的散射可以形成美丽的日落,而某些气溶胶颗粒对太阳辐射的吸收则会使大气变暖,对气候变化产生重大影响。
因此,研究气溶胶光学性质对于了解大气的光学特性、气候变化等具有重要意义。
其次,气溶胶源解析是指通过对气溶胶样本的分析,确定其成分和来源的过程。
气溶胶的来源多种多样,包括自然源和人为源。
自然源包括火山喷发、植物挥发物和海洋喷射等,而人为源则包括燃烧排放、工业废气和机动车尾气等。
研究气溶胶的源解析可以帮助我们了解不同源区气溶胶的特性,进而制定相应的环境管理政策。
例如,如果我们能够确定某个城市的气溶胶主要来自于汽车尾气,那么可以采取相应的措施减少汽车尾气排放,改善大气质量。
对于气溶胶的源解析研究,现代科学技术提供了许多有效的手段。
其中,一种重要的方法是使用质谱仪。
质谱仪可以分析气溶胶样本中的化学成分,从而确定其源区特征。
在进行源解析时,常常利用化学计量学的原理,通过对不同源区气溶胶样本的化学成分进行分析比较,确定其来源。
此外,还可以利用同位素技术和模型模拟等手段来进行源解析研究。
通过这些方法,我们可以更加准确地了解大气中气溶胶的来源,推测其对大气环境的影响。
总之,气溶胶在大气中具有重要的光学性质,并且研究气溶胶的源解析对于了解大气环境和制定相应的环境管理政策具有重要意义。
未来,我们需要进一步深入探索气溶胶的光学性质和源解析方法,以更好地理解大气中气溶胶的特性及其对大气环境的影响。
大气中气溶胶的光学性质研究

大气中气溶胶的光学性质研究气溶胶是大气中的微小颗粒物质,由于其对太阳辐射和地球辐射的散射和吸收作用,对大气光学性质、气候变化以及空气质量等方面有着重要的影响。
因此,对大气中气溶胶的光学性质进行研究具有重要的科学和应用价值。
1. 引言气溶胶是指悬浮在大气中的小颗粒,其来源包括自然和人为排放的物质,如尘土、化学物质和污染物。
气溶胶在太阳光照射下,会导致散射和吸收作用,进而影响大气能量的收支平衡。
2. 气溶胶的光学性质气溶胶的光学性质主要包括散射、吸光和透过率等方面。
散射是气溶胶对光线方向偏离原来传播方向的现象,分为弹性散射和非弹性散射。
弹性散射是指光的能量和频率在散射过程中不发生改变;非弹性散射是指光的能量和频率在散射过程中发生改变,如拉曼散射。
吸光是指气溶胶对特定波长的光吸收而使其能量减弱。
透过率则是指光线穿过气溶胶后的相对强度。
3. 气溶胶光学性质的测量和观测为了研究气溶胶的光学性质,开展了多种测量和观测技术。
常用的包括激光雷达、太阳光度计、气溶胶成分分析仪等。
激光雷达可以通过测量散射和吸收来研究气溶胶的浓度和大小分布;太阳光度计则可以通过测量太阳光的散射和吸收来研究气溶胶的光学性质;气溶胶成分分析仪可以精确地测量气溶胶的组成。
4. 气溶胶光学性质与环境与气候变化的关系气溶胶的光学性质直接影响到大气的辐射传输和能量平衡,进而对气候变化产生重要影响。
散射作用会导致大气的反射率增加,使得地球表面的辐射减少,从而导致地球温度下降。
吸光作用则会增加大气的吸收率,导致温度升高。
此外,气溶胶还会通过改变云的性质和影响降水的形成等方式对气候变化产生间接影响。
5. 气溶胶光学性质与空气质量的关系气溶胶的光学性质与空气质量也存在密切联系。
大气中的颗粒物浓度高、组成复杂时,会导致光学性质的变化,进而影响大气的辐射传输,降低能见度和空气质量。
因此,通过研究气溶胶的光学性质,可以评估和监测空气质量状况,为环境管理和治理提供科学依据。
溶胶

性质
特征 光学性质
动力学性质 电学性质
溶胶一般有三个特征:
图1溶胶具有丁达尔效应的光学性质,即用一束光从侧面照射溶胶,在与光路垂直的方向可以清楚地看见一条 发亮的光柱,这种现象称为丁达尔效应,又称丁铎尔(Tyndall)效应,如右图1所示。
丁达尔效应就是光的散射现象,它的产生与分散质离子的大小和入射光的波长有关。当溶质粒子大于入射光 波长,如粗分散系主要发生光的反射,观察不到散射光,所以无丁达尔现象;当溶质粒子小于入射光的波长,如 胶体溶液中溶胶粒子直径为1~100nm,小于可见光波长(400~760nm),当可见光通过溶胶时,散射现象十分明显。 真溶液中由于分散粒子太小,散射现象很弱。所以丁达尔效应是溶胶独有的光学性质。
由表可见,一价、二价三价无机离子的聚沉能力的差别。电解质的聚沉能力主要由异号离子的价态决定,价 态越高聚沉能力越大。这一规律称为叔尔采—哈迪(Schulze—Hardy)规则。
两种电解质的混合物对溶胶的聚沉的研究指出,两种与溶胶粒子相反电荷的离子对溶胶的聚沉作用有时有加 和性,有时又是相互对抗的。例如,向As2S3负溶胶中加入少量的LiCl后再加入MgCl2使As2S3聚沉,发现这时 MgCl2用量远远大于单独使用MgCl2。说明锂离子和镁离子对于As2S3聚沉作用是彼此对抗的
用各种方法制得的溶胶都会含有一定的电解质分子或离子的杂质。这些杂质会影响溶胶的稳定性,因而需要 净化。一般有两种方法:
透析法:利用溶胶粒子不能透过半透膜的性质,分离出电解质。透析时将溶胶装在透析袋中,并将其放入流 水。长时间后,大部分电解质穿过膜随水流去。可以通过检查膜外流水中的离子来监视透析情况。
图2在超显微镜下观察胶体,可以看到代表溶胶离子的发光点在不断地做不规则运动,这种运动称为布朗运动。 如图2所示
基础化学胶体溶液

分散相粒子的半径在1 nm-100 nm之间的体系。目测是均匀 的,但实际是多相不均匀体系。
3.粗分散系
当分散相粒子大于100 nm,目测是混浊不均匀体系,放置后 会沉淀或分层,如黄河水。
一、溶胶的性质
(一)溶胶的光学性质—Tyndall效应
1869年Tyndall发现,若令一束会聚光通过溶胶,从侧 面(即与光束垂直的方向)可以看到一个发光的圆锥体, 这就是Tyndall效应。其他分散体系也会产生一点散射光, 但远不如溶胶显著。
胶团的结构表达式:
胶团的图示式:
[(AgI)m n Ag+ (n-x)NO3–]x+ x NO3–
胶核
|______________________________| |___________胶__粒__( __带 __正 ___电__)_______________|
胶团(电中性)
胶核 胶粒 胶团
谢谢
胶核
[(AgI)m n I – (n-x)K+]x– xK+
胶粒(带负电) |____________胶__团__(__电__中__性__)|
|________________________________|
胶团的图示式:
胶核 胶粒 胶团
二、胶团的结构
例2:AgNO3 + KI→KNO3 + AgI↓ 过量的 AgNO3 作稳定剂
胶体溶液
胶体溶液
分散相与分散介质
把一种或几种物质 分散在另一种物质 中就构成分散体系。 其中,被分散的物 质称为分散相,另 一种物质称为分散 介质。
按分散相粒子的大小分类
1.分子分散系
分散相与分散介质以分子或离子形式彼此混溶,没有界面, 是均匀的单相,分子半径大小在10-9 m以下 。通常把这种 体系称为真溶液,如CuSO4溶液。
胶体

(2)解离作用: 胶核表面分子的解离使胶粒带电。
如:硅胶胶粒(x SiO2 ﹒y H2O)带负电
H 2 SiO 3 HSiO 3 HSiO 3 SiO 3 2+ + H+ H+
3.4.3
一、溶胶的结构
溶胶的结构及稳定 性
胶团结构的表示方法如下:
• AgI正溶胶的胶团结构
3.4.3
一、溶胶的结构
溶胶的结构及稳定 性
二、高分子化合物溶液
高分子化合物在适当的溶剂中能强烈的溶剂化,形 成很厚的溶剂化膜而溶解,碰撞时不易结合成大分子而 沉淀,构成了均匀、稳定的分散系,称为高分子化合物 溶液。高分子化合物溶液的本质是真溶液,丁达尔现象 不明显。
特点:稳定性大、粘度大
17
高分子化合物溶液和溶胶的性质
性质
分散相颗粒特 征 通透性 扩散速度 分散相组成 均一性 稳定性 粘度 外加电解质离 子的影响
3.4.3
溶胶的结构及稳定 性
2. 异电溶胶的相互聚沉
• 将两种带相反电荷的溶胶互相混和,带异电的胶粒会相互 吸引、中和而聚沉。 加入明矾 KAl(SO4)2· 12H2 O 水解后生成Al(OH)3正溶胶
如:水的净化
水中带负电荷的悬浮粒子 相互作用形成絮状物后聚沉
3.4.3
溶胶的结构及稳定 性
温度越高,布朗运动越剧烈
3.4.2
溶胶的基本特征
2. 扩散与沉降(宏观)
在重力场中,胶粒受重力作用而下沉,这 一现象称为沉降。
胶粒由于布朗运动会从密度大的区域向
密度小的区域迁移,这种现象称为扩散。 沉降速率等于扩散速率,溶胶系统处于沉 降扩散平衡。形成浓度梯度。
3.4.2
溶胶的光学性质
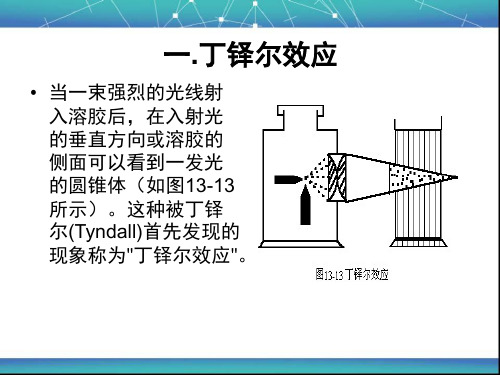
• 当一束强烈的光线射 入溶胶后,在入射光 的垂直方向或溶胶的 侧面可以看到一发光 的圆锥体(如图13-13 所示)。这种被丁铎 尔(Tyndall)首先发现的 现象称为"丁铎尔效应"。
• 光束投射到分散系统上,可以发生光的吸收、反 射、散射或折射。当入射光的频率与分子的固有 频率相同时,则分生光的吸收;但光束与系统不 发生任何相互作用时,则透过;当入射光的波长 小于分散相粒子的尺寸时,则发生光的反射;若 入射光的波长分散相的尺寸时,则发生光的散射 现象。
实例:树林中的丁铎尔现象
光柱,类似这种自然 界的现象,也是丁铎 尔现象。这是因为云, 雾,烟尘也是胶体, 只是这些胶体的分散 剂是空气,分散质是 微小的尘埃或液滴。
二.瑞利公式
• 假设粒子的尺寸远小于入射光的波长时,可把粒 子视为点光源,可以不考虑各个粒子散射光之间 的相互作用。当入射光为非偏振光时单位体积夜 溶胶的散射光强度I可近似地用下列公式表示:
三.超显微镜与粒子大小的近似值测定
• 超显微镜是根据丁铎 尔效应,用来观察溶 胶粒子的存在和运动 的一种显微镜。它可 以观察普通显微镜观 察不到的溶胶粒子, 其结构和光路示意图 如图所示。
• 与普通显微镜不同,超显微镜是在垂直于入射光 的方向上进行观察,因此可以看到黑暗背景中因 胶粒光散射作用而呈现的发光点。应当指出,在 超显微镜下看到的不是粒子本身的大小,而是其 散射光。
本次演讲到此结束 谢谢!
• 可利用超显微镜来估算胶体粒子的平均大小。通 过缝隙的调节可得到光束的高度计宽度,结合样 品的厚度,即可算出产生光散射的溶胶的体积。
• 在超显微镜下直接数 出该体积中含有的粒 子数,即可得到粒子 的数浓度。再设粒子 半径为r,密度为ρ的 圆球,则每个粒子的 质量m可用右式表示:
溶胶的动力学性质和光学性质

第二节溶胶的动力学性质和光学性质
胶体系统是介于真溶液和粗分散系统之间的一种特殊分散系统。
由于胶体系统中粒子分散程度很高,具有很大的比表面积,表现出显著的表面特性,如胶体具有特殊的力学性质、光学性质和电学性质。
1.溶胶的力学性质
1827年,英国植物学家布朗(Brow)在显微镜下,观察悬浮在液体中的花粉颗粒时,发现这些粒子永不停息地做无规则运动。
后来还发现所有足够小的颗粒,如煤、化石、矿石、金属等无机物粉粒,也有同样的现象。
这种现象是布朗发现的,故称布朗运动,但在很长一段时间中,这种现象的本质没有得到阐明。
1903年,齐格蒙德(Zsigmondy)发明了超显微镜,用超显微镜观察溶胶,可以发现溶胶粒子在介质中不停地做无规则的运动。
对于一个粒子,每隔一定时间纪录其位置,可得到类似图9-13所示的完全不规则的运动轨迹,这种运动称为溶胶粒子的布朗运动。
图9-13 布朗运动示意图
粒子做布朗运动无需消耗能量,而是系统中分子固有的热运动的体现。
固体颗粒处于液体分子包围之中,而液体分子一直处于不停的、无序的热运动状态,撞击着固体粒子。
如果浮于液体介质中的固体远较溶胶粒子大(直径约大于5μm),一方面由于不同方向的撞击力大体已互相抵消,另一方面由于粒子质量大,其运动极不显著或根本不动。
但对于胶体分散程度的粒子(直径小于5μm)来说,每一时刻受到周围分子的撞击次数要少得多,那么在某一瞬间粒子各方向所受力不能相互抵消,就会向某一方向运动,在另一瞬间又向另一方向运动,因此形成了不停的无规则运动。
布朗运动的速率取决于粒子的大小、温度及介质黏度等,粒子越小、温度越高、黏度越小则运动速率越快。
溶胶的概念

溶胶的概念
溶胶是一种由微小颗粒(胶粒)悬浮在液体中形成的分散体系。
这些微小颗粒通常具有纳米到微米级别的尺寸,可以是金属、聚合物、生物分子等物质,它们在液体中形成了一个均匀分散的体系,这个分散体系中的胶粒之间相互作用力较弱,可以相对自由地运动和聚集。
溶胶具有一些特殊的物理和化学性质,如光学、磁性、电学、机械等性质,这些性质与胶粒的尺寸、形状、组成等因素密切相关。
由于溶胶中的胶粒尺寸较小,因此它们可以在微观尺度上对光的散射和吸收产生影响,这就是溶胶的光学性质。
此外,溶胶还具有一些特殊的表面性质,如表面电荷、表面活性等,这些性质对溶胶的稳定性和应用性能都有重要影响。
溶胶在材料科学、生物医学、能源等领域具有广泛的应用,如纳米材料制备、生物传感器、太阳能电池、涂料、油墨等。
胶体化学第3章-胶体的基本性质

1)当光束通过粗分散体系,由于粒子大于入射光的波 长,主要发生反射,使体系呈现混浊。 2)当光束通过胶体溶液,由于胶粒直径小于可见光波 长,主要发生散射,可以看见乳白色的光柱。 3)当光束通过分子溶液,由于溶液十分均匀,散射光 因相互干涉而完全抵消,看不见散射光。
区别溶胶、真溶液 和悬浮体最简单而 灵敏的方法。
Brown运动产生的本质
分散介质分子以大小不同和方向不同的力对胶体粒 子不断撞击而产生的。由于受到的力不平衡,连续地以 不同方向、不同速度作不规则运动。随着粒子增大,撞 击的次数增多,而作用力抵消的可能性也变大。
Brown运动的特点
★粒子越小,布朗运动越激烈。 ★运动激烈的程度不随时间而改变,但随温度 的升高而增加。 ★粒子半径大于5μm后,Brown运动就会消失。
物理吸附 如吸附表面活性剂,极性基团吸附到极性( 亲水)表面,非极性基团吸附到非极性(疏水)表面 。当非极性基团吸附到疏水表面时,疏水表面变为 亲水,而且带电。
(2)电离 对于可能发生电离的大分子的 溶胶而言,则胶粒带电主要是其本身发生电离 引起的。
例如蛋白质分子,当它的羧基或胺基在水中解离时, 整个大分子就带负电或正电荷。当介质的pH较低时, 蛋白质分子带正电,pH较高时,则带负电荷。
当蛋白质分子所带的净电荷为零时,这时介 质的pH称为蛋白质的等电点。在等电点时蛋 白质分子的移动已不受电场影响,它不稳定且 易发生凝聚。
(3)离子的不等量溶解
对离子型的固体物质有两种电荷相反的离子,可获得 离子。对于金属氧化物和氢氧化物的溶胶,决定胶粒电 性的主要离子是H+和OH-的浓度。
4)晶格取代
R-观测距离
θ-观测角度
I 1
4
I
大气密度的涨落引起太阳光的散射, 散射光呈淡蓝色
溶胶的性质 (1)

胶粒带电原因?
氢氧化铁溶胶的电泳实验
溶胶粒子的 + 3H2O == Fe(OH)3 + 3HCl Fe(OH)3 + H+ == FeO+ + 2H2O
反离子
胶粒
电势离子 氢氧化铁胶团的结构示意图
胶核
溶胶粒子的结构
负溶胶
扩散层 反离子
胶粒
胶团
AgNO3 + KCl == AgCl + KNO3
电势离子 胶核
氯化银胶团的结构示意图
二、溶胶及其性质
3.溶胶的性质
4)溶胶的稳定性和聚沉
溶胶的稳定性 ① 动力学稳定性
② 胶粒带电(主要因素)
③ 胶粒表面水化膜的保护作用
溶胶的聚沉 ①电解质的聚沉作用
②溶胶的相互聚沉
3、使溶胶聚沉常用的方法有哪些?
溶胶中分散质的颗粒在不断地做无规则的运动,这种运动叫做布朗
。 (Brown)运动
布朗运动是大量分子做无规则运动对悬浮的固体微粒各个方向撞击作用 的不均衡性造成的,所以布朗运动是大量液体分子集体行为的结果。 是溶胶稳定的重要因素
二、溶胶及其性质
3.溶胶的性质 3)电学性质
电泳现象 电泳现象说明溶胶粒子是带电的, 根据电泳实验测定溶胶粒子的带电性。
溶胶及其性质
药学院教师 朱勇
二、溶胶及其性质
1.溶胶的概述:溶胶的胶粒是由大量分子(或原子、离子) 形成的聚集体。直径为l-100 nm的胶粒分散在分散介质中形 成的多相系统,具有很大的界面和界面能,能否长时间存在 取决于胶体的性质。
硅溶胶
二、溶胶及其性质
2.溶胶的分类:习惯上,把分散介质(分散剂)为液体的胶体 分散体系称为液溶胶或溶胶(sol);分散介质为气体的分散体 系成为气溶胶,介质为固体时,称为固溶胶。
溶胶的光学性质

以上是Tyndail的发现,称为Tyndail效应。其他分 散体系也会产生这种现象,但远不如溶胶显著。 Tyndail效应是判别溶胶与真溶液的最简便方法。
2 、 Tyndail效应原理 当光线射入分散体系时能发生两种情况: ①分散相粒子直径>入射光时,主要发生 反射或折射现象。粗分散体系就属于这 种情况 ②分散相粒子直径<入射光时,主要发生
§2-2 溶胶的光学性质
溶胶的光学性质是其高度分散性
和不均匀性特点的反映.
一 、光散射特性 1、TYndall效应(T铎尔) ①晴朗的早晨站在户外,可以看到天空总是蔚蓝 的,这是由于从一个方向射入大气层的阳光,被 空气(气溶胶)分子 散射到各个方向。
② 一束会聚的光通过溶液
从侧面(与光束垂直的方向) 看到一个发光的圆锥体
粒子直径 nm 10-20 银胶体的颜色 透射光 黄 侧面光 兰 小 粒径 S胶体的颜色 透射光 黄 橙 红橙 红 浅红 侧面光 青
25-35
35-45
红
红紫
暗绿
绿
青
绿青
50-60
70-80
兰紫
兰
黄
棕红 大 绿黄
紫
青紫 浅青 绿
黄红
橙红 红
120-130 绿
分散高度(粒子小)的胶体呈现黄或橙, 是因为他吸收了紫光和青光,分散度降 低,变成红、紫、青、绿等色。
式中:A
24 A V
2 2
2
4
n n ( ) n 2n
2 1 2 1
2 2 2 2 2
n1
入射光振幅, 入射光波长, 分散相折射率,
单位体积中粒子数 V 每个粒子的体积 n2 分散介质的折射率
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
ห้องสมุดไป่ตู้1/ 3
m: 单个溶胶粒子的质量
ρ: 单个溶胶粒子的密度 ρB:单位体积溶胶中分散相的质量
C:单位体积溶胶中所含溶胶粒子的个数
3.超显微镜与粒子大小的近似测定 ●一般显微镜:在入射光的反方向上观察,散射光受透射光强烈 干扰,不能看到胶体粒子的存在; ●超显微镜:在与入射光垂直的方向及黑暗视野条件下观察,用 强光源(常用弧光)照射,可看到闪闪发亮、不断移动的光点。 注:在超显微 镜下看到的并 非粒子本身的 大小,而是其 散射光,散射 光的影像比胶 粒的投影大数 倍之多
2 2
即通过光散射测定溶胶和粗分散系统浊度计的原理。
一束会聚光通过溶胶时,站在与光线垂直的方向, 看到的 光柱的颜色是淡蓝色,站在入射光180度的方向, 看到的是橙红 色,为什么?
在入射光侧面,看到的是胶粒的散射光,据瑞利公式,入射光波长越 短,散射光越强,故蓝色紫色光易散射,散射光呈淡蓝色。 对着入射光,看到的是透射光,在白光中,波长较短的蓝色紫色光已 散射,剩下的透射光主要是波长较长的光,故看到的透射光是橙红色的。
§12.2
溶胶的光学性质
2.瑞利公式 非导电性球性粒子,单位体积液溶胶的散射光强度I与入 射光的强度I0近似满足:
9π V C I= 2 λ4 l 2
2
2
⎛ n −n ⎞ 2 ⎜ ⎟ 1 cos α I0 + ⎜ n 2 + 2n ⎟ ⎝ ⎠
2 2 0 2 0
2
(
)
I0 :入射光的强度;V :每个分散相粒子的体积; C :单位体积中的粒子数(数密度); :入射光的波长 l :观察者与散射中心的距离; n :分散相的折射率 ;n0:介质的折射率 a : 散射角,即观察的方向与入射光方向间的夹角
3.超显微镜与粒子大小的近似测定 溶胶粒子平均大小的估算:(假设粒子为球形) 若已知单位体积溶胶中分散相的总质量ρB和所含溶胶粒子 的个数C(由超显微镜测出),可求胶体粒子的半径r 。
ρB 4 3 m = πr ρ = 3 C
⎛ 3m ⎞ r=⎜ ⎟ 4 πρ ⎝ ⎠
1/ 3
⎛ 3ρ B ⎞ =⎜ ⎟ 4 πρ C ⎝ ⎠
§12.2
溶胶的光学性质
1.丁铎尔效应 一束会聚的光通过溶胶,与 光束垂直的方向可看到一个发光 的圆锥体,即丁铎尔效应。 光束 投射 到分 散系 统时 入射光波长 < 分散粒子尺寸——反射 入射光频率 = 分子固有频率—— 吸收 无作用 ——— 透过
可区分 溶胶 真溶液
入射光波长 > 分散粒子尺寸——散射 (可见光波长 400~ 760 nm;胶粒 1~ 1000nm) 丁铎尔效应是由于胶体粒子发生光散射而引起的 丁铎尔效应是由于胶体粒子发生光散射而引起的
2.瑞利公式
9π V C I= 2 λ4 l 2
2 2
⎛ n −n ⎜ ⎜ n 2 + 2n ⎝
2
2 0 2 0
⎞ 2 ⎟ 1 + cos α I0 ⎟ ⎠
2
(
)
讨论:① I ∝ V2成正比。可用来鉴别小分子真溶液与胶体溶液 ②波长愈短,散射光愈强。 ③散射光强度 I ∝ 分散相与分散介质折射率的差 ∆ n成正比 以此可区分:胶体溶液:分散相与分散介质有相界面,∆n 大 高分子溶液:均相溶液,∆n 小 ④散射光强度 I ∝ 粒子数密度C成正比 I 1 C1 同类溶胶,测量条件相同,仅 C 不同时,有 I = C
