硫酸庆大霉素注射液生产过程质量控制要点
庆大霉素生产工艺

硫酸庆大霉素生产工艺流程时左右,硫酸庆大霉素工业发酵的总流程图孢子悬浮液的制备流程及工艺要求设备:蒸汽灭菌柜双人净化工作台操作步骤1.分装纯化水至三角瓶,每瓶装150mL左右。
2.组装接种瓶及接种皮管,组装严密,包扎结实。
3.以上器材及接种用具灭菌,125±1゜C,60min。
4.在缓冲间穿好无菌衣,戴上无菌口罩,进入洁净室,符合人流﹑物流进出程序。
5.用酒精棉球擦拭超净台面﹑双手,先擦台面,后擦手。
6.开启超净台通风,观察风速是否正常,将接种瓶、皮管、无菌水、接种铲及斜面摆在洁净台上。
7.将灭菌纯化水倒入茄子瓶中,一瓶纯化水倒两只茄子瓶。
8.用接种铲将孢子刮下制成孢子悬浮液,用力适度,勿刮出培养基碎屑。
9.打开接种瓶瓶口,将孢子悬浮液全部倒入接种瓶中,注意不要倒在瓶口处,然后重新组装好接种瓶及接种皮管。
10. 制备完毕关闭洁净台,出洁净室,符合人流、物流进出程序。
物料指标物料编号物料名称投产数量0601013 纯化水150-200ml --- 子斜面孢子4支一级种子发酵培养操作步骤1.校正量具,小于1kg用台秤,大于1kg用磅秤。
2.先后将淀粉,玉米粉,硝酸钾,蛋白胨,轻质碳酸钙称好后装在编织袋中,准备投料。
3.向事先冲洗干净并压净的一级罐中加水至埋住下层搅拌桨时,开搅拌,然后将称好的物料缓缓加入罐中,再分别量取2%氯化钴溶液和豆油加入罐中,加水至所需体积。
上紧罐盖,准备灭菌。
4.打开罐底阀,放掉夹套水,夹层通蒸汽预热至90℃后关闭。
5.由取样管、压出管、进气管3路进蒸汽,进行直接蒸汽灭菌。
升温,当罐压达0.1MPa时,保压30min。
保压过程重要适当控制进气、排气。
6.灭菌结束,先关排气阀,后关进气阀,当罐压低于空气分过滤器压力时,再开空气进气阀,控制排气要适当。
7.打开夹层冷水阀,关闭罐底阀,打开回水阀降温至38℃时关闭。
消罐人员停搅拌,进行压差接种。
8.消罐人员停搅拌,将罐压降至0.04Mpa, 看罐人员配合种子组人员接种,先取无菌样,接种前点燃火圈烧接种口,对接种口消毒,火焰要大,要均匀。
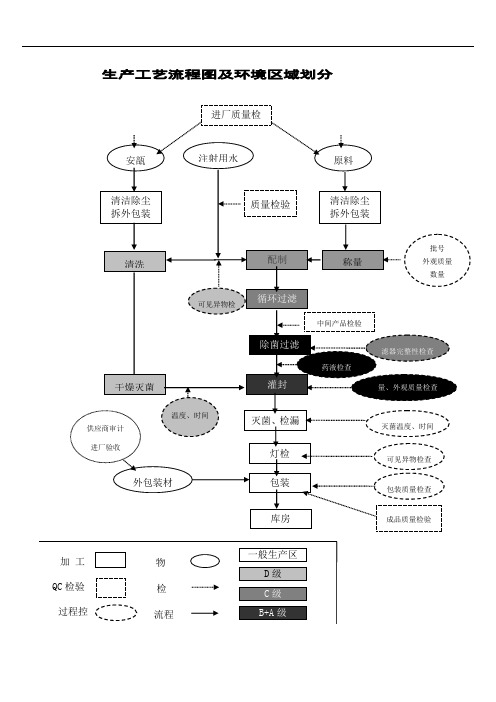
注射液生产流程图及关键控制点
数量,标识,处理
每批
1、不合格品统计数量,每批分区存放并有状态标识;2、在QA监督下每批销毁
工序
监控点
监控内容
监控频次
监控标准
包装
纸盒
内容、字迹、位置、数量
随时/班
1、内容、数量与批包装指令一致;2、字迹清晰,与样张相符;
标签
内容、字迹、位置、数量
随时/班
1、内容、数量与批包装指令一致;2、字迹清晰,与样张相符;
标识、存放区、无菌检查
每批
1、成品统计数量,每批分区存放并有状态标识;
11 质量监控
工序
监控点
监控内容
监控频次
监控标准
配液
备料
物料
物料信息、外观、异物
每次
1、所领物料与生产所用物料一致;2、外观无破损;3、物料无异物
称量
衡具,量具
校验合格证、校准
每批
1、有检验合格证并在有效期内2、经过校准且有记录
原辅料
环境、数量、复核
每次
1、环境:温度:18℃-26℃,湿度:45%-65%;2、称量数量与批生产指令一致;3、双人独立复核
洗瓶
安瓶
物料信息、外观
每批
1、所领物料与生产所用物料一致;2、外观无破损
注射用水
超声频率、注射用水澄明度、水温、水压、清洁度
每小时
1、超声波频率:70Hz;2、注射用水澄明度:无浑浊;3、水压:0.35-0.45Mpa;4、清洁度:无颗粒物
压缩空气
清洁度、压力
每小时
1、清洁度:无颗粒物,无油;2、压力:0.30-0.60Mpa
洗后安瓶
清洁度
随时/批
1、清洁度:无颗粒物,无浑浊;2、瓶内无积水
硫酸庆大霉素注射液工艺流程图溶解于无水亚硫酸钠适量注射

定时/班 定时/班 定时/班
每批
随时/班 随时/班 随时/班 随时/班 随时/班
每锅 每批 定时/班 每盘 随时/班 随时/班 每批 每箱
9、硫酸庆大霉素注射液工艺流程图:
溶解于
无水亚硫酸钠
适量注射用水
+ 硫酸庆大霉素
调 PH 值
过滤脱炭
充氮气
加水至全量
针用活性炭
精滤
灌
封
测 PH、含量
10庆大霉素注射液生产过程质量控制要点:
工序 质量控制点
制水
纯化水 注射用水
理瓶 原包装安瓿
质量控制项目 电导率 《中国药典》全项 pH 值、氯化物、氨盐 《中国药典》全项 检验报告单、清洁度
频次 1 次/2h 1 次/周 1 次/2h 1 次/周 定时/班
洗瓶 配液
灌封
灭菌 灯检 包装
隧道烘箱 洗净后安瓿 烘干后安瓿
药液
烘干安瓿
药液
封口 灌封后半成品 灭菌柜 灭菌前后半成品 灯检品 在包装品 印字 装盒 标签 装箱
温度 清洁度 清洁与干燥程度 批号划分与编制、主药含量、PH 值、可见异 物、色泽、过滤器材的检查(如起泡点等) 清洁度 色泽 可见异物 长度、外观 药液装量、可见异物 标记、装量、温度、时间、记录、真空度 外观清洁度、标记、存放区 抽查可见异物 每盘标记、灯检者代号 批号、内容、字迹 数量、说明书、标签 内容、数量、使用记录 数量、装箱单、印刷内容、装箱者代号
硫酸庆大霉素注射液处方和工艺研究

te i et l w t e prt e f h n c be a rt ea a i g d n e g n a cn s l t n h d i g o d r o nix d n f c e h H sa i t , u h n ixd n o a e n a l h d n n r p r e s e tmy i u f e a d te a d n r e f a t i a t af t d t e p tb l y b tt e a t i a t d s g e r a o i . n a o e i o y
.
Ke r : na cn S l t ne t n fr lt n pe aain po es a c lrtd ts;o g—tr s bly ep rme t y wo  ̄ Ge tmy i uf e jci ;omuai ; rp rt rc s; c eeae etln a I o o o em t it x ei n a i
采 用 1% 氢 氧 化钠 溶 液 上 调 p 经 过 正 常灌 装 灭 菌后 , 现药 液 色 0 H, 出
制 备 : 取 约 总 量 3 % 的 注 射 用 水 ( 方 对 注 射 用 水 水 温 未 称 0 处
作 规 定 ) 加入 备 好 的硫 酸 庆 大 霉 素 , 拌 使 溶 解 , 按 浓 料 体 积 的 , 搅 再 1 。 入 活 性 炭 , 匀 , 置 1 i后 过滤 , 液 中加 入 亚 硫 酸 氢 % 加 】搅 静 5r n a 滤 钠 , 拌 使 溶 解 后 补 加 注 射 用 水 至 全量 。 1% 硫 酸或 1 % 氢 氧 搅 用 0 0 化 钠 液 调 整 p 在 3 8~ . , 滤 后 精 滤 至 澄 明 度 合 格 , 氮 气灌 H . 57粗 充 封 。 通蒸 气 10o 灭 菌 3 i。 流 0 C 0r n 每批 配制 量 为 200mL a 0 。 2 12 浓 料 药液 温 度 对 药 品 p . . H及 色 泽 的影 响
硫酸庆大霉素注射液处方和工艺研究

硫酸庆大霉素注射液处方和工艺研究王洪萍;黄璐;耿海明;杨波【摘要】Objective To study the formulation and preparation process of Gentamycin Sulfate Injection and to improve its pH stability. Methods To investigate the impact of the injectable water temperature for preparing dense gentamycin sulfate, antioxidant dosage and its adding order on the pH stability. According to the finalized formulation and preparation process, 3 batches of samples were prepared and performed the accelerated test and long- term stability experiment. Results In the production of Gentamycin Sulfate Injection, the injectable water temperature for preparing dense gentamycin sulfate and the adding order of antioxidant affected the pH stability, but the antioxidant dosage nearly had no influence on pH stability. Conclusion The finalized formulation and preparation process is more reasonable and suitable for mass production.%目的研究硫酸庆大霉素注射液的处方和工艺,提高其Ph稳定性.方法考察了配制浓料的注射用水温度、抗氧剂用量及其加入顺序对Ph稳定性的影响,按照最终确定的处方和工艺配制3批样品进行加速试验及长期稳定性试验.结果在硫酸庆大霉素注射液生产中,配制浓料的注射用水温度和抗氧剂的加入顺序对Ph稳定性有影响,抗氧剂用量对Ph稳定性几乎无影响.结论最终确定的处方和工艺比较合理,适用于大规模生产.【期刊名称】《中国药业》【年(卷),期】2011(020)004【总页数】2页(P48-49)【关键词】硫酸庆大霉素注射液;处方;制备工艺;加速试验;长期稳定性试验【作者】王洪萍;黄璐;耿海明;杨波【作者单位】武汉远大制药集团有限公司,湖北,武汉,430035;武汉远大制药集团有限公司,湖北,武汉,430035;武汉远大制药集团有限公司,湖北,武汉,430035;武汉远大制药集团有限公司,湖北,武汉,430035【正文语种】中文【中图分类】TQ460.6;R978.1+2硫酸庆大霉素为氨基苷类广谱抗生素,其注射液为无色或几乎澄明液体,适用于治疗敏感革兰阴性杆菌所致的严重感染和敏感细菌所致的中枢神经系统感染。
硫酸庆大霉素内控质量标准
制药GMP管理文件一.目的:制定硫酸庆大霉素内控质量标准,规范公司硫酸庆大霉素的采购与生产。
二.适用范围:适用于硫酸庆大霉素的采购与验收。
三.责任者:生产部经理、质管部经理、检验员四.正文:硫酸庆大霉素本品按无水物计算,每1mg的效价不得少于590庆大霉素单位。
【性状】本品为白色或类白色的粉末;无臭;有引湿性。
本品在水中易溶,在乙醇、丙酮、三氯甲烷或乙醚中不溶。
比旋度取本品,精密称定,加水溶解并定量稀释制成每1ml 中约含50mg的溶液,依法测定,比旋度为+107°至+121°。
【鉴别】(1)取本品约5mg,加水1ml溶解后,加0.1%茚三酮的水饱和正丁醇溶液1ml与吡啶0.5ml,在水浴中加热5分钟,即显紫蓝色。
(2)取本品与庆大霉素标准品,分别加水制成每1ml中含20mg 的溶液,照薄层色谱法试验,吸取上述两种溶液各2ul,分别点于同一硅胶G薄层板(临用前于105℃活化2小时)上;另取三氯甲烷-甲醇-浓氨溶液(1:1:1)混合振摇,放置1小时,分取下层混合液为展开剂,展开,取出于20~25℃晾干,置碘蒸气中显色,供试品溶液所显主斑点数、位置和颜色应与标准品溶液斑点数、位置和颜色相同。
(3)本品的红外吸收图谱应与对照的图谱一致。
(4)本品的水溶液显硫酸盐的鉴别反应。
【检查】酸度取本品,加水制成每1ml中含40mg的溶液,依法测定,PH值应为4.0~6.0。
溶液的澄清度与颜色取本品5份,各0.4g,分别加水5ml使溶解,溶液应澄清无色;如显浑浊,与1号浊度标准液比较,均不得更浓;如显色,与黄色或黄绿色2号标准比色液比较,均不得更深。
硫酸盐取本品约0.125g,精密称定,加水100ml使溶解,用浓氨溶液调节PH值至11,精密加氯化钡滴定液(0.1mol/L)10ml及酞紫指示液5滴,用乙二胺四醋酸二钠滴定液(0.05mol/L)滴定,注意保持滴定过程中的PH值保持为11,滴定至紫色开始消褪,加乙醇50ml,继续滴定至紫蓝色消失,并将滴定的结果用空白试验校正。
药品生产过程中偏差处理典型案例分析和CAPA

01
——提出纠正与预防措施 ——批准纠正与预防措施 ——实施纠正与预防措施 ——评估纠正与预防措施 ——完成纠偏行动
02
(九)偏差管理职责
二、偏差管理与实际运用
——偏差报告人员/部门 负责及时、如实报告偏差;采取应急处理措施;协助调 查偏差的原因;执行及纠正措施的实施。 ——偏差涉及的相关部门 配合调查偏差的原因;提出处理意见及纠正预防措施, 并提供相应的书面支持文件。
—— 偏差风险处置:及时、准确判断偏差性
暂停生产 产品或物料隔离 产品或物料分小批 设备暂停使用 紧急避险
—— 紧急处置措施
二、偏差管理与实际运用
偏差分类
01
——按偏差产生 的范围分类
工程部等的负责人或授权人。
成员为质量部、生产部、物流采购部及
程的处置建议以及相应的纠正预防措施
原因。
——偏差调查小组
负责讨论并制定偏差所涉及的物料或过
01
02
03
04
05
06
——质量部门 负责对偏差报告和调查系统的管理。 负责质量偏差管理文件,制定不同类型偏差处理规程及时限。 在调查过程中与调查组长及团队的协调。 对调查的范围和对产品影响程度协调调查组进行再评估。 批准采取的纠正措施,确保纠正措施符合法律法规要求。 批准调查报告,包括批准继续使用受调查影响物料、设备、区域、工艺、程序的书面解释。 审阅、评估调查延期完成的合理性。 决定产品、系统、仪器设备的处置。 审核和批准跟踪及预防措施报告。
02
实验室偏差
03
非实验室偏差
04
环境监测偏差
05
检验监测偏差
06
生产工艺偏差
07
非生产工艺偏差
大容量注射剂质量控制点

制袋灌封
膜、口管
检查洁净度,是否脱外包装。
逐件
当班人员
印字
确认品名、规格、批号、生产日期、有效期。
每班生产前
班长
组合盖
每桶组合盖使用前检查组合盖标识是否完整,盖是否干净无杂质。
每桶
当班人员
按先进先出原则用盖
灌装前的确认
每班灌装的前6组重点检查澄明度,调节装量,合格才可继续灌装。
每班灌装前
当班人员、QA
工序
控制项目
内容
检查频次
责任人
备注
制水
纯化水
电阻率、氨、酸碱度、氯化物,应有记录。
每两小时
当班人员
贮罐、管道定期清洗消毒
注射用水
电阻率、氨、PH值、氯化物,应有记录。
每两小时
当班人员
空调
温度、湿度
18℃~26℃;45%~65%。
每班
当班人员
定期监测、维护
净化系统
空气洁净度(尘埃粒子、菌落数等)。
定期
随时
当班人员
灭菌温度、时间、压力
1每次灭菌前检查柜内各点的温度探头是否完好,2控制好压力系数、灭菌时间、温度及冷却出柜温度。3 产品出柜后必须有标识,品名,批号要完整
每柜
当班人Байду номын сангаас、QA
如有异常及时通知带班长和现场QA。
下袋
1核对产品品名、规格、批号。
每柜
当班人员、QA
如有异常及时通知带班长和现场QA。
每班
班长、当班人员
包材的领用数=使用数+残损数+剩余数。
核对
每批纸箱、合格证的批号、生产日期、有效期打样后交班长复核,确认无误后开始包装。合格证上有对应的装箱人员签名
大容量注射剂质量控制点

根据生产指令,按先进先出的原则发料。领、发双方确认后在领料单上签名,同时物控科当班人员在货位卡及帐上填写记录,应做到QA随时抽查帐、物、卡相符。
责任人
当班人员
当班人员、QC
每班
称料员
稀配
1、体积准确、混合均匀。2、QA审核符合要求才能进行下一工序;3、如需加料加水量超出日常添加量时,及时通知带班长和现场QA,确认无潜在质量隐患后方可加料加水.
每班
当班人员、QC、QA
取样要有代表性
配液罐、管道清洗
换品种清洗管道后,取洗净水检查理化项目,停产后再生产需取洗净水做全检。
每班
收到质管科发放的不合格报告单,应及时填写“不合格物料处理申请单”,交质管科科长签审核意见,交厂长审批后,在QA监督下处理并填写处理记录。
根据生产指令,按先进先出、效期短的先出、取过样的先出的原则发料。领、发双方确认后在交接单上签名,同时物控科当班人员在货位卡及帐上填写记录,应做到QA随时抽查帐、卡、物、相符。
3.胶口是否完整,底部声深浅是否合适
每季度检一次,原料供应商有变动或模具大修后的第一批取样检测
责任人
当班人员、班长
当班人员、班长
班长、成型主管
制
盖
项目
内盖
外盖
请验
控
制
方
法
每两小时一次,每次取2模检查:1、肉眼观察无气泡、结块、缺边、异物、毛边等现象。应有记录。2、送下工序应有合格标示。
1当班人员应每两小时检测一次拉力。拉力检测应小于75牛、无拉断现象,每班留两模灭菌后送中检测拉力应有记录2、无毛边、无气泡,拉环处无裂开,异物等现象。3、每班将接班后的前十模送组盖组好后交灌装封口,然后送灭菌班灭菌,出柜后观察盖是否积水(如有外盖积水的盖子,记下盖号通知成型班进行调整或重试)根据情况4、送下工序应有合格标示。
硫酸庆大霉素凝胶剂制备及质量控制

硫酸庆大霉素凝胶剂制备及质量控制目的制备硫酸庆大霉素凝胶剂并建立其质量控制方法。
方法以硫酸庆大霉素为主药,卡波姆为基质制备凝胶剂,采用紫外分光光度法测定硫酸庆大霉素含量并进行稳定性试验。
结果制得的凝胶均匀细腻,含量测定方法重复性良好,线性范围为0.02~0.12 mg/mL(r = 0.999 3),回收率为100.23%(RSD = 0.52%,n = 5)。
结论硫酸庆大霉素凝胶剂制备工艺简便可行,制得凝胶符合要求,质量控制方法可靠。
标签:硫酸庆大霉素;凝胶剂;制备;质量控制硫酸庆大霉素是氨基糖苷类抗生素,主要用于敏感菌引起的各种感染及皮肤和软组织感染等,抗菌活力强,但毒性较大。
国内一些皮肤专科门诊使用硫酸庆大霉素溶液外用于皮肤患处湿敷治疗,疗效确切,毒副作用大大减小,由于使用方法是湿敷,使用麻烦,患者依从性不高、携带也不方便。
本制剂以卡波姆940为基质,制成皮肤局部用硫酸庆大霉素凝胶剂,硫酸庆大霉素易溶于水,卡波姆凝胶易于涂布,并能吸收组织渗出液,有利于分泌物的排除,特别适宜治疗湿疹、渗出性皮炎、痤疮等临床治疗,而且制剂稳定性好,用后感觉舒适,易于清洗且透气性良好,不仅可以提高患者依从性,使用携带也方便。
现将其制备及质量控制报道如下:1 仪器与试药UV-2401紫外分光光度计(日本岛津公司),TG328B分析天平(上海天平仪器厂),硫酸庆大霉素对照品(中国药品生物制品检定所,批号:130326-201015),硫酸庆大霉素原料药(南阳普康药业有限公司,批号:100606),卡波姆940(河北固安希星药业有限公司,批号:110705),硫酸庆大霉素凝胶(本院制剂室,批号:110808,110815,110825)其余试剂为分析纯。
2 方法与结果2.1 处方与制备2.1.1 处方硫酸庆大霉素2 000 000 U,卡波姆94 010 g,三乙醇胺10 mL,甘油80 g,纯化水加至1 000 g。
注射剂生产过程的质量控制

注射剂生产过程的质量控制(一)生产过程的质量控制生产数量保证了,质量必须合格,否则不能出厂,尤其是安全指标一点都不能含糊,如:热原、无菌、过敏、异常毒性、降压物质、鉴别项等,,有一样不合格都会要人命的,叫不准重做。
齐二药是假辅料、华源是无菌热原的问题。
现在对药品的质量要求的越来越严了,有一项不合格就算劣药,要没收非法所得,并处以货值1-3倍的罚款,要求生产的药品必须合格,生产合格率要达到100%是非常难的,尤其是生化药针剂更难,但这是每个企业永恒追求的目标。
产品的合格率指两方面:一个是批成品率、一是批次合格率。
(二)提高批成品率:设备必须好使:如有打瓶可能有玻璃屑、灌针有问题水针有碳化点、止灌不好使浪费药液、装量控制不好灌高了产量低、灌低了不合格等,最好刚灌装前十支应传出去灯检,有问题及时调整,没问题再正式灌装。
还有就是控制好含量,既保证含量合格又不浪费,这也要求药液混合均匀、溶解充分、取样有代表性、检验准确。
(三)如何提高批合格率:1 提高主要原辅料的内控质量标准:主要是化学原料药和使用量较大的辅料。
针剂用原辅料国家标准有的制定的不严格不科学,要用内控标准来补充,如有的品种原料不检热原,若原料带热原就有可能导致成品不合格,有的品种在原料生产时可能有毒性,这样的原料就应做异常毒性,因为制剂的工艺过程是无法除毒性物质的,降压物质也是一样,总之,成品要检的项目如果原料有可能带来就应检原料,内控标准就应制定相应的项目,采购时应先与厂家讲清楚,合同中应附带内控标准。
从源头控制产品质量。
2生化药提取原液应检测成品的相关项目,如高分子、过敏试验、降压物质、活性等。
当提取车间更换超滤柱子膜包时和改变工艺及时通知化验室,做溶液的过敏和高分子等,避免生产出的成品不合格,无法挽救,造成损失。
3 半成品的质量标准尤其是新品种的内控质量标准的制定,最近陆续有批准生产的新品种,必须制定科学合理的内控标准,制定时生产和质量共同商量,采购也要参与,原辅料采购时要执行。
注射用硫酸庆大霉素

注射用硫酸庆大霉素生产工艺规程目录1.适用范围 (2)2.引用标准 (2)3.职责 (2)4.产品名称及剂型 (2)5.产品概述 (2)6.处方及工艺 (3)7.生产工艺流程图 (6)8.生产准备 (7)9.操作过程及工艺了条件 (7)10.质量标准 (17)11.技术经济指标的计算 (19)12.使用说明书、标签的内容详见附录样稿 (20)13.技术安全及劳动保护 (20)14.工艺卫生及区域卫生 (21)15.综合利用与环境保护 (22)16.操作工时与生产周期 (23)17.劳动组织与岗位定员 (23)18.设备一览表及主要设备生产能力 (24)19.附录 (26)1.适用范围本规程规定了注射用硫酸庆大霉素生产全过程的工艺技术、质量、物耗、安全、工艺卫生、环境保护等内容,经验证合格,符合GMP规范要求。
本工艺规程具有技术法规作用。
本工艺规程适用于注射用硫酸庆大霉素的生产全过程,是各部门共同遵循的技术准则。
2.引用标准《中华人民共和国药典》2005年版(第三部)《中国生物制品主要原辅材料质控标准》(2000年版)《药品生产质量管理规范》(1998年修订)3.职责起草:生技部组织相关专业技术人员负责起草。
审批:技术总监和质量总监审核,总经理批准。
执行:各级生产质量管理人员及操作人员。
4.产品名称及剂型4.1.产品通用名称:注射用硫酸庆大霉素汉语拼音 Zhusheyong Liusuan Qingdameisu商品名:英文名称:Gentamycin Sulfate for Injection4.2. 剂型:冻干注射剂5.产品概述5.1成份本品主要成分为硫酸庆大霉素,为一种多组分抗生素,含C1、C1a、C2a、C2等组分。
5.2.性状本品为白色或类白色的块状物或粉末;无臭;有引湿性。
5.3.规格(1) 80mg(8万单位) (2) 120mg(12万单位) (3) 160mg(16万单位) 5.4.贮藏密闭,在干燥处保存。
浅析注射剂生产质量的关键控制点

浅析注射剂生产质量的关键控制点摘要:注射剂作为医疗体系的重要组成,其在临床中的应用,能够有效患者的相关病症,提升人体对药物吸收速率,增强治疗成效。
为更好地发挥注射剂的临床价值,规避注射剂质量问题的出现,越来越多的医药生产企业,积极转变管理思路,在强调注射剂生产速率的同时,逐步强化生产质量的把控能力,形成完备的注射剂生产机制。
基于这种现状,文章着眼于注射剂生产的相关环节,重点把握生产质量控制的关键节点,旨在形成完善的生产质量控制体系,为后续生产、管理活动的开展提供参考。
关键词:注射剂;生产质量;质量管理;关键节点;控制举措前言注射剂作为医学用药方式,其能够通过注射等方式,快速进入患者体内,从而确保药物快速发挥功效,并且排除人体PH值、各类蛋白酶等因素的影响。
但是从生产角度来看,注射剂生产流程较为复杂,安全性以及适应性相对较低,因此有着较高的生产成本。
为保证注射剂的生产效率,提高合格率,排除相关因素对于注射剂生产活动的干扰,相关医药生产企业,尝试做好注射剂的质量管控工作,在确保注射剂临床安全性、稳定性的同时,管控生产成本支出,避免额外费用的产生。
1.注射剂概述对注射剂特点与技术要求的梳理,有助于工作人员形成正确的观念认知,准确把握注射剂生产的相关要求,为后续生产质量控制关键举措的研究与探讨创造了条件,进一步强化注射剂生产质量控制的效能。
注射剂作为一种溶液,其主要由无菌溶液以及药物成分构成,通过皮下注射等多种方式,快速进入人体,是目前主流的用药方式,很好地满足临床用药需求。
与传统的用药方式相比,注射剂表现出药效好、实用性高以及容易储存等特点,具体来看,注射剂的药效较为可靠,其通过注射,能够通过血液循环等方式,进入到人体内的相关组织、器官之中,因此注射剂的见效快,在较短的时间内,药效显现较为明显,尤其是注射剂不需要通过人体的胃肠道进行吸收,因此可以排除胃液、消化酶的影响,用药的剂量较为准确,不会出现用药过大或者过小的情况。
硫酸庆大霉素注射液(半成品)内控质量标准

GMP管理文件
一.目的:制定硫酸庆大霉素注射液内控质量标准,规范公司硫酸庆大霉素注射液的生产过程。
二.适用范围:适用于硫酸庆大霉素注射液的生产和质检。
三.责任者:生产部经理、质管部经理、检验员
四.正文:
硫酸庆大霉素注射液
本品为硫酸庆大霉素的灭菌水溶液。
含庆大霉素应为标示量的92.0%~108.0%。
【性状】本品为无色或几乎无色的澄明液体。
【鉴别】(1)取本品约5mg,加水1ml溶解后,加0.1%茚三酮的水饱和正丁醇溶液1ml与吡啶0.5ml,在水浴中加热5分钟,即显紫蓝色。
(2)取本品与庆大霉素标准品,分别加水制成每1ml中含20mg的溶液,照薄层色谱法试验,吸取上述两种溶液各2ul,分别点于同一硅胶G薄层板(临用前于105℃活化2小时)上;另取三氯甲烷-甲醇-浓氨溶液(1:1:1)混合振摇,放置1小时,分取下层混合液为展
开剂,展开,取出于20~25℃晾干,置碘蒸气中显色,供试品溶液所显主斑点数、位置和颜色应与标准品溶液斑点数、位置和颜色相同。
(3)本品的水溶液显硫酸盐的鉴别反应。
【检查】PH值应为3.5~6.0 。
颜色本品应无色;如显色,与黄色或黄绿色2号标准比色液比较,不得更深。
其他应符合注射剂项下有关的各项规定。
【含量测定】精密量取本品适量,精密称取本品适量,用灭菌水定量稀释制成每1ml中约含1000单位的溶液,照抗生素微生物检定法测定。
可信限虑不得
大于7%。
1000庆大霉素单位相当于1mg的庆大霉素。
即得。
【类别】氨基糖苷类抗生素。
中国药典2000版二部:硫酸庆大霉素注射液

药品名称硫酸庆⼤霉素注射液拼⾳名 Liusuan Qingdameisu Zhusheye英⽂名 GENTAMYCIN SULFATE INJECTION来源(分⼦式)与标准本品为硫酸庆⼤霉素的灭菌⽔溶液。
含庆⼤霉素应为标⽰量的90.0~110.0 %。
性状 本品为⽆⾊或⼏乎⽆⾊的澄明液体。
检查 pH值 应为3.5 ~6.0 (附录Ⅵ H)。
溶液的颜⾊ 本品应⽆⾊;如显⾊,与黄⾊或黄绿⾊2 号标准⽐⾊液(附录Ⅸ A第⼀法)⽐较,不得更深。
⽆菌 取本品不少于2 ⽀,分别加灭菌⽔制成每1ml 中约含20 000单位的溶液,⽤薄膜过滤法处理后,依法检查(附录Ⅺ H),应符合规定。
异常毒性、热原与降压物质 取本品,照硫酸庆⼤霉素项下的⽅法检查,均应符合规定。
其他 应符合注射剂项下有关的各项规定(附录Ⅰ B)。
庆⼤霉素C组分测定⽤微量注射器精密量取本品适量(约相当于硫酸庆⼤霉素 2.5mg ),置10ml量瓶中,加⽔4ml ,照硫酸庆⼤霉素项下的⽅法,⾃“加异丙醇2ml ”起,依法测定各C 组分的百分含量C1应为25~50%,C1a 应为15~40%,C2a +C2应为20~50%。
鉴别 取本品,照硫酸庆⼤霉素项下的鉴别试验,显相同的结果。
含量测定 精密量取本品适量,照硫酸庆⼤霉素项下的⽅法测定。
类别同硫酸庆⼤霉素。
剂量肌内注射或稀释后静脉滴注 ⼀次80mg(8 万单位)⼀⽇2 ~3 次间隔8 ⼩时。
⼩⼉每⽇每公⽄体重3 ~5mg (3000~5000单位),分2 ~3 次给药。
注意长期或超量应⽤可引起⽿、肾毒性,肾功能不全者慎⽤。
有抑制呼吸作⽤,不可静脉推注。
规格 (1) 1ml:2 万单位 (2) 1ml:4 万单位 (3) 2ml:8 万单位贮藏密闭,在凉暗处保存。
硫酸庆大霉素生产工艺流程图

硫酸庆大霉素生产工艺一、硫酸庆大霉素产品说明 1、产品名称及化学结构1。
1产品名称:硫酸庆大霉素(Gentamycin sulfate ) 1.2化学结构: 1。
2.1结构式:·2H 2SO 4C 1: R 1=R 2=CH 3C 2: R 1=CH 3 R 2=H C 1a : R 1=R 2=H 1.2.2分子式:C 1: C 21H 43N 5O 7=477。
61 C 2: C 20H 41N 5O 7=463。
58 C 3: C 19H 39N 5O 7=449.55 1.2。
3分子量: C 1: 477.61 C 2: 463。
58 C 3: 449。
55C 1、C 2、C 1a 为硫酸庆大霉素的三个组分,各组分与2个分子的硫酸相结合,其成分折干效价为590µ/ml 以上。
2、理化性质2.1性状:白色或类白色粉末,吸水性强,稳定性高,易溶于水,不溶于乙醇、丙酮、氯仿等有机溶剂。
2。
2比旋度:+1070~ +12103、产品质量标准 (查药典)二、原材料、包装材料质量标准及规格1、发酵部分 OO N HR1R2NH 2OOO HN HOH CH 3N H 2OH N H 32、提取部分三、生产方法及原理简介硫酸庆大霉素的生产是以绛红色小单孢菌()2号作为庆大霉素生产用菌种,在蒸汽消毒的培养基中不断扩大培养、发酵,通过菌种的次级代谢分泌出具有抑菌活性的庆大霉素。
用离子交换树脂提取出菌分泌的活性物质,经精制、转盐生产出硫酸庆大霉素原料药。
用以制成各种硫酸庆大霉素制剂,应用于临床治疗。
四、硫酸庆大霉素生产工艺流程图及操作条件硫酸庆大霉素的生产过程主要包括以下四个部分:发酵生产、提取、精制、无菌压缩空气、无菌喷雾干燥.1、硫酸庆大霉素生产工艺流程图:35℃23hr 35℃35℃35℃种子瓶一级种子罐二级种子罐发酵罐250rpm 38hr 22hr 96hr酸化 6 hr放罐732树脂静态吸附过筛饱和树脂漂洗中和漂去酸洗 4.5%氨水无NH4+ 效价装柱解吸浓缩浓缩液浓缩液杂质无盐水洗串711柱15万μ/ml收率95%收率93%H2SO4活性炭转盐液脱色液过滤精滤无菌喷粉PH=4。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
工序
质量控制点
质量控制项目
频次
制水
纯化水
电导率
1次/2h
《中国药典》全项
1次/周
注射用水
pH值、氯化物、氨盐
1次/2h
《中国药典》全项
1次/周
理瓶
原包装安瓿
检验报告单、清洁度
定时/班
洗瓶
隧道烘箱
温度
定时/班
洗净后安瓿清ຫໍສະໝຸດ 度定时/班烘干后安瓿
清洁与干燥程度
定时/班
灯检
灯检品
抽查可见异物
定时/班
包装
在包装品
每盘标记、灯检者代号
每盘
印字
批号、内容、字迹
随时/班
装盒
数量、说明书、标签
随时/班
标签
内容、数量、使用记录
每批
装箱
数量、装箱单、印刷内容、装箱者代号
每箱
配液
药液
批号划分与编制、主药含量、PH值、可见异物、色泽、过滤器材的检查(如起泡点等)
每批
灌封
烘干安瓿
清洁度
随时/班
药液
色泽
随时/班
可见异物
随时/班
封口
长度、外观
随时/班
灌封后半成品
药液装量、可见异物
随时/班
灭菌
灭菌柜
标记、装量、温度、时间、记录、真空度
每锅
灭菌前后半成品
外观清洁度、标记、存放区
每批
