钠和钠的化合物(知识点齐全)
几种重要的金属化合物钠和钠的化合物

白色固体 -2价 价 常温 不稳定
Na2O+H2O=2NaOH Na2O+CO2=Na2CO3
生成条件 稳定性 与水反应 与CO2反应 特性 用途
— —
强氧化性、 强氧化性、漂白性 供氧剂、 供氧剂、漂白剂
三 碳酸钠和碳酸氢钠 俗 名
Na2CO3 俗 名 纯碱或苏打 NaHCO3 小苏打 —— 结晶水合物 Na2CO3.10H2O
碳酸钠和碳酸氢钠的相互转变
2NaHCO3 = Na2CO3 + H2O + CO2
固体
△
NaHCO3 + NaOH = Na2CO3 + CO2 + H2O = 2NaHCO3
溶液
Na2CO3
正盐
CO2 + H2O 加OH—或△
NaHCO3
酸式盐
表2:碳酸钠与碳酸氢钠的比较 :
碳酸钠 化学式 式量 俗名 颜色状态 水溶性 与酸反应 热稳定性 用途 碳酸氢钠
Na2CO3 106 纯碱、 纯碱、苏打 白色粉末
(250C溶解度为 克) 溶解度为33克 溶解度为
NaHCO3 84 小苏打 细小白色晶体
(250C溶解度为 克) 溶解度为9克 溶解度为
Na2CO3+2HCl=2NaCl+H2O+CO2 ↑ NaHCO3+HCl=NaCl+H2O+CO2 ↑
NaHCO3
白色粉未,加水部分溶 白色粉未 加水部分溶 解,感受不到热量变化
仍有固体残留 溶液变微红色
加水部分溶解, 加水部分溶解,溶液 的碱性比Na 的碱性比 2CO3弱
溶液变红色
加水先变成含结晶 水的晶体, 水的晶体,溶液的 碱性比NaHCO3强 碱性比
钠和钠的化合物

年级高一学科化学编稿老师计志坚课程标题钠和钠的化合物一校林卉二校张琦锋审核张美玲考纲解读考点展示1. 掌握钠及其化合物的性质2. 以碱金属为例,掌握同一主族内元素性质的变化规律与原子结构的关系1. 从原子的核外电子排布,理解IA族元素(单质、化合物)的相似性和递变性。
2. 以氢氧化钠为例,了解重要的碱的性质和用途。
了解钠的重要化合物,如Na2CO3和NaHCO3的性质、转化及制法。
3. 以Na2O2为例,理解过氧化物的性质。
4. 焰色反应的概念及钾、钠化合物的检验。
二、重难点提示重点:1. 金属(钠)在元素周期表中的位置及其性质递变规律;2. 钠及其化合物的主要性质和应用。
难点:1. 钠及其化合物的性质和应用;2. 钠、Na2O2、Na2CO3、NaHCO3的有关计算;3. 重要讨论方法:端值法;计算方法:平均值法、混合物计算的假设法等;4. 涉及Na2CO3、NaHCO3的反应及有关图象问题的分析。
1. 思维导图2. Na2O2与Na2O的比较高考热点:1. 以钠与O2等非金属单质反应、钠的化合物与H2O、CO2等物质反应为背景材料,考查钠及其化合物的性质和有关计算。
2. 以钠及其化合物与H2O、CO2等物质反应,饱和食盐水的电解等知识的实验题。
能力提升类例1一定温度下,向饱和NaOH溶液中加入一定量的钠块,充分反应后恢复到原温度,下列说法正确的是()A. 溶液中溶质质量增加,溶剂量减少,溶液中溶质质量分数变大B. 溶液的pH不变,有氢气放出C. 溶液中Na+数目减小,有氢气放出D. 溶液中c(Na+)增大,有氢气放出一点通:钠放于饱和NaOH溶液中,与水反应生成NaOH和H2,由于原来是饱和溶液,且温度不变,消耗了水,生成了NaOH,故有NaOH晶体析出,而溶液的浓度不变。
答案:BC例2在一定条件下,将钠与氧气反应的生成物2.8 g溶于水,所得溶液恰好能被80 mL 浓度为1.0 mol/L的HCl溶液中和,则生成物的成分是()A. Na2OB. Na2O2C. Na2O和Na2O2D. Na2O2和NaO2一点通:盐酸的物质的量为0.08 mol,由HCl~NaOH~Na,知Na的物质的量也等于0.08 mol,若生成物是Na2O,质量为2.48 g,若生成物是Na2O2,质量为3.12 g,现在2.48 g<2.8 g<3.12 g,则生成物为两者的混合物。
人教版高中化学必修一第6讲:钠及其化合物(教师版)

钠及其化合物__________________________________________________________________________________ __________________________________________________________________________________1.钠的性质;2.钠的重要化合物及其相互转化。
知识点一.钠1.钠的原子结构特点:Na 的原子结构示意图: 。
Na 最外层只有1个电子,因此Na 很容易失去1个电子,具有很强的还原性,是强还原剂,具有金属的通性。
由于钠的活泼性很强,在表现金属通性的同时,又有其特殊之处。
2.钠的化学性质:(1)与氧气反应:(2)与非金属反应:钠除了能跟氧气直接化合外,还能与很多非金属直接化合。
如与硫化合剧烈反应,发生爆炸,生成Na2S。
2Na + Cl2 2 NaCl 2Na + S Na2S(3)与水、酸、盐的反应:①.钠与水(滴有酚酞)反应的实验现象与结论。
3.钠元素的存在:由于钠的强还原性,在自然界中不会以游离态存在,全部以化合态(钠盐)存在。
4.钠的存放和取用。
由于钠极易被氧化,也易与水发生反应,所以保存钠应隔绝空气和水,钠应保存于石蜡油或煤油中。
取用时一般先用镊子把钠从煤油中夹出来,并用滤纸把表面的煤油吸干,然后用小刀切下黄豆粒大小的一块再做有关实验。
知识点二. 钠的化合物1.钠的氧化物知识点三.焰色反应1.焰色反应:很多金属或它们的化合物在灼烧时都会使火焰呈特殊的颜色,在化学上称为焰色反应(发生的是物理变化)。
2.铂丝的清洗与灼烧如下图甲所示,观察钾的焰色如下图乙所示。
3.操作方法。
(1)洗:用稀盐酸洗净铂丝,目的是使铂丝上的高沸点杂质转化为沸点相对较低的氯化物。
(2)烧:将用盐酸洗涤过的铂丝在火焰上灼烧,目的是除去铂丝上的杂质。
注意:①所用的火焰应是无色或浅色的;②要一直烧至火焰恢复到原来的无色或浅色为止。
钠和钠的化合物典班ppt课件.ppt
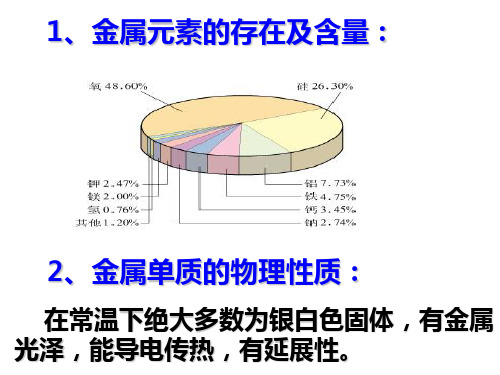
1、金属元素的存在及含量:
2、金属单质的物理性质:
在常温下绝大多数为银白色固体,有金属 光泽,能导电传热,有延展性。
K
认识到了贫困户贫困的根本原因,才 能开始 对症下 药,然 后药到 病除。 近年来 国家对 扶贫工 作高度 重视, 已经展 开了“ 精准扶 贫”项 目
钠和钠的化合物
认识到了贫困户贫困的根本原因,才 能开始 对症下 药,然 后药到 病除。 近年来 国家对 扶贫工 作高度 重视, 已经展 开了“ 精准扶 贫”项 目
一、钠的物理性质
银白软轻低 热电良导体
注意:取用一小块钠后剩余的钠必须放回 原瓶!!
认识到了贫困户贫困的根本原因,才 能开始 对症下 药,然 后药到 病除。 近年来 国家对 扶贫工 作高度 重视, 已经展 开了“ 精准扶 贫”项 目
认识到了贫困户贫困的根本原因,才 能开始 对症下 药,然 后药到 病除。 近年来 国家对 扶贫工 作高度 重视, 已经展 开了“ 精准扶 贫”项 目
溶解性的应用:
工业制纯碱的方法—候德榜制碱法:
1.基本原理:利用NaHCO3在常见可溶盐中溶解度
较小的特点。先制得NaHCO3,再加热分解制得
Na2CO3。 2.基本步骤:制得饱和食盐水
金属钠的切割方法:
滤纸吸干煤油—镊子夹取--小刀在玻璃片 或表面皿上切割。
认识到了贫困户贫困的根本原因,才 能开始 对症下 药,然 后药到 病除。 近年来 国家对 扶贫工 作高度 重视, 已经展 开了“ 精准扶 贫”项 目
药品保存问题:
1.根据药品的性质选择是否密闭。 2.瓶的选择:广口瓶、细口瓶,是否棕色瓶 3.塞的选择:胶塞、玻璃塞等 4.特殊物质的保存方法:液溴、白磷、碱液、 氢氟酸、浓硝酸等
(完整版)钠及其重要化合物知识点总结

钠及其重要化合物知识点总结一.金属钠1.钠的物理性质金属钠是一种柔软,银白色、有金属光泽的金属,是热和电的良导体;它的密度为0.97g/cm3,比水的密度小,比煤油的密度大,熔点为97.81℃、沸点为882.9℃。
2.钠的化学性质钠原子最外层只有一个电子,在化学反应中钠原子容易失去最外层的一个电子,具有很强的还原性,是一种活泼的金属元素。
(1)跟非金属反应:①金属钠放置在空气中,会迅速被氧化而生成氧化钠:4Na+O2=2Na2O,(空气中钠的切面变暗)②在空气(或氧气)中燃烧:2Na+O2Na2O2(黄色火焰),以上反应说明Na2O2比Na2O稳定。
可见,与O2反应时因条件不同而产物不同。
③在氯气中燃烧:2Na+Cl2NaCl(白烟)(2)钠与水反应:2Na+2H2O =2NaOH +H2↑现象:①浮:钠投入水中并浮在水面上②声:钠立即跟水反应,并放出热量,发出嘶嘶响声,产生气体。
③游:同时钠熔成一个闪亮的小球并在水面上向各方迅速游动最后消失,④红:反应后的水溶液使酚酞变红。
(3)钠与酸反应:钠与酸的反应比水反应更激烈,极易爆炸。
(4)钠与盐溶液反应:先考虑钠与水反应生成NaOH,再考虑NaOH是否与盐反应。
例如:①钠与CuSO4溶液反应2Na+2H2O=NaOH+H2↑ (1)CuSO4+2NaOH=Na2SO4+Cu(OH)2 (2)合并(1)(2)得:2Na+2H2O+CuSO4=Na2SO4 +Cu(OH)2↓+H2↑②钠与FeCl3溶液反应:6Na+6H2O+2FeCl3=6NaCl+2Fe(OH)3↓+3H2↑3.钠的存放和取用由于金属钠的化学性质非常活泼,易与空气中的O2、H2O等反应,所以少量金属钠可保存在煤油里,大量的金属钠则存在铁筒中用石蜡密封。
取用时一般先用镊子把钠从煤油中夹出来,并用滤纸把表面的煤油吸干,然后用小刀切下绿豆大小的一块再做有关实验。
4.钠的存在与用途自然界中钠只能以化合态的形态存在,主要以氯化钠的形式存在。
钠及其化合物(知识点总结归纳+典例导析)

2Na + Cl 22 NaCl 2Na + S Na 2S 钠及其化合物【学习目标】1、钠的性质;2、钠的重要化合物及其相互转化。
【要点梳理】学问点一、钠1. 钠的原子构造特点:Na 的原子构造示意图: 。
Na 最外层只有 1 个电子,因此Na 很简洁失去 1 个电子,具有很强 的复原性,是强复原剂,具有金属的通性。
由于钠的活泼性很强,在表现金属通性的同时,又有其特别之处。
2.钠的化学性质:(1) 与氧气反响:试验操作步骤 试验现象 试验结论及反响的化学方程式用小刀切取一小块金属钠 银白色光亮切面 钠是银白色质软的金属放置片刻 光亮切面变暗 常温下钠极易与氧反响 4Na+O 2==2Na 2O钠先熔化,后猛烈燃烧,黄 钠极易燃烧,产物是过氧化钠,放在坩埚中加热 色火焰,生成淡黄色固体 2Na+O △Na 2O 2特别提示:①钠保存在石蜡油或煤油里,以隔绝空气。
②钠的取用:用镊子夹取一块钠,用滤纸吸干煤油,用小刀切取黄豆粒大小的钠,剩余局部放回原瓶。
③将一小块钠久置在空气中的变化是:Na −O −2→ Na O −H −2O −→ NaOH 〔固体〕−H −2O −→ NaOH 〔溶液〕−C −O 2−→ Na CO ·10H O −风−化−→ Na CO 。
2(2) 与非金属反响:2 3 2 2 3钠除了能跟氧气直接化合外,还能与很多非金属直接化合。
如与硫化合猛烈反响,发生爆炸,生成 Na 2S 。
(3) 与水、酸、盐的反响:①.钠与水〔滴有酚酞〕反响的试验现象与结论。
试验现象 试验结论 浮:钠浮在水面上 钠的密度比水小熔:马上熔化成一个闪亮的小球 钠的熔点低,钠与水反响放热游、响:钠球在水面上四处游动,发出嘶嘶的响声,最终完全消逝 钠与水反响猛烈,产生气体红:反响后溶液由无色变为红色 钠与水反响生成可溶性碱〔NaOH 〕要点诠释:Na 与H 2O 反响实质:钠与水微弱电离出的氢离子发生电子转移,可表示如下:②.金属钠与酸溶液反响时应先考虑钠与酸的反响,然后再考虑钠与水的反响。
(完整版)钠知识点

一.金属钠1.钠的物理性质金属钠是一种柔软,银白色、有金属光泽的金属,是热和电的良导体;它的密度为0.97g /cm3,比水的密度小,比煤油的密度大,熔点为97.81℃、沸点为882.9℃。
2.钠的化学性质钠原子最外层只有一个电子,在化学反应中钠原子容易失去最外层的一个电子,具有很强的还原性,是一种活泼的金属元素。
(1)跟非金属反应:①金属钠放置在空气中,会迅速被氧化而生成氧化钠:4Na+O2=2Na2O,(空气中钠的切面变暗)②在空气(或氧气)中燃烧:2Na+O2Na2O2(黄色火焰),以上反应说明Na2O2比Na2O 稳定。
可见,与O2反应时因条件不同而产物不同。
③在氯气中燃烧:2Na+Cl2NaCl(白烟)(2)钠与水反应:2Na+2H2O =2NaOH +H2↑现象:①浮:钠投入水中并浮在水面上②声:钠立即跟水反应,并放出热量,发出嘶嘶响声,产生气体。
③游:同时钠熔成一个闪亮的小球并在水面上向各方迅速游动最后消失④红:反应后的水溶液使酚酞变红。
(3)钠与酸反应:钠与酸的反应比水反应更激烈,极易爆炸。
(4)钠与盐溶液反应:先考虑钠与水反应生成NaOH,再考虑NaOH是否与盐反应。
例如:①钠与CuSO4溶液反应2Na+2H2O=NaOH+H2↑ (1)CuSO4+2NaOH=Na2SO4+Cu(OH)2(2)合并(1)(2)得:2Na+2H2O+CuSO4=Na2SO4 +Cu(OH)2↓+H2↑②钠与FeCl3溶液反应:6Na+6H2O+2FeCl3=6NaCl+2Fe(OH)3↓+3H2↑3.钠的存放和取用由于金属钠的化学性质非常活泼,易与空气中的O2、H2O等反应,所以少量金属钠可保存在煤油里,大量的金属钠则存在铁筒中用石蜡密封。
取用时一般先用镊子把钠从煤油中夹出来,并用滤纸把表面的煤油吸干,然后用小刀切下绿豆大小的一块再做有关实验。
4.钠的存在与用途自然界中钠只能以化合态的形态存在,主要以氯化钠的形式存在。
常见金属元素(一):钠和钠的化合物
钠
Na
Na+
钠与非金属的反应
氧钠的氧化
与硫反应
2Na+S=Na2S
所以实验室通常将钠保存在煤油里。
实际也是以水合离子的形态存在的,
要用
钠的主要用途
•制过氧化物
•钠、钾合金做原子反应堆的导热剂
钠钾合金做原子反应堆的导热剂
•制取钛、锆、铌、钽等金属
例如:
例如
高温
Na+TiCl4(熔融)4NaCl+Ti
•制高压钠灯
】某研究性学习小组拟用如图装置进行实验,以证
】⑶第2小组同学认为Na2O2与SO2反应除了生成Na2SO3和O2外,还有Na2SO4生成。
为检验是
外有生成为验否有Na2SO4生成,他们设计了如下方案:
将装置中反应后的固体溶解于水—BaCl2溶液
B Cl
→白色沉淀—稀HNO3溶液→仍有部分白色沉
淀不溶解,证明有Na2SO4上述方案是否合理?
淀不溶解证明有
________________。
请简要说明两点理由:
①____________________________________
②____________________________________
____________________________________。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
m=28*n(CO)+2*n(H2) (3)一氧化碳、二氧化碳、氢气和水蒸气与足量过氧
化钠反应 m=28*n(CO+CO2)+2*n(H2+H2O)
随堂练习
1、200℃时,11.6g由二氧化碳和水蒸气组成的混合气体与 足量过氧化钠充分反应后,固体质量增加3.6g,则原混合气 体中二氧化碳和水蒸气的物质的量之比是多少?混合气体的 平均相对分子质量为多少?
HCOOCH3(甲酸甲酯)、C6H12O6(葡萄糖)等。
(5)先后顺序关系
一定量的Na2O2与一定量的CO2和H2O(g)的混合物的 反应,可视作Na2O2先与CO2反应,待CO2反应完成后 ,Na2O2再与H2O(g)发生反应。
PS: 过氧化钠固体增重的定量规律 (1)二氧化碳和水蒸气与足量过氧化钠反应
总结:钠与盐溶液发生反应时:先水后盐
Page 8
思考:在FeCl3溶液中加入钠单质有何现象? 2Na + 2H2O = 2NaOH + H2↑
FeCl3+3NaOH = Fe(OH)3↓+3NaCl
溶液中有气泡产生,同时生成红棕色沉淀
⑧钠的用途:
(1)液态的钠、钾合金用做原子反应堆的导热剂 (2)制过氧化物 (3)作还原剂制钛、锆、铌、钽等金属
强氧化剂、漂白剂、供氧剂
PS:
Na2O2与CO2、H2O的反应的几个重要关系 2CO2+2Na2O2===2Na2CO3+O2 2H2O+2Na2O2===4NaOH+O2↑ (1)物质的量的关系
无论是CO2或H2O的单一物质还是二者的混合物, 通过足量的Na2O2时,CO2或H2O与放出O2的物质 的量之比均为2∶1。
2CO2+2Na2O2===2Na2CO3+O2 2H2O+2Na2O2===4NaOH+O2↑ (2)气体体积关系 若CO2和水蒸气的混合气体(或单一气体)通过足量Na2O2,气体
体积的减少量等于原混合气体体积的 1/2 且等于生成氧气 的体积。 (3)电子转移关系 当Na2O2与CO2、H2O反应时,物质的量关系为2Na2O2~O2~2e-
2Na2O2+2H2O==4NaOH+O2 ↑
与CO2 反应
Na2O+CO2=Na2CO3
2Na2O2+2CO2==2Na2CO3+O2
与酸反应
稳定性
Na2O+2HCl=2NaCl+H2O
不稳定 2Na2O+O2===2Na2O2
2Na2O2+4HCl=4NaCl+O2↑+2H2O 稳定
制备NaOH
钠和钠的化合物
Page 1
Байду номын сангаас
一、钠
1.物理性质:银白色固体,质软,密度比煤油大,钠保存在煤油 中(Li :石蜡中;K:煤油中)
Page 2
2.化学性质: ①钠和氧气反应:
常温:生成白色的氧化钠
4Na + O2 === 2Na2O
Page 3
加热:熔化成银色的小球,黄色火焰,生成淡黄色固体过氧 化钠
2Na+2H2O=2NaOH+H2↑
PS:钠与硫酸氢钠溶液 2Na+2NaHSO4===2 Na2SO4+H2↑
总结:先酸后水
Page 7
⑥与碱反应
将钠放入碱液中的反应——钠与水的反应
⑦.与盐反应(钠和硫酸铜)
2Na+2H2O=2NaOH+H2↑ 2NaOH+CuSO4=Cu(OH)2↓+Na2SO4 总:2Na+2H2O+CuSO4=Cu(OH)2↓+Na2SO4 +H2↑
加热
2Na + O2 === Na2O2
加热
2Na2O + O2 === 2Na2O2
稳定性: Na2O2>Na2O
PS:四种淡黄色物质: AgBr、Na2O2、S 、Ag3(PO4)
Page 4
②与硫反应:
研磨/加热
2Na+S====Na2S
③与氯气反应
2Na+Cl2=点燃=2NaCl (冒白烟)
A.2.1 g C.7.2 g
B.3.6 g D.无法确定
四、碳酸钠和碳酸氢钠
纯碱、苏打
小苏打
白色粉末
细小白色晶体
易溶
Na2CO3>NaHCO3 易溶
Na2CO3+CaCl2=CaCO3 ↓+2NaCl
不反应
Na2CO3=不反应
2NaHCO3= Na2CO3+H2O+CO2↑
CO32-
HCO3-
4Na + TiCl4 = 4NaCl + Ti
(4)制高压钠灯(黄光的透雾能力强)
Page 10
三、氧化钠和过氧化钠
白色固体 碱性氧化物
淡黄色固体 过氧化物
Na+和O2-之比2:1
-2
4Na+O2==2Na2O
Na2O+H2O==2NaOH
Na+和O22-之比2:1
-1
加热
2Na+O2==Na2O2
2、取a g某物质在氧气中完全燃烧,将其产物跟足量的过氧化 钠固体完全反应,反应后固体的质量恰好也增加了a g。下列 物质中不能满足上述结果的是( )
A.H2 C.C6H12O6
B.CO D.C12H22O11
3、2.1 g平均相对分子质量为7.2的CO与H2组成的混合气体 在足量的O2中充分燃烧后,立即通入足量的Na2O2固体中, 固体的质量增加( )
+2H+=H反2O应+速C率O2:↑ Na2C+OH3<+=NHaH2OC+OC3O2↑
Na2CO3+NaOH
不反应NaHCO3+NaOH=Na2 CO +H O
Na2CO3和NaHCO3的相互转化
H2O+CO2或少量酸
Na2CO3 ①固体△ ②(aq).NaOH
④钠与水的反应
演示实验,观察现象
浮 熔 游、响 红
钠浮在水面上 立刻熔成一个小球 在水面上四处游动,
发出“嘶嘶声” 反应后溶液变红
密度比水小 反应放热,熔点低
产生气体 生成碱性物质
2Na+2H2O=2NaOH+H2↑
⑤钠与酸反应
将钠放入盐酸中会反应吗,生成什么物质?
如果钠过量2又Na会+生2H成Cl什=2么N物aC质l+?H2↑
2CO2+2Na2O2===2Na2CO3+O2
2H2O+2Na2O2===4NaOH+O2↑
(4)固体质量关系 相当于固体(Na2O2)只吸收了CO2中的“CO”,H2O中的“H2”;可以
看做发生相应的反应 Wg(CO)m(H2)n 型燃烧后通入Na2O2中,质量增加Wg 无机物:H2、CO及H2和CO的混合气体; 有机物:CH4O(甲醇)、CH2O(甲醛)、CH3COOH(乙酸)、
