小鼠灌注取脑
灌流取脑

大鼠灌注固定取脑准备物品:37℃的温生理盐水500ml、10%的中性甲醛或4%的多聚甲醛固定液500 ml、500 ml的输液瓶2个、输液管2副、三通1个,镊子、剪刀、止血钳各2把、灌注针(将12号注射用针头的针尖掐断磨钝圆、光滑即可)1个、麻醉剂、步骤1)将两个输液瓶中分别装满生理盐水和固定液并将输液管安装在生理盐水瓶上并调整好,使管内没有气泡。
2)将动物麻醉,数分钟后,待动物前后肢放松,即可准备灌注。
3)将已麻醉的动物仰卧在解剖台上,固定四肢,用左手持镊子夹起腹部皮肤,右手持剪刀自腹部剪一小口,由此沿腹中线和胸骨剑突中线向上将皮肤剪至下颌,分离皮下组织,将皮肤翻向两侧,再沿腹中线和胸骨中线向上剪开胸骨,沿膈肌向两侧剪开,并用止血钳将胸骨和胸部的皮肤钳紧,将止血钳翻向外侧以充分暴露心脏。
小心用镊子将心包打开,滴一些生理盐水保持湿润。
4)分离出主动脉,穿一根丝线,准备结扎灌针。
5)将左心室尖用眼科剪刀剪开一小口,将灌注针插入心室并送至主动脉内,用丝线结扎牢固,使之不能退出,打调节阀,灌注生理盐水,灌注时的灌流量约20 ml/分钟。
时,剪开右心耳,使血液排出。
观察肝脏逐渐变为白色为止6)旋转三通使之对准灌注液,开始灌注固定液。
固定液进大鼠血管后,逐渐出现四肢抽动,表明灌注液进入大鼠大脑,待抽动完全停止,全身组织器官变硬后即可取材。
7)取脑:枕骨大孔处用剪刀横断,小心地于枕骨大孔斜插入剪刀剪开顶骨,用止血钳掰断两边地顶骨,注意嗅球上地顶骨也要仔细去掉,用剪刀于一侧剪断视神经并探到颅底,就可以将整块的脑组织翘起。
取出的脑在同样固定液中4℃再固定4-6小时。
8)保存或切片注意事项: 1、将灌注针插入主动脉内是灌注固定的关键,也是难点。
首先准确找到主动脉,这是此步骤的要点。
可用温生理盐水将胸腔内的血液冲洗干净,用眼科镊子轻轻夹住心外膜(夹的越少越好,以免影响取材)将心脏向左上方提起,即可看清主动脉,又可使灌注针很容易地插入主动脉内。
小鼠缺血再灌注

小鼠缺血再灌注(实用版)目录1.小鼠缺血再灌注的背景和意义2.小鼠缺血再灌注的实验方法和操作步骤3.小鼠缺血再灌注的实验结果和分析4.小鼠缺血再灌注的结论和展望正文一、小鼠缺血再灌注的背景和意义小鼠缺血再灌注是指在小鼠体内某一部位发生缺血后,再通过灌注使其恢复血流。
这一过程在生物医学研究中具有重要意义,因为它可以模拟人类某些疾病的发生过程,如心肌梗死、脑卒中等。
通过研究小鼠缺血再灌注,可以深入了解缺血后再灌注对组织和器官的影响,为临床治疗提供理论依据。
二、小鼠缺血再灌注的实验方法和操作步骤1.实验动物选择:选用健康成年小鼠,分为实验组和对照组。
2.制备缺血模型:将实验组小鼠放入灌注装置中,通过调整灌注流量和时间,使小鼠某一部位(如心肌、脑组织等)发生缺血。
3.观察缺血程度:通过检测相关生理指标(如心率、血压、血氧饱和度等),评估小鼠缺血程度。
4.再灌注操作:在观察到缺血程度达到预设值后,恢复灌注流量,使缺血部位重新获得血流。
5.观察再灌注效果:通过检测生理指标,评估再灌注对小鼠的影响。
三、小鼠缺血再灌注的实验结果和分析实验结果显示,在缺血发生后,小鼠的心率、血压、血氧饱和度等指标会发生明显变化。
再灌注后,这些指标会逐渐恢复到正常水平。
但不同缺血时间和程度的小鼠,再灌注后的恢复情况有所不同。
通过对实验结果的分析,可以得出以下结论:1.缺血再灌注对小鼠的组织和器官具有一定的保护作用,能够减轻缺血带来的损伤。
2.缺血时间和程度的不同,再灌注的效果有所差异,提示再灌注治疗需要个体化。
四、小鼠缺血再灌注的结论和展望总之,小鼠缺血再灌注实验为研究缺血后再灌注的生物学效应提供了一个有效模型。
通过对这一模型的深入研究,可以为临床治疗缺血性疾病提供理论依据和技术支持。
小鼠脑缺血再灌注损伤药理实验研究技术路线图

Western blot 检测
Bax 、 Bcl-2 、
CytC
、
Caspase-9 、
Caspase-3 、
PARP-1 蛋白表达
小鼠脑缺血ቤተ መጻሕፍቲ ባይዱ灌注损伤药理实验研究技术路线图
ICR 小 鼠 (雄 ) 性 ) (xuxing
空白对照 组:假 手术组
局灶性脑缺血损 伤模型组
模型+阳 性药物 (×××)组
模型+ ×× ×( 高、 中、低剂量)组
连续给予受试药物 5天
线栓法复制大脑中动脉阻塞(MCAO)局灶性脑缺血损伤模型:缺血 2h,再灌注 24h(缺血前 1h 给药一次,再灌注后 12h 再给药一次) 依 Bederson 法进行神经功能缺陷评分
取缺血区脑组织检测
1、T TC 染色 法测 定 脑梗死 面积 2、干湿 重法 检测 脑 水肿程 度 3、 HE 染 色 法进 行组织病理 学观 察
1 、 分光 光 度法 检 测 Caspase-3 活性 2 、 原 位末 端 标 记 (TUNEL)法检测细 胞凋亡 3 、 免疫 荧 光法 测 定 Bax 、 Bcl-2 、 Caspase-3、Cyt C 阳 性细胞数目
小鼠缺血再灌注

小鼠缺血再灌注
小鼠缺血再灌注(I/R)是一种实验模型,用于研究组织缺血引起的损伤以及血液再灌注对损伤的影响。
这一模型通常用于心血管疾病、脑卒中、肝脏和肾脏等器官的研究。
操作步骤通常包括以下几个阶段:
1.缺血阶段:通过暂时封闭(结扎)或阻断(通过其他方法)血
管,以模拟组织缺血。
这可以在不同的器官中进行,比如通过
结扎冠状动脉来模拟心肌缺血,或者结扎肾动脉来模拟肾脏缺
血。
2.再灌注阶段:在一定时间后,重新开通或恢复血液供应,模拟
组织再灌注。
这一步骤旨在模拟血流的恢复,但在一些情况下,
再灌注本身也可能导致组织损伤。
3.取样和分析:小鼠通常在不同的时间点被处死,组织样本被取
出以进行各种生化、组织学和分子生物学分析,以评估缺血再
灌注对组织的影响。
小鼠缺血再灌注模型可以用于研究相关疾病的机制、开发治疗策略以及评估药物的疗效。
例如,这个模型可以用于研究心肌梗死、脑卒中、肾功能损伤等疾病。
在进行这种类型的实验时,需要确保符合伦理和动物福利的要求,并遵循实验室和国家的相关规定和指南。
研究人员应该采取适当的措施来减少动物的痛苦和苦恼。
取小鼠脑组织

取小鼠脑组织丁香园上面总结的方法,排版有点乱。
其实过程与大鼠近似,我的经验是:1. 材料准备;大剪刀、眼科剪、眼科镊、大镊子、滤纸、竹签等;2. 步骤:处死小鼠,取头颅;剪开皮肤,漏出颅骨;用大尖镊子夹住两侧眼眶,用眼科剪稍剪除颅骨中线;再用眼科镊夹住颅骨从内向外夹,从下向上逐步去除颅骨;当全脑露出时,再用眼科镊去除脑膜和血管;然后用竹签从嗅球处向下取出全脑,即可。
3. 注意事项:用力轻柔,否则容易弄破脑部;用剪刀剪颅骨时,一定要贴壁向上剪,否则容易剪破脑部;去除脑膜时,不能硬拉,否则容易弄破大脑;取出全脑时应把头顶朝下,用竹签轻轻取出,离桌面也不要太远、高;若留病理,建议一定要取完整无损的大脑。
做免疫组化的话,稍微麻烦一点儿,因为脑组织含水量多,要固定的好,就需要先灌注。
先麻醉小鼠剪开胸腔,找到心脏,从心尖入针,剪开右心耳先用生理盐水灌注直到从心耳流出来的水清亮了再改用固定液(一般是4%多聚甲醛)灌注至小鼠四肢僵硬小鼠只需要用注射器就行了,我做的25~35g的小鼠一般用50mLNS+30mL多聚甲醛。
具体步骤:常规麻醉小鼠,将其固定,用剪刀剪开胸部皮肤,暴露出皮下组织,剪开时注意钝性分离,以免误伤。
然后用镊子提起剑突,用剪刀剪开胸腔,剪断两侧肋骨,暴露整个胸腔,小心误伤肺及心脏、大血管。
用镊子撕开心包膜,暴露心脏,用眼科剪剪开右心耳,然后提起心尖将准备好的生理盐水注射器插入左心室,注射,注射时小心针头滑脱。
生理盐水灌流至肺和肝的颜色都变成灰白色即可。
然后用多聚甲醛灌流,针孔最好是同一个,多聚灌流时小鼠四肢会抽搐,待抽搐结束,小鼠僵硬即可。
取下小鼠,用剪刀在颈部离断头颅,用剪刀在小鼠头颅中间皮肤剪一刀,将两边皮肤向下翻用手捏住,暴露整个颅骨,用眼科剪从脊髓端插入椎孔,沿着颅正中线剪开颅骨,注意剪刀向上翘一些,以免误伤脑组织,剪开后用弯眼科镊分离颅骨,小心分离,直至暴露整个大脑,然后用弯镊伸入颅底离断颅底神经,就可以取出整个脑子了。
小鼠灌注取脑

成年小鼠心脏灌流及取脑组织步骤
实验步骤:
1、小鼠麻醉后立即将其用针头固定在泡沫板上(用针头插住四肢)。
用镊子扯起胸部皮肤,另一只手用剪刀剪开胸腔的皮肤和肋骨,暴露出心脏和肝脏。
2、将注射针头插入小鼠左心室,同时将小鼠肝脏减掉,以使血液流出。
灌注生理盐水,时间维持在1min(10~20ml)灌注液左右,血液排除后四肢、肝脏和舌头会变白。
3、待小鼠四肢、肝脏和舌头变白之后,用4%PFA灌流固定,当PFA 流至大脑处可能会使小鼠尾巴略有反射现象(有时可能没有),此时可将灌流速度下调,以使固定更加充分。
整个PFA灌流时间约为5min。
(固定原理:多聚甲醛可以使蛋白质交联)
4、将导管始端从PFA中拿出,待管中液体流尽后,将心脏上的针头拔下,如果固定的较好,可发现小鼠眼球呈现白色。
将托盘中的血液倒至废液桶内,并准备下一步的取脑操作。
取脑及脱水:
1、剪开头部皮肤,露出白色头盖骨。
将延髓上包被的软骨剪开,除去多余的结缔组织。
需要注意的时,眼睛要由剪刀剪下,不能够直接扯下来,因为眼睛后部连着视神经,如果扯的话有可能会损坏视交叉上核等其他脑部组织。
2、将头盖骨小心剥开,露出白色的脑部,在剥嗅球部位时要格外小心,必要的话可以先将嗅球前部的碎骨留着待进一步固定之后再去除。
3、将头盖骨剥开后,将脑下部连接的神经逐条剪短(可看到视神经交叉),待全部剪断后将脑整个剥离出来。
4、将剥离出来的脑浸泡在4%PFA中,过夜固定。
5、将PFA液换为30%蔗糖进行脱水(防止冷冻切片时形成冰晶和孔洞),初始脱水时脑会浮在蔗糖上面,待完全脱水后脑会沉底。
此时可将脑取出进行冷冻切片。
老鼠灌注取脑

有无影响?
答:固定时间过长蛋白多肽链都交连在一起了,抗原性就很弱 了,很可能没有阳性结果,抗原修复时一般的修复很难把抗原性恢复. 可能会有影响,但不会太大。固定时间长,抗原修复时间也要长一些。 4.灌注多长时间?灌注液多少?
看了很多经验,每个人的灌注液用量都不一样,灌注速度也能没 有很清楚的说法,灌注时间也不确定。我的总结为,还是看灌注成功 的标志。现将看到的比较详细的处理方法列出。灌注速度,大家比较 公认的是先快后慢。
灌注压过小,不利于灌注液在组织中的灌流,灌注压过大,会造成 毛细血管和器官组织的损害,不利于组织切片的观察。一般灌注生理 盐水时灌注压在 20 伏左右,快速灌流多聚甲醛时一般在 10 伏左右,待 大鼠四肢出现明显抽搐后,再缓慢灌流多聚甲醛 30 min,灌注压一般在 5 伏左右。
大鼠灌注取脑标准操作规程(SOP): 流程: 1)麻醉 2)开胸 3)心脏左心室穿针,剪开右心耳 4)生理盐水冲水 5)4%多基甲醛固定 6)取脑 7)保存或切片. 具体过程: 大鼠经深度麻醉后,固定于自制的手术木板上,置于解剖盘中,开胸暴 露并游离出心脏,经左心室插入灌流针并固定, 切开右心耳,先灌注冰 冻无菌生理盐水(4℃)XmL,直到肝和肺脏颜色转白及右心房流出液 澄清,后再灌注冰冻(4℃)4%多聚甲醛 XmL,断头取脑,多聚甲醛浸泡固 定 24 小时。 Tips: 1.多聚甲醛的配置:
简便方法:先配好 PBS,称好相应的多聚甲醛,37℃水浴或温箱 密封放置 2 天,就能全溶。若是很急,55℃水浴一天,期间不时震荡。 注意,4%的多聚甲醛需临用前配制,配制后需过滤去除小的杂质,避免 心脏灌流时造成栓塞影响灌流效果。 2.制作灌注装置,用两瓶塑料包装的输液瓶装灌注液。同时配好输液 器备用。 3.10%水合氯醛按 4mL/100g 的剂量腹腔注射麻醉动物。 4.沿两侧肋弓剪开皮肤,打开腹腔,用一血管钳夹持剑突并向上提拉, 用弯剪在膈肌与胸骨柄相连处剪一小口,造成人工气胸,然后向两侧 顺延,剪断膈肌及肋骨,夹持剑突的血管钳将剑突连带胸廓上翻固定, 充分暴露心脏,直视下穿刺针左心室心尖处,用血管钳固定。 5.快速滴注生理盐水(室温),同时剪开右心耳。约注入 100~150mL, 至流出液体血色较浅基本澄清,停止灌注。肝脏、眼珠、爪子迅速变 白是排出血液的有效观察指标。 6.继续用 4%多聚甲醛灌流 250ml 固定。 7.后固定:灌流后的脑组织置于 4%PFA 置 4 度冰箱内进行后固定, 时间>2h,过夜最好。 补充: 还有一种省时省剂的方法。 夹闭腹主动脉:只灌注上肢及头脑,固定的好又快,又省试剂。先灌 注生理盐水约 100ml,见到老鼠两前肢及两肺变白可改灌注多聚甲 醛。多聚甲醛用 100ml 以下即可。 灌注成功的标志:刚开始灌注时老鼠前肢剧烈抽动(下肢不抽动证明 腹主动脉夹闭完全);前肢及颈部僵硬;所灌注的脑组织白而硬。
电针对脑缺血再灌注小鼠脑组织NOX2gp91phox表达的影响

电针对脑缺血再灌注小鼠脑组织NOX2/gp91phox表达的影响曾超,陈静,刘文兵,李辉,王静,马睿杰(浙江中医药大学附属第三医院•浙江杭州310012)摘要目的:探讨电针对脑缺血再灌注(I/R)损伤后的神经保护机制,明确电针对脑损伤后氧化应激的抑制作用。
方法:采用小鼠大脑中动脉闭塞模型制备脑局灶性缺血1h再灌注3,24,48h模型。
每组又分为模型组、电针组、药物组、gp91phox基因敲除组(下文简称基因组),另设同时段假手术组。
以神经功能缺损评分和局灶脑血流(rCBF)变化为造模成功和效应指标,并RT-PCR检测NOX2/gp91phox基因在小鼠脑组织的表达情况,光泽精增强发光法检测NOX活性。
结果:①神经行为学评分:造模各组均有不同程度的缺损表现,再灌注即刻缺损情况较再灌注干预后严重,基因组灌注即刻评分明显低于模型组(P<0.05),与模型组比较,灌注后3、24、48h基因组、药物组、电针组神经行为学评分均明显降低(P<0.05)。
②rCBF:各造模组rCBF明显减少,灌注后3、24、48h各组rCBF均有增加,药物、电针组比模型组升高明显(P<0.05)。
③NOX活性:模型组各时相之间无明显差异,基因组NOX活性无明显表达(P<0.01),药物组、电针组比模型组的同时相均有明显下降(P<0.01),药物和电针组的组间比较无明显差异。
④NOX2/gp91phox基因表达:模型组各时相之间无明显差异,基因组无蛋白表达,与各组比较均有显著差异(P<0.01),药物组、电针组比模型组的同时相均有明显下降(P<0.01),药物组和电针组的组间比较无明显差异。
结论:通过与敲除gp91phox基因组的小鼠相比较,电针"百会""大椎"穴位可以通过抑制NOX2/gp91phox表达,达到抑制I/R后小鼠的氧化应激损伤效果,发挥保护脑组织的作用。
小鼠前脑缺血再灌注损伤模型海马CA1区的形态学观察

小 鼠前 脑缺血 6 n再灌注 2 0mi 4h
M o p o o ia h e v Uo fh p o a r h l gc l s r a n o i p c mp sg r s C r a i c t o e r i c e a r p r u i n o u y u A1 a e n mie wih f r b an i h mi e e f so s
weemme i e j t i n i l f r 1 0 m n i h mi.A tr2 e efs n r d a l i e e w t ma nt t 2 s e a f 4 h r r i ,mop oo i l h n e fh p a u i t y n cd h oae i c e p uo rh l c a g o i o mp s ga c s pc
Ab ta t Obetv Toetbi x e me t mo e o vlaig terme y frd n tr e r n fe o e ri sh mi sr c : jcie sa l h ae p f nM d Ifre au t h e d o e aue n u o satrfrban i e a s i n d c
(ru ) 6 n(ru ) 9 n(ru ,10mi go pE go p , n i lr t ru go pF . e o s d — go pB , 0mi go pC , 0mi go p D) 2 n(ru ) ru s mant e e go p( ru ) Th ue o t ad m mo
rp r s n Me o s Sx ymi r n o ydvd t xgo p : h m p rt ngo p( ru ,i h mi fr 0mi e ef i . uo t d it c we r d ml i e i os ru s s a o eai ru g o p A) s e a o n h e ea id n i o c 3
小鼠脑腔注射操作流程

小鼠脑腔注射操作流程
麻醉:首先,需要对小鼠进行麻醉。
这通常可以通过使用异氟烷气体麻醉,将小鼠放入预麻箱,调节高气流量和麻醉浓度(约4LPM, 5%),小鼠1分钟内进入深麻状态。
固定:麻醉后,将小鼠固定在立体定位仪上。
选择带有定位仪专用气体麻醉面罩的小鼠适配器,将小鼠的门齿扣置于适配器,轻压鼻梁,前后移动适配器,使左右两侧耳杆中心线与小鼠外耳道位于同一直线上,然后将左、右耳杆分别推入外耳道,调节两耳杆位置中心对称、且高度一致,螺丝锁紧固定耳杆。
定位:根据脑图谱,确定待注射脑区的位置参数,包含离 Bregma 和 Lambda 点的距离以及核团深度。
钻孔:在预定的注射位置处,用颅骨钻打开一个小孔。
小心地用颅骨钻在注射位点处轻磨颅骨,将颅骨慢慢打薄,当颅骨出现裂缝的时候,用医用注射器的针头小心挑破,防止损伤。
注射:使用微量注射器,将药物或其他试剂缓慢地注入到脑腔中。
将微量注射器的33 G钝针穿过预穿孔并进入视网膜下腔,直到感觉到轻度阻力的点为止。
恢复:注射完成后,将小鼠放回笼中,继续饲养并观察其状态。
小鼠MACO模型制备步骤

小鼠称重,腹腔注射5%水合氯醛0.07ml/10g麻醉,约5min后麻醉,持续时间2h(大小鼠一样即350μg/kg,在小鼠发生呼吸急促,快苏醒时,可适当追加麻药的量,一般情况是原剂量的10%~20%,现追加剂量为20%~30%)↓仰卧位固定,用碘酒颈部消毒,颈部正中切口(稍偏向手术侧),将小鼠移至解剖显微镜下,调节至合适视野,钝性分离颌下腺体,用小勾拉向一侧,将手术侧用枪头垫起,便于操作↓钝性分离左侧CCA,用活结结扎,可过血(注意:分离时先将动脉表面的鞘膜用镊子钝性分离,后取线结扎,避免损伤迷走神经、气管和颌下腺体背面的静脉窦,分离一个就用线结扎)↓游离出ECA,结扎ECA的远心端,在近心端做一个活结,可过血(便于暂时固定线拴,并在进线完成后结扎线拴);游离结扎ICA打活结,不过血↓拉紧颈总活结,不过血,用显微剪在ECA主干上剪一小口,将线拴沿切口插入ECA近心端至CCA内,拉紧结扎线(插入栓线时,栓线头端与ECA开口处垂直插入,便于进线)↓自远端剪断ECA,将线拴轻轻回拉后翻转一定角度,使ECA与ICA成钝角(翻转时,动作要轻,注意两支镊子间的配合)↓经CCA分叉处将线拴送至ICA后,松开ICA上的结扎线,将线拴缓慢推进(插入栓子时,可用镊子夹取颈外动脉段端,稍微向外侧牵拉,动作要轻,便于栓子进入颈内动脉;栓子假如进入翼腭动脉,将栓子轻轻回拉,用镊子将血管轻推向中心侧,辅助栓子进入颈内动脉,进线长度至颈总分叉处算起约9~10mm,插栓子时,控制小鼠麻醉,否则小鼠挣扎易使栓子脱出)↓扎紧栓线进线端,防止线拴脱出↓剪断外部多余的结扎线,将腺体归位,闭合创口,用棉签头部棉头滴加生理盐水保湿↓脑缺血1h后,缓慢拉出线拴(动作要轻柔,防止栓子脱落),结扎ECA,解开并移去CCA的结扎线,MCA可恢复血流,实现缺血后血流再灌注(拔栓子时,一定要保证小鼠在麻醉状态,否则小鼠在拔栓子时挣扎,易使结扎线脱出,造成出血或牵拉扯断血管出血)↓缝合皮肤,将鼠单笼放置复苏,注意术后保暖↓不定时观察小鼠状态,若出现死亡,马上解剖查找死亡原因↓24h后,对小鼠神经行为功能进行评估↓将小鼠麻醉灌流后取脑,放入-20℃冰箱冷冻约10min后取出切片。
小鼠前脑缺血灌注损伤模型海马CA1区的形态学观察

area
in mice with
experimental model for evaluating the effect of remedy for
after cerebral ischemia.reperfusion.
were randomly divided into six groups:sham operation
min后静推甘露醇。实验小鼠再灌注24 h后取脑,固定切片,HE染色,对照观察海马 CAl区细胞损伤程度,筛选脑缺血再灌注损伤形成变性神经元的合适缺血时间,为选取 合适的实验平台提供依据;观察缺血后脱水治疗对变性神经元形态的影响,评价模型用于 缺血再灌注后干预实验的可用性。 结果:两动脉阻断法建立小鼠前脑缺血再灌注损伤模型,再灌注时间定为24h,随缺
Methods:Sixty mice
group(A),
ischemia for 30 min(B),60 min(C),90 min(D),120 min(E)groups,mannitol treated group
(F).Mannitol
treated group was immediately
no
difference between group F and A(P average>0.05).
neurons
Compared with group A,the
C,D
denatured
rates of
hippocampal CAl
F is less
area
in groups B, average<
山西医科人学硕士学位论文
小鼠前脑缺血再灌注损伤模型海马CAl区的形态学观察
摘要
目的:探索以变性神经元为观察对象,适用于脑缺血再灌注后干预实验的动物模型。 方法:60只小鼠随机分为6组:假手术组(A组),缺血30
取小鼠脑组织完整版

取小鼠脑组织HEN system office room 【HEN16H-HENS2AHENS8Q8-HENH1688】丁香园上面总结的方法,排版有点乱。
其实过程与大鼠近似,我的经验是:1.?材料准备;大剪刀、眼科剪、眼科镊、大镊子、滤纸、竹签等;2.?步骤:处死小鼠,取头颅;剪开皮肤,漏出颅骨;用大尖镊子夹住两侧眼眶,用眼科剪稍剪除颅骨中线;再用眼科镊夹住颅骨从内向外夹,从下向上逐步去除颅骨;当全脑露出时,再用眼科镊去除脑膜和血管;然后用竹签从嗅球处向下取出全脑,即可。
3.?注意事项:用力轻柔,否则容易弄破脑部;用剪刀剪颅骨时,一定要贴壁向上剪,否则容易剪破脑部;去除脑膜时,不能硬拉,否则容易弄破大脑;取出全脑时应把头顶朝下,用竹签轻轻取出,离桌面也不要太远、高;若留病理,建议一定要取完整无损的大脑。
做免疫组化的话,稍微麻烦一点儿,因为脑组织含水量多,要固定的好,就需要先灌注。
先麻醉小鼠剪开胸腔,找到心脏,从心尖入针,剪开右心耳先用生理盐水灌注直到从心耳流出来的水清亮了再改用固定液(一般是4%多聚甲醛)灌注至小鼠四肢僵硬小鼠只需要用注射器就行了,我做的25~35g的小鼠一般用50mLNS+30mL多聚甲醛。
具体步骤:常规麻醉小鼠,将其固定,用剪刀剪开胸部皮肤,暴露出皮下组织,剪开时注意钝性分离,以免误伤。
然后用镊子提起剑突,用剪刀剪开胸腔,剪断两侧肋骨,暴露整个胸腔,小心误伤肺及心脏、大血管。
用镊子撕开心包膜,暴露心脏,用眼科剪剪开右心耳,然后提起心尖将准备好的生理盐水注射器插入左心室,注射,注射时小心针头滑脱。
生理盐水灌流至肺和肝的颜色都变成灰白色即可。
然后用多聚甲醛灌流,针孔最好是同一个,多聚灌流时小鼠四肢会抽搐,待抽搐结束,小鼠僵硬即可。
取下小鼠,用剪刀在颈部离断头颅,用剪刀在小鼠头颅中间皮肤剪一刀,将两边皮肤向下翻用手捏住,暴露整个颅骨,用眼科剪从脊髓端插入椎孔,沿着颅正中线剪开颅骨,注意剪刀向上翘一些,以免误伤脑组织,剪开后用弯眼科镊分离颅骨,小心分离,直至暴露整个大脑,然后用弯镊伸入颅底离断颅底神经,就可以取出整个脑子了。
银杏叶提取物对小鼠脑缺血再灌注(MCAO)神经细胞凋亡的影响

银杏叶提取物对小鼠脑缺血再灌注(MCAO)神经细胞凋亡的影响摘要用线栓法制备小鼠脑缺血再灌注模型后,随即机分为3组,即假手术正常组、缺血再灌注组、银杏叶提取物组。
用TTC和FJB染色来检测脑梗死体积和神经元凋亡情况。
7d后,与缺血再灌注组小鼠相比,可观察到银杏叶提取物组的小鼠的脑梗死体积减少,且神经行为学评分有一定的改善。
关键词:缺血再灌注;银杏叶提取物;细胞凋亡;缺血再灌注损伤即恢复缺血的组织或细胞的血流后,造成更严重的损伤。
在缺血再灌注损伤过程中,细胞凋亡参与其中[1]。
有研究表明,银杏叶提取物可以抑制细胞凋亡[2],降低脑缺血再灌注造成的脑损伤[3].材料与方法1.实验材料和方法1.1药品与试剂健康昆明小鼠由湖南期莱克景达实验动物有限公司提供,Fluoro-Jade B染液,TTC(2,3,5—氯化三苯基四氮唑)染液购自南京建成科技有限公司,银杏叶提取物购自Dr. Willmar Schwabe GmbH & Co.KG1.2 实验动物分组及给药方法分组:健康昆明小鼠60只,体质量为(28±5)g,雄性,随机分为3组。
即正常组、模型对照组、银杏叶提取物组(5ml/kg)。
进行神经行为学评分后分两部分:10只进行脑梗死体积的测定;10只进行FJB染色。
给药:造模2h后灌胃,灌胃量均为5ml/kg,2次/d,连续7d。
模型对照组给予等体积生理盐水。
1.3动物模型制备过程(1)制备鱼线:全长2cm的鱼线,在距一端0.7cm处做一标记(黑色),置于肝素盐水,备用。
(2)制备动物模型:在室温下,采用三溴乙醇和阿托品对小鼠进行腹腔麻醉。
用镊子剥离右侧颈总动脉(CCA)、颈外动脉(ECA)、颈内动脉(ICA)。
假手术正常组完成。
用弹性橡皮于CCA和 ECA主干的近心端阻断血流。
在ECA近ECA处用银针扎一小口,插入备用鱼线,至轻微阻力时停止,用手术线扎紧,固定鱼线。
脑缺血模型完成。
鱼线插入深度约0.7cm。
灌注取脑实验报告

一、实验目的1. 掌握动物解剖技术,熟悉小鼠心脏灌流及取脑的方法。
2. 了解脑组织在生理学、病理学等研究中的重要性。
3. 提高实验操作技能,培养严谨的科学态度。
二、实验原理灌注取脑实验是研究脑组织生理、生化及病理变化的重要方法。
通过心脏灌流,将生理盐水或特定试剂注入动物体内,达到清除脑组织中的血液、细胞等杂质,便于后续实验研究。
本实验采用小鼠作为实验动物,通过心脏灌流及取脑,获取脑组织样本。
三、实验材料1. 实验动物:成年小鼠2. 仪器:解剖显微镜、手术器械、灌流装置、剪刀、镊子、注射器、注射针、泡沫板、生理盐水、固定液等3. 药品:戊巴比妥钠、肾上腺素、生理盐水、固定液等四、实验步骤1. 麻醉:将小鼠放入戊巴比妥钠溶液中,待小鼠失去意识后,立即用针头固定在泡沫板上。
2. 解剖:扯起小鼠胸部皮肤,用剪刀剪开胸部肌肉,暴露心脏。
3. 心脏灌流:用注射针连接灌流装置,将生理盐水注入小鼠心脏,使血液流向脑部。
4. 取脑:待生理盐水灌流完成后,将小鼠头部朝下,用剪刀剪开颅骨,暴露脑组织。
5. 固定:将脑组织取出,放入固定液中固定,以便后续实验研究。
6. 清洗:将固定好的脑组织用生理盐水清洗,去除杂质。
7. 标本保存:将清洗后的脑组织放入装有固定液的容器中,密封保存。
五、实验结果与分析1. 实验结果:通过心脏灌流及取脑,成功获取了小鼠脑组织样本。
2. 结果分析:本次实验操作规范,脑组织样本质量良好,为后续实验研究提供了有力支持。
六、实验讨论1. 实验过程中,应注意操作规范,避免损伤脑组织。
2. 灌流速度不宜过快,以免损伤脑组织。
3. 固定液的选择对脑组织样本质量有重要影响,应选用合适的固定液。
4. 实验过程中,应注意动物福利,尽量避免动物痛苦。
七、实验总结本次实验成功进行了小鼠心脏灌流及取脑操作,掌握了动物解剖技术,为后续实验研究奠定了基础。
在实验过程中,我们应注重操作规范,确保实验结果的准确性。
同时,本次实验也使我们认识到动物福利的重要性,为今后实验研究提供了有益经验。
小鼠取材心脏灌流实验知识点

成年小鼠的灌流实验主要用于:(1)获得良好的形态学观察结果;(2)保存脑、肾、心脏和其他器官。
成年小鼠的灌流实验
实验原理
进行实验动物灌流是获得良好的形态学观察结果以及保存脑、肾、心脏和其他许多器官所必需的。
实验材料
小鼠
试剂/试剂盒
PBS
仪器/耗材
23-G针头注射管解剖器械
实验步骤
1. 一支针管吸满1×PBS,另一支吸4%PFA固定液(4℃),搁置待用。
2. 在袋中用CO2气体处死小鼠。
停止吸呼后,立刻背朝下放平小鼠,小心剖开胸腔防止过多出血,小心并迅速切开肋骨,剪去横隔膜,暴露心脏。
3. 小心将吸有1×PBS的针管刺入左心室,剖开右心室排液。
缓慢但持续将1×PBS灌入心脏(如灌流正常,血液丰富器官,如肝脏,脾脏和肾脏将转呈灰白色)。
4. 当多数血液已流出后,拨去1×PBS的针管将吸有4%PFA固定液的针管插入左心室同一进针处,以20 ml 固定液缓慢灌流小鼠。
5. 灌流后,剖下器官或组织,放入盛有4%PFA固定液的做好标记玻璃瓶中,于冰上保存。
展开
注意事项
对于未经训练的实验人员,初次进行灌流可能会失败,故建议首先用一些对照实验动物练习,以熟悉此过程。
小鼠pcr基因扩增及鼠灌注取脑操作

小鼠PCR基因鉴定一、取材:小鼠出生后3-4周,给小鼠打耳标,并依照雌雄分笼饲养,需要鉴定的小鼠剪尾部、脚趾或耳部边缘,放置好在印管中,并做好相应的标志,放置标本与标志混乱。
处理: (1)将A液一定量加入带有样本的印管中,在98℃孔板中煮1小时(2)取出印管后,再加入B液75 μl二、扩增1.反应体系 Mix 5μlH20 3μlPrimer1 0.5mlPrimer2 0.5ml2.加样先计算出所需总量,加入印管中,混合均匀,离心,摆放好单个PCR管,将上述混合液放入PCR仪,每管9 μl盖紧。
3.扩增打开PCR仪并设置好程序,将PCR管放入PCR仪,扩增,40多分钟可以完成。
4.保存扩增后,取出PCR管,放入冰中保存。
三、琼脂糖凝胶电泳1.制胶:电子天平称取计算后的琼脂糖,小心倒入干净的锥形瓶内(锥形瓶内保持干净)。
加入TAE缓冲液,盖上锡箔纸,加热。
取制胶模具、梳子,安装固定,保证不会漏胶。
戴上手套,取出锥形瓶,掀开锡箔纸,冷却3-4分钟,加入染色剂,贴着远梳子端的制胶模板壁缓慢倒入琼脂糖溶液,若有气泡。
室温放置凝固。
2.上样:胶凝固后,双手缓慢垂直地拔出梳子,避免破坏梳孔。
将胶板放上电泳槽,注意正负极变化,加入1×TAE缓冲液,从胶表面开始缓慢倒入,自然流向两边,然后依次对孔加入对应的DNA样品,剩余样品放入冰箱储存。
3.电泳:合上电泳槽,正负极对好,检查底部是否有气泡升起。
有气泡则电泳开始。
4.成像:观察是否出现条带,若出现条带,则停止电泳,打开凝胶成像系统,对结果进行比对、记录并拍照。
关闭系统,登记实验记录,取出胶并清洗仪器器材。
鼠灌注取脑1、麻醉:根据鼠的体型、重量适量注射麻醉剂,腹腔注射,用手套防止被鼠抓伤,虎口卡住颈部肌肉及其周围肌肉,注射药物时反推针筒活塞以防有空气,针头针刺入鼠腹腔注射药物后,并放回笼中,等待药物起效。
2、开胸:找到剑突,用弯剪在剑突附近把毛剪干净,露出表层皮肤,再沿肋弓朝两边剪开,注意深度,别剪到心脏,待心脏暴露出后,仔细剔除神经,剪掉心包膜,用镊子夹持剑突并将其连胸廓上翻固定,使心脏充分暴露。
小鼠脑定位注射
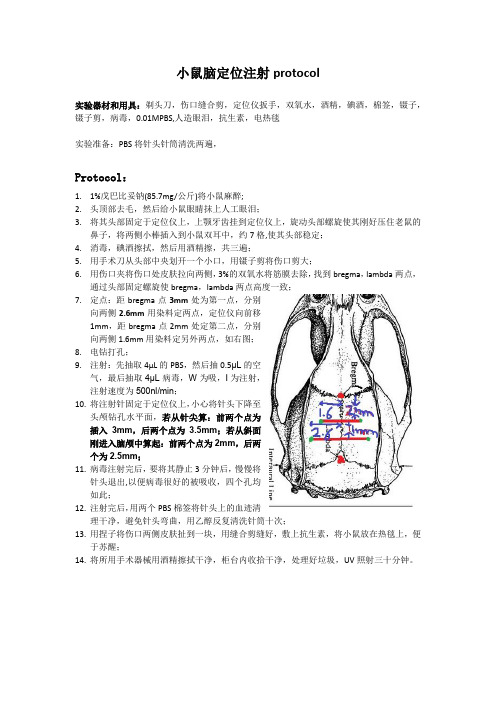
小鼠脑定位注射protocol实验器材和用具:剃头刀,伤口缝合剪,定位仪扳手,双氧水,酒精,碘酒,棉签,镊子,镊子剪,病毒,0.01MPBS,人造眼泪,抗生素,电热毯实验准备:PBS将针头针筒清洗两遍,Protocol:1.1%戊巴比妥钠(85.7mg/公斤)将小鼠麻醉;2.头顶部去毛,然后给小鼠眼睛抹上人工眼泪;3.将其头部固定于定位仪上,上颚牙齿挂到定位仪上,旋动头部螺旋使其刚好压住老鼠的鼻子,将两侧小棒插入到小鼠双耳中,约7格,使其头部稳定;4.消毒,碘酒擦拭,然后用酒精擦,共三遍;5.用手术刀从头部中央划开一个小口,用镊子剪将伤口剪大;6.用伤口夹将伤口处皮肤拉向两侧,3%的双氧水将筋膜去除,找到bregma,lambda两点,通过头部固定螺旋使bregma,lambda两点高度一致;7.定点:距bregma点3mm处为第一点,分别向两侧2.6mm用染料定两点,定位仪向前移1mm,距bregma点2mm处定第二点,分别向两侧1.6mm用染料定另外两点,如右图;8.电钻打孔;9.注射:先抽取4µL的PBS,然后抽0.5µL的空气,最后抽取4µL病毒,W为吸,I为注射,注射速度为500nl/min;10.将注射针固定于定位仪上,小心将针头下降至头颅钻孔水平面,若从针尖算:前两个点为插入3mm,后两个点为3.5mm;若从斜面刚进入脑颅中算起:前两个点为2mm,后两个为2.5mm;11.病毒注射完后,要将其静止3分钟后,慢慢将针头退出,以便病毒很好的被吸收,四个孔均如此;12.注射完后,用两个PBS棉签将针头上的血迹清理干净,避免针头弯曲,用乙醇反复清洗针筒十次;13.用捏子将伤口两侧皮肤扯到一块,用缝合剪缝好,敷上抗生素,将小鼠放在热毯上,便于苏醒;14.将所用手术器械用酒精擦拭干净,柜台内收拾干净,处理好垃圾,UV照射三十分钟。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
成年小鼠心脏灌流及取脑组织步骤
实验步骤:
1、小鼠麻醉后立即将其用针头固定在泡沫板上(用针头插住四肢)。
用镊子扯起胸部皮肤,另一只手用剪刀剪开胸腔的皮肤和肋骨,暴露出心脏和肝脏。
2、将注射针头插入小鼠左心室,同时将小鼠肝脏减掉,以使血液流出。
灌注生理盐水,时间维持在1min(10~20ml)灌注液左右,血液排除后四肢、肝脏和舌头会变白。
3、待小鼠四肢、肝脏和舌头变白之后,用4%PFA灌流固定,当PFA 流至大脑处可能会使小鼠尾巴略有反射现象(有时可能没有),此时可将灌流速度下调,以使固定更加充分。
整个PFA灌流时间约为5min。
(固定原理:多聚甲醛可以使蛋白质交联)
4、将导管始端从PFA中拿出,待管中液体流尽后,将心脏上的针头拔下,如果固定的较好,可发现小鼠眼球呈现白色。
将托盘中的血液倒至废液桶内,并准备下一步的取脑操作。
取脑及脱水:
1、剪开头部皮肤,露出白色头盖骨。
将延髓上包被的软骨剪开,除去多余的结缔组织。
需要注意的时,眼睛要由剪刀剪下,不能够直接扯下来,因为眼睛后部连着视神经,如果扯的话有可能会损坏视交叉上核等其他脑部组织。
2、将头盖骨小心剥开,露出白色的脑部,在剥嗅球部位时要格外小心,必要的话可以先将嗅球前部的碎骨留着待进一步固定之后再去除。
3、将头盖骨剥开后,将脑下部连接的神经逐条剪短(可看到视神经交叉),待全部剪断后将脑整个剥离出来。
4、将剥离出来的脑浸泡在4%PFA中,过夜固定。
5、将PFA液换为30%蔗糖进行脱水(防止冷冻切片时形成冰晶和孔洞),初始脱水时脑会浮在蔗糖上面,待完全脱水后脑会沉底。
此时可将脑取出进行冷冻切片。
