物料中间产品和成品的内控标准管理制度
物料、中间产品、成品的内控标准的制订、修订规程

上海标准文件标题:物料、中间产品、成品的内控标准的制订、修订规程分发部门:总经理室,质量技术部,生产技术部,物资管理部,行政部(存档)物料、中间产品、成品的内控标准的制订、修订规程1 目的制定质量标准的管理制度,确保药品生产过程的各环节均有章可循。
2 范围公司所有原辅料、包装材料、中间体和成品的质量标准。
3 责任者质量技术部、生产制造部、物资管理部等部门相关人员。
4 程序4.1 质量标准由质量技术部进行制订,总经理室批准后生效,制订的有关要求如下。
4.1.1 原辅料、中间产品、成品的内控质量标准,应依据法定标准和实际生产水平进行制订,内控标准不得低于法定标准。
4.1.2 有标示内容的包装材料质量标准,应根据企业对包装的技术要求进行制订。
包装材料的技术要求应包括规格尺寸(包括偏差范围);文字内容;材质(如纸质等);包装形式;颜色要求;标准样稿等。
4.1.3 无标示内容的包装材料质量标准,应参照国家、行业的相关标准制订。
4.2 质量标准的修订在下列情况下应进行质量标准的修订:4.2.1 法定标准变更或生产实际情况发生改变时。
4.2.2 包装设计发生变更时。
4.3 修订步骤4.3.1 首先有生产制造部或质量技术部提出质量标准修订要求,经部门经理上报给总经理室,由总经理室统一调度生产制造部、质量技术部、物资管理部相关领导人开技术变更会议,拟定质量标准修订方案。
4.3.2 上述三个部门联合进行产品小试和质量标准验证,再由质量技术部出具质量标准草案交由总经理室审核。
2/2 物料、中间产品、成品的内控标准的制订、修订规程QA-M-0154.3.3 总经理室审核通过后由质量技术部正式发文交给总经理室、生产制造部、物资管理部,并在行政部存档4.4 质量技术部在新的质量标准下发时,应从各相应部门及时收回过时的质量标准,以保证工作现场只有现行的质量标准。
4.5 对未按质量标准执行,或因保管不善等原因给公司造成损失的,将追究当事人的责任。
材料成品管理制度

材料成品管理制度一、总则为了规范材料成品管理,提高生产效率,确保产品质量,特制定本制度。
二、管理责任1. 生产部门负责材料成品的采购、存储和使用管理。
2. 质量部门负责对材料成品的质量进行监督检查。
3. 仓储部门负责对材料成品的入库、出库和库存管理。
4. 生产经理负责监督整个材料成品管理的实施情况。
三、采购管理1. 采购人员应根据生产计划和需求确定所需材料成品的种类和数量,并与供应商进行协商。
2. 采购人员应核实供应商的资质和信誉,并签订合同明确双方责任。
3. 采购人员应及时跟踪供应商的交货进度,确保材料成品按时到达。
4. 采购人员应对收到的材料成品进行验收,确保质量符合要求。
四、存储管理1. 仓库应对不同种类的材料成品进行分类存放,避免混乱和交叉污染。
2. 仓库应保持干燥、通风和清洁,定期清理和消毒,确保材料成品不受污染。
3. 仓库应定期盘点库存,及时更新库存信息,确保数据准确。
4. 仓库应制定合理的货架布局和标识,方便查找和取用材料成品。
五、使用管理1. 生产员工应按照工艺要求和作业程序正确使用材料成品,避免浪费和损坏。
2. 生产员工应注意材料成品的有效期限和储存条件,确保使用前检查材料成品的质量。
3. 生产员工应及时反馈有关材料成品的问题和意见,以便改进和提高质量。
六、质量管理1. 质量部门应进行定期的材料成品抽检和抽查,确保产品质量稳定。
2. 质量部门应建立和完善材料成品的检测标准和程序,提高检测效率和准确性。
3. 质量部门应及时处理发现的材料成品质量问题,做好记录和分析,提出改进建议。
七、绩效评估1. 生产部门应每月对材料成品的采购量、库存量和使用量进行统计和分析,制定相应的改进措施。
2. 质量部门应每季度对材料成品的质量问题进行汇总和分析,减少质量事件的发生。
3. 仓储部门应每周对库存量和存储环境进行检查和评估,消除存储隐患。
八、改进措施1. 各部门应定期召开联席会议,交流经验和问题,提出改进建议。
SMP-QA-01 检验管理制度 B0

1目的:规范公司物料、中间产品和成品的检验过程,以保证产品安全,确保产品质量符合客户及相关法律法规的要求。
2适用范围:本制度适用于所有原料、包装材料、半成品、待包装品、成品的检验工作。
3职责权限:3.1研发部:负责原料和产品检验标准、检验方法的制定;负责原料标准样品的提供。
3.2仓储部:负责原料、包材的接收和报检工作。
3.3生产部:负责半成品、待包装品、成品的报检工作。
3.4质量管理部:负责包材检验标准的制定;负责检验工作的具体实施。
4制度内容:4.1原料检验:4.1.1研发部在新原料评估完成时依据供应商COA、MSDS、原料特性等制定《原料内控标准》,规定检验项目和方法,并提供原料标准样品。
4.1.2原料采购到货后,原料仓按照《物料收发管理制度》接收原料,打印并粘贴我司“原料标签”,并填写《原材料到货及报检通知单》给到检验员检验。
4.1.3检验员接收《原材料到货及报检通知单》并核对原料COA、原料标签,按每种原料每个批次随机抽取1个独立包装进行取样和留样,具体按照《取样管理制度》及《留样管理制度》进行。
4.1.4检验员按《原料内控检验标准》规定的检验项目和检验方法,参照相关“检验作业指导书”进行逐项检验。
4.1.5检验员检验完毕,填写《原料检验报告》;检验合格则在“原料标识卡”上盖合格章;检验不合格的按《不合格品控制程序》进行处理。
4.1.6检验员第一时间通知原料仓检验结果,仓库按照按检验结果对原料进行归位。
4.2包材检验:4.2.1质量管理部按照包材类型和特性结合产品质量要求制定《包材内控标准》。
4.2.2包材到货后,仓储部按照《物料收发管理制度》接收包材并填写《原材料到货及报检通知单》给到检验员检验。
4.2.3检验员接收《原材料到货及报检通知单》后,按以下抽样方案进行抽样:a)开箱数:按照总箱数开平方根取整数+1确定,2箱至4箱开2箱;b)外观检验:按照GB/T2828.1-2012正常一次抽样方案,一般检验水平Ⅱ,AQLCri:0、Maj:2.5、Min:4.0;c)功能检测:按照GB/T2828.1-2012正常一次抽样方案,特殊检验水平S-2,AQL Cri:0、Maj:2.5、Min:4.0。
药品生产质量管理规范

药品生产质量管理规范1998年版与2010年修订版对比表《药品生产质量管理规范》(以下简称药品GMP)是药品生产和质量管理的基本准则。
我国自1988年第一次颁布药品GMP至今已有20多年,其间经历1992年和1998年两次修订,截至2004年6月30日,实现了所有原料药和制剂均在符合药品GMP的条件下生产的目标。
新版药品GMP共14章、313条,相对于1998年修订的药品GMP,篇幅大量增加。
新版药品GMP吸收国际先进经验,结合我国国情,按照“软件硬件并重”的原则,贯彻质量风险管理和药品生产全过程管理的理念,更加注重科学性,强调指导性和可操作性,达到了与世界卫生组织药品GMP的一致性。
新版药品GMP修订的主要特点:一是加强了药品生产质量管理体系建设,大幅提高对企业质量管理软件方面的要求。
细化了对构建实用、有效质量管理体系的要求,强化药品生产关键环节的控制和管理,以促进企业质量管理水平的提高。
二是全面强化了从业人员的素质要求。
增加了对从事药品生产质量管理人员素质要求的条款和内容,进一步明确职责。
如,新版药品GMP明确药品生产企业的关键人员包括企业负责人、生产管理负责人、质量管理负责人、质量受权人等必须具有的资质和应履行的职责。
三是细化了操作规程、生产记录等文件管理规定,增加了指导性和可操作性。
四是进一步完善了药品安全保障措施。
引入了质量风险管理的概念,在原辅料采购、生产工艺变更、操作中的偏差处理、发现问题的调查和纠正、上市后药品质量的监控等方面,增加了供应商审计、变更控制、纠正和预防措施、产品质量回顾分析等制新制度和措施,对各个环节可能出现的风险进行管理和控制,主动防范质量事故的发生。
提高了无菌制剂生产环境标准,增加了生产环境在线监测要求,提高无菌药品的质量保证水平。
1 / 342 / 343 / 344 / 345 / 346 / 347 / 348 / 34压,排至室外的废气应经净化处理并符合要求,排风口应远离其它空气净化系统的进风口;生产β内酰胺结构类药品必须使用专用设备和独立的空气净化系统,并与其它药品生产区域严格分开。
GMP对物料管理的要求

物料管理的范围
物料管理全过程的质量管理:
原辅包材从标准制定→
选定供应商; 购买 →入库→验收→编号→
使用
合格,储存保管 发放、
取样→检验→
不合格、退货
成品→检验→ 销毁
合格→销售、发货 不合格→处理 返工或
物料管理的意义和目的
物料管理是GMP管理的主要内容之一;从物料进入的源 头——采购开始,直至成品销售每一环节,对物料进行全 过程的监控,保障不合格的原辅料 包装材料不进库,不 合格的中间产品半成品不流入下道工序,不合格的成品不 出厂(三不原则)
物料管理的内容
一物料的购入 (二)物料的储存 (三)物料的发放与使用 (四)供应商审计 (五)标签 说明书、印字包材管理 (六)不合格品的管理 (七)管理制度和记录
一物料的购入
物料购买是物流供应链上的源头;是制药对物流管理的一个 非常重要的环节 采购物料的基本任务有以下几项:
1 保证正常供应、支持生产经营活动 2、持续改进采购过程和供应商管理过程 3、控制、减少所有与采购相关的成本 4、建立可靠、安全、优良的供应配套体系,采购尽量集
五标签 说明书、印字包材管理
2 印字包材的验收贮存: 1印字包材进厂;仓库专人应按标准样、检查外观、尺寸、
式样、颜色、文字内容,查看有否污染、破损,凡不符合 要求,点数封存,指定专人及时销毁,做好记录,并由监 销人审查签字 (2)质管部应对每批标签检查是否注明生产单位、注册 商标、批准文号、品名、规格、装量、用法、等内容。毒 剧等特殊药品应按规定明显标志。并按所订标准样本要求 核对内容,还应检查印刷质量,符合要求后,签收 包材到 货验收记录。
二物料的储存
缺点: 1 占用大量流动资金 2、发生库存成本资金利息、保管费、库存损失费 3、掩盖生产经营中存在的问题;如计划不当、因质量问题的
药品包装材料和容器生产质量管理通则
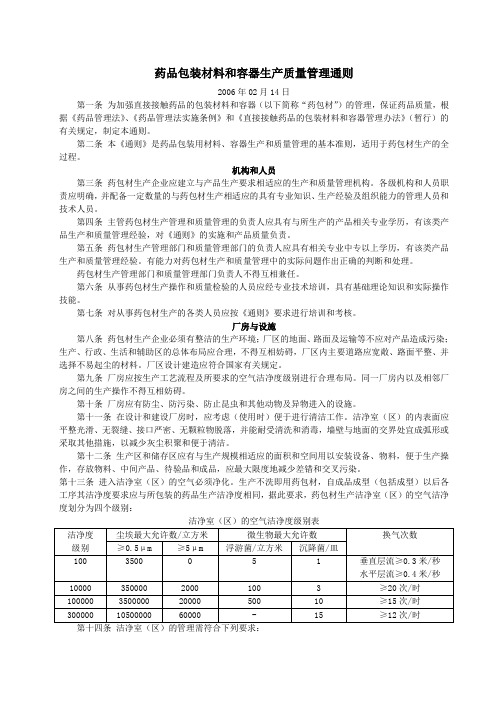
药品包装材料和容器生产质量管理通则2006年02月14日第一条为加强直接接触药品的包装材料和容器(以下简称“药包材”)的管理,保证药品质量,根据《药品管理法》、《药品管理法实施条例》和《直接接触药品的包装材料和容器管理办法》(暂行)的有关规定,制定本通则。
第二条本《通则》是药品包装用材料、容器生产和质量管理的基本准则,适用于药包材生产的全过程。
机构和人员第三条药包材生产企业应建立与产品生产要求相适应的生产和质量管理机构。
各级机构和人员职责应明确,并配备一定数量的与药包材生产相适应的具有专业知识、生产经验及组织能力的管理人员和技术人员。
第四条主管药包材生产管理和质量管理的负责人应具有与所生产的产品相关专业学历,有该类产品生产和质量管理经验,对《通则》的实施和产品质量负责。
第五条药包材生产管理部门和质量管理部门的负责人应具有相关专业中专以上学历,有该类产品生产和质量管理经验。
有能力对药包材生产和质量管理中的实际问题作出正确的判断和处理。
药包材生产管理部门和质量管理部门负责人不得互相兼任。
第六条从事药包材生产操作和质量检验的人员应经专业技术培训,具有基础理论知识和实际操作技能。
第七条对从事药包材生产的各类人员应按《通则》要求进行培训和考核。
厂房与设施第八条药包材生产企业必须有整洁的生产环境;厂区的地面、路面及运输等不应对产品造成污染;生产、行政、生活和辅助区的总体布局应合理,不得互相妨碍,厂区内主要道路应宽敞、路面平整、并选择不易起尘的材料。
厂区设计建造应符合国家有关规定。
第九条厂房应按生产工艺流程及所要求的空气洁净度级别进行合理布局。
同一厂房内以及相邻厂房之间的生产操作不得互相妨碍。
第十条厂房应有防尘、防污染、防止昆虫和其他动物及异物进入的设施。
第十一条在设计和建设厂房时,应考虑(使用时)便于进行清洁工作。
洁净室(区)的内表面应平整光滑、无裂缝、接口严密、无颗粒物脱落,并能耐受清洗和消毒,墙壁与地面的交界处宜成弧形或采取其他措施,以减少灰尘积聚和便于清洁。
S-SMP-QA-004-1 中间产品管理规程

1 目的:建立中间产品管理规程,确保中间产品符合质量标准,保证中间产品管理符合GMP要求。
2 范围:公司生产的所有中间产品。
3 责任者:QA、QC、制造部、各生产车间。
4 程序:4.1 中间产品是指生产过程中出现的原辅料、包装材料、成品之外的一系列产出物料。
4.2 产品的生产过程必须严格执行工艺规程和相关SOP。
所有的中间产品必须严格执行公司内控标准,不符合内控标准的中间产品不得流入下道工序。
中间产品内控标准由QA 起草下发,制造部提供相应参考数据,质量副总批准后执行。
4.3 车间在存放中间产品过程中容器均应加盖,并有明显标签,标签应注明品名、批号、数量等。
操作人员将中间产品按品种、批号放置,挂上“待验”牌(黄色)或“合格”(绿色)标识。
各生产工序填写《中间产品请验单》(R/QA-002),交QC按《中间产品取样规程》(S/SOP/QC/S-002)取样。
4.4 QC按中间产品相应的检验SOP进行检验,做好检验记录。
检验结束,出具2份检验报告,1份留底备查,1份交生产车间。
4.5车间接到检验合格报告后,应将“待验”牌(黄色)换成“合格”牌(绿色);车间接到检验不合格报告后,应将“待验”牌(黄色)换成“不合格”牌(红色)。
4.6经授权的车间放行负责人放行后的中间产品方可下传。
车间任何人不得干扰中间体放行人员独立履行职责。
在中间体放行钱,中间体放行人要确保审阅了所有相关的中间体生产记录、检验报告和偏差等,并进行放行评价和签名。
QA对中间体放行履行日常的放行监督工作。
4.7 不合格中间产品的处理按《不合格品管理规程》(S/SMP/QA-006)进行。
4.8原料药中间产品的储存期不超过6个月,如生产过程中有超过现象,必须经过重新检验和QA评估,根据评估意见进行处理。
4.9 关联文件《中间产品请验单》(R/QA-002)《中间产品取样规程》(S/SOP/QC/S-002)《不合格品管理规程》(S/SMP/QA-006)5 更改信息5.1更改原因:细化退货流程5.2 更改历史。
药品生产质量管理规范

第十三章 自检
第八十三条 药品生产企业应定期组织自检。自 检应按预定的程序,对人员、厂房、设备、文 件、生产、质量控制、药品销售、用户投诉和 产品收回的处理等项目定期进行检查,以证实 与本规范的一致性。 第八十四条 自检应有记录。自检完成后应形成自 检报告,内容包括自检的结果、评价的结论以 及改进措施和建议。
第一章 总则
第一条 根据《中华人民共和国药品管理 法》规定,制定本规范。 第二条 本规范是药品生产和质量管理的 基本准则。适用于药品制剂生产的全过 程、原料药生产中影响成品质量的关键 工序。
第二章 机构与人员
第三条 药品生产企业应建立生产和质量管理机 构。各级机构和人员职责应明确,并配备具有 专业知识、生产经验及组织能力的管理人员和 技术人员。 第五条 药品生产管理部门和质量管理部门的负 责人应具有医药或相关专业大专以上学历,有 一定的实践经验,对工作中的实际问题作出正 确的判断和处理。两部门负责人不得互相兼任。 第六条 从事药品生产及质量检验的人员应经专 业技术培训,具有基础理论知识和实际操作技 能。 第七条 对从事药品生产的各级人员应按本规范 要求进行培训和考核。
第四十五条 物料应按规定的使用期限储存,无规 定使用期限的,其储存一般不超过三年,期满 后应复验。 第四十六条 药品的标签、使用说明书必须与药 品监督管理部门批准的内容、式样、文字相一 致。标签、使用说明书须经企业质量管理部门 校对无误后印制、发放、使用。 第四十七条 药品的标签、使用说明书应由专人保 管、领用。
第三章 厂房与设施
第八条 药品生产企业必须有整洁的生产环境; 生产、行政、生活和辅助区的总体布局合理, 不得互相妨碍。 第九条 厂房应按生产工艺流程及所要求的空气 洁净级别进行合理布局。同一厂房内以及相邻 厂房间的生产操作不得相互妨碍。 第十条 厂房应有防止昆虫和其他动物进入的设 施。 第十一条 在设计和建设厂房时,应考虑使用时 便于进行清洁工作。洁净室(区)的内表面应 平整光滑、无裂缝、无颗粒物脱落,并能耐受 和便于清洗和消毒。
药品生产质量管理制度规范

药品生产质量管理制度规范A型题●药品生产和质量管理的基本原则是《药品生产质量管理规范》。
●药品生产企业的生产文件编制的程序是起草、审核、批准及修订。
●生产文件的编制应注意的内容是用词准确,通俗易懂,层次清楚,各类技术参数要求准确。
●药品生产企业质量标准或检验操作规程是由质量管理部门组织制定,经企业质量管理负责人批准签章后颁发执行。
●药品生产企业的原辅料、包材的采购应按规定质量标准向经质量管理部门质量审计合格的供货单位按计划采购。
●药品生产企业的药品标签、说明书应是设专柜或专库储存,设专人管理。
●纯净水、注射用水的质量标准应符合中国药典。
●药品生产企业的成品发放原则是先进先出。
●洁净室(区)的温度和相对湿度,一般控制在温度18~26℃,相对湿度45%~65%。
●洁净室(区)内输送药液及注射用水的管道,储罐等的材质应选用优质不锈钢或其他优质耐腐蚀材料。
●生产用的注射用水储存可采用80℃以上保温,65℃以上保温循环或4℃以下存放。
●对无菌作业区洁净工作服的要求是应选防静电、无纤维脱落、耐消毒的上纤维材质制成,其试样能覆盖全部头发、胡须与脚部,并能阻留人体脱落物。
●药品生产企业直接接触药品的生产人员应定期体检,时间为每年至少体检一次。
●药品生产中,清场结束后发“清场合格证”的复查人是车间质量管理人员。
●在药品生产中下列说法错误的是清场工作由专门的清场人员进行,岗位负责人检查,质量管理人员复查。
●进入洁净区的维护保养设备人员应穿适宜的工作服。
●药品生产企业药品内控标准制定的原则是必须符合质量法规和强制性标准要求。
●药品生产企业质量管理部门的主要职责不包括制定质量管理和检验人员的职责,批准生产工艺规程。
●药品生产企业的某批产品共包装169件,应随机取样量为14件。
●药品生产企业的某批产品共包装676件,应随机取样量为14件。
●药品生产企业分别购进324批原料和制剂成品,则抽样量分别为10,324件。
●验证工作的一般程序是确定验证项目→制订验证方案→批准验证方案→组织实施→提出验证报告→批准验证报告→建立验证档案。
质量标准编制管理规范

质量标准编制规范1、目的:为统一并规范本公司质量标准的编制,特制订本编制程序。
2、主题内容:本标准规定了质量标准编制的基本要求。
3、适用范围:原料、辅料、包装材料、中间产品、成品内控质量标准的编制。
4、职责——质量管理部起草人负责按已批准的质量标准编制规程(SOP)起草质量标准。
——QC主管负责按已批准的质量标准编制规程(SOP)审核质量标准。
——质量管理部长负责按已批准的质量标准编制规程(SOP)审批质量标准。
5、正文5.1 成品质量标准编制程序5.1.1 编制成品质量标准必须以法定标准为依据,依次为:现行版药典(增补本)、部颁标准、省市自治区地方标准,未收载的应符合国家药品监督部门的有关规定,化工原料用时,并经国家药品监督管理部门批准。
5.1.2 各项编写要求详见《国家药品标准工作手册》。
5.1.3 若法定标准中有量化指标,内控质量标准应根据工艺技术可达到的要求,适当提高标准,确保产品在储存期内能达到法定标准的要求。
5.1.4 要有标准编制依据,【性状】,【性味与归经】,【功能与主治】,【用法与用量】,【贮藏】。
5.2 原料质量标准编制程序(SOP)5.2.1 编制原料质量标准必须以法定质量标准为依据,依次为:现行版药典(增补本)、部颁标准、省市自治区地方标准,未收载的应符合国家药品监督部门的有关规定,化工原料用时,并经国家药品监督管理部门批准。
5.2.2 各项编写要求详见《国家药品标准工作手册》。
5.2.3要有标准依据,【性状】,【贮藏】。
5.2.4 在原料质量标准中,药材的二氧化硫残留量不得过150mg/Kg。
5.3 辅料质量标准编制规程5.3.1 辅料若有法定药用标准应依次为依据,依次为:现行版药典(增补本)、部颁标准、省市自治区地方标准。
如无药用标准,可依据法定食用标准或行业标准制订企业标准,但必须经过验证,确认不影响产品质量。
如既无法定药用标准,又无法定食用标准,而又必须使用的辅料,可以参照相关的标准资料制定企业标准,但要在标准中规定每批辅料都要依据《中国药典》二部附录中“异常毒性检查法”进行检测,确保使用安全。
兽药GMP培训综合试题答案

-iGMP培训试题综合答案一. 填空题1.6乂「的全称是生产质量管理规范,GMP是其英文名称的缩写。
2. GMP的基本宗旨是:避免人为差错,防止混淆和污染、交叉污染,建立有效运作的质量体系。
3.GMP是药品生产和质量管理的基本准则。
4.制定6乂「的依据是兽药管理条例。
5.兽药6乂「自1999年8月1日开始实施。
6.GMP的三要素是:—人_、我件、硬一件。
7. GMP强调的四个一切是:一切行为有标准;一切行为有记录;一切行为有复核;一切行为有监控。
8.我国负责兽药监督管理工作的行政部门是农业部。
9.在2005年6月30日后,未取得“药品GMP证书”的企业或车间将取消其相应的兽药生产资格。
10.GMP适用于药品制剂生产的全过程、原料药生产中影响质量的关键工序。
11.兽药生产企业应建立生产和质量管理机构,各级机构和人员的职责应明确。
12.制药企业的管理人员和技术人员应具有与药品生产相适应的遥业知识、生产经验和组织能力。
13.企业主管药品生产管理和质量管理的负责人以及药品生产管理部门和质量管理部门的负责人均应具有医药或相关专业大专以上学历。
14.药品生产管理部门和质量管理部门的负责人不得—互相兼任。
他们应有能力对药品生产和质量管理中的实际问题作出正画的判断和处理。
15. GMP要求从事药品生产的各级人员都应参加专业技术的培训和考核。
16.兽药生产企业厂区的地面、路面及运输等不应对药品的生产—造成一污染。
17.兽药生产企业的生产区、行政区、生活区和辅助区的总体布局应合理,不得互相妨碍。
18.同一厂房以及相邻厂房之间的生产操作不得相互妨碍。
19.厂房应有防止昆虫和其他动物进入的设施。
20.生产区和储存区应有与生产规模一相适应的面积和空间用以安置设备、物料,便于生产操作,存放物料、中间产品、待验品和成品,应最大限度地减少差错和交叉污染。
21.生产区应根据生产要求提供足够的照明,主要工作室的照度宜为300勒克斯;厂房应有应急照明设施。
物料与产品管理

物料与产品管理药品生产是将物料加工转换成成品的一系列实现过程。
产品的质量基于物料质量,形成与药品生产的全过程,可以说物料质量是产品质量的先决条件和基础,药品生产的全过程是从物料供应商的选择到物料的购入、储存、发放和使用<生产>销售直到用户。
供购储发使用销用应商入存放生产售户物料管理是一个广义概念,对象应是物料产品,而新GMP中将物料与产品的概念进行了细分,其物料是指原料辅料包装材料。
就药品制剂而言:原料是指原料药,就原料药而言:原辅是指用于原料药生产的除包装材料以外地其他物料,它们是生产高质量产品的一个关键先决条件。
产品包括:中间产品、待包装产品和成品。
中间产品指完成部分加工步骤的产品,尚需进一步加工方可成为待包装产品。
成品:已完成所有生产操作步骤和最终包装的产品。
原98版10条而新版7节38条详细规定了对原辅料包装材料,印刷包装材料,中间产品和待包装产品,成品特殊管理的物料和产品的管理内容上更加丰富,规定上更加严格。
1.物料管理:规范购入应包括从合法的单位购进符合规定标准的物料,并按规定入库供应商的评估和选择定点采购按批验收和检验取样检验合理储存分类储存<常温、阴凉冷库><固液><挥发药串味><原药材净药材><特殊管理物料> 规定条件下储存<温度冷2~10℃><阴凉20℃以下><常10~30℃><相对温度45~75%><遮光、干燥、密闭、密封、通风>规定时间内使用<经过考察,在规定时间内稳定确定使用期限><原料应当按有效期复验其储存>仓储设施与定期养护<要避免影响原有质量、避免污染、交叉污染,对环境进行维护清洁目的是保证物料的储存条件不对物料产生不良影响><仓库五妨蝇、虫、鼠、霉、潮><五距剁、墙、行、顶、灯(热源)>控制放行与发放接受<主要目的是防止不合格物料投入使用而对物料是否可以发放使用进行控制,而使用指令控制发放使用种类数量降低混淆差错>无物料的状态与控制:<待验:标志处于搁置,等待状态。
物料、中间产品、成品放行管理制度

目的:建立物料、中间产品、成品的质量标准及放行的管理程序,防止不合格的物料投入生产、不合格的中间产品流入下工序、不合格的成品出厂,特制订本制度。
范围:适用于本厂进厂物料、车间中间产品及成品的管理。
责任:质量部、生产部、质监科、生产车间、生产车间有关人员。
内容:1制订物料、中间产品、成品的质量标准的依据1.1物料的质量标准依据中华人民共和国药典或国标、企标及相关的标准制订,具体见《原辅料质量标准》、《包装材料质量标准》。
1.2中间产品的质量标准依据企业标准的内容制订公司的内控质量标准,具体件《各产品的内控质量标准》。
1.3产品的质量标准是依据保健食品批件的技术要求制订的各产品的企业标准,具体内容见《产品质量标准》。
2物料的放行:2.1每批物料放行前,质量部对物料厂家资质、生产商的检验报告、产品包装、取样、物料进厂检验记录、报告单等审核无误后签名放行,否则不准放行。
2.2物料放行前由质量部审核,审核内容包括:2.2.1供货单位是否为“合格供应商目录”中厂家。
2.2.2 是否有生产商的检验报告,内、外包装是否完整、严密、洁净。
2.2.3 执行批准的取样规程、取样证填写正确完整。
4.2.2.4 是否按规定的检验方法检验,是否按检验操作规程检验,检验记录、报告单填写真实、正确、完整。
2. 3 质量部审核人员审核完成后,填写物料放行审核记录连同相关记录一并交质量受权人审核。
2.4 质量受权人对物料放行单与物料检验报告单进一步审核无误后签名放行。
2.5 QA将物料审核放行单及检验报告单、合格证一同交仓库保管员。
3中间产品的放行3. 1 中间产品由质量部取样员取样,取样后交质检科QC检验。
中间产品放行前,QA审核该工序生产记录和检验记录,经审核无误后发检验报告单及合格证放行,否则不准流入下道工序。
3.2中间产品由QA审核,内容包括:3.2.1 生产过程是否符合GMP要求、符合工艺要求3.2.2 操作是否执行操作规程3.2.3 配料、称量过程是否经复核人复核3.2.4 物料平衡是否符合规定。
GMP概述

4.做有依(明确责任,避免口头的差错,规范操作行为)
5.行有迹(不记等于没做) 6.查有据(生产记录,纠正偏差)
即ISO中第176个技术委员会,全称是“质量保证技术委员会”,成立于 1979年。1987年更名为“质量管理和质量保证技术委员会”。TC176专
门负责制定质量管理和质量保证技术的标准。
GMP与ISO9000的比较
相同点
1. 其目的都是保证产品质量,确保产品质量达到一定要求,两者的指 导思想是完全一致的;
5.1994年,经国家技术监督局批准成立中国药品GMP认证委员会 6.1999年,国家药品监督管理局(SDA)第9号令颁布《药品生产管理规
范》(1998版)及其附件,《药品GMP认证检查评定标准225条》。GMP
认证工作将与药品生产企业许可证换发相结合,采取分剂型、分步骤、 有重点的实施GMP认证的办法。
4.药品生产企业的生存和发展
国际医药产业实施GMP状况
美 国 1963年 美国FDA制定GMP 1964年 开始实施
1972年 美国规定,凡是向美国输出药品的制药企业以
及在美国境内生产药品的外商都要向美国FDA 登记、批准,要求制药企业符合美国GMP
世界卫生组织(WHO)
1969年 WHO在第22届世界卫生大会上的决议中要求 所有的成员国执行WHO的GMP
的规定。
5 年以内:按规定报告所有不良反应 5 年以上:报告药品发生的严重、罕见、和新的不良反应
质量的定义与概念
一组固有特性满足要求的程度(ISO 9000:2000)。
特性:可区分的特征,可以是固有的或赋予,可以是定 性或定量的。 要求:明示的、通常隐含的或必须履行的需求或期望。
影响质量的四个方面
物料中间产品成品检验的管理规程

目的:建立物料、中间产品、成品检验的管理规程,规范各品种检验工作,从而保证产品质量。
适用范围:适用物料、中间产品、成品的检验。
责任人:仓库保管员、质量保证室人员,中心化验室检验员程序:1. 质量保证室人员按《取样管理规程》对所有进厂的原辅料、包装材料、在产的中间产品及成品进行取样、送样。
2. 中心化验室依据<质量标准〉,按照<检验标准操作规程〉进行检验。
3. 中心化验室各室主管在接到样品时,应核对品名、规格、批号、数量、送验日期等,核对无误,将检品分发给相关检验人员进行检验。
4. 原辅料、包装材料4.1凡生产用的各种原辅料、包装材料进库前均应经过仓库保管员初验,不符合规定不得进库。
初检合格方可进库由仓库保管员填写“请验单”交给质量保证室取样。
4.2质量保证室接到“请验单”和供方全检合格的报告单后应在24小时内取样并送达中心化验室。
4.3由质量保证室将中心化验室出具的合格检验报告连同“物料放行单”一并送交仓库保管员。
5. 中间产品5.1中间产品指按工艺规程生产的在产产品。
5.2中间产品应由车间主管根据生产工艺要求及时填写“请验单”由QA检查员取样并送至中心化验室。
5.3由中心化验室对中间产品进行检验,检验项目全部符合企业内控标准,质量保证室将“中间品检验报告、放行审核单” 一并交车间。
5.4此时车间方可进行下一步工序的生产,中间产品未经检验或检验不合格,不得流入下步工序。
6. 成品6.1接到车间“请验单”后由质量保证室QA检查员按《取样和送样管理规程》在生产的前、中、后三个阶段分别取样,同时取好留样观察所用的样品并转交中心化验室。
6.2 “成品检验报告”复核无误后交质量保证室。
6.3质量保证室审核批文件无误后,签发“成品终审放行单”。
7. 物料、中间产品、成品的检验报告均需在检验周期内报出,并填写“检验台帐”8. 所有检验工作必须及时真实填写“检验记录”,并有复核。
9. “检验报告”必须有中心化验室主任审核签字并加盖质检公章,确保无误方可发出。
GMP对物料管理的要求

(2)对大多数上市产品来说,尽量选用已有较成熟质量 标准的物料,包括国际标准、国家标准、行业标准、企业 标准等。进口原料药、中药材、中药饮片应有口岸药检所 的检验报告。(《药品管理法》第十一条规定,生产药品 所需的原料、辅料,必须符合药用要求。GMP中第三十 九、四十条)
(3)按照企业选择、购入物料的SMP、SOP的规定和制 度,对物料购入的审核批准、入库前验收、采购登记(合 同)等工作的完成情况 (4)采购供应部门与质量管理部门应配合做好物料供应 商审计评估工作和按批取样检验工作。
2、印字包材的验收贮存: (1)印字包材进厂,仓库专人应按标准样、检查外观、 尺寸、式样、颜色、文字内容,查看有否污染、破损,凡 不符合要求,点数封存,指定专人及时销毁,做好记录, 并由监销人审查签字。 (2)质管部应对每批标签检查是否注明生产单位、注册 商标、批准文号、品名、规格、装量、用法、等内容。毒 剧等特殊药品应按规定明显标志。并按企业所订标准样本 要求核对内容,还应检查印刷质量,符合要求后,签收 《包材到货验收记录》。
物料的概念: 物料是指药品生产所用的原料、辅料、包装材料、中间产 品、成品。 按物理状态——固态、液态。 包装材料: 是否与药品直接接触——内包装材料与外包装材料。 印刷与否——印刷包装材料与非印刷包装材料。 中间产品——生产过程的半成品、颗粒、素片等。 成品—预混剂、粉剂、溶液剂。
2017年08月
概述: 药品是生产出来的,药品质量自然也是在生产中形 成的。为确保药品质量,必须对原料至成品到销售的全过 程中的各个环节进行严格的管理和控制。必须从生产药品 的基础物质抓起,通过严格、科学、系统的管理,使原料、 辅料及包装材料从采购、入库、贮藏、发放等方面,做到 管理有章可循,使用有标准可依,记录有据可查,从而保 证合格、优质的原料、辅料及包装材料用于药品生产。
GMP规范要求
第三局部GMP标准要求第一章人药品生产企业应建立生产和质量治理机构,明确各级机构和人员的责任.组织机构和人员是组成企业的有机体,企业是依靠各部门和人员执行既定的责任而运作,人那么是具体的执行者.因此,我们这里所讲的人,不仅仅是讲我们企业的员工,同时包括企业的组织机构.第一节组织机构我们知道,在人、机、料、法、环五大因素中人是影响药品质量诸因素中最活泼、最积极的因素,要把人这个因素治理起来,我们必须赋予他一定的权限和责任,这就形成了我们的组织机构.组织机构是我们开展GMP工作的载体,也是GMP体系存在及运行的根底.因此建立一个高效、合理的组织机构是我们开展GMP工作的前提.组织机构设置根据企业规模、人员素质、经营方式等不同而不同,可以有差别,但把握一个总的原那么,那就是“因事设人〞,这样可预防出现组织机构重复设置、工作低效率.既然组织机构是我们赋予人员一定的责任和权限而形成的,也就是说,一个制药企业的组织机构中,每个人都在组织机构中都行使着一定的责任和相应的权限,只是分工不同而已.从下表中我们可以清楚地看到GMP标准与部门责任的关系.GMP标准与部门责任的关系★:表示与此部门紧密相关▲:表示与此部门相关.:表示与此部门无关由此可见,GMP离我们并不遥远,其实它就在我们身边,作为企业的一员, 我们首先要了解我们的组织机构,只有找到自己在组织机构中的正确位置,才能履行自己的责任.从上表中我们看到,在制药企业中,每个部门都会承当着相应责任.而工作范围最广、质量责任最大的一个部门是质量治理部,GMP每个要素都与它紧密相关.其职能是保证所生产的药品对规定标准的符合性和有效性.其具体表现如下:第三局部GMP标准要求质量治理部是我们整个GMP标准实施的核心组织和保证机构.没有它的有效运作,我们产品质量也就无法得到保证.因此,在日常GMP工作中,有许多的工作都需要质量治理部来参与、确认, 提供一种质量信任,从而保证我们执行GMP的有效性、符合性、适宜性.第二节人员一、GMP实施过程关键在人人是GMP实施过程中的一个重要因素,其一切活动都决定着产品的质量.1、人的工作质量决定着产品质量由此可见,我们的工作质量对产品质量起着决定性作用,为保证我们的产品质量,每个员工必须具备与岗位相适应的知识、技能和GMP意识,从而保证我们的工作是高质量的.2、药品生产的五大要素从人、机、料、法、环五大要素构成关系图来看:设备物料।法为人制环为人治法环机、料、法、环均为人限制,无人就无机、无料、无环,无法,更无从谈药品的生产.由此可见,在药品生产过程中,人起着举足轻重的作用.二、人员要求1、、专业知识与技能要求GMP规定:从事药品生产操作必须具备有根底理论知识和实际操作技能因此,我们的员工必须是学习过相关知识或经过专业培训,实际操作考核合格者才能从事药品生产.2、职业道德要求由于我们从事着一项特殊商品药品的生产工作,其重要性这里就不再第三局部GMP标准要求赘述.所以作为药品生产行业的一名员工,我们必须遵守药品生产行业道德标准, 提升医药质量,保证医药平安有效,实行人道主义,全心全意为人民效劳.第三节培训我们在前面已经提到,要保证产品质量,首先要保证每位员工具有一定的GMP意识、专业知识与技能.那么,怎样才能保证员工具有一定的意识、专业知识与技能呢?这就是我们本章需要讲的培训.切记:我们药品生产行业的所有员工必须经过培训,合格后才能上岗.一、培训及培训对象、目的培训对象:1、在岗人员2、新进人员3、转岗、换岗人员4、企业临时聘用的人员培训的目的:1、适应环境的变换2、满足市场的需求3、满足员工自我开展的需要4、提升企业的效益通过培训,不但自己得到了提升和开展,同样也促进了企业的开展.二、培训内容、方式及考核第三局部GMP标准要求GMP 规定:对于从事高生物活性、高毒性、强污染性、高致敏性及有特殊要求的药品生产操作应专业的技术培训.培训采取多种方式进行,学习和实践相结合,提升大家的兴趣:1、课堂教学方式2、技能操作方式3、参观学习方式4、课堂教学与技能操作结合方式培训效果确认:培训之后我们对培训效果进行确认,确认的方式同样多种多样:1、操作技能确认2、口试3、笔试当效果确认达不到要求时,应重新进行培训、考核.培训档案:当每次培训结束之后,我们建立培训档案,作为我们培训的原始依据.培训档案应公司与个人分别建档.公司培训档案1、培训方案2、签到表3、培训资料4、培训结果分析最后,我们可以用下面的流程图来表示培训的过程: 个人培训档案1、培训卡2、测试试卷3、其它证实培训方案测试合格方案实施测试不合格培训测试由此可见,培训是一个持续不断的过程,通过培训,我们不断地接受新的知第三局部GMP标准要求识,不断进步,到达培训的最终目的成为一名优秀的药品生产行业的人才.三、合格员工经历以上讲述了组织机构,人员要求以及上岗培训,结合上述因素分析,要成为一名合格的药品生产行业的员工,必须过五关,斩六将,其经历如下图.应聘—面试一体检培训考核.合格员工第二章机在第一章中,我们讲了“人这个要素,在本章我们讲人、机、料、法、环中第二要素机.什么是“机〞,我们这里所讲的“机〞就是我们产品形成涉及的所有设备、设施,也就是我们常说的硬件.硬件是根底,是产品的实现平台,没有硬件,根本无法谈及GMP 的实施.我们的设施、设备涉及非常广泛,包括厂房设施系统、生产设备、检验设备等等.第一节设施、设备的技术要求我们知道,我们的设施、设备用于药品的生产,其好坏直接影响我们产品的质量,药品是一种特殊的商品,这是我们反复强调的,所以对设施、设备的要求不会跟其它行业一样,GMP对我们的设施、设备的技术有如下要求.一、设施要求其建筑结构、装备及其用具均有减少该区域内污染的介入、产生和滞留功能对于洁净室〔区〕,GMP标准有以下要求,温度、湿度、照度、压差、沉降菌、尘埃粒子等根本指标,只有当各项指标符合标准,才能进行生产.洁净室GMP标准根本指标切记:不同品种、规格的生产操作不得在同一操作间同时进行.所以,在生产过程中,我们采用风幕、纱窗、灭蝇灯、粘鼠板等预防昆虫和其他动物进入.二、设备要求如果我们使用没有校验过的秤来称量,试想一下,会导致什么样的后果呢?第二节设施、设备的平安操作GMP对于设施、设备提出了技术要求,为到达对设备治理的最终目的保持设备处于良好的状态.在生产过程中应该注意哪些方面的问题呢?1、平安操作我们在对设施、设备进行操作时,必须依“法〞操作,保证平安.案例:在某工厂中药前处理车间曾发生过切药机将一操作人员手指切断的事故. 分析其原因:由于当事人未根据制定的标准操作规程进行操作,不待设备平安停下来就去清理出药口,结果失去手指.这就是违法操作的直接后果.由此可见,依法操作对我们来说是多么重要.为了我们的平安,在生产过程中一定要重视平安问题:离开时要关闭电源;设备在运行时别靠近;未经培训别上岗.切记:我们一定要按SOP进行操作,人人关心平安,事事注意平安.2、在操作岗位中我们一定要做到“一平〞、“二净〞、“三见〞、“四无〞:一平:工房四周平整二净:玻璃、门窗净,地面通道净.三见:轴见光、沟见底、设备见本色.四无:无油垢、无积水、无杂物、无垃圾.第三局部GMP标准要求第三节设施、设备的维护保养一、设施的维护保养所有的设施应进行日常巡回检查,检查内容包括厂房内外墙面、地面、门窗、传递窗、照明器材、通风口等及其他辅助设施,巡查中发现损坏要立即汇报并按维修规程组织维修,填写维修记录,净化区内的墙面、地面修补应在未生产时开展,预防污染.每年定期对次墙体霉斑检查,以及对下水道、窖井进行清污工作.二、设备的维护保养要保持产品质量,就要保持设备处于良好的状态,要使用设备处于良好的工作状态,就要对设备进行维护保养.由于设备像人一样,也需要关心、保护, 才能正常工作.一、小修二、中修三、大修第三局部GMP标准要求切记:检修前要传到“三定二“四交流〞、“五落实〞.即:定工程、定时间、定人员.工程任务交底、设计图纸交底、检修标准交底.施工及平安举措交底;组织落实、资金落实、检修方案落实、材料落实、检修技术资料及工具落实.模具的治理:模具是一种特殊的生产设备,主要用于产品的成型,对产品质量有关直接的影响,所以在生产过程中我们要增强模具的治理.切记:模具必须上锁治理.每班使用前必须检查模具有无缺损、划伤、变形、润滑是否良好,上下模具时要轻拿轻放每批清场时应对模具进行清洁,清洁选用工具应不污染环境、模具、药品,且具有柔软性.第四设施、设备状态标志因此,在生产过程中应做好环境设施、设备的状态标志.其目的是做到“我不伤害自己,我不伤害别人,我不愿被别人伤害〞.案例:在某工厂,也曾发生过同样的切药机切断操作人员手指的事件.原因却不同,当时设备正处于清洁,却未悬挂状态标志,一实习生误取下切药机上的卡飞轮的钢管,结果导致事故的发生.大家想想:如果我们随时做好状态标志,就完全可以预防此事故的发生.由此可见,状态标志对我们非常重要,它可以有效地预防过失的发生.第三局部 GMP 标准要求设备的状态标志一般分为三类:,.运行:设备正处于使用的状态〔绿底黑字〕.二、设备的清洁状态标志 已清洁:设备、容器等经过清洗处理,到达洁净的状态〔绿底黑字〕.待清洁:设备、容器等未经过清洗处理,到达洁净的状态〔红底黑字〕.清洁状态卡清洁状态卡已清洁待清洁三、计量的状态标志根据GMP 对计量要求,计量器具必须要经校验合格后才能使用,并且有明 显的合格状态标志.因此,经检定合格的仪器张贴绿色“合格〞标记并定期校验.四、主要管线内容物名称及规定涂色・饮用水水管涂绿色・压缩空气管道刷淡蓝色・真空管道涂刷白色第三局部 GMP 标准要求・冷却水管道刷绿色・消防治理刷红色・排污管道刷黑色切记:状态标志一定要正确,置于设备明显位置,但不得影响设备的操作.第五节设备的记录设备记录是追溯设备是否保持良好状态的唯一论据,它包括设备选型、开箱验收、维护保养、运行、清洁记录等等.因此我们一定要做好设备的各项记录.切记:记录填写要及时准确.。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
【最新资料,WORD文档,可编辑】
1.目的:
建立质量标准的制订、修订、审查与批准的管理程序。
2.范围:
适用于本厂物料、中间产品和成品内控标准的管理。
3.责任:
质监科负责制订和修订内控标准及管理制度,各相关部门负责执行。
4.内容:
4.1质量标准的制订、修订、审查和批准:
4.1.1企业除执行药品的各级法定标准外,还应制订和执行物料、中间产品、成品的内
控标准。
4.1.2 制订和修订物料,中间产品及成品的内控标准,由质监科会同技术科起草,经
质监科长审核,厂长批准,签章后下达,自生效日期起执行。
一般每三至五年由质监科组织复审、修订,若在执行过程中确实需要修订时,审核、批准和执行办法与制订时相同。
4.2质量标准的内容:
4.2.1原辅料质量标准的主要内容包括:品名、代号、规格、性状、鉴别、检验项
目与限度、用途、标准依据等。
4.2.2包装材料质量标准的主要内容包括:材质、外观、尺寸、规格和理化项目。
直接
接触药品的包装材料、容器的质量标准中还应制订符合药品要求的卫生
标准。
第2页/共2页
4.2.3成品内控质量标准可参照中国药典、部颁标准和工艺规程及产品特性制订,工艺
用水应根据生产工艺要求及参照中国药典有关规定制订。
4.3内控标准的印制、发放、保管:
4.3.1批准签章后内控标准,统一交由厂文件控制中心印制、发放。
4.3.2标准颁发后,各接收部门应按有关规定进行编号,妥善保管,谨防丢失,并不得
外传。
4.4 内控标准的执行:
4.4.1生产科须以内控标准组织生产,符合内控标准的产品才能发放销售。
4.4.2质监科必须以质量标准为依据制订与各质量标准相关的检验操作规程。
4.4.3各检验、质监人员及有关管理人员须以质量标准为操作依据严格遵守执行。
4.5 内控标准的收回:
内控质量标准修订后,应及时将原标准予以收回,以免误用,并及时更换产品质量档案中的有关内容。
欢迎下载阅读!。
