有机小分子催化剂
有机小分子催化剂ppt课件

JACS, 2005, 127, 15696.
JACS, 2006, 128, 84.
没有明确的价值取向和人生目标,实 现自我 人生价 值就无 从谈起 。人生 价值就 是人生 目标, 就是人 生责任 。每承 担一次 责任
4.4 手性磷酸—抗衡手性阴离子催化剂
JACS, 2006,
没有明确的价值取向和人生目标,实 现自我 人生价 值就无 从谈起 。人生 价值就 是人生 目标, 就是人 生责任 。每承 担一次 责任
对该类催化剂的研究近年来才得到化学家的重视,并很快有机化学的 热点和前沿,但其渊源可追溯到20世纪70年代。早在1971年Wiechert就 首次报道了L-Proline可以催化分子内不对称羟醛缩合,1974年该反应被 Hajos等优化,ee值高达94%。然而,此后该类型的催化剂没有引起人们 的重视。
没有明确的价值取向和人生目标,实 现自我 人生价 值就无 从谈起 。人生 价值就 是人生 目标, 就是人 生责任 。每承 担一次 责任
6、 金属有机化合物催化剂 6.1 以手性二胺为配体
配体
没有明确的价值取向和人生目标,实 现自我 人生价 值就无 从谈起 。人生 价值就 是人生 目标, 就是人 生责任 。每承 担一次 责任
没有明确的价值取向和人生目标,实 现自我 人生价 值就无 从谈起 。人生 价值就 是人生 目标, 就是人 生责任 。每承 担一次 责任
第一章、简 介
自用1966年第一个手性金属配合物催化剂被成功用于不对称反应至今, 不对称催化研究迄今已有40年的历史。2001年,Nobel化学奖授予了在该 领域做出突出贡献的三位化学家Knowles, Noyori和Sharpless,标志着不 对称催化研究已取得了令人瞩目的成就。
有机化合物的合成与催化剂应用

有机化合物的合成与催化剂应用在化学领域中,有机化合物的合成一直是一个至关重要的研究方向。
它不仅关乎着我们日常生活中所使用的各种材料、药物和化学品的生产,还在推动科学技术的发展和解决全球性问题方面发挥着关键作用。
而在有机化合物的合成过程中,催化剂的应用无疑是一项具有决定性意义的技术。
首先,让我们来了解一下什么是有机化合物的合成。
简单来说,有机化合物的合成就是通过一系列的化学反应,将简单的起始原料转化为具有特定结构和功能的复杂有机分子。
这一过程需要精确的控制反应条件,包括温度、压力、溶剂等,以确保反应按照预期的方向进行,并获得高产率和高纯度的产物。
在有机合成中,我们常常会面临各种各样的挑战。
例如,有些反应可能需要高温高压的条件,这不仅增加了能源消耗,还可能导致副反应的发生,降低产物的纯度和收率。
此外,某些反应的速率可能非常缓慢,需要很长时间才能完成,这也大大降低了生产效率。
而催化剂的出现,为解决这些问题提供了有力的手段。
催化剂是一种能够加速化学反应速率,但在反应前后自身的化学性质和质量不发生变化的物质。
它们通过降低反应的活化能,使反应更容易进行。
催化剂的作用机制多种多样,有的通过与反应物形成中间产物,改变反应的途径,从而降低反应的活化能;有的则通过提供特定的活性位点,促进反应物之间的相互作用。
在有机合成中,常用的催化剂包括金属催化剂、酶催化剂和有机小分子催化剂等。
金属催化剂如钯、铂、铑等,由于其独特的电子结构和催化性能,在许多有机反应中表现出色。
例如,钯催化剂在 Suzuki偶联反应中被广泛应用,用于构建碳碳键。
酶催化剂则具有高度的选择性和催化效率,在生物有机合成中具有不可替代的地位。
有机小分子催化剂如脯氨酸等,因其结构简单、易于制备和修饰,也受到了越来越多的关注。
催化剂的应用不仅能够提高反应的速率和选择性,还可以改善反应的条件,降低成本,减少环境污染。
以工业生产中的乙烯氧化制环氧乙烷为例,如果没有合适的催化剂,这个反应需要在非常高的温度下进行,不仅能耗巨大,而且容易发生爆炸等危险。
有机合成反应的催化剂和方法

有机合成反应的催化剂和方法有机合成反应是有机化学中的重要内容,它涉及到合成有机化合物的方法和催化剂选择。
催化剂在有机合成反应中起着至关重要的作用,能够加速反应速率、提高产率和选择性。
本文将介绍几种常见的有机合成反应的催化剂和方法。
一、金属催化剂金属催化剂在有机合成反应中应用广泛。
其中,过渡金属催化剂是最常见的一类。
它们能够通过配位或氧化还原反应参与反应过程,并提供一个活性中心,促进反应进行。
常见的过渡金属催化剂包括钯、铑、铂、铜等。
以钯催化的反应为例,钯催化的氢化反应是有机合成中的重要反应之一。
钯催化的氢化反应可以将不饱和化合物转化为饱和化合物,常用于合成药物、香料和高分子材料等。
此外,钯催化的交叉偶联反应也是有机合成中的重要方法之一,可以将两个不同的有机物通过碳-碳键的形成连接在一起。
二、酶催化酶是一类具有生物催化活性的蛋白质,能够在温和条件下催化特定的有机反应。
酶催化在有机合成中具有很高的选择性和效率。
例如,脱氢酶可以催化醇的氧化反应,将醇转化为酮或醛。
这种反应在合成药物和香料中广泛应用。
另外,酶催化的不对称反应也是有机合成中的研究热点,可以合成具有手性的有机分子。
三、非金属有机催化剂除了金属催化剂和酶催化外,还有一类非金属有机催化剂也在有机合成中发挥重要作用。
它们通常是有机小分子化合物,能够通过氢键、离子键或共价键与底物反应,催化反应进行。
非金属有机催化剂具有底物广泛性、高效性和可重复使用性的优点。
例如,有机碱是一类常见的非金属有机催化剂。
它们可以催化酯的加成反应、酰基转移反应和酯的酯交换反应等。
此外,有机酸也是一类常用的非金属有机催化剂,可以催化醇的酯化反应和酸催化的环化反应等。
四、辅助剂的应用在有机合成反应中,还常常使用一些辅助剂来提高反应效率和选择性。
辅助剂可以改变反应体系的酸碱性、溶剂极性和反应条件等,从而促进反应进行。
常见的辅助剂包括溶剂、碱和还原剂等。
溶剂的选择对反应速率和产率有很大影响。
L-脯氨酸衍生物催化的不对称Michael加成反应

L-脯氨酸衍生物催化的不对称Michael加成反应刘杰 (有机化学)摘要:有机小分子有着不含贵金属、温和、廉价、对环境友好等优点,其应用已成为催化领域的重要发展趋势。
有机小分子催化的不对称合成反应是目前研究最为活跃的领域之一。
Michael加成反应在有机合成中是一种非常重要的形成碳碳键的反应。
近来,许多手性小分子催化剂被用于催化不对称Michael加成反应。
脯氨酸作为一种结构简单而且含量丰富的手性小分子催化剂在多种不对称催化反应中表现出的非常好的催化性能。
本文的主要工作是从以下两个方面对脯氨酸衍生物催化的不对称Michael加成反应进行了研究:(1)设计并制备了四种Merrifield树脂负载的含脯氨酸单元的手性小分子催化剂,经过实验,发现其中一种在催化Michael加成反应时是非常有效的,当使用5 mol%的该催化剂来催化环己酮和取代硝基苯乙烯时,产率最高可以达到92 %,ee值最高可以达到98 %,d. r.值最高可以达到99:1。
另外该催化剂可以循环使用5次以上,产率上只有很小的减少,而ee值基本不发生改变。
(2)设计并制备了一种糖-四氢吡咯催化剂,通过“Click”反应将 D-glucose 骨架与四氢吡咯连接在一起,在催化 Michael 加成反应时取得了良好效果,仅需要10 mol%的催化剂,在无溶剂条件下室温下反应24小时,产率高达98 %,ee 值大于99 %,d. r.大于99:1。
以上结果与一些天然氨基酸催化的Michael加成反应相比,不仅提高了产率和立体选择性,而且扩大了底物的范围,增大了反应的广谱性。
另外,我们还对功能化离子液体系中发生的 Heck 反应进行了研究。
设计并制备了三种功能化离子液,其中一种在催化Heck反应时非常有效。
该离子液既可作为配体又可作为碱。
在优化条件下,产率较高,且循环六次产率基本没有发生改变。
关键词:有机小分子催化,不对称Michael加成反应,脯氨酸衍生物,Heck 反应,功能化离子液,Pd粉L-Proline’s derivatives Catalyzed AsymmetricMichael AdditionJie Liu(Organic Chemistry)Abstract:Organic catalysts without noble metals have played an important role in the development of the catalytic reaction, due to their moderate effect, cost efficiency, environment friendly and other advantages. Organocatalytic asymmetric reaction is an increasingly active area in oraganic sythesis.The Michael addition reaction is one of the most important carbon-carbon bond-forming reactions in organic synthesis. Asymmetric organocatalytic Michael addition has attracted intense interests in the recent few years due to its stability, cheapness and the generation of multiple chiral centers in a single step. Recently, quite a number of small chiral organic molecules have been developed as stereoselective catalysts for asymmetric Michael reactions. Proline has been gradually recognized as a simple, abundant and powerful chiral catalyst for many asymmetric reactions.In this context, Asymmetric Michael addition reaction is studied from two sides as following.(1) One of the four Merrifield resin-supported pyrrolidine-based chiral organocatalysts,through A3-coupling reaction linkage have been developed and found to be highly effective catalysts for the Michael addition reaction of ketones with nitrostyrenes. The reactions generated the corresponding products in good yields (up to 98 %), excellent enantioselectivies (up to 98 % ee) and high diastereoselectivities (up to 99:1 d.r.). In addition, the catalysts can be reused at least five times without a significant loss of catalytic activity and stereoselectivity.(2) A modular sugar-based pyrrolidine was prepared and was found to be a highly enantioselective and cooperative organocatalyst for asymmetric Michael addition of ketones to nitrostyrenes. In the presence of 10 mol% of the organocatalysts,a pyrrolidine unit anchored to a natural D-glucose backbone through click chemistry, the Michael additions of ketones to nitrostyrenes underwent smoothly to generate the corresponding adducts in good yields (up to 98 %), high enantioselectivities (up to >99 % ee) and excellent diastereoselectivities (up to >99:1 d.r.) under solvent-free reaction conditions.In contrast to the above catalysts, some natural amino acids catalyzed the Michael addition reactions in low yields and stereoselectivities, or the substrates are very limited.In addition, we made research on the study of Heck reaction in ionic liquids. A kind of amino-functionalized ionic liquids has been prepared and investigated as ligand and base for the Heck reactions between aryl iodides and bromides with olefins in the presence of a catalytic amount of Pd submicron powder in [Bmim]PF6. The reactions generated the corresponding products in excellent yields under mild reaction conditions. The generality of this catalytic system to the different substrates also gave the satisfactory results. The key feature of the reaction is that Pd species and ionic liquids were easily recovered and reused for six times with constant activity.Keywords: Organocatalysis, Asymmetric Michael addition reaction, proline’s derivates Heck reaction; functionalized ionic liquids; Pd submicron powder.目 录第一章研究背景 (2)1.1 不对称合成的意义 (2)1.2 不对称合成的方法 (3)1.3 手性催化法 (4)1.4 脯氨酸简介 (5)参考文献 (20)第二章 Merrifield树脂负载的脯氨酸衍生物催化的不对称Michael加成反应 (28)2.1 引言 (28)2.2 结果与讨论 (28)2.3 实验部分 (34)2.4 化合物的结构表征 (37)参考文献 (41)第三章糖-四氢吡咯催化不对称Michael加成反应的研究 (43)3.1 引言 (43)3.2 结果与讨论 (43)3.3 实验部分 (48)3.4 化合物的结构表征 (49)参考文献 (55)第四章功能化离子液体系中钯催化的Heck反应 (57)4.1 引言 (57)4.2 结果与讨论 (58)4.3 实验部分 (63)4.4 化合物的结构表征 (64)参考文献 (67)附I 部分化合物谱图 (70)附录II 硕士期间发表论文题录 (77)致 谢 (78)第一章 研究背景1.1 不对称合成的意义手性(chirality)一词源于希腊语,在多种学科中表示一种重要的对称特点。
新型手性双胍小分子催化剂
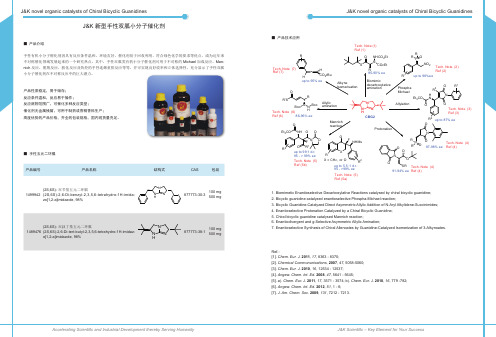
O R Allylic amination N Boc Boc N H Tech. Note (6) Ref (6) 86-96% ee O Et3 CO NH O O O NHMs
Biomimic decarboxylative amination
R3 H N
N N H
Mannich reaction
R O P NO 2 up to 96%ee O N O Tech. Note (3) Ref (3) R2 up to 87% ee R1 Tech. Note (2) Ref (2)
•
R 85-90% ee
产品性质稳定,易于储存; 反应条件温和,反应易于操作; 反应底物范围广,可催化多种反应类型; 催化剂无金属残留,可用于制药或香精香料生产; 高度优势的产品价格,齐全的包装规格,国内现货量充足。
N P O O Tech. Note (4) 87-98% ee Ref (4)
■ 手性五元二环胍
R2
N O F O R1 up to 99:1 d.r. 95 - > 99% ee Tech. Note (5) Ref (5b)
X R1 X = CH 2, or O up to 5.5 :1 d.r. 95 - >99% ee Tech. Note (5) Ref (5a)
Ref.: [1]. Chem. Eur. J. 2011, 17, 8363 - 8370; [2]. Chemical Commununications, 2007, 47, 5058-5060; [3]. Chem. Eur. J. 2010, 16, 12534 - 12537; [4]. Angew. Chem. Int. Ed. 2008, 47, 5641 - 5645; [5]. a). Chem. Eur. J. 2011, 17, 3571 - 3574; b). Chem. Eur. J. 2010, 16, 779 -782; [6]. Angew. Chem. Int. Ed. 2012, 51, 1 - 6; [7]. J. Am. Chem. Soc. 2009, 131, 7212 - 7213.
有机合成中的新型催化剂官能团官能团还原方法

有机合成中的新型催化剂官能团官能团还原方法催化剂在有机合成中扮演着至关重要的角色,能够促使反应进行并提高反应效率。
传统的催化剂官能团官能团还原方法在有机合成中起到了积极的作用,但随着研究的深入,科学家们发现了一些新型催化剂,为有机合成提供了更多选择。
本文将重点介绍有机合成中的新型催化剂官能团官能团还原方法。
一、金属有机催化剂官能团官能团还原方法金属有机催化剂被广泛应用于有机合成中,其官能团官能团还原方法也随之得到研究和发展。
常见的金属有机催化剂包括铂、钯、铜等。
以铂为例,其催化剂通常采用[PtCl2(PPh3)2]和氢气的反应来实现官能团官能团还原。
这种方法适用于多种反应,如亲电加成、硝基还原等。
而钯催化剂的官能团官能团还原方法多种多样,包括催化剂为[ Pd(PPh3)4 ]、[ PdCl2(PPh3)2 ]等的氢气反应,以及钯催化下的亲电还原、硼酸盐的还原等反应。
二、非金属有机催化剂官能团官能团还原方法除了金属有机催化剂外,非金属有机催化剂在官能团官能团还原方法的研究中也发挥了重要作用。
其中,碱金属催化剂和小分子有机催化剂是常见的类型。
碱金属催化剂如钠、锂等可用于官能团官能团的还原反应。
例如,钠法罗化的反应可以将酮类化合物还原成相应的醇类产物。
小分子有机催化剂如有机亚磷酰化合物、硅氢化合物等,在官能团官能团还原方法中也展现出了良好的催化活性。
它们可以与底物发生反应,提供所需的氢原子或电子,催化官能团官能团还原反应的进行。
三、纳米催化剂官能团官能团还原方法近年来,纳米催化剂在有机合成领域引起了广泛关注。
纳米催化剂具有特殊的形貌和结构,与传统催化剂相比具有更高的催化活性和选择性。
纳米金、纳米银等纳米金属催化剂被广泛应用于官能团官能团还原方法。
其高比表面积和丰富的活性位点使得纳米催化剂具有出色的催化性能。
此外,通过调节纳米粒子的尺寸和形状,还可以进一步优化催化反应的效果。
四、生物催化剂官能团官能团还原方法生物催化剂在有机合成中表现出了独特的优势,如高催化活性、温和反应条件和对环境友好等。
有机合成中的不对称催化方法

有机合成中的不对称催化方法不对称合成方法是有机合成领域中的重要研究方向之一。
在有机合成过程中,不对称催化方法能够有效地构建手性分子,为合成具有生物活性的化合物提供了重要的途径。
本文将对不对称催化方法在有机合成中的应用进行探讨。
一、不对称催化方法概述不对称合成是指利用手性催化剂,在化学反应中控制手性的生成。
目前,广泛应用的不对称催化方法包括手性配体催化、酶催化和有机小分子催化等。
手性配体催化是最常见的不对称催化方法之一。
手性配体与金属催化剂形成配合物,通过控制手性环境,实现对反应中的手性诱导。
这种方法应用广泛,不仅适用于碳碳键的构建,还适用于不对称氢化、不对称氧化和不对称复分解等反应。
酶催化是生物催化中一种重要的不对称合成方法。
酶具有高催化活性和良好的立体选择性,对于合成手性分子具有独特的优势。
目前,已经发现了许多催化活性高且具有不对称催化作用的酶。
有机小分子催化是近年来崛起的一种不对称催化方法。
有机小分子催化剂通过与底物形成非共价作用,实现对手性分子的合成。
这种方法不依赖于金属催化剂,具有较高的催化活性和立体选择性。
二、不对称催化方法的应用1. 酮的不对称加成反应不对称酮的加成反应是不对称合成中一类重要的反应。
利用手性配体催化剂,可以将有机酮与亲核试剂反应,构建手性α-羟基酮化合物。
这种反应广泛应用于天然产物的合成和药物合成中。
2. 不对称氢化反应不对称氢化反应是一种高效的不对称催化方法。
通过合成具有手性配体的均相催化剂,可以将不对称双键氢化为手性化合物。
此反应广泛应用于制药工业和天然产物的合成中。
3. 不对称烯烃复分解反应不对称烯烃复分解反应是一类重要的不对称合成方法。
通过合成具有手性配体的金属催化剂,可以将烯烃分解成手性化合物。
这种方法可以构建具有多个手性中心的化合物,是不对称合成中的关键方法。
4. 不对称氧化反应不对称氧化反应是一种重要的不对称合成方法。
通过合成具有手性配体的金属催化剂,可以将有机化合物氧化为手性化合物。
有机小分子催化合成高聚物的研究进展

h eai s i f a y ts u tr aayi a t t, ee t t a oy r o et . t erlt n hp o mls r cu ea dc tlt cii rs lcii dp lm e rp ris o c t n c v) v yn p e
C e g u6 0 4 ) h n d 1 0 1
Ab t a t sr c :Re e r h a v n e ea p ia in o r a o a ay i o y e n e i we e s a c d a c si t p l to f g n c t l ssi p lm rs t ss r n h c o n y h
有机 催化 剂 的发展 经 历 了一个 很 长 的历史 阶段 , 早 期 的氰离 子催 化安 息香 缩合 反应 到 从
近 期 发展 起来 的不对称 有机 催化 剂 催化 立 体选择 性 反应 , 类 催化剂 均 具有 很 高的催化 效 率 这 和 选 择性 。 与传 统 的金 属有 机催 化合 成 高聚 物方 法相 比, 机催 化剂 催 化 的聚合 反应 不仅条 有
剂 ,据C n o等 道,在醇 的引发下,这类催化剂在常温时的催化L 开环聚合 的转换频 on r 报 A
率 (O ) 1 , 已经 与活 性最 高 的金 属催 化剂相 媲 美 。另 外 ,这类 催 化剂 不仅 活性 高 ,而 T F为 8S ~
且 能 得 到P < .6 L DI 11 的P A,反应 为 活 性开环 聚 合 ,可 以较 为 方便 的合 成嵌 段共 聚物 。双 功 能 硫 脲 一胺 i催化L ’ l A的开 环聚 合 可 以得 到分 子量 可控 , 分子量 分 布 , 窄 由引 发 的醇封 端 的P A。 L
有机合成中的碳氢活化反应研究

有机合成中的碳氢活化反应研究有机合成是有机化学的重要分支,研究如何通过合成有机化合物来满足人类社会需求。
在有机合成中,碳氢活化反应是一种重要的反应类型,它可以将碳-氢键转化为碳-碳键或碳-氧键,从而构建有机化合物的骨架。
碳氢活化反应的研究可以追溯到20世纪80年代,当时德国化学家Franz Heinemann首次报道了一种将苯环上的氢原子转化为亚甲基的反应。
这个研究开创了碳氢活化反应的新方向,也为后续的相关研究提供了重要的基础。
在碳氢活化反应中,有机小分子通常是一个可溶剂、催化剂或反应底物。
这意味着有机小分子在反应中发挥着至关重要的作用。
例如,有机小分子可以提供氢原子或促进反应的进行。
近年来,许多有机小分子催化剂被用于碳氢活化反应的研究中。
这些催化剂可以诱导碳氢键的活化,并促使碳-氢键的断裂和新键的形成。
其中,过渡金属配合物是一类常用的有机小分子催化剂,它们具有良好的空间结构和电子特性,能够与底物分子发生有效的相互作用。
此外,碳氢活化反应还可以利用氧、氮等原子为底物引入新的官能团。
碳氢活化反应在有机合成中具有重要的应用价值。
首先,它可以构建复杂有机化合物的骨架,从而扩展了有机合成的范围。
其次,碳氢活化反应可以节约原料和能源的消耗,减少环境污染。
例如,通过碳氢活化反应合成化学药物,可以降低合成成本,提高药物的产量和质量。
有机合成中的碳氢活化反应还面临着一些挑战。
首先,选择性的碳氢活化仍然是一个难题。
由于有机化合物中碳氢键的种类和位置非常多样,选择性地活化特定的碳氢键仍然存在困难。
其次,反应条件的优化也是一项挑战。
碳氢活化反应通常需要较高的温度和压力,这对反应的控制和操作都提出了要求。
此外,有机小分子催化剂的设计与合成也是一个重要的研究方向。
目前,大多数催化剂的设计仍然是基于经验和试错的方法,对于催化剂的性能和反应机理还不完全了解。
为了解决上述挑战,科学家们正在开展碳氢活化反应的深入研究。
他们通过理论计算、实验设计和反应机理的分析,探索新的催化剂和反应体系,以实现高效、选择性的碳氢活化反应。
有机催化类型-概述说明以及解释

有机催化类型-概述说明以及解释1.引言1.1 概述有机催化是一种重要的催化类型,它在有机化学和有机合成领域发挥着重要的作用。
有机催化通过引入一个有机催化剂,可以促使化学反应的进行,在反应速率、选择性和产率上发挥关键作用。
有机催化剂是一种有机化合物,它能够与底物反应,并在反应过程中发生化学变化,从而促进反应进程的进行。
有机催化可以被广泛应用于各种有机合成反应中,包括碳-碳键和碳-氧键的形成、环化反应、氧化反应等。
与传统的无机催化剂相比,有机催化剂具有更好的底物兼容性、反应条件温和以及选择性高等优点。
这些优势使得有机催化成为合成有机分子的重要工具。
有机催化可以根据催化机理的不同进行分类。
常见的有机催化类型包括质子酸、质子碱、路易斯酸、路易斯碱、氢键和氢化合物等。
每种类型的有机催化剂都有其特殊的反应机制和适用范围。
因此,深入理解不同类型的有机催化对于设计和优化有机合成反应具有重要意义。
本文将进一步探讨有机催化的定义、作用以及分类,并介绍有机催化反应的机理和应用。
通过对有机催化的研究和了解,我们可以更好地利用有机催化来推动有机合成的发展,为化学领域的进一步创新和发展做出贡献。
1.2 文章结构文章结构:本文分为引言、正文和结论三个部分。
引言部分包括概述、文章结构、目的和总结四个方面。
首先,概述介绍了本文探讨的主题,即有机催化类型。
然后,文章结构说明了本文的组织结构,即引言、正文和结论三个部分。
接着,目的详细说明了本文的研究目标和意义。
最后,总结部分对整篇文章进行了简要的总结和归纳。
正文部分主要分为三个小节,分别是有机催化的定义和作用、有机催化的分类和有机催化反应机制。
首先,有机催化的定义和作用部分详细介绍了有机催化的概念和在化学反应中的作用。
其次,有机催化的分类部分将不同类型的有机催化进行了系统的分类和说明,包括金属有机催化剂、小分子有机催化剂等。
最后,有机催化反应机制部分探讨了有机催化反应的具体机制和关键步骤,为读者提供了更深入的理解。
【国家自然科学基金】_有机小分子催化剂_基金支持热词逐年推荐_【万方软件创新助手】_20140802
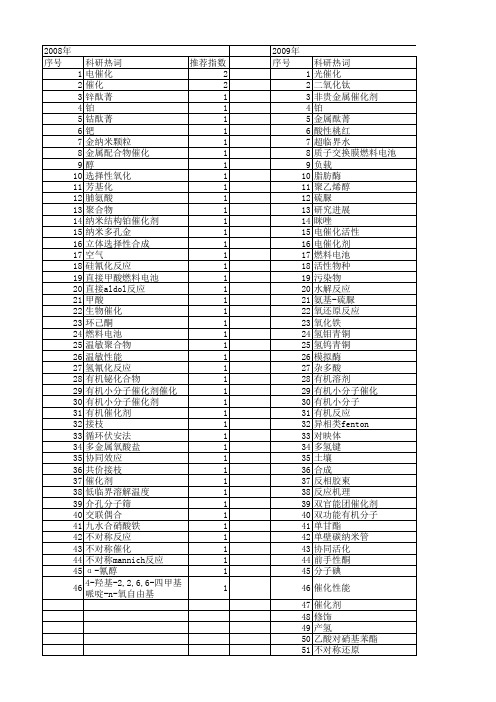
1 1 1 1 1 1 1
2011年 科研热词 光催化 降解 铁席夫碱 负载哌啶 脯氨酸酰肼 矿化 烯酮 橙黄ⅱ 树状分子 极性反转 有毒有机污染物 有机小分子催化剂 有机催化剂 有机催化 手性氨基亚磺酰胺 手性伯胺 席夫碱铁 工业废催化剂 小分子催化 复合物 分子识别 催化氧化 催化 不对称硅氢化 不对称催化 tio2 n-苯基酮亚胺 n-杂环卡宾 henry反应 h2o2 fepcs-tio2 cross-aldol反应 aldol反应 a-羟基酸 推荐指数 3 1 1 1 1 1 1 1 1 1 1 1 1 1 1 1 1 1 1 1 1 1 1 1 1 1 1 1 1 1 1 1 1 1
2010年 序号 1 2 3 4 5 6 7 8 9 10 11 12 13 14 15 16 17 18 19 20 21 22 23 24 25 26 27 28 29 30 31 32 33 34 35 36 37 38 39 40 41 42
科研热词 光催化 羟基自由基 对映选择性 高级氧化技术 静电纺丝 降解效率 降解 铝柱撑蒙脱石 铁离子 金属卟啉 量子点 超氧自由基 超声沉淀 羟基铁 羟基 绿色化学 纳米纤维 离子液体 甲醛降解 甲基红 活性艳蓝kn-r 活性艳红x-3b 氧化还原电位 有机污染物 强电离放电 可见光 双官能团有机催化 光强 光催化降解 光催化剂 催化剂投加量 催化剂循环 二氧化钛 不对称有机催化 不对称合成 不对称催化 zns tio_2 tio2 mnpcs-tio2@sio2 michael加成反应 bi掺杂
科研热词 推荐指数 有机催化 2 对映选择性 2 制备 2 不对称硅氢化 2 非金属有机催化剂 1 钛催化体系 1 酶学性质 1 进展 1 过硫酸钾 1 赤铁矿 1 表面展示 1 萨尔干页岩 1 羟基自由基 1 纳米三氧化钼 1 空间受限lewis酸碱对 1 磺酸盐 1 破乳性能 1 研究进展 1 矿化 1 疏棉状嗜热丝孢菌脂肪酶 1 界面张力 1 甲醇氧化 1 燃料电池 1 烯酮 1 烃源岩 1 活性炭 1 活化机理 1 水源水 1 氨基膦氧 1 毕赤酵母 1 模板剂 1 柯坪 1 有机硅破乳剂 1 有机硅烷 1 有机小分子催化剂 1 有机小分子催化 1 有机催化剂 1 扬水曝气 1 扩散 1 手性亚砜 1 微污染物 1 形貌 1 异相类fenton 1 应用 1 小分子活化 1 对苯二酚 1 合成 1 可接近性 1 双吲哚甲烷衍生物 1 去合金化 1 原位电化学红外光谱 1 印干页岩 1
有机小分子催化讲解

有机⼩分⼦催化讲解引⾔⾃从2000年以来,在Benjamin. List,Carlos F. Barbas III和David W. C. MacMillan 等⼈推动之下,有机催化(Organocatalysis)开始了伟⼤的复兴。
也就是从那时候开始我对这⼀领域产⽣了浓厚的兴趣,阅读了不少⽂献。
从本贴开始,将以回复的形式介绍有机催化领域的经典⽂献。
希望能对chem8er有点帮助。
本贴是为chem8⽽写,转贴请注明出处。
⾸先,罗列⼀些⽂献。
以下⽂献都是review,不是原始⽂献。
要想对此领域有深⼊的了解还是要读原始⽂献⽐较好。
专著两本:a) A. Berkessel, H. GrQger, Asymmetric Organocatalysis: From Biomimetic Concepts to Applications in Asymmetric Synthesis, Wiley-VCH, Weinheim, 2005; b)Enantioselective Organocatalysis (Ed.: P. I. Dalko) Wiley-VCH, Weinheim, 2007。
这两本书书籍中⼼都有。
专刊两期:Acc. Chem. Res. 2004. 37, 487-621;Chem. Rev. 2007, 107, 5413-5883。
每期⼤概⼗篇⽂章,包括了organcatalyst的各个分⽀。
零散的review很多,简单罗列⼀下,不是很全。
特别是专门介绍某⼀分⽀的review 没有列出,否则太多了。
a) P. I. Dalko, L. Moisan, Angew. Chem. Int. Ed. 2001, 40, 3726-3748; b) E. R. Jarvo, S. J. Miller, Tetrahedron 2002, 58, 2481-2495; c) B. List, Tetrahedron 2002, 58, 5573-5590; d) P. I. Dalko, L. Moisan, Angew. Chem. Int. Ed. 2004, 43, 5138-5175; e) J. Seayad, B. List, Org. Biomol. Chem. 2005, 3, 719-724; f) B. List, Chem. Commun. 2006, 819-824; g) M. Marigo, K. A. J?rgensen, Chem. Commun. 2006, 2001-2011; h) F. Cozzi, Adv. Synth. Catal. 2006, 348, 1367-1390; i) M. J. Gaunt, C. C. C.Johansson, A. McNally, N. T. V o, Drug Discovery Today 2007, 12, 8-27; j) R. M. de Figueiredo, M. Christmann, Eur. J. Org. Chem. 2007, 2575-2600; k) D. Enders, C. Grondal, M. R. M. HRttl, Angew. Chem. Int. Ed. 2007, 46, 1570-1581; l) A. Ting, S.E. Schaus, Eur. J. Org. Chem. 2007, 5797-5815;m) S. B. Tsogoeva, Eur. J. Org. Chem. 2007, 1701-1716; n) A. G. Doyle, E. N. Jacobsen, Chem. Rev. 2007, 107, 5713-5743; o) C.F. Barbas III, Angew. Chem. Int. Ed. 2008, 47, 42-47; p) A. Dondoni, A. Massi, Angew.Chem. Int. Ed. 2008, 47, 4638-4660。
有机合成中的手性催化构建手性分子的新策略

有机合成中的手性催化构建手性分子的新策略随着化学合成的不断发展,有机合成中手性分子的合成变得越来越重要。
手性分子具有非对称性质,广泛应用于医药、农化、材料等领域。
而手性催化是一种有效的手性分子合成方法,其在有机合成中起到了至关重要的作用。
手性催化是指通过手性催化剂以及不对称反应中的手性转移,实现对反应物手性的控制。
通过手性催化反应,可以以高选择性和高产率构建手性分子。
在有机合成中,手性催化已经成为合成手性分子的重要策略之一。
近年来,研究人员不断推出新的手性催化构建手性分子的策略,以满足合成复杂手性分子的需求。
以下将介绍几个重要的手性催化策略。
1.不对称氢键催化不对称氢键催化是近年来发展较快的一种手性催化方法。
通过合理设计手性催化剂,可以实现对不对称反应物的高度选择性转化。
这种手性催化方法具有反应条件温和、立体选择性好等特点,广泛应用于手性分子的合成中。
2.金属催化手性反应金属催化手性反应是指通过配合物催化剂的金属中心实现对手性反应物的选择性转化。
金属催化手性反应具有反应条件温和、底物适用范围广等特点,广泛应用于手性骨架、手性环等手性分子的合成中。
3.有机小分子催化有机小分子催化是指通过有机小分子作为催化剂实现手性分子合成的方法。
这种手性催化方法具有反应条件简单、高催化活性、对空气和水稳定等特点,在手性分子的合成中具有广泛应用前景。
4.光催化手性反应光催化手性反应是通过光照的作用下实现手性分子的合成。
这种手性催化方法具有反应条件温和、对光照条件要求低等特点,可以实现对手性反应物的高选择性合成。
5.电催化手性反应电催化手性反应是指通过电流作用下实现手性分子的合成。
这种手性催化方法具有反应条件温和、对电流条件要求低等特点,可以实现对手性反应物的高选择性合成。
总之,手性催化构建手性分子的新策略在有机合成中发挥着重要作用。
通过不断研究和创新,可以提出更多高效、高选择性的手性催化方法,为合成复杂手性分子提供更多选择。
有机小分子催化

有机小分子催化
有机小分子催化是一种利用具有定向性和高选择性分子催化剂进行化学反应加速的技术。
这种技术已经在许多有机合成中取得了广泛应用,例如生物有机化学、药物合成和材料科学等领域。
在有机小分子催化中,催化剂通过与底物形成配合物来催化反应。
这些催化剂通常含有金属离子、碳-氢键活化剂和氢键接受剂等化学功能团,它们可以快速地促进底物之间的反应。
此外,这些催化剂通常具有高度的立体选择性,可以有效地加速反应,同时减少副反应的产生。
有机小分子催化的优势在于其对绿色化学技术的支持。
相对于其他化学合成技术,有机小分子催化可以减少废弃物的产生和减少对环境的污染。
此外,它还具有很高的经济效益,可以提高化学反应的产率和减少合成的成本。
总之,有机小分子催化技术具有广泛的应用前景,在化学反应的过程中能够达到高效、高选择性、环保的效果。
有机小分子催化

有机小分子催化有机小分子催化是一种重要的化学反应过程,它在有机合成中起着至关重要的作用。
通过催化剂的作用,有机小分子可以被转化为更加复杂的有机化合物,拓展了有机合成的可能性。
本文将从催化剂的种类、催化机理以及应用领域等方面进行探讨。
一、催化剂的种类有机小分子催化剂种类繁多,根据其化学性质可以分为酸性催化剂和碱性催化剂。
酸性催化剂如硫酸、盐酸等可以通过质子给予电子的方式促进反应进行,而碱性催化剂如氢氧化钠、碳酸钠等则能够通过接受电子的方式催化反应。
此外,还有一类特殊的催化剂,即金属有机催化剂,它们可以通过金属离子的作用促进反应的进行。
二、催化机理有机小分子催化过程中的机理多种多样,下面以酸性催化为例进行介绍。
在酸性催化剂的作用下,有机小分子首先与质子发生反应,生成质子化的中间体。
这个中间体具有更高的反应活性,可以与其他分子发生进一步的反应。
在反应过程中,催化剂不参与化学反应,只是提供一个合适的环境,降低反应的活化能,加速反应的进行。
三、应用领域有机小分子催化在有机合成中有着广泛的应用。
例如,在药物合成领域,催化剂可以促进反应的进行,提高反应的产率和选择性。
此外,有机小分子催化还可以应用于材料合成、精细化工等领域,拓展了化学合成的范围。
四、实例分析以酸性催化为例,我们来看一个具体的实例。
酸性催化可以促进醇和醛的缩合反应,生成醚化合物。
这个反应在有机合成中具有重要的意义。
通过选择合适的酸性催化剂,可以在温和的条件下实现醇和醛的缩合,避免了传统的缩酮反应中的高温和高压条件。
这种反应在制药工业中有着广泛的应用,可以高效地合成复杂的有机化合物。
总结:有机小分子催化是一种重要的化学反应过程,通过催化剂的作用,可以将简单的有机小分子转化为更加复杂的有机化合物。
酸性催化剂、碱性催化剂以及金属有机催化剂是常见的催化剂种类。
在催化过程中,催化剂通过提供一个适宜的环境,降低反应的活化能,加速反应的进行。
有机小分子催化在药物合成、材料合成等领域有着广泛的应用。
有机合成中的手性催化方法研究

有机合成中的手性催化方法研究手性催化方法是有机合成中的一种重要策略,可以有效合成手性化合物。
在有机合成中,手性分子的合成具有广泛的应用,对于制药、农药、材料科学等领域具有重要意义。
本文将重点研究有机合成中的手性催化方法,探讨其原理和应用。
一、手性催化方法的基本原理手性催化方法是通过手性催化剂引导反应发生高度立体选择性的情况下进行的合成方法。
手性催化剂可以将底物有机分子与催化剂形成手性诱导的中间体,通过对该中间体进行一系列的转化反应,最终得到手性产物。
手性催化方法的基本原理可以分为两类:空间位阻和化学诱导。
空间位阻是指手性催化剂与底物之间的空间障碍效应,使得反应只能在特定的立体构型下进行,从而实现手性产物的合成。
化学诱导是通过手性催化剂与底物之间的相互作用,引发反应的立体选择性。
二、手性催化方法的分类手性催化方法可以根据催化剂的类型进行分类,包括金属有机催化、有机小分子催化和小分子模板催化等。
1. 金属有机催化金属有机催化是一种常用的手性催化方法。
金属有机催化剂通常是含有手性骨架的有机金属化合物,如手性金属螯合物。
它们可以与底物形成配位化合物,通过金属中心的催化作用促进反应的进行。
金属有机催化方法在不对称亲核取代、不对称羰基化反应等方面具有广泛的应用。
2. 有机小分子催化有机小分子催化是一种使用手性有机小分子作为催化剂的手性催化方法。
这类催化剂通常是通过简单的化学合成得到,具有较高的反应效率和选择性。
有机小分子催化方法在不对称氢化、不对称亲电取代等反应中表现出良好的催化活性。
3. 小分子模板催化小分子模板催化是一种基于手性非共价识别的手性催化方法。
催化剂通过与底物形成非共价相互作用,通过识别底物的手性信息,促使反应发生立体选择性。
小分子模板催化方法在不对称醇酸酯化反应、不对称氨基酸合成等方面具有重要应用价值。
三、手性催化方法的应用手性催化方法在有机合成中具有广泛的应用。
通过手性催化方法可以合成大量具有生物活性和工业应用价值的手性化合物。
有机小分子催化的不对称羟醛缩合反应

2006年第26卷有机化学V ol. 26, 2006第5期, 618~626 Chinese Journal of Organic Chemistry No. 5, 618~626* E-mail: zhaoguo@Scheme 1色化学要求. 本文就对近年来发展的有机小分子催化的不对称羟醛缩合反应予以介绍.No. 5姜丽娟等:有机小分子催化的不对称羟醛缩合反应6191 非水相中的不对称羟醛缩合反应1.1 脯氨酸及其衍生物 1.1.1 L -脯氨酸早在20世纪70年代, Hajos [3a]和Eder [3b]就发现脯氨 酸能够催化分子内的羟醛缩合反应, 并具有高度的对映异构体选择性和较高的化学产率. 该反应还被人们用来合成许多有用的化合物[4], 特别是用于类固醇和许多天然产物的合成中[5]. 后来有关这方面的研究鲜有报道. 直到2000年, Barbas 和List 等[6]报道了脯氨酸催化的分子间不对称羟醛缩合反应, 并进行了深入的研究(Eq. 1), 大大拓宽了这一反应的应用前景.Barbas 研究小组[6a]首先以丙酮和对硝基苯甲醛作为反应物, 研究了各种氨基酸对此反应的催化能力(表1). 研究结果表明: 五元环效果最好, 四元环次之, 六元环活性很低, 而非环状结构的普通氨基酸几乎没有催化活性. 把羧基变成酰胺也不发生反应, 这说明羧基的质子在催化反应中也起了关键作用.作者由此对脯氨酸催化反应的机理进行了假设(Scheme 2), 认为脯氨酸类似于醛缩酶(micro-aldo-ase)的功能, 它不仅提供亲核的氨基基团, 而且羧基可作为一种酸/碱助催化剂, 可以促进机理中每一个单独步骤, 包括: (a)氨基的亲核进攻, (b)醇氨中间体的脱水, (c)亚胺的脱质子化作用, (d)碳—碳键形成, (e, f)亚胺-醛中间表1 氨基酸催化的丙酮和对硝基苯甲醛的羟醛缩合反应 Table 1 Amino acids catalyzed asymmetric aldol reaction of acetone with 4-nitrobenzaldehyde Entry Catalyst Yield/% ee /%1(L )-His, (L )-Val (L )-Tyr, (L )-Phe<10N.d.2<10 N.d.355 40468 765<10N.d.6<10 n.d.767 73物的水解. 近年来陆续有文献对此反应机理进行报道[7], 通过计算等多方面研究, 证实了这种独特新颖的不对称羟醛缩合反应可能是通过上述烯胺机理进行的.2002年, MacMillan 等[8]进一步研究了醛与α-位无取代的醛进行的分子间缩合反应, 也得到较好的结果. 从表2中, 我们可以看出, 产物的ee 值普遍较高, 但反应的非对映选择性受作为电子受体的醛的影响较大,用Scheme 2620有 机 化 学 V ol. 26, 2006表2 脯氨酸催化的醛与醛的分子间羟醛缩合反应Table 2 The proline-catalyzed cross-aldol addition reaction ofaldehydesEntry R R' Yield/% Anti ∶Syn ee /% (anti )1 Me Et 80 4∶1 99 2 Me t -Bu 88 3∶1 97 3 Me c-C 6H 11 87 14∶1 99 4 Me Ph 81 3∶1 99 5 n -Bu i -Pr 82 24∶1>996n -Bui -Pr 80 24∶1 987 Bn i -Pr 75 19∶1 91异丁醛作为电子受体时, 反应的非对映选择性明显要比其它醛作为电子受体时高.近年来有关脯氨酸催化的反应的报道更是层出不穷[9,10], 在多种不对称催化反应中都表现出非常好的催化性能. 值得一提的是, 最近MacMillan 研究小组[11]把它用在了高对映选择性地合成六碳糖中. 在生物体的各种复杂过程(如信号转换、识别及免疫响应等)中, 六碳糖都起了非常重要的作用, 但是目前还很少有化学方法能够有效合成六碳糖和各种多聚糖, 特别是如何选择性地构建这些单糖中的五个羟基成为合成化学的一个挑战. 作者应用脯氨酸不对称催化羟醛缩合反应, 不仅两步合成六碳糖(Scheme 3), 而且通过选择不同的Lewis 酸和溶剂, 可以有选择地合成不同的糖类(Scheme 4).这类aldol 反应的应用使糖类合成的步骤大大简化, 将极大地促进药物化学和生命科学的研究.(A) Step 1: Proline-catalyzed enantioselective dimerization ofα-oxyaldehydes; (B) Step 2: Mukaiyama aldol-carbohydrate cycli-zation.Scheme 3(A) Step 1: The enantioselective dimerization of α-oxyaldehydes; (B) Step 2: The Lewis acid-mediated Mukaiyama aldol-carbohydrate cycli-zation.Scheme 4No. 5姜丽娟等:有机小分子催化的不对称羟醛缩合反应6211.1.2 脯氨酸衍生物张雅文等[12,13]在研究Aldol 反应中发现, 若在四氢吡咯环的3-位引入取代基, 对催化性能影响不大, 而5-位取代会使催化能力大大降低, 乃至丧失. 而研究4-位取代的脯氨酸的催化活性(Scheme 5), 取得了一些很好的结果. 由于取代基的引入使催化剂的溶解性增强, 催化剂的用量明显降低(2 mol%). 温度在-25 , ℃可以得到较高的产率(81.3%)和较好的ee 值(89.7%). 同时由于溶剂是丙酮, 后处理也更为方便.Scheme 5除了手性氨基酸外, 还有其它一些对脯氨酸进行修饰的有机小分子也能够催化不对称羟醛缩合反应. Berkessel 等[14]根据苯磺酰胺基团在药物化学中被称为羧酸基的生物等价体(bio-isoster), 合成了如表3所示的催化剂, 并得到较好的催化效果, 在 5 mol%的催化量下, 反应可以达到98%的ee 值. 并且此类催化剂的磺酰胺基团具有很好的可调节性, 可以通过改变苯环上的取代基来改变催化剂的电子效应和空间效应, 调节反应的对映选择性. 作者还通过X 射线结构分析, 得出此羟醛缩合反应可能的过渡态, 如Scheme 6.Scheme 6龚流柱等[15]报道了由脯氨酸和β-氨基醇合成的酰胺可以高效地催化丙酮和芳香醛以及脂肪醛的羟醛缩合反应. 对于丙酮和硝基苯甲醛的反应(表4), 在室温下, 丙酮为溶剂, 可得到89%的产率, ee 值为69%. 在 -25 ℃下, 虽然产率有所下降(66%), 但ee 值可以提高到93%. 而与脂肪醛反应能达到高于99%的ee 值, 这说明该催化剂与脯氨酸相比, 具有更高的活性和更好的对映选择性. 作者还通过理论计算对其过渡态进行研究, 说明了它所催化的Aldol 反应具有的高度对映选择性原因: 催化剂6在上述反应过程所形成的过渡态与脯氨酸催化的过渡态基本一致, 所不同的是催化剂6中的氨基表 3 不同溶剂中磺酰胺催化的丙酮和对硝基苯甲醛的羟醛缩合反应Table 3 Sulfamides catalyzed direct aldol reaction between acetone and p-nitrobenzaldehydeCatalyst and ee (Yield)/% of Products Solvent3 4 5 L -proline DMSO 93 (98)92 (98) 92 (73) 72 ( 68) Methanol 54 (62)70 (97) 69 (40) 37 (87) THF 93 (73)90 (62) 86 (98) 69 (92) Acetone 93 (98)71 (98) 90 (98) 67 (97) Chloroform85 (58)78 (95)88 (54)59 (97)表 4 手性有机催化剂6催化的丙酮和醛的羟醛缩合反应Table 4 Direct aldol reactions of acetone catalyzed by chiral organic catalyst 6Entry Aldehyde Yield/%ee /%1 4-NO 2C 6H 4CHO 66 932 3-NO 2C 6H 4CHO 63 87 3 4-BrC 6H 4CHO 77 904 PhCHO 51 835 c -C 6H 11CHO 85 976 (CH 3)2CHCHO 43 98 7t -BuCHO 51 >998 CH 3CH 2CHO1787键较短, 起了主要作用.作者[16]又对不同的手性β-氨基醇所形成的酰胺进行尝试, 发现具有吸电子基团的亚胺比具有供电子基团的亚胺催化效果更好, 只需2 mol%的催化量, ee 值都在96%以上. 例如以丁酮为底物, 虽然有两个产物生成, 但ee 值都达到98%以上(Eq. 2).622有 机 化 学 V ol. 26, 2006肖文精等[17]报道了另一种酰胺8对环戊酮和各种芳香醛进行不对称催化, 优化反应条件, 能以较高产率和ee 值得到反式产物(Eq. 3).1.2 手性二胺-质子酸催化剂脯氨酸在催化羟醛缩合反应时, 由于脱水产物不可避免, 所以产率不高. 为了提高反应的有效性, Yama-moto 等[18]研究了另一种催化羟醛缩合反应的环境友好的有机小分子催化剂: 手性二胺-质子酸催化剂. 作者对此类催化剂进行了深入研究, 首先确定二胺和质子酸的比例, 实验表明1∶1是最好的, 大于或小于都会大幅度地降低反应速率. 接着在对质子酸的研究中发现反应速率随质子酸的酸性增强而加快, 丙酮是最好的反应溶剂. 通过对不同类型的二胺进行考察, 认为二级和三级胺是效果最好的(Scheme 7). 作者先考察了丙酮和对硝基苯甲醛的羟醛缩合反应, 发现反应2 h 即达到60%的产率和88%的ee 值. 接着发现环酮与对硝基苯甲醛的反应产率也很高(88%~97%).该反应的机理还在研究中, 分析过渡态的可能构型如Scheme 8所示.1.3 非天然手性仲胺催化剂以往的有机小分子催化剂都是建立在天然产物, 如氨基酸、生物碱的基础上的, 在结构的改变上有一定的局限性, 并且在活性和选择性方面都有一定局限性. 例如脯氨酸及其衍生物在与缺电子的芳香醛反应时易形Scheme 7Scheme 8成亚氨盐, 使得所需催化剂的用量大增. 为了解决这些问题, Maruokat 等[19]设计并合成了一类完全不同的新的催化剂: 手性仲胺氨基酸(Scheme 9), 这类高效的催化剂为人们研究Aldol 反应开创了一种新的思路.Scheme 9在5 mol% 催化量下, 这类催化剂催化丙酮和对硝基苯甲醛反应的产率为70%, ee 值为93%, 而同样条件下, 脯氨酸催化下的产率很低(18%), ee 值也不高(71%)(表5). 反应也可以扩展到各种不同的芳香醛和脂肪醛, 而且它们产物的ee 值都非常高(>95%). 作者还通过计算说明了催化剂(S )-16中氨基和羰基之间的距离比脯氨酸的长, 过渡态中的氢键较易形成, 这可能决定了它的高活性和高对映选择性.表5 手性氨基酸催化的直接不对称羟醛缩合反应Table 5Direct asymmetric aldol reaction catalyzed by chiral amino acidsEntry Catalyst Solvent Yield/% ee /% (Conf.)1 (S )-16 DMSO 70 93 (R ) 2L -Proline DMSO 1871 (R )3 (S )-16 CH 3CN 32 95 (R )4 (S )-16 NMP 78 94 (R )5 (S )-16 DMF 82 95 (R )No. 5 姜丽娟等:有机小分子催化的不对称羟醛缩合反应6232 水相中的不对称羟醛缩合反应2.1 吡咯烷-四唑Yamamoto[20]报道了一种能催化水溶性醛如三氯乙醛与酮的Aldol反应的催化剂(Eq. 4), 得到85%的产率和84%的ee值. 当催化剂17用量为5 mol%, 并加入100 mol%水时, 反应的产率为85%, ee值为84%, 而无水条件下, 经过60 h, 反应基本不发生. 更为有趣的是作者还发现当含水量超过100 mol%时, 水含量增加(200 mol%或500 mol%), 产物的ee值也随之增加(92% ee或94% ee), 而脯氨酸的反应就很慢(46 h反应产率约为10%). 底物酮还可以进一步扩展(表6).表6 催化剂17催化的各种酮与三氯乙醛-水化物的羟醛缩合反应Table 6Reaction of various ketones with chloral monohydrate in the presence of 17Entry Ketone Temp./℃t/h Yield/%ee%1 40 24 79 972 30 24 93 823 30 36 91 824 30 24 55 865 40 48 72 886 40 96 76 917 40 96 83912.2 小肽与脯氨酸相比, 小肽中更多的有效原子决定了其结构和功能的多样性. 实验表明[21], 表7中所示的小肽是一个非常高效的催化剂. 用 1 mol%的催化剂催化丙酮和对硝基苯甲醛的反应, 在室温下4 h就能得到99%的产率和80% ee, 而同样条件下脯氨酸为68%(产率)和76% (ee值). 并且反应在-20 ℃时, ee值还可以提高10%. 龚流柱等[22]也考察了小肽用于羟基酮和醛的催化反应, 通过进一步优化条件而得到以手性1,4-二醇为主要产物(Eq. 5), 这是其它催化剂无法得到的. 其反应机理还在研究中.表7 小肽催化的羟醛缩合反应Table 7Aldol reactions catalyzed by peptides1 mol% catalyst 30 mol% proline Entry RYield/%ee/% (Conf.) Yield/%ee/% (Conf.)1 4-NO2C6H499 80(S) 68 76(R)2 Ph 69 78 (S) 62 60(R)3 c-Hexyl 66 82(S) 63 84(R)4 i-Pr 7979(S)97 96(R)624有 机 化 学 V ol. 26, 20062.3 吡咯烷-咪唑Vincent 等[23]开发了一种能催化羟醛缩合反应的吡咯烷-咪唑催化剂(BIP). 如表8所示, 与脯氨酸催化相同的条件下, 仅得到40%的产率和44%的ee 值, 但当有酸加入时, 反应的速率和产率大幅度提高(Entries 2, 3 vs 1). 溶剂、温度及所加的质子酸都是影响反应的重要因素, 如Entry 11, 2 mol%的BIP/TFA 催化剂用量, 丙酮为溶剂, 可以得到87%的产率和82%的ee 值. 它的另一个显著优点是反应只需用等量的酮和醛, 而在脯氨酸催化中, 酮需大大过量. 另外, 作者还发现配体BIP 与Lewis 酸如Zn(OTf)2也能够有效催化Aldol 反应(Entry 15), 由此说明此类配体也可以作为金属不对称催化的潜在的双齿配体. 与脯氨酸相比, BIP-TFA 催化剂的高效性主要是由于具有两个潜在的亲核位置, 分析可能的过渡态构型(Scheme 10). 这类催化剂的应用使我们意识到: 可以通过对配体结构的修饰来不断提高不对称催化反应的产率和对映选择性. 2.4 生物碱Janda 研究小组[24]发现烟碱代谢物(nornicotine)与脯氨酸在结构上具有相似性(Scheme 11), 因此开始研究Scheme 10Scheme 11它对羟醛缩合反应的催化作用. 实验表明: 在与脯氨酸催化丙酮和对硝基苯甲醛反应相同的条件下并未得到产物, 可是在磷酸盐水溶液中, 产率达81%, 反应没有明显的脱水产物和其它副产物. 更有趣的是, 在接近生理pH 7.5~8才能表现最好的催化活性. 后来, Noodle-man 等[25]运用动力学和计算机技术对其催化机理进行深入研究, 它与脯氨酸催化有明显不同(Scheme 12). 通常在分析这类反应的烯胺机理时, 都认为反应过程中形表8 BIP 催化的丙酮和对硝基苯甲醛的羟醛缩合反应Table 8 BIP catalyzed direct aldol reaction between acetone and p-nitrobenzaldehydeEntry BIP/mol% Acid (mol%) T /℃ Solvent Time/h Yield/% ee /%1 30— 20 DMSO 8 40 442 20 AcOH (100) 20 DMSO 0.5 65 503 20 AcOH (30) 20 DMSO 1 65 464 20 AcOH (20) -20 DMSO 4 65 54 5 20 AcOH (20) -20 DMF 24 61 756 20 AcOH (20) -20 THF 8 70 647 20 AcOH (20) -20 CH 2Cl 2 18 92 36 8 20 AcOH (20) -20 Acetone478 62 9 20 TFA (20) -20 Acetone 18 86 82 10 10 TFA (10) -20 Acetone 24 95 80 11 2 TFA (2) -5 Acetone 24 87 82 12 20 TfOH (20) -20 Acetone 24 84 80 13 20 TFA (20) -5 THF 24 67 82 14 5 TFA (5) -5 THF4869 80 15 20 Zn(OTf)2 (20) 20 Acetone 1787 74No. 5姜丽娟等:有机小分子催化的不对称羟醛缩合反应625Scheme 12成的烯胺中间体在水相中会马上水解, 而不宜在水相中进行. 而此催化反应机理的提出是对这种传统观念的挑战, 它也为以后设计更优的水相催化剂开辟了广阔的空间.3 展望越来越多的有机小分子催化剂涌现出来, 催化活性和有效性都在不断提高, 有些报道还应用了离子溶液[26]或高压[27]等方法来扩大其合成应用范围. 由于它们的显著优点: 反应条件温和, 副反应少, 反应的立体和区域选择性高, 可以迅速实现反应规模的放大, 引起了化学工作者极大的关注. 但是这类催化剂在适用性和通用性方面都有一定的局限性, 底物范围较窄, 通用性也还不够. 因此, 设计并合成能广泛应用于不对称催化有机小分子催化剂应成为今后的发展趋势.References1 For an overview of total syntheses involving the aldol bondformation, see:(a) Mukaiyama, T. Tetrahedron 1999, 55, 8609.(b) Nicolaou, K. C.; Vourloumis, D.; Winssinger, N.; Baran, P. S. Angew . Chem ., Int . Ed . 2000, 39, 44. 2 Reviews:(a) Nelson, S. G. Tetrahedron : Asymmetry 1998, 9, 357. (b) Gröger, H.; Vogl, E. M.; Shibasaki, M. Chem . Eur . J . 1998, 4, 1137.(c) Bach, T. Angew . Chem ., Int . Ed . Engl . 1994, 33, 417. (e) Denmark, S. E.; Stavenger, R. A.; Wong, K.-T. J . Org . Chem . 1998, 63, 918.3 (a) Hajos, Z. G.; Parrish, D. R. J . Org . Chem . 1974, 39,1615.(b) Eder, U.; Sauer, G.; wiechert, R. Angew . Chem ., Int . Ed .Engl . 1971, 10, 496. 4 Cohen, N. Acc . Chem . Res . 1976, 9, 412.5 (a) Danishefsky, S.; Cain, P. J . Am . Chem . Soc . 1976, 98,4975.(b) Kwiatkowski, S.; Syed, A.; Brock, C. P.; Watt, D. S. Synthesis 1989, 818.(c) Ramamurthi, N.; Swaminathan, S. Indian J . Chem ., Sect . B 1990, 29, 401.(d) Przezdziecka, A.; Stepanenko, W.; Wicha, J. Tetrahedron : Asymmetry 1999, 10, 15896 (a) List, B.; Lerner, R. A.; Barbas, III, C. F. J . Am . Chem .Soc . 2000, 122, 2395.(b) List, B.; Notz, W. J . Am . Chem . Soc . 2000, 122, 7386. (c) Sakthivel, K.; Notz, W.; Bui, T.; Barbas, III, C. F. J . Am . Chem . Soc . 2001, 123, 5260.7 (a) Bahmanyar, S.; Houk, K. N. J . Am . Chem . Soc . 2001,123, 12911.(b) Rankin, K. N.; Gauld, J. W.; Boyd, R. J. J . Phys . Chem . A 2002, 106, 5155.(c) Domingo, M. A. R. Theor . Chem . Acc . 2002, 108, 232. (d) Hoang, L.; Bahmanyar, S.; Houk, K. N.; List, B. J . Am . Chem . Soc . 2003, 125, 16.(e) Bahmanyar, S.; Houk, K. N.; Martin, H. J.; List, B. J . Am . Chem . Soc . 2003, 125, 2475.8 Northrup, A. B.; MacMillan, D. W. C. J . Am . Chem . Soc .2002, 124, 6798.9 For selected studies of proline-catalyzed aldol reaction see:(a) List, B.; Pojarliev, P.; Castello C. Org . Lett . 2001, 3, 573.(b) Chowdari, N. S.; Ramachary, D. B.; Córdova, A.; Bar-bas, III, C. F. T etrahedron Lett . 2002, 43, 9591.(c) Pidathala, C.; Hoang, L.; Vignola N.; List, B. Angew . Chem ., Int . Ed . 2003, 42, 2785.(d) Bahmanyar, S.; Houk, K. N.; Martin, H. J.; List, B. J . Am . Chem . Soc . 2003, 125, 2475.(e) Storer, R. I.; MacMillan, D. W. C. Tetrahedron 2004, 60, 7705.626有机化学V ol. 26, 2006(f) Thayumanavan, R.; Tanaka, F.; Barbas III, C. F. Org.Lett. 2004, 6, 3541.(g) Pan, Q.-B.; Zou, B.-L.; Wang, Y.-J.; Ma, D.-W. Org.Lett. 2004, 6, 1009.(h) Ward, D. E.; Jheengut, V. Tetrahedron Lett. 2004, 45,8347.(i) Nothrup, A. B.; Mangion, F.; Hettche, I. K.; MacMillan,D. W. C. Angew. Chem., Int. Ed. 2004, 43, 2152.(j) Kazmaier, U. Angew. Chem., Int. Ed. 2005, 44, 2186.(k) Enders, D.; Grondal, C. Angew. Chem., Int. Ed. 2005, 44, 1210.(l) Casas, J.; Engqvist, M.; Ibrahem, I.; Kaynak, B.; Crdova,A. Angew. Chem., Int. Ed. 2005, 44, 1343.(m) Ward, D. E.; Jheengut, V.; Akinnusi, O. T. Org. Lett.2005, 7, 1181.(n) Suri, J. T.; Ramachary, D. B.; Barbas, III, C. F. Org.Lett. 2005, 7, 1383.10 Reviews see:(a) Gröger, H.; Wilken, J. Angew. Chem., Int. Ed. 2001, 40,529.(b) Jarvo, E. R.; Miller, S. J. Tetrohedron 2002, 58, 2481.(c) List, B. Tetrohedron 2002, 58, 5573.(d) List, B. Acc. Chem. Res. 2004, 37, 548.(e) Rdova, A. C. Acc. Chem. Res. 2004, 37, 102.11 Northrup, A. B.; MacMillan, D. W. C. Science 2004, 305,1752.12 Shen, Z.-X.; Zhou, H.; Ma, J.-M.; Liu, Y.-H.; Zhang, Y.-W.Chin. J. Org. Chem. 2004, 24, 1213 (in Chinese).(沈宗旋, 周华, 马济美, 刘艳华, 张雅文, 有机化学, 2004, 24, 1213. )13 Shen, Z.-X.; Chen, W.-H.; Zhang, Y.-W. Chirality 2005, 17,119.14 Berkessel, A.; Koch, B.; Lex, J. Adv. Synth. Catal. 2004,346, 1141.15 Tang, Z.; Jiang, F.; Yu, L.-T.; Cui, X.; Gong, L.-Z.; Mi,A.-Q.; Jiang, Y.-Z.; Wu, Y.-D. J. Am. Chem. Soc. 2003,125, 5262.16 Tang, Z.; Yang, Z.-H.; Chen, X.-H.; Cun, L.-F.; Mi, A.-Q.;Jiang, Y.-Z.; Gong, L.-Z.J. Am. Chem. Soc. 2005, 127,9285.17 Chen, J.-R.; Lu, H.-H.; Li, X.-Y.; Cheng, L.; Wan, J.; Xiao,W.-J. Org. Lett. 2005, 7, 4543.18 Nakadai, M.; Saito, S.; Yamamoto, H. Tetrahedron2002,58, 8167.19 Kano, T.; Takai, J.; Tokuda, O.; Maruoka, K. Angew.Chem., Int. Ed. 2005, 44, 3055.20 Torii, H.; Nakadai, M.; Ishihara, K.; Saito, S.; Yamamoto,H. Angew. Chem., Int. Ed. 2004, 43, 1983.21 Krattiger, P.; Kovasy, R.; Revell, J. D.; Ivan, S.;Wennemers, H. Org. Lett. 2005, 7, 1101.22 Tang, Z.; Yang, Z.-H.; Cun, L.-F.; Gong, L.-Z.; Mi, A.-Q.;Jiang Y.-Z. Org. Lett. 2004, 6, 2285.23 Lacoste, E.; Landais, Y.; Schenk, K.; Verlhaca, J.-B.Vincent, J.-M. Tetrahedron Lett. 2004, 45, 8035.24 Dickerson, T. J.; Janda, K. D. J. Am. Chem. Soc. 2002, 124,3220.25 Dickerson, T. J.; Lovell, T.; Meijler, M. M.; Noodleman, L.;Janda, K. D. J. Org. Chem. 2004, 69, 6603.26 Loh, T.-P.; Feng, L.-C.; Yang, H.-Y.; Yang, J.-Y.Tetrahedron Lett. 2002, 43, 8741.27 Hayashi, Y.; Tsuboi, W.; Shojia, M.; Suzuki, N.Tetrahedron Lett. 2004, 45, 4353.(Y0509133 QIN, X. Q.)。
新型化学催化剂的开发与应用

新型化学催化剂的开发与应用化学催化剂在工业生产和科学研究中起着举足轻重的作用,它们常常被用于促进化学反应,提高反应速率和选择性。
在过去几十年中,化学催化剂的研究已取得了许多成果。
近年来,新型化学催化剂的开发和应用已成为研究热点之一。
本文将探讨新型化学催化剂的研究和应用。
一、新型化学催化剂的研究方向随着科技的进步,新型化学催化剂的研究方向不断拓展。
目前,新型化学催化剂的研究方向主要包括以下几个方面:1.金属催化剂金属催化剂具有优异的催化活性和选择性,广泛用于化学合成、环境保护、能源转换等方面。
常见的金属催化剂包括钯、铂、银等。
现在的研究目标是开发更有效的金属催化剂,提高它们的催化效率和选择性。
2.有机催化剂有机催化剂具有无毒、环保等特点,已成为化学合成和生物催化领域的重要催化剂。
有机催化剂的研究方向包括新颖的有机小分子催化剂、金属有机复合催化剂等。
3.生物酶催化剂生物酶催化剂具有高效、高选择性、绿色等特点,被广泛应用于工业生产和生物技术领域。
现在的研究方向是开发多功能酶催化剂、改造酶催化剂等。
二、新型化学催化剂的应用新型化学催化剂在各个领域都有广泛的应用。
下面介绍几个典型例子。
1.燃料电池燃料电池是一种将燃料化学能转换为电能的设备。
催化剂在燃料电池中起到关键作用,主要用于促进氧化还原反应。
近年来,金属催化剂、有机催化剂和生物催化剂被广泛用于燃料电池的研究和开发。
2.生物催化领域生物催化领域的发展离不开催化剂的支持。
生物酶催化剂在生物工程、制药、医疗等领域都有广泛应用。
例如,蛋白酶催化剂被用于生产抗生素,乳酸酶催化剂被用于制备乳酸饮料等。
3.环境保护新型化学催化剂在环境保护领域也有广泛的应用。
例如,采用金属催化剂或生物催化剂可以将废水中的污染物转化成无害物质,净化环境。
同时,新型催化剂还可以被用于清除有害气体和空气中的污染物。
结论新型化学催化剂的研究和应用已成为一个热门领域,随着科技的进步和需求的变化,新型化学催化剂的研究方向也在不断拓展。
有机双功能团小分子催化剂的研究进展

有机双功能团小分子催化剂的研究进展潘聪;Pinaki S.Bhadury【摘要】在过去的10年时间里,有机小分子催化剂作为一门环境友好的有机合成方法学在不对称催化合成中的应用得到了重新发掘,新颖的有机小分子催化剂受到广泛的关注.其中,有机双功能团小分子催化剂的分子中存在两个活性位点同时和底物相互作用,导致了反应速牢的加快和立体选择性的提高,成为国内外的研究热点.本文简要介绍了近几年来有机双功能团催化剂的研究进展,包括联二萘酚为母体的Br(o)nsted酸催化剂、硫脲催化剂及奎宁催化剂.【期刊名称】《广州化工》【年(卷),期】2010(038)007【总页数】5页(P24-27,35)【关键词】Br(o)nsted酸;Thiourea;Quinine;手性催化剂【作者】潘聪;Pinaki S.Bhadury【作者单位】贵州大学精细化工研究开发中心,教育部绿色农药与农业生物工程重点实验室,贵州,贵阳,550025;贵州大学精细化工研究开发中心,教育部绿色农药与农业生物工程重点实验室,贵州,贵阳,550025【正文语种】中文手性有机小分子催化剂结构简单、对环境友好,不含金属离子,原料廉价易得,催化反应条件温和,且在反应过程中不需要对反应底物进行修饰。
而双功能团的有机催化剂既可以提供酸性位点,又可以提供碱性位点,还可以与底物形成氢键作用,从而更好的活化了底物,增加了立体专一性,提高了产物的对映选择性[1]。
双功能团的有机小分子催化剂目前研究的比较多的包括联二萘酚磷酸酯类、金鸡纳碱类、硫脲类四大类催化剂。
下面就简要介绍下这几类催化剂近几年在国内外的研究进展情况。
在众多的催化进行的有机化学反应中,很大一部分是催化剂活化了亲电试剂。
Lewis 酸是被证实了的非常有效的催化剂,与亲电试剂的络合,使亲电试剂的孤对电子占据Lewis酸的空轨道,从而使亲电试剂的亲电性更强。
基于这一理论,研究者发现氢键作用也可以达到相同的活化效果。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
JACS, 2006,Fra bibliotek4.5 手性联二萘酸催化剂
5、 手性硫脲类催化剂
6、 金属有机化合物催化剂
6.1 以手性二胺为配体
配体
6.2 双恶唑啉配体
6.3 双金属催化剂
6.4 手性-酮亚胺催化剂
6.5 手性salen络合物催化剂
谢谢大家!
4、手性联二萘酚有机磷酸催化剂 2004年,Akiyama和Terada分别在Angew和JACS上,独立地 报道了一类新的手性路易斯酸催化剂—手性有机磷酸,从而引起了 科学家的兴趣。该类催化剂有三个特点:一是其强的酸性;二是其 路易斯碱性,这两个特点使该催化剂具有路易斯酸碱特征,可以同 时激活亲核和亲电反应基质;三是分子上手性的联二萘酚单元保证 了不对称的传递。 4.1 催化Mannich-type 反应
2.2 二胺类催化剂 除酰胺体系外,L-Proline衍生的二胺-质子酸体系也是一大类基 于对L-Proline羧基进行改造所得到的催化剂。二胺中的胺(多为三 级胺)被外加质子酸质子化后,起到了与L-Proline羧基类似的作用: 一方面加速烯胺中间体的形成,另一方面通过氢键作用来稳定过渡 态。
直到2000年,美国Scripps研究所的List等发现,L-Proline也能催化 分子间的Aldol反应,并得到了良好的收率和选择性。此后,有机小分子 催化剂开始得到各国化学家的重视,并在短短几年时间内便成为不对称 催化研究领域内的一个热点。
第二章、常见的小分子催化剂
1、 L-Proline及其类似物催化剂 L-Proline是最早发现的不对称有机小分子催化剂,其结构简单, 价格低廉,研究的也最为深入。迄今,L-Proline已被发现能够催化 许多反应,并且大部分反应能够得到理想的收率和立体选择性。所 催化的反应如下所示: 1.1 直接Aldol反应
1.2 不对称Mannich反应
1.3 不对称Michael反应
1.4 不对称-胺氧化反应
JACS 2003, 125, 10808
1.5 羰基的直接-胺化反应
1.6 Baylis-Hillman反应
1.7 醛的分子内-烷基化反应
1.8 L-Proline类似物催化丙酮和对硝基苯甲醛的Aldol反应
酶是人们熟悉的另一类手性催化剂,催化活性高、反应立体专一是其 最显著的特点。但由于酶的底物专一性太强,催化应用的范围很窄,而 且酶的稳定性差,产物的分离与纯化也有一定的困难,加之某些酶需要 辅酶或培养基,使酶的应用受到很大的限制。
与手性过渡金属催化剂及酶相比,最近几年发展起来的手性有机小分 子催化剂有着自己独特的优势,如不含过渡金属、容易制备、价格低廉、 反应条件温和、稳定性强、对环境友好等,因此,对该催化剂的研究越 来越受到科学家的瞩目。 对该类催化剂的研究近年来才得到化学家的重视,并很快有机化学的 热点和前沿,但其渊源可追溯到20世纪70年代。早在1971年Wiechert就 首次报道了L-Proline可以催化分子内不对称羟醛缩合,1974年该反应被 Hajos等优化,ee值高达94%。然而,此后该类型的催化剂没有引起人们 的重视。
催化机理
2.3 小肽催化剂 基于L-Proline结构,2003年Reymond等首次报道了N-末端小肽 催化的不对称Aldol反应,同年,List等也报道了一系列肽催化的不 对称直接Aldol反应。上述工作为催化剂的设计提供了新颖的思路。
3、 MacMillan催化剂 2000年,MacMillan等首次报道了衍生于苯丙氨酸的手性咪唑啉 酮能高对映选择性的催化环戊二烯和不饱和醛发生的Diels-Alder反 应。
Angew. 2004, 43, 1566.;
JACS, 2004, 126, 5356.
4.2 催化Imine-amidation 反应
JACS, 2005, 127, 15696.
4.3 催化Reductive-amination反应
JACS, 2006, 128, 84.
4.4 手性磷酸—抗衡手性阴离子催化剂
有机小分子催化剂在不对称合成中的应用
教 师:郭 炜 职 称:教 授,博士生导师
专 业:有机化学
单 位:山西大学化学化工学院
第一章、简
介
自用1966年第一个手性金属配合物催化剂被成功用于不对称反应至今, 不对称催化研究迄今已有40年的历史。2001年,Nobel化学奖授予了在该 领域做出突出贡献的三位化学家Knowles, Noyori和Sharpless,标志着不 对称催化研究已取得了令人瞩目的成就。 不对称催化的关键在于手性催化剂。到目前为止,人们对手性过渡金 属催化剂的研究最为深入,其应用也最为广泛。但手性过渡金属催化剂 也存在一些缺点,如催化剂造价昂贵、反应条件苛刻、产生环境污染和 催化剂不易回收等。
L-Proline催化机理
过渡态
2、 L-Proline衍生物作为催化剂 尽管L-Proline的不对称催化反应取得了巨大的成功,但在某些方 面还存在局限性,如其溶解性低、催化剂负载量大、有限的催化反 应类型和底物范围。这些促进了科学家对L-Proline进行修饰,希望 设计出高活性、高立体选择性、使用范围更广泛的催化剂。 2.1 酰胺类催化剂
