矿物晶体化学式计算方法汇总
矿物晶体化学式计算方法

矿物晶体化学式计算方法矿物晶体化学式计算方法一、有关晶体化学式的几个基本问题1.化学通式与晶体化学式化学通式(chemical formula)是指简单意义上的、用以表达矿物化学成分的分子式,又可简单地称为矿物化学式、矿物分子式。
晶体化学式(crystal-chemical formula)是指能够反映矿物中各元素结构位置的化学分子式,即能反映矿物的晶体化学特征。
举例:(1)钾长石的化学通式为:KAlSi3O8或K2O⋅Al2O3⋅6SiO2,而其晶体化学式则必须表示为K[AlSi3O8];(2)磁铁矿的化学式可以写为:Fe3O4,但其晶体化学式为:FeO⋅Fe2O3。
(3)具Al2SiO5化学式的三种同质多像矿物:红柱石、蓝晶石和夕线石具有不同的晶体化学式:2. 矿物中的水自然界中的矿物很多是含水的,这些水在矿物中可以三种不同的形式存在:吸附水、结晶水和结构水。
层间水等。
由于H3O+与K+大小相近,白云母KAl2[AlSi3O10](OH)2在风化过程中K+易被H3O+置换形成水云母(K, H3O+)Al2[AlSi3O10](OH)2。
由于结晶水和结构水要占据一定的矿物晶格位置,所以在计算矿物晶体化学式要考虑它们的数量。
3. 定比原理定比是指组成矿物化学成分中的原子、离子、分子之间的重量百分比是整数比,即恒定值。
举例:(1) 某产地的磁铁矿的化学分析结果为:FeO=31.25%,Fe2O3=68.75%,已知它们的分子量分别为:71.85和159.70。
因此,FeO和Fe2O3的分子比为:FeO:Fe2O3=(31.25/71.85):68.75/159.70)=1.01:1因此,磁铁矿的化学式可写为:FeO Fe2O3或Fe3O4。
(2) 某金绿宝石的化学成分为BeO=19.8%,Al2O3=80.2%,它们的分子量分别为25和102,因此两者之间的分子比为:BeO:Al2O3=(19.8/25) 80.2/102)=1:1金绿宝石的化学式可简写为BeO Al2O3或BeAl2O4。
辉石角闪石三价铁及晶体化学式计算材料.
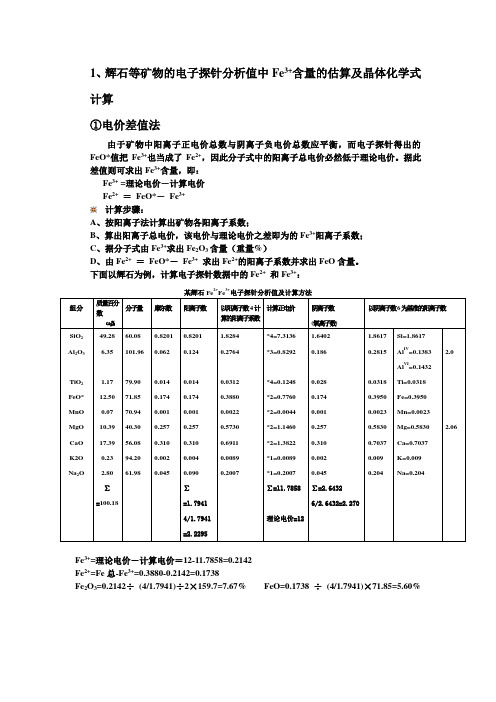
1、辉石等矿物的电子探针分析值中Fe3+含量的估算及晶体化学式计算①电价差值法由于矿物中阳离子正电价总数与阴离子负电价总数应平衡,而电子探针得出的FeO*值把Fe3+也当成了Fe2+,因此分子式中的阳离子总电价必然低于理论电价。
据此差值则可求出Fe3+含量,即:Fe3+ =理论电价-计算电价Fe2+=FeO*-Fe3+计算步骤:A、按阳离子法计算出矿物各阳离子系数;B、算出阳离子总电价,该电价与理论电价之差即为的Fe3+阳离子系数;C、据分子式由Fe3+求出Fe2O3含量(重量%)D、由Fe2+=FeO*-Fe3+求出Fe2+的阳离子系数并求出FeO含量。
下面以辉石为例,计算电子探针数据中的Fe2+和Fe3+:2+3+Fe3+=理论电价-计算电价=12-11.7858=0.2142Fe2+=Fe总-Fe3+=0.3880-0.2142=0.1738Fe2O3=0.2142÷(4/1.7941)÷2×159.7=7.67% FeO=0.1738 ÷(4/1.7941)×71.85=5.60%②剩余氧计算法:对于含变价Fe的矿物,电子探针分析值以FeO*形式给出全铁含量。
把Fe2O3换算成FeO的关系式为:Fe2O3=2FeO+Ox(Ox表示剩余氧)可见由于Fe3+和Fe2+的价态差异,在换算过程中损失了部分氧(剩余氧,用Ox表示),即FeO*中未包含剩余氧Ox。
对于阳阴离子总数有固定比值的矿物,如辉石为4:6,石榴石为8:12,钛铁矿为2:3等,可由电子探针分子值分别算出阳、阴离子总数,又可据其理论比值算出理论阴离子总数。
理论阴离子总数与计算阴离子总数之差则为剩余氧Ox。
由于Fe2O3=2FeO+Ox,所以Fe2O3的分子数与Ox原子数相同,将其乘以Fe2O3的分子量就得出的Fe2O3百含分量。
2+3+计算阳离子总数=1.7941≈理论阳离子总数计算阴离子总数=2.6432理论比值:理论阳离子总数/理论阴离子总数=4/6 理论阴离子总数=6/4×1.7941=2.6912 剩余氧Ox =理论阴离子总数-计算阴离子总数=2.6912-2.6432=0.048因为Fe2O3的分子数与Ox原子数相同,所以Fe2O3=0.048×159.70(Fe2O3的分子量)=7.67%因为2Fe/(Fe2O3):(Fe/FeO)=0.8998(Fe2O3与中FeO含Fe量之比)即FeO=0.8998×Fe2O3(等量Fe由Fe2O3形式换算成FeO形式)所以FeO=FeO*-0.9 Fe2O3 =12.5-0.9×7.67%=5.60%③通用公式计算法(Droop,1987)原理:如果Fe是矿物中唯一的变价元素,则单位分子式中Fe3+的系数可以依据如下原理计算出来(1)若氧是唯一的阴离子,则阳离子正电价之和是氧原子数的2倍;(2)单位分子式中阳离子的总数符合理论化学计量系数;按照晶体化学原理,Fe3+与其他元素的含量具有确定的函数关系。
矿物晶体化学式计算方法汇总

------------------------------------------------------------精品文档-------------------------------------------------------- 成岩成矿矿物学––矿物晶体化学式计算方法矿物晶体化学式计算方法一、有关晶体化学式的几个基本问题1.化学通式与晶体化学式化学通式(chemical formula)是指简单意义上的、用以表达矿物化学成分的分子式,又可简单地称为矿物化学式、矿物分子式。
晶体化学式(crystal-chemical formula)是指能够反映矿物中各元素结构位置的化学分子式,即能反映矿物的晶体化学特征。
举例:(1)钾长石的化学通式为:KAlSiO或KO?AlO?6SiO,而其晶体化学式则282332必须表示为K[AlSiO];83(2)磁铁矿的化学式可以写为:FeO,但其晶体化学式为:FeO?FeO。
3432(3)具AlSiO化学式的三种同质多像矿物:红柱石、蓝晶石和夕线石具有不同的晶52体化学式:2. 矿物中的水自然界中的矿物很多是含水的,这些水在矿物中可以三种不同的形式存在:吸附水、结晶水和结构水。
吸附水:吸附水以机械吸附方式成中性水分子状态存在于矿物表面或其内部。
吸附水不参加矿物晶格,可以是薄膜水、毛细管水、胶体水等。
当温度高于110?C 时则逸散,它可以呈气态、液态和固态存在于矿物中。
吸附水不写入矿物分子式。
结晶水:结晶是成中性水分子参加矿物晶格并占据一定构造位置。
常作为配位体围绕某一离子形成络阴离子。
结晶水的数量与矿物的其它组份呈简单比例。
如石膏:Ca[SO] ?2HO。
24++-+等离子形式参加H、OHH(或称化合水):常以OO表示,结构水呈H、结构水32-+离子少见,O最常见。
H矿物晶格。
占据一定构造位置,具有一定比例。
通常以OH3+++与HO + HO。
结构水如沸石水、层间水等。
矿物晶体化学式计算方法汇总

------------------------------------------------------------精品文档-------------------------------------------------------- 成岩成矿矿物学––矿物晶体化学式计算方法矿物晶体化学式计算方法一、有关晶体化学式的几个基本问题1.化学通式与晶体化学式化学通式(chemical formula)是指简单意义上的、用以表达矿物化学成分的分子式,又可简单地称为矿物化学式、矿物分子式。
晶体化学式(crystal-chemical formula)是指能够反映矿物中各元素结构位置的化学分子式,即能反映矿物的晶体化学特征。
举例:(1)钾长石的化学通式为:KAlSiO或KO?AlO?6SiO,而其晶体化学式则282332必须表示为K[AlSiO];83(2)磁铁矿的化学式可以写为:FeO,但其晶体化学式为:FeO?FeO。
3432(3)具AlSiO化学式的三种同质多像矿物:红柱石、蓝晶石和夕线石具有不同的晶52体化学式:2. 矿物中的水自然界中的矿物很多是含水的,这些水在矿物中可以三种不同的形式存在:吸附水、结晶水和结构水。
吸附水:吸附水以机械吸附方式成中性水分子状态存在于矿物表面或其内部。
吸附水不参加矿物晶格,可以是薄膜水、毛细管水、胶体水等。
当温度高于110?C 时则逸散,它可以呈气态、液态和固态存在于矿物中。
吸附水不写入矿物分子式。
结晶水:结晶是成中性水分子参加矿物晶格并占据一定构造位置。
常作为配位体围绕某一离子形成络阴离子。
结晶水的数量与矿物的其它组份呈简单比例。
如石膏:Ca[SO] ?2HO。
24++-+等离子形式参加H、OHH(或称化合水):常以OO表示,结构水呈H、结构水32-+离子少见,O最常见。
H矿物晶格。
占据一定构造位置,具有一定比例。
通常以OH3+++与HO + HO。
结构水如沸石水、层间水等。
矿物的化学式

书山有路勤为径,学海无涯苦作舟矿物的化学式将矿物的化学成分用元素符号按一定原则表示出来,就构成了矿物的化学式。
它是以单矿物的化学全分析所得各组分的相对百分含量为基础计算出来的。
其表示方法有两种,即实验式和结构式(晶体化学式)。
1.实验式只表示矿物化学成分中各组分数量比的化学式,称为实验式。
如CuFeS2(黄铜矿)和Be3Al2Si6O18(绿柱石)等。
对于含氧盐矿物,也可以用氧化物的组合形式来表示,如绿柱石就可以写成3BeO·Al2O3·6SiO2。
实验式的计算方法:先用单矿物化学全分析所得的各组分重量百分数除以各相应组分的原子量(或分子量),将所得的各商数化为简单整数化,最后用这些整数标定各相应组分的相对含量,即得实验式(表1 和表2)。
表1 黄铜矿实验式的计算过程成分含量百分比(化学全分析结果)原子数原子数比例(近似值)化学式换算(以原子量除)结果CuFeS34.4030.4735.8734.40/63.530.47/56.035.87/32.00.5410.5441.120112CuFeS2 合计100.74 表2 绿柱石实验式的计算过程成分含量百分比(化学全分析结果)分子数原子数比例(近似值)化学式换算(以分子量除)结果BeOAl2O3SiO214.0119.2666.3714.01/25.119.26/102.266.37/60.30.59190.18841.10 073163BeO·Al2O3·6SiO2 或归并成Be3Al2Si6O18 合计99.64 用实验式表示矿物的化学成分,计算简单,书写方便,便于记忆。
但是,实验式不能反映出矿物中各组分之间的相互结合关系,尤其对成分复杂的矿物,还可能引起误解,如上述绿柱石中,就不存在独立的BeO、Al2O3 和SiO2 的分子。
为了克服实验式的弊端,目前在矿物学中普遍采用的是结构式。
2.结构式(称晶体化学式)结构式是一种即能表明矿物中各组分的总类及其数量比,又能表明各组分在晶体结构中的相互关系的化学式。
成因矿物学

1.深成岩和岩浆矿床的矿物共生组合 2.伟晶岩和伟晶矿床的矿物共生组合 例:花岗伟晶岩,云母、绿柱石
正长伟晶岩,稀土、稀有元素矿物
岩浆岩及岩浆矿床的矿物共生组合
方解石 + 透闪石 + 透辉石 + 钙铝榴石 + 绿帘石 + 斜长石(石 灰 岩、中压)
方解石 + 普通角闪石 + 单斜辉石 + 斜长石 ± 绿帘石(石灰岩、 低压)
变质相 特征矿物
典型矿物组合
夕线石
夕线石 + 铁铝榴石 + 黑云母 + 钾长石 + 石英 ± 斜长石(泥质 岩、中压)
高
夕线石 + 堇青石 + 黑云母 + 钾长石 + 石英 ± 斜长石(泥质岩、
低温热液,Sb、Hg、As,辉锑矿、辰砂、 雄黄、雌黄
化学沉积作用的矿物共生组合
原生岩石的化学风化产物,在水体系中沉 积和成岩过程中的“化学分异”,其化学成分 中的Al、Si、Fe、Mn、P、Ca、Na、K、Mg、 等主要化学元素,在迁移过程中发生分离,并 在水体低部的不同地点分别沉积。这与水动力 学环境、生物作用和化学作用(pH、Eh、胶体 吸附等)相关。
二.晶体化学式的内涵(书写方法)
①阳离子写在化学式的开始,在复盐中阳离子 按碱性强弱顺序排列。
②阴离子写在阳离子的后边,络阴离子则用方 括号[ ]括起来。
③附加阴离子写在主要阴离子或络阴离子之后。
④含水化合物的水分子写在最后,并用圆点 “·”相隔,当含水量不定时,用H2O表示。例:蛋 白石 SiO2·nH2O 或 SiO2·aq (aqua含水缩写)
矿物晶体化学式计算方法(new).doc

矿物晶体化学式计算方法一、有关晶体化学式的几个基本问题1. 化学通式与晶体化学式化学通式(chemical formula)是指简单意义上的、用以表达矿物化学成分的分子式,又可简单地称为矿物化学式、矿物分子式。
晶体化学式(crystal-chemical formula)是指能够反映矿物中各元素结构位置的化学分子式,即能反映矿物的晶体化学特征。
举例:(1)钾长石的化学通式为:KAlSi3O8或K2O⋅Al2O3⋅6SiO2,而其晶体化学式则必须表示为K[AlSi3O8];(2)磁铁矿的化学式可以写为:Fe3O4,但其晶体化学式为:FeO⋅Fe2O3。
(3)具Al2SiO5化学式的三种同质多像矿物:红柱石、蓝晶石和夕线石具有不同的晶体化学式:红柱石:Al V Al VI OSiO4蓝晶石:Al2VI OSiO4矽线石:Al VI SiAl IV O5此外,还要指出的是,晶体化学式是最简化学式的Z倍(Z为单位晶胞分子数)。
如:金红石TiO2,其Z=2,因此,金红石的晶体化学式应该为:Ti2O4,锐钛矿的Z=4,它的晶体化学式为Ti4O8,板钛矿的Z=8,它的晶体化学式为Ti8O16。
2. 矿物中的水自然界中的矿物很多是含水的,这些水在矿物中可以三种不同的形式存在:吸附水、结晶水和结构水。
吸附水:吸附水以机械吸附方式成中性水分子状态存在于矿物表面或其内部。
吸附水不参加矿物晶格,可以是薄膜水、毛细管水、胶体水等。
当温度高于110︒C时则逸散,它可以呈气态、液态和固态存在于矿物中。
吸附水不写入矿物分子式。
结晶水:结晶是成中性水分子参加矿物晶格并占据一定构造位置。
常作为配位体围绕某一离子形成络阴离子。
结晶水的数量与矿物的其它组份呈简单比例。
如石膏:Ca[SO4] ⋅2H2O。
结构水(或称化合水):常以H2O+表示,结构水呈H+、OH-、H3O+等离子形式参加矿物晶格。
占据一定构造位置,具有一定比例。
通常以OH-最常见。
矿物成分空间及晶体化学计算

B.含氢氧根的矿物化学式氧原子计算法
运用公式“某阳离子系数=某阳离子数/氧原子总 数/通式中氧原子总数”时,“通式中氧原子总数” 改为“通式中(O2-+OH1-)”
H1+离子数与其他阳离子数求法相同。 OH1- 的数 目等于H1+离子系数。 注意:符合进入硅氧骨干的氧原子数不超过理论 数,其他氧原子作为附加阴离子处理。
3
3.1 Droop公式 计算公式(Droop,1987)
F=2X(1-T/S) 式中: F为分子式中Fe3+的系数; X为分子式中的氧原子数; T为阳离子的理论数目; S为将Fe均作为Fe2+时的阳离子数。
计算步骤
b.计算S值,如果S>T,进入下一步计算。否则,所有 Fe均应为Fe2+ ;
a.以X个氧为基准,计算全Fe均作为Fe2+时的离子系数;
为了避免对水类型判断不准造成 误差,根据与除氢以外的其他阳 离子结合的氧之和计算公约数 。
例:孔雀石化学式计算。 通式:Cu2[CO3](OH)2 实验式:2CuO· CO2· H2 O
组分
CuO ZnO CO2 H2O 总和 公约数
含量%
71.31 0.45 19.78 8.80 100.34
分子数
3.3 剩余氧法
原理:
由于Fe2O3=2FeO+O, EMPA把 Fe3+ 当成Fe2+ 换算FeO时损失了部分 氧(Ox),即EMPA给出的FeO未包 含Ox。据此可求出Fe3+ 。
计算步骤:
(1)按EMPA的百分含量算出阳离子总数; (2)按EMPA的百分含量算出阴离子总数; (3)根据理论阴阳离子比计算理论上的阴 离子总数;则Ox=理论阴离子总数- 实际算出的阴离子总数; (4)求出Fe2O3 的分子数(与Ox原子数相 同)和百分含量,并求出FeO的百分 含量 。
矿物晶体化学式计算方法

矿物晶体化学式计算方法一、有关晶体化学式的几个基本问题1.化学通式与晶体化学式化学通式(chemical formula)是指简单意义上的、用以表达矿物化学成分的分子式,又可简单地称为矿物化学式、矿物分子式。
晶体化学式(crystal-chemical formula)是指能够反映矿物中各元素结构位置的化学分子式,即能反映矿物的晶体化学特征。
举例:(1)钾长石的化学通式为:KAlSi3O8或K2O⋅Al2O3⋅6SiO2,而其晶体化学式则必须表示为K[AlSi3O8];(2)磁铁矿的化学式可以写为:Fe3O4,但其晶体化学式为:FeO⋅Fe2O3。
(3)具Al2SiO5化学式的三种同质多像矿物:红柱石、蓝晶石和夕线石具有不同的晶体化学式:2. 矿物中的水自然界中的矿物很多是含水的,这些水在矿物中可以三种不同的形式存在:吸附水、结晶水和结构水。
吸附水:吸附水以机械吸附方式成中性水分子状态存在于矿物表面或其内部。
吸附水不参加矿物晶格,可以是薄膜水、毛细管水、胶体水等。
当温度高于110︒C时则逸散,它可以呈气态、液态和固态存在于矿物中。
吸附水不写入矿物分子式。
结晶水:结晶是成中性水分子参加矿物晶格并占据一定构造位置。
常作为配位体围绕某一离子形成络阴离子。
结晶水的数量与矿物的其它组份呈简单比例。
如石膏:Ca[SO4] ⋅2H2O。
结构水(或称化合水):常以H2O+表示,结构水呈H+、OH-、H3O+等离子形式参加矿物晶格。
占据一定构造位置,具有一定比例。
通常以OH-最常见。
H3O+离子少见,也最不稳定,易分解:H3O+→ H+ + H2O。
结构水如沸石水、层间水等。
由于H3O+与K+大小相近,白云母KAl2[AlSi3O10](OH)2在风化过程中K+易被H3O+置换形成水云母(K,H3O+)Al2[AlSi3O10](OH)2。
由于结晶水和结构水要占据一定的矿物晶格位置,所以在计算矿物晶体化学式要考虑它们的数量。
矿物晶体化学式计算方法(new)

矿物晶体化学式计算方法一、有关晶体化学式的几个基本问题1. 化学通式与晶体化学式化学通式(chemical formula)是指简单意义上的、用以表达矿物化学成分的分子式,又可简单地称为矿物化学式、矿物分子式。
晶体化学式(crystal-chemical formula)是指能够反映矿物中各元素结构位置的化学分子式,即能反映矿物的晶体化学特征。
举例:(1)钾长石的化学通式为:KAlSi3O8或K2O⋅Al2O3⋅6SiO2,而其晶体化学式则必须表示为K[AlSi3O8];(2)磁铁矿的化学式可以写为:Fe3O4,但其晶体化学式为:FeO⋅Fe2O3。
(3)具Al2SiO5化学式的三种同质多像矿物:红柱石、蓝晶石和夕线石具有不同的晶体化学式:红柱石:Al V Al VI OSiO4蓝晶石:Al2VI OSiO4矽线石:Al VI SiAl IV O5此外,还要指出的是,晶体化学式是最简化学式的Z倍(Z为单位晶胞分子数)。
如:金红石TiO2,其Z=2,因此,金红石的晶体化学式应该为:Ti2O4,锐钛矿的Z=4,它的晶体化学式为Ti4O8,板钛矿的Z=8,它的晶体化学式为Ti8O16。
2. 矿物中的水自然界中的矿物很多是含水的,这些水在矿物中可以三种不同的形式存在:吸附水、结晶水和结构水。
吸附水:吸附水以机械吸附方式成中性水分子状态存在于矿物表面或其内部。
吸附水不参加矿物晶格,可以是薄膜水、毛细管水、胶体水等。
当温度高于110︒C时则逸散,它可以呈气态、液态和固态存在于矿物中。
吸附水不写入矿物分子式。
结晶水:结晶是成中性水分子参加矿物晶格并占据一定构造位置。
常作为配位体围绕某一离子形成络阴离子。
结晶水的数量与矿物的其它组份呈简单比例。
如石膏:Ca[SO4] ⋅2H2O。
结构水(或称化合水):常以H2O+表示,结构水呈H+、OH-、H3O+等离子形式参加矿物晶格。
占据一定构造位置,具有一定比例。
通常以OH-最常见。
3矿物的化学成分之2

矿石学基础
矿物加工工程专业
随后许多研究者根据自己的研究成果对其作了进一步 的补充和更正,或者另行编制了地球化学元素丰度表。
但就地壳中分布最广泛、丰度较大的元素来说, 其相对差别不大。
克拉克值 为了纪念克拉克的功绩,苏联学者费尔斯曼提 议,把地壳中化学元素平均含量的质量百分数称 为“克拉克值”,或称“质量克拉克值”。
在地壳相当深度条件下,这些元素可与侵入体的围岩发 生变质作用,形成接触变质矿物,在深度很大的岩浆体中, 可促进伟晶岩矿物的形成;在外力作用过程中形成各种含 氧盐及盐类矿物。
矿石学基础 矿物加工工程专业
硼除见于伟晶岩矿物(电气石)外,常呈含水硼酸盐 (主要是钠和钙的含水硼酸盐)出现在含硼岩层中 ,它 的出现与火山活动有关。 碳除了形成金刚石和石墨外,还与造岩元素和部分的铁 锰等元素形成碳酸盐,广泛存在于外力作用及部分热液作 用的产物中。 氮和氧是大气的组成部分,氮可成为硝酸盐类矿物的组 成部分。
矿石学基础
矿物加工工程专业
原子克拉克值
由于各元素的原子量不同,质量克拉克值的概念还不 能如实反映地壳中元素的相对多少,而元素参加化学反应 时,原子数目起着决定性的作用。 1911年前苏联科学院院士、地球化学家、矿物学家 A.E.费尔斯曼进行了元素的原子克拉克值的换算。
将每一元素的质量克拉克值除以该元素的原 子量得出元素的原子因数,然后将各种元素的原 子因数化为百分数即为该元素的原子克拉克值。
铷、铯、锶、钡的克拉克值较低,常呈现分散状态, 在矿物中呈类质同象混入物存在。 锂和铍具有小的离子半径,多见于伟晶作用形成的矿 物中(如锂云母、 绿柱石)。
矿石学基础
矿物加工工程专业
4)矿化剂族 硼、碳、氧、氟、磷、硫、氯主要形成简单的阴离子或 络阴离子,对各种盐类矿物的形成起重要的作用。
萤石的计算公式

萤石的计算公式萤石是一种常见的矿物,化学成分为CaF2,是一种重要的工业原料。
萤石的计算公式是指其化学成分的比例关系,可以用来计算萤石的化学成分和化学反应等相关问题。
在化学和工业领域中,萤石的计算公式是非常重要的,下面我们来详细介绍一下萤石的计算公式。
萤石的化学成分是CaF2,其中Ca是钙的化学符号,F是氟的化学符号。
根据化学元素的化学价,钙的化学价为+2,氟的化学价为-1。
因此,萤石的计算公式可以表示为Ca2+和F-的比例关系。
根据化学成分的比例,可以得出萤石的化学式为CaF2。
在化学反应中,萤石的计算公式可以帮助我们计算萤石在化学反应中的摩尔比和摩尔质量。
根据萤石的化学式CaF2,可以得出其摩尔质量为Ca的摩尔质量40.08g/mol加上2个F的摩尔质量218.998g/mol,总计为78.08g/mol。
这样,我们就可以通过萤石的计算公式得出其摩尔质量,从而在化学反应中进行计算。
此外,萤石的计算公式也可以帮助我们计算萤石的化学成分。
通过化学实验和化学分析,可以得出萤石中钙和氟的质量比例,然后通过质量比例计算可以得出萤石的化学成分。
这对于工业生产中的原料配比和产品质量控制非常重要。
在工业生产中,萤石的计算公式也可以帮助我们进行工艺设计和生产控制。
比如,在冶金工业中,萤石常用作熔剂,可以降低熔点和粘度,促进矿石的熔化和分离。
通过萤石的计算公式,可以确定其在熔炼过程中的加入量和作用机理,从而提高冶金工艺的效率和产品质量。
除此之外,在材料工业、化工工业和环保工业中,萤石的计算公式也有着重要的应用价值。
比如,在玻璃和陶瓷工业中,萤石可以作为助熔剂和稳定剂,通过计算公式可以确定其在配方中的用量和作用效果。
在化工工业中,萤石可以用作氟化剂和氟化反应的原料,通过计算公式可以确定其在反应中的摩尔比和反应条件。
在环保工业中,萤石可以用作氟化废气的处理剂,通过计算公式可以确定其在废气处理中的用量和处理效果。
总之,萤石的计算公式在化学和工业领域中有着广泛的应用价值。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
55.88 56.08 0.996 0.996 0.996 Ca2+ 10.01
3.72 19 0.196 0.196 0.196 F 1.968
101.66 2.672
1.57 -0.083
12.56 71.80 0.175 0.175 0.175 Fe2+ 0.201
19.32 40.31 0.479 0.479 0.479 Mg2+ 0.751
99.46
=1.569
A1 A2 A3 A4
重量百
(%) 氧化物分子量 分子数=A1/A2 阳离子系数Y’ 氧原子系数 阳离子数Y
已知通式中的氧原子数/(m氧化物重量百分比/氧化物分子量)
A1 A2 A3 A4
重量百
(%) 氧化物分子量 分子数=A1/A2 阳离子系数Y’ 氧原子系数 阳离子数Y
O3 57.89 101.96 0.568 1.136 1.704 Al3+ 1.782
O3 9.72 152 0.064 0.128 0.192 Cr3+ 0.200
Na[AlSi
O8]和Ca[Al2Si2O8],虽然发生了Na+ +
4+ Ca2+ + Al3+的复杂替代,但它们的氧原子数总是8。
已知氧原子数的一般计算法
––矿物晶体化学式计算方法
X (Y为单位晶胞中的阳离子数;Y’为阳离子系数;X氧原子系数)
Y
Om为例,
氧化物重量百分比/氧化物分子量;
13.17 40.31 0.327 0.327 0.327 Mg2+ 2.913
0.74 56.08 0.013 0.013 0.013 Ca2+ 0.116
O 0.20 61.98 0.003 0.006 0.003 Na+ 0.053
O 8.01 94.20 0.085 0.17 0.085 K+ 1.514
CuFeS
。
A1(wt%) A2原子量 A3=A1/A2 A3=A3/0.396
22.2 56.08 0.396 1
29.4 71.80 0.409 1.03
48.4 60.09 0.805 2.03
CaOFeO2SiO
。
氧原子计算法
8个氧,而钾被钠替代后,不管替
8个氧,另一个例子是斜长石系列的两个端员矿物:
Cu
[CO3](OH)2;
––矿物晶体化学式计算方法
CaSiO
2H2O。
原子–分子计算法:直接把元素的百分含量换算成原子或分子比,在计算硫化物、
CuFeS
,Cu、Fe、S的原子量分别为63.54、55.85和32.07,黄铜矿“分
63.54+55.85+(232.07)=183.53;那么可分别计算得到三个元素的重量
0.09 56.08 0.002 0.002 0.002 Ca2+ 0.005
99.82 3.046
=2.626
(Na
K0.005Ca0.005)[Al1.003Si3.002O8]。
15.999,基本等于阴离子电荷16。
含(OH)– 矿物化学式的计算法
– = H
––矿物晶体化学式计算方法
化学通式与晶体化学式
(chemical formula)是指简单意义上的、用以表达矿物化学成分的分子式,
(crystal-chemical formula)是指能够反映矿物中各元素结构位置的化学
(1)钾长石的化学通式为:KAlSi
O8或K2OAl2O36SiO2,而其晶体化学式则
A1 A2 A3 A4
重量百
(%) 氧化物分子量 分子数=A1/A2 阳离子系数Y’ 氧原子系数 阳离子数Y
O5 42.00 141.94 0.296 0.592 1.48 P5+ 5.945
O3 0.03 159.7 0.000 0.000 0.000 Fe3+ 0.000
0.01 70.9 0.000 0.000 0.000 Mn2+ 0.000
K[AlSi
O8];
磁铁矿的化学式可以写为:Fe
O4,但其晶体化学式为:FeOFe2O3。
具Al
SiO5化学式的三种同质多像矿物:红柱石、蓝晶石和夕线石具有不同的晶
矿物中的水
这些水在矿物中可以三种不同的形式存在:吸附水、
吸附水以机械吸附方式成中性水分子状态存在于矿物表面或其内部。吸附
110C时则逸
O + O2-
A1 A2 A3 A4
重量百
(%) 氧化物分子量 分子数=A1/A2 阳离子系数Y’ 氧原子系数 阳离子数Y
38.32 60.09 0.638 0.638 1.276 Si4+ 5.684
2.89 79.9 0.036 0.036 0.072 Ti4+ 0.321
O+ 4.04 18 0.224 0.448 0.224 OH- 3.991
99.82 2.694
=8.909
(Mg,Fe)6-4(Fe3+,Al)0-2(Al2Si6O20)(OH)4
含F、Cl矿物化学式的计算法
F、Cl,这些阴离子替代氧使矿物中的总的氧原子数实际过剩
分别用氧化物重量含量除以其氧化物分子量(以单位阳离子为标准,如Al
Om(Ti) ,即:
3)
2+)=x/71.8…………………………………………………………………….(4)
3+)=y/79.8…………………………………………………………………….(5)
理想化学配比计算法
电子探针不能分辨元素的价态,例如电子探针不能测定磁铁矿中Fe2+和Fe3+
3和阳离子总电
8(即以O=8为基础)
设电子探针分析数据为FeO(全铁)、TiO
和MgO,其重量百分含量分别为
、Wt(Ti)和Wt(Mg)。
在全铁含量中理论上应包括xFeO和yFe
O3,因此有:
y = Wt(Fe)…………………………………………………………………(1)
––矿物晶体化学式计算方法
O+)Al2[AlSi3O10](OH)2。
所以在计算矿物晶体化学式要考
定比原理
某产地的磁铁矿的化学分析结果为:FeO=31.25%,Fe
O3=68.75%,已知它们
71.85和159.70。因此,FeO和Fe
O3的分子比为:
O3=(31.25/71.85):68.75/159.70)=1.01:1
100)/183.53=34.64%;
100)/183.53=30.42%;
32.07100)/183.53=34.94%。
A1(wt%)
原子量 A3=A1/A2 A3=A3/0.545
34.64 63.54 0.545 1
30.42 55.85 0.545 1
34.91 32.07 1.090 2
––矿物晶体化学式计算方法
120.48 3.838
20.49 -1.078
99.99 2.76
=0.7246,或以2个F为基准计算Ca离子数:
A1 A2 A3 A4
重量百
(%) 氧化物分子量 分子数=A1/A2 阳离子系数Y’ 氧原子系数 阳离子数Y
O5 50.61 441.8 0.115 0.230 0.575 1.082
4.09 79.9 0.051 0.051 0.102 0.240
0.97 270.03 0.004 0.004 0.008 0.019
O3 3.34 291.6 0.011 0.022 0.033 0.103
O3 15.21 101.96 0.149 0.258 0.447 Al3+ 2.298
O3 1.49 159.7 0.009 0.018 0.027 Fe3+ 0.160
––矿物晶体化学式计算方法
15.58 71.8 0.217 0.217 0.217 Fe2+ 1.933
0.22 70.9 0.003 0.003 0.003 Mn2+ 0.027
2.1和1.8,所以碲银矿的化学式应写为AgTe;Bi和Te的电负性分别为:
和2.1,楚碲铋矿的化学式则为:BiTe。呈类质同像替代的元素用圆括号包括,按
离子化合物的化学式的书写顺序为:正离子排左,负离子排右,正离子电价由
相同电价依电负性大小由小到大;如钾长石K[AlSi
O8]、橄榄石(Mg,Fe)2[SiO4]。
F、Cl的矿物晶格中,这些
但不是氧化物形式,同时又分析了F、
,所以分析总量必然超过100%。因此,必须对氧进行校正:从总量中扣除被F、Cl
F、Cl是一价,一克分子氯(235.45=70.90)替代一克原
(16.00),因此,扣除氯的计算公式为:
(16/70.90)=0.23 Cl
(16/219)=0.42 F
91.54 1.802
=2.220
(Cu
Zn0.013)2.002(C0.999O)(OH)2。
阳离子总数固定计算法
A1 A2 A3 A4
重量百
(%) 氧化物分子量 分子数=A1/A2 阳离子系数Y’ 氧原子系数 阳离子数Y
O5 19.26 265.8 0.072 0.144 0.360 0.678
