烷、烯、炔习题及答案
傅建熙《有机化学》课后习题答案

第一章绪 论μ=0。
34332习题一参考答案1. (1) sp 3 (2) sp(3) sp 2 (4) sp (5) sp 3 (6)sp 2 2. (1),(3),(6)互为同分异构体;(2),(4),(5),(7)互为同分异构体。
3. (1)醇类 (2)酚类 (3)环烷烃 (4)醛类 (5)醚类 (6)胺类4.π键的成键方式:成键两原子的p 轨道沿着与连接两个原子的轴垂直的方向“肩并肩”重叠而形成。
π键特点:①电子云平面对称;②与σ键相比,其轨道重叠程度小,对外暴露的态势大,因而π键的可极化度大,在化学反应中易受到亲电试剂的进攻而发生共价键的异裂;③由于总是与σ键一起形成双键或叁键,所以其成键方式必然限制σ键单键的相对旋转。
5. (1) (2) (5)易溶于水;(5) (4) (6)难溶于水。
6.C 6H 67.C 3H 6F 2第三章开链烃问题三参考答案3-1(1) 3,3-二甲基己烷(2) 2,2,4,9-四甲基癸烷3-4 (1) 2,4,4-三甲基-1-戊烯(2) 4,6-二甲基-3-庚烯3-5 2-己烯有顺反异构:3-8 在较高温度和极性溶剂条件下,1,3-戊二烯同溴化氢主要发生1,4加成:习题三参考答案1.(1) 2-甲基-4,5-二乙基庚烷(2) 3-甲基戊烷(3) 2,4-二甲基-3-乙基戊烷(4) (顺)-3-甲基-3-己烯or Z-3-甲基-3-己烯(6) (Z)-3,5-二甲基-3-庚烯(7) 2,3-己二烯(8) 3-甲基-2-乙基-1-丁烯(9) 2,5,6-三甲基-3-庚炔(10)1-丁炔银(11)3-甲基-1,4-戊二炔(12) 3-甲基-1-庚烯-5-炔2.3.4.(Z)-2-戊烯(E)-2-戊烯(Z)-3-甲基-3-己烯(E)-3-甲基-3-己烯(Z)-3-甲基-4-乙基-3-庚烯(E)-3-甲基-4-乙基-3-庚烯(Z)-5-甲基-3-乙基-2-己烯(E)-5-甲基-3-乙基-2-己烯(Z)3-甲基-1,3-戊二烯(E)3-甲基-1,3-戊二烯5.2,3,3-三甲基戊烷2,3-二甲基-3-乙基戊烷2,3-二甲基-1-戊烯6-甲基-5-乙基-2-庚炔二乙基-1-己烯-4-炔6. (1)和(3) (2)和(4) (5)和(6)7.8.1-庚烯2-庚烯3-庚烯2-甲基-1-己烯3-甲基-1-己烯4-甲基-1-己烯5-甲基-1-己烯2-甲基-2-己烯3-甲基3-甲基-3-己烯2,3-二甲基-1-戊烯2,4-二甲基-1-戊烯3,5-二甲基-1-戊烯3,3-二甲基-1-戊烯2-乙基-1-戊烯3-乙基-1-戊烯2,3-二甲基-2-戊烯2,4-二甲基-2-戊烯3,4-二甲基-2-戊烯3-乙基-2-戊烯3-甲基-2-乙基-1-丁烯9.(1) 官能团位置异构(2) 顺反异构(3) 碳胳异构(4) 官能团异构(5) 碳胳异构(6) 碳胳异构10.该化合物的分子式为C14H3011.12.13. (CH 3)22CH 3 > CH 3CH 3 >C(CH 3)4 > CH 4烷烃的卤代反应机理为自由基取代反应。
(完整版)红外光谱法习题参考答案

第十二章 红外吸收光谱法思考题和习题8.如何利用红外吸收光谱区别烷烃、烯烃及炔烃?烷烃主要特征峰为233,,,CH s CH as CH H C δδδν-,其中νC-H 峰位一般接近3000cm -1又低于3000cm -1。
烯烃主要特征峰为H C C C H C -==-=γνν,,,其中ν=C-H 峰位一般接近3000cm -1又高于3000cm -1。
νC=C 峰位约在1650 cm -1。
H C -=γ是烯烃最具特征的峰,其位置约为1000-650 cm -1。
炔烃主要特征峰为H C C C H C -≡≡-≡γνν,,,其中H C -≡ν峰位在3333-3267cm -1。
C C ≡ν峰位在2260-2100cm -1,是炔烃的高度特征峰。
9.如何在谱图上区别异丙基及叔丁基?当两个或三个甲基连接在同一个C 上时,则吸收峰s CH 3δ分裂为双峰。
如果是异丙基,双峰分别位于1385 cm -1和1375 cm -1左右,其峰强基本相等。
如果是叔丁基,双峰分别位于1365 cm -1和1395cm -1左右,且1365 cm -1峰的强度约为1395 cm -1的两倍。
10.如何利用红外吸收光谱确定芳香烃类化合物? 利用芳香烃类化合物的主要特征峰来确定:芳氢伸缩振动(ν=C-H ),3100~3000cm -1 (通常有几个峰) 泛频峰2000~1667cm -1苯环骨架振动(νc=c ),1650-1430 cm -1,~1600cm -1及~1500cm -1 芳氢面内弯曲振动(β=C-H ),1250~1000 cm -1 芳氢面外弯曲振动(γ =C-H ),910~665cm -114.试用红外吸收光谱区别羧酸、酯、酸酐。
羧酸的特征吸收峰为v OH 、v C=O 及γOH 峰。
v OH (单体)~3550 cm -1(尖锐),v OH (二聚体)3400~2500(宽而散),v C=O (单体)1760 cm -1 (S),v as C=O (二聚体)1710~1700 cm -1 (S)。
医用有机化学答案

第1章 绪 论1.5.1什么是有机化合物?什么是有机化学?解:有机化合物是指碳、氢化合物及其衍生物。
仅由碳、氢两种元素组成的有机物称为烃类化合物,若还含有其他元素,则称为烃的衍生物。
有机化学是研究有机物的组成、结构、性质及其相互转化的一门科学。
1.5.2 有机化合物的两种分类方法是什么?解:有机化合物一般是按分子基本骨架特征和官能团不同两种方法进行分类。
1.5.3 σ键和π键是如何形成的?各自有何特点?解: 由两个成键原子轨道向两个原子核间的联线(又称对称轴)方向发生最大重叠所形成的共价键叫σ键;由两个p 轨道彼此平行“肩并肩”重叠所形成的共价键叫π键。
σ键和π键主要的特点σ键π键存 在 可以单独存在不能单独存在,只与σ键同时存在 生 成 成键轨道沿键轴重叠,重叠程度大 成键p 轨道平行重叠,重叠程度较小 性 质①键能较大,较稳定;②电子云受核约束大,不易极化; ③成键的两个原子可沿键轴自由旋转。
①键能小,不稳定;②电子云核约束小,易被极化;③成键的两个原子不能沿键轴自由旋转。
1.5.4 什么是键长、键角、键能及键的离解能?解:键长是指成键原子核间的平衡距离;键角是指两个共价键之间的夹角;当把一摩尔双原子分子AB (气态)的共价键断裂成A 、B 两原子(气态)时所需的能量称为A-B 键的离解能,也就是它的键能。
但对于多原子分子来说,键能与键的离解能是不同的。
键的离解能的数据是指解离某个特定共价键的键能。
多原子分子中的同类型共价键的键能应该是各个键离解能的平均值。
键能是化学键强度的主要标志之一,在一定程度上反映了键的稳定性,相同类型的键中键能越大,键越稳定。
1.5.5 用“部分电荷”符号表示下列化合物的极性。
解:(1) CH 3Br(2) CH 3CH 2OHCH 3OCH 2CH 3C ||O(3)(1) CH 3-Brδ-δ+ (2) CH 3CH 2-O-Hδδ-+δ+CH 3OCH 2CH 3C ||O (3)δ+δ-δ-δ+1.5.6 键的极性和极化性有什么区别?解:极性是由成键原子电负性差异引起的,是分子固有的,是永久性的;键的极化只是在外电场的影响下产生的,是一种暂时现象,当除去外界电场后,就又恢复到原来的状态。
2022学年下学期高二暑假化学新教材巩固练习题及答案2烯烃、炔烃

2022学年下学期高二暑假新教材巩固练习题及答案2烯烃、炔烃例1.某化工厂因附近采石场放炮,致使该厂异丁烯成品储罐被炸坏,发生了异丁烯[CH2=C(CH3)2]外泄事故。
下列有关异丁烯的说法中错误的是A.异丁烯与环丁烷互为同分异构体B.异丁烯的沸点比1−丁烯的沸点低C.异丁烯分子里的四个碳原子位于同一平面D.聚异丁烯的结构简式为例2.下列关于化合物(x)、(y)、(z)的说法正确的是A.x的名称是5−乙基−1,3,5−己三烯B.x、y的一氯代物均有7种C.z的所有碳原子均处于同一平面D.x、y、z均可与溴的四氯化碳溶液反应1.下列有机物的命名正确的是A.:二溴乙烷B.:2−丁醇C.:3−乙基−1−丁烯D.:2,4,4−三甲基戊烷2.由1L乙烯和乙炔的混合气体,在催化剂存在下与足量的H2发生加成反应,消耗H21.4L,则原混合气体中乙烯与乙炔的体积比为A.3∶2B.2∶3C.2∶1D.1∶23.通过催化加氢可得到2−甲基戊烷的是A.B.C.D.4.实验室制备乙烯的实验,下列说法正确的是A.反应物乙醇和浓硫酸的体积比为3∶1B.圆底烧瓶中要放入少量碎瓷片C.反应物是乙醇和3mol/L的硫酸混合D.加热时温度慢慢升高至170℃5.某烃结构式用键线表示为,该烃与2Br按物质的量之比为1:1加成时,所得产物有(不考虑立体异构)A.3种B.6种C.5种D.4种6.下列有机物中存在顺反异构的是A.CH3CH2CH2CH3B.CH3CH=CHCH3C.CH3CH2CH=CH2D.CH3CH2C≡CCH2Cl7.图是制备和研究乙炔性质的实验装置图,下列有关说法错误的是A.用蒸馏水替代a中饱和食盐水可减缓产生乙炔的速率B.c中溶液的作用是除去H2S、PH3C.d、e中溶液褪色的原理不同D.f处产生明亮、伴有浓烟的火焰8.柠檬烯具有特殊香气,可溶于乙醇或乙醚,难溶于水,其结构简式如图所示,有关柠檬烯的说法正确的是A .柠檬烯的分子式为C 10H 18B .柠檬烯分子中所有碳原子处于同一个平面上C .柠檬烯能与酸性高锰酸钾溶液发生取代反应D .柠檬烯能使溴的四氯化碳溶液褪色9.下列说法正确的是A .等质量的烷烃和烯烃完全燃烧,烯烃的耗氧量更大B .某烯烃和氢气加成后的产物是3−乙基戊烷,该烯烃的可能结构有2种C .实验室制乙炔时,为了加快反应速率,应用饱和食盐水代替蒸馏水D .1mol 丙烯先和氯气发生加成反应,加成产物再和氯气发生取代反应,该过程最多可消耗氯气4mol10.烯烃被酸性高锰酸钾溶液氧化的规律是烯烃中双键断裂:双键两端的基团2CH =变成2CO :CHR =变成RCOOH:=CRR '变成R 'RC=O 。
高二化学炔烃试题答案及解析

高二化学炔烃试题答案及解析1.为探究乙炔与溴的加成反应,甲同学设计并进行了如下实验:先取一定量工业用电石与水反应,将生成的气体通入溴水中,发现溶液褪色,即证明乙炔与溴水发生了加成反应。
乙同学发现在甲同学的实验中,褪色后的溶液里有少许淡黄色浑浊,推测在制得的乙炔中还可能含有少量还原性的杂质气体,由此他提出必须先除去之,再与溴水反应。
请你回答下列问题:(1)写出甲同学实验中两个主要的化学方程式、。
(2)甲同学设计的实验(填能或不能)验证乙炔与溴发生加成反应,其理由是(a)使溴水褪色的反应,未必是加成反应(b)使溴水褪色的反应,就是加成反应(c)使溴水褪色的物质,未必是乙炔(d)使溴水褪色的物质,就是乙炔(3)乙同学推测此乙炔中必定含有的一种杂质气体是,它与溴水反应的化学方程式是;在验证过程中必须将此杂质全部除去。
(4)请你选用下列四个装置(可重复使用)来实现乙同学的实验方案,将它们的编号填入方框,并写出装置内所放的化学药品。
【答案】(2)不能(1分) a、c (2分)(3)H2S (1分) Br2+H2S=S↓+2HBr (2分)(4) c b(CuSO4或NaOH溶液)(CuSO4溶液)(各1分)【解析】(1)甲同学的两个反应包括制取乙炔的反应、乙炔与溴的加成反应,化学方程式为(2)甲同学的实验不能验证乙炔与溴发生加成反应,应为不能确定乙炔与溴发生的一定是加成反应,也不能确定使溴水褪色的物质一定是乙炔,实验答案选ac。
(3)制取乙炔的电石中常含有S杂质,结合褪色后的溶液里有少许淡黄色浑浊,所以乙同学推测此乙炔中必定含有的一种杂质气体是硫化氢,硫化氢与溴水反应的化学方程式为Br2+H2S=S↓+2HBr(4)电石与水的反应很剧烈,不能用启普发生器,所以电石、水放在c装置,b装置放氢氧化钠溶液或硫酸铜溶液以除去硫化氢气体,继续选用b装置,放硫酸铜溶液以检验硫化氢是否除净,最后通入放有溴水的b瓶中观察现象。
有机化学4 炔烃试题及答案

第三章 炔烃和二烯烃(习题和答案)一、给出下列化合物的名称1.H C CH 3H C CH 3C C HH 2. CH CH CH 2CH 2C(Z ,E)-2,4-己二烯 1-戊烯-4-炔3. CH CH 2CH 3C 2H 5CH 3C C C4. (CH 3)2CH C(CH 3)3CC4-乙基-4-庚烯-2-炔 2,2,,5-三甲基-3-己炔5. CH CH CH CH 2CH C6. CH CH CH CH 3CC C1,3-己二烯-5-炔 5-庚烯-1,3-二炔7. (CH 3)2CH H C C 2H 5C H C C 8.CH 2CH 22CH 3CH 2CH 3CH C C(E)-2-甲基-3-辛烯-5-炔 3-乙基-1-辛烯-6-炔9. H H C C 2H 5C CH 3C C H H 10. CH H C CH CH3C CH 3CH 3C(Z ,Z)-2,4-庚二烯 3,5-二甲基-4-己烯-1-炔 二、写出下列化合物的结构1. 丙烯基乙炔 2. 环戊基乙炔CH CH CH CH 3CCHC3.(E)-2-庚烯-4-炔 4.3-乙基-4-己烯-1-炔 CH 2CH 3H C CH 3C H C C CH CH CH 2CH 3CH CH 3CH C5.(Z)-3-甲基-4-乙基-1,3-己二烯-1-炔 6.1-己烯-5-炔CH CH 2CH3CHCH 2C CH 3C C CH CH CH 2CH 2CH 2C7.(Z ,E)-6-甲基-2,5-辛二烯 8.3-甲基-5-戊烯-1-炔H H C C 2H 5CH 2CH 3C CH 3C C H 9.甲基异丙基乙炔 10.3-戊烯-1-炔 CH (CH 3)2CH 3C C CHCH 3CH CH C三、完成下列反应式 1.Cl 2CH 2CH 2CH CHC ClCH 2CH 2CH CHC2.稀H 2SO 4CH 3CH 2CHCHgSO 4OCH 3CH 3CH 23.+CHCH CH CH 3OCH=CH 2CC CH OOO CH 3C C OO4.NaCH 2CH NH 3O s O 4H 2O 2CH 3CC 液 HHC C 2H 5CH 3C HO C 2H 5(±)OHCH 3HH 5.CH CH 3Br 24CH 3CC CHCH CH 3CH 3CC CH6.H 2催化剂Lindlar CH 3CH CC HHC CH 3C CH 37.2CHCOCH 3C 8.Na2CH 2CHCCH 2CHCCH 2CH 3C9.H 2OCH 稀H 2SO 4+CH CH 3CH CHgSO 4CH CH 3C OCH 3CH10.KMnO 4KOHCH 3CH 2CCOOK +CO CH 3CH 211.CH 2Cl CH 2CH +C C Ag(NH 3) CH 2C ClCH2F C CAg12.CHCH 3CH 2CCHO CH 2CH 3CH 213.Na INH 3CH 3CHCH 3C液H 2Pt /PbCNa CH 3CCCH 3CH 3C H HC CH 3C CH 314.H 2OCOOHKMnO 4C 2H 5CH 3CH +B 2H 6CC 2H 5CH=CH 2CH 2C 2H 5CH 15.CH 2CH 2CH HBr CH+C(1mol)CH 2CH CHCH 3C16.CH 2C CH 3+CH=CH 2 CH 2C 3Br +CH CH 3(主)CH 2C CH 3CH CH 3(次)17.CH C 6H 5+CH CH=CH 2 CH C 6H 5CH CH CH 318.CH3CHC COCH3CH3CH219.O3CH2OCH3CH2CH3CCOOHCH3CH2CH3COOH+20.△ClNa NH2 CH3ClCCHC CH2CHO四、用化学方法鉴别下列化合物1.(A) 己烷(B) 1-己炔(C) 2-己炔答:加入溴水不褪色的为(A),余下两者加入Ag(NH3)2+溶液有白色沉淀生成的为(B),另者为(C)。
2022届高三化学一轮复习烷烃必刷卷

2022届高三化学一轮复习烷烃必刷卷一、选择题(共17题)1.液化石油气中含正丁烷。
有关正丁烷的叙述正确的是A.分子中碳原子在一条直线上B.比异丁烷沸点低C.一氯代物比异丁烷的一氯代物少D.与空气混合能形成爆炸性混合物2.下列化学用语或模型正确的是A.NH4Cl的电子式:B.中子数为7的氮原子:N715C.丙烷分子的球棍模型:D.乙烯的结构简式:CH2CH23.已知1mol某炔烃与卤素单质按物质的量之比为1:2发生加成反应后,生成的有机物至少需6mol卤素单质才能把其分子中的氢原子全部取代,则该炔烃可能是A.丙炔B.1−丁炔C.3−己炔D.2−庚炔4.下列反应中,属于取代反应的是A.甲烷燃烧生成二氧化碳和水B.乙醇与氧气反应生成乙醛和水C.乙烯与溴反应生成1,2−二溴乙烷D.甲烷与氯气反应生成一氯甲烷和氯化氢5.环己烷可以通过以下四步反应合成1,2−环己二醇,其中属于加成反应的是A.①B.②C.③D.④6.下列有关叙述正确的是A.用广范pH试纸测出某溶液的pH为9.0B.甲烷与氯气的在光照下充分反应后有两种气态产物,三种液态产物(常温常压下)C.往氯化铁溶液中加入过量碘化钾溶液,充分反应后,取上层清液,检验其中是否存在氯离子,进而证明反应存在一定的限度D.将氢氧化钡晶体与氯化铵晶体混合后研磨,能感觉到反应明显放热7.下列物质分子中所有碳原子肯定在同一平面上的是A.B.CH3CH=CHCH3C.CH2=CHCH2CH3D.(CH3)3CCH=CH28.下列关于组成表示为C x H y的烷、烯、炔烃的说法不正确的是A.当x≤4时,常温常压下均为气体B.y一定是偶数)molC.分别完全燃烧1mol,耗O2为(x+y4D.在密闭容器中完全燃烧,120∘C时测得的压强一定比燃烧前大9.下列有关饱和链烃的叙述正确的是A.相邻两个烷烃在分子组成上相差1个甲基B.特征反应是取代反应C.可以与溴水中的溴反应而使溴水褪色D.能使高锰酸钾溶液褪色10.一定量的甲烷在氧气不足的情况下然烧,得到一氧化碳、二氧化碳和水的总质量为14.4g,若其中水的质量为7.2g,则一氧化碳的质量是A.2.8g B.4.4gC.5.6g D.在2.8g∼5.6g之间11.一定量的甲烷在氧气不足的情况下燃烧,得到一氧化碳、二氧化碳和水的总质量为14.4g,若其中水的质量为7.2g,则一氧化碳的质量是A.2.8g B.4.4gC.5.6g D.在2.8g∼5.6g之间12.若要使0.5mol甲烷完全和氯气发生取代反应,并生成相同物质的量的四种取代物,则需要氯气的物质的量为A.2.5mol B.2mol C.1.25mol D.0.5mol13.2005年1月14日,成功登陆“土卫六”的“惠更斯”号探测器发回了350张照片和大量数据。
第2~4章 习题课

解:反应活性为 C > D > A > B ② 将下列烯烃与浓H2SO4反应活性大小排列成序是: 将下列烯烃与浓H 反应活性大小排列成序是: A. CH3CH2-CH=CH2 C. CH2=CH2 B. CH3-CH=CH-CH3 CH=CHD. (CH3)2C=CH2
解:反应活性为 D > B > A > C
六、鉴别题
要求: 要求:
① 方法简单 ② 反应速度快 ③ 现象明显 ④ 简明扼要
P105P105-9- ① 2-甲基丁烷 3-甲基-1-丁烯 甲基3-甲基-1-丁炔 甲基(-) (-) ( + ) 白↓
Br2 / CCl4
Ag(NH3)2NO2
(-) ( + ) 褪色
命名步骤 1. 根据化合物中所含官能团的情况,确定好母体。 根据化合物中所含官能团的情况,确定好母体。 官能团的情况 2. 选取含母体官能团的最长的碳链作为主链。 选取含母体官能团 最长的碳链作为主链。 母体官能团的 的碳链作为主链 当具有相同长度的碳链可作为主链时, (当具有相同长度的碳链可作为主链时,应选择具 有支链最多的碳链作为主链; 有支链最多的碳链作为主链;当主链的长度和支链 数目相同时,应遵循最低系列原则。) 数目相同时,应遵循最低系列原则。) 3. 编号从离母体官能团最近的一端开始,如果母体 编号从离母体官能团最近的一端开始, 支链的一端开始 官能团位于中间, 从靠近支链的一端开始, 官能团位于中间,就从靠近支链的一端开始,尽可 能使取代基具有最低编号 最低编号。 能使取代基具有最低编号。 4. “先小后大,同基合并” 先小后大,同基合并” 烃基大小的次序(大取代基为“较优”基团) 烃基大小的次序(大取代基为“较优”基团): 甲基<乙基<丙基<丁基<戊基<己基<异戊基< 甲基<乙基<丙基<丁基<戊基<己基<异戊基< 异丁基< 异丁基<异丙基
化学习题答案
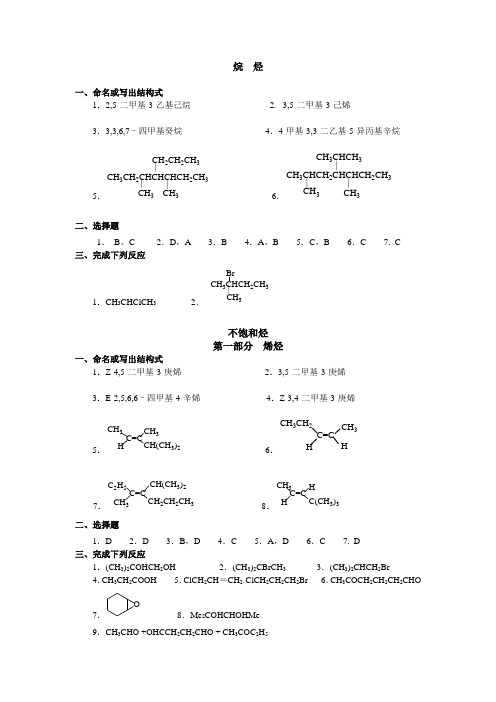
烷烃一、命名或写出结构式1.2,5-二甲基-3-乙基己烷2.3,5-二甲基-3-己烯3.3,3,6,7–四甲基癸烷4.4-甲基-3,3-二乙基-5-异丙基辛烷5.CH3CH2CHCHCHCH2CH3|CH3|CH2CH2CH3|CH36.CH3CHCH2CHCHCH2CH3|CH3|CH3CHCH3|CH3二、选择题1.B、C 2.D,A 3.B 4.A,B 5.C,B 6.C 7. C 三、完成下列反应1.CH3CHClCH32.|CH3CH3CHCH2CH3Br不饱和烃第一部分烯烃一、命名或写出结构式1.Z-4,5-二甲基-3-庚烯2.3,5-二甲基-3-庚烯3.E-2,5,6,6–四甲基-4-辛烯4.Z-3,4-二甲基-3-庚烯5.CH3CH3H3)2C=C6.CH3CH2C=CCH3H H7.C2H5CH(CH3)2CH3CH2CH2CH3C=C8.CH3HH C(CH3)3C=C二、选择题1.D 2.D 3.B,D 4.C 5.A,D 6.C 7. D三、完成下列反应1.(CH3)2COHCH2OH 2.(CH3)2CBrCH33.(CH3)2CHCH2Br4.CH3CH2COOH 5.ClCH2CH=CH2,ClCH2CH2CH2Br 6.CH3COCH2CH2CH2CHO7.O8.Me2COHCHOHMe9.CH3CHO +OHCCH2CH2CHO + CH3COC2H510.CH 3COCH 3 + CH 3CH 2CHO 11.||ClOH四、推断结构1.解:H 2催化剂AB ||2(1)O 3OHCCH 2CH 2CHOA||2.解:(1)CH 2=C(CH 3)2 (2) CH 3CH=CHC(CH 3)2 (3)CH 3或CH 3(4) CH 3CH 2CH=CHCH 2CH 3五、由指定有机原料合成下列化合物解:1.CH 3CH =CH 2−−−−→−︒C Cl 500/2CH 2=CHCH 2Cl −→−2Br T.M 2.CH 3CHOHCH 3−−−→−∆/42SO H CH 3CH =CH 2−−→−HOBr T.M3.CH 3CHOHCH 3−−−→−∆/42SO H CH 3CH =CH 2−−−−→−22/O H HBr T.M4.Cl第二部分 炔烃和二烯烃一、命名或写出结构式1.2,2-二甲基-3-庚炔 2.6-溴己炔 3.1,4-己二烯4.4-甲基-2-己炔 5.2,2,6,6-四甲-3-庚炔 6.3-丁基-1,6-庚二烯7.(CH 3)2CHC ≡CC(CH 3)3 8.(CH 3)3CC ≡C CH 2CH 2CH 39.CH 2=C(CH 3)CH=CHCH 2CH 3 10.HC ≡CCH=CHCH 3 二、选择题1.C 2.A 3.C 4. B 5.C 三、完成下列反应1.CH 3CH 2CH 2C(Br)=CH 2 2. CHO3.CH 3CH 2C(CN)=CH 24.CH 3COCH 3 5. CHCH=CH 2 + BrCH 2C=CHCH 3_BrCH 2_|CH 3|CH 36.C=CHCH 2Br_CH 3|CH 3四、鉴定与提纯1.解:⎪⎪⎩⎪⎪⎨⎧⎪⎩⎪⎨⎧−→−−−→−−−−−→−−−→−−−→−−−−→−↓+C B ANH Ag CCl Br 无白色褪色不褪色未知物2342)(/ 2.解:⎪⎪⎪⎩⎪⎪⎪⎨⎧−−−→−⎪⎪⎩⎪⎪⎨⎧⎪⎩⎪⎨⎧−→−−−→−−−−−→−−→−−−→−−−−−→−−−→−−−−→−↓↓+A B D CNH Ag CCl Br 不褪色无白色顺丁烯二酸酐无白色褪色未知物2342)(/ 五、推断结构1.解:ClCH 2CH =CH 2−−−−←高温/2Cl CH 3CH =CH 3−−−→−低温/2Cl CH 3CHClCH 2ClC A B↓C 2H 5MgICH 3CH 2CH 2CH =CH 2−−→−NBS CH 3CH 2CHBrCH =CH 2 D E ↓KOH ―EtOHCH 3CH =CHCH =CH 2 FO O O+O OOO O O+O O O2.解:A CH 3CH=CC ≡CH_C 2H 52H 5B CH 3CH=CCH=CH 2CH 3C C O==OO_C 2H 5_六、以乙炔为原料合成下列化合物解:1.2CH ≡CHCH ≡CCH=CH 2H 24Cu 2Cl 2CH 2=CHCH=CH 2CH ≡CH224CH 2TM2.3CH ≡CNaC 2H 5ClCH 3CH 2C ≡CHH 2O424NaNH 2TMCH ≡环 烃一、命名或写出结构式1.3-甲基环己烯 2.反-1-甲基-4-乙基环己烷 3.4-硝基-2-氯甲苯4.3-甲基-4-硝基苯磺酸 5.3,5-二溴乙苯 6.对溴苯胺7.8.CH 3 9.|NH 2ClBr10.NO 2二、选择题1.D 2.A 3.A ,C 4.A 5.A 6.D 7.B 8. A , B 9. B 10. B 11.B 三、完成下列反应1.(CH 3)2CHCBr(CH 3)2 2.COOH CH 3H 3C+CH 3COOH3.C(CH 3)3C(CH 3)3H 3CH 2C C(CH 3)3HOOC4. O5.CH 3CH 3 +ClCl四、鉴定下列化合物1.解:⎪⎪⎩⎪⎪⎨⎧⎪⎩⎪⎨⎧−−→−−−→−−−−→−−−→−−−→−−−−→−C B A KMnO CCl Br 褪色不褪色褪色不褪色未知物442/ 2.解:⎪⎪⎪⎪⎩⎪⎪⎪⎪⎨⎧⎪⎩⎪⎨⎧−−→−−−→−−−−→−−−→−⎪⎪⎩⎪⎪⎨⎧⎪⎩⎪⎨⎧−→−−→−−−−−→−−→−−→−−−−→−−−→−−→−↓↓+E A D C BKMnO NH Ag Br 不褪色褪色不褪色无白顺丁烯二酸酐无白褪色未知物4232)( 五、推断结构1.解:ACH 3 B C CH 3CH 2CHBrCH 3 D CH 3CH 2CH 2CH 3BrCH 3+Br 2BrCH 2CH 2CHBrCH 3CH 3+HBr CH 3CH 2CHBrCH 3+HBrCH 3CH 2CH 2CH 2Br2.解:构造式及有关的反应式:C CH 332C CH 3CCuAC CH 3C 2H 5CH 3CHH 2/cat-H 2OO OOB CDCCH 3CH+E3.解:+COOHH 2SO 4HNO 3NO 2_CH 2CH 2CH 3[O]_|___CH 2CH 2CH 3CH 2CH 2CH 3NO 2AH 2SO 4HNO 3NO 2|C|_|CH 3CH 3CH 3|_|COOHCOOHCOOH|_|CH 3CH 3CH 3六、以甲苯为原料合成下列化合物1.CH 33CH ||NO 24|KMnO 4||COOHNO 22.|3223_CH 3CH 3CH(CH 3)23.BrBr 2NO2|CH 3_CH 3_FeBr 3BrCOOH3H 2SO 4Br __COOH4.CH 32|||_||NO 2CH 3324BrCH 3NO 2|Br旋光异构一、命名或写出结构式1.(3R)-4-甲基-3-溴戊烯 2.(2R,3S)-2,3-二甲基-2,3-二羟基丁二酸3.(2S ,3S)-3-氯-2-丁醇 4.(R)-2,3-二甲基己烷 5.(R)-2-氯丙酸6.3C ≡CHH CH 2CH 3 7.6H 13-n IH CH 38.6H 5H HOCH 39.HHC 2H 5C 2H 5NO 2NO 2 10.C 2H 5H HOCH 3二、选择题1.C 2.D 3.D 4. A 5. D 6. A 7.D卤代烃一、命名或写出结构式1.(E)-4,4-二甲基-3-氯甲基-2-戊烯 2.2,4,4-三甲基-2-溴戊烷3.3-甲基-4-氯环戊烯 4.2-甲基-3-氯-6-溴-1,4-己二烯5.顺-1-氯-3-溴环己烷 6.2-溴-1-己烯-4-炔7.CHClC 2H 5C 2H 5H H 3C 8. HC ≡CCHCHCH 2CH 3C 2H 5_Cl _9.CH 2=CHCH 2Cl 10.ClCH 2Cl二、选择题1.D ,A 2.A ,B 3.A ,B 4.C 5.A 6.B,C,D,F/A,E 三、完成下列反应1. C 6H 5CH 2MgCl ,C 6H 5CH 2COOMgCl ,C 6H 5CH 2COOH 2.CH 2=CHCH 2OC 2H 5 3.MgBrCH 3,CH 34. Br Br, ,CHO5. CH 2ClCl四、写出下列反应机理解:CH 3CHCHCH 3CH 3Cl3CHCHCH 3CH 3+OH 2CH 3CCH 2CH CH 3+OH 2H 2O CH 3CHCHCH CH 3+CH 3CHCH 2CH 3CH 3+H 2O -H +-H +3CHCHCH 3CH 3OH 3CCH 2CH 3CH 3OH五、推断结构1.解:A CH 3CH 2CH 2CH 2Br B (CH 3)3CBr C C 2H 5CHBrCH 32.解:CH 3CH 2CH 2Br −−−−→−-EtOHKOHCH 3CH=CH 2−−→−HBr CH 3CHBrCH 3 A B C六、由2-甲基-1-溴丙烷及其它无机试剂制备下列化合物解:1.(CH 3)2CHCH 2Br −−−−→−-EtOHKOHT.M 2.(CH 3)2CHCH 2Br −−→−NaOHT.M 3.(CH 3)2CHCH 2Br −−−−→−-EtOHKOH (CH 3)2C=CH 2−−→−HBr T.M 4.(CH 3)2CHCH 2Br −−−−→−-EtOH KOH (CH 3)2C=CH 2−→−2Br T.M 5.(CH 3)2CHCH 2Br −−−−→−-EtOH KOH (CH 3)2C=CH 2−−→−HOBr T.M醇酚醚一、命名或写出结构式1.4-羟基-2-戊烯 2.2-苯基乙醇 3.乙基异丙基醚4.苯乙醚 5.1-甲基环己醇 6.1,2-环氧丁烷7.2-甲基-4-乙基苯酚 8.4,5-二甲基萘酚9.CHOH |CH 2OHCH 2OH 10.CH 2OH11.O O12.NO 2OHNO 2O 2N13.OHOCH 3OCH 3二、选择题1.B ,C 2.A ,C 3. A/B ,D/D 4.D 5.C 6.C三、完成下列反应1.CH 2BrHO2. CH 3COCH 33.CH 3CHCH 2OH OCH 3 ,CH 2=CHCH 2CHCH 3OH 4.HO + CH 3I5. CH 3CHCH 2OCH 3OH 6.,Br Br7. CH 3I+CH 3CH 2CH 2OH 8. BrCH 2CH 2CH 2CH 2CH 2Br9.,OHOH ,HOC(CH 2)4CHO 四、用化学方法鉴别下列各组化合物1.解:⎪⎪⎩⎪⎪⎨⎧−→−⎪⎩⎪⎨⎧−→−−−→−−−→−−−→−−→−↑B AC FeCl H Na无无紫色未知物32 2.解:⎪⎪⎩⎪⎪⎨⎧−→−⎪⎩⎪⎨⎧−→−−−→−−−→−−−→−−→−↑B C A FeCl H Na 无无紫色未知物32 五、推断结构1.解:AOH OHCH 3CH 3BCH 3CH 3 C H 3C H 3C OHOH2.解:A .CH 3CH 2OCHMe 2 B .CH 3CH 2Br C .BrCHMe 2D .CH 3CH 2OHE .HOCHMe 2F .CH 3CHOG .CH 3COCH 3六、合成1.解:CH 2=CHCH 3−−−−→−22/O H HBr CH 3CH 2CH 2Br −−→−-OH CH 3CH 2CH 2OH −→−Na CH 3CH 2CH 2ONa CH 2=CHCH 3−−→−NBS CH 2=CHCH 2Br −−−−−→−ONaCH CH CH 223T.M 2.解:PhCH 3−−→−NBSPhCH 2Br −−→−-OHT.M 七、写出下列反应机理解:H 3C CH 3OH H+H 3CCH 3OH +2H 3CCH333醛酮一、命名或写出结构式1.2-羟基-4-甲氧基苯乙酮 2.对甲基苯甲醛 3.苯乙醛 3.2-甲基丙醛 4.3-甲基丁酮 5.丙烯醛 6.2,5-己二酮 7.OO8.CH 3CH 2COCH 2CHO 9.BrCH 2CHCHO10.PhCOCH 3 11.Cl 3CCH 2COCH 2CH 3二、选择题1.AC/D 2.A 3.D/A 4.B 5.D 6.BC 7.A/B 8.D 9.D 10.D三、完成下列反应1. NNHC 6H 52. CH 3CCH 2CH 3NOH3.CH 3CH 2CHOHCH(CH 3)CHO 4.ArCC 2H 5OHCH 35.(CH 3)3CCOOH + (CH 3)3CCH 2OH 6 .ArCH=CHCOCH3 7.BrCH 2CH 2COCH 38.CNCH=CHCHO + CH 2=CHCHOHCN 9.ArCOCH 2Cl 10.ArCOOH + CHCl3四、鉴别下列各组化合物1.解:⎪⎪⎪⎩⎪⎪⎪⎨⎧⎪⎩⎪⎨⎧−→−−−→−−−−→−−→−⎪⎩⎪⎨⎧−→−−−→−−−−→−−−→−−−−−−→−↓-↓-↓C D A B NaOHI NaOH I 无黄无无黄黄二硝基苯肼未知物22-4,2 2.解:⎪⎪⎪⎩⎪⎪⎪⎨⎧−→−⎪⎪⎩⎪⎪⎨⎧⎪⎩⎪⎨⎧−→−−−→−−−−→−−→−−−→−−−−→−−→−−−−→−↓↓-↓+D C A BAg NH Ag NaOH I NaHSO 无无无黄白未知物2323)(3.解:⎪⎪⎪⎪⎩⎪⎪⎪⎪⎨⎧⎪⎪⎩⎪⎪⎨⎧−→−⎪⎩⎪⎨⎧−→−−−→−−−→−−−→−−→−−→−⎪⎩⎪⎨⎧−→−−−→−−−−→−−−→−−−−−−→−↑↓↓+A C B E D FeCl H Na Ag NH Ag 无无紫色无无黄二硝基苯肼未知物3223)(-4,2 五、推断结构1.解:A CH 3COCH=CHCH 3 CH 3COCH 2CH(CH 3)2 C (CH 3)2CH(OH)CH=CHCH 3D CH 3CH=CHC(CH 3)=CH 2E CH 3H 3COH OH2.解:A CH 3OB CH 3HO OC CH 3CH 2D CH 3CH 3ECOCH 3CHOH 3CFCOCH 3COOH H 3C六、合成解:1.2CH 3COCH 3−−−→−NaOH%5 (CH 3)2COHCH 2COCH 3−−−→−-∆OH 2/(CH 3)2C=CHCOCH 3−−−−−→−+HNaOH I )2(;/)1(2(CH 3)2C=CHCOOH2.解:CH 2=CH 2−−−→−∆+,/2H O H CH 3CH 2OH −−−→−莎瑞特试剂CH 3CHO↓HClCH 3CH 2Cl −−−→−OEt Mg 2/CH 3CH 2MgCl −−−−−−→−+OH H CHO CH 23,)2(,)1(T.M 3.解:CH 3CH 2CH =CH 2−−−→−∆+,/2H O H CH 3CH 2CHOHCH 3−−−−→−∆+,/722H O Cr K3+CH 3CCH 2CH 3CNOHCH 3CH 2COCH CH 3CCH 2CH 3COOHOH4.解:CH 3CH 3CH 3COCH 2CH 2Br 22H +CH 3CH 3H 3CCCH 2CH 2BrO O2CH 3CH 3H 3CCCH 2CH 2MgBrO OT.M。
混合烃组成问题习题

混合烃组成问题习题一.选择题(共11小题)1.通常状况下,由两种气态烃组成的混合物完全燃烧后,燃烧产物与混合烃的物质的量的变化关系如图所示,下列关于混合烃组成的判断正确的是()A.一定有甲烷B.一定有乙烯C.一定有丙烷D.一定有丙炔考点:有机物的推断.专题:烃及其衍生物的燃烧规律.分析:由图象可以看出,1mol混合烃完全燃烧生成的CO1.5mol,肯定含有小于1.5个C原2子的烃,则一定含有甲烷.解答:解:根据图象判断,1mol混合烃完全燃烧生成的CO1.5mol,2molH2O,则平均分子式2为C1.5H4,在分子中,肯定有1.5个C原子的烃,则一定含有甲烷,并且另一种含有的H原子数为4,故选A.2.将0.2mol两种气态烃组成的混合气完全燃烧后得到6.72升二氧化碳(标准状况下)和7.2克水,下列关于该混合烃说确的是()A.一定有乙烯B.一定有甲烷C.一定没有甲烷D.可能有乙炔考点:有关混合物反应的计算;有关有机物分子式确定的计算.专题:烃及其衍生物的燃烧规律.分析:根据n=计算7.2克水的物质的量,根据n=计算二氧化碳的物质的量,根据H原子、C原子守恒计算混合物的平均分子组成,据此判断.解答:解:两种气态烃组成的混合物0.2mol完全燃烧得6.72L二氧化碳和7.2克水,7.2克水的物质的量为=0.4mol,平均分子组成中H原子数目为:=4,6.72L二氧化碳的物质的量==0.3mol平均分子组成C原子数目为:=1.5,故该混合烃的平均分子式为C1.5H4,根据C原子可知,该烃一定含有CH4,根据H原子可知,另一烃的分子中H原子数目为4,故ACD错误、B正确.故选B.3.气态烃组成的混合气 0.1mol,完全燃烧得0.16molCO2和3.6g水下列说确的是()A.一定含乙烷B.一定含乙烯C.既不含甲烷又不含乙烯D.可能含乙烯考点:有关有机物分子式确定的计算.专题:烃及其衍生物的燃烧规律.分析:n(H2O)==0.2mol,即0.1mol混合烃完全燃烧生成0.16molCO2和0.2molH2O,根据元素守恒,则混合烃的平均分子式为C1.6H4,根据平均分子式进行判断.解答:解:n(H2O)==0.2mol,0.1mol混合烃完全燃烧生成0.16molCO2和0.2molH2O,根据元素守恒,则混合烃的平均分子式为C1.6H4,烃中C原子数小于1.6的只有甲烷,则一定含有甲烷,CH4分子中含4个氢原子,故另一种分子中一定含4个氢原子,且其碳原子数大于1.6,故可能是C2H4或C3H4,一定没有C2H6或C2H2,二者的H原子不等于4,A、由上述分析可知,混和气体中一定有甲烷,一定不含乙烷,故A错误;B、由上述分析可知,混和气体中一定有甲烷,可能含有是C2H4或C3H4,故B错误;C、由上述分析可知,混和气体中一定有甲烷,可能含有乙烯,故C错误;D、由上述分析可知,混和气体中一定有甲烷,可能含有乙烯,故D正确.故选D.4.120℃和101kPa时,甲烷、乙烯和乙炔组成的混合烃32mL,与过量氧气混合并完全燃烧,恢复到原来的温度和压强,气体总体积缩小了8mL,原混合烃中乙炔的体积分数为()A.12.5% B.25% C.50% D.75%考点:有关混合物反应的计算.专题:计算题.分析:发生反应分别为:CH4+2O2CO2+2H2O,C2H4+3O22CO2+2H2O,C2H2+O22CO2+H2O,恢复到原来的温度和压强,根据反应方程式可知,CH4和C2H4反应前后气体总体积不变,体积减小由乙炔燃烧导致,根据差量法计算乙炔的体积,进而计算炔的体积分数.解答:解:恢复到原来的温度和压强,水为气体,则:CH4+2O2CO2+2H2O△V1 2 1 2 0C2H4+3O22CO2+2H2O△V1 32 2 0C2H2+O22CO2+H2O△V1 2.52 1 0.5CH4和C2H4反应前后气体体积不变,体积减小由乙炔燃烧导致,设混合气体中C2H2为ymL,则:C2H2+O2 2CO2+H2O△V1 2.52 1 0.5ymL 8mL所以1:0.5=ymL:8mL,解得y=16则原混合烃中乙炔的体积分数为×100%=50%,故选C.5.150℃时取1升混合烃与足量的9升O2混合,在容积固定的容器中充分燃烧,当恢复到150℃时,容器压强增大8%,则混合烃可能的组成为()A.甲烷和乙烯B.丙炔和乙炔C.丁烯和丁烷D.乙烯和丁烯考点:有关有机物分子式确定的计算.专题:烃及其衍生物的燃烧规律.分析:假设混合烃的分子式是CxHy,其燃烧的方程式是:CxHy+(x+)O2xCO2+H2O.在150℃时水是气态.因此根据方程式可知1L的混合烃完全燃烧,气体体积增加了(﹣1)L.根据题意可得﹣1=(1+9)×8%.解得y=7.2,H原子数平均为7.2个,则一种烃分子中的H原子数小于8,另一种大于8,对各个选项逐一排查解答.解答:解:假设混合烃的分子式是CxHy,在150℃时水是气态,则:CxHy+(x+)O2xCO2+H2O 气体体积增大1L (x+)L xL L (﹣1)L根据题意可得:﹣1=(1+9)×8%,解得y=7.2,H原子数平均为7.2个,则一种烃分子中的H原子数小于7.2,另一种大于7.2,A.甲烷和乙烯中H原子数目分别为4、4,不符合题意,故A错误;B.丙炔和乙炔中H原子数目分别为4、2,不符合题意,故B错误;C.丁烯和丁烷中H原子数目分别为8、10,不符合题意,故C错误;D.乙烯和丁烯中H原子数目分别为4、8,符合题意,故D正确,故选D.6.25℃和101kPa时,乙烷,乙炔和丙烯组成的混合烃8mL与过量氧气混合并完全燃烧,除去水蒸气,恢复到原来的温度和压强,气体总体积缩小了18mL,原混合烃中乙炔的体积分数为()A.12.5% B.25% C.50% D.75%考点:有关混合物反应的计算.专题:计算题.分析:发生反应分别为:C2H6+O2=2CO2+3H2O、C2H2+O2=2CO2+H2O、C3H6+O2=3CO2+3H2O,除去水蒸气,恢复到原来的温度和压强,根据反应方程式可知,相同体积的C2H6和C3H6反应后体积缩小的量是相同的,故可将两者看成是一种物质,设C2H6和C3H6一共为xmL,C2H2为ymL,列方程计算,进而计算乙炔的体积分数.解答:解:除去水蒸气,恢复到原来的温度和压强,水为液态,则:C2H6+O2=2CO2+3H2O△V1 3.52 2.5C2H2+O2=2CO2+H2O△V1 2.52 1.5C3H6+O2=3CO2+3H2O△V1 4.5 3 2.5相同体积的C2H6和C3H6反应后体积缩小的量是相同的,故可将两者看成是一种物质,设C2H6和C3H6一共为xmL,C2H2为ymL,则有:解得x=6 y=2,混合烃中乙炔的体积分数为×100%=25%,故选B.7.25°C和101kpa时,乙烷、乙炔和丙烯组成的混合烃32mL与过量氧气混合并完全燃烧,除去水蒸气,恢复到原来的温度和压强,气体的总体积缩小了64mL,原混合烃中乙炔的体A.12.5% B.25% C.50% D.75%考点:有关混合物反应的计算.专题:烃及其衍生物的燃烧规律.分析:发生反应分别为:C2H6+O2=2CO2+3H2O,C2H2+O2=2CO2+H2O,C3H6+O2=3CO2+3H2O,除去水蒸气,恢复到原来的温度和压强,根据反应方程式可知,相同体积的C2H6和C3H6反应后体积缩小的量是相同的,故可将两者看成是一种物质,设C2H6和C3H6一共为xmL,C2H2为ymL,利用气体体积缩小了35mL及混合气体的体积来列等式计算出乙炔的体积,进而计算乙炔的体积分数.解答:解:除去水蒸气,恢复到原来的温度和压强,则:C2H6+O2=2CO2+3H2O△V1 3.52 2.5C2H2+O2=2CO2+H2O△V1 2.52 1.5C3H6+O2=3CO2+3H2O△V1 4.5 3 2.5根据反应方程式可知,相同体积的C2H6和C3H6反应后体积缩小的量是相同的,故可将两者看成是一种物质,设C2H6和C3H6一共为xmL,C2H2为ymL,则:解得x=16、y=16,则原混合烃中乙炔的体积分数为×100%=50%,故选C.8.(2013•三模)100℃时,两种烃蒸汽组成的混合气体完全燃烧后所得CO2和H2O的物质的量随混合烃的总物质的量变化如图所示.则下列对该混合烃组成的判断正确的是()A.一定含有甲烷B.一定含有乙烯C.一定含有苯D.一定不含乙烯考点:有关有机物分子式确定的计算.专题:烃及其衍生物的燃烧规律.分析:根据图象判断一定物质的量的混合物完全燃烧生成的CO和H2O的物质的量关系,进2而计算混合烃中C、H原子个数关系,则得到平均分子式,根据平均分子式进行判断.解答:解:由图象中的线性关系,选取混合烃的总物质的量为1mol作研究,生成的CO和2 H2O的物质的量分别为1.6mol和2mol,故其平均分子组成为C1.6H4,由于碳原子数小于1.6的烃只有甲烷一种,因此一定含有甲烷;CH4分子中含4个氢原子,故另一种分子中一定含4个氢原子,且其碳原子数大于1.6,故可能是乙烯,一定不含有苯.故选A.9.由两种气态烃组成的混合物,体积为10ml.与过量的氧气混合再充分燃烧,将生成物通过浓H2SO4气体体积减少15ml,再通过碱石灰气体体积又减少20ml(气体体积均为同温同压下).混合烃的组成可能为()A.CH4和C2H2B.C2H6和C2H4C.C H4和C3H4D.C4H10和C2H42考点:有关混合物反应的计算.专题:烃及其衍生物的燃烧规律.分析:浓硫酸吸收的是水蒸气,碱石灰吸收的是二氧化碳,令烃的平均组成为CH y,根据体x 积之比等于物质的量之比计算平均分子式,据此判断.解答:解:通过浓硫酸体积减少为烃燃烧生成的水蒸气,通过碱石灰体积减少为烃燃烧生成的二氧化碳,10mL该烃完全燃烧生成:二氧化碳20mL、水蒸气15mL,令烃的平均组成为C x H y,则:根据C原子守恒有:10x=20,故x=2,根据H原子守恒有:10y=15×2,故y=3,故该烃的平均组成为C2H3,根据H原子平均数可知,该烃一定还含有C2H2,根据C原子平均数可知,该烃一定含有C2H4,故该烃为C2H4、C2H2组成的混合物;故选A.10.某混合气体由两种气态烃组成.取2.24L该混合气完全燃烧后得到4.48L二氧化碳(气体已折算为标准状况)和3.6g水,则这两种气体可能是()A.C H和C3H8B.C H4和C2H4C.C2H2和C3H4D.C2H2和C2H64考点:有关混合物反应的计算.专题:烃及其衍生物的燃烧规律.分析:2.24L该混合气体的物质的量为0.1mol,完全燃烧得到4.48L二氧化碳和3.6g水,生成二氧化碳的物质的量为0.2mol,水的物质的量为0.2mol,则说明混合气体平均分子式为C2H4,利用平均值法判断.解答:解:2.24升该混合气体的物质的量==0.1mol,完全燃烧得到4.48升二氧化碳和3.6克水,生成二氧化碳的物质的量==0.2mol,水的物质的量==0.2mol,则说明混合气体平均分子式为C2H4,A.CH4和C3H8混合,平均H原子数目介于4~8之间,不可能为4,故A不符合;B.CH4和C2H4混合,平均C原子数目介于1~2之间,不可能为2,故B不符合;C.C2H2和C3H4混合,平均C原子数目介于2~3之间,不可能为2,平均H原子数目介于2~4之间,不可能为4,故C不符合;D.C2H2和C2H6混合,以任意比混合,平均C原子数目都是2,当二者按照1:1混合时可满足平均H原子数目为4,故D符合,故选D.11.两种气态烃组成的混合气体完全燃烧后所得到CO2和H2O的物质的量随混合烃总物质的量的变化如图所示.下列有关混合气体的说确的是()A.该混合气体中一定含有乙烯B.该混合气体一定含有甲烷和乙炔C.在110℃条件下,该混合气体与氧气混合,总混合气燃烧前后体积不变D.若混合气体由CH和C2H4组成,则其体积比为1:34考点:有机物的推断;有关混合物反应的计算.专题:烃及其衍生物的燃烧规律.分析:由图可知两种气态烃的平均组成为CH4,根据碳原子平均数可知,混合气体一定含1.6有CH4,由氢原子平均数可知,另一气态烃中氢原子数目为4,碳原子数目大于1.6,不超过4.据此判断.解答:解:由图可知两种气态烃的平均组成为CH4,根据碳原子平均数可知,混合气体一1.6定含有CH4,由氢原子平均数可知,另一气态烃中氢原子数目为4,碳原子数目大于1.6,不超过4.A、混合气体一定含有CH4,由氢原子平均数可知,另一气态烃中氢原子数目为4,可能含有C2H4,或含有C3H4等,故A错误;B、C2H2中氢原子数目为2,氢原子数目小于4,不可能含有C2H2,故B错误;C、在110℃条件下,生成的水为气体,两种气态烃的平均组成为C1.6H4,H原子数目为4,燃烧前后总体积不变,故C正确;D、若混合气体由CH4和C2H4组成,令甲烷物质的量为xmol、乙烯为ymol,两种气态烃的平均组成为C1.6H4,根据平均C原子数目可知,=1.6,整理得x:y=2:3,故选D错误;故选C.二.填空题(共1小题)12.常温下,10mL某气态烃A和80mL氧气(过量)混合,点燃使其充分燃烧后,恢复到原状态时,残留气体体积为70mL.试通过计算确定:(1)若A为烷烃,则分子式为CH4.(2)若A为烯烃,则分子式为C2H4.(3)若A为炔烃,则分子式为C3H4.考点:有关有机物分子式确定的计算.专题:烃及其衍生物的燃烧规律.分析:先写出烃的燃烧通式C x H y+(x+)O2=xCO2+H2O,在常温下水的状态为液态,氧气过量,则反应后残留的气体为二氧化碳、氧气,然后根据体积差列式计算出y值,最后根据题中要求写出A的分子式.解答:解:烃的燃烧通式为:C x H y+(x+)O2=xCO2+H2O,常温下水的状态为液体,氧气过量,残留气体为二氧化碳和氧气的混合物,则:C x H y+(x+)O2=xCO2+H2O△V1 (x+) x 1+10mL (80+10﹣70)mL=20mL=解得:y=4,即:烃中含有4个H原子,满足条件的有:烷烃:CH4、烯烃:C2H4、炔烃:C3H4,(1)若A为烷烃,则A的分子式为CH4,故答案为:CH4;(2)若A为烯烃,则分子式为C2H4,故答案为:C2H4;(3)若A为炔烃,则分子式为C3H4,故答案为:C3H4.三.解答题(共4小题)13.根据烷、烯、炔烃燃烧的反应方程式,有人总结出以下规律:对于烷烃有n(烷烃)=n (H2O)﹣n(CO2),对于烯烃有n(H2O)﹣n(CO2)=0,对于炔烃有n(炔烃)=n(CO2)﹣n (H2O).请回答下列问题:(1)某混合气体由C2H6和C3H4组成.将1.0L混合气在氧气中充分燃烧,产生的CO2体积比水蒸气多0.2L(相同状况下测定),通过计算确定C2H6的体积.(请写出计算过程)(2)某混合气由烯烃和烷烃或烯烃和炔烃组成.组成中可能是两种气体,也可能是多种气体.将1.0L混合气在氧气中充分燃烧,产生3.0LCO2和2.4L水蒸气(相同状况下测定).试判断混合气是由烯烃和炔烃两类烃组成,其体积比为2:3 .考点:有关有机物分子式确定的计算;有关混合物反应的计算.专题:计算题.分析:(1)设混合气体中CH6和C3H4的体积分别为aL和bL,根据燃烧方程式表示出生成的2二氧化碳、水的体积,列方程解答;(2)烯烃燃烧生成的n(H2O)=n(CO2),混合物燃烧产生3.0LCO2和2.4L水蒸气,n (CO2)﹣n(H2O)>0,故混合物由烯烃与炔烃组成;由信息可知,二氧化碳与水蒸气的体积之差为炔烃的体积,进而计算烯烃的体积.解答:解:(1)设混合气体中CH6和C3H4的体积分别为aL和bL,则:2C2H6+3.5O2→2CO2+3H2Oa 2a 3aC3H4+4O2→3CO2+2H2Ob 3b 2b由两个反应式可得出下列关系:,解得,a=0.4,b=0.6答:混合气体中C2H6的体积为0.4L,(2)(2)烯烃燃烧生成的n(H2O)=n(CO2),混合物燃烧产生3.0LCO2和2.4L水蒸气,n(CO2)﹣n(H2O)>0,故混合物由烯烃与炔烃组成;由信息可知,二氧化碳与水蒸气的体积之差为炔烃的体积,故V(炔烃)=3.0L﹣2.4L=0.6L,故V(烯烃)=1L﹣0.6L=0.4L,所以V(烯烃):V(炔烃)=0.4L:0.6L=2:3,故答案为:炔烃;2:3.14.(1)准确称取3.0g有机物样品A(只含有C、H、O三种元素中的一种或三种),在氧气中充分燃烧后生成3.6g水和3.36L(标准状况下)CO2.①通过计算确定该有机物的实验式.②要确定该有机物的分子式,是否还要其他的条件,请简述其理由H原子已经饱和,最简式即为分子式.③总物质的量一定的情况下,该有机物和某气态烃的混和物,无论以何比例混合,完全燃烧所消耗的氧气的物质量也为定值,则该烃的分子式为C3H6(2)有机物B由碳,氢,氧三种元素组成.现取4.6gB与5.6L氧气(标准状况)在密闭容器中燃烧,燃烧后只生成CO2、CO和水蒸气(假设反应没有剩余),将反应生成的气体依次通过浓硫酸和碱石灰,浓硫酸增重5.4g,碱石灰增重4.4g.回答下列题:①4.6gB中所含氢原子的物质的量为0.6mol ,碳原子的物质的量为0.2mol ;②通过计算确定该有机物的分子式:(3)可以利用核磁共振氢谱法确定有机物B的结构,请完成下表:判断依据结论(写结构简式))核磁共振氢谱有1个峰CHOCH33核磁共振氢谱有3个峰CHCH2OH3考点:有关有机物分子式确定的计算;有机物的推断.专题:计算题;有机物的化学性质及推断.分析:(1)①3.6g水的物质的量为=0.2mol,故n(H)=0.2mol×2=0.4mol,m(H)=0.4mol×1g/mol=0.4g,3.36L(标准状况下)CO2的物质的量为=0.15mol,故n(C)=0.15mol,m(C)=0.15mol×12g/mol=1.8g,由于0.4g+1.8g=2.2g<3.6g,故m(O)=3.6g﹣0.4g﹣1.8g=2.4g,n(O)==0.15mol,故n(C):n(H):n(O)=0.15mol:0.4mol:0.15mol=3:8:3,故实验式为C3H8O;②H原子已经饱和,最简式即为分子式;③总物质的量一定的情况下,该有机物和某气态烃的混和物,无论以何比例混合,完全燃烧所消耗的氧气的物质量也为定值,说明1molC3H8O与烃消耗的氧气的物质的量相等,将C3H8O改写为C x H y•H2O形式判断;(2)①浓硫酸增重5.4g是水的质量,根据n=计算水的物质的量,根据H原子守恒有n(H)=2n(H2O),碱石灰增重4.4g是生成的二氧化碳的质量,根据n=计算氧气的物质的量,再根据m=nM计算氧气的质量,根据质量守恒计算CO的质量,再根据n=计算CO的物质的量,根据C原子守恒有n(C)=n(CO2)+n(CO),②根据m=nM计算C原子、H原子的质量,进而计算O原子的质量,根据n=计算O原子的物质的量,据此计算最简式,据此解答;(3)核磁共振氢谱有1个峰,分子中H原子等效,结合分子式书写结构简式;核磁共振氢谱有3个峰,说明分子中有3种不等效H原子,结合分子式书写结构简式.解答:解:(1)①3.6g水的物质的量为=0.2mol,故n(H)=0.2mol×2=0.4mol,m (H)=0.4mol×1g/mol=0.4g,3.36L(标准状况下)CO2的物质的量为=0.15mol,故n(C)=0.15mol,m(C)=0.15mol×12g/mol=1.8g,由于0.4g+1.8g=2.2g<3.6g,故m(O)=3.6g﹣0.4g﹣1.8g=2.4g,n(O)==0.15mol,故n(C):n(H):n(O)=0.15mol:0.4mol:0.15mol=3:8:3,故实验式为C3H8O;故答案为:C3H8O;②H原子已经饱和,最简式即为分子式,故有机物分子式为C3H8O;故答案为:H原子已经饱和,最简式即为分子式;③总物质的量一定的情况下,该有机物和某气态烃的混和物,无论以何比例混合,完全燃烧所消耗的氧气的物质量也为定值,说明1molC3H8O与烃消耗的氧气的物质的量相等,将C3H8O改写为C3H6•H2O,故该烃为C3H6符合,故答案为:C3H6;(2)①浓硫酸增重5.4g是水的质量,水的物质的量为=0.3mol,根据H原子守恒有n(H)=2n(H2O)=0.6mol,碱石灰增重4.4g是生成的二氧化碳的质量,二氧化碳的物质的量为=0.1mol,氧气的物质的量为=0.25mol,氧气的质量为0.25mol×32g/mol=8g,根据质量守恒可知CO的质量为4.6g+8g﹣5.4g﹣4.4g=2.8g,CO的物质的量为=0.1mol,根据C原子守恒有n(C)=n(CO2)+n(CO)=0.1mol+0.1mol=0.2mol,故答案为:0.6 mol,0.2 mol;②m(H)=0.6mol×1g/mol=0.6g,m(C)=0.2mol×12g/mol=2.4g,故m(O)=4.6g﹣0.6g﹣2.4g=1.6g,n(O)==0.1mol,故n(C):n(H):n(O)=0.2mol:0.6mol:0.1mol=2:6:1,故实验式为C2H6O,H原子已经饱和,最简式即为分子式,故答案为:C2H6O;(3)若核磁共振氢谱有1个峰,分子中H原子等效,故有机物的结构简式为CH3OCH3,若核磁共振氢谱有3个峰,说明分子中有3种不等效H原子,故有机物的结构简式为CH3CH2OH,故答案为:CH3OCH3,CH3CH2OH;15.常温下某混合气由烯烃和炔烃两种气体组成.将1.0体积混合气在氧气中充分燃烧,产生3.0体积CO2和2.4体积水蒸气(相同状况下测定).则①该混合气体的平均分子式是C3H4.8.②上述两类烃的结构简式分别为HC≡C﹣CH3、H2C═CH﹣CH3;其体积比为V(C3H6):V(C3H4)=2:3 .考点:有关有机物分子式确定的计算.专题:烃及其衍生物的燃烧规律.分析:将1.0体积混合气在氧气中充分燃烧,产生3.0体积CO和2.4体积水蒸气,可知1mol2混合气体含有3个C原子,4.8个H原子,则平均分子式是C3H4.8,应为丙烯和丙炔的混合物,利用平均值法可确定二者的体积之比.解答:解:(1)在相同条件下,气体的体积之比等于物质的量之比,将1.0体积混合气在氧气中充分燃烧,产生3.0体积CO2和2.4体积水蒸气,可知1mol混合气体含有3个C 原子,4.8个H原子,则平均分子式是C3H4.8,故答案为:C3H4.8;(2)可能的气体为C2H4、C4H6;C2H2、C4H8;C3H4、C3H6;如为C2H4、C4H6,二者应按1:1混合才能满足平均C原子数为3,则H原子数为5,不符合题意;如为C2H2、C4H8,二者应按1:1混合才能满足平均C原子数为3,则H原子数为5,不符合题意;则只能为C3H4、C3H6,设C3H6的物质的为xmol,C3H4的物质的量为ymol,则=4.8,x:y=2:3,结构简式分别为HC≡C﹣CH3、H2C═CH﹣CH3,故答案为:HC≡C﹣CH3;H2C═CH﹣CH3;V(C3H6):V(C3H4)=2:3.16.(1)有机物若完全燃烧生成CO2和H2O,或不完全燃烧生成CO、CO2、H2O.则此有机物含有元素的组成情况C、H或C、H、O (填元素符号).(2)某有机物ag与0.8mol O2在密闭容器中充分混合后点燃.待充分反应后,将产物中的H2O(g)和其它气态产物先缓慢通过足量澄清石灰水,产生40g白色沉淀,溶液质量减少0.8g.余下气体通过浓硫酸干燥后,再缓慢通过足量灼热CuO,固体由黑变红.将产生的气体又缓慢通过足量过氧化钠,充分反应后固体质量增加11.2g且只有氧气放出(假设每一步都充分反应或吸收).请回答下列问题:①通过计算确定该有机物化学式为C2H6O2.②若ag该有机物恰好与18.4g金属钠完全反应,试确定该有机物的结构简式HOCH2CH2OH .③若0.4mol该有机物恰好与9.2g金属钠完全反应,试确定该有机物的结构简式CH3﹣O﹣CH2﹣OH .(已知①醚不与钠反应②一个碳原子上同时连2个或多个羟基是不稳定的)考点:有机物实验式和分子式的确定;有关有机物分子式确定的计算.专题:烃及其衍生物的燃烧规律.分析:(1)根据质量守恒定律,化学反应前后元素种类不变进行确定,有机物燃烧燃烧时一般有氧气参与,据此分析解答;(2)①通过澄清石灰水,产生沉淀为碳酸钙40g,由此可知该有机物燃烧生成二氧化碳的物质的量为:=0.4mol,含二氧化碳的质量为0.4mol×44g/mol=17.6g,因析出沉淀40g,溶液质量减轻0.8g,所以该有机物燃烧生成的水的质量为:40g﹣0.8g﹣17.6g=21.6g,水的物质的量为:=1.2mol,通过灼热氧化铜,由于发生反应CuO+CO Cu+CO2,生成的二氧化碳和过氧化钠反应生成碳酸钠和氧气,反应方程式为:2Na2O2+2CO2=2Na2CO3+O2,由此可知增重即为CO的质量,物质的量为:=0.4mol,故该有机物中含碳0.4mol+0.4mol=0.8mol,含氢1.2mol×2=2.4mol,含氧:0.4mol×2+0.4mol+1.2mol﹣0.8mol×2=0.8mol,故该有机物中碳氢氧物质的量之比为:0.8mol:2.4mol:0.8mol=1:3:1,最简式为:CH3O,分子式为C2H6O2;②结合分子式、根据有机物与钠反应的关系,判断分子中官能团个数,据此书写结构简式;③结合分子式、根据有机物与钠反应的关系,判断分子中官能团个数,据此书写结构简式.解答:解:(1)由题意可知有机物燃烧后产物只有CO和H2O或不完全燃烧生成CO、CO2、H2O,2从生成物中含有碳、氢元素,依据质量守恒定律可知该物质中一定含有碳、氢元素,氧元素不能确定,可通过测定有机物及CO2和H2O的质量,若C、H两元素的质量之和等于有机物的质量,则该有机物只含C、H两元素;若C、H两元素的质量之和小于有机物的质量,则该有机物一定含有C、H、O三种元素,故答案为:C、H或C、H、O;(2)①通过澄清石灰水,产生沉淀为碳酸钙40g,由此可知该有机物燃烧生成二氧化碳的物质的量为:=0.4mol,含二氧化碳的质量为0.4mol×44g/mol=17.6g,因析出沉淀40g,溶液质量减轻0.8g,所以该有机物燃烧生成的水的质量为:40g﹣0.8g﹣17.6g=21.6g,水的物质的量为:=1.2mol,通过灼热氧化铜,由于发生反应CuO+CO Cu+CO2,生成的二氧化碳和过氧化钠反应生成碳酸钠和氧气,反应方程式为:2Na2O2+2CO2=2Na2CO3+O2,由此可知增重即为CO的质量,物质的量为:=0.4mol,故该有机物中含碳0.4mol+0.4mol=0.8mol,含氢1.2mol×2=2.4mo l,含氧:0.4mol×2+0.4mol+1.2mol﹣0.8mol×2=0.8mol,故该有机物中碳氢氧物质的量之比为:0.8mol:2.4mol:0.8mol=1:3:1,最简式为:CH3O,分子式为C2H6O2;故答案为:C2H6O2;②由以上计算可知ag该有机物的物质的量为0.4mol,18.4g金属钠的物质的量为:=0.8mol,即1mol该有机物能和2mol钠反应,所以该有机物含2个羟基,结构简式为:HOCH2CH2OH,故答案为:HOCH2CH2OH;③9.2g钠的物质的量为:=0.4mol,0.4mol有机物和0.4mol钠反应,可知该有机物中含一个羟基,结构简式为:CH3﹣O﹣CH2﹣OH,故答案为:CH3﹣O﹣CH2﹣OH.。
烷烃烯烃苯的化学性质、同分异构体练习题(附答案)

烷烃烯烃苯的化学性质、同分异构体练习题一、单选题1.下列说法中,正确的是( )A.烷烃、烯烃、炔烃属于脂肪烃B.烷烃、烯烃、炔烃和苯及其同系物都属于脂肪烃C.苯及其同系物属于脂环烃D.烷烃、烯烃、炔烃都属于饱和烃2.下列物质属于同系物的是( )①CH3CH2Cl②CH2=CHCl③CH3CH2CH2Cl④CH2ClCH2Cl⑤CH3CH2CH2CH3⑥CH3CH(CH3)2A.①②B.①④C.①③D.⑤⑥3.美国康乃尔大学的威考克斯(C·Wilcox)所合成的一种有机分子就像一尊释迦牟尼佛像,因而称为释迦牟尼分子(分子中所有原子均在同一平面),如图。
对于该有机物的叙述正确的是( )①该有机物属于芳香烃②该有机物的分子式为C22H12③该有机物能发生加成反应④该有机物的一氯代物的同分异构体有6种A.③B.①②C.②③D.①②③④4.下列有机物.既能被酸性高锰酸钾溶液氧化.又能与溴水发生加成反应的是( )A.苯B.甲苯C.乙烯D.乙烷5.下列有关乙炔性质的叙述中,既不同于乙烯又不同于乙烷的是( )A.能燃烧生成二氧化碳和水B.能与溴水发生加成反应C.能与KMnO4酸性溶液发生氧化反应D.能与HCl反应生成氯乙烯6.下列有关烷烃的叙述中,不正确的是( )A.在烷烃分子中,所有的化学键都是单键B.烷烃中除甲烷外,很多都能使KMnO4酸性溶液褪色C.分子通式为C n H2n+2的烃一定是烷烃D.所有烷烃在光照条件下都能与氯气发生取代反应7.某烃的结构简式为,它可能具有的性质是( )A.易溶于水,也易溶于有机溶剂B.既能使溴水褪色,又能使KMnO4酸性溶液褪色C.能发生加聚反应,其加聚产物可用表示D.能使溴水褪色,但不能使KMnO4酸性溶液褪色8.下列各化合物的命名中正确的是( )A.CH2=CH-CH=CH2 1,3-二丁烯B. 3-丁醇C. 2-甲基苯酚D. 2-乙基丙烷9.某化合物由碳、氢、氧三种元素组成,其红外光谱图有C-H键、O-H键、C-O键的振动吸收,该有机化合物的相对分子质量是60,则该有机化合物的结构简式是( )A.CH3CH2OCH3B.CH3CH2CH(OH)CH3C.CH3CH2CH2OHD.CH3CH2CH2OCH310.已知烯烃在一定条件下被氧化时,C=C键断裂,RCH=CHR'可被氧化成RCHO和R'CHO。
高二化学炔烃试题答案及解析

高二化学炔烃试题答案及解析1.如图所示装置进行实验,将液体A逐滴加入到固体B中,下列叙述中错误的是A.实验中仪器C可起到防止倒吸的作用B.若A为醋酸,B为贝壳(粉状),D中盛C6H5ONa溶液,则D中溶液变浑浊C.若A为浓氨水,B为生石灰,D中盛AgNO3溶液,则D中无现象D.若A为食盐水,B为电石,D中盛KMnO4酸性溶液,则D中溶液紫红色褪色【答案】C【解析】A.实验中仪器C可起导气和防止倒吸的作用,正确;B. 若A为醋酸,B为贝壳(粉状),D中盛C6H5ONa溶液,由于酸性:醋酸>碳酸>苯酚,则根据强酸制取弱酸的原理,D中溶液变浑浊,正确;C. 若A为浓氨水,B为生石灰,产生的氨气通过导气管进入到烧杯D的盛AgNO3溶液,首先产生白色沉淀,后沉淀溶解得到银氨溶液,错误;D. 若A为食盐水,B为电石,则在B中产生是乙炔C2H2气体进入到D中盛KMnO4酸性溶液,与酸性高锰酸钾发生氧化还原反应,而使D中溶液紫红色褪色,正确。
【考点】考查物质的性质、操作、现象的关系的知识。
2.下列叙述的乙炔的结构和性质中,既不同于乙烯,也不同于乙烷的是A.存在不饱和键B.不易发生取代反应,易发生加成反应C.分子中的所有原子都处在同一条直线上D.能使酸性KMnO4溶液褪色【答案】C【解析】乙炔中所有原子处在同一条直线上,乙烯所有的原子处于同一个平面上。
乙烷所有的原子不能共线也不能共面。
故C选项是正确的。
【考点】考查乙炔机构的相关知识点。
3. CaC2和ZnC2、Al4C3、Mg2C3、Li2C2等都属于离子型碳化物。
请通过CaC2制C2H2的反应进行思考,从中得到必要的启示,判断下列反应产物正确的是A.ZnC2水解生成乙烷B.Al4C3水解生成丙炔C.Mg2C3水解生成丙炔D.Li2C2水解生成乙烯【答案】C【解析】 A.ZnC2+2H2O Zn(OH)2↓+ C2H2↑;错误。
B.Al4C3+6H2O4Al(OH)3↓+ 3CH4↑;错误。
《有机化学》练习题与参考答案
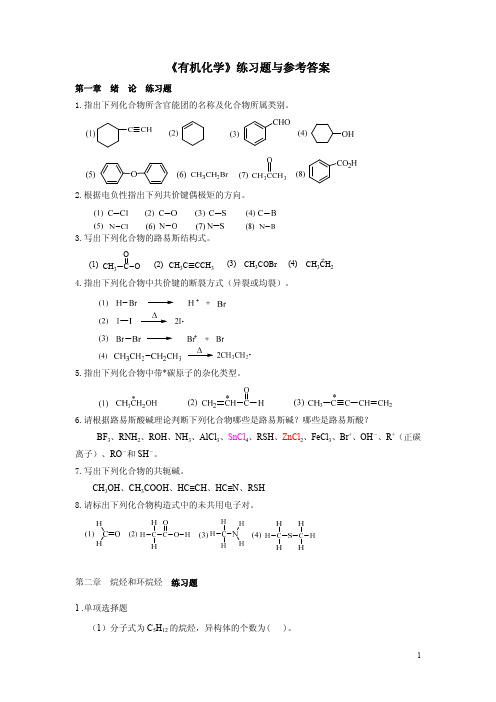
(4)苯酚分子中,羟基属于( )。 A.间位定位基 B.邻位定位基 C.对位定位基 D.邻、对位定位基
(5)苯分子中碳原子的杂化方式是( )。 A.sp 杂化 B.sp2 杂化 C.sp3 杂化 D.sp2d 杂化
6
(6)下列基团能活化苯环的是( )。 A.-NH2 B.-COCH3 C.-CHO D.-Cl
(7)
基团的名称是( )。
A.苄基 B.苯基 C.甲苯基 D.对甲苯基 (8)下列化合物中,在 Fe 催化下发生卤代反应最快的是( )。
A.乙苯 B.邻二硝基苯 C.苯酚 D.氯苯 (9)在苯分子中,所有的 C-C 键键长完全相同,是因为( )。
A.自由基加成反应 B.亲电取代反应 C.亲电加成反应 D.协同反应
2..判断题(对的打√,错的打×) (1)炔烃比烯烃的不饱和程度大,所以炔烃更容易发生加成反应。 (2)在卤化氢中,只有 HBr 与烯烃的加成才观察到过氧化物效应。 (3)凡是具有通式 CnH2n-2 的化合物一定是炔烃或环烯烃。 (4)顺-1,2-二氯-1-溴乙烯又可命名为(Z)-1,2-二氯-1-溴乙烯。
(7)
CC
H3CH2CH2C
CH3
4.写出下列化合物的结构式。
(2) CH3CH2CHCH2CH3 CH CH2
(4) H2C CH CH C(CH3)2
H
H
(6)
CC H
H3C
CC
H
CH2CH3
(1)3-甲基环戊烯
(2)3,3-二甲基-1-己炔
(3)2,4-二甲基-1,3-己二烯 (4)3-乙基-1-戊烯-4-炔
(名师整理)最新高考化学专题复习热点题型《烷烃、烯烃、炔烃的结构与性质》难点精练课件

6.1 mol 某链烃最多能和 2 mol HCl 发生加成反应,生成 1 mol 氯代烷,1 mol
该氯代烷能与 6 mol Cl2 发生取代反应,生成只含有碳氯两种元素的氯代烃,
该链烃可能是
()
A.CH3CH===CH2
B.CH3C≡CH
C.CH3CH2C≡CH
D.CH2===CHCH===CH2
的中心,4 个氢原子分别位 不饱和烃;6 个原子 不饱和烃,所有的原
于 4 个顶点
在同一个平面上 子均在同一直线上
空间构型
正四面体形
平面 形
直线 形
2.烃的分类 根据烃分子中碳原子间成键方式的不同,烃可分为饱和烃和不饱和 烃,不 饱和烃可分为烯烃、炔烃和芳香烃等。
3.物理性质
4.化学性质
(1)烷烃的取代反应
解析:1 mol CH3CH===CH2 最多能和 1 mol HCl 发生加成反应,A 不满足题 意;1 mol CH3C≡CH 最多能和 2 mol HCl 发生加成反应生成 C3H6Cl2,1 mol C3H6Cl2 能与 6 mol Cl2 发生取代反应,生成只含有碳氯两种元素的氯代烃 C3Cl8,B 满足题意;1 mol CH3CH2C≡CH 最多能和 2 mol HCl 发生加成反应 生成 C4H8Cl2,1 mol C4H8Cl2 能与 6 mol Cl2 发生取代反应,生成 C4H2Cl8,该 产物含 H,C 不满足题意;1 mol CH2===CHCH===CH2 最多能和 2 mol HCl 发生加成反应生成 C4H8Cl2,1 mol C4H8Cl2 能与 6 mol Cl2 发生取代反应,生成 C4H2Cl8,该产物含 H,D 不满足题意。 答案:B
考点(一) 烷烃、烯烃、炔烃的结构与性质
烷烃、环烷烃、烯烃、炔烃

烷烃、环烷烃、烯烃、炔烃一、烷烃1、烷烃的命名和异构普通命名法、习惯命名法C1-C10:甲、乙、丙……壬、癸C11以上用中文数字:如十一烷正、异、新的含义俗名系统命名法一长、二多、三小的原则(最低系列)书写原则:a、在母体前标出取代基及位次b、相同取代基合并,小的在前(按次序规则)c、数字与数字间用逗号、数字与文字间用短横隔开IUPAC命名法与系统命名法的区别:取代基书写次序按英文字母序烷基的命名及英文缩写-CH3甲基Me. -CH2CH3乙基Et.-CH2CH2CH3丙基n-Pr. -CH(CH3)2异丙基i-Pr.-(CH2)3CH3 丁基n-Bu. -CH2CH(CH3)2异丁基i-Bu.-CH(CH3)CH2CH3 仲丁基s-Bu.-C(CH3)3叔丁基t-Bu.SP3杂化、正四面体结构伯、仲、叔、季碳原子(1°、2°、3°、4°碳原子)构造式、结构简式、键线式锯架式、投影式、纽曼式等同分异构构造异构碳架异构、位置异构、官能团异构构型异构对映异构、顺反异构(烯烃、脂环化合物)构象异构1、烷烃的物理性质及变化规律颜色、气味熔点、沸点密度、溶解性、极性变化规律沸点(直链、支链)熔点(直、支链,奇、偶数)2、烷烃的反应A、氧化反应燃烧生成CO2和H2O 注意碳氢比与产物的关系催化氧化生成含氧衍生物如醇、醛、酸等【例题】三种等摩尔气态脂肪烷烃在室温(25℃)和常压下的体积为2升,完全燃烧需氧气11升;若将该气态脂肪烃混合物冷至5℃,体积减少到原体积的0.933倍。
试写出这三种脂肪烃的结构式,给出推理过程。
注:已知该混合物没有环烃,又已知含5个或更多碳原子的烷烃在5℃时为液态。
(12分)【评析】(1)解题的第一步是写出用烷烃通式来表示的完全燃烧的化学方程式:C n H2n+2+(1.5n+0.5)O2=nCO2+(n+1)H2O写出通式的依据自然是试题告诉我们——这三种气态烷烃中没有环烷。
大学有机化学总结习题及答案

有机化学总结一.有机化合物的命名1. 能够用系统命名法命名各种类型化合物:包括烷烃,烯烃,炔烃,烯炔,脂环烃(单环脂环烃和多环置换脂环烃中的螺环烃和桥环烃),芳烃,醇,酚,醚,醛,酮,羧酸,羧酸衍生物(酰卤,酸酐,酯,酰胺),多官能团化合物(官能团优先顺序:-COOH >-SO3H >-COOR >-COX >-CN >-CHO >>C =O >-OH(醇)>-OH(酚)>-SH >-NH2>-OR >C =C >-C ≡C ->(-R >-X >-NO2),并能够判断出Z/E 构型和R/S 构型。
2. 根据化合物的系统命名,写出相应的结构式或立体结构式(伞形式,锯架式,纽曼投影式,Fischer 投影式)。
立体结构的表示方法:1)伞形式:COOHOH3 2)锯架式:CH 3OHHHOH 2H 53)纽曼投影式: 4)菲舍尔投影式:COOH CH 3OHH5)构象(conformation)(1) 乙烷构象:最稳定构象是交叉式,最不稳定构象是重叠式。
(2) 正丁烷构象:最稳定构象是对位交叉式,最不稳定构象是全重叠式。
(3) 环己烷构象:最稳定构象是椅式构象。
一取代环己烷最稳定构象是e 取代的椅 式构象。
多取代环己烷最稳定构象是e 取代最多或大基团处于e 键上的椅式构象。
立体结构的标记方法1. Z/E 标记法:在表示烯烃的构型时,如果在次序规则中两个优先的基团在同一侧,为Z 构型,在相反侧,为E 构型。
CH 3C HC 2H 5CH 3CC H2H 5Cl(Z)-3-氯-2-戊烯(E)-3-氯-2-戊烯2、 顺/反标记法:在标记烯烃和脂环烃的构型时,如果两个相同的基团在同一侧,则为顺式;在相反侧,则为反式。
CH 3CCH CH 3HCH 3CC H HCH 3顺-2-丁烯反-2-丁烯333顺-1,4-二甲基环己烷反-1,4-二甲基环己烷3、 R/S 标记法:在标记手性分子时,先把与手性碳相连的四个基团按次序规则排序。
烯烃炔烃的系统命名练习题(附答案)

烯烃炔烃的系统命名练习题(附答案)1.烷烃正确答案为C。
2-甲基-3-丙基戊烷。
2.下列有机物的命名正确的是正确答案为B。
2,2-二甲基丁烷。
3.某单烯烃与氢气的加成产物为:CH3CH2CH(CH3)CH2CH3,下列相关说法正确的是正确答案为C。
原单烯烃可能有3种不同结构。
4.下列说法正确的是正确答案为B。
属于醛类,官能团为—CHO。
5.下列有机物的命名正确的是正确答案为B。
CH3CH2CH=CH2:3—丁烯。
6.有机物的系统名称为正确答案为C。
3,4,4-三甲基-2-戊炔。
7.下列有机物的命名肯定错误的是正确答案为C。
2,2-二甲基丙烷。
8.下列有机物的命名正确的是正确答案为B。
3-乙基-1-丁烯。
9.关于烷烃的命名正确的是正确答案为A。
3,3,5-三甲基-5-乙基辛烷。
10.对于烃的命名正确的是正确答案为D。
2,4-二甲基-2,4-二乙基庚烷。
11.根据名称写出下列有机物的结构简式,并判断下列有机物命名是否正确,如不正确,指出错误原因,然后再写出正确命名1) 2,2,3,3-四甲基戊烷;CH3CH(CH3)C(CH3)CH3命名正确。
解析:A.该有机物中含有两个乙基基团,且它们都连接在同一个碳原子上,所以其名称是2,2-二乙基丁烷,故A错误;B.该有机物中含有两个甲基和一个乙基基团,它们连接在同一个碳原子上,所以其名称是2,3-二甲基-6-乙基庚烷,故B错误;C.该有机物中含有两个甲基和一个乙基基团,它们连接在不同的碳原子上,所以其名称是2-甲基-3-乙基-4-异戊烷,故C正确;D.该有机物中含有两个甲基和一个丙基基团,它们连接在同一个碳原子上,所以其名称是2,3-二甲基-4-丙基庚烷,故D 错误;故选:C5.答案:A解析:根据有机物的命名规则,选择分子中含有碳原子数最多的碳链为主链,当最长碳链有多条选择时,选取连有支链最多的为主链。
在该分子中,选择含有8个碳原子的链为主链,编号如下:因此,该分子的名称为3,4-二甲基-4-乙基庚烷,故选A。
有机化学 第四版 课后答案
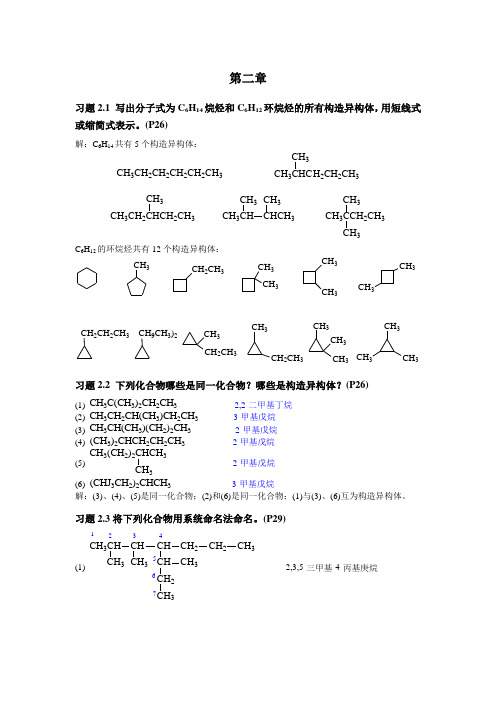
第二章习题2.1 写出分子式为C 6H 14烷烃和C 6H 12环烷烃的所有构造异构体,用短线式或缩简式表示。
(P26)解:C 6H 14共有5个构造异构体:CH 3CH 2CH 2CH 2CH 2CH 3CH 3CHCH 2CH 2CH 3CH 3CH 3CH 2CHCH 2CH 3CH 3CH 3CCH 2CH 3CH 3CH 3CH 3CH CHCH 3CH 3CH 3C 6H 12的环烷烃共有12个构造异构体:CH 3CH 3CH 3CH 3CH 3CH 2CH 3CH 3CH 33CH 2CH 3CH 3CH 2CH 3CH 2CH 2CH 3CH 3CH 3CH 3CH 3CH 3CH 3CH 9CH 3)2习题2.2 下列化合物哪些是同一化合物?哪些是构造异构体?(P26)(1) CH 3C(CH 3)2CH 2CH 3 2,2-二甲基丁烷 (2) CH 3CH 2CH(CH 3)CH 2CH 3 3-甲基戊烷 (3) CH 3CH(CH 3)(CH 2)2CH 3 2-甲基戊烷 (4) (CH 3)2CHCH 2CH 2CH 3 2-甲基戊烷 (5)CH 3(CH 2)2CHCH 3CH 32-甲基戊烷(6) (CHJ 3CH 2)2CHCH 3 3-甲基戊烷解:(3)、(4)、(5)是同一化合物;(2)和(6)是同一化合物;(1)与(3)、(6)互为构造异构体。
习题2.3将下列化合物用系统命名法命名。
(P29)(1)CH 3CH CHCH CH 2CH 2CH 3CH 3CH CH 3CH 2CH3CH 31234567 2,3,5-三甲基-4-丙基庚烷(2)1234567CH 3CH CHCH CH 2CH 2CH 3CH 3CH CH 3CH 3CH 3 2,3-二甲基-4-异丙基庚烷(3)123456CH 3CH CHCH 2CHCH 3CH 3CH 3CH 32,3,5-三甲基己烷习题2.4 下列化合物的系统命名是否正确?如有错误予以改正。
烯烃 炔烃带答案

烯烃炔烃基础一、单选题1.下列烃中不是饱和烃的是()A.CH4B.C2H4C.C2H6D.C4H102.下列关于乙烷(CH3—CH3)和乙烯(CH2===CH2)的说法中不正确的是()A.乙烷和乙烯都是由碳、氢两种元素组成B.乙烷属于饱和烃,乙烯属于不饱和烃C.乙烷和乙烯分子中碳原子形成的共价键相同D.乙烯分子中的碳原子还能结合氢原子3.某烯烃的相对分子质量为84,该烯烃的分子式是()A.C4H10B.C5H10C.C6H12D.C6H144.据报道,科学家合成了一种分子式为C200H300含多个碳碳双键的链状烃,其分子中所含碳碳双键最多是()A.48个B.49个C.50个D.51个5.某混合气体由两种气态烃组成。
2.24 L该混合气体完全燃烧后,得到4.48 L二氧化碳(气体已折算成标准状况)和3.6 g水。
则这两种气体可能是()A.CH4和C3H8B.CH4和C3H4C.C2H4和C3H4D.C2H4和C2H66.乙烷和乙烯的混合气体200 mL,在催化剂的作用下与氢气发生加成反应,最多消耗氢气100 mL,则原混合气体中乙烷和乙烯的体积比是()A.2∶1B.3∶1C.1∶1D.1∶37.一种气态烷烃和气态烯烃组成的混合物共10 g,混合气体的密度是相同状况下氢气密度的12.5倍,该混合气体通过装有溴水的试剂瓶时,试剂瓶总质量增加了8.4 g,该混合气体的组分可能是() A.乙烯和乙烷B.乙烷和丙烯C.甲烷和乙烯D.丙烯和丙烷8.下列有关乙炔的说法不正确的是()A.燃烧时有浓厚的黑烟B.实验室制乙炔时可用CuSO4除杂质气体C.为了减缓电石和水的反应速率,可用饱和食盐水来代替D.乙炔的收集方法可用排空气法收集9.下列有关烃说法叙述正确的是()A.通式为C n H2n+2的烃一定是烷烃B.通式为C n H2n的烃一定是烯烃C.通式为C4H6的烃一定是炔烃D.相对分子质量为128的烃一定是烷烃10.已知Mg2C3的结构与CaC2相似,由此可断定Mg2C3与水反应的产物是()A.Mg(OH)2和CH≡CH B.MgO和CH≡CHC.Mg(OH)2和CH3CH=CH2D.Mg(OH)2和CH3C≡CH11.下列烯烃中存在顺反异构体的是()A.丙烯B.1-丁烯C.3-己烯D.2-甲基-2-丁烯二、填空题13.已知碳原子数小于或等于8的某单烯烃与HBr反应,其加成产物只有一种结构。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
烷烃1. 价键理论、分子轨道理论有什么区别?[解答] 价键理论、分子轨道理论是目前关于共价键形成、本质的两个主要理论。
它们的不同之处在于价键理论是定域的,主要讨论两个原子之间的电子配对成键情况。
而分子轨道是以电子离域的观点为基础的。
在电子离域的共轭体系中,用分子分子轨道理论讨论问题可以避免价键理论定域的缺陷。
2. 烯烃加溴是反式加成,其他加成也是反式吗?[解答]:不一定。
亲电加成反应是分步进行的,首先与亲电试剂反应,生成正离子活性中间体。
烯烃加溴,通常认为是经过环状溴翁离子中间体进行的,所以得到反式加成的结果:其他的加成反应并不一定经过环状中间体的过程,比如加 HBr ,首先得到碳正离子活性中间体:Cl2可以形成翁离子,也可以形成碳正离子活性中间体,所以产物为顺式和反式两种产物。
3. 丙烯与氯气高温下反应,主要产物为α-H的氯代产物(A),为什么不产生亲电加成产物(B)?[解答]:烯烃与卤素在低温或无光照条件下,在液相中主要发生亲电加成反应。
在高温或光照条件下,主要发生自由基取代反应,一般取代在双键的α-H上。
这主要由于C—Cl键键能较小,高温下容易断裂而使反应可逆。
同时,取代反应的活性中间体更稳定。
4. 乙烯、丙烯、异丁烯在酸催化下与水加成,其反应速度哪个最快?为什么?[解答]:乙烯 < 丙烯 < 异丁烯。
决定于活性中间体碳正离子的稳定性次序。
5. 下列反应如何完成?[解答]:(1)CH3COOOH , CH3COOH (2)稀、冷 KMnO4,OH-6. 叁键比双键更不饱和,为什么亲电加成的活性还不如双键大?[解答]:叁键碳原子sp杂化,双键碳原子sp2杂化。
电负性Csp>Csp2,σ键长sp-sp<sp2-sp 2叁键中形成两个π键的 p 轨道交盖的程度比在双键中更大,结合更紧密。
故不易发生给出电子的亲电加成反应。
7. 烯烃比炔烃更易发生亲电加成反应(Cl2、HCl、Br2、H2O,H+等),但当这些亲电试剂与炔烃作用时,反应很易停留在卤代烯烃阶段,进一步加成需要更强烈的条件,是否矛盾?[解答]:不矛盾。
叁键发生亲电加成确实没有双键活泼。
如:但在卤代烯烃的结构中,卤素的吸电子作用降低了双键碳上的电子云密度,使得亲电反应不易进一步发生。
所以反应易停留在卤代烯烃阶段。
8. 为什么烯烃不能与 HCN 反应?[解答]:烯烃与HBr、HCl等无机强酸发生亲电加成反应,反应的第一步(速度决定步骤)为质子对π键的亲电进攻生成碳正离子。
HCN 是弱酸,没有足够的 H + 对双键进行亲电进攻。
所以反应不能发生。
9.为什么烯烃不能与 HCN 反应,炔烃却可以?[解答]:乙炔与 HCN 发生的是亲核加成。
碱可以催化反应。
反应中CN—先进攻叁键,生成负离子 - CH=CHCN ,它再与氢离子作用,完成反应。
烯烃π键不易受亲核试剂进攻,不易发生亲核加成反应。
10、异戊烷氯代时产生四种可能的异构体,它们的相对含量如下:上述的反应结果与游离基的稳定性为3︒>2︒>1︒>CH3·是否矛盾?解释之[解答]:不矛盾。
在高温下各产物的多少,除了与游离基的稳定性有关外,还与产生某种游离基的几率有关,即与不同位置上可取代氢的数目有关。
可产生产物(i)的氢有6个,每个的相对产量为5.8%;生成(ii)的氢只有1个,相对产量为22%;生成(iii)的氢有2个,每个的相对产量为14%,生成(iv)的氢有3个,每个的相对产量为 5.3%。
从上述不同单个游离基所生成的产物来看,仍符合游离基的稳定性为3︒>2︒>1︒>CH3·的规律。
11、考虑假设的两步反应:,它是用下面的能量轮廓图来描述的,请回答(1)总的反应(A→C)是放热还吸热?(2)标出过渡状态。
哪个过渡状态是决定速度的?(3)正确的速度常数的大小次序是什么?(i)K1>K2>K3>K4 (ii) K2>K3>K1>K4 (iii) K4>K2>K3>K2 (iv) K3>K2>K4>K1(4)哪一个是最稳定的化合物?(5)哪一个是最不稳定的化合物?[解答]:(1)放热,C处在较低的能态,因此比A稳定。
(2)第二个过渡态是决定速度的(3)K2>K3>K1>K4 (4)C (5)B12、下列结构式,哪些代表同一化合物的相同构象,哪些代表同一化合物的不同构象,哪些彼此是构造异构体?[解答]:(1)与(3);(4)与(7)代表同一化合物的相同构象(1)与(2)代表同一化合物的不同构象(1)、(2)、(3)与(6)是构造异构体(4)、(7)与(8)也是构造异构体13、画出下列化合物指出的C-C键旋转的优势构象(即稳定构象)[解答]:14、下列化合物进行溴代,40℃时各种H原子的相对活性为1︒H:2︒H:3︒H = 1:220:19000,写出溴代时可能得到一溴代物的结构式,并估算各种异构体的百分含量。
(1)丁烷(2)2-甲基丁烷[解答]:15、如何实现下列转变:(1) 由为原料合成下列化合物:(2)由丁烷合成2,3-丁二醇[解答]:16、下表左栏为烃类分子式,右栏为烃类臭氧化-还原水解产物,试推测烃类的结构。
[解答]:17、有A、B两个化合物,其分子式都是C6H12,A经臭氧化并与Zn粉和水反应后得到乙醛和甲乙酮,B 经KmnO4氧化只得丙酸,推测A和B的构造式。
[解答]:18、2-丁烯通过不同的反应生成下列化合物,请写出产生各种化合物的2-丁烯的几何构型及其进行的反应。
[解答]:19、解释下旬反应中如何产生(i),(ii)两个化合物,而不生成(iii)[解答]:反应先生成2级碳正离子,它重排后生成3级碳正离子,3级比2级稳定得多,分别与水生成(i),(ii)。
(iii)需要1级碳正离子才能产生,但1级碳正离子能量高,不易形成,故无(iii)生成。
20、写出下列反应的反应机理CH2=CHCH2I与Cl2+H2O发生反应,主要产物为ClCH2CHOHCH2I,同时产生少量的HOCH2CHClCH2I和ClCH2CHICH2OH[解答]:21、用简便的化学方法鉴别(1)2-甲基丁烷(2)3-甲基-1-丁烯(3)3-甲基-1-丁炔解答:(1)银氨溶液(2)Br2/CCl422、以乙炔、丙炔为原料,合成下列化合物23、用什么二烯和亲二烯体以合成下列化合物28、完成下列反应方程式:29、写出下列反应的主要产物:30、完成下列反应方程式:第四章 脂环烃一、命名下列化合物1.2.3.4. CH 3CH 35.1-甲基-2-异丙基环戊烷 1,6-二甲基螺[4.5]癸烷 二环[2.2.1]庚烷造 反-1,2-二甲基环丙烷2,7,7-三甲基二环[2.2.1]庚烷二、写出下列化合物的结构式1、反-1-甲基-4-叔丁基环己烷2、5,6-二甲基二环[2.2.1]庚-2-烯(CH 3)3CH 3CH 3CH 33、2,3-二甲基-8-溴螺[4.5]癸烷4、1,2-二甲基-7-溴双环[2.2.1]庚烷CH 3CH 3BrCH 3H CH 3Br二、完成下列反应式1.+CH 3O C OCH 32.CH 3CH CH 2CH 2+ HBrCH CH 2CH 3CH 3Br3.CH 3+COOCH 3COOCH 3COOCH 3CH 3COOCH 34.H 3CH 3CCH 2CH 3Cl 2+C 2H 5Cl C CH 2CH CH 3ClCH 35. HBrH 3CH 3CCH 2CH 3+CH 3CH 3CH C CH CH 3Br6.CH OHCH CH 3KMnO 4CH 3CH OH OHCH 3C7.CH CCH 3CH3C CH 3OCH 3+8.H 2SO 4H 2O+CH 3OH CH CH 2CH 339.C O C O+O CO C O O10. +COOCH 3COOCH 3COOCH 3COOCH 3三、请写出顺-1-甲基-4-叔丁基环己烷、反-1-甲基-3-异丙基环己烷、反-1-甲基-4-异丙基环己烷、反-1-叔丁基-4-氯环己烷的稳定构象。
C(CH 3)3H CH 3HCH(CH 3)2H CH 3H CH(CH 3)2CH 3C(CH3)3Cl四、用化学方法鉴别下列化合物1.苯乙炔 环己烯 环己烷 环丙烷 2. 1-戊烯 1,2-二甲基环丙烷 1-丁炔 丁烷五、合成题1.以乙炔和丙烯为原料合成 CH 2ClCH 2H 22CH2CH 2CH CH CHNH CHCH CLindlarCH2CH 2CH 2 △Cl ℃+CH 2CH CH CH CH 2ClCl +CH 3500CH CH 22.以环己醇为原料合成(已二醛) OHC -(CH 2)4-CHOCHO(1)(2)O 3(CH 2)4OHC Zn/H 2O3.以烯烃为原料合成 ClCH2ClClCH 2Cl ℃+2CH CH 2ClCl +CH 3500CH CH 2Cl+CH 2Cl Cl 2Cl CH 2Cl4.从1-甲基环己烷出发合成反-2-甲基环己醇。
Br 2H 3CCH 3+hv Br3六、推测结构1.某烃C 3H 6(A)在低温时与氯作用生成C 3H 6Cl 2(B),在高温时则生成C 3H 5Cl(C)。
使(C)与碘化乙基镁作用得C 5H 10(D),后者与NBS 作用生成C 5H 9Br(E)。
使(E)与氢氧化钾的酒精溶液共热,主要生成C 5H 8(F),后者又可与丁烯二酸酐发生双烯合成得(G)。
试推测由(A)到(G)的结构式。
(A )CH 3CH CH 2; (C )CH CH 2CH 2Cl; (D )CH 2CH 3CH CH 2CH 2(B )CH CH 3CH 2;(E )CH CH 2CH 3CH CH 2Br ;(G )C OC O CH 3O(F )CH CH 3CH CH CH 2;2.有(A),(B),(C),(D)四种化合物分子式均为C 6H 12,(A)与臭氧氧化水解后得到丙醛和丙酮,(D )用臭氧氧化水解后只得到一种产物。
(B )和(C )与臭氧或催化氢化都不反应,(C )分子中所有的氢原子均为等价,而(B )分子中含有一个CH 3—CH< 结构单元。
问(A ),(B ),(C ),(D )可能的结构式?(A )CH 3C 2H 5CH 3C CH ; (B )CH 3; (C )(D )C 2H 5CH 3CH 2CHCH 或 H 3C CH 3C H 3C CH 3C3.化合物(A )分子式为C 4H 8,它能使溴水褪色,但不能使稀的高锰酸钾溶液褪色。
