初中化学人教版九年级上册原子的构成
人教版初中化学九年级上册 3.2 原子的构成( 26 张PPT)(共26张PPT)

相对质量
每粒大米
1
每粒黄豆
3
每粒蚕豆 10
课堂练习一
将①分子②原子③质子④中子⑤电子等粒子用序号分别填入下 列适当空格中:
(1)构成物质的基本粒子是_____①___②________ (2)构成原子的基本粒子是_______③__④___⑤____
(3)显示电中性的粒子是_______①__②___④____
( 11 , 11 )
原子核比原子小得多
原子
原子核
金刚石
碳原子
BBB BBB
水
水分子
BBB
反馈练习
1 我国计划在2007年发射一颗饶月探测卫星,其任务之一是寻找
一种新能源——氢-3,氢-3原子核是由一个中子和两个质子构成
的,其原子核外电子数为
(B)
A、1 B、2
C、3
D、6
2 有关原子的相对质量说法正确的是 A、相对原子质量的单位是g
小结2
原子构成的规律:
⑴、核电荷数 = 质子数 = 核外电子数 (原子核所带的电荷数简称为核电荷数)
⑵、原子不显电性。
⑶、原子中不一定含有中子。 ⑷、不种类的原子,质子数和电子数都不相同。
( P70表4-1)构成原子的粒子的电性和质量
?从上表你能得出哪些结论?
B
小结3
m m (1)
= 质子
中子
17、儿童是中心,教育的措施便围绕 他们而 组织起 来。2021/8/102021/8/102021/8/102021/8/10
2、Our destiny offers not only the cup of despair, but the chalice of opportunity. (Richard Nixon, American President )命运给予我们的不是失望之酒,而是机会之杯。二〇二一年六月十七日2021年6月17日星期四
新人教版九年级化学 原子的构成讲义

原子的构成
1、原子的构成:原子是由原子核(质子和中子)和核外的电子构成,但并不是所有的原子都有中子(氢原子就没有中子),每个质子带一个单位的正电荷,每个电子带一个单位的负电荷,中子不带电。
2、原子呈电中性:由于原子核内质子所带的电荷数和核外电子所带的电荷数相等,但电性相反,因此原子不显电性。
3、原子核外电子的排布规律:原子的电子在原子核外是分层排布的,原子最少一个电子层,最多7个电子层,第一层最多排2个电子,第二层最多排8个电子,最外层不得超过8个电
2n
子,其规律为:2
4、1-18号元素的原子结构示意图
5、原子最外层电子数规律金属元素的原子最外层电子一般少于4个,反应时容易失去最外层电子,变成阳离子。
;非金属元素原子最外层一般多余4个电子,反应时一般容易得到电子变成阴离子;稀有气体元素原子最外层为2个电子(一个电子层)或8个电子,反应时不容易得失电子,是一种、稳定结构。
6、原子中的等量关系:质子数=核电荷数=核外电子数=等于原子序数
7、相对原子质量:是一个比值,相对原子质量=质子数+中子数。
初中化学人教版九年级上册原子的构成

原子真是最小的粒子吗? 在任何情况下原子都不能再分吗?
第三单元 物质构成的奥秘
课题2 原子的构成
原子的发现历程
道尔顿于1803 年提出科学假 说:物质由原子 组成,原子是不 可分割的实心 球体,同种原子 的性质和质量 相同.
•改写这一论断的是科学家汤姆生。
原子的发展历程
原子是不是不可分割的实心球体?
17
铁
26
30
26
1、构成原子的粒子一般是质子、中子、电子
不一是所个有的氧原原子都子有中是子,氢由原子8的个中质子数子为0、。 8个 23..在 质中子原数子子中和和, 中质 子8子 数个数不一=电定电子相子等数构=,但核成很电接的荷近数。
4.不同种类的原子, 质子数不相同,核外电子数也不相同
课堂练习
1 下列叙述正确的是( C D ) A 原子核都由质子和中子构成 B 在原子中,核内的质子数与核外的电子数不一定
相等 C 原子里有相对很大的空间,电子在这个空间里作
高速运动 D 不同种类的原子,核内的质子数不同
2、我国南海海底蕴藏着丰富的锰结核——含有
锰、铁、铜等金属的矿物。已知锰原子的核内
质子数为25,相对原子质量为55,则锰原子的
越快。 3、原子间有间隔。 4、原子可以直接构成物质也可以构成分子。 5、原子在化学变化中不能再分。 6、由原子构成的物质,原子可以保持物质
的化学性质。
原子的质量测定值
一个碳原子的质量是: 0.00000000000000000000000001993千克 即1.993×10-26千克 一个氧原子的质量是: 0.00000000000000000000000002657千克 即2.657×10-26千克 一个铁原子的质量是: 0.00000000000000000000000009288千克 即9.288×10-26千克
3.2 原子的构成 课件 人教版九年级化学上册

2.离子的表示方法:“数字前,符号后,1省略,右上角”。 (如:镁离子Mg2+ 硫酸根离子SO42-)
3.离子也是构成物质的粒子。 (如:氯化钠NaCl由钠离子Na+和氯离子Cl-构成)
三、相对原子质量
原子种类 氢 氧 碳 铁
原子质量(kg) 1.67*10-27 2.657*10-26 1.993*10-26 9.288*10-26
A.是原子的实际质量 B.可以用千克作单位 C.是比值,没有单位 D.在数值上约等于质子数与中子数之和
2.科学家近来制造出一种元素的原子,其核电荷数为112,相
对原子的质量为227.下列说法中错误的是( A )
A.中子数为112
B.质子数和中子数之和为227
C.质子数为112
D.中子数与核外电子数之差为3
说明:由于原子的质量数值太小,书写使用不方便, 所以采用相对原子质量
相对原子质量:
以一种碳原子质量的1/12为标准,其他原子的质 量跟它相比较所得的比
该原子的实际质量
相对原子质量(Ar)= 标准碳原子质量的1/12
注意:
Ar = 12m某 m碳
1 相对原子质量不是原子的实际质量,是一个比值
2 相对原子质量的单位是1
3.铁原子的相对原子质量是( B )
A 56克
B 56
C 9.288*10-26 Kg D 1/56
4.某粒子最外层有8个电子,下列对该粒子的判断
正确的是( D )
A 一定是阳离子
B 一定是阴离子
C 一定是m,一种碳原子的质量是n,
求铁的相对原子质量? Fe(Ar)= 12m/ n
二、原子核外电子的排布 读P54第1、2段
人教版初中化学九上 3.2 原子的结构-原子的构成 课件
11
11
11
氯 17 18
17
17
17
1.不同原子之间有哪些区别?
原子里质子数不同,原子种类也不同。
2.所有原子都是由质子、中子、电子构成的吗?
不是所有的原子都有中子。如氢原子
观察表格(表3-1),思考下列问题
原子种类 质子数 中子数 核外电子数 核电荷数 原子序数
氢
1
0
1
1
1
碳
6
6
6
6
6
氧
8
8
8
8
8
钠 11 12
11
11
11
氯 17 18
17
17
17
3. 质子数、中子数在数量上有什么关系?
质子数不一定等于中子数。
4.质子数、电子数、核电荷数、原子序数有什么联系?
质子数=核外电子数=核电荷数=原子序数
以氧原子为例,说明构成原子的粒子有 哪几种?它们是怎样构成的?为什么整 个原子不显电性?
构成原子的微粒有质子、中子和电 子;在氧原子中8个中子和8个质子 构成了原子核,8个电子在核外运动, 从而构成了氧原子。
+13 2 8 3
Al
你能挑战
3.溴的原子结构示意图如下,试回答:
1)X的值为 35 ,
2)溴元素的化学性质与下列哪种元素
的化学性质最相似
( C ) Br
+12 2 8 2
Mg
A
+7 2 5
N
B
+17 2 8 7
Cl
C
+16 2 8 6
S
D
原子的结构
第一课时
一、原子的构成
初中化学人教版九年级上册原子的构成

(n代表电子层数).
请动手试一试:
元 质子 电子 素 数 层数 H1 1
O8 2 Ne 10 2
Mg 12 3
Cl 17 3
各层电子数 第1层 第2层 第3层
1
26
28
28 2
28
7
3.原子结构示意图
钠原子结构示意图 第二层 第三层
你知道吗?
原子核的半径为原子半径 的十万分之一
原子核的体积为原子体积 的千亿分之一
原子核
原 子
所以在原子核外有很大的空间,电子就在 这广阔的空间里高速运动。
原子核外的电子是如何运动的? 1、高速运动 2、无规则运动 3、分层运动
电子经常出现 的区域叫电子层。
原子核外的电子是如何运动的?
(1).高速运动 (2).无规则运动
原子种类
氢原子 1
0
1
碳原子 6
6
6
氧原子 8
8
8
阅读教材 总结规律
规律
原子:质子数=电子数 氢原子中没有中子
质子数不一定等于中子数
钠原子 11 12
11 原子:质子数=核电数
氯原子 17 18
17 原子核电荷数=电子数
观察表格(表3-1),思考讨论下列问题
原子种类 质子数 中子数 核外电子数 核电荷数
知识回顾
• 1.什么是分子? • 2. 什么是原子? • 3.分子与原子的区别:
第三单元 物质构成的奥秘
课题2 原子的结构
吞盘初中:余凤飞
学习目标
(1)了解原子是由质子、中子和电子构成的,以及构 成粒子之间的关系。 (2)初步了解原子核外电子是分层排布的。 (3)初步学会分析原子结构示意图。
人教版化学-九年级上册-3.2《原子的构成》配套课件

(A)原子(B)分子 (C)电子 (D)原子核
4.一个碳原子的质量是1.993×10千克,
碳的相对原子质量为 (C )
(A)12克(B)14 (C)12 (D)16
5.已知原子的核电荷数,可以确定它的(B )
(A)相对原子质量 (B)质子数
A、146 B、92 C、136 D、238
4、道尔顿在著作中说:“一切物质都是由数量巨大的、 极微小的粒子(原子)构成的,这些粒子间通过引力互相 结合,我们不能创造原子,也不能分裂原子,我们能实验 的变化,无非是把原先结合在一起的原子分开,或原先分 开的原子结合起来。”有人对其观点作如下修正,你认为
相 对 原 子 质 量=
一种碳原子真实质量×1/12
1.6726 ×10- 27 kg ×质子数+1.6748 ×10- 27 kg ×中子数
=
1.66×10- 27 kg
= 质子数+中子数
练一练:
1.据中央电视台2001年6月3日对云南抚仙湖湖底古城考古的现
场报道,科学家曾通过对古生物遗骸中的碳-14含量来推断古城
练习题
氢原子的质量= 1.6726×10- 27 kg 氢原子的相对原子质量 = 1.6726×10- 27 kg÷ 1.66×10- 27 kg ≈ 1
碳12的十二分 之一的质量
练习题
氢原子的质量= 1.6726×10- 27 kg
氢原子的相对原子质量
= 1.6726×10- 27 kg÷ 1.66×10- 27 kg ≈ 1
A.40 B.54 C.26 D.27
3.英国科学家道尔顿(J.Dolton)于19世纪初提出了近代原 子学说。他认为物质是由原子构成的,这些原子是微小不 可分割的实心球体,同种原子的性质和质量都相同。请你 指出道尔顿原子学说中现代科学实验证明的事实不相符的
3.2原子的结构讲义九年级化学人教版上册

第三单元物质构成的奥秘课题2 原子的结构★知识点一、原子的构成1、构成物质的三粒子:原子、分子、离子。
构成原子的三种粒子:质子、中子、电子。
原子由原子核和核外电子两部分构成。
2、原子不显电性的原因:原子核带的正电荷数与核外电子所带电量相等,电性相反。
3、原子的质量主要集中原子核;原子的质量主要由质子和中子决定。
4、不是所有原子都含有中子,如氢原子就不含中子。
5、原子中的等量关系:核电荷数=质子数=电子数。
二、原子核外电子的排布1、核外电子是分层排布的。
2、核外电子排布的规律:第一层最多2个;第二层最多8个;最外层不超过8个(只有一层不超过2个)3、120号元素的原子结构示意图。
4、元素在周期表中的周期数等于原子的电子层数。
5、元素的化学性质主要取决于原子的最外层电子数。
注:(1)稳定结构:最外层具有8个电子(只有一层具有2个电子)的结构。
(2)各类元素性质与原子结构的关系:最外层电子数得失电子倾向化学性质金属元素一般少于4个易失不稳定非金属元素一般为47个易得不稳定1、离子:带电荷的原子或原子团。
2、离子的分类阳离子;带正电荷的离子。
如:H+、Na+、Mg2+、Al3+、Ca2+、NH4+、Fe3+、Fe2+阴离子:带负电荷的离子。
O2、S2、Cl、OH、SO42、CO32、NO3、3、离子符号的意义:Mg2+:表示镁离子;1个镁离子带2个单位的正电荷2Mg2+:表示2个镁离子.4、离子的判断:质子数>电子数的是阳离子。
质子数<电子数的是阴离子。
5、离子与形成离子的原子在质量上相等,且属于同种元素。
四、相对原子质量1、概念:以一种碳原子质量的1/12为标准,其它原子的质量跟它相比较所得的比,就是相对原子质量。
2、计算式:某元素相对原子质量=()()kg1 12kg12⨯一个该原子的实际质量一种碳原子的实际质量3、相对原子质量=质子数+中子数。
注意:相对原子质量不是实际质量,单位是1,省略。
人教版九年级化学上册 第1课时原子的构成、相对原子质量

6. 一个铝原子共有40个粒子,其中14个粒子不带电,则铝的相对原子质
量为( C )
A. 13
B. 26
C. 27
D. 40
作业布置
课题2 原子的结构
注意:氢原子没有中子
新知学习
课题2 原子的结构
一、原子的构成
想一想:原子内部有带正电的质子和带负电的电子, 那么整个原子是否显电性?为什么?
原子不显电性
原子核内质子所带电荷与核外电子的电荷数量相等,电性相反 核电荷数=质子数=电子数
新知学习
二、相对原子质量
课题2 原子的结构
原子的质量很小
1个氢原子的质量约为:1.67Ⅹ10-27 kg 1个氧原子的质量约为:2.657Ⅹ10-26 kg
相对原子质量 1 12 16 23
新知学习
课题2 原子的结构
一些常见元素的名称、符号和相对原子质量
新知总结
课题2 原子的结构
1.原子的构成 原子
质子 每个质子带1个单位正电荷 原子核
中子 不带电
电子 每个电子带1个单位负电荷
核电荷数=质子数=核外电子数
2.以一种碳原子质量的1/12作为标准,其他原子的质量与它相比较所得的 比,作为这种原子的相对原子质量
原子质量数值太小,书写和使用都不方便
国际上一致同意采用相对原子质量来替代原子质量
新知学习
课题2 原子的结构
二、相对原子质量
以一种碳原子质量的1/12为标准,其他原子的质量与它相 比较所得的比,作为这种原子的相对原子质量(符号Ar)
作为标准的碳原子叫做碳12,是含有6个质子和6个中子的碳原子
它的质量的1/12等于1.66Ⅹ10-27 Kg
相对原子质量≈质子数 + 中子数
人教版化学九年级上册 3.2 原子的结构--原子的构成 课件

原子种类 核电荷数 质子数 中子数 电子数 相对原子质量
H
1
1
0
1
1
Mg
12
12 12
12
24
Fe
26
26
30 26
56
2、据报道,上海某医院正研究用放射性碘治疗肿瘤,这 种碘原子的核电荷数是53,相对原子质量是125,下列关 于这种原子的说法错误的是 ( C )
A.质子数是53 B.核外电子数是53 C.中子数是53 D.质子数与中子数之和是125
标准
已知:氧原子的质量=2.657×10-26Kg
标准=
1 12
×一个碳12原子的质量
≈ 1.66×10-27Kg
氧原子质量
氧的相对原子质量=
2.657×10-26Kg 1.66×10-27Kg 标准
≈ 16
注意: 1、相对原子质量不是原子的实际质量,是原子的 相对质量,是一个比值,单位:为1(一般不写)
课题1 原子的构成
课题一 原子的构成
分析表格
阅读下表,你能得出什么结论呢?
构成原子的粒 子种类
各粒子的电性
质子
1个单位正电荷
中子 电子
不带电 1个单位负电荷
各粒子的质量(kg)
1.6726×10-27 1.6749×10-27 质子质量的1/1836
1、质子带正电,中子不带电,电子带负电。所以原子 核的量。
原子的质量很小,书写、使用都很不方便,怎么办?
课题一 原子的构成
教学目标
1.知识与技能 (1)初步了解相对原子质量的概念,并学会查 相对原子质量表。
(2)学会应用概念计算某一原子的相对原子质量。 (3)能说出原子的实际质量和相对质量的区别与联系。 2.过程与方法 (1)学习用相对值代表实际值的方法 (2)学会查阅资料、表格中运用观察、分析归纳的方法获取信息,并对收 集的信息进行加工处理,提高自主探究的能力。 3.情感态度价值观目标 (1)学会科学计量的重要性,培养学生科学的计量观和计量意识。 (2)结合张青莲教授的卓越贡献资料,进行爱国主义教育。
人教版九年级化学上册原子的构成.pptx

4、下列叙述中正确的是( D )
练一练, 你会了吗
A 相对原子质量就是原子的实际质量的简称
B 相对原子质量可以用千克或者克做单位
C 相对原子质量就是一个没有单位的比值
D 相对原子质量约等于原子核内质子数与中子数之和
5、某原子R:相对原子质量为m, 核内质子数为n,则其核外电子数 (C )
A、m-n
核外电子 (带负电荷)
在原子中:核电荷数=质子数=电子数
• 一个氢原子的质量是 • 一个氧原子的质量是 • 一个碳原子的质量是
1.67×10-27Kg 2.657×10-26Kg 1.993×10-26Kg
你认为如果用这样的数字来表示原子的质 量方便吗?
有没有更好的方法来表示呢?
一 个 某原 子 的 实 际 质 量与一个碳原子实际 质量的1/12的比值,叫做这种原子的相对原子质量。
(1)构成物质的基本粒子是____①___②_________ (2)构成原子的基本粒子是____③___④__⑤_______ (3)显示电中性的粒子是______①__②___④_____ (4)带正电的粒子是______③__________ (5)参加化学反应一定发生变化的粒子是_____①_______ (6)原子中数目一定相等的粒子是____③___⑤________
在此输入您的封面副标题
初中化学课件
鼎尚图文 整理制作
复习提问:
1、构成物质的微粒有 分子、原子
2、分子可以再分为原子,但原子在化学变化中可 再分吗?
原子在化学变化中是最小的粒子
3、原子有没有自身的结构?
原子有自身的结构
同学们,你听说过原子弹吗?不 烦目睹一下!
为什么原子弹和氢弹爆炸 时会产生如此巨大的能量?
人教版初三化学上册原子的结构知识点

人教版初三化学上册原子的结构知识点原子的中心是一些带正电的粒子,外围是一些绕转着的电子,下面是查字典化学网整理的原子的结构知识点,希望对大家有帮助。
知识点一、原子的构成1. 原子的构成原子由原子核和电子构成,原子核由质子和中子构成。
2. 每个质子带一个单位正电荷,每一个电子带一个单位负电荷,中子不带电。
原子核所带的正电荷数为核电荷数。
电子的质量很小,可忽略不计,原子的质量主要集中在原子核上。
3. 构成原子的粒子一般是质子、中子、电子。
构成原子的必要粒子是质子和电子,决定原子种类的是质子。
4. 原子核所带正电荷数(核电荷数)和核外电子所带负电荷数相等,但电性相反,所以整个原子不显电性。
5. 在原子中核电荷数=质子数=电子数,原子核内质子数不一定等于中子数。
二、相对原子量国际上以一种碳原子质量的1/12为标准,其他原子的质量跟它相比较所得到的比,作为这种原子的相对原子量(Ar)。
注意:相对原子量只是一个比,不是原子的实际质量。
相对原子量的计算公式:电子的质量很小,跟质子和中子相比可以忽略不计,所以Ar≈质子数+中子数课后练习1.(2021年福州质检)11H、12H、13H、H+、H2是()A.氢的五种同位素B.五种氢元素C.氢的五种核素D.氢元素的五种不同粒子2.下列有关钋(210 84Po)的说法正确的是()A.钋原子的核外电子数是126B.钋原子核内中子数与质子数之差是42C.钋是金属元素,最外层电子数小于4D.钋元素的相对原子质量是2103.四种主族元素的离子aXm+、bYn+、cZn-和d Rm-(a、b、c、d为元素的原子序数),它们具有相同的电子层结构,若m>n,则对下列叙述的判断正确的是 ()①a-b=n-m ②元素的原子序数a>b>c>d③元素非金属性Z>R ④最高价氧化物对应水化物碱性X>YA.②③B.③C.①②③④D.①②③4.已知1~18号元素的离子aW3+、bX+、cY2-、dZ-都具有相同的电子层结构,下列关系正确的是()A.质子数c>dB.离子的还原性Y2->Z-C.气态氢化物的稳定性H2Y>HZD.原子半径X5.假设R元素无同位素,元素R原子的质量数为A,Rm-的核外电子数为x,则W g Rm-离子所含中子的物质的量为() A.(A-x+m)mol B.(A-x-m)mol C.WA(A-x+m)molD.WA(A-x-m)mol6.短周期元素X、Y的原子序数相差7,下列有关判断错误的是()A.X和Y可能处于同一周期B.X和Y可能处于相邻周期C.X和Y可能处于同一主族D.X和Y可能处于相邻主族7.下列关于元素周期表的叙述,不正确的是()A.共有7个周期,16个族B.形成化合物种类最多的元素在第二周期C.第ⅡA族的右边是第ⅢB族,第ⅢA族的左边是第ⅡB族D.某主族元素最高价氧化物对应的水化物的化学式为HnROm,其气态氢化物的化学式一定为H2m-nR或RH2m-n 8. (20XX?嘉兴模拟)下列有关物质性质的比较中,正确的是 ()①热稳定性:CH4>NH3>H2O ②还原性:I->Br->Cl- ③酸性:H3PO4>H2SO4>HClO4 ④原子半径:Na>Mg>OA.①③B.②④C.①④D.②③可以更好的学习。
人教版初中化学九上 原子的结构原子的构成 课件

随堂反馈
见导学稿:【随堂反馈】
15
活用所学
1、为了揭开原子内部结构的奥秘,1911年著名物理
学家卢瑟福等人做了一个著名的“卢瑟福实验”:用
一束带正电的质量比电子大很多的高速运动的α粒子
轰击金箔,结果是大多数α粒子能穿过金箔且不改变
原来的前进方向,但也有一小部分改变了原来的方向,
甚至有极少数的α粒子被反弹了回来。下列结论不正
第四单元 物质构成的奥秘
课题1 原子的构成
1
预习导学
阅读教材P70-71页 完成导学稿【预习导学】
2
探究学习
一、认识原子的构成
展开你想象的翅膀,发挥你的聪明才智, 亲自动手制作一个原子模型,也可画一个 原子的构成示意图,或用其他你认为直观 的方法表示原子的构成,与同学们交流。
3
探究学习
原子的构成示意图
•
6.作者将此处坐车的困难抽象为人生 旅途的 苦难, 但从本 质上讲 他们同 样是想 达到目 的地而 不能达 到,想 实现理 想而不 能实现 自己所 有的理 想,实 质上还 是一场 苦旅。 所以“ 实质上 ”不能 去掉。
•
7.课堂活动是为了课堂教学目标而开 展的,如 果课堂 活动与 学生动 脑脱节,活动与 学生情 感、态 度、价 值观的 培养脱 节,没有 学生真 实的体 验与反 思,那 么这种 课堂活 动只能 说是一 种教学 资源的 浪费.
•
2.生命和死亡全不相容,我们是为着 生的, 或者是 为着死 的,非 此即彼 ,在本 质上不 可兼得 ;同时 ,他也 肯定了 生命的 价值, 春天必 然会来 临,谁 也无法 阻挡生 命的冲 动,无 法阻挡 我们对 于新生 命、新 世界的 渴望与 追求
•
人教版化学九年级(上册)3.2原子的结构-教学课件

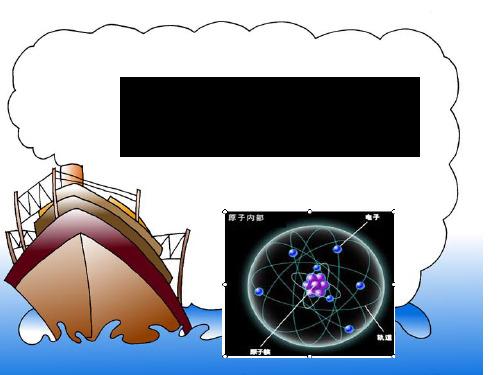
读一读这幅图,说说你得到什么信息?
一、 原 子 的 构 成
原子的构成示意图
一、原子的构成
1、原子并不是一个实心球体 2、原子是由居于原子中心的原子核和核外 电子构成。原子核是由质子和中子构成。 3、质子带正电,中子不带电,核外电子带 负电
一、原子的构成
合作探究 读表3--1, 从横向和纵向分析,找出原子中 各微粒存在的关系
(1)能直接构成纯净物的是( 分子 ),( 原子)。
(2)保持物质化学性质最小的微粒( 分子 )。
(3)化学变化中最小的微粒(原子 )。 (4)带正电荷的微粒(原子核),( 质子)。
(5)带负电荷的微粒( 电子 )。
(6)不显电性的微粒( 分子 ), ( 原子 ), ( 中子 )。
1 、下列叙述正确的是( C ) A 原子核都由质子和中子构成。 B 在原子中,核内的质子数与核外的电子数不一定相等。 C 原子里有很大的空间,电子在这个空间里作高速的运
一、原子的构成
1、质子数=核外电子数 2、质子数不一定等于中子数 3、不是所有的原子都含中子 4、不同种类的原子,核内的质子数不同,核 外的电子数也不同。
练一练:
1.原子由 ( 质子) ( 中子) ( 核外电子 ) 构成的。 质子带 正电 ,电子带 负电。 2.原子核是由 质子和中子 构成的,由于质子带 正电,因此整个原子核带的是 正 电。 3.原子核带电的多少是由 质子数 决定的。
二、核外电子的排布
自学提示
1、阅读课本54页第一、二段,及图3-10,说 出核外电子是怎样运动的?
2、画出氢、钠、氯三种原子的结构示意图。 3、观察图3-12,总结这18个原子核外电子排 布的规律。
核外电子排布规律
九年级上册人教版化学原子的结构

九年级上册人教版化学原子的结构一、原子的构成。
1. 原子的组成粒子。
- 原子是由居于原子中心的原子核与核外电子构成的。
- 原子核由质子和中子构成(氢原子除外,氢原子的原子核内只有1个质子,没有中子)。
2. 粒子的电性和电量。
- 质子带正电,每个质子带1个单位正电荷。
- 中子不带电。
- 电子带负电,每个电子带1个单位负电荷。
- 在原子中,质子数=核电荷数 =核外电子数,原子整体不显电性。
例如,氧原子的质子数为8,核外电子数也是8,所以氧原子呈电中性。
3. 原子的质量。
- 原子的质量主要集中在原子核上,因为质子和中子的质量相对电子来说很大,电子的质量很小,几乎可以忽略不计。
- 相对原子质量≈质子数 + 中子数。
例如,钠原子的质子数为11,中子数为12,其相对原子质量约为11 + 12 = 23。
二、原子核外电子的排布。
1. 电子层。
- 核外电子是分层排布的。
离核最近的电子层为第一层,离核最远的电子层为最外层。
- 第一层最多容纳2个电子,第二层最多容纳8个电子,最外层电子数不超过8个(只有1层的不超过2个)。
2. 原子结构示意图。
- 以氧原子为例,其原子结构示意图为:- 小圆圈表示原子核,圆圈内的数字表示质子数(即核电荷数),弧线表示电子层,弧线上的数字表示该层的电子数。
氧原子的质子数为8,核外有2个电子层,第一层有2个电子,第二层有6个电子。
3. 元素化学性质与最外层电子数的关系。
- 最外层电子数决定元素的化学性质。
- 稀有气体元素(如氦、氖、氩等)的原子最外层电子数一般为8个(氦为2个),这种结构称为相对稳定结构,它们的化学性质比较稳定。
- 金属元素的原子最外层电子数一般少于4个,在化学反应中易失去电子,形成阳离子。
例如,钠原子最外层电子数为1,在化学反应中易失去1个电子形成钠离子(Na⁺)。
- 非金属元素的原子最外层电子数一般多于4个,在化学反应中易得到电子,形成阴离子。
例如,氯原子最外层电子数为7,在化学反应中易得到1个电子形成氯离子(Cl⁻)。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
化学反应中的离子
Na
Cl
Na+
Cl-
NaCl
三、离子
1、离子定义——带电的原子或原子团。
阳离子:失电子带正电 (质子数>核外电子数) 2、离子
阴离子:得电子带负电荷(质子数<核外电子数)
一起练习:
1.找出原子、阳离子、阴离子的结构示意图。
+11 2 8
阳离子
+12 2 8
阳离子
+16 2 8 6
。
①元素的种类 ②元素的化学性质 ③相对原子质量 ④粒子的 电性 ⑤原子核 ⑥最外层电子数 ⑦电子层数 ⑧核外电子层 数 ⑨质子个数
阴离子
+2 2
氦原子
+8 2 8
氧离子
+17 2 8 7
氯原子
+13 2 8
铝离子
一起练习:
你选对了吗?
4.对于同种元素的原子和离子,一定具有相同的( A )
A.质子数
B.电子数
C.电子层数
D.最外层电子数
5.元素的化学性质取决于原子结构中的 ( D )
A.电子层数
B.中子数
C.核外电子数
D.最外层电子数
, ;
(2)铝元素原子核外共有 3
数是 3
;
个电子层,最外层电子
(3)铝元素的原子在化学反应中易(填“得”或“失失”)
电
子,形阳成
离子(填“阴”或“阳”3),带
个正单位的
电荷(填“正”或“负”),铝离子的符号表示Al3+
为
。
(4)由此可以看出:原子在失去最外层电子或在①最③外⑤层⑨得到电
子达到稳定结构后,一般不会发生改变的有
小结
1、 什么是离子? 失去电子
阳离子
原子
得到电子 阴离子
2、离子符号的表示:在元素符号右上角写上离子所带电荷数 及所带电荷的正负。例如Mg2+、S2-
(表示一个离子,也告诉我们带什么单位的电荷及多少电荷)
3、离子和原子的区别与联系:
11.已知铝元素的原子结构示意图为Al
(1)
表示的意义 原子核内有13个质子
原子
+17 2 8 8
阴离子
3、离子符号写法:右肩挑、数前号后
在元素符号的右上角标出离子所带的电荷的多少及电荷的正负。 (先写数字后标电荷,当离子所带电荷数为1时,1可以不写。)
如镁离子符号:Mg2+ S2-
一起练习: 2.写出下面结构示意图的离子符号
+11 2 8
Na+
+12 2 8
Mg2+
+16 2 8 8
答:钠原子与氧原子结合时,阴阳离子个数比是 1:2,离子化合物 为Na2O。Leabharlann 4.原子和离子的联系和区别
失电子
联系: 阳离子
得电子
原子
得电子 失电子
区 原子中:质子数=电子数(原子不带电) 别 阳离子中:质子数>电子数(带正电)
阴离子中: 质子数<电子数(带负电)
一起练习
3、请写出下列示意图的名称。
6. 下列关于钠离子和钠原子的认识中,不正确的是( C)。
A. 它们的质子数相同
B. 它们的电子层数不同
C. Na 比 Na+ 少一个电子 D. Na+ 的最外层是稳定结构
7.下列符号表示阳离子的是 ( C )
8、构成物质的粒子有_原__子____、 __分__子___、离__子_____。 汞由_汞__原__子__构成;氧气由_氧__分__子__构成;氯化钠(NaCl) 是由_钠__离__子__和_氯__离__子__构成。
第三单元 物质构成的奥秘 课题2 原子的结构——离子
学习目标:
1、以氯化钠为例,了解离子形成的过程,知道离 子是构成物质的一种粒子。
2、掌握离子的分类、写法以及与原子的区别和联 系。
元素的化学性质主要是由最外层电子数决定 知识回顾
金属元素
最外层电子数 <4
易失电子
稀有气体元素
=8
稳定结构
非金属元素
(1)x表示该元素原子核内的质子数,该粒子有 3 个电 子层,y与粒子的 化学性质 关系非常密切。
(2)当x-y=10,该粒子为 原子 别)。
(填类
(3)y=8时,该粒子带有2个单位的负电荷,该
粒子的符号为 S2-
。
(4)当y=1的中性原子与y=7的中性原子化合 时,形成的化合物属于 离子 化合物。
4≤ <8
易得电子
离子的形成
一、离子的形成
这下两面种是原钠子原该子如和何氯变原化子才,能这达两到种稳原定子呢的?结 构稳定吗?
+11 2 8 1
87 8 2 +17
这种粒子有什 么特点,它还
是原子吗?
这种粒子有什 么特点,它还 是原子吗?
整它个们化之合间物会还怎带样电影吗响??
表演:氯化钠是怎样形成的?
S2-
+17 2 8 8
Cl-
继续探索
Mg +12 2 8 2 e
e
失去 2个 电子
7 8 2 +17 Cl
1 个 得到
Cl
氯原 1 个
子 电子
Mg2+ +12 2 8
Cl-
8 8 2 +17 Cl-
Mg2+ Cl-
MgCl2
阴、阳离子相互结合形成离子化合物。
思考
离子化合物 NaCl 中,阴阳离子个数比是 1 : 1;而 离子化合物 MgCl2 中,阴阳离子个数比是 2 : 1;那么, 如果钠原子与氧原子结合形成化合物时,阴阳离子个数 比应是多少?
9、根据右边的结构图回答:
(1)如果该图表示的是原子,X值为_1__0 ,
该原子的符号是____Ne
。
(2)如果该图表示的是带两个单位正电荷的
阳离子,X值为___12 ,符号是_M__g_2+ 。
(3)如果该图表示的是带两个单位负电荷的
阴离子,X值为___8 ,符号是__O__2- 。
10、某粒子结构示意图为
