高中化学必修1氧化还原反应1PPT课件
合集下载
人教版高中化学必修一 《氧化还原反应》PPT教学课件

6
第六页,共三十八页。
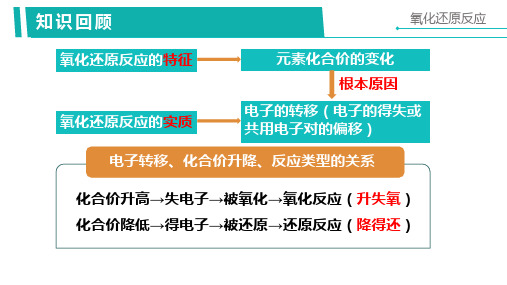
2.在氧化还原反应里的电子转移(得失或偏移)与元素化合价的关系如
图所示。
7
第七页,共三十八页。
3)在氧化还原反应中,具有最高价的元素只可能被还原,使化合价
降低;具有最低价的元素只可能被氧化,使化合价升高;处于中间价
态的元素既可能被氧化使化合价升高,又可能被还原使化合价降低。
诱思探究:下列反应哪些反应是氧化还原反应?发生氧化反应、还原反 应的各是什么物质?
(1)2NaBr+Cl2=2NaCl+Br2 (2)NaOH+HCl=NaCl+H2O
3 MnO2 4HCl(浓)MnCl2 2H2O Cl2
(4)Ca(ClO)2+CO2+H2O=CaCO3↓+2HClO
提示:(1)、(3)属于氧化还原反应。(1)中的Cl2,(3)中的MnO2发生还原 反应;(1)中的NaBr,(3)中的HCl发生氧化反应。
(4)分解反应有的是氧化还原反应,有的不是,若有单质生成,一定是 氧化还原反应,若没有单质生成,大部分是非氧化还原反应。
11
第十一页,共三十八页。
3)四种基本反应类型与氧化还原反应图示:
12
第十二页,共三十八页。
特别提示:①有单质参与的化学反应不一定是氧化还原反应,如2O3=3O2
。
②无单质参与的化合反应也可能是氧化还原反应,如
叫做氧化还原反应。
(3)元素的原子失去电子的反应叫氧化反应,元素的原子得到电子 的反应叫还原反应,有电子转换(得失或偏移)的反应,是氧化还原 反应。
3
第三页,共三十八页。
2.特征 一种或几种元素的化合价发生变化。
3.实质 氧化还原反应的实质是电子的转移(即电子的得失或偏移)。
第六页,共三十八页。
2.在氧化还原反应里的电子转移(得失或偏移)与元素化合价的关系如
图所示。
7
第七页,共三十八页。
3)在氧化还原反应中,具有最高价的元素只可能被还原,使化合价
降低;具有最低价的元素只可能被氧化,使化合价升高;处于中间价
态的元素既可能被氧化使化合价升高,又可能被还原使化合价降低。
诱思探究:下列反应哪些反应是氧化还原反应?发生氧化反应、还原反 应的各是什么物质?
(1)2NaBr+Cl2=2NaCl+Br2 (2)NaOH+HCl=NaCl+H2O
3 MnO2 4HCl(浓)MnCl2 2H2O Cl2
(4)Ca(ClO)2+CO2+H2O=CaCO3↓+2HClO
提示:(1)、(3)属于氧化还原反应。(1)中的Cl2,(3)中的MnO2发生还原 反应;(1)中的NaBr,(3)中的HCl发生氧化反应。
(4)分解反应有的是氧化还原反应,有的不是,若有单质生成,一定是 氧化还原反应,若没有单质生成,大部分是非氧化还原反应。
11
第十一页,共三十八页。
3)四种基本反应类型与氧化还原反应图示:
12
第十二页,共三十八页。
特别提示:①有单质参与的化学反应不一定是氧化还原反应,如2O3=3O2
。
②无单质参与的化合反应也可能是氧化还原反应,如
叫做氧化还原反应。
(3)元素的原子失去电子的反应叫氧化反应,元素的原子得到电子 的反应叫还原反应,有电子转换(得失或偏移)的反应,是氧化还原 反应。
3
第三页,共三十八页。
2.特征 一种或几种元素的化合价发生变化。
3.实质 氧化还原反应的实质是电子的转移(即电子的得失或偏移)。
第一章第三节氧化还原反应课件高一化学人教版必修第一册

氧化还原反应分析
3. 氧化反应与还原反应的关系分析
电子得失
电子有失必有得
得e- = 失e- = 转移e-
化合价 升降
化合价有升必有降
升价=降价
氧还反应 氧化反应与还原反应必然同时发生
氧化还原反应规律
【问题】下列哪个反应发生?为什么? Cu+Fe2+= Cu2++Fe; Fe+Cu2+= Fe2++Cu
1.强弱律 氧化剂的氧化性大于氧化产物的氧化性 还原剂的还原性大于还原产物的还原性
强氧化剂 + 强还原剂 → 弱氧化剂 + 弱还原剂
氧化还原反应规律
【问题】 在化学反应中,一个钠原子能失去一个电子,一个铝原子
能失去三个电子,所以铝的还原性比钠强,这种说法对吗?
氧化性、还原性的强弱只取决于得失电子的难易,而不 取决于得失电子的多少。
海带灰
单质碘
氧化还原反应应用
1.利用氧化还原反应原理,提取制备物质。
海带灰
?
单质碘
具体要求: (1)设计实验,确定海带灰中碘元素的存在形式。
(2)设计合理分离步骤,将海带灰中的碘离子转移到溶液体系。 (3)依据氧化还原反应原理,寻找合适的氧化剂,将碘离子转化 为碘单质,并完成实验过程。 (4)选择合适试剂,检验碘单质是否被成功提取。
共用电子对偏移
H
Cl
共用电子对偏向于氯原子而
偏离于氢原子,则氢原子化合价
升高,氯原子化合价降低。
HCl
氧化还原反应本质
3.拓展思考: 如何通过实验证明氧化还原反应中有电子转移?
Zn
Cu
H2SO4 结论:氧化还原的本质是电子的转移(电子得失和共用电子对偏移)。
人教版高一化学必修一2.3氧化还原反应课件(共28张PPT)
知识层面
2
具备自主预 习,发现、 分析问题能
力。
能力层面
3
运用已有知识 提升对新知识 的学习兴趣。
情感层面
四 教法学法分析
探究学习 做学一体
整个教学过程 中“教师为辅” 与学生共同获 取知识解决问 题,让学生 “学会”。
以学生为主,自 主学习、合作学 习、探究学习, 体验科学探究的 历程,让学生 “会学”。
能量
转换
拓展 视野
应用
【设计意图】
联系实验所演示的铜锌原电池 反应,化学能转换为电能,再 次前后呼应,便于理解。
四 教法分析
问
题
1. 视频激趣法,
引
导
, 层
2. 合作学习法,讨论法
层
引导归纳总结
探
究
增强学生的探究 意识和协作精神
过程与方法
体验氧化还原反 应概念演变,用 发展的眼光看问 题。
教学重点难点
教学重点
用化合价升降的 观点以及电子转移 的观点来理解氧化 还原反应
教学难点
氧化还原反应 的特征与本质
三学情分析
1
具备氧化反应 和还原反应的 直观概念,四 大反应类型, 元素化合价,
分类思想。
新课标人教版高中化学必修1说课
第二章 化学物质及其变化
第三节 氧化还原反应 第一课时
课标要求
• 课标要求:了解氧化还原的本质是电子的转移, 了解氧化还原在生产和生活中的应用。
• 课标解读: • 1、由表及里揭示氧化还原反应的概念。 • 2、关注生产与生活与化学的关系。
说课主要流程
教材分析 目标分析 学情分析
谢谢指导!
氧化还原 概念的建构
氧化还原 与其他概念 关系建构
2
具备自主预 习,发现、 分析问题能
力。
能力层面
3
运用已有知识 提升对新知识 的学习兴趣。
情感层面
四 教法学法分析
探究学习 做学一体
整个教学过程 中“教师为辅” 与学生共同获 取知识解决问 题,让学生 “学会”。
以学生为主,自 主学习、合作学 习、探究学习, 体验科学探究的 历程,让学生 “会学”。
能量
转换
拓展 视野
应用
【设计意图】
联系实验所演示的铜锌原电池 反应,化学能转换为电能,再 次前后呼应,便于理解。
四 教法分析
问
题
1. 视频激趣法,
引
导
, 层
2. 合作学习法,讨论法
层
引导归纳总结
探
究
增强学生的探究 意识和协作精神
过程与方法
体验氧化还原反 应概念演变,用 发展的眼光看问 题。
教学重点难点
教学重点
用化合价升降的 观点以及电子转移 的观点来理解氧化 还原反应
教学难点
氧化还原反应 的特征与本质
三学情分析
1
具备氧化反应 和还原反应的 直观概念,四 大反应类型, 元素化合价,
分类思想。
新课标人教版高中化学必修1说课
第二章 化学物质及其变化
第三节 氧化还原反应 第一课时
课标要求
• 课标要求:了解氧化还原的本质是电子的转移, 了解氧化还原在生产和生活中的应用。
• 课标解读: • 1、由表及里揭示氧化还原反应的概念。 • 2、关注生产与生活与化学的关系。
说课主要流程
教材分析 目标分析 学情分析
谢谢指导!
氧化还原 概念的建构
氧化还原 与其他概念 关系建构
高一【化学(人教版)】氧化还原反应(第一、二课时)-课件-(含实验视频)

石墨 硫酸铜溶液
高中化学
任务二 认识氧化还原反应的本质
活动2 利用图中装置 进行铁与硫酸铜溶液 反应的实验,实验现 象之一是电流计的指 针发生偏转。请你根 铁片 据这一实验现象对该 反应的原理做进一步 思考。
指针偏转
石墨 硫酸铜溶液
高中化学
任务二 认识氧化还原反应的本质
小结2
1. 所有的氧化还原反应中都存在电子转 移,电子转移是氧化还原反应的本质。
2CuO
+2
高温 0
2CuO + C
2Cu + CO2 ↑
氧化还原反应
+2
0
CuSO4 + Fe +2
Cu + FeSO4 +2
CuSO4 + 2NaOH
Cu(OH)2 ↓ + Na2SO4
非氧化还原反应
高中化学
任务一 认识氧化还原反应的特征
小结2
氧化还原反应的重要特征是反应前后有 元素的化合价变化。
氧化还原反应(第一课时)
年 级:高一
学 科:化学(人教版)
高中化学
高中化学
任务一 认识氧化还原反应的特征
1774年,法国化学家拉瓦锡提出燃烧的氧化学 说后,人们把物质与氧结合的反应叫做氧化反应, 把氧化物失去氧的反应叫做还原反应。
《九年级化学》 物质与氧发生的反应属于氧化反应。 含氧化合物里的氧被夺去的反应叫做还原反应。
2. 元素化合价的变化是电子转移的外在 表现,可以通过分析反应中是否有元素的 化合价发生变化来判断某个反应是否属于 氧化还原反应。
高中化学
任务三 巩固提升
活动1 请你为下列反应分类,说明你的分类依据。
2Na + Cl2
高中化学
任务二 认识氧化还原反应的本质
活动2 利用图中装置 进行铁与硫酸铜溶液 反应的实验,实验现 象之一是电流计的指 针发生偏转。请你根 铁片 据这一实验现象对该 反应的原理做进一步 思考。
指针偏转
石墨 硫酸铜溶液
高中化学
任务二 认识氧化还原反应的本质
小结2
1. 所有的氧化还原反应中都存在电子转 移,电子转移是氧化还原反应的本质。
2CuO
+2
高温 0
2CuO + C
2Cu + CO2 ↑
氧化还原反应
+2
0
CuSO4 + Fe +2
Cu + FeSO4 +2
CuSO4 + 2NaOH
Cu(OH)2 ↓ + Na2SO4
非氧化还原反应
高中化学
任务一 认识氧化还原反应的特征
小结2
氧化还原反应的重要特征是反应前后有 元素的化合价变化。
氧化还原反应(第一课时)
年 级:高一
学 科:化学(人教版)
高中化学
高中化学
任务一 认识氧化还原反应的特征
1774年,法国化学家拉瓦锡提出燃烧的氧化学 说后,人们把物质与氧结合的反应叫做氧化反应, 把氧化物失去氧的反应叫做还原反应。
《九年级化学》 物质与氧发生的反应属于氧化反应。 含氧化合物里的氧被夺去的反应叫做还原反应。
2. 元素化合价的变化是电子转移的外在 表现,可以通过分析反应中是否有元素的 化合价发生变化来判断某个反应是否属于 氧化还原反应。
高中化学
任务三 巩固提升
活动1 请你为下列反应分类,说明你的分类依据。
2Na + Cl2
人教版高中化学必修一《氧化还原反应》物质及其变化PPT课件

验 收
2.下列反应是氧化还原反应的是 ( A )
A.Zn+H2SO4===ZnSO4+H2↑
B.NaCl+AgNO3===AgCl↓+NaNO3
C.CaCO3=====CaO+CO2↑
D.CaO+H2O===Ca(OH)2
课
堂
3.下列变化过程中,属于还原反应的是( D )
达 标 验 收
A.HCl→Cl2
学
科
信息提取
核
已知四个氧化还原反应化学方程式,要求判断其中氧
心
化剂、还原剂属于不同物质的选项。
素
思路建立
养
元素化合价变化→氧化剂、还原剂。
第课 四堂
部 分
达 标
验
收
课
堂
1.下列变化过程中,属于还原反应的是( B )
达 标
A.HCl→H2 C.CO-→AgCl
B.Mg→Mg2+ D.CuO→Cu
元素化合价的变化。
课
前
新 知 预 习
化合 反应
氧 化
还 置换
原 反应
复分解 反应
分解 反应
反 应
课
前
考点点拨:
新
知
①复分解反应一定不是氧化还原反应。
预
②置换反应一定是氧化还原反应。
习
③有的化合反应属于氧化还原反应,有的不属于。
④有的分解反应属于氧化还原反应,有的分解反应不是。
⑤有单质参加或生成的反应不一定是氧化还原反应。
止于还原产物中的相应元素
标得失 标出转移电子的总数。
课
堂
双线桥法
探
正确标出反应前后各元素的化合价。
究
标价态
明确变价元素的化合价升降关系。
高中化学 第二章 化学物质及其变化 第三节 氧化还原反应 第1课时课件 新人教A版必修1

氧化还原反应 置换反应 复分解反应
有单质参与的反 有单质参加的化合反应和有单质生成的分解反应 应不一定是氧化 一定是氧化还原反应 还原反应 置换反应一定是氧化还原反应; 置换反应一定是氧化还原反应;复分解反应一定 不是氧化还原反应
下列反应那些是氧化还原反应 ACE A.Cu+2AgNO3=2Ag+Cu(NO3)2 B.CuSO4+Ba(OH)2= BaSO4 +Cu(OH)2 C.3Cu+8HNO3 (稀)=3Cu(NO3)2+2NO +4H2O 稀 D.Fe2O3+3H2SO4 =Fe2(SO4)3 +3H2O
下列反不是氧化还原反应是( 下列反不是氧化还原反应是 A 2CO+O2=2CO2 B SO2+2H2S=3S+2H2O
D
)
C.Cu+2H2SO4 (浓)=CuSO4+SO2 +2H2O 浓 D FeCl3+3NaOH=Fe(OH)3 +3NaCl
再见
都是
复分解反应NaOH+HCl=NaCl+H2O 都不是 全不是 2NaOH+ CuSO4 =Cu(OH)2 +Na2SO4
5.氧化还原反应与基本反应类型之间的关系: 氧化还原反应与基本反应类型之间的关系: 氧化还原反应与基本反应类型之间的关系 化合反应 分解反应
同种元素的单质(同素异形体 之间的转化不 同种元素的单质 同素异形体)之间的转化不 同素异形体 小 结 是氧化还原反应: 是氧化还原反应:如3O2==2O3
化合价升高 发生氧化反应 得到氧 化合价升高 得到氧 发生氧化反应
点燃
0
H2+CuO =Cu+H2O +
氧化还原反应(教学课件)鲁科版高中化学必修一
0 Cl2
一、氧化剂与还原剂及相关概念
氧化剂 还原剂
酸性KMnO4溶液和KI溶液的反应:
+7
-1
+2
0
2MnO4-+10I-+16H+= 2Mn2++ 5I2+ 8H2O
1. 处于高价态的是 锰 元素,处于低价态的
是 碘 元素。
2. 氧化剂是
,还原剂是
。
3. 强氧化剂一定能与强还原剂发生氧化还原反应吗?
下反应制得:2KClO3+H2C2O4+H2SO4= 2ClO2↑+2CO2↑+K2SO4+2H2O.下
列有关该反应的说法正确的是( B )
A.KClO3在反应中失去电子
B.ClO2是还原产物
C.H2C2O4在反应中被还原
D.1 mol H2C2O4参加反应有4 mol电子转移
三、氧化还原反应的配平和计算
高中同步课堂学案
C
三、氧化还原反应的配平和计算
氧化剂 还原剂
题型三 判断简单反应的产物价态或可能产物物质: 根据得失电子守恒法判断简单反应的产物价态或可能产物物质
例题3.R2O8n-在一定条件下可以把Mn2+氧化为MnO4-,若反应后R2O8n-变成 RO42-,又知反应中氧化剂与还原剂的物质的量之比为5∶2,则R2O8n-中R元素
Zn2+ H2O CO2 Fe3+ S
I2
二、常见的氧化剂与还原剂
氧化剂 还原剂
(3)元素化合价处于中间价态的物质既有氧化性,又有还原性。如:
Fe
S
H2OFe3+源自SO24-O2其中:Fe2+、SO23- 主要表现 还原 性,H2O2主要表现氧化 性。
课堂练习
氧化剂 还原剂
1.分析下列反应并按要求填空。
化学人教版高中必修1高一化学《氧化还原反应》课件-PPT

还原剂:反应中失电子的物质,表现还原性,具 有还原能力,起还原作用。
2、氧化产物:还原剂失电子被氧化对应生成物 还原产物:氧化剂得电子被还原对应生成物 氧化剂(有氧化性)--→还原产物 还原剂(有还原性)--→氧化产物
一、常见的氧化剂和还原剂
1.常见氧化剂
(1)部分非金属单质:如 、Cl2 等O。2
CaCO3 高温 CaO+CO2
(否)
2KClMO△n3O2 2KCl+3O2
(是)
CaO+H2O Ca(OH) 2
(否)
C+O2 点燃 CO2
(是)
CuO+H△2
Cu+H2O
(是)
3C+Fe2O3 高温 2Fe+3CO2
(是)
HCl+NaOH NaCl+H2O
(否)
2HCl+CaCO3 CaCl2+H2O+CO2(否)
(2)含有高价态元素的化合物:如
HNO3、 KMnO、4 FeC等l3。
H2、SO4
2.常见还原剂 (1)活泼的金属单质,如 (2)某些非金属单质,如
Al Zn Fe
、H2 、C 等。 、 C等O。 SO2
(3)某些非金属氧化物,如 、 等。
要点一 氧化性、还原性强弱的判断
1.根据氧化还原反应方程式进行判断 在同一反应中 氧化性:氧化剂>氧化产物;还原性:还原剂>还 原产物; 如:Fe+H2SO4===FeSO4+H2↑ 氧化性:H2SO4>FeSO4,还原性:Fe>H2
四 “双线桥”法
Mg + Cl2 = MgCl2
步骤:
1.标出变价元素的化合价
2、氧化产物:还原剂失电子被氧化对应生成物 还原产物:氧化剂得电子被还原对应生成物 氧化剂(有氧化性)--→还原产物 还原剂(有还原性)--→氧化产物
一、常见的氧化剂和还原剂
1.常见氧化剂
(1)部分非金属单质:如 、Cl2 等O。2
CaCO3 高温 CaO+CO2
(否)
2KClMO△n3O2 2KCl+3O2
(是)
CaO+H2O Ca(OH) 2
(否)
C+O2 点燃 CO2
(是)
CuO+H△2
Cu+H2O
(是)
3C+Fe2O3 高温 2Fe+3CO2
(是)
HCl+NaOH NaCl+H2O
(否)
2HCl+CaCO3 CaCl2+H2O+CO2(否)
(2)含有高价态元素的化合物:如
HNO3、 KMnO、4 FeC等l3。
H2、SO4
2.常见还原剂 (1)活泼的金属单质,如 (2)某些非金属单质,如
Al Zn Fe
、H2 、C 等。 、 C等O。 SO2
(3)某些非金属氧化物,如 、 等。
要点一 氧化性、还原性强弱的判断
1.根据氧化还原反应方程式进行判断 在同一反应中 氧化性:氧化剂>氧化产物;还原性:还原剂>还 原产物; 如:Fe+H2SO4===FeSO4+H2↑ 氧化性:H2SO4>FeSO4,还原性:Fe>H2
四 “双线桥”法
Mg + Cl2 = MgCl2
步骤:
1.标出变价元素的化合价
人教版化学必修一2.3氧化还原反应优秀课件PPT

( 6)被还原的元素是__H_2_S_O_4中__的__S_元__素_,
(7)1molFeS参加反应,转移电子____3___mol。
勤学勤练:
2S2- + SO32- + 6H+ = 3S↓+ 3H2O
氧化剂:__S_O_3_2_-
还原剂:__S_2_- ___
氧化产物:_S______ 还原产物:_S______
每生成1molS转移电子__1_._3_3___mol
(三)常见的氧化剂和还原剂
元素的化合价分成最高价,最低价和中间价态,元 素的最高价只有: 氧化性 最低价只有:还原性 中 间价态: 既有氧化性又有还原性 金属的化合价只 有: 正价 所以金属单质只有: 还原 性。非金属 的最高化合价一般等于 最外层电子数 最低化合价一 般等于:最高化合价-8 但是氟元素的化合价一般只 有:负一价 所以F2只有: 氧化性。
重要的氧化剂、还原剂
氧化剂
具体物质
(1)活泼非金属单质 O3、Cl2、Br2、O2
(2)高价的氧化物 NO2、CO2、MnO2
(3)高价的含氧酸 HClO、浓H2SO4、HNO3
(4)高价的盐
KMnO4、KClO3、FeCl3
(5)过氧化物
Na2O2、H2O2等
还原剂
具体物质
(1)活泼金属单质 Na、Al、Zn、Fe
记忆方法:失高氧、得低还,若说“剂” 两相反。 氧化剂本身被还原,还原剂本身被氧化。
(二)氧化还原反应中电子转移的表示方法
双线桥法 线上标出得失电子的情况及价的升降、被氧
化或被还原等内容。
1氧、化M剂nO是2:+4MHnCO2l(浓) 还原剂Cl是2↑:+MHnCCll2+2H2O 氧化产物是:Cl2 还原产物是:MnCl2 氧化剂和还原剂的物质的量之比是:_1_:__2__。 每生成2.24LCl2(标况),转移__0_._2_mol电子。
(7)1molFeS参加反应,转移电子____3___mol。
勤学勤练:
2S2- + SO32- + 6H+ = 3S↓+ 3H2O
氧化剂:__S_O_3_2_-
还原剂:__S_2_- ___
氧化产物:_S______ 还原产物:_S______
每生成1molS转移电子__1_._3_3___mol
(三)常见的氧化剂和还原剂
元素的化合价分成最高价,最低价和中间价态,元 素的最高价只有: 氧化性 最低价只有:还原性 中 间价态: 既有氧化性又有还原性 金属的化合价只 有: 正价 所以金属单质只有: 还原 性。非金属 的最高化合价一般等于 最外层电子数 最低化合价一 般等于:最高化合价-8 但是氟元素的化合价一般只 有:负一价 所以F2只有: 氧化性。
重要的氧化剂、还原剂
氧化剂
具体物质
(1)活泼非金属单质 O3、Cl2、Br2、O2
(2)高价的氧化物 NO2、CO2、MnO2
(3)高价的含氧酸 HClO、浓H2SO4、HNO3
(4)高价的盐
KMnO4、KClO3、FeCl3
(5)过氧化物
Na2O2、H2O2等
还原剂
具体物质
(1)活泼金属单质 Na、Al、Zn、Fe
记忆方法:失高氧、得低还,若说“剂” 两相反。 氧化剂本身被还原,还原剂本身被氧化。
(二)氧化还原反应中电子转移的表示方法
双线桥法 线上标出得失电子的情况及价的升降、被氧
化或被还原等内容。
1氧、化M剂nO是2:+4MHnCO2l(浓) 还原剂Cl是2↑:+MHnCCll2+2H2O 氧化产物是:Cl2 还原产物是:MnCl2 氧化剂和还原剂的物质的量之比是:_1_:__2__。 每生成2.24LCl2(标况),转移__0_._2_mol电子。
人教版高中化学必修一第二章第三节氧化还原反应 课件(共16张PPT)

1、定义:元素化合价发生变化的化学反应
有电子转移(电子的得失或偏移) 的化学反应
氧化还原的本质:电子的转移(电子的得失或 偏移)
总结
◆从得氧失氧角度分析 特点:局限于得氧失氧的反应,是氧化还原反应的表 观现象。
◆从化合价升降角度分析 特点:可作为氧化还原反应的判断依据。
◆从电子转移角度分析 特点:揭示氧化还原反应的本质。
NaCl +H2O
高温
B. CaCO3
CaO + CO2 D、E、F
C. Na2O + H2O
2NaOH
D. Mg + 2HCl
MgCl2 + H2↑
点燃
E. H2 + Cl2 Nhomakorabea2HCl
催化剂
F. 2KClO3 △ 2KCl + 3O2↑
一、氧化还原反应
1、定义:元素化合价发生变化的化学反应
氧化还原反应的特征:元素化合价发生变化
课堂练习
√
× ×√
√ ××√
关系如下图:
非氧化还原反应
Ⅱ.下列反应中属于氧化还原反应的是( CDE ) A CaCO3 + 2HCl == CaCl2 + CO2↑ + H2O B. Na2O + H2O == 2NaOH C. 2KMnO4 == K2MnO4 + MnO2 + O2↑ D. MnO2 + 4HCl == MnCl2 + 2H2O + Cl2↑ E. 3Fe + 2O2 == Fe3O4 F. CuSO4·5H2O == CuSO4 + 5H2O
人教版化学1
第二章 化学物质及变化
第三节 氧化还原反应
1.为什么这些食品要采用 真空包装?
2.从化学反应角度考虑真 空包装食品防止了什么反 应的发生?
有电子转移(电子的得失或偏移) 的化学反应
氧化还原的本质:电子的转移(电子的得失或 偏移)
总结
◆从得氧失氧角度分析 特点:局限于得氧失氧的反应,是氧化还原反应的表 观现象。
◆从化合价升降角度分析 特点:可作为氧化还原反应的判断依据。
◆从电子转移角度分析 特点:揭示氧化还原反应的本质。
NaCl +H2O
高温
B. CaCO3
CaO + CO2 D、E、F
C. Na2O + H2O
2NaOH
D. Mg + 2HCl
MgCl2 + H2↑
点燃
E. H2 + Cl2 Nhomakorabea2HCl
催化剂
F. 2KClO3 △ 2KCl + 3O2↑
一、氧化还原反应
1、定义:元素化合价发生变化的化学反应
氧化还原反应的特征:元素化合价发生变化
课堂练习
√
× ×√
√ ××√
关系如下图:
非氧化还原反应
Ⅱ.下列反应中属于氧化还原反应的是( CDE ) A CaCO3 + 2HCl == CaCl2 + CO2↑ + H2O B. Na2O + H2O == 2NaOH C. 2KMnO4 == K2MnO4 + MnO2 + O2↑ D. MnO2 + 4HCl == MnCl2 + 2H2O + Cl2↑ E. 3Fe + 2O2 == Fe3O4 F. CuSO4·5H2O == CuSO4 + 5H2O
人教版化学1
第二章 化学物质及变化
第三节 氧化还原反应
1.为什么这些食品要采用 真空包装?
2.从化学反应角度考虑真 空包装食品防止了什么反 应的发生?
人教版高中化学必修一 《氧化还原反应》PPT

第十八页,共四十四页。
(2)该反应中 Fe2O3 发生了________反应,Al 发生了________反 应。
[答案] (1)Al 失 氧化 Fe 得 还原 (2)还原 氧化
第十九页,共四十四页。
人教版高中化学必修一 《氧化还原反应》PPT
科 目:化学 适用版本:人教版 适用范围:【教师教学】
第一章 物质及其变化
第三节 氧化还原反应 第1课时 氧化还原反应
第一页,共四十四页。
目标与素养:1.从化合价变化和电子转移的角度认识、判断氧化 还原反应。(宏观辨识与微观探析)2.理解氧化还原反应与四种基本反 应类型的关系,能够识别化合反应、分解反应中的氧化还原反应。(宏 观辨识)
①铜元素化合价降低,发生 还原 反应。 ②碳元素化合价 升高 ,发生 氧化 反应。 (2)对于无氧元素参加的反应 Fe+CuSO4===FeSO4+Cu。 ①铜元素化合价 降低 ,发生 还原 反应。 ②铁元素化合价 升高 ,发生 氧化 反应。 (3)结论:凡是有元素 化合价升降 的反应,都是氧化还原反应。
第十七页,共四十四页。
3.有反应:Fe2O3+2Al=高==温==Al2O3+2Fe。 (1)________元素的化合价升高,则该元素的原子____________ 电子,被________(填“氧化”或“还原”);而________元素的化合 价降低,则该元素的原子________电子,被___________(填“氧化” 或“还原”)。
__氧__化__反_应____ 还原反应
第四页,共四十四页。
结论:一种物质得到氧发生 氧化反应 ,必然有一种物质失去 氧发生 还原反应 ,氧化反应和还原反应是在一个反应中同时发生 的,称为氧化还原反应。
第五页,共四十四页。
(2)该反应中 Fe2O3 发生了________反应,Al 发生了________反 应。
[答案] (1)Al 失 氧化 Fe 得 还原 (2)还原 氧化
第十九页,共四十四页。
人教版高中化学必修一 《氧化还原反应》PPT
科 目:化学 适用版本:人教版 适用范围:【教师教学】
第一章 物质及其变化
第三节 氧化还原反应 第1课时 氧化还原反应
第一页,共四十四页。
目标与素养:1.从化合价变化和电子转移的角度认识、判断氧化 还原反应。(宏观辨识与微观探析)2.理解氧化还原反应与四种基本反 应类型的关系,能够识别化合反应、分解反应中的氧化还原反应。(宏 观辨识)
①铜元素化合价降低,发生 还原 反应。 ②碳元素化合价 升高 ,发生 氧化 反应。 (2)对于无氧元素参加的反应 Fe+CuSO4===FeSO4+Cu。 ①铜元素化合价 降低 ,发生 还原 反应。 ②铁元素化合价 升高 ,发生 氧化 反应。 (3)结论:凡是有元素 化合价升降 的反应,都是氧化还原反应。
第十七页,共四十四页。
3.有反应:Fe2O3+2Al=高==温==Al2O3+2Fe。 (1)________元素的化合价升高,则该元素的原子____________ 电子,被________(填“氧化”或“还原”);而________元素的化合 价降低,则该元素的原子________电子,被___________(填“氧化” 或“还原”)。
__氧__化__反_应____ 还原反应
第四页,共四十四页。
结论:一种物质得到氧发生 氧化反应 ,必然有一种物质失去 氧发生 还原反应 ,氧化反应和还原反应是在一个反应中同时发生 的,称为氧化还原反应。
第五页,共四十四页。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
元素的化合价每降低一价,该元素 的原子得到一个电子,降低几价, 得到几个电子。
氧化还原反应的本质
共价化合物HCl 的形成过程
H H
Cl Cl
电子对偏离,化合价升高,被氧化
0
0
H2 + Cl2
+1-1
=
2 HCl
电子对偏向,化合价降低,被还原
化合价升降的原因:共用电子对的偏移
[结论] 本质定义:有电子转移(得失或偏移)的化学反应 都是 氧化还原反应。
[问题]化合价的升降是什么原因引起的?
从电子得失角度分析:
NaCl 的形成过程
失去e-
Na
Cl
失去e-后
得到e-后
失电子,化合价升高,被氧化
00
+1 -1
2Na+Cl2 = 2Na Cl
Na+ [ Cl ]-
得电子,化合价降低,被还原
Na+ Cl -
化合价升降的原因: 电子的得失
元素的化合价每升高一价,该元素 的原子失去一个电子,升高几价, 失去几个电子。
是
点燃
(5) 2Mg+O2=2MgO
是
(6) CaCO3+CO2+H2O=Ca(HCO3)2
非氧化还原反应
学与问
置换反应、有单质参加的化合反应和有 单质生成分解反应全部属于氧化还原反应
四大基本反应类型与氧化还原反应间的关系
氧化还原反应
化合反应
分解反应
置换反应
复分解反应
非氧化还原 反应
氧化还原反应的本质
氧化还原反应
感受氧化还原反应的存在
刚削好的苹果
放置30分钟以后的苹果
感受氧化还原反应的存在
刚泡好的绿茶
放置2小时后的绿茶
感受氧化还原反应的存在
好吃的月饼
脱氧剂
感受氧化还原反应的存在 金 属 生 锈
资料
一 .初步认识氧化还原反应
【探究一】
H2 + CuO △ Cu +H2O
得到氧,被氧化,发生氧化反应
对 CuO: C+u2 O
Cu 0
有元素化合价升降的化学反应是氧化还原反应。
(氧化还原反应的特征或判断依据)
(1)MnO2+4HCl(浓) = MnCl2+2H2O+Cl2↑ 是
(2)Cl2+2FeCl2=2FeCl3
是
(3)2CuO+C 高温 2Cu+CO2 是
(4)2KClO3 MnO2 2KCl+O2
氧化性和还原性 氧化性:得电子的性质 还原性:失其中的氧化剂和还原剂
写在最后
经常不断地学习,你就什么都知道。你知道得越多,你就越有力量 Study Constantly, And You Will Know Everything. The More
You Know, The More Powerful You Will Be
物质失去(偏离)电子,所含元素 化合价升高,发生氧化反应
升、失、氧
物质得到(偏向)电子,所含元素化 合价降低,发生还原反应
降、得、还
二、氧化剂和还原剂
基本概念
氧化剂和还原剂 氧化剂:得电子(电子对偏向)的物质 还原剂:失电子(电子对偏离)的物质
氧化产物和还原产物 氧化产物:还原剂被氧化后得到的生成物 还原产物:氧化剂被还原后得到的生成物
对 H2:
H2
H2O
失去氧, 被还原, 发生还原反应
对 CuO: CuO
Cu
【结论】氧化还原反应:
氧化反应和还原反应同时发生的反应。
初步认识氧化还原反应
【探究二】 H2 + CuO △ Cu +H2O
化合价升高, 被氧化, 发生氧化反应
对 H2: H20
H2O +1
化合价降低, 被还原, 发生还原反应
结束语
感谢聆听
不足之处请大家批评指导
Please Criticize And Guide The Shortcomings
讲师:XXXXXX XX年XX月XX日
氧化还原反应的本质
共价化合物HCl 的形成过程
H H
Cl Cl
电子对偏离,化合价升高,被氧化
0
0
H2 + Cl2
+1-1
=
2 HCl
电子对偏向,化合价降低,被还原
化合价升降的原因:共用电子对的偏移
[结论] 本质定义:有电子转移(得失或偏移)的化学反应 都是 氧化还原反应。
[问题]化合价的升降是什么原因引起的?
从电子得失角度分析:
NaCl 的形成过程
失去e-
Na
Cl
失去e-后
得到e-后
失电子,化合价升高,被氧化
00
+1 -1
2Na+Cl2 = 2Na Cl
Na+ [ Cl ]-
得电子,化合价降低,被还原
Na+ Cl -
化合价升降的原因: 电子的得失
元素的化合价每升高一价,该元素 的原子失去一个电子,升高几价, 失去几个电子。
是
点燃
(5) 2Mg+O2=2MgO
是
(6) CaCO3+CO2+H2O=Ca(HCO3)2
非氧化还原反应
学与问
置换反应、有单质参加的化合反应和有 单质生成分解反应全部属于氧化还原反应
四大基本反应类型与氧化还原反应间的关系
氧化还原反应
化合反应
分解反应
置换反应
复分解反应
非氧化还原 反应
氧化还原反应的本质
氧化还原反应
感受氧化还原反应的存在
刚削好的苹果
放置30分钟以后的苹果
感受氧化还原反应的存在
刚泡好的绿茶
放置2小时后的绿茶
感受氧化还原反应的存在
好吃的月饼
脱氧剂
感受氧化还原反应的存在 金 属 生 锈
资料
一 .初步认识氧化还原反应
【探究一】
H2 + CuO △ Cu +H2O
得到氧,被氧化,发生氧化反应
对 CuO: C+u2 O
Cu 0
有元素化合价升降的化学反应是氧化还原反应。
(氧化还原反应的特征或判断依据)
(1)MnO2+4HCl(浓) = MnCl2+2H2O+Cl2↑ 是
(2)Cl2+2FeCl2=2FeCl3
是
(3)2CuO+C 高温 2Cu+CO2 是
(4)2KClO3 MnO2 2KCl+O2
氧化性和还原性 氧化性:得电子的性质 还原性:失其中的氧化剂和还原剂
写在最后
经常不断地学习,你就什么都知道。你知道得越多,你就越有力量 Study Constantly, And You Will Know Everything. The More
You Know, The More Powerful You Will Be
物质失去(偏离)电子,所含元素 化合价升高,发生氧化反应
升、失、氧
物质得到(偏向)电子,所含元素化 合价降低,发生还原反应
降、得、还
二、氧化剂和还原剂
基本概念
氧化剂和还原剂 氧化剂:得电子(电子对偏向)的物质 还原剂:失电子(电子对偏离)的物质
氧化产物和还原产物 氧化产物:还原剂被氧化后得到的生成物 还原产物:氧化剂被还原后得到的生成物
对 H2:
H2
H2O
失去氧, 被还原, 发生还原反应
对 CuO: CuO
Cu
【结论】氧化还原反应:
氧化反应和还原反应同时发生的反应。
初步认识氧化还原反应
【探究二】 H2 + CuO △ Cu +H2O
化合价升高, 被氧化, 发生氧化反应
对 H2: H20
H2O +1
化合价降低, 被还原, 发生还原反应
结束语
感谢聆听
不足之处请大家批评指导
Please Criticize And Guide The Shortcomings
讲师:XXXXXX XX年XX月XX日
