化学期末考试试卷题库(含答案)
最新高中高三期末考试化学试题(答案解析)

辽宁省辽河油田第二高级中学【精品】高三期末考试化学试题学校:___________姓名:___________班级:___________考号:___________一、单选题1.下列说法错误的是A.“霾尘积聚难见路人”,雾霾所形成的气溶胶有丁达尔效应B.水玻璃、双氧水、漂粉精、硅胶都是混合物C.氢氧燃料电池、硅太阳能电池中都利用了原电池原理D.“陶成雅器”的主要原料是黏土2.设N A为阿伏加德罗常数的值。
下列说法正确的是A.常温常压下,32gO2与O3的混合气体中含有的分子总数小于N AB.1L0.1mol•L-1NaClO溶液中含有的ClO- 数目为N AC.标准状况下,22.4L甲醇中含有的氧原子数目为N AD.1mol Fe在1molCl2中充分燃烧,转移的电子数目为3N A3.下列解释事实的化学用语不正确...的是A.闪锌矿(ZnS)经CuSO4溶液作用后,转化为铜蓝(CuS):ZnS + Cu2+ === CuS + Zn2+ B.0.1 mol/L 的醋酸溶液pH约为3:CH 3COOH CH3COO- + H+C.电解NaCl溶液,阴极区溶液pH增大:2H2O + 2e- === H2↑+ 2OH-D.钢铁发生吸氧腐蚀,负极反应为:Fe-3e- === Fe3+4.下列表述中,与盐类水解有关的是( )①明矾和FeCl3可作净水剂;②为保存FeCl3溶液,要在溶液中加少量盐酸;③AlCl3溶液蒸干,灼烧,最后得到的主要固体产物是Al2O3;④NH4Cl与ZnCl2溶液可作焊接中的除锈剂;⑤实验室盛放NaOH溶液的试剂瓶应用橡皮塞,而不能用玻璃塞;⑥用NaHCO3与Al2(SO4)3两种溶液可作泡沫灭火剂;⑦草木灰与铵态氮肥不能混合施用。
A.①②③⑤⑥⑦B.①②③④⑥⑦C.①③⑤⑥⑦D.全有关5.X、Y、Z、W是原子序数依次增大的短周期主族元素,e、g、h、i、j均是由这些元素组成的二元化合物,i常温常压下为液体,其余均为无色气体。
四川省成都市第七中学2022至2023学年高一下学期期末考试化学试题及参考答案(部分详解)

2022-2023 学年度下期高一-年级期末考试化学试卷考试时间:90 分钟满分:100分可能用到的原子量:H-1 N-14 O-16 Na-23 Cu-64 Zn-65第Ⅰ卷选择题(共40分)一、选择题(每题只有一个选项符合题意,每小题2分,共40分)1.化学与生活、环境密切相关,下列说法不正确的是A.提倡采用新技术不断开采煤、石油和天然气,以满足经济发展的需要B.为减少白色污染,应对塑料制品回收利用C.绿色化学的核心是从源头上减少和消除工业生产对环境的污染D.利用太阳能等清洁能源代替化石燃料,有利于节约资源、保护环境2.有机物可有多种方式表示其组成或结构,下列表示方法不正确的是A.甲烷的球棍模型:B.乙烯的结构式:C.乙醇官能团的电子式:D.乙酸的分子式:C2H4O23.煤、石油和天然气是重要的化工原料,下列有关说法不正确的是A.煤的气化、液化和干馏都属于化学变化B.天然气可用于合成氨和生产甲醇等C.石油是多种碳氢化合物的混合物,可利用分馏得到乙烯、丙烯等D.塑料、合成橡胶和合成纤维主要是以石油、煤和天然气为原料生产的4.自然界为人类提供了多种多样的营养物质,下列有关营养物质的说法正确的是A.油脂、糖类、蛋白质都可以发生水解反应B.脂肪酸的饱和程度对油脂的熔点无影响C.纤维素、蛋白质、油脂都是高分子化合物D.硝酸可以使很多蛋白质变黄,可用于蛋白质的检验5.下列有关物质的性质与用途具有对应关系的是A.稀硫酸具有酸性,可用于除去铁锈B.SO2具有氧化性,可用于纸浆漂白C.Si具有良好的导电性,可用作光导纤维D. NH4HCO3受热易分解,可用作化肥6.下列关于自然界中氮循环的说法错误的是A.氮肥的有效成分均为铵盐B.雷电作用固氮中氮元素被氧化C.人工固氮主要是通过控制条件将氮气转化为氮的化合物D.动物排泄物中的氮元素被细菌分解进入大气7.下列关于乙烯及其相关反应产物的说法正确的是A.聚乙烯能使溴水褪色B.乙烯与Br2加成可生成CH3CH2BrC.乙烯与溴水、酸性高锰酸钾溶液的反应现象及原理相同D.可用酸性高锰酸钾溶液区分甲烷和乙烯8.分子式为C5H10的有机物的同分异构体的数目为(不考虑立体异构)A.8种B.9种C.10种D.11种9.某种有机物的分子结构简式如图所示,关于该化合物说法不正确的是A.含有两种官能团B.与乙酸乙酯互为同系物C.可发生水解反应D.可发生加聚反应10.下列不能用勒夏特列原理解释的事实是A.棕红色的NO2(g)加压后颜色先变深后变浅B.对H 2(g)+I2(g)2HI(g)平衡体系加压,颜色变深C.黄绿色的氯水光照后颜色变浅D.合成氨工业使用高压以提高氨的产量11.已知化学反应A2(g)+B2(g)=2AB(g) △H=+100 kJ/mol的能量变化如图所示,判断下列叙述中正确的是A.加入催化剂,该反应的反应热△H将减小B.每形成2 molA-B键,将吸收b kJ能量C.每生成2分子AB吸收(a-b)kJ热量D.该反应正反应的活化能大于100 kJ/mol12.下列制取SO2、验证其漂白性、收集并进行尾气处理的装置和原理能达到实验目的的是A.制取SO2B.验证漂白性C.收集SO2D.尾气处理13.实验室制取少量乙酸乙酯的实验装置如下图所示。
高三期末统考(化学)试题含答案

高三期末统考(化学)(考试总分:100 分)一、单选题(本题共计15小题,总分40分)1.(2分)实验室中下列做法错误的是()A.用钢瓶盛放氯气B.用浓盐酸酸化高锰酸钾C.制备乙酸乙酯时用浓硫酸催化并吸水D.取用后剩余钠单质放回原试剂瓶2.(2分)下列说法与化学反应无关的是()A.明矾用于污水净化B.小苏打用作食品膨松剂C.X射线衍射测定青蒿素晶胞结构D.疫苗运输过程需低温冷藏3.(2分)短周期主族元素X、Y、Z、W的原子序数依次增大,W的最外层电子数比X的最外层电子数少1个,X、Y、Z为同一周期元素,X、Y、Z组成一种化合物(ZXY)2的结构式为。
下列说法正确的是()A.第一电离能:Y > Z > X > WB.简单离子半径:W > Z > YC.简单离子的还原性:Z > YD.最简单氢化物的稳定性:X > Y > Z4.(2分)下列关于Na、Cs的化合物结构与性质的说法错误的是()A.NaCl为离子化合物,可推知CsCl也为离子化合物B.NaCl与CsCl相比,熔点更高C.NaCl与CsCl晶胞中Cl-的配位数均为8D.Cs+容易形成配合物而Na+一般不会形成配合物的原因与微粒半径有关5.(2分)利用下列实验装置(部分夹持装置略去)进行实验时,能达到实验目的的是()A.用图①所示装置制备O2B.用图①所示装置检验溴乙烷与NaOH醇溶液共热产生的C2H4C.用图①所示装置从食盐水中提取NaClD.用图①所示装置探究铁的吸氧腐蚀6.(2分)有机物具有抗肿瘤、镇痉等生物活性。
下列说法正确的是()A.能够使酸性重铬酸钾溶液变色B.能够发生消去反应形成双键C.可与FeCl3溶液发生显色反应D.1mol该分子最多与4molH2发生加成反应7.(2分)绿原酸具有抗病毒,降血压,延缓衰老等保健作用。
利用乙醚、95%乙醇浸泡杜仲干叶,得到提取液,进一步提取绿原酸的流程如下:下列说法错误的是()A.从“提取液”获取“有机层”的操作为分液B.蒸馏时选用球形冷凝管C.过滤时所需玻璃仪器有烧杯、漏斗、玻璃棒D.粗产品可通过重结晶的方法提纯8.(2分)毗啶又称为氮苯,与苯都有大π键。
医用基础化学期末考试练习题及答案(精简版)

医用基础化学期末考试练习题及答案一、单项选择题第一至三章1.下列关于分散系概念的描述,错误的是( ).D. 分散相粒子直径大于100nm的体系,称为胶体分散系2.符号n用来表示( )。
A. 物质的量3.关于粗分散系统,下列说法错误的是().A. 分散相离子的直径小于100nm4。
关于胶体分散系统,下列说法错误的是( )。
C. 胶体分散系统为不稳定的多相系统5.医学中常用的质量浓度单位().D。
g﹒L—16.关于物质的量,下列表示方法错误的是( )。
A。
n(硫酸)7。
医学中不太适用的物质的量浓度单位(). B. mol﹒m-38。
正常人的血浆中每100ml含Na+0。
326g,M(Na+)=23.0g/mol,试计算其物质的量浓度。
C。
0.142 mol。
L—19。
市售HCl溶液的浓度为12mol﹒L-1欲配制0.60 mol﹒L-1的HCl 1000ml,需取市售HCl溶液多少毫升?D。
50ml10.关于产生渗透现象必须具备的条件,下列说法正确的是()。
C.存在不允许溶质粒子透过的半透膜,并半透膜两边的溶液浓度不相同11。
关于溶液的渗透方向,下列说法正确的是()。
A。
总是从纯溶剂一方往溶液一方,或者从稀溶液一方往浓溶液一方渗透12. 关于渗透压定律的数学表达式,下列说法是不正确的.( )D。
渗透压与溶质的本性有关13. 试计算温度在37℃,物质的量浓度为0。
154 mol﹒L-1的氯化钠溶液的渗透压。
()B。
793 kPa14. 医学上等渗溶液的渗透浓度范围为()。
C。
280~320mmol﹒L—115。
关于溶胶的电泳现象,下列说法不正确的是().B. 中性粒子,电泳时不移动16。
欲使被半透膜隔开的A、B两种稀溶液间不发生渗透,应使两溶液的( )。
B。
渗透浓度相等17.反应速率常数k与下列哪个因素无关( ) A.反应物浓度18.对于一个化学反应,下列说法中正确的是( )D.活化能越小,反应速率越大19。
人教版2022--2023学年度第一学期高一化学期末测试卷及答案(含四套题)

化学试题 第1页(共38页) 化学试题 第2页(共38页)………………○………………内………………○………………装………………○………………订………………○………………线………………○………………………………○………………外………………○………………装………………○………………订………………○………………线………………○………………… 学校:______________姓名:_____________班级:_______________考号:______________________人教版2022--2023学年度第一学期期末测试卷高一 化学(满分:100分 时间:90分钟)题号 一 二 总分 分数可能用到的相对院子质量:H:1 C:12 N:14 O:16 Na:23 P:31 S:32 Cl:35.5 Ca:40一、单项选择题(共15个小题,期中1-10题每题3分,11-15题每题4分,共50分)1.我们常用“往伤口上撒盐”来比喻某些人乘人之危的行为,其实从化学的角度来说,“往伤口上撒盐”的做法并无不妥,撒盐可以起到凝血作用,其化学原理涉及胶体的( ) A .丁达尔效应 B .电泳C .聚沉D .渗析2.下列各组中的离子能在溶液中大量共存的是( ) A .H +、Ca 2+、Cl -、2-3CO B .K +、Na +、OH -、Cl -C .Na +、Cu 2+、2-4SO 、OH - D .Fe 3+、Ba 2+、Cl -、2-4SO3.下列电离方程式书写正确的是( )A .H 2SO 4=H 2+2+SO 2-4 B .NaHCO 3=Na ++H ++CO 2-3C .NaOH=Na ++O 2-+H +D .Na 3PO 4=3Na ++PO 3-44.影响1mol 气体所占体积大小的主要因素( ) A .分子直径的大小B .分子间距离的大小C .分子间作用力的大小D .分子数目的大小5.1869年,俄罗斯化学家制定第一张元素周期表,随着科学的发展,周期表的形式和内涵变得更加完美,关于现代元素周期表的说法正确的( )A .ⅠA 、IIA 族的元素全部是金属元素,均能与酸发生反应生成氢气B .元素周期表包含七个周期、七个主族、七个副族,一个零族,一个VIII 族C .现代元素周期表是按照相对原子量的大小顺序进行对元素进行排列D .零族元素中所有原子的最外层电子数都是八个,化学性质稳定 6.下列有关化学用语表示正确的是( ) A .氯原子的结构示意图:B .铀(U)原子14692U 的中子数为146、质子数为92C .溴原子8035Br 的核外电子数为35D .硫离子的结构示意图:7.将一小块绿豆大的钠放入滴有酚酞的适量水中,不可能...出现的现象是( )A .钠浮于水面B .钠熔成小球C .钠静止不动D .溶液变红 8.每年10月23日上午6︰02到下午6︰02被誉为“摩尔日”(MoleDay),设N A 为阿伏伽德罗常数的值,下列说法正确的是( )A .3L 0.4mol ·L -1 KCl 溶液中Cl -物质的量浓度是1.2mol ·L -1B .1molOH -的质量等于17C .标况下1mol 乙醇的体积为22.4LD .2molH 2O 的摩尔质量为18g ·mol -1化学试题第3页(共38页)化学试题第4页(共38页)……○………………内………………○………………装………………○………………订………………○………………线………………○………………此卷只装订不密封……○………………外………………○………………装………………○………………订………………○………………线………………○………………9.关于以下四个实验相关说法正确的是()A.图Ⅰ是实验室制备氯气,其中盛装浓盐酸的仪器是长颈漏斗B.图Ⅱ是配制溶液时向容量瓶中转移溶液的操作C.图Ⅲ铜在氯气中燃烧,产生棕黄色的烟D.图Ⅳ用于验证碳酸钠和碳酸氢钠的稳定性10.下列关于钠的化合物的说法中不正确的是()①溶解性:Na2CO3>NaHCO3②在Na2CO3与NaHCO3混合溶液中滴加少量稀盐酸,则稀盐酸先与NaHCO3反应③钠蒸气充入灯泡中制成钠灯,常用于公路照明④Na2O和Na2O2晶体中阴、阳离子的数目比不相同⑤分别向Na2CO3和NaHCO3的水溶液中滴加BaCl2稀溶液,均可产生白色沉淀A.②④⑤B.①②④C.②③⑤D.③④⑤11.《本草图经》在“绿矾”项载:“盖此矾色绿,味酸,烧之则赤……”,下列关于“绿矾”的说法正确的是()A.绿矾的主要成分为Fe2(SO4)3·7H2OB.绿矾的溶液中能电离出H+,所以“味酸”C.“烧之则赤”时,绿矾被氧化D.可以用KSCN溶液检验绿矾是否已经全部变质12.铁与水蒸气反应的实验装置如图,下列说法正确的是()A.实验时,试管口应高于试管底B.加热时试管内生成黑色物质,点燃肥皂泡可听到爆鸣声C.反应的化学方程式为2Fe+3H2O(g)ΔFe2O3+3H2 D.试管中发生化合反应13.黑火药爆炸反应的化学方程式为:2KNO3+S+3C点燃K2S+N2↑+3CO2↑,下列说法正确的是()A.该反应的氧化剂是 KNO3,还原剂为 S 和 CB.氧化剂与还原剂的物质的量之比为 1:1C.氧化产物只有 CO2,还原产物只有 N2D.每消耗 0.1molS,反应中共转移电子 0.2mol 电子14.X、Y分别代表两种非金属元素,下列不能说明非金属性X比Y强的是()A.X的氧化物对应水溶液的酸性比Y的氧化物对应水溶液的酸性强B.Y-的还原性强于X-C.X的单质X2能将Y的阴离子Y-氧化为Y2D.X、Y的单质分别与Fe化合,产物中前者Fe为+3价,后者Fe为+2价15.如图所示,元素周期表中的金属和非金属元素的分界线处用虚线表示化学试题 第5页(共38页) 化学试题 第6页(共38页)………………○………………内………………○………………装………………○………………订………………○………………线………………○………………………………○………………外………………○………………装………………○………………订………………○………………线………………○………………… 学校:______________姓名:_____________班级:_______________考号:______________________下列说法正确的是( )A .虚线左下方的元素均为非金属元素B .紧靠虚线两侧的元素都是具有金属性和非金属性的金属元素C .可在虚线附近寻找半导体材料(如Ge 、Si 等)D .可在虚线的右上方,寻找耐高温材料 二、非选择题(包含4个小题,共50分) 16.(14分)按要求回答下列问题:(1)有以下几种物质:①铁 ②液态的HCl ③蔗糖 ④酒精 ⑤稀盐酸 ⑥H 2SO 4 ⑦KOH ⑧熔融的KNO 3 ⑨O 2 ⑩干冰。
化学(无机、有机化学)期末考试复习题及参考答案-专升本

《化学(无机、有机化学)》复习题一、填空题1、300K时,已知某难挥发非电解质的水溶液浓度为0.3 mol•L-1,则该溶液的渗透压为。
2、用自由能判断反应的方向和限度时,当ΔG < 0时反应。
3、若可逆反应正向放热,则其活化能Ea正于Ea逆。
4、某弱酸HA的p OH=5,此溶液的pH=。
5、将NaAc固体加入到HAc溶液中,其pH变,6、某原子的原子序数为24,价电子层结构为。
7、H2O分子的空间构型为。
8、在沸水中加入少量FeCl3所得到的胶体,其胶粒结构式为。
9、[FeCl(H2O)(en)2]Cl2的命名为。
10、。
11、CH3-CH-CH-CH2-CH2-CH-CH3CH3CH3CH3。
12、32CH3OH。
13. CH3CH=CHCH2CHO被NaBH4还原水解后的产物为。
14. 仲胺与亚硝酸反应的现象为。
15. 乙炔与硫酸亚铜的氨溶液作用的现象是。
16、往FeCl3溶液中加入KI溶液,再加入CCl4,CCl4层的现象为。
17、用自由能判断反应的方向和限度时,当ΔG > 0时反应。
18、对于吸热反应,升高温度,化学平衡向移动。
19、某弱酸溶液中,c r(H+) c r(OH) =。
20、将NaAc固体加入到HAc溶液中,其pH变。
21、某原子的原子序数为26,价电子层结构为。
22、NH3分子中N的杂化类型为。
23、Kθ与标准电动势Eθ的关系为。
24、[FeCl(H2O)(en)2]Cl2的命名为。
25、的系统命名为。
26、甲基环丙烷与HBr反应的主要产物是。
27、在稀碱、加热条件下乙醛与乙醛缩合的产物为。
28、被酸性高锰酸钾氧化的产物的结构式为。
29、乙酸与乙醇在浓硫酸条件下加热,反应产物的结构式为。
CH3。
山东省日照市2022-2023学年高二下学期期末考试化学试题(含解析)

山东省日照市2022-2023学年高二下学期期末考试化学试题学校:___________姓名:___________班级:___________考号:___________一、单选题1.有机物在生产、生活中应用广泛。
下列说法错误的是A.福尔马林可用于饮用水消毒B.地沟油可用于生产肥皂和油漆C.纤维素可用于生产硝酸纤维D.甲酚可用于制造酚皂和消毒液2.下列不能用氢键相关知识解释的是A.羊毛衫水洗后变形B.氨容易液化C.2H O比2H S更稳定D.冰浮在水面上3.X、Y、Z、W四种短周期元素,X、Y、Z处于同一周期,X、W位于同一主族,W 原子的最外层电子数是其电子层数的3倍,基态Z原子的电子总数是其最高能级电子数的5倍,同周期元素中Y的电负性最大。
下列说法错误的是A.Z的最高价氧化物对应水化物的化学式可表示为H3ZO4B.简单离子半径由大到小的顺序:Y>X>Z>WC.以上元素对应的简单氢化物中,W的氢化物沸点最高、最稳定D.第一电离能由大到小的顺序:Y>Z>X4.下列能达到实验目的的是A.制备并检验乙炔的性质B.鉴别苯与己烷C.分离甲烷氯代反应后的液态产物D.检验1-溴丁烷的消去产物5.甘氨酸铜结构中,铜和与其配位的四个原子共平面,甘氨酸铜有顺式和反式两种结构,如下图所示。
下列说法错误的是A .顺式甘氨酸铜易溶于水B .反式甘氨酸铜能与氢气发生加成反应C .甘氨酸铜中铜原子的杂化类型可能为2dspD .两种物质中 键和π键的数目之比均为10:16.“二月茵陈,五月蒿”,茵陈有保肝利胆的作用,它所含的菌陈二炔酮的结构简式如图所示。
下列关于菌陈二炔酮的说法正确的是A .分子的不饱和度为8B .分子中一定共线的碳原子最多有8个C .分子与氢气完全加成的产物中含有2个手性碳原子D .分子中采取sp 、sp 2杂化的碳原子数之比为4:77.一种Co()Ⅱ配合物的制备过程如下:下列说法错误的是A .M 的名称为2-羟基苯甲醛B .P 的制备过程可能经历了加成反应和消去反应C .Q 中的化学键只有极性共价键和配位键D .Q 中钴的配位数为4,提供孤电子对的原子为N 和O 8.实验室提纯乙酸乙酯的流程如图所示:下列说法正确的是A .为保证反应回流效果,应使用直形冷凝管B .水相1中除23Na CO 和NaCl 外,还有3CH COOHA .分子式为1010C HA .X 通常使用23Na SO 固体B .多孔球泡的作用是增大2SO 与液体的接触面积C .检验4MnSO 的分解产物2SO 、3SO ,E 、F 装置中应分别为品红溶液、液D .装置D 中得到固体34Mn O ,该反应的氧化产物与还原产物物质的量之比为二、多选题12.某种离子液体M 由有机阳离子EMIM +( )和阴离子6PF -构成。
高中化学期末试题及参考答案

高中化学期末试题及参考答案选择题
1. 下列元素中,化合价最多的是:
- A. 碳
- B. 氢
- C. 氧
- D. 氮
答案:A. 碳
2. 以下哪个不是酸的性质?
- A. 反应中和碱
- B. 酸性溶液有酸味
- C. 可导电
- D. pH值小于7
答案:C. 可导电
3. 以下哪个元素是最活泼的金属?- A. 钠
- B. 铁
- C. 铜
- D. 铝
答案:A. 钠
填空题
1. 水的化学式是______。
答案:H2O
2. 酸性溶液的pH值小于______。
答案:7
3. 碳的化合价为______。
答案:4
解答题
1. 请简要解释物质的三态变化过程。
答案:物质的三态变化是指物质在不同温度下由固态转变为液态,再由液态转变为气态的过程。
固态物质在升温过程中,分子间的相互作用力减弱,分子的热运动加剧,最终分子间的相互作用力完全被克服,固态物质转变为液态。
液态物质在继续升温过程中,分子热运动更加剧烈,分子间的相互作用力被克服,液态物质转变为气态。
2. 请列举两种酸和相应的化学式。
答案:硫酸(H2SO4)和盐酸(HCl)。
以上为高中化学期末试题及参考答案。
大学有机化学期末考试题(含三套试卷和参考答案)
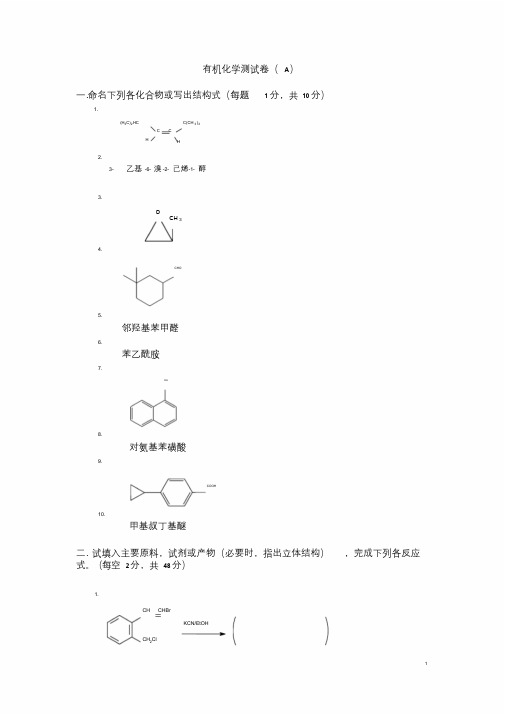
有机化学测试卷(A)一.命名下列各化合物或写出结构式(每题 1 分,共10 分)1.C(CH 3)3(H3C)2HCC CHH2.3- 乙基-6- 溴-2- 己烯-1- 醇3.OCH 34.CHO5.邻羟基苯甲醛6.苯乙酰胺7.OH8.对氨基苯磺酸9.COOH10.甲基叔丁基醚二. 试填入主要原料,试剂或产物(必要时,指出立体结构),完成下列各反应式。
(每空 2 分,共48分)1.CH CHBrKCN/EtOHCH2Cl12.+ C12高温、高压O3①②H2O Zn粉3. HBr MgCH = CH2 CH3COCH3①+醚H2O H②CH3COC14.+ CO 2CH 35.1, B2H6-2, H2O2, OH1, Hg(OAc) 2,H2O-THF2, NaBH46.O OO OO7.CH2ClNaOHH2OCl8.CH3-+ H2O OHClSN1 历程+9.OOCH3+ CH 2=CH C CH 3C2H5ONa C2H5ONaO10.2BrZnEtOHBr11.OC +CH 3 + Cl2 H12.CH 3(2)HNO 3H2SO 4Fe,HCl (CH 3CO) 2OBr2 NaOH NaNO 2 H3PO 2H2SO 4三. 选择题。
(每题 2 分,共14 分)1. 与NaOH 水溶液的反应活性最强的是()(A). CH3CH2COCH2Br (B). CH3CH2CHCH 2Br (C). (CH3)3CH2Br (D). CH3(CH2)2CH2BrCH32. 对CH3Br 进行亲核取代时,以下离子亲核性最强的是:()(A). CH 3COO- (B). CH 3CH2O- (C). C6H5O- (D). OH -3. 下列化合物中酸性最强的是()(A) CH3CCH (B) H2O (C) CH3CH2OH (D) p-O2NC6H4OH(E) C6H5OH (F) p-CH 3C6H4OH4. 下列化合物具有旋光活性得是:()COOHOHHCH3A,B,H OHCOOH CH3C, (2R, 3S, 4S)-2,4-二氯-3-戊醇5. 下列化合物不发生碘仿反应的是( )A、C6H5COC3HB、C2H5OHC、CH3CH2COC2H C H3D、CH3COC2H C H336. 与HNO2 作用没有N2 生成的是( )A、H2NCON2H B 、CH3CH(NH2)COOHC、C6H5NHCH3 D 、C6H5NH27. 能与托伦试剂反应产生银镜的是( )A、CCl3COOH B 、CH3COOHC、CH2ClCOOH D 、HCOOH四.鉴别下列化合物(共6分)苯胺、苄胺、苄醇和苄溴五.从指定的原料合成下列化合物。
高中化学必修一期末测试题(含答案)

高中化学必修1期末测试卷姓名:得分:一、单项选择题。
(3×18=54分)1.C、N、S的氧化物中许多是工业上重要的化工原料,但是当它们分散到空气中时,会带来很多环境问题。
下列有关这些元素的氧化物说法不正确的是【】A.开发太阳能、水能、风能、氢能等新能源有利于减少这些氧化物的产生B.这些氧化物使雨水的PH<7,我们把PH<7的雨水称之为酸雨C.N及S的氧化物还能直接危害人的身体健康,引发呼吸道疾病D.温室效应及二氧化碳的排放有着直接的关系2.下列试验装置不能达到实验目的的是【】3.科研人员最近开发出被称为第五形态的固体碳,这种新的碳结构称作“纳米泡沫”,直径约6到9纳米。
下列关于固体碳说法不正确的是【】A.是金刚石的同素异形体 B.在合适的分散剂中形成的分散系是胶体C.其相对分子质量为12g/mol D.在氧气中充分燃烧的产物是CO24.下列叙述正确的是【】A.为提醒人们使用浓硫酸时注意安全,贮存浓硫酸的容器应贴上下图标识B.实验室可利用丁达尔效应鉴别Fe(OH)3胶体和FeCl3溶液C.大量氯气泄漏时,用NaOH浸湿毛巾捂住嘴和鼻,并迅速离开现场D.实验室常将氢氟酸保存在带磨口玻璃塞的细口玻璃瓶中5.用N A表示阿伏加德罗常数的值。
下列叙述中不正确的是【】A.分子总数为N A的NO2和CO2混合气体中含有的氧原子数为2N AB.28g乙烯(C2H4)和环丁烷(C4H8)的混合气体中含有的碳原子数为2N AC.常温常压下,92g的NO2和N2O4混合气体含有的原子数为6 N AD.常温常压下,22.4 L氯气及足量镁粉充分反应,转移的电子数为2 N A6.在电解质溶液的导电性装置(如下图所示)中,若向某一电解质溶液中逐滴加入另一溶液,则灯泡由亮变暗至熄灭,后又逐渐变亮的是【】A.盐酸逐滴加入食盐溶液中B.硫酸逐滴加入氢氧化钠溶液中C.硫酸逐滴加入氢氧化钡溶液中D.醋酸逐滴加入氨水中7.常温下,下列各组离子在制定溶液中一定能大量共存的是【】A.0.1 mol·L-1的NaOH溶液:K+、Na+、SO42-、CO32-B.0.1 mol·L-1的Na2CO3溶液:K+、Ba2+、NO3-、Cl-C.0.1 mol·L-1FeCl3溶液:K+、NH4+、I-、SCN-D.c(H+)/c(OH-)=1×1014的溶液:Ca2+、Na+、ClO-、NO3-8.下列离子方程式书写正确的是【】A.硫酸氢钠及少量氢氧化钡反应:2H++SO42-+Ba2++2OH-=BaSO4↓+2H2O B.硅酸钠溶液及醋酸溶液混合:SiO32-+ 2H+ = H2SiO3↓C.钠及水反应:Na + 2H2O = Na+ + 2OH- + H2↑D.浓硝酸中加入过量铁粉并加热:Fe + 3NO3- + 6H+△Fe3+ + 3NO2↑ + 3H2O9.从矿物学资料查得一定条件下自然界存在如下反应:14CuSO4+ 5FeS2+ 12H2O==7Cu2S +5FeSO4+12H2SO4下列说法正确的是【】A.Cu2S 既是氧化产物又是还原产物B. 5 mol FeS2发生反应,有 10 mol 电子转移C.产物中的SO42-离子有一部分是氧化产物D.FeS2只作还原剂10.下列说法正确的是【】A.将CO2通入CaCl2溶液中可以得到CaCO3沉淀B.向待测溶液中加入稀硝酸酸化后,滴入BaCl2溶液,可检验SO42-C.将足量的Na2O2、Na2O分别加到酚酞溶液中,最终溶液均为红色D.向某溶液中加入KSCN溶液,溶液不变成血红色,通入氯气后,溶液变成血红色,说明原溶液中含有Fe2+11.等体积、等物质的量浓度的硫酸、氢氧化钠溶液分别放在甲、乙两个烧杯中,各加等质量的铝,生成氢气的体积比为5:6,则甲、乙两烧杯中的反应情况分别可能是【】A.甲、乙都是铝过量B.甲中铝过量,乙中碱过量C.甲中酸过量,乙中铝过量D.甲中酸过量,乙中碱过量12.向一定量的FeO,Fe,Fe3O4的混合物中加入100mL 1mol/L的盐酸,恰好使混合物完全溶解,放出224mL(标准状况)的气体,在所得溶液中加入KSCN溶液无血红色出现.。
化学试卷期末考试题及答案

化学试卷期末考试题及答案一、选择题(每题2分,共20分)1. 元素周期表中,氧元素的原子序数是多少?A. 7B. 8C. 16D. 18答案:C2. 以下哪个化合物不是酸?A. HClB. H2SO4C. HNO3D. NaOH答案:D3. 根据化学键理论,下列哪个化合物是离子化合物?A. CO2B. NaClC. H2OD. CH4答案:B4. 以下哪个反应是氧化还原反应?A. 2H2O → 2H2 + O2B. CaO + H2O → Ca(OH)2C. 2H2 + O2 → 2H2OD. NaOH + HCl → NaCl + H2O答案:C5. 摩尔质量的单位是?A. g/molB. kgC. mol/gD. g答案:A6. 根据勒夏特列原理,增加反应物的量会使得化学平衡向哪个方向移动?A. 向左B. 向右C. 不变D. 无法确定答案:B7. 以下哪个元素是过渡金属?A. NaB. KC. FeD. He答案:C8. 什么是化学计量?A. 化学方程式的平衡B. 化学方程式的书写C. 化学反应中物质的量的比例D. 化学反应中物质的总质量答案:C9. 什么是同位素?A. 具有相同原子序数但不同质量数的原子B. 具有相同原子质量但不同原子序数的原子C. 具有相同化学性质但不同物理性质的分子D. 具有不同化学性质但相同物理性质的分子答案:A10. 以下哪个是有机化合物?A. CO2B. H2OC. CH4D. NaCl答案:C二、填空题(每空2分,共20分)11. 化学中的“摩尔”是指_________。
答案:物质的量单位12. 电子亲合能是指_________。
答案:一个中性原子获得一个电子形成负离子时释放的能量13. 根据阿伏伽德罗定律,1摩尔任何气体在标准状况下所占的体积是_________。
答案:22.4升14. 化学键的形成可以降低系统的_________,这是化学键稳定的一个原因。
答案:能量15. 酸的定义是能够_________的物质。
2010-2023历年上海市静安区初三上学期期末考试化学试卷(带解析)

2010-2023历年上海市静安区初三上学期期末考试化学试卷(带解析)第1卷一.参考题库(共18题)1.能源、环境与人类的生活和社会发展密切相关。
①目前,人类以化石燃料为主要能源,常见的化石燃料包括煤、石油和(8)。
②煤燃烧过程中某些反应的微观示意图如下:该反应中生成物的化学式为(9)。
为了能使煤充分燃烧提高燃料利用率,在反应物中应增加的微粒是(10)(填序号)。
A.B.C.D.③为减轻对化石燃料的依赖,可以在燃油中添加适量的酒精(C2H5OH)。
则酒精中含有碳、氢、氧元素的原子个数比为(11),碳、氢元素的质量比为(12),0.5mol酒精中约含有(13)个氢原子。
④“绿色化学”特点之一是“零排放”。
一定条件下,一氧化碳和氢气可以按照不同比例反应,若只生成一种产物就能实现“零排放”,符合这一要求的产物是(14)(填序号)。
A.甲醇(CH4O) B.乙醇(C2H6O)C.甲醛(CH2O) D.乙醛(C2H4O)2.有关物质的量的叙述中正确的是A.16gO3含有1mol氧B.1molHCl中约含有6.02×1023个原子C.MgO的摩尔质量为40D.1molCO和1molCO2所含碳元素质量相等3.液氢常用做航天飞机的燃料,下列描述属于氢气化学性质的是A.氢气是最轻的气体B.燃烧产生淡蓝色火焰C.液氢燃烧放出大量热D.氢气具有可燃性4.下列对符号“Cu”表示的意义说法错误的是A.1个铜元素B.1个铜原子C.金属铜D.铜元素5.下列化学符号表示2个分子的是A.2HB.2NaC.O2D.2H2O6.汞是常温下唯一的液态金属,汞的化学式是A.AgB.HgC.HeD.Hg27.FeO、Fe2O3、Fe3O4三种化合物中,与等物质的量铁元素相结合的氧元素物质的量之比为A.6:9:8B.12:8:9C.2:3:6D.1:3:48.根据反应事实可以推出影响化学反应的因素,下列推理中不合理的是选项化学反应事实影响因素A木炭在纯氧中燃烧的火焰比在空气中燃烧的火焰更明亮反应物浓度B粉末状大理石与盐酸反应比块状大理石更加剧烈反应物种类C红磷在常温下与氧气不发生反应,加热后能与氧气反应反应温度D双氧水在通常情况下难分解,加入二氧化锰后迅速分解催化剂9.生活中常见的物质属于纯净物的是A.百事可乐B.酱油C.蒸馏水D.加碘食盐10.下图能正确反映其对应操作中各量的变化关系的是A.向澄清石灰水中不断通入二氧化碳B.向饱和Ca(OH)2溶液中不断加入CaO固体C.高温加热碳和氧化铜的混合物,恰好完全反应生成铜和二氧化碳D.氢氧化钠溶液中加足量的水稀释11.化学与生活息息相关。
河北省张家口市桥西区2023-2024学年九年级上学期1月期末化学试题(含答案)

2023-2024学年度第一学期期末学情诊断测试九年级化学试卷考生注意:1.本试卷共6页,总分100分,考试时间为90分钟。
2.请务必在答题纸上作答,写在试卷上的答案无效。
考试结束,只收答题纸。
3.答卷前,请在答题纸上将姓名、班级、考场、座位号、准考证号填写清楚。
4.客观题答题,必须使用2B铅笔填涂,修改时用橡皮擦干净。
5.主观题答案须用黑色字迹钢笔、签字笔书写。
6.必须在答题纸上题号所对应的答题区域内作答,超出答题区域的书写,无效。
7.保持卷面清洁、完整。
禁止对答题纸恶意折损,涂画,否则不能过扫描机器。
可能用到的相对原子质量:H-1 C-12 O-16 K-39 Cl-35.5 Ca-40 Fe-56一、单项选择题(本大题共20个小题,每小题2分,共40分)1.我国传统文化源远流长,下列相关制作过程中一定发生了化学变化的是A.丝绸刺绣B.玉柄雕琢C.烧制陶器D.手工剪纸2.下列有关空气及其成分的说法错误的是A.氧气具有助燃性,常用作燃料B.二氧化碳是植物进行光合作用必需的物质C.工业上可用分离液态空气制取氧气D.空气污染指数越大,空气质量状况越差3.下列关于溶液的说法中正确的是A.水可以溶解任何物质B.物质溶于水时都放出热量C.溶质可以是固体,也可以是液体或气体D.饱和溶液就是不能再溶解任何物质的溶液4.2023年世界环境日中国的主题是“建设人与自然和谐共生的现代化”。
下列做法不符合这一主题的是A.煤炭脱硫处理,有效减少酸雨的产生B.积极植树造林,促进达成“碳中和”C.禁止使用化石燃料,防止产生雾霾D.使用新型可降解塑料,减少“白色污染”5.水是一种重要的物质,在实验室中有着重要的作用。
下列实验中对水的主要作用分析正确的是A.甲中水的作用是吸收燃烧产物B.乙中的水只用于提供热量C.丙中的水用于溶解碳酸钠D.丁中的水只用于观察气压变化6.碳单质除了金刚石、石墨、C60外,科学家们还合成了C70、C90、C240等,由此做出如下推测:①同一元素可以形成多种单质;②单质可能存在复杂的分子结构;③单质的研究具有广阔的前景,其中正确的是A.①B.①③C.②③D.①②③7.“见微知著”,研究微观是化学学习中重要的内容,有以下表述:①氯气:Cl2;②+2价的镁元素:Mg+2;③粒子结构示意图表示的粒子:S 2+;④三个氮分子:3N 2;⑤两个铁离子:2Fe 2+;⑥中硫元素的化合价。
无机化学期末试题题库(130道)

无机化学期末试题1、无机化学研究内容不包括的是()——[单选题]A 物质组成B 结构C 性质D 合成正确答案:D2、某元素处在周期表中的第三周期,该元素原子的电子层数为——[单选题]A 1B 3C 2D 4正确答案:B3、据报道,1995年我国科研人员在兰州首次合成了新核素镤-239,其原子核内有148个中子,则该元素的原子序数为——[单选题]A 148B 239C 91D 108正确答案:C4、不是共轭酸碱对的一组物质是——[单选题]A NH3, NH4+B NaOH, Na+C HS-, S2-D H2O, OH-正确答案:B5、生理盐水的质量浓度为——[单选题]A 4g/LB 9g/LC 15g/LD 50g/L正确答案:B6、2mol MgCl2 和1mol AlCl3中,Cl-的物质的量之比为——[单选题]A 3:2B 2:3C 4:3D 3:4正确答案:C7、物质的量浓度的单位是——[单选题]A mol/LB g/LC 1D g/mol正确答案:A8、下列溶液中渗透压最大的是——[单选题]A 0.1mol·L-1AlCl3B 0.1mol·L-1CaCl2C 0.1mol·L-1葡萄糖(C6H12O6)D 0.1mol·L-1NaCl正确答案:A9、下列说法正确的是——[单选题]A NaCl的质量浓度是0.1mol/LB 水的摩尔质量是18C 1mol H2的质量是2gD 1mol O的质量是32g正确答案:C10、正常人血浆(37˚C时)渗透浓度范围是——[单选题]A 210~280mmol/LB 280~320mmol/LC 280~320mol/LD 380~410mmol/L正确答案:B11、一个电对中,氧化态的氧化能力越强,则其共轭还原态的还原能力——[单选题]A 无法确定B 越强C 越弱D 影响不大正确答案:C12、将12.5g葡萄糖溶于水,配成250mL溶液,该溶液的质量浓度为——[单选题]A 25 g/LB 5.0 g/LC 50 g/LD 0.025 g/L正确答案:C13、决定多电子原子轨道能量的量子数是——[单选题]A n,lB nC lD n,l,m正确答案:A14、正常人血浆(37˚C时)渗透压范围是——[单选题]A 210~280kPaB 720~800kPaC 440~600kPaD 500~1000kPa /L正确答案:B15、下列说法正确的是——[单选题]A p轨道之间以“肩并肩”方式重叠形成σ键B p轨道之间以“头碰头”方式重叠形成π键C p轨道之间以“头碰头”方式重叠形成σ键D s轨道之间以“头碰头”方式重叠形成π键正确答案:C16、基态的电子组态是——[单选题]A [Ar]4s23d4B [Kr]4s23d4C [Ar] 3d54s1D [Xe] 3d54s1正确答案:C17、在氧化还原反应中失去电子的物质是——[单选题]A 氧化剂B 还原剂C 氧化产物D 还原产物正确答案:B18、如果将氮原子的价层电子的运动状态写成为:2,1,0,+1/2; 2, 1,0,-1/2; 2,1,1,+1/2。
高一下学期期末考试化学试题(含答案)(word版)

高一下学期期末考试化学试题1.已知原子序数,可能推断原子的( )①质子数②中子数③质量数④核电荷数⑤核外电子数⑥原子结构示意图⑦元素在周期表中的位置A.①②③④⑥ B.①④⑤⑥⑦ C.②③④⑤⑦ D.③④⑤⑥⑦2.下列化学变化中,反应物的总能量低于生成物的总能量的是()A、2H2 + O2 2H2OB、CaO + H2O = Ca(OH)2C、CaCO3 CaO + CO2↑D、CH3CH2OH(酒精)+ 3O2 2CO2 + 3 H2O3.化学键使得一百多种元素构成了世界的万事万物,关于化学键的下列叙述中,正确的是( ) A.离子化合物一定含有共价键,共价化合物中不含离子键B.共价化合物可能含离子键,离子化合物中只含离子键C.构成单质分子的粒子一定含有共价键D.在氧化钠中,除氧离子和钠离子的静电吸引作用外,还存在电子与电子、原子核与原子核之间的排斥作用4.若两物质恰好完全反应,下列各项中反应前后保持不变的是( )①电子总数②原子总数③分子总数④物质的总能量⑤物质的总质量A.①②⑤B.①③⑤C.②③④D.②④⑤5、化学科学需要借助化学专用语言来描述,下列有关化学用语正确的是 ( )A.原子核内有10个中子的氧原子: B.乙烯的结构简式: C2H4C.乙酸的实验式: C2H4O2 D.CO2的电子式:6、由乙烯和乙醇蒸气组成的混和气体中,若碳元素的质量百分含量为60%,则氧元素的质量百分含量为()A.15.6% B.26.7% C.30% D.无法确定7、某有机物的结构如图所示,它不可能具有的性质是()①可以燃烧②能使酸性高锰酸钾溶液褪色③能跟NaOH溶液反应CH2 COOH2④能发生酯化反应 ⑤能发生加聚反应 ⑥能发生水解反应A .①④B .只有⑥C .只有⑤D .④⑥8.下列说法正确的是: ( ) A .钠原子失去一个电子后,它的电子数与氖原子相同,所以变成氖原子B .任何元素的原子都是由核外电子和核内中子、质子组成的C .核素指一种原子,而元素是指一类原子D .4018Ar 、40 19K 、40 20Ca 的质量数相同,所以它们是互为同位素9.下列结论错误的是 ( )①微粒半径:K +>Al 3+>S 2->C1- ②氢化物的稳定性:HF>HC1>H 2S>PH 3>SiH 4③离子的还原性:S 2->C1->Br ->I - ④氧化性:C12>S>Se>Te⑤酸性:H 2SO 4>H 3PO 4>H 2CO 3>HClO ⑥非金属性:O>N>P>Si ⑦金属性:Be<Mg<Ca<KA .只有①B .①③ C.②④⑤⑥⑦ D.①③⑤10.一定温度下,在一容积不变的密闭容器中发生的可逆反应2X(g) Y(g)+Z (s),以下能说明作为反应达到平衡标志的是 ( )A.X 的分解速率与Y 的消耗速率相等 B .X 、Y 与Z 的物质的量之比为2:1:1C .混合气体的密度不再变化D .单位时间内生成lmolY 的同时分解2mol X11.下列说法中正确的是 ( )A .离子化合物中可能含有共价键,共价化合物中可能含有离子键B .一定条件下1 mol N 2与3 mol H 2在密闭容器中充分反应可生成2 mol NH 3C .铁质器件附有铜质配件,在接触处易生铁锈D .非极性共价键只存在于双原子单质分子里12.N A 表示阿伏加德罗常数的值,下列说法正确的是 ( )A .标准状况下,22.4L 二氯甲烷的分子数约为N A 个B .常温下,在18182g O 中含有N A 个氧原子C .1 mol 乙烷中含有C 一H 的键数为7×6.02×l023 mol —1 D .1mo l —OH 所含的电子数目为7N A13.苯分子中不存在单、双键交替排列的结构,可以作为证据的事实是( )。
普通化学期末考试复习题及参考答案

普通化学 --复习资料一、单项选择题1、 NaHCO3-Na2CO3组成的缓冲溶液pH值为( )A. AB. BC. CD. D参考答案: A2、下列关于氨基酸的描述,不正确的是( )A. 必需氨基酸是指人体必需而自身不能合成的氨基酸B. 非必需氨基酸是人体非必需的氨基酸C. 氨基酸是蛋白质的基本结构单元D. 氨基酸是既有酸性又有碱性的两性物质参考答案: B3、在下列反应中反应的标准摩尔焓变ΔrHmӨ与生成物的ΔfHmӨ相等的是( )A. H2(g) +O2(g) = H2O (g)B. H2(g) + Cl2(g) = 2HCl(g)C. CaO(s) +CO2(g) = CaCO3(s)D. Fe2O3 (s) + 6HCl(aq) = FeCl3(aq) +3H2O (l)参考答案: A4、以公式ΔU = Q – pΔV表示的热力学第一定律,其适用条件是( )A. 封闭系统B. 封闭系统,不做非体积功C. 封闭系统,不做非体积功的等压过程D. 封闭系统,不做非体积功的等温等压过程参考答案: C5、在由乙二醇水溶液、冰、水蒸气、氮气和氧气组成的系统中含有 ( )A. 三种组分B. 三个相C. 四个相D. 五个相参考答案: B6、下列化合物中哪种能形成分子间氢键( )A. H2SB. HIC. CH4D. HF参考答案: D7、下列物质中熔点最高的是( )A. AlCl3B. SiCl4C. SiO2D. H2O参考答案: C8、下列物质中酸性最弱的是( )A.H3AsO3B.H3AsO4C.H3PO4D.HBrO4参考答案: A9、某反应在298K标准状态下不能自发进行,但经升温至某一温度,该反应却能自发进行。
从定性角度分析,应符合的条件是 ( )A. ΔrHmӨ >0 , ΔrSmӨ< 0B. ΔrHmӨ < 0, ΔrSmӨ > 0C. ΔrHmӨ > 0 ΔrSm Ө> 0D. ΔrHmӨ< 0, ΔrSm Ө< 0参考答案: C10、下列四种价电子的构型的原子中电离能最低的是( )A. ns2np3B. ns2np4C. ns2np5D. ns2np6参考答案: B11、 AgCl固体在下列哪一种溶液中的溶解度最大?( )A. 0.0 1mol·dm-1氨水溶液B. 0.01mol·dm-1氯化钠溶液C. 纯水D. 0.01mol·dm-1硝酸银溶液参考答案: A12、下列物质中,其分子具有平面三角形几何构型的非极性分子是( )A. CH4B. CO2C. BCl3D. H2O参考答案: C13、在H2O分子和CO2分子之间存在的分子间作用力是()A. 取向力,诱导力B. 诱导力,色散力C. 取向力,色散力D. 取向力,诱导力,色散力参考答案: B14、电镀工艺是将欲镀零件作为电解池的( )A. 阴极B. 阳极C. 任意一个电极参考答案: A15、某电池反应①0.5Cu(s)+0.5Cl2(g)=Cl-(1mol/dm3)+0.5Cu2+(1mol/dm3)的电动势为E1;另一电池反应②Cu(s)+Cl2(g)=2Cl-(1mol/dm3)+Cu2+(1mol/dm3)的电动势为E2,则E1和E2比值为( )A. E1/E2=1B. E1/E2=0.5C. E1/E2=0.25D. E1/E2=2参考答案: A16、决定多电子原子电子的能量E的量子数是( )A. 主量子数nB. 角量子数lC. 主量子数n和角量子数lD. 角量子数l和磁量子数m参考答案: C17、下列水溶液中pH值最大的是( )A.0.1mol·dm-3HCNB.0.1mol·dm-3NaCNC.0.1mol·dm-3HCN-0.1mol·dm-3NaCND.0.1mol·dm-3NaAc参考答案: B18、固态时为典型离子晶体的是( )A. AlCl3B. SiO2C. Na2SO4D. CCl4参考答案: C19、下列电池中,哪个电池的电动势与Cl–离子的浓度无关?( )A.Zn (s) | ZnCl2 (aq)| Cl2 (g) | Pt (s)B. Zn (s) | ZnCl2 (aq)| |KCl (aq) | AgCl (s) | Ag (s)C.Ag (s), AgCl (s) | KCl (aq) | Cl2 (g) | Pt (s)D.Hg (l) | Hg2Cl2 (s) |KCl (aq)||AgNO3 (aq) | Ag (s)参考答案: C20、已知反应A + 1/2B = D的标准平衡常数为K1Ө ,那么反应2A + B = 2D在同一温度下的标准平衡常数K2Ө为- ( )A. K2Ө=K1ӨB. K2Ө= (K1 Ө)1/2C. K2 Ө = 1/2 K1 ӨD. K2 Ө = (K1 Ө)2参考答案: D二、判断题1、有一由HAc - Ac-组成的缓冲溶液,若溶液中C(HAc)>C(Ac-),则该缓冲溶液抵抗外来酸的能力大于抵抗外来碱的能力。
人教部编版九年级化学下册期末考试题(及参考答案)

人教部编版九年级化学下册期末考试题(及参考答案)(时间:60分钟分数:100分)班级:姓名:分数:一、选择题(每小题只有1个选项符合题意。
共20小题,每题2分,共40分)1、最早使用的充电电池是铅蓄电池。
已知电动车铅蓄电池充电时反应的化学方程式为:2PbSO4+2H2O==Pb+PbO2+2X,则X的化学式为()A.SO2B.SO3C.H2SO3D.H2SO42、下列物质不属于溶液的是()A.碘酒B.矿泉水C.白醋D.蒸馏水3、科学家用单个分子制戚的“纳米车”能在人工操纵下运输药物分子到病源处释放,杀死癌细胞。
下列叙述错误的是()A.分子是由原子构成的 B.分子之间有间隙C.分子是肉眼不能够直接看见的 D.分子在人为外力作用下才能运动4、下列有关金刚石、石墨、C60的说法中,错误的是()A.C60是一种新型的化合物B.金刚石是天然存在最硬的物质C.金刚石、石墨、C60在氧气中充分燃烧时都生成二氧化碳D.金刚石与石墨物理性质不同的原因是碳原子的排列方式不同5、市场上有些不法分子用外表酷似黄金的黄铜(铜锌合金)冒充黄金销售,以牟取暴利,下列做法不能鉴别其真伪的是()A.测量密度 B.加入稀盐酸C.在酒精灯上加热 D.观察颜色6、下图是某化学反应过程的微观示意图,下列有关说法正确的是()A.反应前后分子的个数不变 B.生成物有三种C.反应前后汞原子和氧原子的个数不变 D.汞和氧气都由分子构成7、压缩气体可使气体液化,气体液化后()A.分子的质量变大B.分子的体积变小C.分子的数目减少D.分子的间隙变小8、下列化学用语表示正确的是()A.两个氢分子: 2H B.三个氮原子: 3NC.一个镁离子: Mg+2 D.氧化钠中氧元素的化合价: 2-2Na O9、向ZnSO4和CuCl2的混合溶液中加入过量的铁粉,充分反应后,过滤、洗涤、干燥得到滤渣,该滤渣中含有的金属是()A.Zn、Fe B.Zn、Cu C.Fe、Cu D.Zn、Fe、Cu 10、已知2A+3B==C+3D,用足量的A和49 g B恰好完全反应,生成57 g C 和1 g D,若B的相对分子质量为98,则A的相对分子质量为()A.16 B.27 C.44 D.5611、被称之为“软电池”的纸质电池采用薄层纸片作为传导反应为:,避免了传统电池所带来的污染问题。
人教版27课标高中化学高一年级下册 期末测试试题试卷含答案 答案在前

期末测试 答案解析一、 1.【答案】A【解析】地沟油的主要成分是油脂,属于酯类,汽油是烃的混合物,A 错误。
2.【答案】B【解析】天然橡胶是天然的高分子化合物,不是合成材料,故选B 。
3.【答案】B【解析】乙酸的结构简式是3CH COOH ,A 错误;模型中白球比黑球小,故该模型可以表示甲烷,而不能表示四氯化碳,C 错误;氨气中的氮原子少一个电子对,D 错误。
4.【答案】B【解析】该原电池总反应为44Zn CuSO Cu ZnSO ++,故4CuSO 浓度减小,4ZnSO 浓度增大;Zn 失去电子被氧化,电子沿导线从Zn 极流向Cu 极,在原电池内部,负极产生2Zn +,2Zn +通过隔膜向正极区移动;由方程式可以看出,每消耗21 mol Cu +则生成21 mol Zn +。
5.【答案】C【解析】3CH OH (22CH H O ⋅)的耗氧量实际等于2CH 的耗氧量,等物质的量的3CH OH 和36C H 的耗氧量不相同,A 不正确;37C H COOH 可写成,253C H CCH O 可写成()462C H H O ,等物质的量的44C H和46C H 的耗氧量不相同,即等物质的量的37C H COOH 和的耗氧量不相同,B 不正确;25C H CHO 可写成()342C H H O ,故等物质的量的25C H CHO 和34C H 的耗氧量相同,C 正确;381 mol C H 的耗氧量为()83 5 mol 4+=,461 mol C H 的耗氧量为()64 5.5 mol 4+=,D 不正确。
6.【答案】A【解析】()()()()B B 2.0 mol L 1.0 mol 20 s 0.05 mol L s v c t =∆÷∆=−÷=⋅,因此选A 。
7.【答案】B【解析】A 发生的是取代反应,错误;B 发生的是加成反应,正确;C 发生的是置换反应,错误;D 发生的是氧化反应,错误。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
化学期末考试试卷题库一、选择题1、下列化合物中,不属于有机化合物的是( D )。
A、酒精B、食醋C、石炭酸D、石墨2、下列气体的主要成分不是甲烷的是( A )。
A、煤气B、沼气C、瓦斯气体D、天然气3、下列化合物中,不能使溴水和酸性高锰酸钾溶液褪色的是( A )。
A、C2H6B、C3H6C、C2H2D、环己烯4、下列化合物,不能使溴水褪色但能使酸性高锰酸钾溶液褪色的是( B )A、乙烯B、丙炔C、苯D、甲苯5、乙醇分子结构中,各种化学键为;关于乙醇在各种反应中,断裂键的说法不正确的是( A )。
A、和乙酸、浓H2SO4共热时断裂②键 B、和金属钠反应时断裂①键C、和浓H2SO4共热至170℃时断裂②⑤键 D、在Ag催化下和O2反应时断裂①③键6、下列关于苯酚的叙述中,不正确...的是( C )。
A、在水中的溶解度随温度的升高而增大,超过65℃可与水混溶。
B、NaOH溶液与苯酚反应生成苯酚钠。
C、其水溶液显强酸性,俗称石炭酸。
D、其浓溶液对皮肤有强烈的腐蚀性,如果不慎沾在皮肤上,应立即用酒精擦洗。
7、下列物质中,与苯酚互为同系物的是( C )A、CH3CH2OH B、(CH3)3C—OH C、D、8、下列物质中属于酚类的是( B )9、下列试剂与乙醛发生反应,能够形成银镜的是(C)。
A、高锰酸钾B、溴水 C 、托伦试剂D、斐林试剂10、剧烈运动后,造成肌肉酸胀的物质是(C)。
A、乙酸B、酒精C、乳酸D、碳酸11、关于乙醛的下列反应中,乙醛被还原的是( B )A、乙醛的银镜反应B、乙醛制乙醇C、乙醛与新制氢氧化铜的反应D、乙醛的燃烧反应12、下列物质中,不属于羧酸类的是( D )A、乙二酸B、苯甲酸C、硬脂酸D、石炭酸13、下列物质中,与NaOH溶液、Na2CO3、溴水、苯酚钠水溶液和甲醇都能反应的是( D )A、C6H6B、CH3CHO C、CH3COOH D、CH2CH—COOH14、下列各组物质互为同系物的是( C )A、C6H5OH和C6H5CH2OH B、CH3OH和HOCH2CH2OHC、HCOOH和C17H35COOH D、CH3Cl和CH2Cl215、下列不能使新制的氢氧化铜被还原的物质是( A )A、甲醇B、甲醛C、甲酸D、甲酸钠16、乙酸乙酯在KOH溶液条件下水解,得到的产物是( C )A、乙酸钾和甲醇B、乙酸和甲醇C、乙酸钾和乙醇D、乙酸和乙醇17、下面4种变化中,有一种变化与其他3种变化类型不同的是( B )A、CH3CH2OH+CH3COOH CH3COOCH2CH3+H2OB、CH3CH2OH CH2=CH2↑+H2OC、2CH3CH2OH CH3CH2OCH2CH3+H2OD、CH3CH2OH+HBr CH3CH2Br+H2O18、常温下就能发生取代反应的是( A )A、苯酚和浓溴水B、苯和浓溴水C、乙烯和溴水D、乙苯和溴水19、下列分子式表示的一定是纯净物的是( C )A、C5H10B、C7H8O C、CH4O D、C2H4Cl220、下列物质中,在一定条件下能够与甲烷发生取代反应的是(B)。
A、H2 B、Cl2C、HClD、O221、油脂的皂化反应是指油脂的( B )A、氢化反应B、碱性水解反应C、加成反应D、氧化反应22、下列反应中,能够导致油脂酸败的反应是(C)A、加氢反应B、加碘反应C、氧化反应D、硬化反应23、既能发生水解反应,又具有还原性的糖是(B)A、葡萄糖B、麦芽糖C、蔗糖D、果糖24、下列关于多糖的叙述中不正确的是(C)A、多糖都是高分子化合物B、多糖都是非还原糖C、多糖的水解产物都是α-葡萄糖D、多糖都没有甜味25、下列有机物中,具有双官能团的是(D)A、酒精B、草酸C、石炭酸D、甘氨酸26、当溶液中pH=6时,下列氨基酸向阳极移动的是(A)A、丝氨酸(pI=5.68)B、丙氨酸(pI=6.00)C、赖氨酸(pI=9.74)D、精氨酸(pI=10.76)27、医药中常用酒精来消毒,因为酒精能够(B)A、与细菌蛋白质发生氧化反应B、使细菌蛋白质发生变性C、使细菌蛋白质发生盐析D、与细菌配合体生成配合物28、人体的体液内大多数蛋白质的主要存在形式是(C)A、阳离子B、两性离子C、阴离子D、中性分子29、蛋白质结构中的主键是(B)A、氢键B、肽键C、二硫键D、离子键30、可以用来鉴别己烯、甲苯、乙酸乙酯、苯酚溶液的一组试剂是(C)A.氯化铁溶液溴水B.碳酸钠溶液溴水C.酸性高锰酸钾溶液溴水D. 酸性高锰酸钾溶液氯化铁溶液31、已知在浓H2SO4存在并加热至140 ℃的条件下,2个醇分子在羟基上发生分子间脱水反应生成醚,如CH3CH2—OH+HO —CH2CH3 CH3CH2—O —CH2CH3+H2O ,用浓H2SO4跟分子式分别为C2H6O 和C3H8O 的醇的混合液反应,可得到醚的种类有( D )A. 1种B. 3种C. 5种D. 6种 32、在由5种基团-CH3、-OH 、-CHO 、-C6H5、-COOH 两两组成的物质中,能与NaOH 反应的有机物有( B ) A .4种 B .5种 C .6种 D .7种 33、下列各有机物中,属于烃的是 ( B )A 、氯丁烷B 、甲苯C 、硝基苯D 、乙醇 34、下列化学式只能代表一种纯净物的是( D )A .C 3H 6B .C 4H 10C .C 5H 12D .CH 2Br 235、由许多单体相互作用,只生成高分子化合物的反应称为( B )。
A 、化合反应 B 、聚合反应 C 、取代反应 D 、加成反应36、某烯烃的相对分子质量为70,其名称为(C ) A 、丙烯 B 、丁烯 C 、戊烯 C 、己烯 37、(—OH )是哪种物质的官能团(C ) A 、烯烃 B 、炔烃 C 、醇 D 、卤代烃38、下列化合物能与菲林试剂反应生成砖红色沉淀的是(C ) A 、CH 3COOH B 、(CH 3 )2 C=O C 、H 2C=O D 、CH 3CH 2OH39、室内空气污染的主要来源之一,是室内装饰材料、家具、化纤地毯等不同程度都释放出有毒有害气体,它主要是(D ) A 、一氧化碳 B 、二氧化碳C 、甲醇D 、甲苯和苯的同系物及甲醛 40、1mol 的油脂完全水解后能生成(D )A 1mol甘油和1mol甘油二酯B 1mol甘油和1mol脂肪酸C 3mol甘油和1mol脂肪酸D 1mol甘油和3mol脂肪酸41、有机物的正确命名为 CA.2-乙基-3,3-二甲基-4-乙基戊烷 B.3,3-二甲基-4-乙基戊烷C.3,3,4-三甲基已烷 D.2,3,3-三甲基已烷42、某药物主要成分的结构简式如下图所示,若1 mol该有机物分别与浓溴水和NaOH溶液完全反应,则消耗的Br2和NaOH的物质的量分别为A 、2mol Br2 6mol NaOH B 、3mol Br27mol NaOHC 、4mol Br2 8 mol NaOH D 、4mol Br27mol NaOH43、能证明苯酚具有弱酸性的方法是( A )①苯酚溶液加热变澄清②苯酚浊液中加NaOH后,溶液变澄清,生成苯酚钠和水③苯酚可与FeCl3反应④在苯酚溶液中加入浓溴水产生白色沉淀⑤苯酚不能使石蕊溶液变红色⑥向澄清的苯酚钠溶液中通入CO2,溶液变浑浊A.②⑤⑥B.①②⑤C.③④⑥D.③④⑤44、白藜芦醇()广泛存在于食物(例如花生、葡萄)中,它可能具有抗癌性。
能够跟1 mol该化合物起反应的Br2或H2的最大用量分别是( D )A.1 mol,1 mol B.3.5 mol,7 molC.3.5 mol,6 mol D.6 mol,7 mol45、将完全转变为的方法是( A )A.与足量的NaOH溶液共热后,再通入CO2B.加热溶液,通入足量的HClC.与稀H2SO4共热后,加入足量的NaHCO3D.与稀H2SO4共热后,加入足量的NaOH46、乙酸乙酯水解反应可能经历如下步骤:若将上面①~⑥反应按加成、消去、取代分类,其中错误的是( D )A.加成反应:③⑥B.消去反应:④⑤ C.取代反应:①②D.取代反应:④⑥二、填空题(1, x30=30)1、纯净的石炭酸是无色晶体,该晶体常温下在水中的溶解度较小,通常呈浑浊状,若加热到65℃以上,液体变澄清,成为溶液,溶液冷却后又浑浊。
2、甲醛是一种无色刺激性气味的液体,易溶于水,其35%~40%的水溶液称为福尔马林,此溶液可用于塑料工业、合成纤维、皮革工业、医药、染料等;乙醛是无色刺鼻气味的液体,既能溶于水,也能溶于乙醇、乙醚等溶剂。
两种物质中均有醛基官能团,所以其化学性质相似,都可以被氧化为羧酸,还可以被还原为醇。
3、甲酸具有下列性质:①挥发性;②酸性;③比碳酸的酸性强;④还原性;⑤能发生酯化反应。
下列各实验中,分别填出表现甲酸相应性质的编号:(1)在碳酸钠溶液中加入甲酸有气体放出,说明甲酸具有③;(2)在甲酸钠晶体中加入浓磷酸,加热后放出能使湿润蓝色石蕊试纸变红的气体,说明甲酸具有①;(3)与乙醇、浓硫酸混合后共热,能闻到一种香味,说明甲酸具有⑤;(4)在甲酸溶液中加入氢氧化铜,能看到溶液变蓝色,说明甲酸具有②;(5)在新制氢氧化铜中加入甲酸溶液,加热看到有红色沉淀生成,说明甲酸具有④。
4、脂肪烃基和羟基相连的化合物称为醇,饱和一元醇的通式是Cn H2n+1-OH。
乙二醇、丙三醇是重要的化工原料,乙二醇可作汽车的防冻液,丙三醇用于配制化妆品。
5、烷烃的通式是Cn H2n+2,苯及苯的同系物的通式是 CnH2n-6(n≥6)。
6、(10分)有甲基、苯基、羟基、羧基四种基团,在它们两两组合形成的化合物中,写出具有以下性质的物质的结构简式:(1)能使石蕊试液变色的是___CH3COOH________(任写一种)。
(2)能与溴水发生取代反应的是____C6H5-OH______。
(3)催化氧化后产物能与新制氢氧化铜发生氧化还原反应的是___CH3-OH____,(4)能与氯化铁溶液发生显色反应的是______C6H5-OH___。
(5)不能使溴水褪色,但可以是高锰酸钾溶液褪色的是____C6H5-CH3_____。
7、请根据下列变化关系填空:(1)A分子中所含官能团的名称为醛基和羟基。
(2)B溶液为氢氧化钠,作用是提供碱性环境生成新制Cu(OH)2 。
(3)写出反应④的化学方程式,并在括号中标明反应类型。
(氧化反应)8、烯烃的组成通式是CnH2n,烯烃的官能团是碳碳双键,由于官能团中存在碳碳双键,比较活泼,因此烯烃容易发生化学反应,其重要的化学反应是加成反应,除此之外,烯烃容易发生氧化、聚合反应;炔烃的组成通式是 CnH2n-2 ,炔烃的官能团是碳碳三键。
