大学有机化学知识点整理考试必备.doc
完整版大学有机化学知识点整理考试必备

完整版大学有机化学知识点整理考试必备一、基础概念1. 有机化学的定义2. 同分异构体的定义和分类3. 共价键的构成和性质4. 电子云模型和分子轨道模型5. 共轭体系和杂环化合物的概念6. 化学平衡7. 离子的化学性质8. 酸碱性及其影响因素二、物质分类和性质1. 醇的性质及其与酸反应2. 烷基卤化酯的性质及其合成3. 胺的性质及其与酸碱反应4. 羧酸的性质及其合成5. 酯的性质及其制备、加成和加水反应6. 假脂类的性质及其与酸碱的反应7. 烷基磺酸酯的性质及其合成8. 脂肪族化合物的氧化和还原反应三、化学反应和机理1. 反应速率和速率常数2. 化学反应的平衡常数3. 酸催化和碱催化的化学反应4. 木质素的生物合成和人工合成5. 光化学反应的能量和机理6. 重绝旋化合物的立体化学和合成方法7. 质子转移催化的克鲁森斯基反应和迈克尔加成反应8. 半羧酸的制备和酯化反应四、有机分析和表征1. 元素分析和红外光谱分析2. 液体和气相色谱分析3. 质谱和核磁共振分析4. 过氧化氢值的测定和比色法分析5. 紫外光谱和拉曼光谱分析6. 纯度的测定和晶体衍射分析7. 氢谱和电子自旋共振分析8. 光电子能谱和电子能损谱分析五、应用和前沿1. 医药,例如:阿司匹林的合成和应用2. 食品,例如:食用油的合成和性质3. 环境,例如:污染物的分析和去除4. 原料化工和新能源,例如:糖基化合物的生产和利用5. 生物学和材料科学,例如:合成生物材料和功能化金属氧化物6. 多相催化和光化学反应机理研究7. 有机化学的计算方法和机器学习应用8. 网络化学和人工智能发展对有机化学的影响有机化学知识点非常广泛深奥,以上只是其中一部分,仅供参考。
在学习过程中,建议多数练习和思考,加强理解和记忆。
(完整版)大学有机化学知识点整理考试必备

大学有机化学知识点提纲(一)绪论共价键价键理论(杂化轨道理论);分子轨道理论;共振论.共价键的属性:键能;键长;键角;键的极性.键的极性和分子极性的关系;分子的偶极矩.有机化合物的特征(二)烷烃和环烷烃基本概念烃及其分类;同分异构现象;同系物;分子间作用力;a键,e键;构型,构象,构象分析,构象异构体;烷基;碳原子和氢原子的分类(即1,2,3碳,氢;4碳);反应机理,活化能.对于基本概念,不是要求记住其定义,而是要求理解它们,应用它们说明问题.命名开链烷烃和环烷烃的IUPAC命名,简单的桥环和螺环的命名.烷烃和环烷烃的结构碳原子sp3杂化和四面体构型;环烷烃的结构(小环的张力).烷烃的构象开链烷烃的构象,能量变化;环烷烃的构象:重点理解环己烷和取代环己烷的构象及能量变化,稳定构象,十氢萘及其它桥环的稳定构象.烷烃的化学性质自由基取代反应—卤代反应及机理;碳游离基中间体—结构,稳定性;不同的卤素在反应中的活性和选择性;反应过程中的能量变化.环烷烃的化学性质自由基取代反应(与烷烃一致);小环(3,4元环)性质的特殊性—加成.(三)烯烃烯烃的结构特点碳的sp2杂化和烯烃的平面结构;键和键.烯烃的同分异构,命名碳架异构,双键位置异构,顺反异构(Z,E).烯烃的物理和化学性质烯烃的亲电加成及其机理,马氏规则;碳正离子中间体—结构,稳定性,重排.其它加成反应:催化加氢(立体化学,氢化热);硼氢化—氧化(加成取向,立体化学);羟汞化—脱汞(加成取向);与HBr/过氧化物加成(加成取向);其它游离基加成.氧化反应:羟基化反应—邻二醇的形成;KMnO4/H+的氧化,臭氧化反应,烯烃结构的测定.α-位取代反应:烯丙基型取代反应(高温卤代和NBS卤代)及机理—烯丙基自由基.(四)炔烃和二烯烃炔烃①结构:碳的sp杂化和碳-碳三键;sp杂化,sp2杂化和sp3杂化的碳的电负性的差异及相应化合物的偶极矩.②同分异构体③化学性质:末端炔烃的酸性及相关的反应;三键的加成:催化加氢,亲电加成,亲核加成;碳—碳三键与H2/Lindlar催化剂反应(顺式烯烃);碳—碳三键与Na/液氨的反应(反式烯烃);加卤素;加HX(马氏规则);加H2O(羰基化合物的形成);加HBr/过氧化物;硼氢化—氧化;加HCN及乙炔的二聚;氧化反应:KMnO4氧化和臭氧化.二烯烃①共轭二烯烃的稳定性:键能和键长平均化,共轭效应.②二烯烃的化学反应:1,2-加成和1,4-加成(反应机理);反应的动力学控制和热力学控制(反应过程中的能量变化);烯丙型碳正离子的稳定性(p-共轭);Diels-Alder反应.(五)波谱分析紫外光谱理解各种跃迁(,n,,n)和各自的吸收能量波长;发色团和助色团;溶剂效应;最重要的是能够从一张UV谱图中得到有用的信息(判断结构)(不要求利用经验规则去计算某化合物之吸收波长).红外光谱理解IR光谱之基本原理,最重要的是利用IR光谱(结合其它波谱)推测有机分子的结构,这就要求对各类官能团的红外吸收范围有清楚的了解,并清楚影响峰位置变化的因素.核磁共振谱(1H NMR)(碳谱不要求)了解基本原理;基本概念:化学位移,内标,外标,偶合,偶合常数,屏蔽,去屏蔽等.清楚不同类型的枝质子的化学位移范围及影响因素;最重要的是利用NMR谱(结合其它波谱)推测有机分子的结构.质谱了解基本原理;几种重要的开裂方式(包括重要的重排开裂如麦氏重排,逆Diels-Alder重排等);最重要的是利用MS得出的分子离子峰(并结合其它波谱方法)推测有机分子的结构.本章最重要的是利用几种波谱方法结合推测有机分子的结构.(六)芳香烃苯的结构和芳香性理解芳香性的概念和判断芳香性的Hückel规则,能用此规则判断一给定的分子(或离子)是否是芳香性的.苯的异构,同系物和命名苯及其同系物的物理性质和波谱性质主要了解其波谱特征,例如芳香烃的NMR谱学特征,不同取代苯在IR指纹区的特征等.化学性质亲电取代反应及机理;傅氏反应的特点及局限;氯甲基化反应;Gatterman-Koch反应;芳香环上取代基的定位效应;其它反应:侧链氧化;侧链取代;芳香环上的还原:催化加氢,Birch还原.萘的结构和化学性质(七)立体化学基本概念对映异构(体);手性分子;镜像;旋光性,旋光度;对映体;非对映体;差向异构体;内消旋体;外消旋体;手征性;手性中心.对映异构体构型的表示法R/S法(次序规则).熟悉各类手性分子含1—3个手性碳原子的手性分子;不含手性碳原子的手性分子;环状化合物.立体异构体的制备和反应熟悉能产生立体异构体的化学反应及机理,象烯烃与卤素的反式加成,环氧乙烷的开环,羰基化合物的加成(Cram规则)等等.(八)卤代烃异构,分类,命名波谱性质,尤其是NMR谱化学性质亲核取代反应及机理(SN1,SN2);影响亲核取代及机理的因素;亲核试剂的亲核性;SN2反应的立体化学;SN1反应中的重排;邻基参与.消除反应及机理(E1,E2,E1cb):消除反应的取向(Saytzeff规则)和立体化学;消除反应和取代反应的竞争.卤代烃与Mg,Li,Na等的反应:Grignard试剂,有机锂试剂及其应用.(九)醇,酚,醚结构,分类,命名醇的物理性质和光谱性质氢键对其物理性质的影响;IR光谱和NMR谱的特征.醇的化学性质醇的酸性(与其它类型化合物如H2O,酚,羧酸酸性的比较);与酸性有关的反应(与金属如Na,Mg,Al的反应);醇的氧化(形成醛/酮,羧酸);熟悉各种氧化剂;醇的成酯反应:与无机酸成酯,与有机酸成酯(机理);卤化反应;用SOCl2卤化的立体化学及机理;用HX的卤代反应(Lucas试剂用来区别六个碳原子以下1,2和3醇);Wagner-Meerwein重排.醇的脱水反应:反应机理/扎依切夫规律;反应活性;重排;分子间脱水成醚.多元醇的反应:与HIO4或Pb(OAc)4的反应;片呐醇重排反应及机理.酚的物理性质和光谱性质酚的化学性质酸性及与之相关的反应;Fries重排;芳环上的亲电取代:卤代,硝化,磺化;其它亲电取代:与醛的作用;与CO2的作用;Reimer-Tiemann反应;酚的氧化反应.酚的制备方法异丙苯氧化法;氯苯水解法;苯磺酸碱熔法.醚的反应与HX的反应(醚键断裂)及机理;Claisen重排;环氧乙烷的反应.醚的合成方法Williamson合成法.(十)醛和酮醛酮的反应①加成反应,亲核加成以上反应适用于醛,脂肪族甲基酮和八个碳原子以下的环酮.②—碳原子上卤仿反应:③氧化和还原醛酮的制法①烃类氧化②醇的氧化及去氢③Friedel-Crafts酰化反应3.,—不饱和醛,酮的反应:(十一)羧酸及其衍生物羧酸的反应:①酸性:羧酸的酸性比碳酸强,比无机酸弱.②羧酸中羟基的取代反应③还原羧酸的制法①氧化法②水解法③Grignard试剂与二氧化碳作用羧酸衍生物的反应①水解都生成羧酸②醇解酰氯,酸酐和酯的醇解都生成酯,酯与醇作用生成原酸酯或酯.③氨解酰氯,酸酐和酯的氨解都生成酰胺④酸解生成平衡混合物羧酸衍生物的制法①酰氯:羧酸与无机酰氯作用;②酸酐:酰氯与羧酸盐作用;③酯:直接酯化: ④酰胺:羧酸的铵盐去水或酯的氨解;⑤腈:酰胺去水或卤代烃与氰化钠作用.(十二)取代羧酸卤代酸的反应①与碱的反应,产物与卤素和羧基的相对位置有关.-卤代酸羟基酸-卤代酸,-不饱和酸或-卤代酸内酯②Darzen反应诱导效应共轭效应醇酸的反应①去水,产物与羟基的相对位置有关-醇酸交酯-醇酸,-不饱和酸-醇酸内酯②分解:乙酰乙酸乙酯在合成上的应用①合成甲基酮:②合成酮酸丙二酸酯在合成上的应用①合成一元羧酸②合成二元羧酸(十三)胺和含氮化合物胺的化学性质①碱性②烃化③酰化(Hinsberg反应)④与亚硝酸的反应胺的制法①硝基混合物的还原②氨或胺的烃化③还原烃化④Gabriel合成法⑤Hofmann重排:芳香族重氮盐的反应①取代反应②还原反应③偶联反应(十四)含硫,含磷化合物硫醇的制备和性质①酸性和金属离子形成盐,还原解毒剂;②氧化反应,二硫化物,磺酸;③和烯键及炔键的加成反应.磺酸基的引入和被取代在合成上应用了解磺胺药物一般制备方法.磷Ylide的制备及Wittig反应在合成中的应用.(十五)杂环化合物杂环化合物的分类和命名呋喃,噻吩,吡咯的结构和芳香性.芳香性: 苯>噻吩>吡咯>呋喃离域能(kJ/mol—1) 150.6,121.3,87.6,66.9呋喃,噻吩,吡咯的性质①亲电取代:卤代,硝化,磺化,乙酰化;②呋喃易发生;Diels-Alder反应;③吡咯的弱碱性;④吡啶的碱性;⑤吡啶的氧化,还原性质;⑥Fischer吲哚合成法和Skraup喹啉合成法.(十六)周环反应在协同反应中轨道对称性守恒电环化反应的选择规律电子数基态激发态4n 顺旋对称4n+2 对旋顺旋环化加成反应的选择规律(同一边)电子数基态激发态4n 禁阻允许4n+2 允许禁阻迁移反应的选择规律(同一边)i+j 4n 4n+2基态禁阻允许Cope重排Claisen重排(十七)碳水化合物单糖的结构与构型①Fischer构型式的写法:羰基必须写在上端;②构型:编号最大手性碳原子上OH在竖线右边为D-型,在左边为L-型;③Haworth式:己醛糖的Haworth式中C1上的OH与C5上的CH2OH在环同一边为位异构体.单糖的反应①氧化:醛糖用溴水氧化生成糖酸,用稀硝酸氧化生成糖二酸②还原:用NaBH4还原生成多元醇③脎的生成:糖与苯肼作用——成脎.(十八)氨基酸,多肽,蛋白质1.①氨基酸的基本结构天然的-氨基酸,只有R取代基的差别.②等电点:等电点时氨基酸以两性离子存在,氨基酸溶解度最小;③氨基酸-茚三酮的显色的反应;④Sanger试剂及应用;⑤氨基酸的制备:a. -卤代酸的氨解,b. 醛和酮与氨,氢氰酸加成物水解,c. 二丙酸酯合成法;⑥多肽的合成方法.(十九)萜类和甾体化合物①掌握萜类化合物的基本结构:碳骨架由异戊二烯单位组成的;会划分萜类化合物中的异戊二烯单位.②掌握一些重要的萜类天然产物常规性质:如法尼醇;牛儿酮;栊牛儿奥;山道年;维生素A;叶绿醇;角鲨烯.-胡萝卜素.③了解甾体化合物的四环结构和命名.④了解萜类和甾体化合物的生物合成。
大学有机化学知识整理

链烷烃1、新(neo):表示第二位碳原子上带有两个甲基2、命名时,较优基团后列出:甲基、乙基、丙基、丁基、戊基、异戊基、异丁基、新戊基、异丙基、仲丁基、叔丁基3、在支链烷烃中,相对分子质量相同时,对称性好的熔点较高4、相同碳数的烷烃,支链越多,其相对密度越小5、烷基自由基的相对稳定性:甲基最不稳定6、卤化反应:条件——光照决定反应速度的步骤是:夺氢过程卤素反应活性:氟氯溴碘氢反应活性:根据烷基稳定性判断(越稳定越易生成)7、溴化具有很高的选择性环烷烃1、卤代反应:五元环、六元环2、加氢:三元环、四元环、五元环(Ni作催化剂,所需温度逐渐升高)3、加卤素:三元环室温,四元环温热4、加卤化氢:只有三元环5、不对称环丙烷加HX 的规律:①开环位置:在含氢最多与含氢最少的两个碳之间②氢加在含氢较多的碳原子上。
6、O260%HNO3100o C HOOC(CH2)4COOH7、环丙烷不使KMnO4水溶液褪色,可用此区别:环丙烷和不饱和烃8、三键与银氨离子反应有白色沉淀9、键角变形程度越大,张力越大。
张力越大,环的稳定性越低,反应性越大。
环戊烷、环己烷偏转角度最小,也最稳定。
10、椅式是环己烷的最稳定的构象,在各种构象的平衡混合中,椅式占99.9%。
多环烃中,含椅式最多的构象为最稳定的构象。
平伏键(e键),直立键(a键)11、一取代环己烷最稳定构象是取代基在e键上。
多取代环己烷,e取代基最多的构象最稳定。
多取代环己烷,体积较大的取代基为e型的构象最稳定。
取代基体积越大,e取代占的比例越大。
烯烃1、正构(无支链)端烯烃称为α-烯烃,与双键碳直接相连的饱和碳称为α-C,其上的氢称为α-H。
2、在不发生化学反应的情况下,顺式(Z )不可能转变成反式(E )。
3、含两个及以上双键的烯烃称为某二烯、某三烯、某四烯等,用数字详细说明双键的位置。
4、写名称时把双键的Z 或E 构型用“()”标在前面并注明位号。
5、与HX 反应(与X2也是):反应活性——取代烃基多的反应活性大(因为R 有+I 效应,使C 上电子云密度变高,有利于H+作用6、一般热力学稳定性好的烯烃,其亲电加成反应活性也高。
(完整版)有机化学基础知识点总结

引言概述:有机化学作为化学学科的一个重要分支,研究有机化合物的结构、性质和反应机理,是化学学习的基础。
有机化学基础知识点对于理解和掌握有机化学的原理和应用至关重要。
本文将从五个大点出发,详细阐述有机化学的基础知识点。
一、有机化合物的命名1.醇类的命名:通过识别羟基的位置和数量,采用“字根+ol”的命名法。
2.醛和酮的命名:以醛基和酮基分别作为命名的基础,通常采用“字根+al”的命名法和“字根+one”的命名法。
3.酸类和酯的命名:以羧基和酯基分别作为命名的基础,通常采用“希酸”和“酸酯”的命名法。
4.芳香化合物的命名:根据苯环上的取代基的位置和数量,采用数字和字母的组合进行命名。
5.范德华力、静电干涉和氢键的重要性:通过这些相互作用力的存在,可以解释分子之间的特殊性质和反应。
二、有机化学反应的机理1.加成反应:通过两个或多个分子中部分反应性的化学物质结合形成一个新的化合物。
2.消除反应:通过两个或多个分子中部分反应性的化学物质相互分离形成两个或更多的产物。
3.变位反应:通过化合物中某一部分的结构重新组合形成产物。
4.羰基化合物的还原反应:通过添加一种强还原剂,将羰基物质转化为相应的醇。
5.羟醇的氧化反应:通过添加一种强氧化剂,将醇转化为相应的醛或酮。
三、有机化合物的结构和性质1.共价键与键长:共价键是有机化合物中最常见的键,其长度取决于成键原子的电子云分布。
2.极性共价键:由于成键原子之间电子云密度的不均匀,导致共价键中电子密度分布的不均匀。
3.分子的分散力和溶解性:分子之间的分散力是由于电子云的不均匀分布而引起的吸引力。
4.电子云的亲核性/亲电性:电子云可以表现出亲核性或亲电性,取决于原子内的电子分布和外部原子的电子密度。
5.光学活性:光学活性是指一个有机化合物可以使平面偏振光彻底旋转一定角度。
四、有机化合物的合成方法1.羰基化合物的合成:羰基化合物可以通过醛或酮的氧化获得,也可以通过相应的醇的氧化后进行脱水反应得到。
大一有机化学必考知识点

大一有机化学必考知识点有机化学是化学专业中一门重要的基础课程,对于学习化学的学生来说,掌握有机化学的基本知识点是非常重要的。
本文将介绍大一有机化学必考的知识点,帮助学生更好地备考和学习。
一、有机化学的基本概念1. 有机化合物的定义:有机化合物是由碳原子构成的化合物,可以通过共价键连接其他的原子或基团。
2. 共价键:共价键是由原子间电子的共享形成的化学键。
3. 有机官能团:有机官能团是分子中具有相同化学性质和功能的原子或原子团。
二、有机化合物的结构和命名1. 有机化合物的结构:有机化合物的结构可以通过结构式、简式或分子式来表示。
2. 碳原子的化合价:碳原子可以形成最多四个共价键。
3. 碳链的命名:碳链的命名可以根据主链的长度、取代基的位置和种类来进行。
三、有机化合物的分类1. 饱和和不饱和化合物:饱和化合物是指所有碳-碳键都是单键的化合物,不饱和化合物则包含双键或三键。
2. 碳环化合物:碳原子形成环状结构的有机化合物。
四、有机化学反应1. 反应物和生成物:有机化学反应的反应物是发生反应的起始物质,生成物是反应之后形成的物质。
2. 反应机理:有机化学反应的反应机理是描述反应中各步骤和反应中间体的过程。
3. 主要反应类型:包括取代反应、加成反应、消除反应、还原反应等。
五、重要的有机官能团1. 烃类:烃类是由碳和氢构成的有机化合物,包括烷烃、烯烃和炔烃等。
2. 醇:醇是含有羟基的有机化合物,可以通过取代或加成反应制备。
3. 醛和酮:醛和酮是含有羰基的有机化合物,可以通过氧化或还原反应制备。
4. 羧酸和酯:羧酸是含有羧基的有机化合物,酯是羧酸和醇反应生成的产物。
六、有机化合物的应用1. 医药化学:有机化合物在药物的合成和研发中起着重要的作用。
2. 材料化学:有机化合物可以用于合成各种材料,如塑料、纤维等。
3. 生物化学:有机化合物是生物体内许多重要的生物分子,如蛋白质、核酸等的组成部分。
总结:大一有机化学必考的知识点包括有机化合物的基本概念、结构与命名、分类、反应和重要的有机官能团等内容。
大一有机考试知识点总结

大一有机考试知识点总结有机化学是化学的重要分支之一,也是大学化学课程中的重要内容之一。
下面是大一有机化学考试中的重要知识点总结。
1. 化学键的类型:- 单键:由两个原子共享一对电子而形成的键。
- 双键:由两个原子共享两对电子而形成的键。
- 三键:由两个原子共享三对电子而形成的键。
2. 饱和与不饱和化合物:- 饱和化合物:每个碳原子的化合价都用完,并且没有多余的键。
例如甲烷(CH4)。
- 不饱和化合物:至少存在一对碳原子之间的双键或三键。
例如乙烯(C2H4)。
3. 碳的立体化学:- 手性:一个分子非对称,不能与其镜像重叠的性质。
手性分子具有两个互为镜像的异构体,称为手性体。
- 手性中心:一个碳原子连接着四个不同的基团时,就形成一个手性中心。
手性中心也被称为立体中心。
4. 碳的杂化轨道:- sp3杂化轨道:四个σ键,四个sp3杂化轨道。
例如甲烷的碳原子。
- sp2杂化轨道:三个σ键和一个π键,三个sp2杂化轨道。
例如乙烯的碳原子。
- sp杂化轨道:两个σ键和两个π键,两个sp杂化轨道。
例如乙炔的碳原子。
5. 反应机理:- 亲核取代反应:亲核试剂攻击含有部分正电荷的反应物,将原来的基团替换掉。
- 亲电取代反应:亲电试剂从反应物中吸引电子,形成新的键。
- π加成反应:π电子云中的电子攻击亲电试剂。
6. 重要的反应类型:- 加成反应:两个分子结合形成一个新的分子。
例如烯烃加成反应。
- 消除反应:一个分子分解成两个或多个分子。
例如脱水反应。
- 变位反应:化学键的重新组合而成不同的构型。
例如环化反应。
- 氧化还原反应:涉及电子的转移。
例如醛酮的氧化反应。
- 反应类型与机构的学习与辨认:了解不同反应类型和机构的特点,并能根据反应过程和产物识别反应类型和机构。
这些是大一有机化学考试中的重要知识点总结。
希望对你的学习有所帮助!。
(完整版)大学有机化学知识点总结.doc

有机化学复习总结一.有机化合物的命名1.能够用系统命名法命名各种类型化合物:包括烷烃,烯烃,炔烃,烯炔,脂环烃(单环脂环烃和多环置换脂环烃中的螺环烃和桥环烃),芳烃,醇,酚,醚,醛,酮,羧酸,羧酸衍生物(酰卤,酸酐,酯,酰胺),多官能团化合物(官能团优先顺序:-COOH>- SO3H>- COOR>- COX>- CN>- CHO> >C= O>- OH(醇 ) >- OH(酚 ) >- SH>- NH2>- OR> C = C>- C≡C-> ( -R>- X>- NO2),并能够判断出Z/E 构型和 R/S 构型。
2. 根据化合物的系统命名,写出相应的结构式或立体结构式(伞形式,锯架式,纽曼投影式,Fischer 投影式)。
立体结构的表示方法:COOH CH 31)伞形式: C 2)锯架式:H H OHH OHOHH3C C 2 H 5H H COOHH HH4)菲舍尔投影式:H OH 3)纽曼投影式:H H HCH 3H H H H5)构象 (conformation)(1)乙烷构象:最稳定构象是交叉式,最不稳定构象是重叠式。
(2)正丁烷构象:最稳定构象是对位交叉式,最不稳定构象是全重叠式。
(3) 环己烷构象:最稳定构象是椅式构象。
一取代环己烷最稳定构象是 e 取代的椅式构象。
多取代环己烷最稳定构象是 e 取代最多或大基团处于 e 键上的椅式构象。
立体结构的标记方法1. Z/E 标记法:在表示烯烃的构型时,如果在次序规则中两个优先的基团在同一侧,为Z 构型,在相反侧,为 E 构型。
CH 3 Cl CH 3 C 2 H 5C C C CH C 2H 5 H Cl(Z) - 3 -氯- 2 -戊烯(E) - 3 -氯- 2 -戊烯2、顺 / 反标记法:在标记烯烃和脂环烃的构型时,如果两个相同的基团在同一侧,则为顺式;在相反侧,则为反式。
CH3 CH3 CH3 H CH3 CH3 H CH3C C C CH H H CH3 H H CH3 H顺- 2-丁烯反- 2-丁烯顺- 1,4-二甲基环己烷反- 1,4-二甲基环己烷3、 R/S 标记法:在标记手性分子时,先把与手性碳相连的四个基团按次序规则排序。
大学有机化学复习重点总结(各种知识点

大学有机化学复习重点总结(各种知识点1、烷烃的自由基取代反应 X2的活性:F2 >Cl2 >Br2 >I2 选择性:F2 < Cl2 < Br2< I22、烯烃的亲电加成反应活性 R2C=CR2 > R2C=CHR>RCH=CHR > RCH=CH2 > CH2=CH2 > CH2=CHX3、烯烃环氧化反应活性 R2C=CR2 > R2C=CHR> RCH=CHR > RCH=CH2 > CH2=CH24、烯烃的催化加氢反应活性:CH2=CH2 >RCH=CH2 >RCH=CHR > R2C=CHR > R2C=CR2 卤代烃的亲核取代反应SN1 反应:SN2 反应:成环的SN2反应速率是:v五元环 > v六元环 > v中环,大环 > v三元环 > v四元环定位基定位效应强弱顺序:邻、对位定位基:-O->-N(CH3)2>-NH2>-OH>-OCH3>-NHCOCH3>-R >-OCOCH3>-C6H5>-F>-Cl>-Br >-I间位定位基:-+NH3>-NO2>-CN>-COOH>-SO3H>-CHO>-COCH3>-COOCH3>-CONH2 转]有机化学鉴别方法《终极版》找了很久有机化学鉴别方法的总结1烷烃与烯烃,炔烃的鉴别方法是酸性高锰酸钾溶液或溴的ccl4溶液(烃的含氧衍生物均可以使高锰酸钾褪色,只是快慢不同)2烷烃和芳香烃就不好说了,但芳香烃里,甲苯,二甲苯可以和酸性高锰酸钾溶液反应,苯就不行3另外,醇的话,显中性4酚:常温下酚可以被氧气氧化呈粉红色,而且苯酚还可以和氯化铁反应显紫色5可利用溴水区分醛糖与酮糖6醚在避光的情况下与氯或溴反应,可生成氯代醚或溴代醚。
醚在光助催化下与空气中的氧作用,生成过氧化合物。
7醌类化合物是中药中一类具有醌式结构的化学成分,主要分为苯醌,萘醌,菲醌和蒽醌四种类型,具体颜色不同反应类型较多一、各类化合物的鉴别方法1、烯烃、二烯、炔烃:(1)溴的四氯化碳溶液,红色腿去(2)高锰酸钾溶液,紫色腿去。
大学有机化学知识点归纳.doc

大学有机化学知识点归纳大学有机化学知识点归纳(一)1) 马氏规律:亲电加成反应的规律,亲电试剂总是加到连氢较多的双键碳上。
2) 过氧化效应:自由基加成反应的规律,卤素加到连氢较多的双键碳上。
3) 空间效应:体积较大的基团总是取代到空间位阻较小的位置。
4) 定位规律:芳烃亲电取代反应的规律,有邻、对位定位基,和间位定位基。
5) 查依切夫规律:卤代烃和醇消除反应的规律,主要产物是双键碳上取代基较多的烯烃。
6) 休克尔规则:判断芳香性的规则。
存在一个环状的大键,成环原子必须共平面或接近共平面, 电子数符合4n+2 规则。
7) 霍夫曼规则:季铵盐消除反应的规律,只有烃基时,主要产物是双键碳上取代基较少的烯烃(动力学控制产物)。
当-碳上连有吸电子基或不饱和键时,则消除的是酸性较强的氢,生成较稳定的产物(热力学控制产物)。
8) 基团的顺序规则。
大学有机化学知识点归纳(二)烷烃:烷烃的自由基取代:外消旋化烯烃:烯烃的亲电加成:溴,氯,HOBr (HOCl) ,羟汞化-脱汞还原反应-----反式加成;其它亲电试剂:顺式+反式加成烯烃的环氧化,与单线态卡宾的反应:保持构型烯烃的冷稀KMnO4/H2O 氧化:顺式邻二醇烯烃的硼氢化-氧化:顺式加成烯烃的加氢;顺式加氢环己烯的加成:(1-取代,3-取代,4-取代)炔烃:选择性加氢:Lindlar 催化剂-----顺式烯烃Na/NH3(L)-----反式加氢亲核取代:SN1:外消旋化的同时构型翻转SN2:构型翻转(Walden 翻转) 消除反应E2,E1cb: 反式共平面消除环氧乙烷的开环反应:反式产物大学有机化学知识点归纳(三)大学有哪些文科的专业值得去报考大学十大文科热门专业介绍大学十大文科热门专业:经济与金融专业培养目标:经济与金融专业旨在培养经济与金融专业方面的知识及理论,能应用所学知识进行相关工作的能力,能在经济和金融活动中进行实际工作的高层次金融人才。
就业前景:从整体上看,金融学专业这几年在报考方面比较热门,其职业前景普遍看好,但根据实际就业情况看,两极分化比较严重,据文都教育经济学考试中心的观察统计发现,知名院校的金融学硕士,如果导师影响力较大,在校期间注重实践,同时研究功底比较深厚,刚出校门拿到10万以上年薪者,不在少数。
大学有机化学笔记整理(精选)(一)2024

大学有机化学笔记整理(精选)(一)引言概述:大学有机化学是化学专业中的一门重要课程,涵盖了有机化合物的结构、性质和反应机制等内容。
本文是对大学有机化学课程进行笔记整理,以帮助学生更好地理解和掌握有机化学的基础知识。
正文内容:大点一:有机化合物的基本结构1. 有机化合物的组成元素2. 有机化合物的键的类型及特点3. 有机化合物的立体构型4. 有机化合物的分子式与结构式表示5. 有机化合物的同分异构体大点二:有机化合物的物理性质1. 有机化合物的颜色2. 有机化合物的溶解性3. 有机化合物的沸点和熔点4. 有机化合物的密度和折射率5. 有机化合物的光学活性大点三:有机化合物的反应机制1. 有机化合物的取代反应2. 有机化合物的加成反应3. 有机化合物的消除反应4. 有机化合物的氧化还原反应5. 有机化合物的重排反应大点四:有机化合物的官能团转化1. 烷烃的官能团转化2. 卤代烃的官能团转化3. 醇的官能团转化4. 酮和醛的官能团转化5. 酸和酯的官能团转化大点五:有机合成的基本方法1. 反应的选择与优化2. 反应条件的控制3. 催化剂的作用与选择4. 有机合成的常用试剂5. 实验技术与安全注意事项总结:大学有机化学是一门让人感到挑战和兴趣并存的科目。
通过本文对有机化学的基础知识进行整理,希望能够帮助学生加深对有机化学的理解,提升学习效果。
在学习过程中,不仅要掌握有机化合物的基本结构和物理性质,还要了解有机化合物的反应机制和官能团转化方法,最终能够运用所学知识进行有机合成。
有机化学基础知识点归纳总结.doc

有机化学基础知识点归纳总结.doc(一)有机化学的定义与内容有机化学是研究有机化合物的形成、结构、性质、反应及其机理的化学分子科学,是物质组成和反应机理分析的主要科学。
它是植物和动物体内分子活动中最重要的学科之一。
有机化学是一门化学和生物学都有关系的科学,包括:有机材料的分子结构、构型、化学键及其相互作用的调控和机制;有机化合物的制备与合成;有机化合物的反应原理和物理化学性质;有机反应中金属催化、生物催化及活性催化体系的构建及其应用;有机材料的性质改性;以及有机聚合物、半导体材料、生物药物等的合成配方及结构修饰等相关研究。
(二)有机化学中重要的化学现象(1)杂原子取代反应:指在某种稳定的反应条件下,通过改变维持电性能的杂原子的形式或位置,使有机物的某些性质发生明显的改变的反应。
常见的杂原子取代反应有溴代反应、氯代反应、硝基取代反应、氰基取代反应、还原反应、抗坏血酸取代反应等。
(2)有机物的加成反应:指在有机化合物的定位碳原子当中发生了双卡几键的形成,从而形成稳定的大分子有机化合物的反应。
常见的有机物加成反应包括烷基化反应、异构化反应、偏极子共价加成反应等。
(3)宇称反应:指碳原子承受、转移或释放电子而发生的有机化学反应,即碳酸酯类和酮类有机化合物间反应形成水以及羧酸类和醛类有机化合物中氧原子转移或释放电子而形成活性歧化反应的反应。
常见的宇称反应有酯交换反应、醛解缩反应、酮脱氢反应、酰胺水解反应、羧酸和醛羰基化反应等。
(4)杂环反应:指碳原子原子间形成四唑环或螺环及其噁肩环或桥联环。
常见的杂环反应有Friedel-Crafts反应、Baeyer-Villiger 反应、Stevens反应、Swern反应等。
(三)有机化学中的主要结构类型烷基类有机物:烷基类有机物是指碳原子具有连续的三种氢原子,形成链状结构的有机物。
烷基类有机物又可以分为醇类、醚类、酰胺类、脂肪酸类等。
芳香类有机物:芳香类有机物是指通过共价键合形成含环结构的有机化合物,又称芳环类化合物。
大学有机化学知识点总结资料

有机化学复习总结一.有机化合物的命名 1. 能够用系统命名法命名各种类型化合物:,芳烃,包括烷烃,烯烃,炔烃,烯炔,脂环烃(单环脂环烃和多环置换脂环烃中的螺环烃和桥环烃),多官能团化合物(官能团优先顺序:醇,酚,醚,醛,酮,羧酸,羧酸衍生物(酰卤,酸酐,酯,酰胺)C>-NH2OR >OH(酚)>-SH>->->>--COOH>-SO3HCOOR>-COX>-CN>-CHO>C=O>-OH(醇) R/S构型。
X>-NO2),并能够判断出Z/E构型和≡=C>-CC->(-R>-Fischer根据化合物的系统命名,写出相应的结构式或立体结构式(伞形式,锯架式,纽曼投影式, 2.。
投影式)立体结构的表示方法:CH COOH3HOH C 2)伞形式:)锯架式:1H H OHOHCH3HC52HHCOOH HHH OHH纽曼投影式:3)4)菲舍尔投影式:HHHCHHHH3H(conformation))构象5(1)乙烷构象:最稳定构象是交叉式,最不稳定构象是重叠式。
(2)正丁烷构象:最稳定构象是对位交叉式,最不稳定构象是全重叠式。
式构象。
多e取代的椅(3) 环己烷构象:最稳定构象是椅式构象。
一取代环己烷最稳定构象是e键上的椅式构象。
取代环己烷最稳定构象是e取代最多或大基团处于立体结构的标记方法构型,1.Z/E标记法:在表示烯烃的构型时,如果在次序规则中两个优先的基团在同一侧,为Z 构型。
在相反侧,为E ClCHCHCH5233CCCC HCHHCl52(Z)-3-氯-2-戊烯(E)-3-氯-2-戊烯顺/反标记法:在标记烯烃和脂环烃的构型时,如果两个相同的基团在同一侧,则为顺式;、2在相反侧,则为反式。
1CHHCHCHCH333HCHCH333CC HHHHCHHCHH33-二甲基环己烷-二甲基环己烷反-1,42反--丁烯顺-1,4-丁烯顺-2标记法:在标记手性分子时,先把与手性碳相连的四个基团按次序规则排序。
大学化学易考知识点有机化学

大学化学易考知识点有机化学有机化学作为大学化学的重要分支,是许多学生认为较为困难的一门课程。
但是,只要我们掌握了一些易考的重要知识点,就能够在考试中取得好成绩。
本文将针对大学化学易考的有机化学知识点进行详细的介绍和解析,帮助大家更好地备考。
一、有机化合物的命名规则在有机化学中,命名是一个非常重要的环节。
准确的命名能够直观地展示出有机化合物的结构和性质。
下面是一些常见的有机化合物的命名规则:1. 烷烃烷烃是最简单的有机化合物,其命名规则较为简单。
烷烃的命名根据碳原子数目的不同,分为甲烷、乙烷、丙烷、丁烷等。
其中,甲烷是由一个碳原子和四个氢原子组成的。
2. 单官能团化合物对于单官能团化合物,我们需要先确定它所含的官能团,再进行命名。
比如,醇是一种常见的官能团,其命名规则为“词干+醇”。
例如,乙醇就是由乙烷中一个氢原子被羟基(-OH)取代而成的。
3. 多官能团化合物对于含有多个官能团的化合物,我们需要按照优先级进行命名。
在有机化学中,羧酸和酮是常见的官能团,其优先级较高。
例如,乙酸乙酯是一种含有羧酸和酯官能团的化合物,命名时我们首先确定乙酸基团,并将其作为主链,然后再加上乙酸基团。
二、有机化学反应机制有机化学反应机制是有机化学中的重要内容,也是大学化学考试中的重点。
下面是几个常见的有机化学反应机制:1. 取代反应取代反应是有机化学中最基本的反应类型之一。
在取代反应中,一个或多个官能团会被其他官能团所取代。
比如,卤代烷与氢氧化钾(KOH)反应,卤素会被氢氧根(OH-)所取代。
2. 加成反应加成反应是指有机化合物中的双键或三键断裂,并与其他分子的原子或官能团形成新键。
在加成反应中,通常会加入一些试剂,如氢气(H2)、溴水(Br2)等。
例如,乙烯与溴水加成反应会生成1,2-二溴乙烷。
3. 消除反应消除反应是指有机化合物中的两个邻接原子或官能团的化学键断裂,并形成双键或三键。
在消除反应中,常用的试剂是强碱,如氢氧化钠(NaOH)。
大一有机化学知识点

大一有机化学知识点1.有机化合物的命名原则:有机化合物的命名主要根据它们所含有机基团和官能团进行命名,例如烷烃、烯烃、炔烃等。
2.常见的有机官能团:醇、酚、醛、酮、酸、酯、酰胺、醚、酮、胺等,它们在有机反应中起着重要的作用。
3.共价键的构成和性质:共价键是由原子间的电子共享形成的,有机化合物中的共价键具有一定的特性,如键的类型、键的键长和键的键能等。
4.有机官能团的化学性质:有机官能团在不同条件下会发生不同的化学反应,如羟基醇化、酯化、醚化、胺化等。
5.有机化合物的结构与性质:有机化合物的结构决定了它们的性质,如溶解性、沸点、熔点、燃烧性、酸碱性等。
6.有机化合物的急性毒性:有机化合物的急性毒性与它们的结构密切相关,不同结构的有机化合物对人体的毒害性也不同。
7.化学键的键能和键长:有机化合物中的化学键的键能和键长对它们的性质和反应有重要影响,如C-C键的键能和键长是确定碳原子的化学性质的重要因素。
8.有机化合物的立体化学:有机化合物中存在立体异构体,主要有构象异构体和光学异构体,它们的存在会影响化合物的性质。
9.有机氧化还原反应:有机氧化还原反应是有机化学中常见的反应类型之一,常见的氧化还原试剂有酸性高锰酸钾、过氧化氢等。
10.饱和烃的热解和催化裂化反应:饱和烃在高温下经历热解反应,可以得到烯烃和炔烃等不饱和烃。
催化裂化是在催化剂作用下进行的裂化反应。
11.核磁共振谱和红外光谱的应用:核磁共振谱和红外光谱是有机化学中常用的分析方法,可以用于确定有机化合物的结构。
12.反应机理:有机化学的反应机理指的是反应过程中的中间体和过渡态,通过研究反应机理可以更好地理解和预测有机化学反应。
以上是大一有机化学的一些重要知识点,掌握这些知识可以为学生打下坚实的有机化学基础,为进一步学习和研究有机化学奠定基础。
(word完整版)《有机化学基础》知识点整理,推荐文档

《有机化学基础》知识点整理一、重要的物理性质1.有机物的溶解性(1)难溶于水的有:各类烃、卤代烃、硝基化合物、酯、绝大多数高聚物、高级的(指分子中碳原子数目较多的,下同)醇、醛、羧酸等。
(2)易溶于水的有:低级的[一般指N(C)≤4]醇、(醚)、醛、(酮)、羧酸及盐、氨基酸及盐、单糖、二糖。
(它们都能与水形成氢键)。
(3)具有特殊溶解性的:① 乙醇是一种很好的溶剂,既能溶解许多无机物,又能溶解许多有机物,所以常用乙醇来溶解植物色素或其中的药用成分,也常用乙醇作为反应的溶剂,使参加反应的有机物和无机物均能溶解,增大接触面积,提高反应速率。
例如,在油脂的皂化反应中,加入乙醇既能溶解NaOH ,又能溶解油脂,让它们在均相(同一溶剂的溶液)中充分接触,加快反应速率,提高反应限度。
② 苯酚:室温下,在水中的溶解度是9.3g (属可溶),易溶于乙醇等有机溶剂,当温度高于65℃时,能与水混溶,冷却后分层,上层为苯酚的水溶液,下层为水的苯酚溶液,振荡后形成乳浊液。
苯酚易溶于碱溶液和纯碱溶液,这是因为生成了易溶性的钠盐。
③ 乙酸乙酯在饱和碳酸钠溶液中更加难溶,同时饱和碳酸钠溶液还能通过反应吸收挥发出的乙酸,溶解吸收挥发出的乙醇,便于闻到乙酸乙酯的香味。
④ 有的淀粉、蛋白质可溶于水形成胶体..。
蛋白质在浓轻金属盐(包括铵盐)溶液中溶解度减小,会析出(即盐析,皂化反应中也有此操作)。
但在稀轻金属盐(包括铵盐)溶液中,蛋白质的溶解度反而增大。
⑤ 线型和部分支链型高聚物可溶于某些有机溶剂,而体型则难溶于有机溶剂。
⑥ 氢氧化铜悬浊液可溶于多羟基化合物的溶液中,如甘油、葡萄糖溶液等,形成绛蓝色溶液。
2.有机物的密度(1)小于水的密度,且与水(溶液)分层的有:各类烃、一氯代烃、酯(包括油脂)(2)大于水的密度,且与水(溶液)分层的有:多氯代烃、溴代烃(溴苯等)、碘代烃、硝基苯3.有机物的状态[常温常压(1个大气压、20℃左右)](1)气态:① 烃类:一般N(C)≤4的各类烃注意:新戊烷[C(CH 3)4]亦为气态② 衍生物类:一氯甲烷(.....CH ..3.Cl ..,沸点为....-.24.2....℃)..氟里昂(....CCl ...2.F .2.,沸点为....-.29.8....℃).. 氯乙烯(....CH ..2.==CHCl ......,沸点为....-.13.9....℃).. 甲醛(...HCHO ....,沸点为....-.21..℃).. 氯乙烷(....CH ..3.CH ..2.Cl ..,沸点为....12.3....℃).. 一溴甲烷(CH 3Br ,沸点为3.6℃) 四氟乙烯(CF 2==CF 2,沸点为-76.3℃) 甲醚(CH 3OCH 3,沸点为-23℃) 甲乙醚(CH 3OC 2H 5,沸点为10.8℃) 环氧乙烷( ,沸点为13.5℃)(2)液态:一般N(C)在5~16的烃及绝大多数低级衍生物。
大一有机化学常考知识点

大一有机化学常考知识点大一的大学生物化学专业学生都会学习有机化学,这是化学领域一个非常重要的分支。
有机化学主要研究碳与氢以及其他一些非金属元素的化合物,包括它们的结构、性质、合成和反应等。
以下是大一有机化学常考的知识点。
一、有机化合物的命名方法有机化合物的命名方法是学习有机化学的第一步,也是非常基础的知识点。
常见的命名方法有:根据碳链的长度命名、根据官能团命名、根据取代基的位置和官能团的位置命名等。
二、立体化学立体化学是有机化学中的重要部分,它研究分子和离子的空间结构。
有机分子的立体构型常常影响其性质和反应活性。
大一有机化学常考的立体化学知识点有:手性和手性中心、立体异构体(顺反异构体和立体异构体)等。
三、官能团的性质和反应官能团是有机化合物中具有一定性质和反应性的取代基。
大一有机化学常考的官能团包括:烷基、卤基、醇基、酮基、酯基、醚基、胺基等。
对于每种官能团,我们需要掌握它们的性质和常见的反应类型。
四、有机化合物的反应类型有机化合物的反应类型繁多,大一阶段主要学习一些基础的反应类型。
常考的有机化学反应类型有:取代反应、加成反应、消除反应、重排反应等。
对于每种反应类型,我们需要了解反应的基本机理以及反应条件。
五、重要的有机化合物在大一有机化学课程中,还会学习和了解一些重要的有机化合物,这些化合物在生活和工业中都有重要的应用。
常考的有机化合物有:乙醇、甲酸、乙酸、苯、甲苯等。
我们需要了解这些化合物的结构、性质、合成和反应等方面的基本知识。
六、有机合成有机合成是有机化学的核心内容之一,它研究如何通过控制反应条件和反应过程来合成目标有机化合物。
大一有机化学常考的合成方法有:加成、消除、取代、重排等。
我们需要了解每种合成方法的基本原理和适用条件。
七、有机化学实验技术有机化学实验是培养学生实际操作能力和实验观察力的重要环节。
大一有机化学常见的实验技术有:重结晶、蒸馏、萃取、干燥、滤液等。
我们需要理解这些实验技术的基本原理和实际应用方法。
高考必备重要知识点有机化学知识点总结免费下载

高考必备重要知识点有机化学知识点总结免费下载有机化学是高考化学考试中的重要内容之一,掌握有机化学的知识点对于高考的取得好成绩有着至关重要的作用。
为了帮助大家更好地备考,本文将对高考必备的有机化学知识点进行总结,并提供免费下载资料,供大家学习使用。
一、有机化学基础知识1. 有机化合物的命名法:掌握有机化合物的命名方法,包括醇、酚、醛、酮、羧酸等各类有机化合物的命名规则。
2. 烃的分类和性质:了解烃的分类,包括烷烃、烯烃和炔烃,并了解它们的物理性质和化学性质。
3. 有机反应类型:掌握有机反应的常见类型,包括酸碱反应、加成反应、消除反应、取代反应等,并能够根据反应类型推测反应产物。
二、有机化学官能团的性质和反应1. 醇和酚:了解醇和酚的性质和常见反应,如醇的氧化反应和酚的酸碱性质。
2. 醛和酮:掌握醛和酮的性质,包括氧化还原反应和亲核加成反应,并了解醛酮的常见应用。
3. 羧酸和酯:了解羧酸和酯的性质和反应,包括酯的加水解酸解反应和羧酸的碳碳键断裂反应。
4. 醚和过氧化物:了解醚和过氧化物的性质和反应,包括醚的酸催化醚解和过氧化物的分解反应。
5. 胺和胺类化合物:掌握胺和胺类化合物的性质,包括碱性和缩合反应,并了解胺类化合物在生物体内的重要作用。
三、功能化合物的合成和转化1. α,β-不饱和酮和羰基化合物:了解α,β-不饱和酮和羰基化合物的合成方法和反应特点,包括Michael加成、羟醛缩合反应等。
2. 酮和醛的互变反应:掌握酮和醛的互变反应,包括氧化还原反应和醛缩反应。
3. 羧酸和酯的合成和加水解:了解羧酸和酯的合成方法,如酸催化酯化反应和酸碱催化的加水解反应,并能够根据具体的反应条件预测反应的产物。
四、高分子化合物1. 聚合反应:了解聚合反应的基本原理和分类,包括加合聚合和缩合聚合,并能够根据给定的单体结构推测聚合产物的结构。
2. 常见高分子材料:掌握常见的高分子材料,如聚乙烯、聚氯乙烯和聚苯乙烯的结构和应用。
(完整版)大学有机化学知识点总结
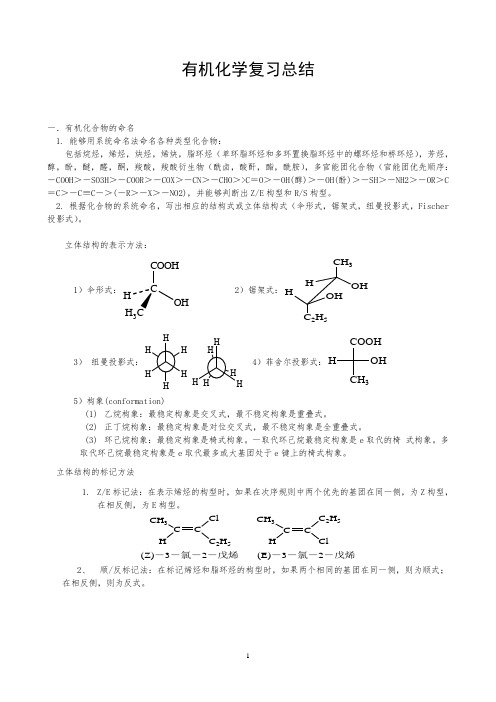
有机化学复习总结一.有机化合物的命名1. 能够用系统命名法命名各种类型化合物:包括烷烃,烯烃,炔烃,烯炔,脂环烃(单环脂环烃和多环置换脂环烃中的螺环烃和桥环烃),芳烃,醇,酚,醚,醛,酮,羧酸,羧酸衍生物(酰卤,酸酐,酯,酰胺),多官能团化合物(官能团优先顺序:-COOH >-SO3H >-COOR >-COX >-CN >-CHO >>C =O >-OH(醇)>-OH(酚)>-SH >-NH2>-OR >C =C >-C ≡C ->(-R >-X >-NO2),并能够判断出Z/E 构型和R/S 构型。
2. 根据化合物的系统命名,写出相应的结构式或立体结构式(伞形式,锯架式,纽曼投影式,Fischer 投影式)。
立体结构的表示方法:1)伞形式:CCOOHOHH 3 2)锯架式:CH 3OH HHOH C 2H 53)纽曼投影式:H H 4)菲舍尔投影式:COOHCH 3OH H5)构象(conformation)(1) 乙烷构象:最稳定构象是交叉式,最不稳定构象是重叠式。
(2) 正丁烷构象:最稳定构象是对位交叉式,最不稳定构象是全重叠式。
(3) 环己烷构象:最稳定构象是椅式构象。
一取代环己烷最稳定构象是e 取代的椅 式构象。
多取代环己烷最稳定构象是e 取代最多或大基团处于e 键上的椅式构象。
立体结构的标记方法1. Z/E 标记法:在表示烯烃的构型时,如果在次序规则中两个优先的基团在同一侧,为Z 构型,在相反侧,为E 构型。
CH 3C H C 2H 5CH 3C CH 2H 5Cl(Z)-3-氯-2-戊烯(E)-3-氯-2-戊烯2、 顺/反标记法:在标记烯烃和脂环烃的构型时,如果两个相同的基团在同一侧,则为顺式;在相反侧,则为反式。
CH 3C CHCH 3HCH 3CCH HCH 3顺-2-丁烯反-2-丁烯333顺-1,4-二甲基环己烷反-1,4-二甲基环己烷3、 R/S 标记法:在标记手性分子时,先把与手性碳相连的四个基团按次序规则排序。
有机化学知识点总结超全完整版

有机化学主要考点第一部分 烃一、烷烃。
通式C n H n 2+2能发生取代反应,例如CH 4+Cl 2 光 CH 3Cl +HCl 。
(条件:C12、Br 2、光照) 二、烯烃。
通式:C n H n 2 二烯烃通式为C n H 22-n 官能团: C=C (碳碳双键)、CH 2=CH 2六个原子共面。
性质:①氧化反应:烯烃能使KM n O 4(H +)的紫红色褪去。
②加成反应:烯烃能使溴的四氯化碳红棕色褪去。
(或溴水)CH 2=CH 2+B 2r →③加聚反应:烯烃能发生加聚反应。
例如:n CH 2=CH 2催化剂[2-CH 2]n三、炔烃。
通式:C n H 22-n HC ≡CH 四个原子共直线,官能团:-C ≡C-性质:与烯烃的性质类似,比如能发生 ①氧化反应 ②加成反应 ③加聚反应 四、芳香烃。
苯和苯的同系物的通式:C n H 62-n (n ≥6) 分子中12个原子共平面。
苯的性质:①取代反应 +B 2r (l ))(Fe 催 –B r +HB r (B 2r 的水溶液不发生此反应)+HO-NO 242SO H 浓 -NO 2+H 20 (也叫硝化反应)②加成反应: +3H苯的同系物的性质,比如甲苯3CH ①氧代反应:能使KMn O 4(H+)溶液褪色②取代反应33HONO220第二部分 烃的衍生物一、卤代烃。
(官能团-B r )性质:①取代反应(水解反应)C 2H 5-B r 2H 5-OH+HB r 或C 2H 5B r +N a 2H 5OH +N a B r 。
②消去反应:C 2H 5 B r + N a 2H 4(CH 2= CH 2)+ N a B r +H 2O或写成:C 2H 5 B 2=CH 2 +HB r二、醇。
官能团:-OH 饱和一元醇的通式:C n H 22+n O 。
饱和x 元醇的通式:C n H 22+n O x 性质:①(催化)氧化反应:2CH 3CH 2OH +O 23CHO +2H 2O (醇的特征:“-CH 2OH ”)②消去反应:C 2H 52= CH 2 +H 2O③酯化反应:C 2H 5OH+CH 3COOH 42SO H 浓 +H 2O C 2H 5OOCCH 3(先写水,避免漏掉) ④与N a 反应。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
%1醇解酰氯,酸酊和酯的醇解都生成酯,酯与醇作用生成原酸酯或酯.
%1氨解酰氯,酸酊和酯的氨解都生成酰胺
%1酸解生成平衡混合物
梭酸衍生物的制法
%1酰氯:梭酸与无机酰氯作用;②酸酎:酰氯与梭酸盐作用;③酯:直接酯化④酰胺:梭酸的铉盐 去水或酯的氨解;⑤腊:酰胺去水或卤代炷与氤化钠作用.
酚的制备方法
异丙苯氧化法;氯苯水解法;苯横酸碱熔法.
醍的反应
与HX的反应(酰键断裂)及机理;Claisen重排;环氧乙烷的反应.
幡的合成方法
Williamson合成法.
(十)醛和酮
醛酮的反应①加成反应,亲核加成
以上反应适用于醛,脂肪族甲基酮和八个碳原子以下的环酮.
%1一碳原子上
卤仿反应:
%1氧化和还原
①Fischer构型式的写法:魏基必须写在上端;②构型:编号最大手性碳原子上OH在竖线右边 为D-型,在左边为L-型;@Haworth式:己醛糖的Haworth式中C1上的OH与C5上的CH2OH在环同一,边为位异构体.
单糖的反应
%1氧化:醛糖用浪水氧化生成糖酸,用稀硝酸氧化生成糖二酸
%1还原:用NaBH4还原生成多元醇
碳架异构,双键位置异构,顺反异构(Z,E).
烯炷的物理和化学性质
烯姣的亲电加成及其机理,马氏规则;碳正离子中间体一结构,稳定性,重排.
其它加成反应:催化加氢(立体化学,氢化热);硼氢化一氧化(加成取向,立体化学);羟汞化一脱 汞(加成取向);与崩17过氧化物加成(加成取向);其它游离基加成.
氧化反应:羟基化反应一邻二醇的形成;KMnO4/H+的氧化,臭氧化反应,烯燃结构的测定.
理解IR光谱之基本原理,最重要的是利用IR光谱(结合其它波谱)推测有机分子的结构,这就 要求对各类官能团的红外吸收范围有清楚的了解,并清楚影响峰位置变化的因素.
核磁共振谱(1H NMR)(碳谱不要求)
了解基本原理;基木概念:化学位移,内标,外标,偶合,偶合常数,屏蔽,去屏蔽等.清楚不同类型的 枝质子的化学位移范围及影响因素;最重要的是利用NMR谱(结合其它波谱)推测有机分子的 结构.
醇的脱水反应:反应机理/扎依切夫规律;反应活性;重排;分了间脱水成酷.
多元醇的反应:与HIO4或Pb(OAc)4的反应;片呐醇重排反应及机理.
酚的物理性质和光谱性质
酚的化学性质
酸性及与之相关的反应;Fries重排;芳环上的亲电取代:卤代,硝化,磺化;其它亲电取代:与醛的 作用;与CO2的作用;Reimer-Tiemann反应;酚的氧化反应.
大学有机化学知识点提纲(一)绪论
共价键
价键理论(杂化轨道理论);分子轨道理论;共振论.
共价键的属性:键能;键长;键角;键的极性.
键的极性和分子极性的关系;分子的偶极矩.
有机化合物的特征
(二)烷炷和环烷炷
基本概念
炷及其分类;同分异构现象;同系物;分子间作用力;a键,e键;构型,构象,构象分析,构象异构体; 烷基;碳原子和氢原子的分类(即1,2,3碳,氢;4碳);反应机理,活化能.
卤代炷与Mg,Li,Na等的反应:Grignard试剂,有机锂试剂及其应用.
(九)醇,酚,醍
结构,分类,命名
醇的物理性质和光谱性质
氢键对其物理性质的影响;IR光谱和NMR谱的特征.
醇的化学性质
醇的酸性(与其它类型化合物如H2O,酚,孩酸酸性的比较);与酸性有关的反应(与金属如Na,Mg,A]的反应);醇的氧化(形成醛/酮,梭酸);熟悉各种氧化剂;醇的成酯反应:与无机酸成酯, 与有机酸成酯(机理);闵化反应;用S0C12卤化的立体化学及机理;用HX的闵代反应(Lucas试 剂用来区别六个碳原子以H 1,2和3衅);Wagner-Meerwein重排.
(十六)周环反应
在协同反应中轨道对称性守恒
电环化反应的选择规律
电子数基态激发态
4n顺旋对称
4n+2对旋顺旋
环化加成反应的选择规律(同一边)
电子数基态激发态
4n禁阻允许
4n+2允许禁阻
迁移反应的选择规律(同一边)
i+j 4n 4n+2
基态禁阻允许
Cope重排
Claisen重排
(I•七)碳水化合物
单糖的结构与构型
苯的异构,同系物和命名
苯及其同系物的物理性质和波谱性质
主要了解其波谱特征,例如芳香炷的NMR谱学特征,不同取代苯在IR指纹区的特征等.
化学性质
亲电取代反应及机理啊氏反应的特点及局限;氯甲基化反应;Gatterman-Koch反应;芳香环上 取代基的定位效应;其它反应:侧链氧化;侧链取代;芳香环上的还原:催化加氢,Birch还原. 蔡的结构和化学性质
(十九)俩类和备体化合物
%1掌握站类化合物的基本结构:碳骨架由异戊二烯单位组成的;会划分俩类化合物中的异戊 二烯单位.
%1掌握一•些重要的藉类天然产物常规性质:如法尼醇;牛儿酮;桃牛儿奥;山道年;维生素A;叶绿 醇;角鲨烯.■胡萝卜素.
%1了解备体化合物的四环结构和命名.
%1了解俩类和咱体化合物的生物合成
芳香性:苯W塞吩>毗咯>吠喃
离域能(kJ/mol— 1) 150.6,121.3,87.6,66.9
吠喃,嚏吩,毗咯的性质
①亲电取代:卤代,硝化,磺化,乙酰化;②味喃易发生;Diels-Alder反应;③毗咯的弱碱性;④毗喧 的碱性;⑤毗暄的氧化,还原性质;©Fischer□引噪合成法和Skraup喳I琳合成法.
(十二)取代梭酸
卤代酸的反应
%1与碱的反应,产物与卤素和梭基的相对位置有关.
•卤代酸羟基酸
•肉代酸,■不饱和酸
或-卤代酸内酯
%1Darzen反应
诱导效应
共辄效应
醇酸的反应
%1去水,产物与羟基的相对位置有关
-醇酸交酯-醇酸,-不饱和酸-醇酸内酯
%1分解:
乙酰乙酸乙酯在合成上的应用
%1合成甲基酮:
%1合成酮酸
对于基本概念,不是要求记住其定义,而是要求理解它们,应用它们说明问题. 命名
开链烷烧和环烷烧的IUPAC命名,简单的桥环和螺环的命名.
烷姣和环烷炷的结构
碳原了sp3杂化和四面体构型;环烷炷的结构(小环的张力).
烷炷的构象
开链烷炷的构象,能量变化;环烷炷的构象:重点理解环己烷和取代环己烷的构象及能 量变化,稳定构象,十氢荼及其它桥环的稳定构象.
质谱
了解基本原理;儿种重要的开裂方式(包括重要的重排开裂如麦氏重排,逆Diels-Alder重排等); 最重要的是利用MS得出的分子离子峰(并结合其它波谱方法)推测有机分子的结构.
本章最重要的是利用儿种波谱方法结合推测有机分子的结构.
(六)芳香姣
苯的结构和芳香性
理解芳香性的概念和判断芳香性的HUckel规则,能用此规则判断一给定的分子(或离子)是否 是芳香性的.
%1豚的生成:糖与苯肌•作用一一成豚.
(十八)氨基酸,多肽,蛋白质
1.①氨基酸的基木结构
天然的-氨基酸,只有R取代基的差别.
②等电点:等电点时氨基酸以两性离子存在,氨基酸溶解度最小;③氨基酸描三酮的显色的反 应;@Sanger试剂及应用;⑤氨基酸的制备:a..肉代酸的氨解,b.醛和酮与氨,氢氤酸加成物水 解,c.二丙酸酯合成法;⑥多肽的合成方法.
丙二酸酯在合成上的应用
%1合成一元梭酸
%1合成二元舞酸
(十三)胺和含敏化合物
胺的化学性质
%1碱性
%1炷化
%1酰化(Hinsberg反应)
%1与亚硝酸的反应
胺的制法
%1硝基混合物的还原
%1氨或胺的炷化
%1还原炷化
%1Gabriel合成法
%1Hofmann重排:
芳香族重氮盐的反应
%1取代反应
%1还原反应
醛酮的制法
%1慌类氧化
%1醇的氧化及去氢
%1Friedel-Crafts酰化反应
3.,—不饱和醛,酮的反应:
(十一)梭酸及其衍生物
竣酸的反应:
%1酸性:愈酸的酸性比碳酸强,比无机酸弱.
%1梭酸中羟基的取代反应
%1还原
薮酸的制法
%1氧化法
%1水解法
%1Grignard试剂与二氧化碳作用
梭酸衍生物的反应
(七)立体化学
基本概念
对映异构(体);手性分子;镜像;旋光性,旋光度;对映体;北对映体;差向异构体;内消旋体;外消旋 体;手征性;手性中心.
对映异构体构型的表示法
R/S法(次序规则).
熟悉各类手性分子
含1—3个手性碳原子的手性分子;不含手性碳原子的手性分子;环状化合物.
立体异构体的制备和反应
熟悉能产生立体异构体的化学反应及机理,象烯炷与肉素的反式加成,环氧乙烷的开环,蹶基 化合物的加成(Cram规则)等等.
Q■位取代反应:烯丙基型取代反应(高温卤代和NBS卤代)及机理一烯丙基自由基.
(四)快烷和二烯燃
快炷
%1结构:碳的sp杂化和碳-碳三键;sp杂化,sp2杂化和sp3杂化的碳的电负性的差异及相应化 合物的偶极矩.
%1同分异构体
%1化学性质沫端快炷的酸性及相关的反应;三键的加成:催化加氢,亲电加成,亲核加成;碳一 碳三键与H2/Lindlar催化剂反应(顺式烯炷);碳一碳三键与Na/液氨的反应(反式烯炷);加卤素; 加HX(马氏规则);加H20(段基化合物的形成);加HBr/过氧化物;硼须化一氧化;加HCN及乙 焕的二聚;氧化反应:KMnO4氧化和臭氧化.
(八)南代炷
异构,分类,命名
波谱性质,尤其是NMR谱
化学性质
亲核取代反应及机理(SN1,SN2);影响亲核取代及机理的因素;亲核试剂的亲核性;SN2反应的 立体化学;SN1反应中的重排;邻基参与.
