BIO-RAD电转化仪使用教程(自制)
Bio-Rad半干转印系统操作规程(Trans-BlotSD型)

Bio-Rad半干转印系统操作规程(Trans-BlotSD型)
Bio-Rad 半干转印系统操作规程(Trans-Blot SD 型)
□操作规程
n 准备好转印缓冲液(参看说明书,不同样品缓冲配方不同),把凝胶在缓冲中平衡20-60分钟
n 剪好合适尺寸的转印膜,在缓冲中浸5-10分钟
n 剪好合适尺寸的滤纸(2张增厚滤纸或4张厚滤纸或6张薄滤纸)用缓冲液浸湿
n 在阳极平板上根据图中顺序做好转印三明治,注意不能有气泡n 装好阴极平板,合上安全盖
n 接上合适的电泳仪开始转印。
注意电极连接(正对正,负对负),根据不同的蛋白摸索最合适的转印条件。
常规推荐:小胶用10 V 30 minutes 或15 V 15 minutes;大胶用25 V 30 minutes 或15 V 60 minutes;注意大胶不要超过 25 V电压和 3 mA/cm2电流,小胶电流不要超过 5.5 mA/cm2
n 7. 关闭电泳仪,打开安全盖和阴极电极,取出转印膜
注:对于一些用酸性缓冲液的转印,需把凝胶放在膜上,其他同上。
Bio-Rad C1000操作指南

图 4.1 程序编辑界面 4、按 F4(Options)将出现一个 Step Options 的对话框(图 4.2)。在此对话框中可对所选 中的步骤进行温度梯度、升降温速率、TouchDown 等参数的设置。
广州市昊洋贸易有限公司
(86)020-37663997
图 4.2 Step Options 界面 5、按 F1(Insert)可在选中的步骤下增加一个步骤。 6、F3(Delete)删除不需要的步骤。 7、当一个程序被修改或编辑完成后,按 F2(Done)进行保存(图 4.3)。
图 5.2 程序运行界面 在运行界面中 F1—暂停(Pause);F2-取消运行(Cancel Run);F3—跳过该步骤(Skip Step); F4-返回主界面(Main Menu)。可通过以上的键暂定或取消程序的运行。
广州市昊洋贸易有限公司
(86)020-37663997
F1(Log in)
F2(Add New User)
通过数字键输入用户名
通过数字键输入密码(若不设置密码可直接使用 Enter 键确认)
确认 F4(Main Menu)返回主界面。
Enter 键 确 认 Enter 键
2、已有的用户登录:
F1(Log in)
通过巡航键选择用户名
通过数字键输入用户名
认
间
功能键
F1,F2,F3,F4
激活功能键上方的屏幕内显
示的选项内容
数字键
1至9
输入阿拉伯数字或英文字母
0,INCUBATE 程序自动编写热键
插入 0,设定永久温度值,或 启动一个即时性的孵育
启动一个反应程序自动编写 工具
备注 返回主界面,显示程序运行状 况,查看热盖信息
biorad chemidoc mp说明书

biorad chemidoc mp说明书
1、转膜时,1张5.5×8.5cm的PVDF膜以及2张6.5×10cm的滤纸需要被准备,由于膜会受到手上的蛋白的污染,必须要戴手套切滤纸和膜。
在甲醇中浸没切好的PVDF膜超过15秒即可。
2、将浸过的PVDF膜、两张滤纸、两块海绵垫以及转膜用的夹子放置于加有转移液的搪瓷盘里。
3、将夹子打开,在转膜液中放入黑的一面,海绵、滤纸、分离胶、PVDF膜、滤纸、海绵由下往上依次放入。
4、合好夹子,放入转移槽中,使夹的白面对着槽的红面,夹的黑面对槽的黑面,将电接通,电转移时会有热产生。
有较大空隙在槽的一边,降温将事先准备好的冰盒放入。
在一个大的盛满冰的容器中放入整个电泳槽。
美国伯乐电转化仪使用说明

Gene pulser xcell TM Electroporation system quick guide产品名称: Gene Pulser Xcell 电穿孔系统产品型号: Gene Pulser Xcell 电穿孔系统产品展商: 众磊(北京)生物科技发展有限公司驻沪办简单介绍Gene Pulser Xcell 电穿孔系统Gene Pulser Xcell 电穿孔系统的详细介绍【介绍】电穿孔是功能强大的将核酸、蛋白及其它分子导入多种细胞的高效技术。
通过高强度的电场作用,瞬时提高细胞膜的通透性,从而吸收周围介质中的外源分子。
这种技术可以将核苷酸、DNA 与RNA 、蛋白、糖类、染料及病毒颗粒等导入原核和真核细胞内。
电转化相对其它物理和化学转化方法,是一种有价值和有效的替代方法。
Gene Pulser Xcell 系统的设计,基于Bio-Rad 15 年来在电转化技术上经验积累,它提供指数波和方波波型选择、系统配置选择及友好的用户界面。
主要特点指数波和方波波型确保所有细胞类型(原核及真核)均可获得最佳的电转化效果Bio-Rad 专利的* PulseTrac 电路和电弧保护设计,确保可重复性并保护样品模块化设计可根据研究需要选择系统用户友好的数字化界面,具有直观的编程以控制所有参数,包括附属模块的参数包括人工操作、预设规程、用户规程、一个优化规程及其它先进功能等程序选择指数波或方波脉冲选择Gene Pulser Xcell 系统可产生指数波和方波波型,使你选择最适合你细胞的波型与规程。
指数波和方波均能有效地用于电转化及电融合。
电穿孔波型对不同类型细胞的转化效率有很重要的影响。
左,指数衰变脉冲。
当一个充电至电压为V 0 的电容器放电到细胞,加在细胞上的电压随时间以指数方式下降。
从起始电压下降到V0 / e 所需的时间称为为时间常数τ, 一种方便的脉冲时间表达方式。
右,方波脉冲。
放电到样品后截断电容器脉冲可产生方波脉冲。
(完整版)Bio_Rad电泳仪操作规程

Bio—rad小电泳槽及电泳仪操作规程一.目的为规范Bio—rad小电泳槽及电泳仪的基本操作、维护保养、异常处理程序,防止人为操作失误,确保Bio-rad小电泳槽及电泳仪正常运转,特制定本程序。
二.适用范围本程序适用于Bio—rad小电泳槽及电泳仪.三.责任1. 本程序的实施者为Bio-rad小电泳槽及电泳仪操作者,各实验室负责人对本程序的实施情况进行监督。
2. 日常运行及维护、定期维护、定期点检及保养由Bio-rad小电泳槽及电泳仪操作者负责。
四.内容1.灌胶a、取出灌胶模具,打开封底盘至完全开放的状态,松开两侧螺丝,向外侧打开夹子。
b、取长方形和带凹槽的长玻板各一块,从内到外依次按带凹槽玻板及长方形玻板的顺序排列,形成gel sandwich.注意正确排列以防漏胶。
c、短玻板朝外将sandwich放入模具中,检测sandwich的底是否紧靠底面.旋紧螺丝。
将封底盘锁至密闭状态。
d、将模具放在桌面上准备灌胶.e、根据需要配制一定浓度的胶.1、分离胶的灌制:用加样枪慢慢将胶加入sandwich中,注意不要有气泡。
其上加0.1%SDS 封顶。
2、浓缩胶的灌制:待分离胶凝后弃去SDS,开始灌浓缩胶,最后轻轻插入梳子。
f、待胶聚合后,拔出梳子,用电泳缓冲液清洗加样槽,去除未聚合的胶。
g、模具放入电泳槽中。
2.电泳a、加适量的电泳缓冲液b、准备样品,加样。
c、盖上电泳槽的盖子,注意红色对正极,黑色对负极。
打开电源,开始电泳.初始电压100V, 15分钟后改为120v。
d、直至指示剂距前沿1cm处结束电泳,拔掉电源,小心取出胶,根据需要进行染色或转膜,回收电泳缓冲液(可重复利用3次)。
五.注意事项:a、每次用完后,立即清洗电泳槽,灌胶模具,玻璃板(先用自来水洗干净,再用蒸馏水冲一遍后放在架子上晾干)。
b、扣紧或打开灌胶模具时要用力均匀,以免压坏玻璃板。
c、盖上电泳槽的盖子时,务必注意正负极不要接反。
Bio-Rad电泳仪操作规程

Bio-Rad电泳仪操作规程一、实验室准备及前置操作1.确认所需试剂齐全,按照试剂说明书正确配制试剂。
2.准备电泳池:将电泳池放在水平台上,并在池底加入适量的电泳缓冲液,上层电泳缓冲液加入清水至电泳池上部。
3.安装电泳模板:将电泳模板安装于电泳池内,使用扳手或洛氏钳拧紧螺丝未水密。
4.准备样品:将样品于电泳缓冲液中混合均匀,加入电泳模板中的样品槽中,尽量避免气泡。
5.准备DNA标尺:选择合适的DNA标尺,并按照说明书添加至样品中。
二、电泳仪的操作流程1.打开电源:按照电泳仪说明书将电泳仪电源插座插入电源接口,按下电源开关按钮打开电泳仪电源。
2.设置温度:根据实验需要,在电泳仪面板上按照说明书设置电泳仪的工作温度。
3.设置电压和电流:根据实验需要,在电泳仪面板上按照说明书设置电泳仪的电压和电流,通常情况下,实验初期需要较低电流和电压,随后增加直到试样达到最佳分离效果。
4.加载样品:将样品及DNA标尺加入电泳模板,并注意样品槽的填充水平是否均匀,注意避免样品和标尺之间的干扰。
5.开始电泳:确认样品准备和电泳仪设置无误后,按下“开始电泳”按钮启动电泳过程。
6.结束电泳:确定电泳时间到达后,按下“停止电泳”按钮停止电泳过程。
7.处理电泳后试样:将电泳模板取出,使用染色剂染色并传递至显微镜下观察或进行下一步实验步骤。
8.关闭电源:关闭电泳仪电源,拔下电源接口。
三、维护和清洁电泳仪1.频繁检查电泳仪电路板的情况,并用除尘器清洁电泳仪的内部环境,保持电泳仪清洁干净。
2.经常检查电泳仪的液位是否充足、密封是否完好,电泳模板螺钉是否松动等问题,及时维护。
3.定期对电泳仪进行全面的清洁、保养和维修,确保电泳仪的准确性和稳定性。
四、实验注意事项1.电泳缓冲液的pH值要控制在所选用DNA电泳缓冲液的限度内。
2.电泳的时间、电压、电流、电极介质、电泳芯板质量等参数的选择应根据实验目的、样品性质和操作经验等综合考虑。
3.操作时注意安全,不要将电泳仪中的试样触碰到电极、线路和电泳芯板,以免引起放电等事故。
质粒的电击转化

质粒的电击转化
1) 将菌落接种在5 ml的LB培养液中,30℃震荡培养至OD600≈0.8;
2) 将培养液分装在离心管中,12,000 rpm 离心1 min后收集菌体;
3) 加入1 ml冰浴的Milli-Q ddH2O清洗细胞,并重复3次;
4) 加入100 μl的灭菌的Milli-Q ddH2O,悬浮细胞,冰浴15 min;
5) 用灭菌的Milli-Q ddH2O漂洗电击转化杯,晾干后冰浴15 min;
6) 将纯化过的质粒加入新制的感受态细胞中,轻轻混匀后,冰浴2 min;
7) 将预转化物迅速接入预冷的电击杯,并装入电击仪(Bio-Rad Micro pulserTM)后电击,
电击转化条件:电压1.5 kv,电阻300 Ω,电容2.5 μF。
8) 将500μl的LB培养液迅速加入电击杯,充分混匀并转移到新的离心管中,37℃水浴1 h;
9) 吸取50 μl涂布于含有卡那霉素的LB平板上,1~2 d后观察结果;。
BIO-RAD凝胶电泳成像系统的操作方法

BIO-RAD凝胶电泳成像系统的操作方法BIO-RAD凝胶电泳成像系统的操作方法
1.接通电源和照相机电源
2.打开开关,预热30分钟
3.打开软件,文件菜单中gel-doc.xr
4.按live/focus,30s后按autoexpose or manualexpose
5.调iris,zoom ,focus调节图像清晰度,之后按freeze拍照,保存。
BIO-RAD 凝胶成像系统Universal Hood Ⅱ
仪器性能:
拍摄对象:核酸琼脂糖凝胶电泳
X光胶片
软件功能:获取并处理图像
测定图像光密度
操作步骤:
1. 开启成像系统,电脑电源
2. 打开Quality One软件,调整光源所示图像
3. 观察并调整曝光时间,获得图像并保存
4. 调整图像,并对图像进行光密度分析
5. 关闭所有电源。
BIO-RAD MyCycler梯度PCR仪操作规程

潍坊医学院医学研究实验中心仪器简明操作规程汇编
BIO-RAD MyCycler梯度PCR仪操作规程
1、接通电源,启动PCR仪。
2、从左下方的程序库进入,出现一程序界面。
在右侧栏里是随机匹配的程序通用模式,实验者可按照自己的具体需要编辑程序,最后save as 保存为自命名程序,自命名程序出现在程序库界面的左侧。
3、选取自己的程序run,之后出现一个界面提示你定义管内的样本量,按实际填写;再选择是否用hot start。
4、以上全部完成后运行程序。
使用注意事项:
1、此型号PCR仪为96反应模块,用0.2ml平顶管或96孔PCR板;
2、反应模块的温度变化如上图所示;
3、如果在扩增过程中出现突然停电的情况,请立刻向实验室工作人员报告(突发停电情况有损设备);
4.程序中最终的保温温度请设置为12-18 °C,反应结束后尽快将样品取出,以免影响设备半导体的寿命。
BIO-RAD S1000 PCR仪简易操作指南-宝诚logo

S1000 PCR仪简易操作指南一.运行程序1.接通仪器电源,打开仪器开关,仪器自检后,显示主菜单。
2.在PCR管中加入样品,把管子放入仪器中,关上盖子,准备开始实验。
3.检查主菜单中状态是否为Block is idle,选择RUN。
然后选择需要运行的程序,点击ENTER确定选择并继续。
注意:当仪器安装了双48反应模块时,有当两个模块均为闲置状态时,状态信息才显示Blocks are idle。
4.选择运行的程序:点击箭头键选择一个文件夹,然后点击向右箭头键选择此文件夹中的文件。
选择MAIN文件夹可选择预设程序。
点击ENTER确定并继续。
注意:运行中的程序是不能进行编辑的。
程序中的改动将在下一次此程序运行时被应用。
5.选择运行模块(双48模块形式)点击箭头键选择BLOCK A或BLOCK B。
点击ENTER继续。
6.输入样品体积输入1-50微升(使用Calculated mode)或输入0微升(使用Block mode)。
6.选择VIEW键预览运行的程序(可选择操作)点击向右箭头键选择VIEW,点击ENTER确定进行程序预览。
点击ENTER向下翻页来预览程序,在程序最后一步再次点击ENTER返回。
7.选择RUN开始运行。
选择RUN,点击ENTER开始运行。
8.程序运行时的监测(可选操作)程序运行开始后,点击SCREEN键可在下面三个屏幕之间切换。
A.运行屏幕:程序开始运行后,在屏幕的最下面一行将显示运行状态。
点击Screen键可显示Running屏幕。
B.图形屏幕:此屏幕可显示每一步的目标温度。
C.Time Remaining屏幕:此屏幕显示到程序结束的剩余时间。
9.浏览Protocol complete屏幕程序结束后,将显示Protocolcomplete屏幕。
浏览此屏幕后,点击ENTER返回主菜单。
10.浏览LAST RUN屏幕(可选操作)返回主菜单后点击SCREEN键可浏览LAST RUN。
BIO-RAD MYCYCLER PCR 操作步骤

BIO-RAD MyCycler PCR仪操作步骤(一)接通电源,打开开关,如果仪器处于备用状态,可直接按显示屏上的standby键,在通过一个快速自动诊断程序后,初始界面将会出现。
(二)按F2键,初始界面上将会出现选择菜单。
(三)选择“Custom”项,并按Enter键以建立新的运行程序。
如果菜单已有的程序与你需要的程序相近,那么你也可以在选择菜单对已有的模板程序进行编辑。
(四)编辑运行程序(1)仪器默设的运行程序有3个简单的步骤组成。
95℃30秒,55℃30秒,72℃30秒。
你将根据需要按如下步骤更改。
(2)按F4键增加或删除部分步骤,注意竖线把不同的循环周期搁开,正在运行的循环次数在第一次循环的左下脚标出。
(3)采用方向键在不同的步骤之间转换,调定点温度将显示在温度曲线上方。
相反运行时间将显示在温度曲线下方。
循环次数将在每一个循环最后一步的右下角,后跟随“x”符号。
(4)在用方向键选择要更改的温度调定点以及运行时间后,按F3,选择要更改的操作,此时会弹出一个新的界面,在此界面下,可以输入所需的时间或温度。
(5)程序编辑完成后按F5。
(五)在选择菜单中点“Sae Protocol As…”保存编辑程序,以字母与数字组合命名。
然后按Enter键完成操作。
(六)此时初始界面会出现,按F1键进入程序储存库,用箭头键选择你新编辑的程序,随后按Enter键,将会出现一个选择菜单。
选择“Run Protocol”(七)随之出现运行方案界面。
提示是否想热启动(如果你选择“YES”将会进一步提示你所需要的热启动温度),如果你选择“Algorithmic Measurement”,界面上还会让你选择温度标准以及取样容积标准。
(八)按F5开始运行程序。
(九)运行完毕后按Stop键完成操作。
bio电转仪使用手册

bio电转仪使用手册一、简介Bio电转仪是一种用于测量生物电信号的仪器,主要用于医学研究和临床诊断。
本手册将详细介绍Bio电转仪的使用方法、操作步骤和注意事项,以帮助用户正确高效地操作该仪器。
二、仪器结构1. 主机:Bio电转仪的核心部件,包含高精度的信号采集和处理模块。
2. 探头:与被测对象直接接触,采集生物电信号。
3. 连接线:连接主机和探头,传输信号和供电。
4. 显示屏:显示实时测量结果和参数设置。
三、使用方法1. 准备工作在使用Bio电转仪之前,确保如下准备工作已完成:a. 确认仪器和电源正常工作。
b. 清洁探头,并检查是否存在损坏。
c. 将探头正确连接到主机,并确保连接牢固。
d. 检查是否有足够的传输线,以保证正常使用。
e. 打开仪器电源,并待显示屏正常启动后,进入下一步操作。
2. 调整参数a. 使用仪器自带的控制按钮或触摸屏,设置适当的参数。
参数设置包括采样频率、增益、滤波器等。
b. 根据测量对象的特点和需要,选择合适的参数。
如需测量心电图,可选择较高的采样频率和适当的增益。
3. 测量过程a. 将探头正确安放在被测对象的表面,确保电极与皮肤充分接触,同时保持稳定且不产生干扰。
b. 确认所有参数设置正确后,开始测量。
在测量过程中,保持被测对象的舒适和安静,避免产生干扰信号。
c. 实时观察显示屏上的测量结果,并进行记录或保存。
如有异常信号或测量错误,可尝试调整参数或重新测量。
四、注意事项1. 使用过程中,应遵守以下注意事项:a. 避免将仪器及配件放置在潮湿或易受污染的环境中。
b. 操作时需注意安全,避免电击和损伤。
c. 仪器和配件需定期进行清洁和维护,以确保正常使用和延长寿命。
d. 使用前务必阅读并理解本使用手册,并按照要求正确操作。
2. 避免干扰a. 在测量过程中,尽量避免接近大功率电源或其他强电磁源,以免产生干扰信号。
b. 当探头未使用时,可对其进行屏蔽,防止外部干扰。
3. 不当操作及异常情况处理a. 遵循正确的操作流程,避免不当触摸或擅自改变参数设置。
Bio-Rad C1000操作指南

F1(Log in)
F2(Add New User)
通过数字键输入用户名
通过数字键输入密码(若不设置密码可直接使用 Enter 键确认)
确认 F4(Main Menu)返回主界面。
Enter 键 确 认 Enter 键
2、已有的用户登录:
F1(Log in)
通过巡航键选择用户名
通过数字键输入用户名
认
计算的辅助工具中。
图 3.1 自动编写界面 ② 在 Ta 辅助工具中(图 3.2),常用键的 RUN 对应为 A;EDIT 对应为 T;STATUS 对应为 G;
VIEW 对应为 C。可通过常用键来输入引物的碱基序列计算(F2-Calculate)退火温度。 F4(ok)退出。
图 3.2 Ta 计算辅助工具 ③ 若酶选择为 Other,则会在下方出现一个输入框(图 3.3),需要输入该酶的温度梯度范
输入
退火温度
F2(Next)
选择反应模式(Standard 为标准;Fast 为快速;Ultrafast
为超快速;推荐使用标准和快速模式) F2(Next) 输入反应体系大小和程序名称
F2(Done)进行保存(见四),或直接通过常用键的 RUN 进行程序的运行。
Note: ① 激活自动编写工具后 F1 对应为 Ta Calc(图 3.1),此时按下 F1 可进入退火温度(Ta)
图 4.3 程序保存界面 此时 F1 对应 Edit Filename;F2 对应 Save;F3 对应 Create Folder;F4 对应 Main Menu。 在左边的文件库中选中登录用户(USERS)的文件夹,可创建一个新的文件夹或选中一个已有 的文件夹进行保存。
五、运行程序
bio电转仪使用手册

Bio电转仪——让你了解身体电信号的神奇仪器
我们的身体每时每刻都在发出电信号,这些信号通过神经系统传递,控制我们的肌肉运动、心跳、呼吸等生理功能。
而Bio电转仪则是一种能够测量这些电信号的仪器。
Bio电转仪的使用方法非常简单,只需要将电极贴在身体上,就能够测量出身体发出的电信号。
这些电信号可以反映出身体内部的生理状态,比如心跳、呼吸、肌肉运动等。
通过对这些信号的分析,我们可以了解身体的健康状况,及时发现潜在的健康问题。
Bio电转仪的应用范围非常广泛,比如在医疗领域,可以用于诊断心脏病、神经系统疾病等;在运动领域,可以用于监测运动员的身体状态,提高训练效果;在科学研究领域,可以用于研究人体生理学、神经科学等方面的问题。
除了以上应用领域,Bio电转仪还有一些非常有趣的应用。
比如,有些艺术家将Bio 电转仪的测量结果作为音乐的创作素材,创造出了一些非常独特的音乐作品。
还有一些科技公司将Bio电转仪与虚拟现实技术结合起来,开发了一些可以通过身体动作控制虚拟世界的游戏。
Bio电转仪的使用虽然非常简单,但是在使用过程中还是需要注意一些事项。
使用前需要将身体部位清洗干净,以保证电极能够贴紧皮肤;需要注意电极的位置,不同的位置对应不同的测量结果;需要注意仪器的使用方法,避免误操作导致测量结果不准确。
Bio电转仪是一种非常神奇的仪器,它能够让我们了解身体内部的电信号,帮助我们更好地了解身体的健康状况。
无论是在医疗、运动、科学研究还是艺术、科技领域,Bio 电转仪都有着广泛的应用前景。
让我们一起来探索这个神奇的世界吧!。
Bio-rad MicroPulser电穿孔仪中文说明书

MicroPulser电穿孔仪操作手册2018年12月27日1、介绍(1)基本原理MicroPulser电穿孔仪用于细菌、酵母和其他众多微生物的电击转化,转化时,高压电脉冲作用于悬浮在小体积高阻介质中的样品。
本系统由一个脉冲发生器(pulse generator)模块、一个电击腔(shocking chamber)和一个装有电极的电击杯(cuvette)组成。
样本放置于电击杯的电极之间。
MicroPulser模块包含一个电容器,将电容器充电至高电压,然后模块将电容器中的电流放电到试管中的样品中。
MicroPulser的电容放电电路产生具有指数衰减波形的电脉冲,如下图。
当电容器放电至样品时,跨越电极的电压迅速上升至最大电压(or峰值电压,peak voltage;也称为初始电压,Vo),并随时间(t)减小,如下式:其中τ=R·C,为时间常数,是脉冲长度的简便表达式。
R为电路电阻,单位为ohms(欧姆)。
C为电容,单位为microfarad(微法拉)。
根据方程1,τ是电压下降至峰值电压1/e(~37%)的时间。
MicroPulser的内部电路被设计以使E.coli、酿酒酵母及其他许多微生物可以得到最佳电穿孔,最佳转化效率发生在大约5ms的时间常数内。
这些电穿孔条件是通过使用10微法拉电容器和将600欧姆电阻与样品池并联以及将30欧姆电阻与样品池串联来实现的。
除时间常数外,电场强度是另一个决定转化效率的重要参数。
电场强度E,是施加于电极间的电压,公式为:其中,V为施加的电压,d为电极间的距离,单位为cm。
电场强度和细胞的尺寸(size)决定了横贯每个细胞的电压降,正是电压降可能是电穿孔中电压效应的重要表现。
30欧姆串联电阻的目的是在发生电弧的情况下保护设备电路。
在正常操作条件下,当样本在高电阻介质中,电阻不会影响施加在样本上的电压。
但是,当样本的电阻较低时,电阻将极大地降低施加在样品上的电压。
bio电转仪使用手册

bio电转仪使用手册一、简介与概述本手册旨在为您提供bio电转仪的使用方法、操作步骤以及维护保养等方面的详细指导。
电转仪是一种高效、便捷的将生物大分子、细胞等样本转移到靶细胞或试剂上的设备。
通过使用电转仪,您可以实现实验室研究、药物筛选、基因转移等多方面的应用。
在开始使用电转仪之前,请务必仔细阅读本手册,以确保安全、正确地操作设备。
二、操作步骤1.准备工作a.设备开机:将电源线插入电源插座,按下设备开关,待设备启动后进行下一步操作。
b.样本准备:根据实验需求,将待转染的样本(如细胞、质粒、寡核苷酸等)制备好,放入电转杯中。
c.设置参数:根据实验需求,设置电转参数,如电压、电流、时间等。
您可以参考设备说明书或预先设定的参数进行调整。
2.电转过程a.细胞转染:将电转杯放入设备上,按照设定的参数进行电转。
电转过程中,请确保细胞紧密排列,以获得更好的转染效果。
b.质粒转染:将质粒DNA与转染试剂混合后,放入电转杯中,按照设定的参数进行电转。
注意在转染过程中,保持试剂盒的稳定性。
c.其他样品转染:根据样品性质,选择适当的转染方法,如脂质体介导转染、慢病毒转染等,并按照相应步骤进行电转。
3.转染后处理a.清洗设备:实验结束后,及时关闭设备电源,用清水冲洗设备表面,避免残留物影响设备性能。
b.样品收集与检测:根据实验需求,收集转染后的样品,并进行相应检测,如细胞活力、基因表达等。
三、设备维护与保养1.定期检查设备电源线、插头、开关等部件,确保设备正常运行。
2.保持设备工作环境干燥、通风,避免阳光直射。
3.严禁在设备表面放置重物或尖锐物品,以免损坏设备外观。
4.实验过程中,请勿让儿童、宠物接近设备,确保实验安全。
四、安全与注意事项1.操作设备时,请务必佩戴实验室防护用具,如手套、口罩等。
2.遵循实验室安全规程,避免触电、火灾等事故。
3.如有异常情况,请立即关闭设备电源,并及时联系售后服务。
五、故障排除与售后服务1.如遇设备故障,请先检查电源、电缆、插头等是否正常。
Bio-radMicroPulser电穿孔仪(中文)
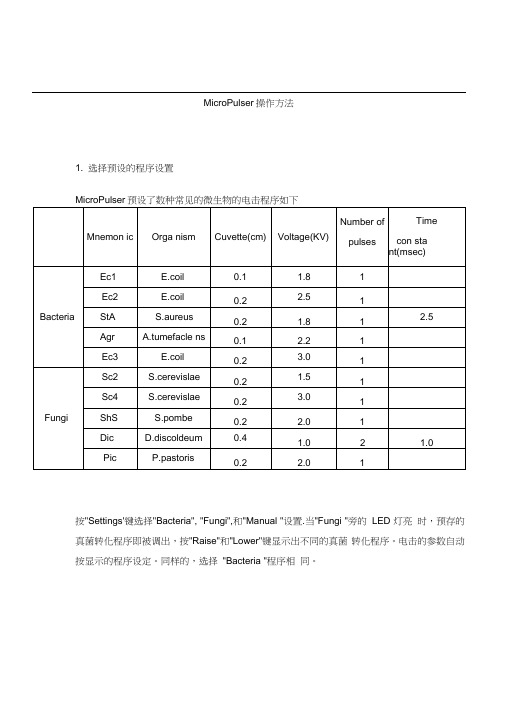
MicroPulser操作方法1. 选择预设的程序设置MicroPulser预设了数种常见的微生物的电击程序如下按"Settings'键选择"Bacteria", "Fungi",和"Manual "设置.当"Fungi "旁的LED 灯亮时,预存的真菌转化程序即被调出,按"Raise"和"Lower"键显示出不同的真菌转化程序。
电击的参数自动按显示的程序设定。
同样的,选择"Bacteria "程序相同。
2. 使用Micropulser 的手动模式A. 改变电压按"Settings" 键,当"Manual". 旁的LED 灯亮时,显示屏显示电压值(单位kV). 按"Raise"和"Lower"键在0.20 kV to 3.00 kV.之间改变电压设置。
如果仪器刚刚打开,显示值为"0.00"B. 截短脉冲.当"Manual".旁的LED灯亮时,同时按"Raise"和"Lower"键LED屏显示“t—” , 表示为脉冲选择了时间。
开机时的默认设置为标准的指数衰减脉冲,衰减过程并不被截短,显示为“一一”。
同时按"Raise"和"Lower"键后只松开"Lower"键,显示数字为截短的脉冲持续时间,单位为毫秒,从 1 毫秒开始以0.1毫秒为增量一直到4毫秒。
限定脉冲时间在1-4毫秒之间。
同时按"Raise"和"Lower"键后只松开"Raise'键,可以调整脉冲时间到更短。
3. 脉冲功能按"Pulse"键到电容充电至设定电压;"PLS"显示在显示屏上。
电转化仪使用方法

电转化仪使用方法嘿,朋友们!今天咱就来讲讲这电转化仪的使用方法。
电转化仪啊,就像是一个神奇的魔法盒子,能帮我们完成一些特别的实验任务呢!想象一下,它就是那个能把普通的东西变得神奇的宝贝。
首先呢,咱得把电转化仪准备好,就像战士上战场前要检查自己的武器一样。
确保它的各个部件都完好无损,没有啥毛病。
这可是关键的第一步哦!然后呢,把要处理的样本啥的准备好。
这就好比做饭,食材得先备好不是?可别马马虎虎的,不然出来的结果可能就不那么理想啦。
接下来,按照操作说明,一步一步来。
别着急,就像走楼梯一样,稳稳当当的。
设置好各项参数,可别设置错啦,不然那不就乱套了嘛。
在操作的过程中,要时刻留意电转化仪的状态。
它要是有啥“小情绪”,咱得赶紧发现呀。
就像照顾小孩子一样,得细心着呢。
你说这电转化仪是不是挺有意思的?它能帮我们在实验里探索好多未知的东西。
但咱可不能小瞧它哦,得认真对待它。
使用电转化仪的时候,还得注意安全。
这可不是开玩笑的,电这东西可得小心点。
就好像过马路要左右看一样,不能马虎。
还有啊,用完了电转化仪,也得好好收拾收拾。
把它擦干净,放好,就像我们每天睡觉前要把自己的床铺好一样。
总之呢,电转化仪是个很重要的实验工具,咱得学会正确使用它。
这样才能让它发挥出最大的作用呀!大家可都要记住这些要点哦,别到时候手忙脚乱的。
相信大家都能很好地驾驭这个神奇的小盒子,让我们的实验更顺利,更成功!怎么样,是不是对电转化仪的使用方法更清楚啦?那就赶紧去试试吧!。
Bio-Rad成像系统使用操作

Bio-Rad成像系统使用规程1.1 打开电源:
打开机身背部左下方机身电源开关(左),后打开CCD电源开关(右);
1.2 放入凝胶、调节位置
打开抽屉放入琼脂糖凝胶(左)或SDS-PAGE凝胶或PVDF膜(右)
打开Quantity One软件,点击“File”选择“ChemiDoc XRS”,按下“Select”键,选择“White EPI”,按下Live Focus按钮,勾选“Light on”,调节凝胶位置居于视野中央。
1.3 曝光
选择光源:
点击Iris、Zoom、Focus调节图像大小和最佳曝光参数
点击曝光按钮选项获得图像;
1.4 点击“File”中的“save”保存文件;
1.5 用完后关闭电源和清洁凝胶载物台;
●不准使用化学发光凝胶成像仪做切胶回收;
●使用前预热30min;
●使用完毕后请关闭电源和清洁凝胶载物台;。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
BIO-RAD Gene Pulser Xcell Electroporation SystemBIO-RAD电转化仪使用教程(自制)cexoihtydx 20110902一电转仪示意图Figure 1 connecting the shockpad to the Gene Pulser Xcell main unit.Figure 2 Shockpod with cuvette.Figure 3 Gene Pulser Xcell front panel.二电转仪主界面在主界面中,我们经常会用到:4. Pre-set protocols和5. User protocolsPre-set protocols(预置方案)中,有Bacterial,Fungal和Mammalian三种预置方案。
下面简单介绍一下Bacterial中E. coli和Fungal中Pichia pastoris的电转化方案和注意事项。
三Electroporation of Bacterial Cells (E. coli)1 制备电转化感受态细胞1). Inoculate 5 ml of a fresh overnight E. coli culture into 500 ml of L-broth ina 2.8 L Fernbach flask.2). Grow the cells at 37°C shaking at 300 rpm to an OD600 of approximately 0.5–0.7. The best resultsare obtained with cells that are harvested at early- to mid-log phase; the appropriate cell densitydepends on the strain and growth conditions but should be about 4–5 x 107cells/ml.3). Chill the cells on ice for ~20 min. For all subsequent steps, keep the cells as close to 0°C as possi-ble (in an ice/water bath) and chill all containers in ice before adding cells. Transfer the cells to asterile, cold 500 ml centrifuge bottle and centrifuge at 4000 xg for 15 minutes at 4°C.4). Carefully pour off and discard the supernatant. It is better to sacrifice yield by pouring off a fewcells than to leave any supernatant behind.5). Gently resuspend the pellet in 500 ml of ice-cold 10% glycerol. Centrifuge at 4000 xg for 15 minutes at 4°C; carefully pour off and discard the supernatant.6). Resuspend the pellet in 250 ml of ice-cold 10% glycerol. Centrifuge at 4000 xg for 15 minutesat4°C; carefully pour off and discard the supernatant.7). Resuspend the pellet in ~20 ml of ice-cold 10% glycerol. Transfer to a 30 ml sterile Oakridge tube.Centrifuge at 4000 xg for 15 minutes at 4°C; carefully pour off and discard the supernatant.8). Resuspend the cell pellet in a final volume of 1–2 ml of ice-cold 10% glycerol. The cell concentration should be about 1–3 x 1010cells/ml.9). This suspension may be frozen in aliquots on dry ice and stored at -70°C. The cells are stable forat least 6 months under these conditions.2 电转化转化参数:Pre-set protocols (E. coli)V oltage(V) 1800Capacitance(µF) 25Resistance(ohm) 200Cuvette(mm) 11). Thaw the cells on ice. For each sample to be electroporated: place a 1.5 ml microfuge tube onice, place either a 0.1 or 0.2 cm electroporation cuvette on ice, and place a 17 x 100 mm tubewith 1 ml of SOC at room temperature.2). To a cold, 1.5 ml polypropylene microfuge tube, add 20 µl of cell suspension if electroporating in 0.1 cmcuvettes, or 20–40 µl of cell suspension if electroporating in 0.2 cm cuvettes. Add 1 to 2 µlof DNA(DNA should be in a low ionic strength buffer such as water or TE). Mix well and incubateon ice for ~1 minute. (Note: it is best to mix the plasmids and cells in a microfuge tube since the narrow gap ofthe cuvettes prevents uniform mixing.)3). From the Home screen on Gene Pulser Xcell open the Pre-set Protocols screen, then the BacterialProtocol screen (press 4, then Enter twice). When using the 0.1 cm cuvettes, press Enter to open E. coli, 1mm cuvette Protocol Detail screen. When using the 0.2 cm cuvettes, press 2 then Enter, or 3 then Enter, to select the Protocol Detail screens for E. coli to pulse at 2.5 or 3.0 kV, respectively.4). Transfer the mixture of cells and DNA to a cold electroporation cuvette and tap the suspension to the bottom. Place the cuvette in the ShockPod. Push the chamber lid down to close.5). Pulse once.6). Remove the cuvette from the chamber and immediately add 1 ml of SOC medium to the cuvette.Quickly but gently resuspend the cells with a Pasteur pipette. (The period between applying the pulse and transferring the cells to out growth medium is crucial for recovering E. coli transformants (Dower et al., 1988). Delaying this transfer by even 1 minute causes a 3-fold drop in transformation.This decline continues to a 20-fold drop by 10 minutes.)7). Transfer the cell suspension to a 17 x 100 mm polypropylene tube and incubate at 37°C for 1 hour,shaking at 225 rpm.8). Check and record the pulse parameters. The time constant should be close to 5 milliseconds. Thefield strength can be calculated as actual volts (kV) / cuvette gap (cm).9). Plate on LB plates with antibiotic.3 溶液和试剂1). L-Broth: 10 g Tryptone peptone, 5 g Yeast extract, 5 g NaCl; dissolve in 1.0 L water.Autoclave.2). LB agar plates with selective antibiotic: prepare L broth as above, adding 15g of agar perliter. Autoclave. Cool to 55–60°C and add antibiotic. Pour 12–15 ml per 100 mm plate.3). 10% (v/v) Glycerol: 12.6 g glycerol (density = 1.26 g/cc) in 90 ml of water. Autoclave or filtersterilize.4). TE: 10 mM Tris-HCl pH 8.0, 1 mM EDTA.5). SOB: 2.0 g Tryptone peptone, 0.5 g Yeast extract, 0.2 ml 5 M NaCl, 0.25 ml 1 M KCl; dissolvein 90 ml water. Adjust pH to 7.0. Bring volume to 100 ml. Autoclave. Add 1.0 ml sterile 1 M MgCl2and 1.0 ml sterile 1 M MgSO4.6). SOC: to 100 ml SOB, add 2.0 ml sterile 1 M glucose (sterilize by filtration).4 注意事项1). 细菌电转化电压一般默认为1.8 KV即可,某些细菌可能会需要更高的电压,可以参考电转化仪器厂商的相关资料以及文献报道。
