01热力学基本概念资料
工程热力学-01 基本概念及定义

平衡状态1
p1 v1
p
p2
2
压容图 p-v图
平衡状态2
p1
1
p2 v2
O
v2
v1
v
12
1-4 状态方程式
在平衡状态下,由气态物质组成的系统,只要知道两个独立的 状态参数,系统的状态就完全确定,即所有的状态参数的数值随之 确定。这说明状态参数间存在某种确定的函数关系,状态参数之间 存在着确定的函数关系,这种函数关系就称为热力学函数。
(2)当系统处于热力学平衡状态时,只要没有外界的影响, 系统的状态就不会发生变化。
(3)整个系统可用一组具有确定数值的温度、压力及其他参
? 数来描述其状态。
10
经验表明,确定热力学系统所处平衡状态所需的独立状 态参数的数目,就等于系统和外界间进行能量传递方式的数 目。对于工程上常见的气态物质组成的系统,系统和外界间传递 的能量只限于热量和系统容积变化所作的功两种形式,因此只需 要两个独立的状态参数即可描述一个平衡状态。
3、平衡状态、稳定状态、均匀状态
(1)关于稳定状态与平衡状态
稳定状态时,状态参数虽不随时间改 变,但它是依靠外界影响来维持的。而平 衡状态是不受外界影响时,参数不随时间 变化的状态。
85℃ 20℃
90℃
15℃
铜棒
平衡必稳定,稳定未必平衡。
(2)关于均匀状态与平衡 水
质统称为外界。 通常选取工质作为热力学系统,把高温热源、低温热源
等其他物体取作外界。
3、边界 ——热力学系统和外界之间的分界面称为边界。
边界可以是固定的,也可以是移动的; 边界可以是实际的,也可以是假想的。
3
二、热力学系统的分类 依据——有无物质或能量的交换
热力学基本概念

热力学基本概念热力学是一门研究能量转化和相互转换的科学,它关注热量、能量和功的关系,以及物质在温度、压强和体积等条件下的相互作用。
在热力学中,有一些基本概念是我们必须了解和掌握的,本文将对热力学中的基本概念进行探讨。
1. 系统和环境在热力学中,我们将研究对象称为系统,而系统外部的一切都被称为环境。
系统可以是一个物体、一个化学反应器或者一个能量转换设备等等。
而环境则包括与系统相互作用的外部介质、周围的物体以及能与系统交换热量和做功的一切。
2. 状态函数和过程函数热力学的基本概念之一是状态函数与过程函数。
状态函数是系统的某一物理量,它只与系统的初始和末状态有关,与经历的过程无关。
例如温度、压强、体积、内能等都属于状态函数。
而过程函数则与系统经历的过程有关,例如热量、功等。
3. 热平衡与热力学平衡热平衡是指当两个物体接触时,它们之间没有净热量的传递。
在热平衡状态下,物体之间的温度是相等的。
而热力学平衡是指系统内部的各个部分之间达到平衡状态,它要求系统的各种宏观性质保持不变。
4. 等温过程与绝热过程等温过程是指系统与环境之间进行热交换的过程,过程中系统的温度保持不变。
绝热过程则是指系统与环境之间没有能量传递的过程,系统内部的能量不发生改变。
5. 内能和焓内能是指系统中分子和原子的热运动能量总和,它是一个状态函数。
焓是系统的内能与系统对外做的功之和,它是一个状态函数。
内能和焓在热力学中是非常重要的概念,它们描述了系统的能量转化和传递。
6. 熵和热力学第二定律熵是一个用来描述系统无序程度的物理量,它是表示分子混乱程度的度量。
热力学第二定律是关于熵变的定律,它表明一个孤立系统的熵只能增加或保持不变,而不能减小。
7. 等压、等体和等焓过程等压过程是指系统在恒定压力下发生的过程。
等体过程是指系统的体积保持不变的过程。
而等焓过程是指系统的焓保持不变的过程。
这些过程在热力学中有着重要的应用和意义。
8. 热容和热力学第一定律热容是指单位质量物质温度上升1度所需要的热量。
热力学基本概念解析

热力学基本概念解析热力学是研究物质热现象和能量转化的科学,它涉及到我们生活中许多方面,比如能源利用、环境保护和工业生产等。
本文将对热力学的基本概念进行解析,以帮助读者更好地理解和应用这一学科。
一、热力学基本概念1. 热量:热量是热力学中最基本的概念之一。
简单地说,热量是物体内部分子之间传递的能量。
在热力学中,热量的单位通常用焦耳(J)来表示。
当物体受热时,其内部的分子会发生运动,从而使得物体的温度升高。
2. 温度:温度是用来衡量物体热状况的物理量。
它表示了物体内部分子的平均动能。
在国际单位制中,温度的单位是开尔文(K)。
在热力学中,温度可以通过测量物体的热胀冷缩、压力或者其他物理现象来确定。
3. 热平衡:当两个物体之间没有能量交换时,它们处于热平衡状态。
在这种状态下,两个物体的温度相同。
当两个物体达到热平衡后,它们的热量交换将停止。
4. 热力学系统:热力学系统是指由物质和能量组成的系统。
根据系统与周围环境之间能量和物质的交换,热力学系统可以分为开放系统、封闭系统和孤立系统三种类型。
开放系统与周围环境能够进行物质和能量的交换,封闭系统只能进行能量的交换,而孤立系统则不能与外界交换任何物质和能量。
5. 状态函数:状态函数是指只与系统的初始状态和末状态有关的物理量。
在热力学中,温度、压力和体积等都是状态函数。
相反,热量和功是路径函数,它们的值取决于系统所经历的路径。
二、热力学基本定律热力学基本定律是热力学体系的基础,它们描述了物体之间能量转化的规律。
1. 第一定律:能量守恒定律,也称为热力学能量守恒定律。
根据这一定律,能量不能被创造或者销毁,只能从一种形式转化为另一种形式。
在热系统中,能量转化包括热传递和功的作用。
2. 第二定律:热力学第二定律主要表述了热量只能从高温物体传递到低温物体的方向。
即热量不会自发地从低温物体传递到高温物体。
这一定律还引申出了熵的概念,熵反映了系统的混乱程度,系统趋于混乱的方向是不可逆的。
热力学基础知识

热力学基础知识热力学是一门研究能量转化与传递的学科,是自然科学的基础。
热力学的概念源于研究热与功之间的相互转化关系,以及能量在物质之间的传递过程。
本文将通过介绍热力学的基本概念、热力学定律和热力学过程,帮助读者了解热力学的基础知识。
1. 热力学的基本概念热力学研究的对象是宏观体系,即指由大量微观粒子组成的物质系统。
热力学通过对体系的宏观性质进行观察和测量,来揭示物质和能量之间的关系。
热力学的基本概念包括系统、热、功、状态函数等。
系统是热力学研究的对象,可以是孤立系统、封闭系统或开放系统。
孤立系统与外界不进行物质和能量交换,封闭系统与外界可以进行能量交换但不进行物质交换,开放系统则可以进行物质和能量的交换。
热是能量的一种传递方式,是由高温物体向低温物体传递的能量。
热的传递方式有导热、对流和辐射。
功是对系统做的物质微观粒子在宏观层面的效果,是由于力的作用而引起物体位移的过程中所做的功。
例如,当一个物体被推动时,根据物体受力和运动方向的关系,可以计算出所做的功。
状态函数是由系统的状态决定的宏观性质,不依赖于热力学过程的路径,只与初态和终态有关。
常见的状态函数有温度、压力、体积等。
2. 热力学定律热力学定律是热力学基础知识的核心内容,揭示了宏观物质之间相互作用的规律。
第一定律:能量守恒定律,能量既不能被创造,也不能被消灭,只能从一种形式转化为另一种形式。
热力学第一定律表达了能量的守恒关系,即系统的内能变化等于吸收的热量与做的功的差。
第二定律:热力学第二定律描述了自然界的能量传递过程中不可逆的方向。
它说明热量会自发地从高温物体传递到低温物体,而不会反向传递。
热力学第二定律还提出了热力学箭头的概念,即自然界中某些过程的方向是不可逆的。
第三定律:热力学第三定律说明在绝对零度(0K)下,熵(系统的无序程度)将趋于最低值。
此定律进一步阐述了热力学中的温标和熵的概念。
3. 热力学过程热力学过程描述了系统由一个状态转变为另一个状态的过程。
热力学基本概念

热力学基本概念热力学是研究热能与其他形式能量之间转化和传递规律的科学学科。
它涉及到一系列基本概念和定律,这些概念和定律是理解和应用热力学的基础。
本文将介绍热力学中的几个基本概念,包括热、温度、功、热容和熵。
一、热热是一种能量传递方式,当物体与外界存在温度差时,热就会从高温物体传递到低温物体。
热是热力学系统与外界之间的能量交换形式之一。
热的单位是焦耳(J)。
二、温度温度是表征物体热状态的物理量,它反映了物体中分子的平均热运动程度。
温度用开尔文(K)作为单位,也可以使用摄氏度(℃)或华氏度(℉)进行表示。
热力学中的零绝对温标是绝对零度,对应着开尔文的0K。
三、功功是热力学系统与外界相互作用过程中的能量传递形式之一。
当一个物体受到外力作用,同时沿着力的方向发生位移时,就会进行功的交换。
功的单位也是焦耳(J)。
四、热容热容描述了物体受热后温度变化的程度。
它是指单位质量物体温度升高1K(或1℃)所需要吸收或放出的热量。
热容的单位可以是焦耳/开尔文(J/K)、焦耳/摄氏度(J/℃)或卡路里/开尔文(cal/K)。
五、熵熵是用来描述系统无序程度的物理量。
它是热力学第二定律的核心概念,表示系统的混乱程度或无序程度。
熵的增加代表着系统趋于混乱,反之则代表着系统趋于有序。
熵的单位是焦耳/开尔文(J/K)。
在热力学中,这些基本概念相互联系、相互影响,通过热力学定律加以描述和解释。
例如,热力学第一定律表示能量守恒,即能量可以从一种形式转化为另一种形式,但总能量的数量保持不变。
热力学第二定律则说明了在孤立系统中热流只会从高温物体流向低温物体,并且系统的熵将不断增加。
通过对这些基本概念的理解和应用,我们可以更好地理解和研究能量的转化和传递过程。
热力学在能源、化学、物理等领域都有广泛的应用,并对相关工程和技术的发展起到了重要的推动作用。
总结起来,热力学基本概念包括热、温度、功、热容和熵。
这些概念相互联系、相互作用,通过热力学定律来描述和解释。
热力学基本知识

c12
)
m g( z2
z1) U
W Ws p2V2 p1V1 Ws ( pV )
Q W
1 2
m( c22
c12
)
m g( z2
z1)
U
1
Q U ( pV ) mc 2 mgz W
2
s
1
Q H mc2 mgz W
2
s
1
q h c 2 gz w
2
s
上式就是稳定流动能量方程
H—焓,h—质量焓或比焓 h u pv
焓也是状态参数,单位与热力学能一样
第三节 热力学第二定律
一、熵、自然过程的方向性 热力学第一定律表明:能量之间可以相互转换,以
及转换过程中的数量关系,而没有指明此种能量与他 种能量相互转化的差异。
状态参数熵给出了自然过程方向性的定量描述。
dS dQ T
熵就是在可逆的条件下,传入系统的微元热量dQ与 热源温度T的比值。理论证明了熵确实是一个状态参 数,单位质量熵〔符号s)的单位是kJ/(kg·K)。
q
h
1 2
c 2
gz
ws
h 0 h1 h2
➢注意:节流过程不是等焓过程
节流后,压力和温度下降,熵增大,做功能力 降低。(导致能量损失)
第三节 蒸汽动力装置及循环 蒸汽动力装置是以蒸汽作为工质的热动力装置。 火电厂热力循环(以过热蒸汽为工质) 锅炉、汽轮机、冷凝器、水泵是循环的主要设备。
热源
3-4:水在给水泵中的可逆 绝热压缩过程;
4-5-6-1:水与水蒸气在锅炉 中的可逆定压加热过程;
1-2 : 水 蒸 气 在 汽 轮 机 中 的 可逆绝热膨胀过程; 2-3 : 乏 汽 在 冷 凝 器 中 的 定 压放热过程。
热力学热力学

热力学热力学热力学热力学是研究能量转化与传递规律的学科,是物理学中的重要分支。
它探讨了物质的热现象、能量的转化和守恒、热力学系统的性质以及热平衡与热非平衡态之间的关系。
本文将介绍热力学的基本概念、热力学第一定律和第二定律等内容。
一、热力学的基本概念热力学的基本概念主要包括系统、热平衡、温度和内能等。
在热力学中,系统是指研究对象,可以是一个物体、一个容器或者一组物质。
系统与外界之间可以有能量和物质的交换。
当系统处于热平衡状态时,其温度是均匀的,各部分之间不存在温度差异。
温度是物质分子平均动能的度量,通常用开尔文(K)作为单位。
内能是系统内各部分的微观粒子热动能之和,它是系统宏观性质的一个重要参数。
二、热力学第一定律热力学第一定律是能量守恒原理在热力学中的表现。
根据热力学第一定律,系统的能量可以从其他形式转化为热能或做功,也可以从热能转化为其他形式或做功。
换句话说,系统的内能改变等于热量和做功的代数和。
其中,热量是由于温度差而传递给系统或系统释放出去的能量,而做功是系统通过外界物体的移动或变形而产生的能量。
三、热力学第二定律热力学第二定律是指在孤立系统中,热量不能自发地从低温物体传递到高温物体。
换句话说,自然界中热量只能从高温物体向低温物体传递,而不能相反。
根据热力学第二定律还可以引出熵增定律,即孤立系统的熵总是增加的。
熵是描述系统混乱程度的物理量,熵增可以理解为整个系统的无序性增加。
四、热力学的应用热力学在科学和工程领域有广泛的应用。
在能源领域,热力学可以用来优化能量转换过程,提高能源利用效率。
在化学反应中,热力学可以指导实验设计和反应条件的选择。
在工程领域,热力学可以用于设计制冷、发电和汽车引擎等系统。
热力学还对气候变化、环境保护等问题的研究有着重要的意义。
综上所述,热力学是研究能量转化和传递规律的学科,涉及到的概念包括系统、热平衡、温度和内能等。
热力学第一定律表达了能量守恒原理,而热力学第二定律揭示了自然界中热量传递的规律。
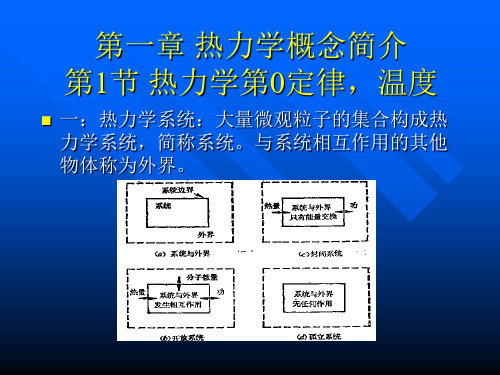
第1章 热力学基本概念

第一章热力学的基本概念1.1 热力系及其描述 (1)1.1.1 热力系 (1)1.1.2 热力系的状态、平衡状态及状态参数 (2)1.1.3 状态参数的特性 (3)1.2 基本状态参数 (4)1.2.1 密度及比体积 (4)1.2.2 压力 (4)1.2.3 温度及热力学第零定律 (7)1.3 状态方程式,状态参数坐标图 (12)1.3.1 状态公理 (12)1.3.2 纯物质的状态方程式 (12)1.3.3 状态参数坐标图 (13)1.4 热力过程及热力循环 (14)1.4.1 准平衡过程 (14)1.4.2 热力循环 (16)思考题及答案 (19)1.1 热力系及其描述1.1.1 热力系在对一个现象或—个过程进行分析时为了确定研究的对象,规划出研究的范围,常从若干物体中取出需要研究的部分.这种被取出的部分叫做热力学系统,简称热力系。
热力系以外的物质世界统称为外界(或环境)。
热力系与外界的分界面叫做界面(或边界)。
所谓热力系,即是由界面包围着的作为研究对象的物体的总和。
热力系与外界之间的界面可以是真实的,也可以是假拟的,可以是固定的,也可以是运动的。
在一般情况下,热力系与外界处于相互作用中,彼此可交换能量(如热量及各种形式的功)及物质。
按热力系与外界进行物质交换的情况可将热力系分类为:闭口系(或闭系)——热力系与外界无物质交换,或者说没有物质穿过边界。
此时.热力系内部的质量将保持不变,称为控制质量(C.M.),故闭口系即是我们所研究的某“控制质量”。
开口系(或开系)——热力系与外界之间有物质交换,或者说有物质穿过边界。
这种热力系内部的质量可以是变化的。
这时,我们可以把研究的对象规划在一定的空间范围内,这种空间范围叫作控制容积(C.V.),或称控制体,故开口系即是我们所研究的某“控制体”。
相应地,控制质量或控制容积与外界的分界面也可称为控制面。
按热力系与外界进行能量交换的情况常将热力系分类为:简单热力系——热力系与外界只交换热量及一种形式的准静功(准静功的概念将在2-2节中讨论);绝热系——热力系与外界无热交换;孤立系——热力系与外界既无能量交换又无物质交换。
第1章 热力学概念简介课件培训
经验上说,B与C具有了相同的温度,或,是温度达 到了平衡。
概念:温度 T=T(X,Y) ——对于简单系统。
温标:对温度的定量描述,热力学中常用的有两种温标: 开耳文温标(又叫绝对热力学温标)和理想气体温标。
三:状态方程:
气体在平衡态时,可由气体的状态参量描述。温度可以写 成函数T=T(X,Y),或者f(X,Y,T)=0 —— 称为状态方程。
dQ dT P
定容热容量:
cV
lim Q T 0 T V
dQ dT V
等容过程中:dV=0,则 dU V dQV
cV
dQ dT V
U T V
对于磁介质系统: 定磁场热容量:
定磁矩热容量:
cH
lim Q T 0 T H
dQ dT H
cM
lim Q T 0 T M
1 V
V T P
1 V
V P T
dV dT dP
V
两边积分,即为要证明的等式。
若 1 1
T
P
ln V ln T ln P c0
ln PV T
c0
得到状态方程为:PV
c0 'T
(理想气体)
第5节 麦克斯韦关系及其应用
本节介绍麦克斯韦关系,并且讨论TdS方程和内能方程。
解:理想气体状态方程:PV=nRT
V nRT P
P nRT V
V nR T P P P nR T V V
等温条件下,dT=0,则VdP+PdV=0
V V P T P
1 V 1 nR 1 V T P V P T
1 P nR 1 P T V PV T
热力学基本概念知识点总结

热力学基本概念知识点总结热力学是研究能量转化和能量传递规律的学科,它涉及到许多基本概念。
本文将对热力学中的一些基本概念进行总结和解析。
一、热力学系统和环境热力学系统指的是我们研究的对象,可以是一个物体、一个化学反应体系等。
而环境则是指与系统不相干的一切物体和能量。
系统和环境之间可以通过能量和质量的交换进行相互作用。
二、热和功热是指能量的传递方式,是由于温度差导致的能量交换。
而功则是指通过外界对系统施加的作用力所做的功。
在热力学中,热和功都是能量的表现形式,它们可以相互转化。
三、热力学第一定律热力学第一定律是能量守恒定律在热力学中的表述。
它指出,能量既不能被创造也不能被毁灭,只能在系统和环境之间进行转化。
系统所吸收的热量和所做的功等于系统所增加的内能。
四、热力学第二定律热力学第二定律是描述能量转化方向的定律,也被称为热力学不可逆性原理。
它指出,在孤立系统中,热能永远不能自发地从低温物体传递到高温物体,总是从高温物体向低温物体传递。
这是因为热能的传递总是伴随着有序度的降低。
五、熵熵是用来描述系统无序程度的物理量,也是热力学第二定律的量度。
熵的增加代表着系统的无序度增加,而熵的减少则代表着有序度的增加。
在自然界中,熵总是趋向于增加,这是热力学第二定律的基本表现。
六、温度和热力学温标温度是用来描述物体热平衡状态的物理量,它代表了物体内部粒子热运动的程度。
在热力学中,常用的温标是开尔文温标(K)。
开尔文温标与摄氏温标之间的换算关系是:K = °C + 273.15。
七、压力和热力学压强压力是指物体单位面积上受到的力的大小,它是由物体内部分子的碰撞引起的。
而热力学压强则是指单位面积上受到的压力大小。
在热力学中,常用的压力单位是帕斯卡(Pa),1 Pa = 1 N/m²。
八、状态方程状态方程是描述物体状态的数学关系式,它连接了物体的各个状态参量,如压力、温度、体积等。
热力学中最著名的状态方程是理想气体状态方程,即PV = nRT。
工程热力学知识点笔记总结

工程热力学知识点笔记总结第一章热力学基本概念1.1 热力学的基本概念热力学是研究能量与物质的转化关系的科学,它关注热与功的转化、能量的传递和系统的状态变化。
热力学中最基本的概念包括系统、热力学量、状态量、过程、功和热等。
1.2 热力学量热力学量是描述系统的性质和状态的物理量,包括内能、焓、熵、自由能等。
内能是系统的总能量,焓是系统在恒压条件下的能量,熵是系统的无序程度,自由能是系统进行非体积恒定的过程中能够做功的能量。
1.3 热力学第一定律热力学第一定律是能量守恒的表达形式,在闭合定容系统中,系统的内能变化等于系统所接受的热量减去系统所做的功。
1.4 热力学第二定律热力学第二定律是描述系统不可逆性的定律,它包括开尔文表述和克劳修斯表述。
开尔文表述指出不可能将热量完全转化为功而不引起其他变化,克劳修斯表述指出热量自然只能从高温物体传递到低温物体。
根据第二定律,引入了熵增大原理和卡诺循环。
1.5 热力学第三定律热力学第三定律是指当温度趋于绝对零度时,系统的熵趋于零。
这一定律揭示了绝对零度对热力学过程的重要意义。
第二章热力学系统2.1 定态与非定态定态系统是指系统的性质在长时间内不发生变化,非定态系统是指系统的性质在长时间内发生变化。
2.2 开放系统与闭合系统开放系统是指与外界交换物质和能量的系统,闭合系统是指与外界不交换物质但可以交换能量的系统。
2.3 热力学平衡热力学平衡是指系统内各部分之间的温度、压力、化学势等性质达到一致的状态。
系统处于热力学平衡时,不会产生宏观的变化。
第三章热力学过程3.1 等温过程在等温过程中,系统的温度保持不变,内能的变化全部转化为热量输给外界。
3.2 绝热过程在绝热过程中,系统不与外界交换热量,内能的变化全部转化为对外界所做的功。
3.3 等容过程在等容过程中,系统的体积保持不变,内能的变化全部转化为热量。
3.4 等压过程在等压过程中,系统的压强保持不变,内能的变化转化为对外界所做的功和系统所吸收的热量。
热力学知识:热力学中的热力学知识和热力学体系

热力学知识:热力学中的热力学知识和热力学体系热力学是一门探究热、功和物质变化的科学,它广泛应用于化学、物理等多个领域。
了解热力学知识以及如何应用热力学体系是学习这门科学的必要前提。
本文将对热力学知识和热力学体系进行介绍和阐述。
一、热力学知识1.热力学基础概念系统:热力学中所研究的任何物质量,都称为系统。
界面:系统中不同物质之间的分界面称为界面。
状态量:系统状态的独立参数称为状态量。
基本状态量:温度T、压强P、体积V等。
状态函数:状态量的函数称为状态函数。
定常过程:系统参数不随时间而变化的过程称为定常过程。
2.热力学定律第一定律(能量守恒定律):对于一个孤立系统,系统的内能变化等于热和功的代数和。
第二定律(熵增定律):系统在自发过程中,熵是增加的。
第三定律(绝对零度定律):在温度绝对为零时,所有的物质具有相同的熵。
3.热力学过程等温过程:系统在恒定温度下进行的过程。
等压过程:系统在恒定压力下进行的过程。
等体过程:系统在恒定体积下进行的过程。
绝热过程:系统在无热交换的情况下进行的过程。
4.热力学函数内能:系统所含能量的总和。
焓:系统在恒压下所含能量的总和。
自由能:系统在恒温恒压下进行的过程中,系统产生的功所能达到的最大值。
5.常见的热力学循环卡诺循环:热源、冷源、活塞、活塞运动是构成卡诺循环的四个重要组成部分。
布里雪循环:常用于低温制冷。
斯特林循环:常用于制冷和发电。
以上是热力学知识的介绍,下面将讲解热力学体系。
二、热力学体系热力学体系是指标定一定物质量和标定其状态,进而可以观察和测量的系统,包括孤立系统、开放系统和封闭系统。
不同的体系有不同的物理性质和特征。
1.孤立系统孤立系统是指没有与外界发生任何热、物质和功交换的系统。
这种体系中,内能总是保持不变,在任何一个不可逆过程中,熵都会增加。
孤立系统是一种理想状态,在现实中比较少见。
2.封闭系统封闭系统指物质可以从系统外部流入,也可以从系统内部流出,但系统的能量始终保持不变。
01基本概念及定义热力学2013-文档资料

第一章 基本概念及定义
12
2. 准静态过程 quasi-static state process
过程中系统经历的是一系列平衡状态,并在 每次状态变化时仅是无限小地偏离平衡状态。 实现准静态过程的条件: 系统和外界△→0 大部分实际过程可以近似地当作准静态过程。
在状态参数坐标图上,可用一条过 程曲线定性地表示该准静态过程。
第一章 基本概念及定义
6
3. 温度 Temperature , T ( t )
温度是标志系统冷、热程度的参数。 温度的建立以及测量是以热力学第零定律为基础的。
热力学第零定律(热平衡定律)The Zeroth Law of Thermodynamics : 两个系统分别与第三个系统处于热平衡,则这两个系统彼此也
是衡量可逆过程中工质与外 界是否发生热交换的标志。
在p-v图上: 一点:一个平衡状态 一实线:一个准静态过程
在T-s图上:一点:一个平衡状态 一实线:一个准静态过程
曲线下面积:
可逆过程中系统所 做的容积变化功。
功是过程量
第一章 基本概念及定义
曲线下面积:
可逆过程中系统与 外界所交换热量。
热量是过程量
状态参数坐标图:
应用两个独立状态参数,可组成状态参数坐标图。
ex: P-V, T-s, h-s, p-h
注意:①图上任意一点代表一个平衡状态;
②若系统处于不平衡状态, 则无法在状态参数坐标图上描述。
第一章 基本概念及定义
10
1-4 状态方程式
1. 状态方程式
三个基本状态参数(p、v、T)之间的函数关系。即:
• 功量是过程量,仅存在于过程中,过程 一旦结束,功量这种能量形式就不复存在。
热力学基本概念

热力学基本概念热力学是一门研究能量转化和传递规律的物理学科,它涉及到热、能量和它们的传递过程。
在热力学中,有一些基本概念是我们理解和应用此学科的基础。
本文将介绍热力学的几个基本概念,包括热力学系统、状态量、过程和平衡等。
一、热力学系统热力学系统是研究对象,可以是任何一个系统,从小到微观的分子系统,到大到宏观的天体系统。
系统可以与外界进行热、功和物质的交换。
根据系统与外界之间的交换情况,热力学系统可以分为封闭系统、开放系统和孤立系统。
封闭系统是与外界不进行物质交换,但可以进行热和功交换的系统。
开放系统允许物质的进出,与外界进行热、功和物质的交换。
孤立系统既不进行物质交换,也不进行热和功交换。
二、状态量状态量是描述热力学系统特征的物理量,它们的值只与系统所处的状态有关。
例如,温度、压力、体积、内能和熵等都属于状态量。
温度是一个描述系统热平衡状态的物理量,它与热量的传递方向有关。
压力是描述系统内部分子碰撞对容器壁施加的压力力度。
体积是描述系统占据的空间大小。
内能是系统的总能量,包括宏观和微观的能量。
熵是描述系统的无序程度。
三、过程过程是系统由一个状态转变为另一个状态的变化过程。
根据系统是否与外界有物质和能量的交换,过程可以分为无穷小过程和有限过程。
在无穷小过程中,系统与外界之间的交换量可以忽略不计。
有限过程是指系统与外界之间的交换量无法忽略。
在热力学中,最常见的过程有等温过程、绝热过程和等熵过程等。
等温过程是指系统与外界保持温度不变,在此过程中系统与外界发生热交换。
绝热过程是指系统与外界没有热交换,在此过程中只有功交换。
等熵过程是指系统的熵保持不变,即系统从一个状态转变为另一个状态,且熵不发生改变。
四、平衡平衡是热力学中的一个重要概念,它分为热平衡和力学平衡。
在热平衡状态下,系统内部各部分之间没有温度差异;力学平衡状态下,系统内各部分之间没有压力差异。
热力学平衡是指热平衡和力学平衡同时成立的状态。
在热力学平衡状态下,系统处于最稳定的状态,不发生自发变化。
热力学基础知识

热力学基础知识热力学是物理学的一个分支,研究热现象和热能转化的规律。
在我们生活中,也可以看到许多与热力学有关的现象,比如汽车引擎的工作、空调的制冷、发热体的加热等等。
在接下来的文章中,我们将深入了解一些热力学的基本概念和原理。
一、热力学的基本概念1. 温度和热量温度是描述物体热度的物理量,单位是摄氏度(℃)、开尔文(K)、华氏度(℉)等。
热量是指热能的转移量,单位是焦耳(J)、卡路里(cal)等。
两者的联系可以用下面的公式表示:Q=m×c×ΔT其中,Q表示热量,m表示物体质量,c表示物体的热容量,ΔT表示物体温度变化量。
此外,还有一个重要的物理量叫做热力学摩尔容量,指的是单位量物质在温度变化1K时所吸收的热量,单位是焦/摩尔-开尔文(J/mol-K)。
2. 热力学第一定律热力学第一定律也叫做能量守恒定律,指的是能量不能被创造或毁灭,只能从一种形式转化为另一种形式,并且总能量守恒。
从热观点来看,热量也是一种能量,因此热能也具有守恒性质。
3. 热力学第二定律热力学第二定律是一个非常重要的定律,它规定了热能转化的方向性,即热量只能从高温物体流向低温物体,不可能反向。
这个定律也成为热力学的增熵定律,指的是一个孤立系统的熵(混乱度)只可能增加,而不可能减小。
二、热力学的应用1. 热力学循环热力学循环是指通过对气体或液体的加热或冷却来产生机械功或者热量,再将剩余的热量排放到外界,从而实现能量转化的过程。
熟悉汽车工作原理的人应该都知道,汽车引擎就是一种热力学循环系统,通过燃烧汽油来加热气体,从而产生机械功驱动车轮,同时排放废气。
2. 热力学平衡当物体的温度相同时,此时物体达到了热力学平衡,它们之间的热量不再交换。
但是,这并不意味着温度相同的两个物体一定热力学平衡。
比如,在室内放着一瓶冰水和一只热汤的碗,虽然它们的温度都是20℃,但是它们内部的热量分布不同,因此不能说它们处于热力学平衡状态。
热力学基本概念和公式

第一章热力学基本概念一、基本概念热机:可把热能转化为机械能的机器统称为热力发动机,简称热机。
工质:实现热能与机械能相互转换的媒介物质即称为工质。
热力系统:用界面将所要研究的对象与周围环境分割开来,这种人为分割的研究对象,称为热力系统。
边界:系统与外界得分界面。
外界:边界以外的物体。
开口系统:与外界有物质交换的系统,控制体(控制容积)。
闭口系统:与外界没有物质的交换,控制质量。
绝热系统:与外界没有热量的交换。
孤立系统:与外界没有任何形式的物质和能量的交换的系统。
状态:系统中某瞬间表现的工质热力性质的总状况。
平衡状态:系统在不受外界影响的条件下,如果宏观热力性质不随时间而变,系统内外同时建立热和力的平衡,这时系统的状态就称为热力平衡状态。
状态参数:温度、压力、比容(密度)、内能、熵、焓。
强度性参数:与系统内物质的数量无关,没有可加性。
广延性参数:与系统同内物质的数量有关,具有可加性。
准静态过程:过程进行的非常缓慢,使过程中系统内部被破坏了的平衡有足够的时间恢复到新的平衡态,从而使过程的每一瞬间系统内部的状态都非常接近于平衡状态。
可逆过程:当系统进行正反两个过程后,系统与外界都能完全回复到出示状态。
膨胀功:由于系统容积发生变化(增大或者缩小)而通过系统边界向外界传递的机械功。
(对外做功为正,外界对系统做功为负)。
热量:通过系统边界向外传递的热量。
热力循环:工质从某一初态开始,经历一系列中间过程,最后又回到初始状态。
二、基本公式⎰⎰=-=02112dx x x dx理想气体状态方程式:RT pV m =循环热效率1q w nett =η 制冷系数netw q 2=ε 第二章 热力学第一定律一、基本概念热力学第一定律:能量既不能被创造,也不能被消灭,它只能从一种形式转换成另一种形式,或从一个系统转移到另一个系统,而其总量保持恒定。
热力学能:储存在系统内部的能量(内能、热能) 外储存能:宏观动能和重力位能。
热力学基本概念和原理

热力学基本概念和原理热力学是研究能量转化和能量流动的科学领域。
它关注物质系统的宏观行为,涉及热量、功、温度等因素。
本文将介绍热力学的基本概念和原理,并探讨其在自然界和工程中的应用。
一、热力学的基本概念1. 系统和环境:在热力学中,将所研究的物质部分称为系统,而系统之外的一切称为环境。
系统和环境可以通过能量交换进行相互作用。
2. 平衡态:当系统的所有宏观性质不发生变化或者发生的变化可以忽略不计时,系统处于平衡态。
平衡态可以分为热平衡、力学平衡和相平衡。
3. 定态和循环过程:定态是指系统性质不发生变化,而循环过程则是指系统经历一系列状态变化后回到初始状态。
4. 状态参数:状态参数是用来描述系统状态的物理量,如温度、压力、体积等。
它们与系统在平衡态时的性质有直接的关联。
二、热力学的基本原理1. 热力学第一定律:热力学第一定律,也被称为能量守恒定律,指出能量在系统和环境之间的转化是平衡的。
它表明能量既不能被创造,也不能被消灭,只能从一种形式转化为另一种形式。
数学表达式为:ΔU = Q - W其中,ΔU表示系统内能的变化,Q表示系统吸收的热量,W表示系统对外界做的功。
根据正负号的不同,可以判断能量的流动方向。
2. 热力学第二定律:热力学第二定律描述了能量转化的方向性。
它规定了自然界中存在一个不可逆的趋势,即热量只能从高温物体传递到低温物体,而不能反过来。
这个趋势被称为热力学箭头。
根据热力学第二定律,可以引出熵的概念。
熵是一个度量系统无序程度的物理量,自然界的熵总是趋向于增加。
3. 热力学第三定律:热力学第三定律指出,在温度绝对零度(0K)时,系统的熵为零。
它为研究低温物理学和凝聚态物理学提供了基础。
热力学第三定律的重要性在于,它确定了熵计算的参考点,并为系统热平衡时的温度提供了一个下限。
三、热力学的应用1. 自然界中的应用:热力学在自然界中的应用非常广泛。
例如,它能解释太阳能如何转化为地球上的生物能,并推导出地球表面的温度分布。
热力学基础

汽液平衡,饱和压力、饱和温度
2、定压加热汽化过程
五种状态;
干度;
(1)
(2)
(3)
(4)
(5)
● 饱和状态 (Saturated state) 当汽化速度 = 液化速度时,宏观上气、液两相保持 一定的相对数量,系统处于动态平衡—饱和状态。
◇ 饱和温度,ts (Ts) —饱和状态的温度
◇ 饱和压力,ps— 饱和状态的压力
t=ts
t>ts
干度(dryness)
定义:湿蒸汽中干饱和蒸汽的质量分数,用x表示。
干度x=
湿蒸汽中含干蒸汽的质量 湿蒸汽的总质量
x m汽 m汽 m液
饱和水
x=0
湿饱和蒸汽 0<x<1
干饱和蒸汽 x=1
● 湿度 y=1–x 表示湿蒸汽中饱和水的含量。
第五节 水蒸气
• 预热阶段:未饱和水区
• 气化阶段:饱和水区(湿蒸汽区)
• 准平衡过程 特点:自动恢复;实线示图;
• 可逆过程 特点:准平衡过程+ 无能量耗散; 实际过程均为不可逆过程;
★ 可逆过程熵的变化: 系统吸热 q 0, ds 0 熵增; 系统放热 q 0, ds 0 熵减; 绝热过程 q 0, ds 0 熵不变。
(可逆绝热过程)
可逆绝热过程又称等熵过程。
(表明与实际气体的区别)
(2) 状态方程式:
pv= RgT 2、理想气体的比热
定义:单位物量的工质,温度升高或降低一度所吸收 的热量。
c = (δq/dT)
注意:三种不同单位。
第三节 理想气体
3、定容比热、定压比热:
cv= (∂u/∂T)v = du/dT (理想气体)
热力学知识点

热力学知识点热力学是研究热量和能量转化的物理学科,涉及到能量在热力学系统中的转移和转化过程。
在热力学中,有一些重要的知识点需要我们了解和掌握,下面将逐一介绍这些知识点。
一、热力学基本概念热力学是研究热现象和动力学相互关系的物理学科。
研究的范围包括热平衡、热力学第一定律、热力学第二定律等内容。
1. 热平衡:热平衡是指在热力学系统中,系统内各部分之间没有热传递的过程。
在热平衡状态下,系统内各部分的温度是相等的。
2. 热力学第一定律:热力学第一定律是指能量守恒定律,即能量不会自行消失,也不会自行产生,只能在各种形式之间相互转换。
3. 热力学第二定律:热力学第二定律是指热量不可能自发地从低温物体传递到高温物体,而只有从高温物体传递到低温物体。
二、热力学参数在热力学中,有一些重要的参数需要我们了解,这些参数可以帮助我们描述和分析热力学系统的性质。
1. 温度:温度是物体内部微观粒子热运动的程度,是衡量物体热量高低的物理量。
2. 热量:热量是物体内部由于温度差异而传递的能量,是物体的一种能量形式。
3. 内能:内能是热力学系统内部分子和原子的热运动能量,是系统的一个基本性质。
4. 熵:熵是描述系统无序程度的物理量,是系统能量分布的一种统计性质。
三、热力学循环热力学循环是指在热力学系统中,系统经过一系列的过程后,最终回到初始状态的过程。
常见的热力学循环包括卡诺循环、布雷顿循环等。
1. 卡诺循环:卡诺循环是一个理想的热力学循环过程,由等温膨胀、绝热膨胀、等温压缩和绝热压缩四个过程组成。
2. 布雷顿循环:布雷顿循环是一种内燃机循环过程,应用于内燃机和蒸汽轮机等发动机中。
四、热力学方程热力学方程是描述热力学系统中热量和能量转化关系的数学表达式,包括理想气体方程、卡诺循环效率等。
1. 理想气体方程:理想气体方程描述了理想气体状态下温度、压力和体积之间的关系,即PV=nRT。
2. 卡诺循环效率:卡诺循环效率是指卡诺循环中高温热源和低温热源之间能量转化的效率,其最大效率与工作物质的性质有关。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
基础知识
远大工程学院
1/52
主要内容
• 热力学知识 • 产品知识
2020/11/13
2/52
2020/11/13
一、热力学知识
3/52
热力学知识
空调
2020/11/13
一般理解即空气调节,指为满足人们的生活或 生产的需要而对特定的空间内的空气温度、相 对湿度、清洁度、噪音或空气流动速度等参数 的适当调节和控制。
在标准大气压下,以水的结冰温度作为 0℃,沸 腾温度作为100℃,中间分成100等分,每一等分 为一摄氏度。
在标准大气压下,以水的结冰温度为32℉,沸腾 温度作为212℉,中间分为180等分,每一等分为 一华氏度。
17/52
热力学知识
相对湿度
2020/11/13
空气中实际的水蒸汽分压力和同温度下饱 和水蒸汽分压力之比。
热力学知识 二 元 溶 液
2020/11/13
两种互相不起化学作用的物质组成的混合物。
这种均匀混合物其内部各种物理性质,如压力、 温度、浓度、密度等在整个混合物中各处都完 全一致。不能用机械的沉淀法或离心法将它们 分离为原组成物质。
例如:溴化锂溶液就是一种二元溶液,溴化锂 是溶质,水是溶剂。在标准大气压下,溴化锂 溶液中水的沸点是 100℃,而溴化锂的沸点为 1265℃,两者相差甚大,因此,溶液沸腾时产 生的蒸汽几乎不带溴化锂的成分。
在实际工程应用中,人们通常习惯于把压强称 为压力。
8/52
热力学知识
大气压力
2020/11/13
指环绕地球的空气层在地球单位表面 积上形成的压力。
大气压力不仅与海拔高度有关,还随 季节、气候的变化稍有差别。
9/52
热力学知识
标准大气压力
2020/11/13
指纬度45°的海平面上大气的常年平均压 力,其值为760mmHg。
11/52
热力学知识
绝对压力
2020/11/13
密闭容器内部的真实压力。 它等于表压力与外部环境大气压力之和。
12/52
热力学知识
真空
2020/11/13
密闭容器内部的绝对压力小于外部 环境压力时的状态。
13/52
热力学知识
不凝性气体
2020/11/13
在机组内部温度和压力条件下,既不凝结 亦不能被溴化锂和冷剂水吸收的气体。
22/52
热力学知识 热 量 与 冷 量
2020/11/13
热量是指由于物质间温度差别而引起转移的 能量。
冷量的物理含义和热量相同,只是物体温度 高于周围介质温度的习惯上称为“热”,其 向周围介质放出的能量称为“热量”,而物 体温度低于周围介质温度的称为“冷”,其 向周围介质吸收的能量即为“冷量”。
对于满足人们生活需要的舒适性空调,远大的 理解是空气调和。“和”是中华文化的顶点, 而空调顶点是“六度皆优”(依重要性排序)。
4/52
热力学知识
空调
2020/11/13
空调顶点的“六度皆优”(依重要性排序): ① 温度:与自然气候抗衡,将室内温度调节到符 合人体要求;② 鲜度:将新鲜空气有效引入室内, 让人呼吸到足够的氧气;③ 净度:将空气中有害 物质和细菌捕集并排除;④ 静度:将设备噪音调 低到用户听不见;⑤ 湿度:将空气湿度调节到符 合皮肤需求;⑥ 速度:使吹到人身上的风慢到用 户感觉不到。
地球上绝大多数空调使用地区的大气压力 均接近标准大气压,故分析空调系统(包 括主机)时,一般假设外部环境压力为标 准大气压。
10/52
热力学知识
表压力
2020/11/13
在工程中用压力仪表检测出来的密闭容器内 的压力。压力表读数为密闭容器内压力与外 部大气压力的差值。
当内部压力小于外部大气压时,压力表的读 数为负值,此时称密闭容器内部处于负压状 态或真空状态。当内部压力大于外部大气压 力时,压力表的读数为正值,此时称密闭容 器内部处于正压状态。
20/52
热力学知识
结晶
2020/11/13
当降低饱和溶液的温度时,由于溶质 溶解度的降低,单位溶剂中所能溶解 的溶质量减少,出现溶质分子晶体从 溶液中析出的现象。21/52热力学知识浓度
2020/11/13
是指溶液中的溶质在溶液中所占的比例。
溴化锂溶液的浓度通常以质量百分数表示, 即溶质溴化锂质量与溶液质量的比值。
要实现“六度皆优”,必须做到“四优”:设计 优化、设备优质、施工优良、保养优秀。
5/52
热力学知识
空调
2020/11/13
38℃ 26℃
冷水 系统
冷却水 系统
37℃
26℃
38℃
30℃
6/52
热力学知识
制冷
2020/11/13
指在某一特定环境内制造出比周围环境温 度低的“冷”环境。
所谓“冷”环境,是要求“特定环境”中 空气的温度低于“周围环境”的温度,比 如要求室内温度(26℃)低于室外温度 (38℃)等。
相对湿度反映了湿空气中水蒸汽含量接近 饱和的程度。此值越小,表示空气离饱和 程度越远,空气越干燥,吸水能力越强。 反之,此值越大,表示空气更接近饱和程 度,空气越潮湿,吸收水蒸汽能力越弱。
18/52
热力学知识
饱和溶液
2020/11/13
指在一定温度下,固体溶质溶于溶剂中达 到最大值时的溶液。
19/52
练习题1:
用气压表测得当地大气压力为100.3kPa 从U形管测得机组吸收器的压力比大气压 力低99.4kPa。
则吸收器的真空度为
kPa
绝对压力为
kPa。
16/52
热力学知识
温度
2020/11/13
度量物体冷热程度的物理量。
温度是物体分子运动的结果,温度的高低用温标 表示。
常用的温标有摄氏温标(℃)和华氏温标(℉)。
不凝性气体存在于机组内部,将影响机组 真空,减少机组出力。
如果其中含有氧气还将导致机组锈蚀,严 重缩短机组使用寿命。
14/52
热力学知识
2020/11/13
大气压力、绝对压力、表压力的关系
正压状态
真空状态
表压力
大气 压力
绝对 压力
表压力
绝对 压力
大气 压力
0 Pa
15/52
热力学知识
2020/11/13
7/52
热力学知识
压力
2020/11/13
在物理学中,把垂直作用于物体表面的力叫做 压力;把单位面积上所受的压力称为压强。压 强是物理学中定量表示压力产生作用效果大小 的物理量。
压强单位为帕斯卡,简称帕(Pa)。1帕表示垂直 作用于每平方米(m2)上的力为 1牛顿(N)。 1Pa = 1N/m2,1mmHg = 133Pa。
