物化试题A
2019年北京理工大学884物理化学A试题(基本完整)

北京理工大学2019考研884物理化学
物化23道填空题,8道大题,一个证明题,2道简答题E 有二道大题涉及到了极化超电势和电导率与摩尔电导率,最后让求解离度和平衡常数,最需要注意的地方
一.填空(40分)
1.△H=Q P的条件是:()
2.轮胎里面充有理想气体,恒容,压力由280Kpa膨胀到320Kpa,C v,m=2.5R,求热力学能()
3.1mol理想气体,压力由100Kpa膨胀到500Kpa,求吉布斯变化能()
4.在298K,101.325kPa下,1mol苯和1mol甲苯混合为理想溶液,则混合过程的焓变△H= 和熵变△S= 。
5.298K,标准压力下,苯和甲苯形成理想液态混合物。
第一份混合物体积为2dm3,苯的摩尔分数为0.25,苯的化学势为μ1,第二份混合物的体积为1 dm3,苯的摩尔分数为0.5,化学势为μ2,则μ1μ2。
6.丙酮(A)与氯仿(B)形成真实液态混合物,在温度为T时,测得总的蒸气压力为29.398kPa,蒸气中丙酮的摩尔分数
y A=0.818,而在相同温度下纯氯仿的饱和蒸气压
p*B=29.571kPa。
在液相中氯仿的活度a B= 。
7.氮气和氢气瓶的颜色为()()
8.288.15K是,1molNaOH溶在4.59molH2O中所形成溶液的。
物化题练习题

物化题练习题1. 下列关于物质的说法中,正确的是:A. 物质是由分子或原子构成的;B. 物质可以被分解成更小的物体;C. 物质可以存在于固态、液态和气态;D. 物质可以通过化学反应转变成其他物质。
2. 水的化学式是H2O,其中2是表示:A. 氧元素的个数;B. 氢元素的个数;C. 氧气分子的个数;D. 氢气分子的个数。
3. 下列物质中,是化合物的是:A. 纯净水;B. 氧气;C. 氯气;D. 金属铝。
4. 气体的特点不包括:A. 分子间距离大,分子运动自由;B. 气体可以被压缩;C. 气体分子之间有强烈的相互作用力;D. 气体可以扩散和弥散。
5. 下列物质中,属于物理变化的是:A. 将水煮沸;B. 冰块融化成水;C. 铁生锈;D. 木材燃烧成灰。
6. 下列物质中,属于化学变化的是:A. 电池产生电能;B. 冰融化成水;C. 水蒸气变成水;D. 液化石油。
7. 下列物质中,属于原子的是:A. 水分子;B. 氧气分子;C. 铁分子;D. 氯气分子。
8. 下列元素中,是金属的是:A. 氧气;B. 氯气;C. 铁;D. 氮气。
9. 化学方程式中反应物和生成物分别位于方程式的左边和右边,这是遵守了什么定律?A. 质量守恒定律;B. 能量守恒定律;C. 波动守恒定律;D. 力学守恒定律。
10. 在化学方程式中,用于表示反应条件的符号是:A. ♦;B. ∆;C. ⊕;D. ↾。
以上是物化题练习题,请根据题目自行选择答案,并进行检查。
祝你好运!。
福州大学历届物化试题

物理化学试卷(A )41. 5 分 (6698)有一吹肥皂泡装置,下端连有一个一端通大气的 U 型水柱压力计,当肥皂泡的直径是 5×10-3 m 时,压力计水柱高度差为 2×10-3 m ,试计算该肥皂液在直径为 1×10-4 m 的毛细管中的升高值。
设皂液对毛细管壁完全润湿,且密度与水相同。
41. 5 分 (6698)[答] p s = 2×2γ /R ' = ρgh γ = 0.01225 N ·m -1 (3分)h = 2γ cos θ /ρgR 2= 0.05 m (2分) 135. 5 分 (7035)在298.15 K 时,苯蒸气在石墨上吸附服从Langmuir 吸附等温式。
当苯蒸气压力为760 Pa 时,石墨表面覆盖率θ=0.5,求苯蒸气在石墨表面上的吸附系数a 。
135. 5 分 (7035)[答] 1ap apθ=+ 将θ=0.5 p =760 Pa 代入解得a =0.001 315 Pa -1 (5分)7. 10 分 (4813)298 K 时, 以Pt 为阳极, Fe 为阴极, 电解浓度为1 mol ·kg -1的NaCl 水溶液(活度系数为 0.66)。
设电极表面有H 2(g)不断逸出时的电流密度为0.1A ·cm -2, Pt 上逸出Cl 2(g)的超电势可近似看作零。
若Tafel 公式为 η =a+blg(j /1A ·cm -2), 且Tafel 常数 a=0.73 V, b=0.11V , φ (Cl 2/Cl -)=1.36 V ,请计算实际的分解电压。
7. 10 分 (4813)[答] E 理论 =φ +-φ -=[φ (Cl 2/Cl -)-RT F ln α (Cl -)]-[(φ (H +/H 2)+RT F ln α (H +)) =1.36 - 0.01 - 831429896500.⨯ln10-7 =1.76 V (3分) η阴= a + b lg j =0.73+0.11× lg0.1 =0.62 V (2分) η阳=0 (2分)E 分解 =E 理论+η阴+η阳=2.38 V (3分)213. 10 分 (4710)有电池Hg(l)|Hg 22+(a 1)||Hg 22+(a 1),Hg 2+(a 2)|Pt 。
物化第五章习题A卷

A 卷一、选择题1. 用什么仪器可以区分固溶体和低共熔混合物? ( )(A)放大镜 (B)超显微镜 (C)电子显微镜 (D)金相显微镜2. 已知苯―乙醇双液体系中,苯的沸点是353.3 K ,乙醇的沸点是351.6 K ,两者的共沸组成为:含乙醇47.5%(摩尔分数),沸点为341.2 K .今有含乙醇77.5%的苯溶液,在达到气液平衡后,气相中含乙醇为y 2,液相中含乙醇为x 2。
问:(1) 下列结论何者正确?( )(A) y 2>x 2 (B) y 2=x 2 (C) y 2<x 2 (D) 不确定(2) 若将上述溶液精馏,则能得到( ) (A) 纯苯 (B) 纯乙醇(C) 纯苯和恒沸混合物 (D) 纯乙醇和恒沸混合物3. 当乙酸与乙醇混合反应达平衡后,体系的独立组分数 C 和自由度 f 应分别为: ( )(A) C = 2,f = 3 (B) C = 3,f = 3 (C) C = 2,f = 2 (D) C = 3,f = 44. 在一个密封的容器中装满了温度为373.15 K 的水,一点空隙也不留,这时水的蒸气压:( )(A)等于零 (B)等于101.325 kPa (C)小于101.325 kPa (D)大于101.325 kPa5. 恒沸混合物在气、液两相平衡共存时的自由度为: ( )(A)0 (B)1 (C)2 (D)36. 某气体服从状态方程pV p nRT ()1-=β,β为与气体性质和温度有关的常数。
根据相图和相律可知,该气体在气相区、气液共存区、临界点时的自由度分别为:( )(A)3,2,1 (B)3,1,0 (C)2,1,0 (D)2,1,17. N 2的临界温度是124 K ,如果想要液化N 2就必须: ( )(A) 在恒温下增加压力 (B) 在恒温下降低压力(C) 在恒压下升高温度 (D) 在恒压下降低温度8. 硫酸与水可形成H 2SO 4·H 2O (s )、H 2SO 4·2H 2O (s )、H 2SO 4·4H 2O (s )三种水合物,问在 101 325 Pa 的压力下,能与硫酸水溶液及冰平衡共存的硫酸水合物最多可有多少种? ( )(A) 3 种 (B) 2 种 (C) 1 种 (D) 不可能有硫酸水合物与之平衡共存。
初中物化竞赛试题及答案

初中物化竞赛试题及答案一、选择题(每题3分,共30分)1. 以下哪种物质是由原子直接构成的?A. 水银B. 二氧化碳C. 氯化钠D. 氧气答案:A2. 物质的密度是指单位体积的质量,其计算公式为:A. 密度 = 质量 / 体积B. 密度 = 体积 / 质量C. 质量 = 密度× 体积D. 体积 = 质量 / 密度答案:A3. 光在真空中的传播速度是:A. 299,792,458米/秒B. 3×10^8米/秒C. 2.998×10^8米/秒D. 3×10^5千米/秒答案:C4. 以下哪个选项是正确的化学方程式?A. 2H2 + O2 → 2H2OB. H2 + O2 → H2OC. 2H2 + O2 → H2OD. H2 + O2 → 2H2O答案:A5. 以下哪个选项是正确的能量转换?A. 电能→ 化学能B. 化学能→ 电能C. 热能→ 电能D. 电能→ 热能答案:D6. 以下哪个选项是正确的物理量单位?A. 长度单位:米(m)B. 质量单位:千克(kg)C. 速度单位:米每秒(m/s)D. 所有选项都是正确的答案:D7. 以下哪个选项是正确的化学反应类型?A. 分解反应B. 化合反应C. 置换反应D. 所有选项都是正确的答案:D8. 以下哪个选项是正确的物理量?A. 力的单位:牛顿(N)B. 功率的单位:瓦特(W)C. 电压的单位:伏特(V)D. 所有选项都是正确的答案:D9. 以下哪个选项是正确的原子结构?A. 原子核 + 电子云B. 原子核 + 电子层C. 原子核 + 电子轨道D. 所有选项都是正确的答案:A10. 以下哪个选项是正确的物质状态?A. 固态B. 液态C. 气态D. 所有选项都是正确的答案:D二、填空题(每题2分,共20分)1. 物质的三态变化包括______、______和______。
答案:熔化、凝固、蒸发2. 牛顿第一定律也被称为______定律。
物化基础知识试题及答案

物化基础知识试题及答案一、选择题(每题2分,共20分)1. 物质的三态变化中,下列哪种变化是吸热过程?A. 熔化B. 凝固C. 液化D. 升华答案:A2. 根据理想气体状态方程 PV=nRT,当温度不变时,气体的压强与体积成什么关系?A. 正比B. 反比C. 无关D. 无法确定答案:B3. 以下哪种物质不属于晶体?A. 食盐B. 冰C. 玻璃D. 金属答案:C4. 物质的比热容是指单位质量的物质温度升高1摄氏度所需要的热量,下列物质中比热容最大的是?A. 水B. 铜C. 铁D. 铝答案:A5. 以下哪种现象不属于布朗运动?A. 悬浮在空气中的花粉颗粒的随机运动B. 悬浮在水中的花粉颗粒的随机运动C. 悬浮在液体中的固体颗粒的随机运动D. 悬浮在气体中的固体颗粒的随机运动答案:D6. 物质的导热性能与其结构有关,以下哪种物质的导热性能最好?A. 玻璃B. 橡胶C. 金属D. 木材答案:C7. 物质的扩散现象表明了分子的什么特性?A. 静止B. 有序排列C. 无规则运动D. 高速运动答案:C8. 物质的表面张力是由于分子间的哪种力引起的?A. 引力B. 斥力C. 静电力D. 磁力答案:A9. 物质的相变过程中,哪种过程不涉及相的变化?A. 蒸发B. 凝结C. 沉淀D. 溶解答案:D10. 物质的热膨胀系数是指单位温度变化时,物质体积的相对变化量。
以下哪种物质的热膨胀系数最大?A. 铁B. 铜C. 铝D. 水答案:D二、填空题(每题2分,共20分)1. 物质的三态变化包括______、______和______。
答案:熔化、汽化、凝固2. 理想气体状态方程为______,其中P表示压强,V表示体积,n表示摩尔数,R是______,T表示温度。
答案:PV=nRT,气体常数3. 晶体与非晶体的主要区别在于晶体具有______,而非晶体没有。
答案:规则的几何外形和内部结构4. 物质的比热容越大,其吸收或释放相同热量时,温度变化越______。
2007级(5-7)物化期末试题(南大5版)A

泰山学院课程考试专用泰山学院材料与化学工程系2007级(3+2)专升本化学工程与工艺专业本科2007~2008学年第一学期《物理化学》试卷A(试卷共10页,答题时间120分钟)一、选择题(每小题 2 分,共 40分。
请将答案填在下面的表格内)1、压力升高时,单组分系统的熔点将如何变化--------------------------------( )A、升高B、降低C、不变D、不一定2、硫酸与水可形成H2SO4·H2O(s)、H2SO4·2H2O(s)、H2SO4·4H2O(s)三种水合物,问在101325 Pa 的压力下,能与硫酸水溶液及冰平衡共存的硫酸水合物最多可有多少种----------------------------------------------------------------------------------( )A、3 种B、2 种C、1 种D、不可能有硫酸水合物与之平衡共存3、水蒸气蒸馏通常适用于某有机物与水组成的--------------------------------( )A、完全互溶双液系B、互不相溶双液系C、部分互溶双液系D、所有双液系:本试卷共10页第 1 页4、对恒沸混合物的描述,下列叙述哪一种是不正确的---------------------- ( )A、不具有确定的组成B、平衡时,气相和液相的组成相同C、其沸点随外压的改变而改变D、与化合物一样,具有确定的组成5、A与B是两种互不相溶的两种液体,A的正常沸点80℃,B的正常沸点120℃。
把A、B混合组成一个系统,那么这个混合物的正常沸点为----------------( )A、小于80℃B、大于120℃C、介于80℃与120℃之间D、无法确定范围下面关于6、如图,对于右边的步冷曲线对应是哪个物系点的冷却过程--------------( )A、a点物系点B、b点物系点C、c点物系点D、d点物系点7、如图,对于形成简单低共熔混合物的二元相图,当物系点的组成为x,冷却到t℃时,固液二相的重量之比是-------------------------------------------------( )A、w(s)∶w(l) = ac∶bcB、w(s)∶w(l) = ac∶abC、w(s)∶w(l) = bc∶abD、w(s)∶w(l) = bc∶ac8、如图A与B是两组分恒压下固相部分互溶凝聚系统相图,图中有几个两相区----------------- -------------- ( )A、1个B、2个C、3个D、4个9、H2O-KNO3-NaNO3物系的相图如下。
物理化学期末试卷A卷

1昆 明 理 工 大 学 试 卷 (A )考试科目: 物理化学 考试日期:2013. 1. 08 命题教师:物化命题小组 一、选择题 (每小题2分,共30分)1、一定量的某理想气体等容下由T 1升温到T 2,相同量的该气体等压下也由T 1升温到T 2,两个过程热量的关系和热力学能变化的关系:( ) ( A ) Q V = Q p ,∆U V = ∆U p ; ( B ) Q V < Q p ,∆U V = ∆U p ; ( C ) Q V > Q p ,∆U V < ∆U p ; ( D ) Q V < Q p ,∆U V < ∆U p 。
2、物质的量为n 的理想气体等温压缩,当压力由p 1变到p 2时,其∆G 是: ( )(A) nRT p p ln 12; (B) nRTp p p p d 12⎰; (C) Vp p ()21-; (D) nRT p p ln 213、CH 4(g)在298 K 且反应物及产物均在标准压力下完全燃烧,反应进度ξ=1 mol ,ν[CH 4(g)] =-1,放出的热为890.7 kJ ,其热化学方程式写法正确的是: ( )(A )CH 4(g)+ 2O 2(g) == CO 2(g)+ 2H 2O(l),∆r H (298 K) = -890.7 kJ ·mol -1; (B )CH 4(g)+ 2O 2(g) == CO 2(g)+ 2H 2O(g),∆r H (298 K) = -890.7 kJ ·mol -1; (C )CH 4(g)+ 2O 2(g) == CO 2(g)+ 2H 2O(l),∆r H (298 K) = 890.7 kJ ·mol -1; (D )CH 4(g)+ 2O 2(g) == CO 2(g)+ 2H 2O(g),∆r H (g) = 890.7 kJ ·mol -14、一封闭系统,当状态从A 到B 发生变化时,经历了两条任意不同的途径,则下列四式正确的是: ( ) ( A ) Q 1 = Q 2; ( B ) W 1 = W 2; ( C ) Q 1 +W 1 = W 2 +Q 2; ( D ) Q 1 -W 1 = W 2 -Q 2。
物化上题目-苏州大学 物理化学 样卷-考研试题文档资料系列

苏州大学物理化学样卷(A) 共页一、选择题 ( 共10题 20分 )1. 理想气体经可逆与不可逆两种绝热过程:( B )(A) 可以从同一始态出发达到同一终态(B) 从同一始态出发,不可能达到同一终态(C) 不能断定(A)、(B) 中哪一种正确(D) 可以达到同一终态,视绝热膨胀还是绝热压缩而定2. 在 S,H,CV,G,F 几个热力学函数中,其数值与最低能级能量数值的选取无关的是:( C )(A) S,H,CV,G,F (B) CV (C) CV,S (D) F,G,H3.理想气体的 atto 循环由下面四个可逆步骤构成:(A) 气体绝热可逆压缩 (B) 恒容升温,气体从环境吸热(C) 气体经绝热膨胀作功 (D) 恒容降温回到原态该循环过程的T-S图为:( D )4. 下述哪一种说法正确?因为ΔHp = Qp,所以:( D )(A) 恒压过程中,焓不再是状态函数(B) 恒压过程中,体系与环境无功的交换(C)恒压过程中,焓变不能量度体系对外所做的功(D)恒压过程中,ΔU不一定为05. 理想气体反应 N2O5(g) = N2O4(g) + (1/2) O2(g) 的ΔrH 为 41.84 kJ⋅mol-1,ΔCp= 0,试问增加 N2O4平衡产率的条件是:( B )(A) 降低温度 (B) 提高温度 (C) 提高压力 (D) 等温等容加入惰性气体6. 在非等压过程中加热某体系, 使其温度从T1升至T2, 吸热Q, 则此过程的焓增量ΔH 为:( C )(A) ΔH=Q (B) ΔH=0 (C) ΔH=ΔU+Δ(pV) (D) ΔH等于别的值7. Ag2O分解可用下面两个计量方程之一表示,其相应的平衡常数也一并列出:设气相为理想气体,且已知反应是吸热的,试判断下列结论哪个是正确的: A(A)(B)(C)随温度的升高而增大(D)O2气的平衡压力与计量方程的写法无关8. 在一绝热箱中装有水,水中通一电阻丝,由蓄电池供电,通电后水及电阻丝的温度均略有升高,今以水和电阻丝为体系,其余为环境,则有:( B)(A) Q < 0 , W = 0 , ΔU < 0 (B) Q = 0 , W < 0 , ΔU > 0(C) Q > 0 , W = 0 , ΔU > 0 (D) Q < 0 , W = 0 , ΔU > 09. 气相反应A+B=2L+M ,在25℃下和恒定容器内进行,最初A和B各为101.325 kPa,而没有L和M,平衡时A和B均为×101.325 kPa,则该反应的K c/ mol·cm-3 为: ( A )(A) 4.31×10-3 (B) 8 (C) 10.67 (D) 1610. 下列的过程可应用公式ΔH=Q进行计算的是:( C )(A) 不做非体积功,终态压力相同但中间压力有变化的过程 (B) 不做非体积功,一直保持体积不变的过程 (C) 273.15 K,p 下液态水结成冰的过程 (D) 恒容下加热实际气体二、填空题 ( 共10题 20分 )11. 卡诺热机的效率只与有关,而与无关。
大学物化实验期末考试试题及答案

大学物化实验期末考试试题及答案一、选择题(每题2分,共20分)1. 物质的量浓度是指:A. 溶液中溶质的质量B. 溶液中溶质的体积C. 单位体积溶液中所含溶质的物质的量D. 单位质量溶液中所含溶质的物质的量答案:C2. 在恒温恒压下,气体的体积与气体的物质的量成正比,这是:A. 波义耳定律B. 查理定律C. 阿伏伽德罗定律D. 盖吕萨克定律答案:C3. 以下哪个不是热力学第一定律的表述?A. 能量守恒B. 能量可以以不同的形式存在C. 能量不能被创造或毁灭D. 能量可以从一种形式转化为另一种形式答案:C4. 根据热力学第二定律,以下哪个说法是错误的?A. 热量不能自发地从低温物体传递到高温物体B. 任何能量转化过程都不可能完全转化为机械能C. 自然界中的熵总是增加的D. 热量可以自发地从高温物体传递到低温物体答案:B5. 理想气体状态方程为:A. PV=nRTB. PV=mRTC. P=V/nRTD. P=nRT/V答案:A6. 物质的溶解度与以下哪个因素无关?A. 温度B. 压力C. 溶剂的量D. 溶质的性质答案:C7. 根据范特霍夫方程,以下哪个因素不会影响化学反应的平衡常数?A. 温度B. 压力C. 浓度D. 催化剂答案:D8. 根据吉布斯自由能变化,以下哪个结论是正确的?A. ΔG=0时,反应处于平衡状态B. ΔG>0时,反应不能自发进行C. ΔG<0时,反应可以自发进行D. 所有选项都是正确的答案:D9. 以下哪个是电解质?A. 氯化钠B. 酒精C. 葡萄糖D. 碘化钾答案:A10. 根据电化学原理,以下哪个说法是错误的?A. 原电池中,阳极发生氧化反应B. 电解池中,阴极发生还原反应C. 电镀池是电解池的一种D. 电化学腐蚀是氧化还原反应的一种答案:A二、填空题(每空2分,共20分)1. 物质的量浓度的单位是________。
答案:mol/L2. 阿伏伽德罗常数的值是________。
物理化学A试卷(答案)

河北理工大学2006~2007学年第一学期物理化学A-11分,答案填入题后表格中)1、1mol 理想气体298K 向真空膨胀体积变为原来的10倍,则∆G 为 a 19.14J b 5703.7J c -5703.7J d 02、∆H=∆U+∆(PV)适用于a 恒压过程b 恒容过程c 恒温过程d 一切过程 3、1mol 单原子理想气体在300K 绝热压缩至500K,则其焓变∆H 为 a 4157J b 596J c 1255J d 994J 4、若体系与环境之间只有能量交换而无物质交换,该系统为: a. 封闭体系 b 隔离体系 c. 敞开体系 d. 混合体系 5、已知CO ( g) +1/2O 2(g) =CO 2(g) 的∆r H m 下列说法何者不正确: a. ∆r H m 是CO 2(g) 的生成热 b. ∆r H m 是CO (g) 的燃烧热 c. ∆r H m 是负值 d. ∆r H m 与反应的∆r U m 数值不相等 6、-20 ︒C 、101.325KPa 下1mol 过冷水结冰,放热为∆H ,则过程的熵变∆Sa. 等于253H ∆b. 大于253H ∆c. 小于253H∆ d. 不能确定7、B 物质从α相自发地向β相转移,则μB α 与μB β 的关系是:a. μB α >μB βb. μB α <μB βc. μB α =μB βd. 不能确定8、25︒C 有反应)(2)(2)(2)(6663217g l g l CO O H O H C +=+气体作为理想气体,则反应的❒H 与❒U 之差约为:a -3.7KJb 1.2KJc -1.2KJd 3.7KJ 9、H 2 和O 2以2:1的比例在绝热的钢瓶中反应生成水,在该反应过程中 a ∆H =0 b ∆T=0 c ∆P=0 d ∆U=0 10、任一反应的Q p,m 与Q v,ma Q p,m 总是大于Q v,mb Q p,m 总是小于Q v,mc Q p,m 等于Q v,md Q p,m 与Q v,m 的比较不能确定 11、100℃,101.325KPa 条件下,1mol 水向真空蒸发为100℃,101.325KPa 的水蒸汽,则:a ∆S=0b ∆U=0c ∆H=0d ∆G=0 12、任意不可逆循环的熵变a 大于零b 小于零c 等于零d 是温度的函数 13、绝热过程中,系统的∆S>0,表示过程a 自发的b 反自发的c 可逆的d 可能自发也可能反自发14、CaCO 3(s)装入真空容器中加热分解达平衡,则其自由度为a 1b 2c 0d 315、A 和B 形成理想溶液,已知100℃时P A *=1000mmHg ,P B *=500mmHg ,当溶液中X A =0.5时,与溶液平衡的蒸气中A 的摩尔分数为a 1b 43c 21d 32 16、已知1mol O 2在25℃,100KPa 的S m θ=205.14JK -1mol -1,则其在45℃,101.3KPa 的规定熵以J.mol -1.K -1表示值应为(C p,m =25J.K -1mol -1)a209.28 b 206.65 c 206.87 d 249分,每题1分,以"Y"、或"N"填入题后表格中) 1、沸点上升是稀溶液的依数性之一; 2、绝热过程熵值不变;3、理想液态混合物中某一组分化学势,μB =μB θ+RTlnX B ;4、系统在恒压过程中吸收的热等于焓变;5、过冷水结冰是一自发过程,∆S 系<0与熵增原理相矛盾;6、升高温度对平衡常数增加有利;7 、20℃时,1mol 纯理想气体从0.1Mpa 压缩到2.5MPa 时,化学势变化值为 - 9.845kJ ;8、物质处于临界状态时,Sm (l)=Sm (g);;9、理想气体化学反应等温方程式为-∆ r G m =∆ r G m θ+RTlnJp ; 10 、∆G<0的化学反应能自发向右进行;已知水在100℃、101325Pa 下蒸发热Δvap H m =40.64KJ ·mol -1,试求4mol 水在100℃、101325Pa 下变为水蒸气过程的Q 、W 、ΔU 、ΔH 、ΔS 、ΔG 各为若干?(水的体积与水蒸气体积相比较可忽略不计。
物化练习题(1)

高材15级物理化学试题A一、分析及相图题1、真实气体的行为规则是什么?真实气体能否被液化?其条件是什么?答:分子之间有相互作用力,分子本身占有体积,分子不断作无规则热运动;能被液化,气体温度低于Tc(临界温度)。
2、质量作用定律对于复杂反应是否适应?答:否,质量作用定律只适用于基元反应,对于非基元反应,只能对其反应机理的每一步基元反应适用。
3、现在有人想利用海洋中不同深度的温度不同,设计一种循环操作的机器,使海水的热力学能转换成有用的机械功。
这是不是违反热力学第二定律?为什么?答:不违反,海洋深层的温度低于表面,由于相对密度的原因,温度低的水总在海洋的下层,因为不是从单一的热源吸热做功,所以不违反热力学第二定律。
4、任一封闭系统在任意指定的始末状态之间可设计出无数多个具体的途径,各具体途径的热和功皆不相等,但每个途径的热和功的代数和皆相等,原因何在?答:封闭系统在指定的始末状态之间,任一指定途径的Qi+Wi=Δu,而Δu是状态函数的增量。
对于指定系统,Δu只取决于始末状态而与途径无关,故各途径的热和功…5、气相反应NO(g)+1/2O2(g) → NO2(g)在298 K,101.325 kPa下进行。
若有关气体均可视为理想气体,则因理想气体的热力学能只是温度的函数,故上述反应的△U = 0,又因是等温等压过程,Q=nC p,m△T=0。
此种说法是否正确?为什么?答:不正确,对于一定质量一定组成的理想气体,其热力学能只是温度的函数,有相变化或化学变化时不满足上述条件,也就是得不到ΔU=0的结论,只适用于系统在无相变化及化学变化且ω′=0的等压过程下的的情况,而有化学变化时套用公式则不对。
6、知道了化学反应方程式,能否确定其反应级数和反应分子数?答:不能,反应级数由实验得到,可通过尝试法,半衰期法,初始速率法等加以确定,通常一个化学反应不是按其计量数所示个数分子直接碰撞,而是经过一系列分子直接碰撞发生的步骤7、一定量100℃,100 kPa的水,在等温等压条件下变成水蒸气。
物化试卷A卷及参考答案

《物理化学》期末考试(A卷)班级学号姓名总分一、选择题(共10题,每题2分,共20分)请将正确答案写在题目后面的括号内。
1.当用压缩因子z = pV/(nRT) 来讨论实际气体时,如z >1,则表示该气体()。
A. 不易压缩B.易于压缩C.易于液化D.不易液化2.下列物理量中不属于强度性质的物理量为()。
A.摩尔体积B.热力学能C.压力D.密度3.已知CO2的T c=304.13 K,P c=7.375 MPa。
有一钢瓶中贮有302.15 K的CO2,则该CO2处于什么状态()。
A.液体B.气体C.气液共存D.数据不足,无法确定4.△H = Q p此式适用于下列那个过程(皆为封闭系统)()。
A.理想气体从1013250 Pa 反抗恒定的101325 Pa压力膨胀到101325PaB.气体从(298K, 101325 Pa) 可逆变化到(373K, 10132.5 Pa)C.101325 Pa压力下电解CuSO4水溶液D.0℃,101325 Pa下冰融化成水5.对于物理吸附的描述,以下说法中不正确的是()。
A.吸附力来源于范德华力B.吸附一般无选择性C.吸附可以是单分子层或多分子层D.吸附速度较小6.丁铎尔效应是光射到胶体粒子上引起的什么现象()。
A.透射B.反射C.散射D.衍射7.以下说法中,错误的是()。
A.催化剂的加入能改变反应机理B.催化剂的加入能改变反应速率第 1 页共8 页C.催化剂的加入能改变反应转化率D.催化剂的加入能改变反应活化能8.将少量表面活性剂溶入溶剂后,溶液的表面张力()。
A.降低B.显著降低C.增大D.先增大,后减小9.基元反应H + Cl2→ HCl + Cl 的反应的分子数为()。
A.1B.2C.3D.410.已知反应2A → P,A 的半衰期与其初始浓度成正比,则此反应为()。
A.零级反应B.一级反应C.二级反应D.三级反应二、填空题(共15题,每题2分,共30分)请将正确答案写在题目上的横线上。
物化A试卷答案

暨 南 大 学 考 试 试 卷一、选择题(共25小题,每小题1分,总共25分;请将正确的选项填入题后的括号内)1. ΔH =Q p 适用于下列哪个过程? ( ) (A) 理想气体从107 Pa 反抗恒压105 Pa 膨胀到105 Pa (B) 101325 Pa 下电解CuSO 4 (C) 0 ℃、101325 Pa 下冰融化成水(D) 气体从298 K 、101325 Pa 可逆变化到373 K 、101325 Pa2. 某绝热封闭体系在接受了环境所作的功之后,温度 ( ) (A) 一定升高 (B) 一定降低 (C) 一定不变 (D) 随接受功多少而定3. 将某理想气体从温度T 1加热到T 2,若此变化为非恒容途径,则其热力学能 的变化ΔU 应为何值? ( ) (A) ΔU = 0 (B) ΔU = C V (T 2-T 1) (C) ΔU 不存在 (D) ΔU 等于其他值4. 理想气体混合过程中,下列体系的性质,不正确的是( )∆∆∆∆S H G UC)(A) >0 (B) =0=0 ((D) =05. 理想气体可逆定温压缩过程中,错误的有( )∆∆∆=0 (B) =0 (C) <0 (D) =0(A)S U Q H体6. 理想气体自状态p1V1T1恒温膨胀至p2V2T1。
此过程的ΔA与ΔG有什么关系?( ) (A) ΔA>ΔG(B) ΔA<ΔG(C)ΔA=ΔG(D) 无确定关系7. 糖可以顺利溶解在水中,这说明固体糖的化学势与糖水中糖的化学势比较,高低如何?( )(A)高(B) 低(C) 相等(D) 不可比较8. 比较如下两筒氮气化学势的大小(γ为逸度系数), 答案应为( )(A) μ1> μ2(B) μ1<μ2(C)μ1=μ2(D) 不能比较其相对大小9. 关于偏摩尔量,下面的说法中正确的是( )(A) 偏摩尔量的绝对值都可以求算(B) 系统的容量性质才有偏摩尔量(C) 同一系统的各个偏摩尔量之间彼此无关(D) 没有热力学过程就没有偏摩尔量10. 已知下列反应的平衡常数:H2(g) + S(s) = H2S(s) ①K1;S(s) + O2(g) = SO2(g) ②K2。
物化试卷
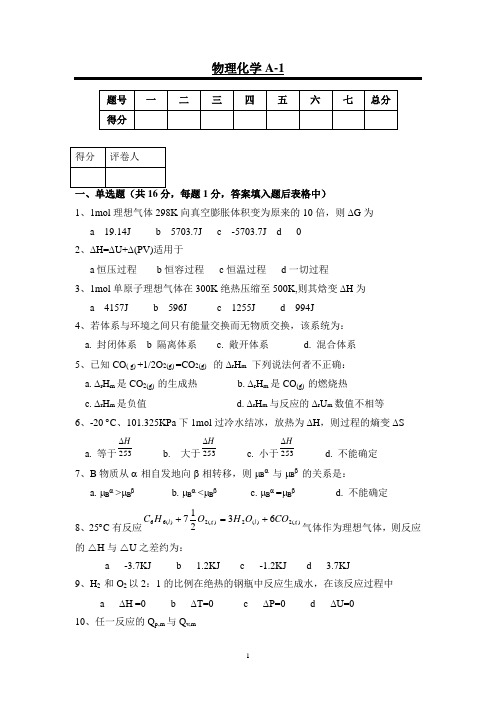
物理化学A-11分,答案填入题后表格中)1、1mol 理想气体298K 向真空膨胀体积变为原来的10倍,则∆G 为 a 19.14J b 5703.7J c -5703.7J d 02、∆H=∆U+∆(PV)适用于a 恒压过程b 恒容过程c 恒温过程d 一切过程 3、1mol 单原子理想气体在300K 绝热压缩至500K,则其焓变∆H 为 a 4157J b 596J c 1255J d 994J 4、若体系与环境之间只有能量交换而无物质交换,该系统为: a. 封闭体系 b 隔离体系 c. 敞开体系 d. 混合体系 5、已知CO ( g) +1/2O 2(g) =CO 2(g) 的∆r H m 下列说法何者不正确: a. ∆r H m 是CO 2(g) 的生成热 b. ∆r H m 是CO (g) 的燃烧热 c. ∆r H m 是负值 d. ∆r H m 与反应的∆r U m 数值不相等 6、-20 ︒C 、101.325KPa 下1mol 过冷水结冰,放热为∆H ,则过程的熵变∆Sa. 等于253H ∆b. 大于253H ∆c. 小于253H∆ d. 不能确定7、B 物质从α相自发地向β相转移,则μB α 与μB β 的关系是: a. μB α >μB β b. μB α <μB β c. μB α =μB β d. 不能确定8、25︒C 有反应)(2)(2)(2)(6663217g l g l CO O H O H C +=+气体作为理想气体,则反应的❒H 与❒U 之差约为:a -3.7KJb 1.2KJc -1.2KJd 3.7KJ9、H 2 和O 2以2:1的比例在绝热的钢瓶中反应生成水,在该反应过程中 a ∆H =0 b ∆T=0 c ∆P=0 d ∆U=0 10、任一反应的Q p,m 与Q v,ma Q p,m 总是大于Q v,mb Q p,m 总是小于Q v,mc Q p,m 等于Q v,md Q p,m 与Q v,m 的比较不能确定 11、100℃,101.325KPa 条件下,1mol 水向真空蒸发为100℃,101.325KPa 的水蒸汽,则:a ∆S=0b ∆U=0c ∆H=0d ∆G=0 12、任意不可逆循环的熵变a 大于零b 小于零c 等于零d 是温度的函数 13、绝热过程中,系统的∆S>0,表示过程a 自发的b 反自发的c 可逆的d 可能自发也可能反自发14、CaCO 3(s)装入真空容器中加热分解达平衡,则其自由度为a 1b 2c 0d 315、A 和B 形成理想溶液,已知100℃时P A *=1000mmHg ,P B *=500mmHg ,当溶液中X A =0.5时,与溶液平衡的蒸气中A 的摩尔分数为a 1b 43c 21d 32 16、已知1mol O 2在25℃,100KPa 的S m θ=205.14JK -1mol -1,则其在45℃,101.3KPa 的规定熵以J.mol -1.K -1表示值应为(C p,m =25J.K -1mol -1)a 209.28b 206.65c 206.87d 2491分,以"Y"、或"N"填入题后表格中) 1、沸点上升是稀溶液的依数性之一; 2、绝热过程熵值不变;3、理想液态混合物中某一组分化学势,μB =μB θ+RTlnX B ;4、系统在恒压过程中吸收的热等于焓变;5、过冷水结冰是一自发过程,∆S 系<0与熵增原理相矛盾;6、升高温度对平衡常数增加有利;7 、20℃时,1mol 纯理想气体从0.1Mpa 压缩到2.5MPa 时,化学势变化值为 - 9.845kJ ;8、物质处于临界状态时,Sm (l)=Sm (g);;9、理想气体化学反应等温方程式为-∆ r G m =∆ r G m θ+RTlnJp ; 10 、∆G<0的化学反应能自发向右进行;已知水在100℃、101325Pa 下蒸发热Δvap H m =40.64KJ ·mol-1,试求4mol水在100℃、101325Pa 下变为水蒸气过程的Q 、W 、ΔU 、ΔH 、ΔS 、ΔG 各为若干?(水的体积与水蒸气体积相比较可忽略不计。
贵州大学物化试题及答案

贵州大学物化试题及答案一、选择题(每题2分,共20分)1. 物质的三态变化中,不涉及化学键变化的是()。
A. 熔化B. 凝固C. 蒸发D. 升华2. 根据热力学第一定律,下列说法正确的是()。
A. 系统吸收热量,内能一定增加B. 系统对外做功,内能一定减少C. 系统从外界吸收热量,同时对外做功,内能可能增加D. 系统从外界吸收热量,同时对外做功,内能可能减少3. 在理想气体状态方程中,下列哪个变量与气体的体积无关?()A. 温度B. 压力C. 摩尔数D. 气体常数4. 根据热力学第二定律,下列说法错误的是()。
A. 热量不能自发地从低温物体传向高温物体B. 所有自发过程都是不可逆的C. 熵总是增加的D. 熵总是减少的5. 根据布朗运动,下列说法正确的是()。
A. 布朗运动是分子的运动B. 布朗运动是分子间碰撞的结果C. 布朗运动是宏观物体的运动D. 布朗运动是分子间的吸引力6. 根据吉布斯自由能的定义,下列说法正确的是()。
A. 吉布斯自由能增加,反应自发进行B. 吉布斯自由能减少,反应非自发进行C. 吉布斯自由能不变,反应处于平衡状态D. 吉布斯自由能增加,反应非自发进行7. 根据化学平衡的概念,下列说法错误的是()。
A. 化学平衡是动态平衡B. 化学平衡时,正反应和逆反应速率相等C. 化学平衡时,各物质的浓度不再变化D. 化学平衡时,各物质的摩尔数不再变化8. 在电化学中,下列说法正确的是()。
A. 阳离子向阴极移动B. 阴离子向阳极移动C. 电子从阳极流向阴极D. 电子从阴极流向阳极9. 根据表面张力的概念,下列说法错误的是()。
A. 表面张力是液体表面分子间的相互吸引力B. 表面张力使液体表面具有收缩的趋势C. 表面张力与液体的表面能成正比D. 表面张力与液体的体积成正比10. 根据胶体的性质,下列说法正确的是()。
A. 胶体粒子在电场中不发生迁移B. 胶体粒子在磁场中不发生迁移C. 胶体粒子在电场中发生迁移D. 胶体粒子在磁场中发生迁移二、填空题(每题2分,共20分)1. 物质的比热容是指单位质量的物质温度升高1K时所吸收或放出的热量,其单位是______。
物化期末考试试卷a-知识分享

中山大学本科生期末考试考试科目:《物理化学(上)》(A卷)学年学期:2014学年第三学期姓名:学院/系:化学与化学工程学院学号:考试方式:闭卷+A4纸双面小结年级专业:考试时长:120分钟班别:警示《中山大学授予学士学位工作细则》第八条:“考试作弊者,不授予学士学位。
”------------以下为试题区域,共3道大题,总分100分,考生请在答题纸上作答------------一、选择题(共15 小题,每小题 2 分,共30 分)1. 硫酸与水可形成H2SO4·H2O(s)、H2SO4·2H2O(s)、H2SO4·4H2O(s)三种水合物,问在 101 325 Pa 的压力下,能与硫酸水溶液及冰平衡共存的硫酸水合物最多可有多少种? ( )(A) 3 种 (B) 2 种(C) 1 种 (D) 不可能有硫酸水合物与之平衡共存。
2. 理想气体卡诺循环的图为下列四种情况中的哪一种? ( B、C ) 答案为何无C?3. 液体B比液体A易于挥发,在一定温度下向纯A液体中加入少量纯B液体形成稀溶液,下列几种说法中正确的是:( )(A) 该溶液的饱和蒸气压必高于同温度下纯液体A的饱和蒸气压(B) 该液体的沸点必低于同样压力下纯液体A的沸点(C) 该液体的凝固点必低于同样压力下纯液体A的凝固点(溶液凝固时析出纯固态A)(D) 该溶液的渗透压为负值4. 在下列状态变化中,哪些可以应用公式d U = T d S-p d V ?O2(A) NO2气体缓慢膨胀,始终保持化学平衡NO2===NO+12(B) NO2气体以一定速度膨胀,解离出来的NO+1O2总是落后于平衡组成2O2的条件下膨胀(C) SO3气体在不解离为SO2+12(D) 水在-10℃时等温结冰5. 假定某原子的电子态有两个主要能级,即基态和第一激发态,能级差为1.38⨯10-21J,其余能级可以忽略,基态是二重简并的。
则在100 K时,第一激发态与基态上的原子数之比为:( )(A) 3 (B) 0.184 (C) 1 (D) 0.016. 下列条件哪一个错误? ( )理论上使公式ΔH p = Q p成立的条件是:(A) 封闭体系(B) 只做体积功(C) 恒压可逆(D) 等压不可逆7. 主要决定于溶解在溶液中粒子的数目,而不决定于这些粒子的性质的特性叫________。
物理化学试题答案

物理化学试题答案一、选择题1. 物理化学是研究物质的物理性质及其与化学反应关系的科学。
以下哪项不是物理化学的研究内容?A. 物质的结构B. 化学反应的速率C. 物质的热力学性质D. 生物体内的分子运动答案:D2. 在恒温条件下,理想气体的状态方程为:A. PV=nRTB. PV=nHC. U=Q+WD. G=H-TS答案:A3. 以下关于熵变的描述,哪项是错误的?A. 熵是一个状态函数B. 熵变通常用ΔS表示C. 熵增加表示系统无序度增加D. 所有自然过程都会导致系统熵的减少答案:D4. 表面张力的形成是由于:A. 分子间作用力的不平衡B. 重力的作用C. 液体与气体的相互作用D. 温度的变化答案:A5. 电解质溶液的电导率与以下哪个因素无关?A. 电解质的浓度B. 电解质的化学性质C. 溶液的温度D. 电极的材料答案:D二、填空题1. 在相同温度和压力下,气体的摩尔体积与气体的__________无关。
答案:种类2. 化学反应的平衡常数K只与__________有关。
答案:温度3. 物质的溶解度是指在一定温度下,__________溶剂中能溶解一定量的物质。
答案:100克4. 热力学第一定律表明能量守恒,即系统的内能变化等于__________和__________的总和。
答案:热量;功5. 阿伦尼乌斯方程用于描述化学反应速率常数与__________的关系。
答案:温度三、简答题1. 请简述布朗运动的物理意义及其对物理化学研究的重要性。
布朗运动是指微小粒子在流体中因受到分子碰撞而表现出的无规则运动。
这一现象直接体现了分子的热运动,是研究分子动力学和扩散现象的重要依据。
布朗运动的观察和分析有助于理解物质的微观结构和宏观性质之间的关系,对于化学动力学、胶体化学以及生物学等领域的研究具有重要意义。
2. 描述焓变和熵变在化学反应中的作用及其对反应方向的影响。
焓变(ΔH)是化学反应过程中系统与环境之间热量交换的量度,反映了化学反应的能量变化。
物化A试题

石家庄学院2012—2013学年第 一 学期《物理化学》 期末考试试卷(闭卷)系(院)化工学院__化学(本)专业_____班级_____姓名_____学号_____一、判断(本大题共10小题,每个1分,共10分)1、反应速率常数K A 与反应A 的物浓度有关( )。
2、一级反应肯定是单分子反应( )。
3、对基元反应,反应速率常数总是随温度的升高而增大( )4、连串反应的速率由其中最慢的一步决定,因此速率控制步骤的级数就是种总反应的级数( )。
5、液体的表面张力总是力图缩小液体的表面( )。
6、溶液的表面张力总是随着溶液的浓度的增大而减少( )。
7、离子独立运动定律只适用无限稀的强电质溶液( )。
8、电解质溶液的电导率是两极板为单位面积,其距离为单位长度时溶液的电导( )。
9、电解池中阳极发生氧化反应,阴极发生还原反应( )。
10、原电池在定温、定压可逆的条件下放电时,∆G 为零( )。
二、选择题(本大题共10小题,每题2分,共20分)1、某反应A →Y ,如果反应物A 的浓度减少一半,它半衰期也缩短一半,则该反应的级数为( )A 、零级;B 、一级;C 、二级;2、基元反应:H+CI 2→HCI+CI 反应分子数( )A 、单分子反应;B 、双分子反应;C 、四分子反应;D 、不能确定。
3、某反应速率常数与各基元反应的速率常数的关系为k=k 2(k 1/2k 4)2/1,则该反应的表观活化能与各基元反应活化能的关系( )。
A 、E a =E 2+1/2E 1-E 4;B 、E a =E 2+1/2(E 1-E 4);C 、E a =E 2+(E 1-2E 4)2/1;D 、不确定。
4、催化剂中毒是指催化剂( )。
A 、对生物体有毒;B 、活性减小;C 、选择性消失;D 、活性或选择性减小或消失。
5、温度与表面张力的关系( )。
A 、温度升高表面张力减小;B 、温度升高表面张力升高;C 、温度对表面张力无影响;D 、不确定6、在定温、定压下影响物质的表面吉布斯函数的因素( )。
考研物化试题及答案

考研物化试题及答案一、选择题(每题2分,共20分)1. 下列关于物质的量浓度的描述,正确的是:A. 物质的量浓度与溶液体积成正比B. 物质的量浓度与溶液质量成正比C. 物质的量浓度与溶质的摩尔数成正比D. 物质的量浓度与溶剂的摩尔数成反比答案:C2. 根据热力学第一定律,下列说法正确的是:A. 系统对外做功,内能一定增加B. 系统吸收热量,内能一定增加C. 系统对外做功,内能可能增加也可能减少D. 系统吸收热量,内能可能增加也可能减少答案:D3. 在理想气体状态方程中,下列哪个变量是温度的函数?A. PB. VC. nD. T答案:D4. 根据吉布斯自由能的定义,下列说法正确的是:A. 吉布斯自由能增加,反应自发进行B. 吉布斯自由能减少,反应自发进行C. 吉布斯自由能不变,反应处于平衡状态D. 吉布斯自由能增加,反应不自发进行答案:B5. 根据热力学第二定律,下列说法正确的是:A. 熵总是增加的B. 熵总是减少的C. 熵可以增加也可以减少D. 熵在孤立系统中总是增加的答案:D6. 根据拉乌尔定律,下列说法正确的是:A. 溶液的蒸气压与溶质的摩尔分数成正比B. 溶液的蒸气压与溶剂的摩尔分数成正比C. 溶液的蒸气压与溶质的摩尔数成正比D. 溶液的蒸气压与溶剂的摩尔数成正比答案:B7. 根据亨利定律,下列说法正确的是:A. 气体的溶解度与压力成正比B. 气体的溶解度与压力成反比C. 气体的溶解度与温度成正比D. 气体的溶解度与温度成反比答案:A8. 根据阿伏伽德罗定律,下列说法正确的是:A. 在相同温度和压力下,不同气体的体积与摩尔数成正比B. 在相同温度和压力下,不同气体的体积与摩尔数成反比C. 在相同温度和压力下,不同气体的体积与摩尔数无关D. 在相同温度和压力下,不同气体的体积与摩尔数成正比,但与温度无关答案:A9. 根据范特霍夫方程,下列说法正确的是:A. 反应的平衡常数与温度无关B. 反应的平衡常数与温度成正比C. 反应的平衡常数与温度成反比D. 反应的平衡常数与温度的关系取决于反应的焓变答案:D10. 根据化学动力学原理,下列说法正确的是:A. 反应速率与反应物浓度无关B. 反应速率与反应物浓度成正比C. 反应速率与反应物浓度成反比D. 反应速率与反应物浓度的关系取决于反应级数答案:D二、填空题(每题2分,共10分)1. 理想气体的摩尔体积是________。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
()6.在绝热体系中,发生一个从状态A→B的不可逆过程,无论用什么方法,体系再也回不到原来的状态了。
()7.某一化学反应的热效应除以反应温度T,即得此ห้องสมุดไป่ตู้应的△rSm。
()8.对于绝热系统,可以用△S≥0判断过程的方向和限度。
()9.对理想气体反应,定温定容下添加惰性组分时,平衡不移动。
得分
评阅人
三、填空题(1-4题每题3分、5-8每题2分,共20分)
1、液体水在100℃, 下气化为水蒸气,此过程的
△H0,ΔS0,ΔG0(填“>”、“<”或“=”)
2、用吉布斯函数作判据的应用条件是、、。
3、5mol理想气体在25℃下由0.1Mpa压缩到1Mpa,此过程的△G=,△A=,△S=。
4、NaHCO3(s)在真空容器中部分分解为Na2CO3(s)、H2O(g)和CO2(g)达平衡时,该系统C=,P=,F=。
T2=2T1;(2)绝热可逆膨胀到T3,使T3=T1;(3)等温可逆压缩回到始态。试计算每步及整个循环过程的Q,W,△U,△H。已知Cv,m=2.5R。(8分)
3、银可能受到H2S(g)的腐蚀而发生下面的反应:
H2S(g)+2Ag(s)→Ag2S(s)+H2(g)
今在298K和标准压力Pθ下,将银放在等体积的氢和H2S组成的混合气体中。
()10.依据相律,纯固体熔点为一定值。
得分
评阅人
二、选择题(每题2分,共16分)
1、当环境向系统放热时,系统的热力学能将()
A、增加B、减少C、不能确定
2、焓的定义式中H=U+pV,式中的p代表()
A、体系的总压B、体系中各组分的分压C、外压
3、非理想气体在绝热条件下,向真空膨胀后,下述答案中不正确的是()
试卷编号:( A )卷
课程编号:H55030042课程名称:物理化学(上)考试形式:闭卷
适用班级:化工061、化工062姓名:学号:班级:
学院:专业:考试日期:
题号
一
二
三
四
五
六
七
八
九
十
总分
累分人签名
题分
20
16
20
38
6
100
得分
考生注意事项:1、本试卷共5页,请查看试卷中是否有缺页或破损。如有立即举手报告以便更换。
得分
评阅人
四、计算题(共38分)
1、1mol水在100℃、101325pa下变成同温同压下的水蒸汽,然后定温可逆膨胀4×104pa,求整个过程的Q、W、△U、△H、△G和△S。已知水的摩尔汽化焓是40670J/mol(16分)
2、1mol,101.3Kpa,0℃的理想气体经以下三步组成一个循环过程:(1)等容加热到T2,使
得分
评阅人
2、考试结束后,考生不得将试卷、答题纸和草稿纸带出考场。
一、是非题(每题2分,共20分)
()1. 298.15K时,H2(g)的标准摩尔燃烧焓与H2O(l)的标准摩尔燃烧焓量值上相等。
()2.绝热过程都是定熵过程。
()3.系统经历一个不可逆循环过程,其△G<0。
()4.功可以全部变成热,但热不能全部转化为功。
得分
评阅人
五、相图题。(6分)
标出下图Mg(A)-Ca(B)系统的相区,描绘系统点a、b的步冷曲线,指明步冷曲线上转折点或停歇点处系统的相态变化。
A、ΔS=0 B、ΔG=0 C、ΔU=0
7、根据克拉贝龙方程可判断水的凝固点随压力增大将()
A、上升B、下降C、不变
8、若A与B可形成理想液态混合物,在一定温度下,纯A、纯B的和蒸气压PB*<PA*,当混合物的组成为0<xB<1,则在其沸点-组成图上的汽液两相平衡区呈平衡的汽液两相组成必有()。
A、yB>xBB、yB= xBC、yB< xB
6、对固体物质而言,若温度升高时,其蒸气压将;若外压增大时,其蒸气压将。
7、A与B可形成理想液态混合物,50℃时PA*=0.357×105pa,PB*=0.315×105pa,则50℃且xA=0.25,混合物的蒸汽压p=,平衡气相组成yB=。
8、1molN2(T,P,V)与1molO2(T,P,V)混合后(两种气体均视为理想气体),若混合气体的终态为(T,P,2V)时,则混合熵变ΔS=;若混合气体的终态为(T,2P,V)时,则混合熵变ΔS=。
(1)试问是否可能发生腐蚀而生成硫化银?
(2)在混合气中,硫化氢的百分数低于多少,才不致发生腐蚀?
已知:298K时,Ag2S(s)和H2S(g)的标准生成吉布斯自由能分别为-40.26kJ.mol-1和-33.02 kJ.mol-1。(6分)
4、在400~500K间,反应PCl5(g)→PCl3(g)+Cl2(g)的ΔrGθm与T的关系为:ΔrGθm/(J.mol-1)=83.68×103-14.52(T/K) ln(T/K)-72.26(T/K),(1)在450K时将PCl5(g)放入抽空的容器中,若平衡时的总压力为101325Pa,试计算PCl5(g)的转化率;(2)计算450K时该反应的ΔrSθm和ΔrHθm。(8分)
A、Q=0 B、△U=0C、△H=0
南昌大学2007~2008学年第一学期期末考试试卷
4、S的标准摩尔燃烧热与下列物质的标准摩尔生成热相等的是()
A、SO B、SO2C、SO3
5、当理想气体反抗一定的压力作绝热膨胀时,则()
A、焓总是不变B、焓总是增加C、热力学能总是减少
6、在绝热密闭的刚性容器内进行的化学反应,其()
