第9章电化学技术概要
第九章++电位法和永停滴定法(人卫第8版)

第三节 直接电位法
直接电位法
Direct Potentiometric Method
• 选择合适的指示电极与参比电极,浸入待测溶液中组成 原电池,测量原电池的电动势,根据Nernst方程直接求 出待测组分活(浓)度的方法。
原电池
Zn棒 V Cu棒
CuSO4
ZnSO4
电解池:Daniell电池
V Zn棒
Cu棒
盐桥
ZnSO4
CuSO4
化学电池
• •
原电池:电极反应自发进行,化学能转变为 电能。 电解池:电极反应不能自发进行,必须有外加电压电极 反应方可进行,电能转 变为化学能的装置。
原电池与电解池的比较
原电池
作用 条件 电极名称 电极反应 电子流动 方向 化学能转变为电能 电极反应可自发进行
根据在滴定过程中电池电动势的变化来确定滴定终点的一
类滴定分析滴定装置
1.滴定管 2.参比电极 3.指示电极
4.电磁搅拌器 5.电子电位计
二、滴定终点的确定
(一)图解法
• • •
E-V曲线法
ΔE/ΔV-V曲线法
Δ2E/ΔV2-V曲线法
(二)二阶导数内插法
例
•
加入11.30ml滴定剂时,Δ2E/ΔV2=5600;加入11.35ml时,
二、指示终点的三种电流变化曲线
第一节 电化学分析法概述
一、电化学和电分析化学
Electrochemistry and Electroanalytical Chemistry • 电化学:将电学与化学有机结合并研究二者之间相互关系 的一门学科。 • 电分析化学:依据电化学原理和物质的电化学性质建立的 一类分析方法。
第九章 电化学(电解质溶液)..

H e 1
1 H2 2
HCl水溶液
9
在(+)极液面接界处则 发生反应
Cl Cl2 e1
不断放出电子,可以看作 电子不断由溶液流出,进 入金属导体,电流从此流 过。 整个效果:电子仍然从负 极有电子流入溶液而又在 正极流出,这就构成了整 个回路中连续的电流 ,电 极反应使得电流在导体/ 液体接界面得以流通。
温度、溶液浓度、外加电场的电场强度
31
三、 离子的电迁移率u
离子的运动速率与外电场强度E的一般关系:
dE dE u u dl dl
u称为离子的电迁移率(有时称为离子淌度) 离子的电迁移率u:某离子在指定溶液中在 电场强度E=1V/m时的运动速率。m2 s1 V1
当通电结束,阴、阳两极部溶液浓度相同,但比原溶 液各少了2mol,而中部溶液浓度不变。
26
(2)正负离子运动速率不相同(+= 3-)
设正离子迁移速率是负离子的三倍, υ+=3υ-,则正 离子导3F电量,负离子导1F电量。在假想的AA、 BB平面上有3mol正离子和1mol负离子逆向通过。
度加快,在水溶液中离子水化作用减弱等
原因,电阻下降
导电总量分别由正、负离子分担
5
2. 电池 由第一类导体联结两个电极并使电流在两极间 通过,构成外电路的装置叫做电池。
3. 原电池 电池能自发地在两极上发生化学 反应,并产生电流,将化学能转 变为电能的装置称为原电池。
4. 电解池 将电能转变为化学能的装置。
18
*电流效率
实际电解过程中,电极上常发生副反应或次级反应,析出一定 数量的某一物质时所消耗的电量要比按照法拉第定律计算所需 的理论电量多一些。此两者之比称为电流效率,通常用百分数 来表示。
(完整版)电化学基础知识点总结

(完整版)电化学基础知识点总结电化学是研究化学变化与电能之间的相互转化关系的科学,是现代化学的一个重要分支。
以下是关于电化学基础知识点的一篇完整版总结,字数超过900字。
一、电化学基本概念1. 电化学反应:指在电池或其他电解质系统中,化学反应与电能之间的相互转化过程。
2. 电化学电池:将化学能转化为电能的装置。
电池分为原电池和电解池两大类。
3. 电池的电动势(EMF):电池两极间的电势差,表示电池提供电能的能力。
4. 电解质:在水溶液中能够导电的物质,分为强电解质和弱电解质。
5. 电解质溶液:含有电解质的溶液,具有导电性。
6. 电极:电池中的导电部分,分为阳极和阴极。
二、电化学基本原理1. 法拉第电解定律:电解过程中,电极上物质的得失电子数量与通过电解质的电量成正比。
2. 欧姆定律:电解质溶液中的电流与电阻成反比,与电势差成正比。
3. 电池的电动势与电极电势:电池的电动势等于正极电极电势与负极电极电势之差。
4. 电极反应:电极上发生的氧化还原反应。
5. 电极电势:电极在标准状态下的电势,分为标准电极电势和非标准电极电势。
6. 活度系数:溶液中离子浓度的实际值与理论值之比。
三、电极过程与电极材料1. 电极过程:电极上发生的化学反应,包括氧化还原反应、电化学反应和电极/电解质界面反应。
2. 电极材料:用于制备电极的物质,分为活性物质和导电物质。
3. 活性物质:在电极过程中发生氧化还原反应的物质。
4. 导电物质:提供电子传递通道的物质。
5. 电极结构:电极的形状、尺寸和组成。
四、电池分类与应用1. 原电池:不能重复充电的电池,如干电池、铅酸电池等。
2. 电解池:可重复充电的电池,如镍氢电池、锂电池等。
3. 电池应用:电池在通信、交通、能源、医疗等领域的应用。
五、电化学分析方法1. 电位分析法:通过测量电极电势来确定溶液中离子的浓度。
2. 伏安分析法:通过测量电流与电压的关系来确定溶液中离子的浓度。
3. 循环伏安分析法:通过测量电流与电压的关系来研究电极过程。
电化学

例:电位滴定法确定酸碱滴定的终点
乌梅
【含量测定】
取本品最粗粉约4g,精密称定,置锥形瓶中, 精密加水100ml,加热回流4小时,放冷,滤过, 弃去初滤液,收集续滤液。精密量取续滤液 20ml,加水至80ml,照电位滴定法,用氢氧化 钠滴定液滴定,即得。
本品含有机酸以枸橼酸计,不得少于15.0%。
5
§1 基本原理 一、Nernst方程
注 意: cOx、cRed 包括了所有参加电极反应的物质 固体或液体的活度定为1
6
二、化学电池
(一)分类(根据电极反应是否能自发进行) 1.原电池:将化学能转化为电能的装置(自发进行) 应用:直接电位法,电位滴定法 2.电解池:将电能转化为化学能的装置(非自发进行) 应用:永停滴定法
电流取决于浓度较低的 一方
37
二、基本概念 1、可逆电对:I2/I- ,外加很小电压就能电解
不可逆电对:S4O62-/ S2O32-,外加很大电压才能电解 2、可逆电对:电流取决于浓度小的型体
[Ox]=[Red]时电流最大 不可逆电对:无电流
38
三、分类: 根据滴定过程的电流变化,分为3种类型
VSP
Fe3+ + e → Fe2+
( ) f = f q + 0.059 lg aFe3+ aFe2+
应用:测定氧化型、还原型浓度或比值
10
4.膜电极(离子选择电极) 以固体膜或液体膜为传感体,用以指示溶 液中某种离子浓度的电极 应用:测定某种特定离子 例:测量溶液pH用的玻璃电极;各种离子选择 性电极
40
小结 玻璃电极的使用注意事项 pH计的使用步骤 电位法指示终点的原理(内插法) 永停滴定法终点的确定
电化学第九章金属的电沉积过程

添加剂的影响
添加剂可以改变溶液的电导率、界面张力和金属离子的还原过程,从而影响电沉 积过程。
常用的添加剂包括络合剂、缓冲剂、表面活性剂等。
温度的影响
温度可以影响电沉积过程的反应速率和产物形貌,通常随着温度的升高,电沉积速率加快。
但温度过高可能导致析出金属结构松散和溶液中气体的大量析出。
04
CATALOGUE
总结词
镀镍是一种具有优良防腐蚀性能的金属 电沉积技术,具有较低的孔隙率和较高 的硬度和耐磨性。
VS
详细描述
镀镍层呈银白色,具有良好的抗腐蚀和抗 磨损性能,广泛应用于电子、电力、石油 化工和航空航天等领域。在镀镍过程中, 应控制电流密度、电镀液成分和温度等参 数,以确保获得高质量的镀层。
镀金
总结词
镀金是一种具有优良导电性能和抗氧化性能 的金属电沉积技术,具有美观的外观和良好 的延展性。
电化学第九章金属 的电沉积过程
目录
• 电沉积过程的基本原理 • 金属电沉积的种类与特性 • 电沉积过程的影响因素 • 电沉积的应用领域 • 电沉积技术的发展趋势与展望
01
CATALOGUE
电沉积过程的基本原理
电沉积的定义
总结词
电沉积是指通过在电解液中施加电流,使金属离子还原并沉积在阴极表面上的过程。
03
CATALOGUE
电沉积过程的影响因素
金属离子的影响
金属离子浓度
金属离子浓度越高,电沉积速率越快,但过高的浓度可能导致析 出金属颗粒粗大。
络合剂
络合剂可以控制金属离子的水解和聚合,从而影响电沉积过程。
金属离子的电荷和半径
金属离电沉积过程。
流电沉积和脉冲电沉积。
电沉积的物理化学基础
化学分析中电化学分析的基本原理与技术

化学分析中电化学分析的基本原理与技术在近代科技的发展中,电化学技术已经成为化学分析的重要工具之一。
电化学分析利用电化学现象来检测物质的性质和组成,具有快速、灵敏、准确、可靠、简便、经济等优点。
因此,在现代化学分析中,电化学分析已经成为不可或缺的重要分析方法之一。
一、电化学分析的基本原理电化学分析是通过电化学反应来检测分析物或样品中的化学成分。
电化学反应是指化学反应在电极表面的反应,这种反应导致电极电势的变化。
电化学反应分为氧化还原反应和非氧化还原反应两种。
(一)氧化还原反应氧化还原反应是指物质中某些原子的氧化态和还原态之间的转化。
在化学反应中,可以将一种物质氧化成另一种物质,也可以将一种物质还原成另一种物质,这种氧化还原反应常常伴随着电子的转移。
具体来说,就是某种物质(还原剂)通过将自身氧化来得到足够的电子,以便还原另一种物质(氧化剂)。
在这个过程中,被氧化的还原剂变成了氧化剂,而被还原的氧化剂变成了还原剂。
这种反应在电极表面进行,会产生一定的电势。
(二)非氧化还原反应非氧化还原反应是指化学反应中电子不参与的反应。
这种反应通常是在电极表面产生化学物质的吸附或解吸过程,或是通过离子对的移动和物质的扩散来实现。
非氧化还原反应通常与电势的变化相关。
二、电化学分析的技术电化学分析技术主要包括极谱法、电位滴定法、电化学滴定法、电化学测量法和电位分析法等。
(一)极谱法极谱法是指利用电极的电势和电流实现对分析物的检测和分析。
极谱法通常用于检测较小的分析物浓度,而且不需要太多的样品。
极谱法分为直接极谱法和间接极谱法两种。
直接极谱法是将分析物电化学还原或氧化成为生成物或还原物,并将其在电极上检测的一种电位法。
直接极谱法分为阴极极谱法和阳极极谱法。
阴极极谱法一般用来检测具有弱氧化性能的分析物,而阳极极谱法则用来检测具有强氧化性能的分析物。
间接极谱法是通过观察在电极上形成的有机分子的电化学反应来检测分析物。
间接极谱法具有应用范围广,实验操作简单,适用于分析种类不同、结构复杂的分析物。
高中化学第九章 电化学基础 Word版含答案

第九章电化学基础考点集训(二十七)第27课时原电池化学电源1.某小组为研究原电池原理,设计如图装置,下列叙述正确的是A.装置Ⅰ,铜片上有O2逸出B.装置Ⅰ,锌片溶解,发生还原反应C.装置Ⅱ,电池反应为:Zn+Cu2+===Zn2++CuD.装置Ⅱ,外电路中,电子从铜电极流向锌电极2.将Al片和Cu片用导线相连,一组插入浓HNO3溶液中,一组插入稀NaOH溶液中,分别形成原电池,则在这两个原电池中,正极分别为A.Al片、Cu片B.Cu片、Al片C.Al片、Al片D.Cu片、Cu片3.随着各地“限牌”政策的推出,电动汽车成为汽车届的“新宠”。
特斯拉全电动汽车使用的是钴酸锂(LiCoO2)电池,其工作原理如图,A极材料是金属锂和碳的复合材料(碳作为金属锂的载体),电解质为一种能传导Li+的高分子材料,隔膜只允许Li+通过,电池反应式Li x C6+Li1-x CoCO2放电C6+LiCoCO2。
下列说法不正确...的是A.放电时Li+从左边流向右边B.放电时,正极锂的化合价未发生改变C.放电时B电极反应式为:Li1-x CoO2+x Li++x e-===LiCoO2D.废旧钴酸锂(LiCoO2)电池进行“放电处理”让Li+进入石墨中而有利于回收4.如图所示,杠杆AB两端分别挂有体积相同、质量相等的空心铜球和空心铁球,调节杠杆并使其在水中保持平衡,然后小心地向烧杯中央滴加浓CuSO4溶液,一段时间后,下列有关杠杆的偏向判断正确的是(实验过程中,不考虑铁丝反应及两球的浮力变化) A.杠杆为导体和绝缘体时,均为A端高B端低B.杠杆为导体和绝缘体时,均为A端低B端高C.当杠杆为绝缘体时,A端低,B端高;为导体时,A端高,B端低D.当杠杆为绝缘体时,A端高,B端低;为导体时,A端低,B端高5.镁及其化合物一般无毒(或低毒)、无污染,且镁原电池放电时电压高而平稳,越来越成为人们研制绿色原电池的关注焦点。
其中一种镁二次电池的反应为:x Mg+Mo3S4放电Mg x Mo3S4,下列说法正确的是A.电池放电时,Mg2+向负极迁移B.电池放电时,正极反应为:Mo3S4+2x e-+x Mg2+===Mg x Mo3S4C.电池充电时,阴极发生还原反应生成Mo3S4D.电池充电时,阳极反应为x Mg-2x e-===x Mg2+6.下图为两个原电池装置图,由此判断下列说法错误的是A.当两电池转移相同电子时,生成和消耗Ni的物质的量相同B.两装置工作时,盐桥中的阴离子向负极移动,阳离子向正极移动C.由此可判断能够发生2Cr3++3Ni===3Ni2++2Cr和Ni2++Sn===Sn2++Ni的反应D.由此可判断Cr、Ni、Sn三种金属的还原性强弱顺序为:Cr>Ni>Sn7.美国圣路易斯大学研制了一种新型的乙醇电池,它用磺酸类质子溶剂,在200 ℃时供电,乙醇电池比甲醇电池效率高出32倍且更安全。
09第九章 电分析化学法导论

9-5-1 浓差极化
有电流通过时,电 极表面电活性物质的 消耗若得不到有效补 充,电极电位将变得 与平衡电位不同。此 称浓差极化
平衡电位 指由Nernst方程按 本体溶液浓度计算 得到的电位。
9-5-1 浓差极化
对于还原反应,浓差极化将使电极电位变得更负。对于氧化反应, 浓差极化将使电极电位变正。
AgCl /Ag AgCl /Ag
'
RT ln aCl F
甘汞电极 Hg Hg2Cl2(s) KCl(a=xmol/L)
SCE 0.242
将Pt插入汞与甘汞的糊状物中,内充液多为饱和KCl,也可为0.1 或1.0mol/LKCl。内充液一般用Hg2Cl2饱和。盐桥为充满内充液的 多孔陶瓷。
9-5-3 超电位
由于极化,使实际电位和可逆电位之间存在差异 ,此差异即为 超电位 对于阳极和阴极,分别有阳极超电位a和阴极超电位c。对于单个 电极,超电位为浓差超电位和电化学超电位之和
= 浓差+电化
9-5-3 超电位
影响因素: a) 电流密度,
b) T,
c) 电极化学成份不同,不同。与电活性物质和电极材料 亲和力有关
≈ 右 - 左≈ c - a
当E>0,为原电池;E<0为电解池。
9-2 液接电位与盐桥
9-2-1 液接电位 Ej
因各离子迁移速度不同而产生 对于类型1的1:1型电解质接界:
RT a1 E j t t ln F a2
设a1=0.01,a2=0.1。则t+=0.83、t-=0.17, 25 ℃时
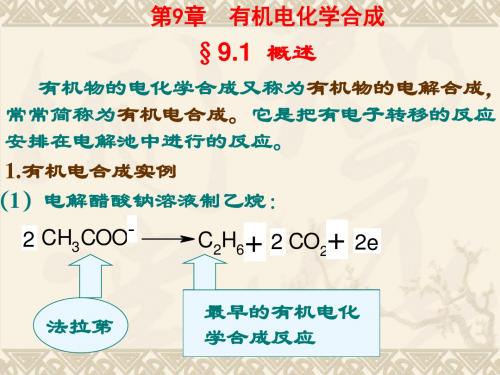
第9章 有机电化学合成
+e
A*
活性中心
9.3.3 电化学聚合
2、电聚合机理 : 链增长: A* + R
R*
A + R* R* 2 R* 2+ R R* 3
+R
链终止:末端活性基团通过复合反应或歧化反应 失去活性而终止聚合过程。
通过改变电极材料、溶剂、支持电解质、pH值 或电聚合方式可以获得不同结构和性能的功能高 聚物材料;通过控制电解条件可以改变高聚物的 聚合度和相对分子质量。
H 3C SO 3NEt
C阴极 CH3
OH2 HOAc NaBF4 C Cr2O3 CH3 CHO
+
COOH
9.4.1 官能团变换反应
3、杂环化合物电氧化:
CH3OH NaBr O C 阳极 MeO O OMe CH2 COOH CH2 COOH
H2SO4 O CHO PO2 阳极
CHCOOH 阳极 CHCOOH HCCHO HC HC CHOH COOH NH2 +
H2 C O
O
CH2 + 2e
双键还可电氧化为酮:
H3 CCH CHCH3 + OH2
H3 CCCH2 CH3 + 2 H + + 2e
§9.4 有机电合成反应
9.4.1 官能团变换反应
2、芳香族化合物电氧化
生成醌:
O 阳极
+
2 OH2
+
O
6H+ + 6e
OAc
酰氧基化: CH3 甲氧基:
HOAcCH2 CH2 CH2NHOAc C 聚丙烯阳极 CH2OAc HOAc , CH3
第9章 有机电化学合成
分析化学第九章电化学分析概论(大学课件)

二. 现代电化学分析的特点及发展趋势
时间和空间上体现“快 小”:仪器袖珍化,电极微型化
(1)化学修饰电极(chemically modified electrode) (2)生物电化学传感器(Biosensor) 生命过程的模拟研究,生命过程的氧化还原反应类似电 极上的氧化还原,用电极膜上反应模拟生命过程,可 深 化认识生命过程。 (3)光谱一电化学方法 ( Electrospectrochemistry) (4)超微电极(Ultramicroelectrode) 活体现场检测(无损伤分析 )
(2)液体接界电位与盐桥
在两种不同离子的溶液或两种不同浓度的溶液接触界 面上,存在着微小的电位差,称之为液体接界电位。 液体接界电位产生的原因:各种离子具有不同的迁移速率 而引起。
二、仪器分析方法的分类
Classification of instrument analytical method
光分析法 电化学分析法 仪器分析 质谱分析法
色谱分析法
分析仪器联用技术
热分析法
电化学分析方法的分类
Classification of electrochemical analysis 电导分析法 电位分析法 电化学分析法 电解分析法
(Galvanic cell) 阳极:发生氧化反应的电极(负极); 阴极:发生还原反应的电极(正极); 阳极≠正极 阴极≠负极 电极电位较正的为正极 (Electrolytic cell ) 阳极:发生氧化反应的电极(正极);
阴极:发生还原反应的电极(负极);
阳极=正极 阴极=负极
2.电极电位与液接电位
(5)微型计算机的应用Fra bibliotek30 25 20 15 b a c
I/
9第9章 电分析化学法导论

9-2-2 盐桥-液接电位的消除
盐桥中KCl浓度相应的液接电位
KCl盐桥作用
0.01mol· L-1 0.1mol· L-1
CKCl/ mol· L-1 0.1 0.2 0.5 1.0 2.5 3.5 饱和
液接电位/ mv 27 20 13 8.4 3.4 1.1 <1
液 1.2mV
作用:隔离、接通电路、减小液接电位
① H+ + e = H
② H+ H+ =H2+ 慢,决定整个反应速度
③ H2++e=H2↑ 要使反应 ② 加快,必须增加活化能,使
φc→负
9-5-3 超电位
定义:由于极化,使实际电位和可逆电位之间存在差异,此
差异即为 超电位
影响因素: ⑴电流密度, ⑵T, ⑶电极材料不同,不同 ⑷产物是气体的电极,其大,析出物为金属其小
第9章 电分析化学法导论
9-1 电化学电池
9-2 9-3 9-4 9-5 9-6
液体接界电位与盐桥 电极电位 一般电极反应过程 电极的极化和超电位 电极的类型
电分析化学法
又称电化学分析法---
应用电化学原理和实验技术建立起来的一类分析方
法的统称。 依据被测物溶液的电化学性质及其变化而建立起来 的分析方法。 根据电学参数可分为:电导法、电位法、电解分析法、 库仑分析法、伏安法和极谱法等
1.反应中的氧化剂与还原剂必须分隔开来,不能使其直接 接触,并保持两种溶液都处于电中性
2.电子由还原剂传递给氧化剂,要通过溶液之外的导线 (外电路) 反应装置-电化学电池(化学电池)
9-1-1 原电池与电解池
1.原电池 (以Cu-Zn原电池为例) 自发地将本身的化学能转变成电能的装置-化学电池
分析化学 第9章

一、参比电极 1. 甘汞电极 由Hg-Hg2Cl2-KCl组成的电极, 构造如图:
导线 绝缘帽 加液口
Pt丝
汞 - … .... - ... - -------------- -----汞和甘汞混合物 多孔物质 KCl溶液
多孔物质
电极反应 Hg2Cl2+2e 2Hg+2Cl电极电势: RT ln 1 ø (Hg2Cl2/Hg)= (Hg2Cl2/Hg)+ 2F a2(Cl-) RT -) ø ln a (Cl = (Hg2Cl2/Hg) F 25℃,值与KCl浓度的关系:
|
|
G- Na+
浸泡(具有响应H+的功能)后,表面形成 水合硅胶层,Na+被H+取代
G-Na+ + H+ → Na+ + G-H+
外表面与试液间形成相界电势外 内表面与内参比溶液间也形成相界电势内
膜 = 外- 内
玻璃膜 Na+
内水合 内参 比液 硅胶层 -4mm + 10 a(H 内) 干玻璃层 0.1mm 外水合 硅胶层 10-4mm 外部溶液 a(H+外)
指示电极(-) 参比电极(+) cr,x= cr,s×10±△E/S 对阳离子取“-” 对阴离子取“+”
*
浓度的单位为mol· L-1 ; 0.0592V 25℃, △E单位为V ,S= Z Z为待测离子电荷数。
例:25℃,氟电极(负)与饱和甘汞电极(正), 放入1.0×10-3moL · L-1 F- 溶液, Es= -0.159V;放入未知溶液时, Ex= -0.212V,未知溶液的pF是多少? 解: S= 0.0592V/1=0.0592V
电化学技术

电化学技术
电化学技术是一种以电源为能源,以电极反应为过程,由电解质所发生的化学变化而从事的化学工程技术。
其基本特点是以涉及电极电位、电流密度和质量转移等电化学特性,以及交流电源、直流电源、脉冲电源、恒定电位源和恒定电流源等电解技术为主要内容。
电化学技术可以用来制造电池、制备纯净的金属,控制化学反应的方向和速度等。
它还可以应用于电池制造工艺上,以实现电池的质量控制,提高电池的能量密度,提高充电效率,延长电池的使用寿命。
电化学技术也被广泛应用于环境保护、污染防治等领域,可以用于脱除水生物中的污染物,减少工业废水中污染物的排放。
电化学技术及其基本原理

电化学技术及其基本原理
《电化学技术及其基本原理》
本文将介绍电化学技术及其基本原理。
首先,我们要了解电化学的定义。
电化学是一门研究电子流和电荷运动的物理学和化学科学。
它既关注电子流的流动规律,也关注化学反应的产物。
电化学的基本原理是电荷的移动。
个体之间的电荷会从高电势附近移动到低电势附近,从而在两处产生剩余电势的差异,这称为电势势差或电压。
当化学反应发生时,电荷移动会产生电势势差,这可以产生电流,并将其输送给其他地方。
此外,电化学的基本原理还涉及到电解质的极化,即电解质中的阳性电荷和阴性电荷之间的差异。
电解质的极化可以用电压来表示,也可以用电流来表示,这种极化可以增加电流的强度,从而激发电荷移动,最终形成电势势差。
电势势差又称为电位差,是电荷在电路中流动的能量。
它可以显示在电路中存在一定的电能。
但是电位差的实际大小受到电路电阻的影响,它会直接影响电流的流速。
而当电位差增加时,电流流速也会相应增加,最终可以使电路的电压增加。
以上就是关于电化学技术及其基本原理的简要介绍,希望能为您提供参考。
- 1 -。
电化学技术及其基本原理

电化学技术及其基本原理x《电化学技术及其基本原理》第1章介绍1.1电化学技术简介电化学技术是一种日益重要的技术,它是指在电池、电容、催化剂和其他电化学设备中引入电能,以实现各种电化学过程的技术。
它主要应用于催化剂的研究、金属的氧化阳极保护、太阳能电池的研制、电池充电和电池的制造等领域。
1.2电化学技术基本原理电化学技术主要依靠两种反应,即还原反应和氧化反应,来实现电子在物质内的转移。
在这两种反应中,氧化反应是一种物质源头中电子的放出,而还原反应则是向物质源头中输入电子。
传统的电化学反应(以氢氧化钠为例)是由氢氧化物中的阴离子排出电子,经固定电位迁移至氧化物中,形成氧化物中的阳离子,而这些阴离子就是传统的还原反应。
此外,通过电源和电路来控制电位,可以实现复杂的电化学过程。
1.3电化学技术发展状况随着科技的发展,电化学技术正在发展,受到人们越来越高的重视。
电池的发展:电池的发展已使其变得更加完美。
新型电池,如锂电池、钛酸锂电池和二次电池等,可以提供更大的电力量和更长的使用寿命。
催化剂的发展:催化剂是电化学反应过程中一种重要的物质,新型催化剂可以提高反应的效率和速率,更好地满足电子传递的需求。
电容器的发展:新型电容器可以提供更多的电能,可以更好地支持电化学设备的发展。
除了上述技术的发展外,电化学技术也在其他领域受到越来越多的重视,如能源储存和节能减排等。
第2章催化剂2.1 催化剂的结构与功能催化剂本质上是一种活性因子,其作用是促进或阻止特定化学反应的发生,从而改善反应的速率和效率。
催化剂的结构主要有三种:一是块状的催化剂,二是液体的催化剂,三是固体的催化剂,它们可以分别用于不同的反应条件。
2.2 催化剂的种类催化剂有很多种,例如有机催化剂、无机催化剂、金属催化剂、介孔催化剂等。
有机催化剂是指以有机分子为核心结构,由非金属原子组成的化合物,是一种常用的催化剂。
无机催化剂是一种以原子、分子或小分子团簇为核心结构的化合物,它们由金属和非金属元素组成。
电化学知识点总结

电化学知识点总结电化学是研究电能转化为化学能,或者化学能转化为电能的科学与技术。
它是电学和化学的交叉学科,广泛应用于电池、蓄电池、电解槽、电解质溶液、腐蚀等领域。
下面将介绍电化学的几个重要知识点。
第一个知识点是电化学电池。
电化学电池是电化学系统的核心。
电池分为两个电极,一个是阳极,一个是阴极。
在电化学电池中,阳极是发生氧化反应的电极,阴极是发生还原反应的电极。
当两个电极通过导电介质连接后,阳极上发生氧化反应,产生电子,并且在阴极上发生还原反应,消耗电子。
这样就形成了电池中的电流。
常见的电化学电池包括原电池、库仑电池、氢燃料电池等。
第二个知识点是电化学反应动力学。
电化学反应动力学是研究电化学反应速率的科学。
在电化学反应中,有两个重要的动力学参数,一个是电极电势,一个是交换电流密度。
电极电势是指电极与溶液之间的电势差,是衡量反应进行方向和程度的重要指标。
交换电流密度是指电极界面上电子从电极向溶液传输的电流密度,是反应速率的决定因素之一。
电化学反应动力学的研究对于揭示反应机制、优化反应条件具有重要意义。
第三个知识点是电化学电容器。
电化学电容器是利用电荷在电介质中的吸附和解吸附现象储存电能的装置。
常见的电化学电容器包括超级电容器和电化学锂离子电容器。
超级电容器具有高能量储存密度和高电荷-放电速率的特点,被广泛应用于电动车、电池管理系统等领域。
电化学锂离子电容器则利用锂离子在电极材料中的嵌入和脱嵌过程储存电能,具有高能量密度和长循环寿命的优点。
第四个知识点是电化学腐蚀。
电化学腐蚀是指金属在电解质溶液中遭受的腐蚀现象。
在电化学腐蚀中,金属表面存在阳极和阴极两个区域,阳极区发生氧化反应,金属离散为阳离子并且溶解入电解质溶液中,而阴极区发生还原反应,电子从电解质溶液传输到金属表面。
这样就形成了电流,产生腐蚀作用。
电化学腐蚀是金属材料破坏的主要原因之一,研究电化学腐蚀对于预防腐蚀具有重要意义。
以上就是电化学知识的一些重要点的简要总结。
分析化学 第9章 电势分析法

|
|
没有可供交换的电荷点,
对各种离子无响应。 其中加入氧化物(如Na2O)后, 原结构断裂, 成为:
| — Si — O- Na+
Na+和H+可 交换, 故对 H+有响应。 可测pH1~9
|
范围。
若在 SiO2 玻璃中加入 Li2O, 制成锂玻璃电极, 可测 pH 1 ~ 14 。 ②玻璃电极的响应机理
Ag,AgCl|内充液|玻璃膜膜|试液|液|K接Cl(饱和)|Hg2Cl2,Hg
|
玻璃电极
| | 甘汞电极 |
液接为液接电势 liquid junction potential
是两种组成不同或浓度不同的溶液接触界
面上,由于溶液中正、负离子扩散、通过界 面的迁移率不等而产生的接界电势差。
使用盐桥并用多孔陶瓷等为渗透材料 可使液接部位流速均匀,使液接电势在 一定条件下为恒定值(1~2mV)。
玻璃电极用前须在水中浸泡一天以上, 使发生如下交换反应:
H+ + Na+Gl- Na+ + H+ Gl-
代表硅酸根
硅酸
致使玻璃表面几乎全由硅酸(H+Gl-)组成。 玻璃内表面也已发生同样过程。(因为已填充有
0.1 mol ·L-1 HCl)
两表面中间为干玻璃层(未与 H+ 交换的玻璃)
(浸泡后的玻璃电极的三层结构见下图:)
电极(原电极与透气
膜组合而成)
酶电极 如氨基酸酶电极等
4. 离子选择电极的电极电势公式 (1) 膜电势 film potential 以 pH 玻璃电极为例
(玻璃电极如下图:)
(0.1mol/LHCl)
第9章电化学技术概要

四、PCO2 电极的工作原理
PCO2电极是气敏电极(gas sensing electrode),是
由pH玻璃电极和银-氯化银电极组装在一起的复合电
极。
电解质分析仪
电解质分析仪(electrolyte analyzer) : 采用离子选择性电极(ISE)测量溶液中离 子浓度的仪器 。 测定指标: 生物样品中的K+、Na+、Cl-、 Ca2+、Li+、pH值等。
离子极----主要有K+、Na+、Li+、Ca2+、
Cl-、pH和pCO2 电极
伏安型传感器----主要是PO2 电极
一般的血气分析仪使用四支电极: pH 电极 PCO2 电极 PO2 电极 pH 参比电极。
1.pH电极和pH参比电极
血气分析仪使用毛细管pH玻璃电极和甘汞电极测量溶液的
酸碱度。
液体界面 PH敏感玻璃膜 液体界面
二、电解质分析仪的结构
(一)湿式电解质分析仪
基本组成
湿式电解质分析仪
离子选择性电极 参比电极 分析箱 测量电路 控制电路 驱动电机 显示器
结构框图
分 析 Na电极 K电极 测 量 电 路 显 示 器
箱 参比电极
驱 动 器
逻辑控制电路
操作键
测定原理
样品通过某离子选择性电极时由某相应的电解质渗过电极 膜时产生了电流,通过对该电流的放大,同标准液 A 标及 B
甘汞 电极
饱和 KCl 血液
PBS
Ag/AgCl 电极
放大器
PH7.38
pH 测量系统示意图
Ag/AgCl
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
(1)钠电极
钠电极内充液的浓度降低最为严重,要经常检查调整内充液
浓度。 许多仪器的程序设计中已包含每日保养(daily maintenance) 一项。坚持每日用厂家提供的清洁液和钠电极调整液进行清 洗和调整是最基本的保养。 调整液含有氟化钠----玻璃腐蚀剂。
(2)钾电极
钾电极为选择性膜电极,使用过程中会吸附蛋白质,影响 电极的响应灵敏度。每月至少更换一次内充液。
甘汞 电极
饱和 KCl 血液
PBS
Ag/AgCl 电极
放大器
PH7.38
pH 测量系统示意图
Ag/AgCl
入口 出口
气泡
缓冲液
PH敏感玻璃膜
循环水
吸收泵
甘汞电极
屏蔽电线 玻璃电极
饱和KCl
连接管
恒温水浴
聚乙烯管
二、电解质分析仪的结构
(一)湿式电解质分析仪
基本组成
湿式电解质分析仪
离子选择性电极 参比电极 分析箱 测量电路 控制电路 驱动电机 显示器
结构框图
分 析 Na电极 K电极 测 量 电 路 显 示 器
箱 参比电极
驱 动 器
逻辑控制电路
操作键
测定原理
样品通过某离子选择性电极时由某相应的电解质渗过电极 膜时产生了电流,通过对该电流的放大,同标准液 A 标及 B
电位 电流 电导 电量 确定
测 定 物理量
参与 反应的化学物质的 量
电位分析法
电化学分析原理
一、pH值测定原理
1. pH玻璃膜电极(glass membrane electrode)
玻璃电极对溶液pH的敏感程度取决于
电极的玻璃膜。 在25℃时,玻璃电极的电极电位:
K 0.05916pHx
2.流路系统的保养 仪器在测量过程中,由于血清中含有部分纤维蛋白,蛋白将 附着在液流通道 (flowpath)的泵、管路和电极系统毛细管的内壁 上,当测量工作量较大时,内壁所附的蛋白增厚,造成阻塞管 路和影响样品与电极之间的测量电位,影响正常工作和测试结 果的准确性。
(1)流路保养
多数仪器都有仪器流路保养程序,可以根据保养程序进行保 养工作。当流路保养程序结束后,应当对仪器进行重新定标。 (2)全流路清洗 流路清洗是为了保证仪器流路中没有蛋白质、脂类沉积和 盐类结晶。
2. 电化学法测量血液 pH 通常采用二次测量法,即用相同的仪器测定标准溶液和待 测溶液的电动势,以确定待测液的pH。采用的电池组成是:
(-)玻璃电极︱标准缓冲溶液(pHs)‖饱和甘汞电极 (+)
(-)玻璃电极︱待测溶液(pHx)‖饱和甘汞电极 (+)
E X ES pHX pHS + 2. 303RT / F
2.303 RT E K lg ai nF
离子选择性电极作正极时: 对阳离子响应的电极,取正号;
ISE 法测量
对阴离子响应的电极,取负号。
直接法血清不经稀释直接由电极测量
ISE测量方法
间接法血清经一定稀释后由电极测量。
三、氧分压(PO2)电极的工作原理 PO2 电极是氧化还原电极,对氧的测量是基于电解 氧的原理实现的。 目前用得最多的氧电极是电解式的Clark氧电极
标通过电极时产生的电流进行对数及斜率比较,计算出样品中 某一电解质的值。
测定过程
① 由动力泵将 A 标准液抽入电极池(抽样长度由光电开 关检测),并停留几秒进行 A 标标定,然后由动力泵将 A 标 准液抽回废液瓶。
② 分配阀动作将通道接向 B 标准液,由动力泵将 B 标 准液抽入电极池进行斜率测定。B 标定标完成后,由动力 泵将 B 标准液抽回废液瓶。 ③ 由动力泵将样品吸入电极池进行样品的测定,测量数据
SPOTCHEM EL SE-1520
样品液
参比液
塑料膜
盐桥
塑料膜
离子选择敏感膜 离子选择敏感膜
参比层 氯化银层 银层 电位计
参比层 氯化银层 银层
基于ISE法干式电解质分析仪的结构示意图
通常每测一个项目需要用一个干片,每个干片上带有条形识别码,仪器将 自动识别所进行的测定项目。
测定时,用双孔移
经前置放大器放大送入CPU 板,与 A 标、B 标测量值进行比
较,计算结果通过 CRT 显示器显示或打印机输出。
测定过程框图
到位 检测
CRT 显示器
CPU 板
运算 放大器
电极
动力泵
样品
打印机
废液
A 标准液
B 标准液
AVL 9181型 电解质分析仪 内部结构示意图
(二)干式电解质分析仪
电解质的干化学测定法目前主要有两类: 基于反射光度法干化学测定 基于离子选择性电极(ISE)方法 干化学测定
放大 模 数 转 换
PCO2电极
前置放大
反对数放大
PO2电极
前置放大
放大
管路 系统
温度控制 微机
输出显示 打印输出
键盘
血气分析仪的工作原理图
测量室必须是一个恒温系统。通常测量室的温度被恒定 在37℃±0.1℃。 在血气分析仪中,为了完成对样品的自动定标、自动测量
和自动冲洗等功能,装有一套比较复杂的管路系统以及配合
管路工作的泵体和电磁阀。 泵和电磁阀的转、停、开、闭、温度的高低;定标气 及定标液的有、无、供、停等,均由微机进行控制或监测。
血气分析方法是一种相对测量方法。在测量样品之前,
需用标准液及标准气体确定pH、PCO2和PO2三套电极的工 作曲线。
通常把确定电极系统工作曲线的过程叫做定标 或校准(Calibration)。
每种电极都要有两种标准物质来进行定标,以 便确定建立工作曲线最少需要的两个工作点。
定
pH系统:
标
使用7.383和6.840两种标准缓冲液进行定标。 氧和二氧化碳系统: 用两种混合气体来进行定标。 5% CO2和20% O2
10% CO2
二、仪器结构 (一)电极系统
电极是血气分析仪的电化学传感器。 电化学传感器主要包括两大类:
非正常生理指标 <7.35 酸血症 <4.655 kPa >7.45 碱血症 >5.985 kPa
pCO2
pO2
低碳酸血症
<7.3 kPa 呼吸衰竭
高碳酸血症
<4 kPa 有生命危险
男
Hb
女
120~160g.L-1 110~150g.L-1
一、工作原理
参比电极 测 量 管 样 品 室
pH电极
前置放大
值等。
2.血气分析仪
利用电极对血样中的酸碱度(pH)、二氧化碳分压(PCO2)
和氧分压(PO2)进行测定的仪器。
测量样品中的指标: pH、PCO2、PO2、AB、SB、 BB、TCO2、BE blood、BEECF、 SO2等。
二、电化学分析法 (Electrochemical analysis) 电化学分析法是建立在溶液电化学性质基础上的一 类分析方法。
第九章 电化学分析技术和临床相关
仪器
概
述
一、电化学临床分析仪器
电化学临床分析仪器是利用 电化学分析技术而设计的临床分 析仪器。
电解质分析仪
(electrolyte chemistry analyzers)
分类
血气分析仪
(blood gas analyzers)
1.电解质分析仪 采用离子选择性电极(ISE)测量体液中离子浓度的 仪器。 测量样品中的指标: 钾、钠、氯、钙、锂、pH
Clark氧电极是由铂阴极、Ag/AgCl阳极、KCl电解质和透气膜 所构成。
四、PCO2 电极的工作原理
PCO2电极是气敏电极(gas sensing electrode),是
由pH玻璃电极和银-氯化银电极组装在一起的复合电
极。
电解质分析仪
电解质分析仪(electrolyte analyzer) : 采用离子选择性电极(ISE)测量溶液中离 子浓度的仪器 。 测定指标: 生物样品中的K+、Na+、Cl-、 Ca2+、Li+、pH值等。
4.准确性不够
7.电极漂移与失控
9.电极斜率降低
血气分析仪
血气分析仪(blood gas analyzer)是利用电极对 人全血中的酸碱度(pH)、二氧化碳分压(PCO2) 和氧分压(PO2)进行测定的仪器。
根据所测得的pH、PCO2、PO2参数及输入的血红蛋白 值,血气分析仪可进行计算而求出血液中的其它参数,如:
由于各玻璃电极的 K玻 不尽相同,在测定时仪器需 用标准缓冲溶液进行校正。 常用标准缓冲溶液 (1)0.05mol/Kg 邻苯二甲酸氢钾溶液 37℃,pH值:4.02 (2)0.025mol/Kg 混合磷酸盐溶液
37℃,pH值: 6.84
二、离子选择性电极工作原理 ( principal of Ion selective electrode )
仪器进入流路程序进行清洗,吸入或注射清洗液、去蛋白液 或蒸馏水冲洗流路,重复23次。冲洗完毕,应当对仪器进行重 新定标。
(二)日常维护保养
1.每日维护 检查试剂量,如不足1/4液面,应及时更换;清洁仪器表面 灰尘及吸样探针,保持探针的畅通;及时弃去废液瓶中的废 液。 2.每周维护 仪器应进行流路清洗,除去蛋白质、脂类沉积和盐类结晶, 对仪器进行维护保养。
(3)氯电极 氯电极为选择性膜电极,使用过程中亦会吸附蛋白质,影 响电极的响应灵敏度。最好用物理法进行膜电极的清洁。
(4)参比电极 每周均需检查电极内是否有足够的饱和氯化钾溶液及氯化
钾残片。如果不够或没有,则需及时添加。一般三个月要换一
次参比电极膜。 清洗电极套,保持毛细管通透,使盐桥导通,电极芯无需保 养,但不能用水洗或使其干燥。
