大学本科有机化学41氨基酸20页PPT
合集下载
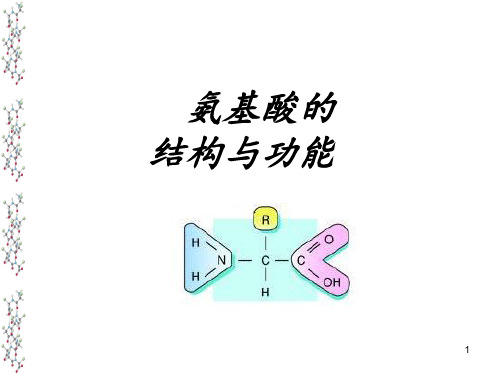
氨基酸结构与性质PPT课件

3 氨基酸的化学性质及其应用
第1页/共61页
蛋白质的元素组成
蛋白质是有机化合物,离不开C、H、O三种元素,还含 有N、P、S、金属元素等。 元素组成 : C H O N S 其它 含量% : 50~55 6~7 20~23 15~~3 微量或无
蛋白质中N是特征元素,且含量恒定,为16%左右 ,即16克 氮/100克蛋白质,故可以用定氮法测量蛋白质含量,即:每 100克蛋白质含氮16克,克蛋白质含氮1克。所以,每克样品 含氮量×6.25×100=100克样品蛋白质含量(克%)。
第37页/共61页
羧基参加的反应: (1)与碱反应成盐 (2)与醇反应成酯 (3)与酰化试剂反应成酰氯
第38页/共61页
氨基与α-羧基共同参加的反应 与茚三酮的反应:除脯氨酸与羟脯氨酸外,可与其它氨基酸生成 蓝紫色化合物。脯氨酸与羟脯氨酸为黄色化合物。
第39页/共61页
第40页/共61页
5.侧链反应(颜色反应):
4..旋光性:除甘氨酸外的氨基酸均有旋光性。
5.光吸收:氨基酸在可见光范围内无光吸收,在近紫外 区含苯环氨基酸有光的吸收。
第20页/共61页
第21页/共61页
(二)化学性质
1.氨基酸的两性电离及等电点: ➢ 氨基酸既含有氨基,可接受H+,又含有羧基,可电离 出H+,所以氨基酸具有酸碱两性性质。通常情况下,氨 基酸以两性离子的形式存在,如下图所示:
第25页/共61页
通过氨基酸的滴定曲线,可用下列 HendersonHasselbalch 方程求出各解离基团的解离常数 (pK’):
根据pK’可求出氨基酸的等电点,可由其等电 点左右两个pK,值的算术平均值求出。
第26页/共61页
氨基酸等电点的计算 中性氨基酸:
第1页/共61页
蛋白质的元素组成
蛋白质是有机化合物,离不开C、H、O三种元素,还含 有N、P、S、金属元素等。 元素组成 : C H O N S 其它 含量% : 50~55 6~7 20~23 15~~3 微量或无
蛋白质中N是特征元素,且含量恒定,为16%左右 ,即16克 氮/100克蛋白质,故可以用定氮法测量蛋白质含量,即:每 100克蛋白质含氮16克,克蛋白质含氮1克。所以,每克样品 含氮量×6.25×100=100克样品蛋白质含量(克%)。
第37页/共61页
羧基参加的反应: (1)与碱反应成盐 (2)与醇反应成酯 (3)与酰化试剂反应成酰氯
第38页/共61页
氨基与α-羧基共同参加的反应 与茚三酮的反应:除脯氨酸与羟脯氨酸外,可与其它氨基酸生成 蓝紫色化合物。脯氨酸与羟脯氨酸为黄色化合物。
第39页/共61页
第40页/共61页
5.侧链反应(颜色反应):
4..旋光性:除甘氨酸外的氨基酸均有旋光性。
5.光吸收:氨基酸在可见光范围内无光吸收,在近紫外 区含苯环氨基酸有光的吸收。
第20页/共61页
第21页/共61页
(二)化学性质
1.氨基酸的两性电离及等电点: ➢ 氨基酸既含有氨基,可接受H+,又含有羧基,可电离 出H+,所以氨基酸具有酸碱两性性质。通常情况下,氨 基酸以两性离子的形式存在,如下图所示:
第25页/共61页
通过氨基酸的滴定曲线,可用下列 HendersonHasselbalch 方程求出各解离基团的解离常数 (pK’):
根据pK’可求出氨基酸的等电点,可由其等电 点左右两个pK,值的算术平均值求出。
第26页/共61页
氨基酸等电点的计算 中性氨基酸:
有机化学ppt-氨基酸蛋白质

蛋白质能够形成稳定亲水胶体溶液,主要有两方面的原因: 形成保护性水化膜。粒子带有同性电荷。
如果改变条件,破坏蛋白质的稳定因素,就可以使蛋白质分 子从溶液中凝聚并析出。这种现象称为蛋白质的沉淀。
盐析法:在蛋白质溶液中加入大量盐[如 NaCl、硫酸铵、 Na2SO4等],由于盐既是电解又是亲水性的物质,它能破坏蛋白 质的水化膜,因此当加入的盐达到一定的浓度时,蛋白质就会从 溶液中沉淀析出,盐浓度变稀时蛋白质溶解,为可逆沉淀。
2.氨基酸的分类
(1)据氨基和羧基的相对位置分为α-氨基酸、β-氨基酸 和γ—氨基酸,与人关系最为密切的是α-氨基酸。
R αCH COOH NH2
α 氨基酸
R β CH α CH2COOH NH2
β 氨基酸
R γ CH β CH2αCH2COOH NH2
γ 氨基酸
(2)按分子中氨基和羧基的数目分为
系统命名法: 氨基酸的命名可以采用系统命名法,与羟基酸的命名相似 ,即以羧酸为母体,氨基为取代基,称为“氨基某酸”。 氨基的位置,习惯上用希腊字母α、β、γ等来表示,并写在 氨基酸名称前面。
CH3CH CHCOOH CH3 NH2
α-氨基--甲基丁酸
CH2CH COOH NH2
α-氨基--苯基丙酸
习惯命名法: 氨基酸多根据其来源或某些特性使用俗名,有时还用中文 或英文缩写符号表示。 α-氨基乙酸因具有甜味俗名甘氨酸,中文缩写为“甘”, 英文缩写为“Gly”。天门冬氨酸是因最初是从植物天门冬的幼 苗中分离出来而得名,中文缩写“天”, 英文缩写为“Asp”。
负离子存在。在一定介质时,主要以两性离子存在。
R CH COOH
NH3+ (Ⅰ) 正离子
OH- R CH COO- OH-
如果改变条件,破坏蛋白质的稳定因素,就可以使蛋白质分 子从溶液中凝聚并析出。这种现象称为蛋白质的沉淀。
盐析法:在蛋白质溶液中加入大量盐[如 NaCl、硫酸铵、 Na2SO4等],由于盐既是电解又是亲水性的物质,它能破坏蛋白 质的水化膜,因此当加入的盐达到一定的浓度时,蛋白质就会从 溶液中沉淀析出,盐浓度变稀时蛋白质溶解,为可逆沉淀。
2.氨基酸的分类
(1)据氨基和羧基的相对位置分为α-氨基酸、β-氨基酸 和γ—氨基酸,与人关系最为密切的是α-氨基酸。
R αCH COOH NH2
α 氨基酸
R β CH α CH2COOH NH2
β 氨基酸
R γ CH β CH2αCH2COOH NH2
γ 氨基酸
(2)按分子中氨基和羧基的数目分为
系统命名法: 氨基酸的命名可以采用系统命名法,与羟基酸的命名相似 ,即以羧酸为母体,氨基为取代基,称为“氨基某酸”。 氨基的位置,习惯上用希腊字母α、β、γ等来表示,并写在 氨基酸名称前面。
CH3CH CHCOOH CH3 NH2
α-氨基--甲基丁酸
CH2CH COOH NH2
α-氨基--苯基丙酸
习惯命名法: 氨基酸多根据其来源或某些特性使用俗名,有时还用中文 或英文缩写符号表示。 α-氨基乙酸因具有甜味俗名甘氨酸,中文缩写为“甘”, 英文缩写为“Gly”。天门冬氨酸是因最初是从植物天门冬的幼 苗中分离出来而得名,中文缩写“天”, 英文缩写为“Asp”。
负离子存在。在一定介质时,主要以两性离子存在。
R CH COOH
NH3+ (Ⅰ) 正离子
OH- R CH COO- OH-
氨基酸知识ppt课件

(二)转氨基反应
1、转氨基作用概念——氨基移换作用
是-氨基酸的氨基通过酶促反应转移到-酮酸的酮基 位置上,形成与原来-酮酸相应的-氨基酸,而原来 的-氨基酸则转变成相应的-酮酸
R1
R2
转氨基酶 R1
R2
CHNH2 + CH=O
C=O + CHNH2
COOH COOH 磷酸吡哆醛 COOH COOH
氨基酸与糖类和脂类物质最显著的区别— —含有-氨基,要彻底氧化脱氨基非常重要
一、氨基酸的脱氨基作用
(一)脱氨基作用——氨基酸失去氨基作用
1、氧化脱氨基作用——普遍存在于动、植 物和需氧微生物
R-CH-NH2 COOH
R-C=NH R-C=O + NH3 COOH COOH
氨基酸
亚氨基酸
-酮酸
氨
反应步骤:(1)酶促脱氢 (2)自发水解
(2)分解脱氨基作用--生成不饱和酸和氨
是氨基酸的直接脱氨基反应,脱去氨基后形成一个不饱和 双键,生成相应的不饱和酸。 例如:天冬氨酸在天冬氨酸酶作用下脱去氨基形成延胡索酸和氨: HOOCCH2CHNH2COOH HOOCCH=CHCOOH
(3)脱水脱氨基作用--生成-酮酸和氨
含有羟基的氨基酸在氨基酸脱水酶的作用下脱水、重排再脱 氨,形成相应的-酮酸和氨 例如:L-Thr在苏氨酸脱水酶的作用下,脱水形成-氨基丁烯酸,重 排形成-亚氨基丁酸再水解脱氨形成-酮丁酸和氨
酸磷 酸
呼吸链 嘌呤
H20+CO2+ATP 嘧啶 鸟氨酸
循环
第三节 氨基酸的生物合成
一 氨基化作用 二 转氨基作用 三 氨基酸之间的相互转化及鸟氨
酸循环 四 氨基酸合成的其它方式
4版有机化学第二十章-氨基酸、蛋白质和核酸课件

CH3 C C OH
NH2
丙氨酸
(alanine) 图 20.1 丙氨酸的分子模型
分子中含有-NH2和-COOH两种官能团。
20.1.1 氨基酸的命名和构型 根据氨基连在C链上的位次不同分为 α,β,γ,……–氨基酸
系统命名法:作-为NH母2体作为取代基,羧酸
CH3CHCH2CHCOOH
H2N(CH2)4CHCOOH 溶于水 酶 蛋白激素
结合蛋白 蛋白质 + 非氨基酸部分 辅基: 碳水化合物、脂质、核酸 (辅基)
或磷酸等 血红蛋白中的辅基:血红素
蛋白质的结构 一级、二级、三级、四级 立体结构
一级结构:氨基酸单位的种类、数目及 排列顺序
A B
图20.2 牛胰岛素的一级结构
L–甘油醛
表 20.1 蛋白质中存在的氨基酸
名称
缩写 结构
等电点
甘氨酸(glycine) 丙氨酸(alanine) *缬氨酸(valine)
甘
CH2COOH
Gly
NH2
5.97
丙 CH3CHCOOH 6.02
Ala
NH2
缬 (CH3)2CHCHCOOH 5.97
Val
NH2
*亮氨酸(leucine)
第二十章 氨基酸、蛋白质与核酸
20.1 氨基酸 20.1.1 氨基酸的命名和构型 20.1.2 氨基酸的制法 (1)α–卤代酸的氨解 (2) Gabrial 合成法 (3) Strecker 合成法 20.1.3 氨基酸的性质 (1) 羧基的反应 (2) 氨基的反应 (3) 两性和等电点 (4) 与水合茚三酮反应 (5) 受热反应 20.2 多肽
嘧啶环上的3位上或嘌呤9位上的氮原子上
的氢 脱水 β–苷
NH2
丙氨酸
(alanine) 图 20.1 丙氨酸的分子模型
分子中含有-NH2和-COOH两种官能团。
20.1.1 氨基酸的命名和构型 根据氨基连在C链上的位次不同分为 α,β,γ,……–氨基酸
系统命名法:作-为NH母2体作为取代基,羧酸
CH3CHCH2CHCOOH
H2N(CH2)4CHCOOH 溶于水 酶 蛋白激素
结合蛋白 蛋白质 + 非氨基酸部分 辅基: 碳水化合物、脂质、核酸 (辅基)
或磷酸等 血红蛋白中的辅基:血红素
蛋白质的结构 一级、二级、三级、四级 立体结构
一级结构:氨基酸单位的种类、数目及 排列顺序
A B
图20.2 牛胰岛素的一级结构
L–甘油醛
表 20.1 蛋白质中存在的氨基酸
名称
缩写 结构
等电点
甘氨酸(glycine) 丙氨酸(alanine) *缬氨酸(valine)
甘
CH2COOH
Gly
NH2
5.97
丙 CH3CHCOOH 6.02
Ala
NH2
缬 (CH3)2CHCHCOOH 5.97
Val
NH2
*亮氨酸(leucine)
第二十章 氨基酸、蛋白质与核酸
20.1 氨基酸 20.1.1 氨基酸的命名和构型 20.1.2 氨基酸的制法 (1)α–卤代酸的氨解 (2) Gabrial 合成法 (3) Strecker 合成法 20.1.3 氨基酸的性质 (1) 羧基的反应 (2) 氨基的反应 (3) 两性和等电点 (4) 与水合茚三酮反应 (5) 受热反应 20.2 多肽
嘧啶环上的3位上或嘌呤9位上的氮原子上
的氢 脱水 β–苷
大学化学《有机化学-氨基酸》课件

去保护基
R O CH3 (CH3)3C+ + CO2 + +NH3CHCNHCHCOO -
*1. 催化氢化和稀碱都不能除去BOC,通常用温 和的酸性水解法除去。
*2. 若氨基酸中有多个氨基,在接肽前均需保护。 *3. 用Z保护还是用BOC保护,视实际情况而定。
22.5.2 羧基的保护
RCHCOON+ H3
(甘-丙-亮)(Gly-Ala-Leu)
2 结构
1. 肽键和肽的几何形状
H O H RH O
NCCNC CNCC
HR H O H R
2. 二硫键
CH2SH
+
CHNH 3
COO-
空气氧化 Na +液NH3
CH2S
+
CHNH 3
COO-
SCH2
+
CHNH 3 COO-
Cys-Tyr-Ile-Glu-Arg-Cys-Pro-Leu-Gly •NH2
HCl
CH3OH
上保护基
R H2NCHCOOCH3
CH3
SO3H RCHCOOCH2
CH2OH NH2
上保护基
(CH3)2C=CH2
上保护基
O RCHCOBu-t
NH2
A
接肽
OR
R'CHCHNCHCOOCH3
NH2
去保护基 Na2CO3
A
接肽
Pd / H2
OR R'CHCHNCHCOOH
去保护基
NH2
蛋白质、碳水化合物、脂肪(甘油醇的 脂肪酸酯)是人的营养中的三种要素。
1 定义和分类
羧酸分子中烃基上的一个或几个氢原子被氨基取代生成的化合物叫氨基酸。
生物化学第2章 氨基酸(共77张PPT)

• Ala Arg Asp
Asn
Cys Glu Gln Gly
His
Ile
Leu
Lys
Met Phe Pro
Ser
Thr
Trp
Tyr
Val
、 20种氨基酸可按其侧链分类
• 氨基酸的侧链可以按照它们的化学结构分为 三类,即:脂肪族氨基酸;芳香族氨基酸; 杂环氨基酸。
1)脂肪族氨基酸(中性)
甘氨酸 Glycine
非极性氨基酸(八种)
不带电何的极性氨基酸(八种)
带负电荷的氨基酸(2种)
带正电荷的氨基酸(2种)
➢第21种基本氨基酸是硒代半胱氨酸(Selenocysteine, Sec) ➢第22种基本氨基酸是吡咯赖氨酸(Pyrrolysine, Pyr) ➢两种罕见基本氨基酸是在特定生物的特定调控条件下生成。
O
H 2N CH C OH
CH 2
SH
C
( α-氨基-β-巯基丙酸 )
两个半胱氨酸氧化可生成胱氨酸
人头发的电子显微镜照片与模型
烫发过程:
1、加还原剂(巯基乙醇) 打开二硫键。
2、加氧化剂(双氧水) 重新生成错位二硫键。
1)、脂肪族氨基酸(含羟基或硫)
丝氨酸 Serine 苏氨酸 Threonine 半胱氨酸 Cysteine 甲硫氨酸 Methionine
O H 2N CH C OH
CH OH CH 3
T
( α-氨基-β-羟基丁酸 )
L-Threonine D-Threonine
L-alloThreonine
D-allo-
Threonine
苏氨酸的光学异构体
1)、脂肪族氨基酸(含羟基或硫)
氨基酸(课件PPT)

• ----C-C(NH2)-C-C-COOH
α-氨基酸 β-氨基酸
γ-氨基酸
• 大多数AA在中性pH时呈兼 性离子状态:
COO-
NH3+
• 除甘氨酸外,19种AA都具有 旋光性。
• 除胱氨酸和酪氨酸外,其余 AA都能溶于水。
二、氨基酸的分类
(一)常见的蛋白质氨基酸
按R基的化学结构分类:
1、脂肪族aa (1)中性aa
NN HO
NN
O
H2N
OH
Pauly反应
HO3S
His侧链咪唑基 与重氮苯磺酸生
HO3S
成棕红色化合物
NN HN
NN
NH2 CH2 CH COOH N
Arg侧链胍基与 环己二酮生成 缩合物
Trp侧链吲哚基能被 N-溴代琥珀酰亚胺氧化 ——分光光度法测定Trp含量
Met侧链上甲硫基:强亲核基团与烃化试剂成锍盐
氨基酸定量和蛋白质水解程度的测定。
R
O2N
F + H2N—CH—COOH
NO2
DNFB
弱碱性
R
O2N
HN—CH—COOH + HF
NO2 DNP-氨基酸 (黄色)
Sanger 法测定N末端氨基酸基础
苯异硫氰酸酯PITC
HR
—N=C=S + N—CH—COOH
PITC
H
pH8.3
H
HR
Edman降解法基础
18、只要愿意学习,就一定能够学会。——列宁 19、如果学生在学校里学习的结果是使自己什么也不会创造,那他的一生永远是模仿和抄袭。——列夫·托尔斯泰
20、对所学知识内容的兴趣可能成为学习动机。——赞科夫 21、游手好闲地学习,并不比学习游手好闲好。——约翰·贝勒斯 22、读史使人明智,读诗使人灵秀,数学使人周密,自然哲学使人精邃,伦理学使人庄重,逻辑学使人善辩。——培根 23、我们在我们的劳动过程中学习思考,劳动的结果,我们认识了世界的奥妙,于是我们就真正来改变生活了。——高尔基 24、我们要振作精神,下苦功学习。下苦功,三个字,一个叫下,一个叫苦,一个叫功,一定要振作精神,下苦功。——毛泽东 25、我学习了一生,现在我还在学习,而将来,只要我还有精力,我还要学习下去。——别林斯基 13、在寻求真理的长河中,唯有学习,不断地学习,勤奋地学习,有创造性地学习,才能越重山跨峻岭。——华罗庚52、若不给自己设限,则人生中就没有限制你发挥的藩篱。
α-氨基酸 β-氨基酸
γ-氨基酸
• 大多数AA在中性pH时呈兼 性离子状态:
COO-
NH3+
• 除甘氨酸外,19种AA都具有 旋光性。
• 除胱氨酸和酪氨酸外,其余 AA都能溶于水。
二、氨基酸的分类
(一)常见的蛋白质氨基酸
按R基的化学结构分类:
1、脂肪族aa (1)中性aa
NN HO
NN
O
H2N
OH
Pauly反应
HO3S
His侧链咪唑基 与重氮苯磺酸生
HO3S
成棕红色化合物
NN HN
NN
NH2 CH2 CH COOH N
Arg侧链胍基与 环己二酮生成 缩合物
Trp侧链吲哚基能被 N-溴代琥珀酰亚胺氧化 ——分光光度法测定Trp含量
Met侧链上甲硫基:强亲核基团与烃化试剂成锍盐
氨基酸定量和蛋白质水解程度的测定。
R
O2N
F + H2N—CH—COOH
NO2
DNFB
弱碱性
R
O2N
HN—CH—COOH + HF
NO2 DNP-氨基酸 (黄色)
Sanger 法测定N末端氨基酸基础
苯异硫氰酸酯PITC
HR
—N=C=S + N—CH—COOH
PITC
H
pH8.3
H
HR
Edman降解法基础
18、只要愿意学习,就一定能够学会。——列宁 19、如果学生在学校里学习的结果是使自己什么也不会创造,那他的一生永远是模仿和抄袭。——列夫·托尔斯泰
20、对所学知识内容的兴趣可能成为学习动机。——赞科夫 21、游手好闲地学习,并不比学习游手好闲好。——约翰·贝勒斯 22、读史使人明智,读诗使人灵秀,数学使人周密,自然哲学使人精邃,伦理学使人庄重,逻辑学使人善辩。——培根 23、我们在我们的劳动过程中学习思考,劳动的结果,我们认识了世界的奥妙,于是我们就真正来改变生活了。——高尔基 24、我们要振作精神,下苦功学习。下苦功,三个字,一个叫下,一个叫苦,一个叫功,一定要振作精神,下苦功。——毛泽东 25、我学习了一生,现在我还在学习,而将来,只要我还有精力,我还要学习下去。——别林斯基 13、在寻求真理的长河中,唯有学习,不断地学习,勤奋地学习,有创造性地学习,才能越重山跨峻岭。——华罗庚52、若不给自己设限,则人生中就没有限制你发挥的藩篱。
【有机化学】氨基酸【课件PPT】

20
氨基酸在溶液中的荷电状态与溶液的pH值有关。
氨基酸分子内羧基和氨基的电离度相等,则氨基 酸形成两性离子的浓度最高,净电荷为零,氨基 酸在电场中既不向正极移动,也不向负极移动, 此时溶液的pH值就称为该氨基酸的等电点,常用 符号pI(isoelectric point)表示。
RCHCOO-
+
NH3
CH2CH COOH 酪氨酸
Tyr
NH2
CH2CH COOH
N
*色氨酸 Trp
H
等电点
6.30 5.66 5.89
7
II 酸性
NH2 HOOC CH2CH COOH
NH2 HOOC (CH2)2CH COOH
天冬氨酸 Asp 谷氨酸 Glu
III 碱性
NH2
H2N (CH2)4CH COOH
NH2
18
(六) 成肽反应
在适当条件下,氨基酸分子间氨基与羧基相互脱 水缩合生成的一类化合物,叫做肽,肽分子中的 酰胺键(-CO-NH-)叫做肽键,由二分子氨基酸 缩合而成的肽叫二肽。
H2NCHCOOH + H2NCHCOOH
R1
R2
H2O
H2NCHCO NHCHCOOH
R1
许多氨基酸分子通过多个肽键
肽键
12
Байду номын сангаас
COOH H2N H
R
L-氨基酸
COOH HO H
CH3 L-乳酸
COOH H2N H
CH2SH
COOH
H2N
H
CH3
L-(+)-丙氨酸
COOH 半胱氨酸(R)
H2N
H
CH2OH
L-(-)-丝氨酸
氨基酸在溶液中的荷电状态与溶液的pH值有关。
氨基酸分子内羧基和氨基的电离度相等,则氨基 酸形成两性离子的浓度最高,净电荷为零,氨基 酸在电场中既不向正极移动,也不向负极移动, 此时溶液的pH值就称为该氨基酸的等电点,常用 符号pI(isoelectric point)表示。
RCHCOO-
+
NH3
CH2CH COOH 酪氨酸
Tyr
NH2
CH2CH COOH
N
*色氨酸 Trp
H
等电点
6.30 5.66 5.89
7
II 酸性
NH2 HOOC CH2CH COOH
NH2 HOOC (CH2)2CH COOH
天冬氨酸 Asp 谷氨酸 Glu
III 碱性
NH2
H2N (CH2)4CH COOH
NH2
18
(六) 成肽反应
在适当条件下,氨基酸分子间氨基与羧基相互脱 水缩合生成的一类化合物,叫做肽,肽分子中的 酰胺键(-CO-NH-)叫做肽键,由二分子氨基酸 缩合而成的肽叫二肽。
H2NCHCOOH + H2NCHCOOH
R1
R2
H2O
H2NCHCO NHCHCOOH
R1
许多氨基酸分子通过多个肽键
肽键
12
Байду номын сангаас
COOH H2N H
R
L-氨基酸
COOH HO H
CH3 L-乳酸
COOH H2N H
CH2SH
COOH
H2N
H
CH3
L-(+)-丙氨酸
COOH 半胱氨酸(R)
H2N
H
CH2OH
L-(-)-丝氨酸
有机化学氨基酸PPT课件

第21页/共45页
(3)三级结构—— 在二级结构的基础上,多肽链间通过氨基酸残基侧链的相互作用, 在三维空间沿多个方向进行卷曲、折叠、盘绕形成紧密的球状结构称为蛋白质的三级
结构。
蛋白质的三级结构 是其他次级键,如 -S-S-(二硫 键)、离子键、氢 键、疏水键、支链 等,共同作用的结 果。
第22页/共45页
第4页/共45页
2、茚三酮反应 用途:鉴别α-氨基酸
O
OH
2
OH
O
水合茚三酮
+ RCHCOOH
NH2
α-氨基酸
O
O
N
O
O
兰紫色
第5页/共45页
1 大蒜的药用价值与氨基酸
O H2 O S C CHC OH
NH2
O SS
S OH
蒜素
现代抗生素问世之前,大蒜制剂被用来治疗霍乱, 痢疾,肺结核等疾病,大蒜制剂还能降低胆固醇, 阻止血小板聚集,对心血管有利,并有一定的抗 菌作用。副作用:味道大
第13页/共45页
2、分类 二肽 三肽 多肽
3、命名 以含有完整羧基的氨基酸为母体,将以羧基
参加形成肽链的氨基酸中的酸字改为“酰”,依次 加在母体前面
O
NH2CH2 C NHCH2COOH 甘氨酰甘氨酸 或甘·甘
CH3 O
O
O
CH2OH
NH2CH C NH CH C NH CH2C NH CHCOOH
第17页/共45页
水蛭素多肽——抗血栓分子药理 1884年Haycraft首先发现新鲜医用水蛭Hirud medicinalis提取物含抗凝血物质,但直至1955年Mark wardt等从医用水蛭中才分离出水蛭素(hirudin,HV),共有 7种异构体。1984年Dodt首先测出其一级结构,确认HV是 一条含65个左右氨基酸的多肽。HV酶是血液凝固、止血过程和血栓形成的中心 酶之一。它专一性地水解纤维蛋白原上的Agr-Gly键,使之转变成纤维蛋白;纤维 蛋白相互作用会进一步形成血栓。HV的2个结构域通过不同的机制分别和凝血酶 相互作用,抑制其活性。其C端长链通过和凝血酶的纤维蛋白原识别部位结合,拮 抗凝血酶对纤维蛋白原的识别。而HV的N末端核心结构域通过和凝血酶的活性部 位结合而抑制它的催化活性。临床实验结果也表明,HV的抗栓作用不需要其它因 子的作用;又不会引起出血等副作用。其效果超过小分子肝素。因此被认为是 2010年前最强的可逆性凝血酶直接抑制剂。全球约有20亿美元市场销售量。
氨基酸PPT幻灯片课件
20
等电点(pI)
对于任何一种氨基酸来说,总存在一定的pH值,使其净 电荷为零,这时的pH值被称为等电点。pI是一个氨基酸的 特征常数。在等电点pH时,氨基酸在电场中,不向两极移 动,并且绝大多数处于兼性离子状态,少数可能解离成阳 离子和阴离子,但解离成阴、阳离子的趋势和数目相等。
21
氨基酸的主要反应性质
17
18
特殊的酸碱性质与等电点
由于氨基酸既含有碱性的氨基又含有酸性的羧 基,因此氨基酸具有特殊的解离性质,但氨基 算的碱性和酸性分别弱于单纯的胺和羧酸。一 个氨基酸分子内部的酸碱反应使氨基酸能同时 带有正负两种电荷,以这种形式存在的离子被 称为兼性离子(zwitterions)或两性离子。
19
氨基酸的两性解离
质氨基酸:含硒半胱氨酸(第21种)和吡咯赖氨酸 (第22种)
非蛋白质氨基酸——不能直接参入到蛋白质分子 之中,或者是蛋白质氨基酸翻译后修饰产物
例如:瓜氨酸、鸟氨酸和羟脯氨酸
4
氨基酸的分类
① 脂肪族 ② 芳香族 ③ 含硫族
① 极性/不带电荷 ② 碱性/酸性
疏水:非极性R基团
亲水:极性的R基团 (电中性、带负电荷、 带正电荷)
2
氨基酸的结构通式
不同的侧链基团 不同的理化性质
3
蛋白质氨基酸和非蛋白质氨基酸
蛋白质氨基酸,即标准氨基酸——在蛋白质生物 合成中,由专门的tRNA携带,直接参入到蛋白 质分子之中
共22种:20种常见+2种不常见 ① 相同的结构通式 ② 差别在侧链基团(R基团) ③ 所有的生物体都含有常见的20种;2种不常见的蛋白
5
亲水氨基酸VS疏水氨基酸
亲水氨基酸,即极性氨基酸,其R基团呈极性,一般能 和水分子形成氢键,故对水分子具有一定的亲和性。它 们包括:Ser、Thr、Tyr、Cys、Sec、Asn、Gln、Asp、 Glu、Pyl、Arg、Lys、His;
等电点(pI)
对于任何一种氨基酸来说,总存在一定的pH值,使其净 电荷为零,这时的pH值被称为等电点。pI是一个氨基酸的 特征常数。在等电点pH时,氨基酸在电场中,不向两极移 动,并且绝大多数处于兼性离子状态,少数可能解离成阳 离子和阴离子,但解离成阴、阳离子的趋势和数目相等。
21
氨基酸的主要反应性质
17
18
特殊的酸碱性质与等电点
由于氨基酸既含有碱性的氨基又含有酸性的羧 基,因此氨基酸具有特殊的解离性质,但氨基 算的碱性和酸性分别弱于单纯的胺和羧酸。一 个氨基酸分子内部的酸碱反应使氨基酸能同时 带有正负两种电荷,以这种形式存在的离子被 称为兼性离子(zwitterions)或两性离子。
19
氨基酸的两性解离
质氨基酸:含硒半胱氨酸(第21种)和吡咯赖氨酸 (第22种)
非蛋白质氨基酸——不能直接参入到蛋白质分子 之中,或者是蛋白质氨基酸翻译后修饰产物
例如:瓜氨酸、鸟氨酸和羟脯氨酸
4
氨基酸的分类
① 脂肪族 ② 芳香族 ③ 含硫族
① 极性/不带电荷 ② 碱性/酸性
疏水:非极性R基团
亲水:极性的R基团 (电中性、带负电荷、 带正电荷)
2
氨基酸的结构通式
不同的侧链基团 不同的理化性质
3
蛋白质氨基酸和非蛋白质氨基酸
蛋白质氨基酸,即标准氨基酸——在蛋白质生物 合成中,由专门的tRNA携带,直接参入到蛋白 质分子之中
共22种:20种常见+2种不常见 ① 相同的结构通式 ② 差别在侧链基团(R基团) ③ 所有的生物体都含有常见的20种;2种不常见的蛋白
5
亲水氨基酸VS疏水氨基酸
亲水氨基酸,即极性氨基酸,其R基团呈极性,一般能 和水分子形成氢键,故对水分子具有一定的亲和性。它 们包括:Ser、Thr、Tyr、Cys、Sec、Asn、Gln、Asp、 Glu、Pyl、Arg、Lys、His;
大学本科有机化学41氨基酸

二 天然氨基酸的结构和名称
非极性(疏水性)中性氨基酸(有8种)
极性(不带电荷)中性氨基酸 (有7种)
碱性氨基酸(有3种) 酸性氨基酸(有2种)
Hale Waihona Puke 氨基酸的性质两性解离和等电点 水溶液中为两性离解 氨基酸在固态时主要以内盐形式存在
(内盐,zwitterion) 高熔点或分解点 不溶于有机溶剂
3.氨基酸的性质
氨基酸的等电点
IP (等电点,isoelectric point) :氨基酸处于电中性时的pH值
等电点时氨基酸以两性离 子形式存在,处于电中性 状态,在电场中不移动。
等电点时氨基酸溶解度最 小,易结晶析出。
中性氨基酸:IP < 7 (5 ~ 6.5) 酸性氨基酸:IP ~ 3 碱性氨基酸:IP > 7 (7.5 ~ 10.8)
2.氨基酸氨基端的反应
Sanger试剂
氨基酸与水合茚三酮的反应
应用 氨基酸的显色 定量分析
水合茚三酮
3.氨基酸羧基端的反应
肽:氨基酸偶联产物,分子量小于10000 蛋白质:分子量大于10000
肽
端
一个三肽
肽键
端
四.多 肽与蛋白质
多肽的合成
01
例:
02
缩合试剂
03
例:
The Nobel Prize in Chemistry 1984 "for his development of methodology for chemical synthesis on a solid matrix"
核酸
01
核糖或脱氧核糖
02
核苷或脱氧核苷
02
胞嘧啶
04
