化工四大化学氧族元素分析PPT精品课件
合集下载
最新第15章氧族ppt模版课件

As4O6 两性 As2O5 酸性
PbO 碱性 PbO2 两性
※ 这种氧化物的酸碱性因变价而发生递变
在d区过渡元素中更为常见
CrO
碱性
Cr2O3
两性
CrO3
酸性
C)衡量标准 通过同类型的相应自由能的变化来近似判断
碱性 MO + H2O → M(OH)2 酸性 2MO + H2O → 2HMO
rG
越负
O3 + 2KI + H2O = I2 + O2 + 2KOH c. O3 + Mn(NO3)2 = MnO2↓+ 2HNO3 + O2
棕褐色
此反应用于鉴别H2O2蒸气中混有O3
补充:
淀粉不是一个单纯分子,而是一种混合物 马铃薯:
可溶性→直链淀粉 20~30% 与I2形成兰色混合物
不可溶性→支链淀粉 70-80% 与I2相互作用很弱,紫红色产物
成键特点
1. 氧和非金属元素形成共价化合物时(除 OF2、H2O2等外)氧化数均为-II;
2. S、Se、Te的价电子层中均有有效空d轨 道,这些d轨道可以参加成链,当它们和电负性 比它们大的元素化合时,可显+II、+IV、+ VI氧化态,如SCl2、SeO2、SF6等。
但氧的氧化数不能大于+II。
自由基是含有一个或多个具有成键能力 的未成对电子的原子或离子,通常的自由基 具有较高活性,一般呈电中性,
如 •CH3、 •OH、 •Br等。
1. 制法
1)利用对氧无声放电来获得臭氧
放电
3O2
2O3
2)3BaO2 + 3H2SO4 (浓)→ O3 + 3BaSO4 + 3H2O
《氧族元素》课件

硫单质
总结词
化学性质不活泼,常温下稳定,加热 易燃烧
详细描述
硫单质包括硫磺和硫化物,它们在常 温下比较稳定,加热时易燃烧,发出 蓝紫色火焰。硫单质在自然界中广泛 存在,是重要的化工原料,可用于生 产硫酸、染料、橡胶等。
硒单质
总结词
化学性质与硫相似,有毒性
详细描述
硒单质包括硒粉、硒化物等,其化学性质与硫相似,在常温下比较稳定,加热时易燃烧。硒单质有毒性,对人和 动物有害,但也是一种重要的微量元素,对生物体具有保护作用。
麻醉剂
氧族元素中的一些化合物具有麻醉 作用,如氧化亚氮、氟代烃等,可 用于手术麻醉和牙科治疗。
在环保领域的应用
大气污染治理
氧族元素中的一些化合物可用于 大气污染治理,如二氧化硫、三 氧化硫等可用于脱硫脱硝处理, 减少燃煤烟气中的硫化物和氮氧
化物含量。
水处理
氧族元素中的一些化合物可用于 水处理,如臭氧、二氧化氯等可 用于消毒和杀菌,三氯化铁等可 用于混凝沉淀,去除水中的悬浮
催化剂பைடு நூலகம்
氧族元素在工业催化领域也有广泛应 用,如二氧化硫、三氧化硫等可用于 石油裂化催化剂,三氧化二砷可用于 合成氨催化剂等。
在农业上的应用
01
02
03
肥料
氧族元素中的磷是植物生 长必需的元素之一,磷肥 的施用能够提高农作物的 产量和品质。
杀虫剂
氧族元素中的硫和硒等具 有杀虫作用,可用于防治 农作物病虫害,如硫磺粉 、亚砷酸等。
硫化物合成
硫化物性质
具有不同的化学性质,如离子型硫化物、共 价型硫化物和配位型硫化物等。
可以通过热分解、硫化还原反应等方法合成 。
02
01
硫化物应用
氧族元素.ppt

c. 实验室制法
装置:固 + 液 → 气(不需要加热) 收集:向上排空气法 尾气处理:把过剩的SO2通入碱液 注意: A、不能用启普发生器制SO2 B、SO2的工业制法
S + O点2 →燃SO2 4FeS2 + 11O高2 →温2Fe2O3 + 8SO2
第20课 氧族元素
【 学 习 要 求】
1.掌握氧族元素的原子结构与其单质和化合物性质递变的关系。 2.知道臭氧的性质。 3.掌握硫、二氧化硫、硫化氢的性质。
一、氧族元素
元素周期表
ⅥA
8O 16S 34Se 52Te 84Po
元素名称 和符号 核电荷数
化合价
跟H2反应
氢化物 (H2X)
的热稳定性
除去H2S 检验H2S
c. H2S的实验室制法 原理:FeS + 2H+ → Fe2+ + H2S↑
装置:可用启普发生器 净化干燥:如用盐酸制H2S,
可选用NaHS溶液除HCl,不能用浓硫酸和碱 性干燥剂干燥,可用无水CaCl2干燥。
检验:润湿的醋酸铅(或硝酸铅)试纸变黑 H2S + (CH3COO)2Pb = PbS ↓ + 2CH3COOH
三、硫、硫化氢、二氧化硫
(1)硫的存在及性质 ①硫的存在 自然界的硫元素主要以硫单质、硫化物(如FeS2、 CuFeS2)和硫酸盐(如重晶石、石膏、芒硝)等形式存在。
在火山口附近或地壳的岩层里,常常存在游离态的硫。
②硫的性质 a.物理性质:硫(俗称硫黄)是一种黄色粉末,不溶于水,易溶于二 硫化碳。 b.化学性质: (a)跟大多数金属反应
X2(Cl2、Br2、I2)+H2S → S↓+2HX 2Fe3++H2S → 2Fe2++2H++S↓ SO2 +2 H2S → 3S ↓ + 2H2O ④酸性气体: 其水溶液为二元弱酸。具有酸的通性。
第六章第一节氧族元素精选教学PPT课件

假如人生不曾相遇,我还是那个我,偶尔做做梦,然后,开始日复一日的奔波,淹没在这喧嚣的城市里。 我不会了解,这个世界还有这样的一个你,只有你能让人回味,也只有你会让我心醉。 假如人生不曾相遇,我不会相信,有一种人可以百看不厌,有一种人一认识就觉得温馨。明知不能相逢,为何魂牵梦系?我又怎能深刻地体会到什么样叫远,什么叫近,远是距离,近在心底。 假如人生不曾相遇,不曾想过会牵挂一个远方的人。我有深切的愿望,愿你快乐每一天。淡淡的情怀很真,淡淡的问候很纯,淡淡的思念很深,淡淡的祝福最真。虽然一切只能给虚幻中的你。 假如人生不曾相遇,我不知道自己有那样一个习惯,收集你的欢笑,收集你的感情,收集你的一切一切。 假如人生不曾相遇,我不能深刻的体会孤独和忧伤,有着莫名的感动,激荡着热泪盈眶的心情入眠。 假如人生不曾相遇,我不会保持着一个人的想象,即使这想象难免寂寞无奈,但我仍然坚持着这样的梦想。 假如人生不曾相遇,我怎会理解一个人的孤独是那样铭心,但却可以释放自我的彷徨与无助。含泪的沧桑,无限的困惑,因为遇见了你,才会有更深的意义。可为什么在爱的时候,总伴着淡淡的心伤? 假如人生不曾相遇,我怎么能知道爱情存在的真正意义。必须有缘才能共舞,珍惜今天所爱方能同步。不能和你同途,也不能与你同步。 假如人生不曾相遇,我还是我,你依然是你,只是错过了人生最绚丽的奇遇。
D
)
3根据氧族元素性质推断,硒不可能具有的性质是( C ) A.在通常情况下是固体 B.SeO3对应的水化物是一种酸
C.H2Se比H2S稳定
D.有-2,+4,+6三种化合物
4.用事实说明氧的非金属性比硫强
A.硫在氧气中燃烧
B.硫与铁反应生成硫化亚铁,氧气与铁 反应生成四氧化三铁 C. 2H2S + O2 == S +2H2O
第十六章-氧族元素PPT课件
O3分子释放出热量,说明O3比O2有更大的化学活性, 无论在酸性或碱性条件下,都比O2有更强的氧化性。
11
第11页/共78页
第十六章 氧族元素
性质二:强氧化性
§16.2 氧、臭氧
O3是一种极强的氧化剂,氧化能力仅次于F2。
O3 2H 2e O2 H2O EA 2.08V
O3 H2O 2e
性质 性质一:强氧化性
性质二:还原性
性质三:不稳定性
性质四:二元弱酸
21
第21页/共78页
第十六章 氧族元素
性质一:强氧化性 • 酸性溶液
§16.3 H2O2O2 来自.6824 H2O2 1.776 H2O
• 碱性溶液
O2 0.076 HO2 0.878 OH
H2O2无论在酸性溶液还是在碱性溶液中都是强氧 化剂。
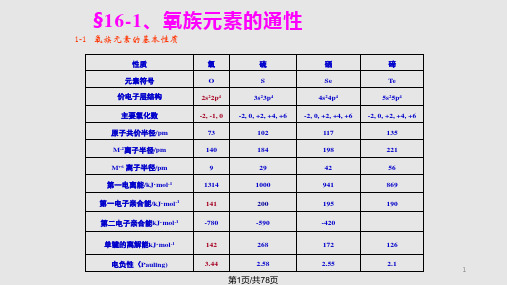
§16-1、氧族元素的通性
1-1 氧族元素的基本性质
性质 元素符号 价电子层结构 主要氧化数 原子共价半径/pm M-2离子半径/pm M+6 离子半径/pm 第一电离能/kJ·mol-1 第一电子亲合能/kJ·mol-1 第二电子亲合能kJ·mol-1
氧 O 2s22p4 -2, -1, 0 73 140 9 1314 141
-420
单键的离解能kJ·mol-1
142
268
172
126
电负性(Pauling)
3.44
2.58
2.55
2.1
1
第1页/共78页
第十六章 氧族元素
§16.1 通性
1-2 氧族元素的成键特征
• 能结合两个电子形成氧化数为-2的阴离子,表现出非 金属元素特性。
• 非金属活泼性弱于卤素。
11
第11页/共78页
第十六章 氧族元素
性质二:强氧化性
§16.2 氧、臭氧
O3是一种极强的氧化剂,氧化能力仅次于F2。
O3 2H 2e O2 H2O EA 2.08V
O3 H2O 2e
性质 性质一:强氧化性
性质二:还原性
性质三:不稳定性
性质四:二元弱酸
21
第21页/共78页
第十六章 氧族元素
性质一:强氧化性 • 酸性溶液
§16.3 H2O2O2 来自.6824 H2O2 1.776 H2O
• 碱性溶液
O2 0.076 HO2 0.878 OH
H2O2无论在酸性溶液还是在碱性溶液中都是强氧 化剂。
§16-1、氧族元素的通性
1-1 氧族元素的基本性质
性质 元素符号 价电子层结构 主要氧化数 原子共价半径/pm M-2离子半径/pm M+6 离子半径/pm 第一电离能/kJ·mol-1 第一电子亲合能/kJ·mol-1 第二电子亲合能kJ·mol-1
氧 O 2s22p4 -2, -1, 0 73 140 9 1314 141
-420
单键的离解能kJ·mol-1
142
268
172
126
电负性(Pauling)
3.44
2.58
2.55
2.1
1
第1页/共78页
第十六章 氧族元素
§16.1 通性
1-2 氧族元素的成键特征
• 能结合两个电子形成氧化数为-2的阴离子,表现出非 金属元素特性。
• 非金属活泼性弱于卤素。
氧族元素一精品PPT教学课件

氧族元素
第一课时
2020/12/6
1
氧族元素
包含元素
氧族元素包括
氧( 8O)、硫( 16 S)、硒( 34Se)、碲( 52Te)、钋( 84Po)等 它们的最外层电子、化学性质相似统称为氧族元素。
2020/12/6
2
氧原子结构特点:核外有2个电子层,最外层有6个电子
2020/12/6
3
硫原子结构特点:核外有3个电子层,最外层有6个电子
元素原子结构的异同决定其化学性 质上具有哪些特点?
} 非金属性
氧化性
减
弱
得电子能力
氧( O)、硫( S)、硒( Se)、碲(Te)、钋( Po)
金属性 还原性
}
失电子能力
增
强
主要化合价: -2、+4、+6 (O只有-2价)
2020/12/6
18
根据各元素的化学性质,你 能推断出元素最高价氧化物 对应的水化物的酸、碱性的 强弱吗?气态氢化物的稳定 性又怎样?
元素符号 状态
O 气态
S 固态
Se 固态
Te 固态
颜色
无
淡黄色
灰色
银白色
溶解性
难溶
难溶
难溶
难溶
导电性 不导电 不导电 半导体
导体
熔沸点 密度
2020/12/6
逐
渐升
高
逐 渐 增大
16
分析氧族元素的原子结构及其在 元素周期表中的位置,预测它们 的化学性质有何相似性和递变规 律?
2020/12/6
17
2020/12/6
O
S Se Te Po
10
氧族元素的性质
原子半径 氧 O 实物图片 硫 S 实物图片 硒 Se 实物图片 碲 Te 实物图片
第一课时
2020/12/6
1
氧族元素
包含元素
氧族元素包括
氧( 8O)、硫( 16 S)、硒( 34Se)、碲( 52Te)、钋( 84Po)等 它们的最外层电子、化学性质相似统称为氧族元素。
2020/12/6
2
氧原子结构特点:核外有2个电子层,最外层有6个电子
2020/12/6
3
硫原子结构特点:核外有3个电子层,最外层有6个电子
元素原子结构的异同决定其化学性 质上具有哪些特点?
} 非金属性
氧化性
减
弱
得电子能力
氧( O)、硫( S)、硒( Se)、碲(Te)、钋( Po)
金属性 还原性
}
失电子能力
增
强
主要化合价: -2、+4、+6 (O只有-2价)
2020/12/6
18
根据各元素的化学性质,你 能推断出元素最高价氧化物 对应的水化物的酸、碱性的 强弱吗?气态氢化物的稳定 性又怎样?
元素符号 状态
O 气态
S 固态
Se 固态
Te 固态
颜色
无
淡黄色
灰色
银白色
溶解性
难溶
难溶
难溶
难溶
导电性 不导电 不导电 半导体
导体
熔沸点 密度
2020/12/6
逐
渐升
高
逐 渐 增大
16
分析氧族元素的原子结构及其在 元素周期表中的位置,预测它们 的化学性质有何相似性和递变规 律?
2020/12/6
17
2020/12/6
O
S Se Te Po
10
氧族元素的性质
原子半径 氧 O 实物图片 硫 S 实物图片 硒 Se 实物图片 碲 Te 实物图片
《高二化学氧族元素》课件

氧族元素的性质特点
非金属性
氧族元素属于非金属元素,表 现出强烈的非金属性,具有较
高的电负性和氧化态。
氧化还原反应
氧族元素在氧化还原反应中表 现出多种氧化态,可以发生得 失电子的氧化还原反应。
化学键
氧族元素易形成共价键,特别 是在含氧酸中,表现出较强的 配位键合共价键。
物理性质
氧族元素在固态时具有较高的 熔点和沸点,但在液态和气态 时较为活泼,易与其它物质发
总结词
随着原子序数的递增,氧族元素单质的还原性逐渐增强。
详细描述
与氧化性相反,氧族元素的还原性随着原子序数的递增而逐渐增强。这是因为随 着原子序数的递增,电子的填充使得原子更倾向于失去电子而不是获得电子。
氧族元素的酸碱性质
总结词
氧族元素的酸碱性质呈现周期性变化。
详细描述
在氧族元素中,随着原子序数的递增,元素的酸性和碱性呈现周期性变化。例如,氧、硫、硒和碲分别呈现强酸 、中强酸、弱酸和两性的性质。这是因为随着原子序数的递增,元素的电子构型发生变化,导致其酸碱性质也随 之改变。
04
氧族元素的重要化合物
氧化物
氧化钠
化学式为Na2O,是一种常见的氧化 物,呈白色,易溶于水,与酸反应生 成对应的盐和水。
氧化镁
化学式为MgO,是一种白色或淡黄色 的氧化物,难溶于水,但能与酸反应 生成对应的盐和水。
硫化物
硫化氢
化学式为H2S,是一种无色、易燃的剧毒气体,具有臭鸡蛋气味,是硫化物中的一种。
生反应。
02
氧族元素的物理性质
氧族元素的原子结构
原子结构相似性
氧族元素具有相似的原子结构,最外 层电子数均为6个,具有相似的电子 排布。
原子半径递变性
化工四大化学(专业)氧族元素(课堂讲义)分析PPT课件

11.3.1 氧族元素概述
ⅥA
氧(O) 硫(S) 硒(Se) 碲(Te) (Po)
原子序数 典型8非金属 16准金属 34金属 52 84 价层电子构型 2s22p4 3s23p4 4s24p4 5s25p4 6s26p4
主要氧价 定化层 电子电数层子结构构型-1,为、0-即n2s有2、n较p-+42,强4、其的、0+原非、6子金-++获属262两性、、个+0电4、子-++2可62达、、到+0 4稳、
第十一章 卤素和氧族元素
11.3 氧族元素
2020年9月28日
1
11.3.1 氧族元素概述
0 ⅢA ⅣA ⅤA ⅥA ⅦA He 氦 2 B 硼 C 碳 N 氮 O 氧 F 氟 Ne 氖
3 Al 铝 Si 硅 P 磷 S 硫 Cl 氯 Ar 氩
4 Ga 镓 Ge 锗 As 砷 Se 硒 Br 溴 Kr 氪 5 In 铟 Sn 锡 Sb 锑 Te 碲 I 碘 Xe 氙 6 Tl 铊 Pb 铅 Bi 铋 Po At 砹 Rn 氡
离子 r(M2-)/pm 140 184 198 221 -
半径r(M6+)/pm - 29 42 56 67
I1/(kJ·mol-1) 1314 1000 941 869 812
电负性( p) 3.5 2.5 2.4 2.1 2.0
2020年9月28日
3
11.3.1 氧族元素概述
ⅥA
氧(O) 硫(S) 硒(Se) 碲(Te) (Po)
2020年9月28日
称为氧族元素
2
11.3.1 氧族元素概述
ⅥA
氧(O) 硫(S) 硒(Se) 碲(Te) (Po)
无机化学之氧族元素介绍课件

02
化学性质:氧族元素具有相似的化学性质,如氧化性和还原性
03
物理性质:氧族元素具有相似的物理性质,如密度、熔点、沸点等
04
应用领域:氧族元素在工业、医学、农业等领域具有广泛的应用
氧族元素分类
2
1
氧族元素包括氧、硫、硒、碲、钋五种元素
氧族元素在自然界中广泛存在,如氧气、硫磺、硒酸盐等
氧族元素在周期表中位于第16族
06
取代反应:氧族元素可与其他元素发生取代反应,生成新的化合物
04
氧化还原反应:氧族元素具有氧化性和还原性,可发生氧化还原反应
01
加成反应:氧族元素可与不饱和化合物发生加成反应
03
聚合反应:氧族元素可发生聚合反应,生成高分子化合物
05
配位反应:氧族元素可与金属离子形成配位化合物
02
氧族元素反应条件
碲:用于制造半导体器件、热电材料、催化剂等领域
钋:用于制造放射性同位素电池、探测器等领域
氧族元素在科研中的应用
01
氧族元素在材料科学中的应用:如氧化物陶瓷、高温超导材料等
02
氧族元素在生物科学中的应用:如氧气在生物体内的作用、氧化应激反应等
03
氧族元素在环境科学中的应用:如大气污染防治、水质净化等
钋:放射性同位素、医学研究等
氧族元素应用
1
氧气:生命支持,工业生产,医疗保健
2
臭氧:消毒杀菌,空气净化,水处理
3
硫:肥料,火药,橡胶,塑料
6
钋:放射性同位素,医学成像,工业探伤
5
碲:半导体,热电材料,催化剂,核工业
4
硒:电子工业,太阳能电池,生物医学
氧族元素分类依据
《氧族元素》幻灯片PPT

Cl2 + SO2 + 2H2O=H2SO4+2HCl (Br2、I2 类似) Na2SO3+ H2O +Cl2= Na2SO4 +2HCl
3、实验室制法 Na2SO3+H2SO4=Na2SO4+SO2+H2O
四、硫酸
1、物理性质 纯硫酸是一种无色油状液体。H2SO4 的质量分数为98.3%的浓硫酸的沸点 是338℃。硫酸是一种难挥发的强酸, 易溶于水,能以任意比与水混溶。浓 硫酸溶解时放出大量的热。
思考:如何检验碳与浓硫酸反响的产物?
混合气体
无水CuSO4
高锰酸钾 〔浓溴水〕
品红
品红 澄清石灰水
在常温下,浓硫酸跟某些金属,如铁、铝 等接触时,能够使金属外表生成一薄层致 密的氧化物薄膜,从而阻止内部的金属继 续跟硫酸发生反响。因此,冷的浓硫酸可 以用铁或铝的容器贮存。但是,在受热的 情况下,浓硫酸不仅能够跟铁、铝等起反 响,还能够跟绝大多数金属起反响。
〔3〕硫酸锌
带七分子结晶水的硫酸锌〔ZnSO4·7H2O〕 是无色的晶体,俗称皓矾。硫酸锌在医疗 上用作收敛剂,它可使有机体组织收缩, 减少腺体的分泌。硫酸锌还可作为木材的 防腐剂,用硫酸锌溶液浸泡过的枕木,可 延长使用时间。在印染工业上用硫酸锌作 媒染剂,能使染料固着于纤维上。硫酸锌 还可用于制造白色颜料〔锌钡白等〕。
3、用途
4、硫酸盐
〔1〕硫酸钙〔CaSO4〕
硫酸钙是白色固体。带两分子结晶水的 硫酸钙〔CaSO4·2H2O〕叫做石膏。石 膏在自然界以石膏矿形式存在。将石膏 加热到150℃~170℃时,就会失去所含 大局部结晶水而变成熟石膏 〔2CaSO4·H2O〕。熟石膏跟水混合成 糊状物后会很快凝固,重新变成石膏。
第15章氧族元素ppt课件

SO2 + H2S == S↓+2 H2O 还原性: SO2<H2SO3<亚硫酸盐 SO2能和一些有机色素结合成为无色的化 合物。
SO3 是一种强氧化剂。
SO2是大气中一种主要的气态污染物。含 有SO2的空气不仅对人类及动植物有毒害, 还会腐蚀金属制品,损坏油漆颜料,织物和
皮革、形成酸雨等。
15-3-3 硫 的 含 氧 化 合 物
3.硫酸盐有哪些主要性质? ❖ 易溶性。除Ca2+、Sr2+、Ba2+、Pb2+、Ag+、Hg2+
外,一般硫酸盐都易溶于水。 ❖ 热稳定性大。8e-构型的阳离子的盐通常
1273K不分解。18e-、(18+2)e-、9-17e-构 型热稳定性略差。 ❖ 易形成复盐(成矾)。多数硫酸盐有形成复 盐的趋势。
3.硫酸盐有哪些主要性质?
4.S2O32-中S的氧化数为+Ⅱ,处于中间氧化 态,为什么S2O32-只表现出还原性,而不表 现出氧化性?S2O32-有哪些主要性质? 5.S2O42-、H2S2O7、S2O82-均含有两个S, 它们的主要性质有何不同,为什么?(从结
构角度理解说明
15-3-3 硫 的 含 氧 化 合 物
15-2-4 过 氧 化 氢
1.H2O2有哪几种制备方法? ❖ 复分解法:
用稀硫酸与BaO2或Na2O2反应来制备过氧化氢
❖ 电解法: 电解硫酸氢盐溶液,将电解产物过二硫酸 盐进行水解,得到H2O2溶液
❖ 乙基蒽醌法
O
C2H5
Pd
+ H2
O 乙基蒽醌
OH
C2H5 + O2
OH
OH C2H5
OH 乙基蒽醇 O
SO3 是一种强氧化剂。
SO2是大气中一种主要的气态污染物。含 有SO2的空气不仅对人类及动植物有毒害, 还会腐蚀金属制品,损坏油漆颜料,织物和
皮革、形成酸雨等。
15-3-3 硫 的 含 氧 化 合 物
3.硫酸盐有哪些主要性质? ❖ 易溶性。除Ca2+、Sr2+、Ba2+、Pb2+、Ag+、Hg2+
外,一般硫酸盐都易溶于水。 ❖ 热稳定性大。8e-构型的阳离子的盐通常
1273K不分解。18e-、(18+2)e-、9-17e-构 型热稳定性略差。 ❖ 易形成复盐(成矾)。多数硫酸盐有形成复 盐的趋势。
3.硫酸盐有哪些主要性质?
4.S2O32-中S的氧化数为+Ⅱ,处于中间氧化 态,为什么S2O32-只表现出还原性,而不表 现出氧化性?S2O32-有哪些主要性质? 5.S2O42-、H2S2O7、S2O82-均含有两个S, 它们的主要性质有何不同,为什么?(从结
构角度理解说明
15-3-3 硫 的 含 氧 化 合 物
15-2-4 过 氧 化 氢
1.H2O2有哪几种制备方法? ❖ 复分解法:
用稀硫酸与BaO2或Na2O2反应来制备过氧化氢
❖ 电解法: 电解硫酸氢盐溶液,将电解产物过二硫酸 盐进行水解,得到H2O2溶液
❖ 乙基蒽醌法
O
C2H5
Pd
+ H2
O 乙基蒽醌
OH
C2H5 + O2
OH
OH C2H5
OH 乙基蒽醇 O
氧族元素课件一PPT课件

2020年10月2日
4
硒原子结构特点:核外有4个电子层,最外层有6个电子
2020年10月2日
5
碲原子结构特点:核外有5个电子层,最外层有6个电子
2020年10月2日
6
钋原子结构特点:核外有6个电子层,最外层有6个电子
2020年10月2日
7
Uuh原子结构特点:核外有7个电子层,最外层有6个电子
2020年10月2日
19
元素最高价氧化物对应的水化物: 酸 性 逐 渐 减弱
H2SO4,H2SeO4,H2TeO4
气态氢化物的稳定性: 稳定 性 逐 渐 减弱
H2O H2S H2Se H2Te
2020年10月2日
20
巩固复习
VIA族与同周期的 VIIA族元素的对比:
元素
S
Cl
最外层电子
6
7
位置
第三周期,VIA族 第三周期,VIIA族
参考答案:①O2和H2需点燃化合生成H2O,而F2和H2在冷
暗处即爆炸化合生成HF;②水中-2价的氧能被F2氧化而
生20成20年O102月:2日2F2 + 2H2O=4HF + O2
24
演讲完毕,谢谢观看!
Thank you for reading! In order to facilitate learning and use, the content of this document can be modified, adjusted and printed at will after downloading. Welcome to download!
2020年10月2日
23
课堂练习:
1.碲元素及其化合物不可能具有的性质是(
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
离子 r(M2-)/pm 140 184 198 221 -
半径r(M6+)/pm - 29 42 56 67
I1/(kJ·mol-1) 1314 1000 941 869 812
电负性( p) 3.5 2.5 2.4 2.1 2.0
2021/3/1
3
11.3.1 氧族元素概述
ⅥAห้องสมุดไป่ตู้
氧(O) 硫(S) 硒(Se) 碲(Te) (Po)
ⅥA
氧(O) 硫(S) 硒(Se) 碲(Te) (Po)
原子序数 典型8非金属 16准金属 34金属 52 84 价层电子构型 2s22p4 3s23p4 4s24p4 5s25p4 6s26p4
主要氧价 定化层 电子电数层子结构构型-1,为、0-即n2s有2、n较p-+42,强4、其的、0+原非、6子金-++获属262两性、、个+0电4、子-++2可62达、、到+0 4稳、
2021/3/1
7
11.3.2 氧和臭氧
氧
无色、无味、无臭的气体 氧分子的解离能较大
O 2O ν 2 h液态氧的化学活性D很高(O2) = 498.34 kJ·mol-1
氧是生命元素
2021/3/1
8
11.3.2 氧和臭氧
臭氧的形成
、 通过电子流、质子流
短波辐射(紫外线)
O2 hν 2O O2 + O hν→ O 通过闪电, 无3声放电也可生成
称为氧族元素
2021/3/1
2
11.3.1 氧族元素概述
ⅥA
氧(O) 硫(S) 硒(Se) 碲(Te) (Po)
原子序数 8 16 34 52 84
价层电子以构单型质存2在s2。2为为p稀4分散3布s元2最3素广p。4的在4成自s矿24然元p界4 无5单s2质5p存4在6,s26p4 主要氧化素硫,化数很物多形-金式1、属 存0-常2在在存、地在-+壳24于中、、重0+以金、6氧属-++化262硫物、、化+0、物4、矿-++2中62、、+0 4、放元射素性原子半径/pm 66 104 117 137 153
臭氧的分子结构
153
离子 r(M2-)/pm 140 184 198 221 -
半径r(M6+)/pm - 29 42 56 67
I1/(kJ·mol-1) 1314 1000 941 869 812
电负性( ) 3.5 2021/3/1
p
2.5
2.4
2.1 2.0 4
11.3.1 氧族元素概述
ⅥA
氧(O) 硫(S) 硒(Se) 碲(Te) (Po)
原子序数 典型8非金属 16准金属 34金属 52 84 价层电子构型 2s22p4 3s23p4 4s24p4 5s25p4 6s26p4
主要氧化数
-1金、属-2性、增-强2 ,、0非、金属-2性、减0弱、 -2 、 0 、
0
+2 、+4 +2 、+4 +4 、+6 +6 +6
-
原子半径/pm 66
第十一章 卤素和氧族元素
11.3 氧族元素
2021/3/1
1
11.3.1 氧族元素概述
0 ⅢA ⅣA ⅤA ⅥA ⅦA He 氦 2 B 硼 C 碳 N 氮 O 氧 F 氟 Ne 氖
3 Al 铝 Si 硅 P 磷 S 硫 Cl 氯 Ar 氩
4 Ga 镓 Ge 锗 As 砷 Se 硒 Br 溴 Kr 氪 5 In 铟 Sn 锡 Sb 锑 Te 碲 I 碘 Xe 氙 6 Tl 铊 Pb 铅 Bi 铋 Po At 砹 Rn 氡
原与子非半径金/p属m、金66属性10较4 弱117 137 153
离子 半径
rr((的MM62元+-))//pp素mm 形14-成0 共1价2894化合1492物8
221 56
67
I1/(kJ·mol-1) 1314 1000 941 869 812
电负性( p) 3.5 2.5 2.4 2.1 2.0
2021/3/1
9
11.3.2 氧和臭氧
臭氧保护层
存在于离地面20-40km的高空,是保护地 面生物免受太阳强烈辐射的防御屏障
近年来,由于大气中NO、NO2等氮 氧化物和氯氟化碳(CFCl3、CF2Cl2) 等含量过多,使臭氧层遭到破坏,
则必须采取措施来保护臭氧层
2021/3/1
10
11.3.2 氧和臭氧
原子序数 8 16 34 52 84
价层电子构型 2s22p4 3s23p4 4s24p4 5s25p4 6s26p4
半衰期为138.7 天。
原主为 纯 大 氧 动子要氧量常生机半用的用命的氧于 纯 作元助径化素 燃医 氧 制为 主 等/疗 用 冷。 剂p数角火二m和 于 剂富。药十高 炼 和氧有(多K-空 钢 火空斜C种1少调有传飞 。 箭气6l、O方0是年同-6量节光真行液发或32硫、发居素硒作电和,、、S现里异对用性制-+、单的夫2形41人,质造C斜人体、0)、体过,光0硫4于+新量用电、618陈则于管-++92862代有电可所最电1、1、制有高阻谢毒影7+0造金,器起。、4、合属用材-++金 中 于2621。 电 制、3、在 阻 造7+0 4、
104
117
增大
137 153
离子 r(M2-)/pm 140 184 198 221 增大 -
半径r(M6+)/pm - 29 42
I1/(kJ·mol-1) 1314 1000 941 电负性( p) 3.5 2.5 2.4
2021/3/1
56 67 869 减小812
减小
2.1 2.0 5
11.3.1 氧族元素概述
-
原子半径/pm 66 常见的1氧04化数为1-217 137 153
离子 r(M2-)/pm硫成、氧1硒4化0、数碲为还+12可、8利4+4用、外+6层1的9d化轨8合道物形 221
-
半径r(M6+)/pm - 29 42 56 67
I1/(kJ·mol-1) 1314 1000 941 869 812
电负性( p) 3.5 2.5 2.4 2.1 2.0
2021/3/1
6
11.3.1 氧族元素概述
ⅥA
氧(O) 硫(S) 硒(Se) 碲(Te) (Po)
原子序数 8 16 34 52 84
价层电子构型 2与s22大p4 多3s2数3p4金4s属24p元4 素5s25p4 6s26p4
主与要大氧多化数数二金元-1属离形、0-2元成子、 -+素2共型4、、0价化+形、6型合-++成262化物、、+0合4、 -++2物62、、+04、 -
