酸碱平衡2015化学竞赛夏令营江苏
2004年全国高中学生化学竞赛(江苏省赛区)夏令营选拔赛试题

“仪征化纤白斯特杯”2004年全国高中学生化学竞赛(江苏省赛区)选拔赛试题(2004年7月15日 8:20-11:20 共计3小时)● 竞赛时间3小时。
迟到超过30分钟者不能进考场。
开始考试后1小时内不得离场。
时间到,把试卷(背面朝上)放在桌面上,立即起立撤离考场。
● 所有解答必须写在指定位置,不得用铅笔填写。
● 姓名、准考证号和所属学校必须写在首页左侧指定位置,写在其他地方者按废卷论。
● 允许使用非编程计算器以及直尺等文具。
第1题(共8分)(1) 越来越多的事实表明:在环境与生物体系中,元素的毒性、生物可给性、迁移性和再迁移性不是取决于元素的总量,而是与该元素的化学形态密切相关。
例如,在天然水正常pH下,铝处于形态,对鱼类是无毒的;但是,若天然水被酸雨酸化,铝则转化为可溶性有毒形态,会造成鱼类的大量死亡。
再如,铝离子能穿过血脑屏障进入人脑组织,引起痴呆等严重后果,而配合态的铝,如处于形态时就没有这种危险。
(2) 在元素周期表第4、第5周期中成单电子数最多的过渡元素的电子构型分别为 和 ;元素名称是 和 。
依据现代原子结构理论,请你推测,当出现5g 电子后,成单电子最多的元素可能的价层电子构型为 ,可能是 元素。
第2题(共9分)(1) 谷氨酸的系统名为:2-氨基戊二酸(pKa 1=2.19,pKa 2=4.25,pKa 3=9.67)。
请回答下列问题:① 写出其结构式 ;② 写出谷氨酸在pH=10.00的水溶液中,占优势的离子结构 ; ③ 若谷氨酸溶于pH=7的纯水中,所得溶液的pH 是x ,则x 7(填“>”或“<”);此氨基酸等电点是大于x 还是小于x? 为什么?。
(2) 110.1℃,6.050×104Pa ,测定醋酸蒸气的密度所得到的平均相对摩尔质量是醋酸单分子摩尔质量的 1.520倍。
假定气体中只含有单分子和双分子。
则110.1℃下反应2CH 3COOH(g)(CH 3COOH)2(g)的ΘP K 为 ;ΔΘ∆m r G 的计算公式及结果为:(Θp =1.013×105Pa)。
第十三讲_化学平衡 2015化学竞赛夏令营 江苏要点

2018/10/5
r Gm r Gm RT ln Qa
MnO2 (s) 4H (aq) 2Cl (aq) Mn2 (aq) Cl2 ( g ) 2H2O(l )
B 1
(
cMn2 c cH c
)eq ( ) (
4 eq
pCl2 p 2 HCl
03:15
二.化学平衡的热力学和动力学特征
1、化学反应达到平衡时,各物种的浓度维持不变
cB
无净变化
cP 生成物 cR 反应物
teq
南京师范大学化科院 物理化学/化学奥赛培训
t
2018/10/5
二.化学平衡的热力学和动力学特征
2、动力学特征
达到平衡时,正反应速率和逆反应速率是相等的。
r Gm
②
f Gm ( B) 为标准摩尔生成吉布斯自由能
在标准压力下,由稳定单质生成1 mol化合物时 吉布斯自由能的变化值,称为该化合物的标准 摩尔生成吉布斯自由能。
r Gm f Gm (H2O, l )
南京师范大学化科院
物理化学/化学奥赛培训
2018/10/5
r Gm
2015年全国高中化学竞赛夏令营(江苏)讲座
第十三讲
南京师范大学化科院
物理化学/化学奥赛培训
2018/10/5
主要内容
一、化学热力学基础导言 二、化学平衡的热力学特征和动力学特征 三、van’Hoff 等温方程式和反应的平衡常数 四、影响化学平衡的因素 五、几种典型化学平衡的计算实例
南京师范大学化科院 物理化学/化学奥赛培训
2018/10/5
r Gm
2002~2008年全国高中学生化学竞赛(江苏赛区)夏令营选重点

2002~2008年全国高中学生化学竞赛 (江苏省赛区夏令营选拔赛试题分类化学平衡(2002年7.(6分已知,CrO 42离子和Cr 2O 72离子在水溶液中存在如下平衡:--2CrO 4(aq+2H+(aq2-Cr 2O 72-[Cr 2O 4](aq+H2O(1,K ==1. 2⨯1014 2-2+2[Cr 2O 4][H ]2-⑴要使平衡向左移动,可以加,或加Ba 2+。
⑵请自行设计两个实验(简单说明实验操作和实验现象来验证Ba 2+确实能使平衡向左移动。
(2003年3.(共6分提出查理定律的查理很幸运,碰巧开始时没有以N 2O 4来研究气体行为,否则他或许会得出一种相当特殊的温度效应。
对于平衡N 2O 4(g4α2p ,α为N 2O 42NO 2 (g,在 298K 时其K p = 0.1 p,而K p =21-αθ的离解度,p 为平衡体系的总压。
假设,298 K 时,查理把0.015 mol 的N 2O 4放于一只2.44×10-3m 3的烧杯中,当离解达到平衡后,他将看到平衡压力等于0.205p θ。
其对应的α = 0.33⑴在保持体积不变的前提下,查理做把温度升高10%的实验,即把温度升高至328K 。
根据理想气体定律,其压力也应只增大10%,即等于0.226p θ,但查理发现这时的压力为0.240p θ。
自然,问题是出在N 2O 4的离解度增加上了。
试求此时的α和K p 。
⑵若NO 2在298K 下的标准摩尔生成自由能为51.463kJ·mol 下的标准摩尔生成自由能。
-1,试计算N 2O 4在298K(2004年2.(共9分⑴谷氨酸的系统名为:2-氨基戊二酸(pKa1=2.19,pKa 2=4.25,pKa3=9.67。
请回答下列问题:①写出其结构式;②写出谷氨酸在pH=10.00的水溶液中,占优势的离子结构;③若谷氨酸溶于pH=7的纯水中,所得溶液的pH 是x ,则x 7(填“>”或“<”;此氨基酸等电点是大于x 还是小于x? 为什么? 。
高中化学竞赛历程

化学竞赛历程以下是我所经历的全部化学竞赛历程,绝对是事实,但今后政策有变就不知道了。
特别是省选的课程安排和时间安排,好像每年都不一样。
2008年5月,江苏预赛。
题目是高考难度,之前有化学教与学的模拟卷,难度相近,一般通过分数线在100分左右。
2008年7月初,江苏夏令营。
地点在南师大,约三千名学生,十天,由南师大、南大、南京工业大学等大学的老师讲课,内容基本按照全国初赛要求,最后一天考试,3个小时,会筛选一部分人,只有约600(?大概)人能通过并获资格参加全国初赛。
夏令营的卷子是南师大的老师借鉴前一年初赛卷,加上自己对化学竞赛的理解而出的试卷,题型和初赛相近,难度比初赛高,对初赛很有参考性。
作为高二学生参加夏令营是很有帮助的,可以系统了解化学竞赛的知识要求,并且有专门的十天全全学竞赛,这段时间水平能提高很多。
2008年8月中旬,南大强化班。
在南京华山饭店,夏令营通过的人可参加,由南大的老师、吴勇老师和扬州大学的一老师上课。
南大的老师是将来省选时的任课/ 出卷老师。
这段时间讲的内容有一些已经达到决赛要求。
第一天能听到院士的演讲,开拓视野;有机吴琳老师讲的内容很有一语惊醒梦中人的效果;南师大的吴勇老师和扬大的老师会教怎么做题,也很有用。
无机氧化还原和电化学的计算方面,如果难理解可以先做笔记,不懂没关系,初赛没有这么难。
PS 对于高中学竞赛的同学,利用好任意一个暑假都能让自己的水平突飞猛进,高一升高二的暑假里这两次大学里培训的机会要好好利用。
如果没能进入下一轮,也要利用好暑假。
2008年9月,全国初赛。
一开学的第二个星期天,地点在南师大随园,前一天(周六)的下午有夏令营的试卷评析,由出题老师讲解出题思路和答案。
初赛考3个小时,题目不难,有些地方不好理解,但难度绝对不大,也很少超纲。
保送和一等奖的线要看当年题目难度,总体而言,如果题目都能做出来,再仔细检查把失误减到最少就没问题了。
初赛后要等两星期左右才知道结果,保送还不能最终确定,保送的试卷会送到北京审查,再由北京最终评分和确定各省保送名额,最终的证书要到11月才能送到。
2016江苏化学夏令营试题+标准答案

2016年 “ 扬 子 石 化 杯 ”第 30届 中 国 化 学 奥 林 匹 克 竞 赛 (江 苏 赛区 )夏 令 营 暨 选 拔 赛 试 题题号 1 2 3 4 5 6 7 89 10 总分满分 12 129 1 00 得分评卷人1.考试时间3小时。
迟到超过半小时者不能进考场。
开始考试后1小时内不得离场。
2.所有解答必须写在指定的位置,用铅笔解答无效(包括作图)。
草稿纸另发。
不得将任何纸张带入考场。
3.凡要求计算者,须给出计算过程,没有计算过程无效。
4.姓名、准考证号和所属学校等必须写在首页左侧指定位置,写于其他地方者按废卷论处。
5.用涂改液涂改的解答无效。
6.允许使用非编程计算器以及直尺等文具。
第1题(12分)11- 二氧化碳是自然界碳循环中的重要物质。
植物通过光合作用将二氧化碳和水转化为碳水化合物和___________;溶解了二氧化碳的雨水和地下水可以将石灰岩变为可溶的___________(填化学式);2CO 分子是___________分子(填“极性”或“非极性”),可以与许多物质反应,下列物质中能与二氧化碳反应的是___________。
A.金属镁ﻩﻩﻩB .苏打ﻩ ﻩC.小苏打ﻩﻩ D.二氧化硫12- 硫-氮化合物在无机化学中是一个非常活跃的研究领域。
实验测得22S N 分子为环状四方平面型结构,对称性为2h D 点群,S N -键长为165pm ,键角约为90。
S原子的价电子排布为________________;从离域π键的角度分析,22S N 分子可看成是S 和N原子间通过杂化轨道形成σ键的环状四方平面分子骨架,在垂直分子平面方向形成了一个离域大π键。
22S N 中N 原子的杂化方式为______________,离域大π键可表达为________________________。
第2题(12分)21- 分析某一种不纯的2Na S ,已知其中除含有22Na S 9H O ⋅外,还含有2232Na S O 5H O ⋅,取此试样10.00g 配制成500.0mL 溶液。
2021年全国高中学生化学竞赛江苏省赛区夏令营选拔赛试题

第11题(8分) C60的发现开创了国际科学的一个新领域,除C60分子本身具有诱人的性质外,人们发现它的金属掺杂体系也往往呈现出多种优良性质,所以掺杂C60成为当今的研究热门领域之一。经测定C60晶体为面心立方结构,晶胞参数a=1420pm。在C60中掺杂碱金属钾能生
4-2绝大多数含有金属-金属键的配合物中,金属表现出为0或接近0的低氧状态,如
C3X2(CO)10。已知X2(CO)10中心原子的配位数为6,试画出其结构。
4-3某催化剂研究所催化剂生产装置在生产聚丙烯腈催化剂的同时产生了大量的催化剂粉尘
和工业废气,其废气主要成分为NOX(氮氧化物)。工业上一般采用碱液、氨水或碱性KXO4(含KOH)溶液吸收NOX。其中以碱性溶液的吸收效率最高。
(1)写出碱性KXO4溶液吸收NOX的化学反应方程式(反应中KXO4全转化为XO2)
(2)为了增强KXO4的氧化吸收能力,KOH的浓度应控制偏高还是偏低,为什么?
第5题(10分)化合物(4)一种新的向列型液晶材料组成成分,该化合物在环已基和芳环之间插入两个饱和碳原子,使其具有低粘度和低的介电各向异性的特性。它与低粘度和高的介电各向异性向列型液晶材料混合使用,能改善液晶材料的显示性能,提高清晰度,在液晶显示材料中具有良好的应用前景。该化合物可按下面的方法合成:
1-2放射性元素的发现19世纪末20世纪初物理学发生巨大变革的基础。最早发现的具有放
235射性的元素是铀,铀也是核电厂的燃料。*****U是自然界存在的易于发生裂变的唯一核素。92U142吸收一个中子发生核裂变可得到
Ba和91Kr,或135I和97Y等。请写出上述核反应方程式:
2003年“扬子石化杯”第17届高中生化学竞赛(江苏赛区)夏令营选拔赛试题
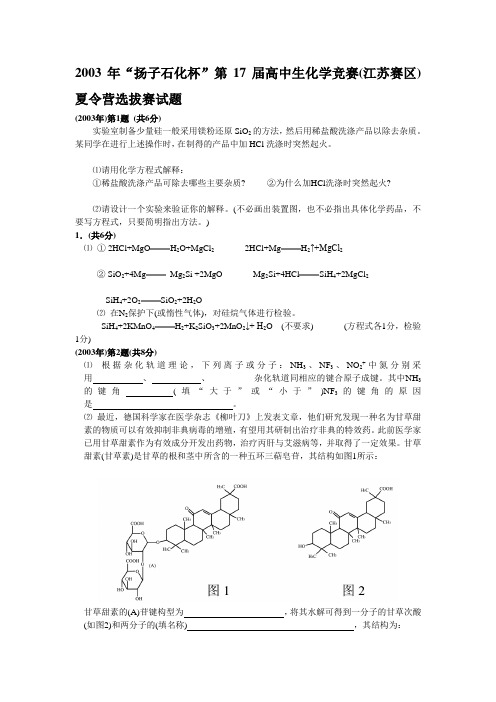
2003年“扬子石化杯”第17届高中生化学竞赛(江苏赛区)夏令营选拔赛试题(2003年)第1题(共6分)实验室制备少量硅一般采用镁粉还原SiO2的方法,然后用稀盐酸洗涤产品以除去杂质。
某同学在进行上述操作时,在制得的产品中加HCl洗涤时突然起火。
⑴请用化学方程式解释:①稀盐酸洗涤产品可除去哪些主要杂质? ②为什么加HCl洗涤时突然起火?⑵请设计一个实验来验证你的解释。
(不必画出装置图,也不必指出具体化学药品,不要写方程式,只要简明指出方法。
)1.(共6分)⑴① 2HCl+MgO H2O+MgCl22HCl+Mg H2↑+MgCl2② SiO2+4Mg Mg2Si +2MgO Mg2Si+4HCl SiH4+2MgCl2SiH4+2O2SiO2+2H2O⑵在N2保护下(或惰性气体),对硅烷气体进行检验。
SiH4+2KMnO4H2+K2SiO3+2MnO2↓+ H2O (不要求) (方程式各1分,检验1分)(2003年)第2题(共8分)⑴根据杂化轨道理论,下列离子或分子:NH3、NF3、NO2+中氮分别采用、、__________杂化轨道同相应的键合原子成键。
其中NH3的键角(填“大于”或“小于”)NF3的键角的原因是。
⑵最近,德国科学家在医学杂志《柳叶刀》上发表文章,他们研究发现一种名为甘草甜素的物质可以有效抑制非典病毒的增殖,有望用其研制出治疗非典的特效药。
此前医学家已用甘草甜素作为有效成分开发出药物,治疗丙肝与艾滋病等,并取得了一定效果。
甘草甜素(甘草素)是甘草的根和茎中所含的一种五环三萜皂苷,其结构如图1所示:甘草甜素的(A)苷键构型为,将其水解可得到一分子的甘草次酸(如图2)和两分子的(填名称) ,其结构为:。
2.(共8分)⑴ sp 3 sp 3 sp 大于 氟的电负性大于氢,因此用于N -F 成键的电子对更偏向氟 (或离氮原子核较远),氮周围电子密度减小(或N -F 成键电子对间的“距离”较远),斥力较小,因而键角较小。
2005年“南化·福达”杯第22届全国高中学生化学竞赛(江苏赛区)夏令营选拔赛试题
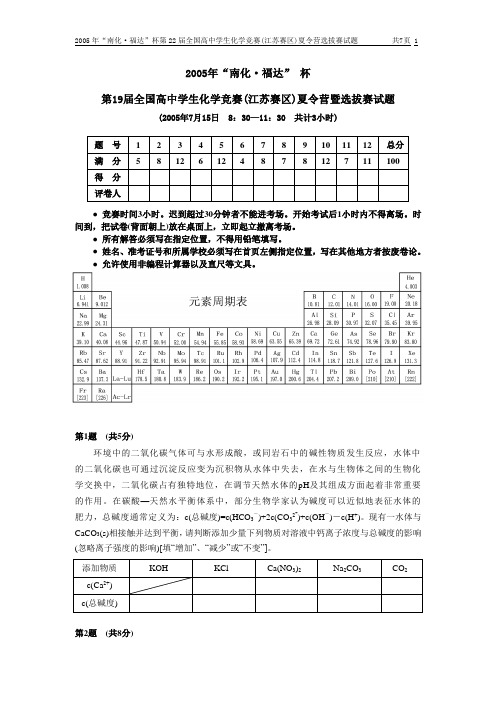
2005年“南化·福达” 杯第19届全国高中学生化学竞赛(江苏赛区)夏令营暨选拔赛试题(2005年7月15日 8:30—11:30 共计3小时)题号 1 2 3 4 5 6 7 8 9 10 11 12 总分满分 5 8 12 6 12 4 8 7 8 12 7 11 100得分评卷人● 竞赛时间3小时。
迟到超过30分钟者不能进考场。
开始考试后1小时内不得离场。
时间到,把试卷(背面朝上)放在桌面上,立即起立撤离考场。
● 所有解答必须写在指定位置,不得用铅笔填写。
● 姓名、准考证号和所属学校必须写在首页左侧指定位置,写在其他地方者按废卷论。
● 允许使用非编程计算器以及直尺等文具。
第1题(共5分)环境中的二氧化碳气体可与水形成酸,或同岩石中的碱性物质发生反应,水体中的二氧化碳也可通过沉淀反应变为沉积物从水体中失去,在水与生物体之间的生物化学交换中,二氧化碳占有独特地位,在调节天然水体的pH及其组成方面起着非常重要的作用。
在碳酸—天然水平衡体系中,部分生物学家认为碱度可以近似地表征水体的肥力,总碱度通常定义为:c(总碱度)=c(HCO3-)+2c(CO32-)+c(OH-)-c(H+)。
现有一水体与CaCO3(s)相接触并达到平衡,请判断添加少量下列物质对溶液中钙离子浓度与总碱度的影响(忽略离子强度的影响)[填“增加”、“减少”或“不变”]。
添加物质KOH KCl Ca(NO3)2Na2CO3CO2 c(Ca2+)c(总碱度)第2题(共8分)铝是一种重要的金属材料,广泛用于制作导线、结构材料和日用器皿,铝合金大量用于飞机和其它构件的制造。
十九世纪曾以电解熔融氧化铝的方法制备金属铝,当时铝由于价格昂贵而只被贵族用作装饰品。
现代工业上是通过在1000℃左右的高温下电解氧化铝和冰晶石(Na3AlF6)的熔融液制备铝的。
请回答下列问题:(1)现代工业电解制备铝过程中正极和负极实际发生的反应分别为:在正极放电产生;在负极放电产生。
2无机化学与竞赛(高一)郭琦

15. 有机化合物的基本类型与基本特征。 16. 高分子的基本概念(单体、聚合、缩聚解聚、混聚等,不 要求聚合反应机理)。
关于化学竞赛选手
一、参赛学生应具备的条件 1. 对化学课具有浓厚的兴趣 2. 各科应全面发展 3. 头脑灵活,善“诡辨” 4. 勇于探索、大胆创新 5. 刻苦钻研、持之以恒 二、参赛学生的培养 1. 自学能力的培养 自学能力包括阅读、查资料、熟练地使用各种工具书的 能力。在教学中,为了培养学生的自学能力,课本上一看就 懂的内容可以有意不讲,引导学生自己看书,让学生主动自 学,以达到逐步培养自学能力的目的。 2. 学习方法的培养 3. 实验技能的培养
无机化学与奥林匹克化学 竞赛
江苏第二师范学院 郭 琦
奥林匹克化学竞赛的要求
对奥赛的认识
参赛对象 竞赛内容 时间安排
化学竞赛需要什么
参加全国高中学生化学竞赛初赛的选手为普通高 中学生,主要是高三学生,参赛学生应品德高尚、身 心健康、学有余力,对化学及相关学科有特殊兴趣, 各科中学课程成绩优良。
在周期表中的位置。半金属(类金属)。主、副族的重要而常 见元素的名称、符号及在周期表中的位置、常见氧化态及其主 要形体。铂系元素的概念。 7. 分子结构 路易斯结构式。价层电子对互斥模型。杂化轨道理 论对简单分子(包括离子)几何构型的解释。共价键。键长、 键角、键能。σ键和π键。离域π键。共轭(离域)体系的一般 性质。等电子体的一般概念。键的极性和分子的极性。等电子 体的一般概念。键的极性和分子的极性。相似相溶规律。对称 性基础(限旋转和旋转轴、反映和镜面、反演和对称中心) 8. 配合物 路易斯酸碱。配位键。重要而常见的配合物的中心离 子(原子)和重要而常见的配体(水、羟离子、卤离子、拟卤 离子、氨、酸根离子、不饱和烃等)。螯合物和螯合效应。重 要而常见的配合反应。配合反应与酸碱反应、沉淀反应、氧化 还原反应的关系(定性说明)。配合物几何构型和异构现象的 基本概念和基本事实。配合物的杂化轨道理论。用杂化轨道理 论说明配合物的磁性和稳定性。用八面体配合物的晶体场理论 说明Ti(OH)63+的颜色。软硬酸碱的基本概念和重要的软酸软碱 和硬酸硬碱。
“扬子石化杯”第26届全国高中学生化学竞赛(江苏省赛区)夏令营暨选拔赛试题参考答案及评分标准

2012年“扬子石化杯”第26届全国高中生化学竞赛(江苏赛区)选拔赛暨夏令营试题(2012年7月22日8:30~11:30 共计3小时)题号 1 2 3 4 5 6 7 8 9 10 总分满分8 6 6 12 12 10 14 8 12 12 100 得分评卷人注意事项:1. 考试时间3小时。
迟到超过半小时者不能进入考场。
开考后1小时内不得离场。
2. 所有解答必须写在指定位置,用铅笔解答无效(包括作图)。
草稿纸另发。
不得将任何纸张带入考场。
3. 姓名、准考证号和所属学校必须写在首页左侧指定位置,写在其他地方者按废卷论处。
4. 凡要求计算者,须给出计算过程,没有计算过程无效。
5. 用涂改液涂改的答案无效。
6. 允许使用非编程计算器以及直尺等文具。
气体常数R = 8.31447J·K-1·mol-1法拉第常数F = 96485C·mol-1 阿佛加德罗常数N A=6.022142×1023 mol-1第1题(8分)长期以来大家都认为草酸根离子C2O42—为具有D2h对称性的平面型结构(如图(a)所示),近期的理论研究表明:对于孤立的C2O42—,具有D2d对称性的非平面型结构更加稳定(如图(b)所示,其中O—C—C—O的二面角为90°)根据上述信息,请回答下列问题:1-1 草酸根中C原子的杂化类型为;1-2 在C2O42—中存在的离域键为(请写出离域键的个数和种类);1-3 在C2O42—中C—O键和C—C的键级分别为和;1-4 D2d结构比D2h结构稳定的原因是。
第2题(6分)人体内胰蛋白酶浓度水平通常被认为是胰脏健康与否的晴雨表,因而简单、快速、高效地检测胰蛋白酶浓度也在生物医学上颇为重要。
下图1为一种胰蛋白酶荧光检测方法示意图。
AIE探针分子先与BAS相互作用形成复合物,显示荧光;该复合物与胰蛋白酶作用,荧光减弱,减弱程度和胰蛋白酶浓度相关,据此可进行定量分析。
2019江苏化竞夏令营 第33届中国化学奥林匹克(初赛)选拔赛暨2019年江苏省高中学生化学奥林匹克复赛试题

第33届中国化学奥林匹克(初赛)选拔赛暨2019年江苏省高中学生化学奥林匹克复赛试题(2019年7月16日8:30-11:30)气体常数R=8.31447 J·K-1·mol-1法拉第常数F=96485 C·mol-1阿伏加德罗常数N A=6.022142×1023mol-1第1题(12分)硼族(ⅢA)元素的基本特点在于其缺电子性,它们有充分利用价轨道、力求生成更多键、以增加体系稳定性的强烈倾向。
以硼族元素为核心可组成形式多样的单核、双核或多核的分子、离子。
1-1请写出硼族元素原子的价电子构型__________。
1-2写出硼酸与水反应的离子方程式______________________________________,并说明硼酸为几元酸__________。
1-3BF3为缺电子化合物,BF3与F-离子反应生成BF-4离子时,其反应类型为______________;分子中硼的杂化类型由_______变为_______。
1-4AlCl3和Al(Me)3在气相和液相以双聚体的形式存在,请分别画出其结构图。
第2题(10分)2018年我国科学家在化学键研究领域取得重大突破。
研究发现位于主族的碱土金属钙、锶和钡可以与CO形成稳定的羰基化合物,分子结构满足18电子规则,表现出了典型的过渡金属成键特性。
这一发现表明碱土金属或具有与一般认知相比更为丰富的化学性质。
2-1写出锶原子的最高占据原子轨道_______和最低空的原子轨道_______。
2-2写出锶和CO结合形成的中性单电子中心羰基化合物的化学式____________;CO与中心锶结合时的成键原子是______。
2-3CO能够与过渡金属或碱土金属形成稳定的羰基化合物是因为二者之间形成了_______________键。
2-4BF和CO互为等电子体,但是计算结果表明,BF分子中B-F键的键级约为1.6。
请写出BF中可能存在的Lewis共振式,根据杂化轨道理论指出结构中F原子的杂化类型。
“扬子石化杯”第24届全国高中学生化学竞赛(江苏赛区)夏令营暨选拔赛试题参考答案及评分标准

20XX年“扬子石化杯”第24届全国高中学生化学竞赛(江苏赛区)夏令营暨选拔赛试题参考答案及评分标准[1]20XX年“扬子石化”杯第24届全国高中生化学竞赛(江苏赛区)夏令营选拔赛试题20XX年“扬子石化”杯第24届全国高中生化学竞赛(江苏赛区)夏令营暨选拔赛试题(20XX年7月22日8:30—11:30 共计3小时)把试卷(背面朝上)放在桌面上,立即起立撤离考场。
·所有解答必须写在指定位置,不得用铅笔填写。
·姓名、准考证号和所属学校必须写在首页左侧指定位置,写在其他地方者按废卷论。
·允许使用非编程计算器以及直尺等文具。
第1题(9分)将氟气通入氢氧化钠溶液中,可得到OF2。
OF2是一种无色、几乎无味的剧毒气体,主要用于氧化、氟化反应、火箭工程助燃剂等。
请回答下列问题:1-1 OF2的中文名称是,OF2中O的化合价为,OF2中O原子的杂化轨道类型是,OF2分子的空间构型为。
1-2 与H2O分子相比,OF2分子的键角更(填“大”或“小”)。
1-3 与H2O分子相比,OF2分子的极性更(填“大”或“小”),原因是。
1-4 OF2在常温下就能与干燥空气反应生成二氧化氮和无色气体氟化氮,该反应的化学方程式为(已知反应中N2和O2的物质的量之比为4:1)。
第2题(9分)金属钛无毒、密度小而强度高,广泛应用于航天材料、人造骨骼的制造等,有航天金属和生命金属的美誉。
2-1 A为+4价钛的卤化物,A在潮湿的空气中因水解而冒白烟。
向硝酸银-硝酸溶液中滴加A,有白色沉淀B生成,B溶于氨水。
取少量锌粉投入A的盐酸溶液中,可得到含第1页共6页20XX年“扬子石化”杯第24届全国高中生化学竞赛(江苏赛区)夏令营选拔赛试题TiCl3的紫色溶液C。
将C溶液与适量氯化铜溶液混合有白色沉淀D生成,混合溶液褪为无色。
①B的化学式为:AgCl ;B溶于氨水所得产物为:;②A水解的化学反应方程式为:TiCl4+3H2O==4HCl ,理论计算可知,该反应的平衡常数很大,增加HCl浓度不足以抑制反应的进行,可是在浓盐酸中,A却几乎不水解,TiCl6 2- ;③C溶液与适量氯化铜溶液反应的化学方程式为:2-2 已知钛的元素电势图(Eθ/V)为:则:Ti2+(填“能”或“不能”)在水溶液中稳定存在;Ti溶于热浓盐酸的化学方程式为:2Ti+6Hcl==2TiCl3+3H2 。
第23届全国高中学生化学竞赛(江苏)夏令营选拔赛试题和答案

第23届全国高中学生化学竞赛(江苏)夏令营选拔赛试题和答案第23届全国高中学生化学竞赛(江苏赛区)夏令营暨选拔赛试题(2009年7月22日8:30—11:30 共计3小时) ● 竞赛时间3小时。
迟到超过30分钟者不能进考场。
开始考试后1小时内不得离场。
时间到,把试卷(背面朝上)放在桌面上,立即起立撤离考场。
● 所有解答必须写在指定位置,不得用铅笔填写。
● 姓名、准考证号和所属学校必须写在首页左侧指定位置,写在其他地方者按废卷论。
● 允许使用非编程计算器以及直尺等文具。
第1题(6分)1-1 在化工、冶金、电子、电镀等生产部门排放废水中,常常含有一些汞金属元素,汞元素能在生物体内积累,不易排出体外,具有很大的危害。
处理含Hg2+废水可加入Na2S或通入H2S,使Hg2+形成HgS沉淀。
但如果Na2S过量则达不到去除Hg2+的目的,为什么?_________________________________________ __________。
解决这一问题的方法是再向该废水中加入FeSO4,可有效地使HgS沉降,为什么?_________________________________________江苏化学网 _____________________________________。
1-2 铊属于放射性的高危重金属。
铊和铊的氧化物都有毒,能使人的中枢神经系统、肠胃系统及肾脏等部位发生病变。
人如果饮用了被铊污染的水或吸入了含铊化合物的粉尘,就会引起铊中毒。
常用普鲁士蓝作为解毒剂,治疗量为每日250 mg/kg。
请说明用普鲁士蓝作为解毒剂的化学原理,并写出相应的化学方程式。
_________________________________________ _____________________________________________________________________________ _____________________________________________________________________________ _____________________________________1-3 在研究酸雨造成的某地土壤的酸化问题时,需pH = 10.00 的碳酸盐缓冲溶液,在500ml 0.20 mol/L 的NaHCO3溶液中需加入___________g的碳酸钠来配制1 L 的缓冲溶液。
2016年“扬子石化杯”第30届中国化学奥林匹克竞赛(江苏赛区)夏令营暨选拔赛试题答案及解析

【总结与点评】 本题总体是一道高考难度的题目,除了最后一空需要一些额外的知识外,其他均为课内知识。 《全国 高中学生化学竞赛基本要求》 (下称《基本要求》 )中明确指出,现行中学化学教学大纲、普通高中化学课 程标准及高考说明规定的内容均属初赛要求。因此,课内知识的掌握,对于化学竞赛参赛者来说是十分重 要的。 【注】 [1] 化学竞赛和大学化学中, “电子排布”默认是用中学化学课本中的“电子排布式”描述。 第 2 题(12 分) 2-1 分析某一种不纯的 Na2S,已知其中除含有 Na2S· 9H2O 外,还含有 Na2S2O3· 5H2O,取此试样 10.00 g 配成 500.0 mL 溶液。 (1) 取试样溶液 25.00 mL 于碘量瓶中, 加入 50.00 mL 0.05250mol· L-1 的 I2, 用 0.1010 mol· L-1 Na2S2O3 溶液滴定多余的 I2,用去 16.91 mL。 (2)取 50.00 mL 试样溶液,用 ZnCO3 悬浮液沉淀除去其中的 Na2S 后(忽略体积影响) ,取滤液
1 0.8540 mmol 2 n(I 2,消耗 ) 50.00mL 0.05250 mol L-1 n(I 2,多余 ) 1.771mmol n(I 2,多余 ) 16.91mL 0.1010 mol L-1
n( Na 2 S) 1.771mmol 0.565 mmol / 2 1.4885 mmol
Na 2S 9H 2 O% n( Na 2S) 240.194g mol 1 20 100% 71.51% [6]
pH 与 c(H2CO3)/c(HCO3-)的关系,就是缓冲溶液的 pH 值计算公式[7],这个公式的推导可以用酸的 pKa 的表达式来推,具体过程略。将 pH 值代入公式,就可以算出 c(H2CO3)/c(HCO3-)的值。 【总结与点评】 本题考察氧化还原反应、酸碱平衡及相关计算,是《基本要求》中要求掌握的知识,也是各次化学竞 赛的常考考点。 要解答好这类问题, 考生需要了解常用的氧化剂、 还原剂及其对应的氧化产物、 还原产物, 了解酸碱平衡中的基本公式,计算时要细心、耐心,必要时加以验算,尽量不要犯计算错误。 【注】 [1] 对于写反应方程式的题目,一定要看清楚是要写化学方程式还是离子方程式,如果没有明确说明,一 般两者都可; 2-2
2011年第25届全国高中生化学竞赛(江苏赛区)选拔赛暨夏令营试题及答案
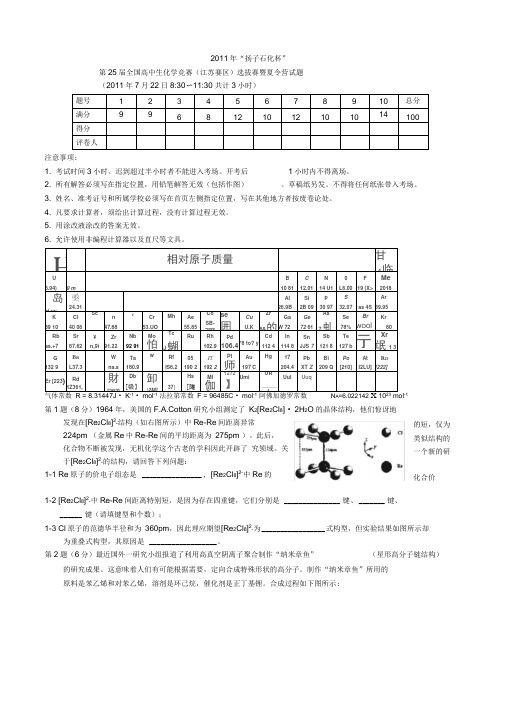
2011年“扬子石化杯”第25届全国高中生化学竞赛(江苏赛区)选拔赛暨夏令营试题 (2011年7月22日8:30〜11:30 共计3小时)题号 1 2 3 4 5 6 7 8 9 10 总分满分9968121012101014100得分评卷人注意事项:1. 考试时间3小时。
迟到超过半小时者不能进入考场。
开考后 1小时内不得离场。
2. 所有解答必须写在指定位置,用铅笔解答无效(包括作图) 。
草稿纸另发。
不得将任何纸张带入考场。
3. 姓名、准考证号和所属学校必须写在首页左侧指定位置,写在其他地方者按废卷论处。
4. 凡要求计算者,须给出计算过程,没有计算过程无效。
5. 用涂改液涂改的答案无效。
6. 允许使用非编程计算器以及直尺等文具。
H相对原子质量甘 4临U 6.94) 9 mB10 81 C 12.01 N 14 U1 0 L6.00 F19 (X> Me2018 岛 ai.yy 亟24.31Al26.9B Si 2B 09 p 30 97 S32.07 as 4S Ar39.95K 39 10 Cl 40 06 Scn 47.88vCr 53.UOMh Ae 55.85 Co SB-彌 se囲 CuU.K Zr 6&的 Ga W 72 Ge 72 61 As7虬Se 78% Br woolKr80Rb as.+7Sr87.62 ¥n,9i Zr 91.22Nb 92 91 Mo怕舛Tc.J 蝴RuRh 102.9 Pd106.4 *8 to? yCd 112 4 In 114 8 SnJJS 7 Sb 121 8 Te 127 b亍 Xr氓1 3G132 9B BL37.3Wna.s Ta180.9w Rf IS6.2 05190 2 I T192 2Pt师」 Au 197 C Hg17204.4 Pb XT Z Bi209 Q Po[210] AtI2LU] R D[222]Er [223)Rd 1Z361,財 [2fi2]Db [吸】 卸 \2M] 37| Hs [陶 Ml 伽〕 1272】 Umi UR _____ 1 Uul Uuq气体常数 R = 8.31447J • K • mol 法拉第常数 F = 96485C • mol 阿佛加德罗常数 N A =6.02214210 mol -1第1题(8分)1964年,美国的F.A.Cotton 研究小组测定了 K 2[Re 2Cl 8] • 2H 2O 的晶体结构,他们惊讶地发现在[Re 2Cl 8]2-结构(如右图所示)中Re-Re 间距离异常224pm (金属Re 中Re-Re 间的平均距离为 275pm )。
2021年全国高中学生化学竞赛(江苏省赛区)夏令营选拔赛试题

2021年全国高中学生化学竞赛(江苏省赛区)夏令营选拔赛试题“南京工业大学・扬子石化杯”2021年全国高中学生化学竞赛(江苏省赛区)夏令营选拔赛试题(2021年7月21日 8:30―11:30 共计3小时)题号满分得分评卷人 1 12 2 6 3 9 4 8 5 8 6 12 7 10 8 11 9 9 10 8 11 7 总分100 ● 竞赛时间3小时。
迟到超过30分钟者不能进考场。
开始考试后1小时内不得离场。
时间到,把试卷(背面朝上)放在桌面上,立即起立撤离考场。
● 所有解答必须写在指定位置,不得用铅笔填写。
● 姓名、准考证号和所属学校必须写在首页左侧指定位置,写在其他地方者按废卷论。
● 允许使用非编程计算器以及直尺等文具。
H He 相对原子质量 1.008 4.003 Li Be B C N O F Ne 6.941 9.012 10.81 12.01 14.01 16.00 19.00 20.18 NaMg Al Si P S Cl Ar 22.99 24.31 26.98 28.09 30.97 32.07 35.45 39.95 K Ca Sc TiV Cr Mn Fe Co Ni Cu Zn Ga Ge As Se Br Kr 39.10 40.08 44.96 47.88 50.94 52.00 54.94 55.85 58.93 58.69 63.55 63.39 69.72 72.61 74.92 78.96 79.90 83.80 Rb SrY Zr Nb Mo Tc Ru Rh Pd Ag Cd In Sn Sb Te I Xe 85.47 87.62 88.91 91.22 92.91 95.94 [98] 101.1 102.9 106.4 107.9 112.4 114.8 118.7 121.8 127.6 126.9 131.3Cs Ba Hf Ta W Re Os Ir Pt Au Hg Tl Pb Bi Po At Rn La-Lu 132.9 137.3 178.5180.9 183.8 186.2 190.2 192.2 195.1 197.0 200.6 204.4 207.2 209.0 [210] [210] [222] Fr Ra Rf Db Sg Bh Hs Mt Ds Ac-Lr Uuu Uub Uut Uuq Uuq [223] [226] [262] [266] [264] [277] [268] [281] [272]第1题(12分)1-1 根据原子结构理论可以预测:第八周期将包括______种元素;原子核外出现第一个5g电子的原子序数是______。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
2)无法解释非水溶液中的酸碱行为 液氨中: NH4+ + NH2- = 2 NH3
精选课件
5
8.1 布朗斯特-劳莱酸碱理论 (酸碱质子理论)
the BrØnsted-lowry acid-base model (1923年)
Kay{cB-
/cy}{cH3O /cy} {cHB/cy}
lgKay2G .3y(02R39TK8)
精选课件
14
酸电离平衡常数
▲
K
y a
值越大,酸性越强。
K
y a
大于1时的酸为强酸,
K
y a
小于1的酸为弱酸。
▲
K
y a
的值可跨越24个数量级,常用
p
K
y a
代替:
pKaylgKay
▲ 对二元和三元酸(如H2S和H3PO4)而言,还有 第二步和第三步质子转移反应的相应常数,
● 碱指在水中电离出的阴离子全部为OH的物质 NaOH = Na+ + OH-
● 中和反应的实质是 H+ + OH- = H2O Arrhenius
● 水溶液中电解质(electrolyte )是部分电离的:
已电离的溶质粒子数
电离度:= ——————————100%
原有的溶精选质课件粒子数
4
电离说的局限:
精选课件
7
酸:凡能给出质子的分子或离子,即质子给予体 (proton donor) HCl、HAc、NH4+、 HSO3- 、Al(H2O)63+ 等都能 给出质子,都是酸
HCl →H+ + ClHAc →H+ + AcNH4+ →H+ + NH3 HSO3- →H+ + SO32Al(H2O)63+ → H+ + [Al(OH)(H2O)5]2+
精选课件
3
酸碱的概念在不断地发展。石蕊变色说 Arrhenius的“ 电离说” Bronsted-lowry酸碱理论(酸碱质子理论)
Lewis酸碱理论(酸碱电子论)。
1887年Arrhenius提出“电离说” (Arrhenius acid-base
concept)
● 酸指在水中电离出的阳离子全部为H+ 的物质:H2SO4 = HSO4- + H+
精选课件
8
碱:凡能接受质子的分子或离子,即质子接受体 (proton acceptor)
OH、Ac、 NH3、 HSO3、 CO32等都能接受质 子,都是碱:
HO- + H+ → H2O
Ac- + H+ → HAc
NH3+ H+ →NH4+ HSO3- + H+ → H2SO3
CO32- + H+ → HCO3-
精选课件
9
酸碱存在着对应的相互依存的关系;物质的酸性 或碱性要通过给出质子或接受质子来体现
酸
H+ + 碱
碱+ H+
酸
共轭酸碱
精选课件
10
8.1.2 共轭酸碱对 (conjugate acid-base pair)
酸
H+ + 碱
碱+ H+
酸
质子理论中酸碱特点:有酸才有碱,有碱才有酸;酸 中有碱,碱可变酸
第 8 章 酸碱平衡
Chapter 8 Equilibrium of Acid and Base
精选课件
1
本章教学内容
8.1 酸碱质子理论
Proton Theory of Acid and Base
8.2 路易斯酸碱理论
Lewis acid-base theory
8.3 弱酸弱碱电离平衡
Ionization Equilibrium of Weak Acid and Base
精选课件
13
8.1.3 酸碱的强弱和电离平衡常数
1、酸电离平衡常数
K
y a
HB(aq) + H2O(l)
B-(aq) + H3O+(aq) Gy
该反应的标准平衡常数
K
y a
叫酸常数(Acidity
constant), 也叫酸的电离平衡常数(Acid ionization
equilib下r表iu列m出c一o些ns常ta见n酸t)的电离常数,使用时应该注意:
精选课件
11
酸碱反应的实质:两个共轭酸碱对之间的质子传递
● 酸越强,其共轭碱越弱;碱越强,其共轭酸越弱
● 反应总是由相对较强的酸和碱向生成相对较弱的
酸和碱的方向进行
● 对于某些物种而言,是酸是碱取决于参与的具体
反应
精选课件
12
两性物质:
既能给出质子又能接受质子的分子和离子。如:
HCO3-、H2PO4-、HS- 等。
HCO3- + H+ → H2CO3
HCO3- → CO32- + H+
H2PO4- + H+ → H3PO4 H2PO4- → HPO42- + H+
HS- + H+ →H2S
HS- →S2- + H+
水 也
H2O + NH3 →OH- + NH4+
是
两
H2S + H2O →H3O+ + HS-
性
1923年由丹麦BrØnsted J N和英国Lowry TM提出:
酸:凡能给出质子的分子或离子,即质子给予体 (proton donor)
碱:凡能接受质子的分子或离子,即质子接受体 (proton acceptor)
酸碱反应是指质子由质子给予体向质 子接受体的 转移过程
由于该定义不涉及发生质子转移的环境,故而 在气相和任何溶剂中均通用。
8.4 酸碱电离平衡的移动
Shift of Acid-Base Ionization Equilibrium
8.5 缓冲溶液
Buffer Solution
8.6 酸碱中和反应
Acid-Base Neutralization Reaction
精选课件
2
Cave formation result from acid-base reaction involving CaCO3
8.1.1 定义 8.1.2 共轭酸碱对 8.1.3 酸碱的强弱和
电离平衡常数
8.1.4 水的自耦合 电离平衡
8.1.5 酸碱反应的类型
布朗斯特
8.1.6 溶剂的效应
(BrØnsted J N, 1879-1947) 丹麦物理化学家。因其酸、碱质
子理论而著名于世.
精选课件
6
8.1.1 定义(definition)
K
y a1
K
y a2
K
y a3
精选课件
15
Ionization constants of some common acids in water at 298 K
Name
HB
B-
Ka
pKa
Hydroiodic acid Perchloric acid Hydrobromic acid Hydrochloric acid Sulfuric acid Hydronium ion Sulfurous acid Hydrogensulfate ion Phosphoric acid Hydrofluoric acid Carbonic acid Hydrogen sulfide Ammonium ion Hydrocyanic acid Hydrogencarbonate ion Hydrogenphosphate ion Water
