高中白猫杯化学竞赛辅导主讲华东师大王程杰-.ppt
高中化学竞赛辅导全套课件

化学基础知识回顾
原子结构
化学反应速率与化学平衡
包括原子核、电子排布、量子数等基 本概念。
涵盖速率概念、速率方程、平衡常数 等基本知识。
分子结构
涉及分子极性、化学键、分子间作用 力等知识点。
重点概念解析与拓展
氧化还原反应
从电子转移角度深入剖析氧化还原反应的本质。
离子反应与离子方程式
重点掌握离子反应的条件、离子方程式的书写技巧。
实验设计与实施方案展示
实验目的与原理
明确实验的目的和原理,理解实 验的设计思路和科学依据。
实验步骤与操作
详细介绍实验的步骤和操作方法, 包括实验器材的准备、实验操作的 具体步骤、实验数据的记录等。
实验结果与结论
展示实验结果,对实验结果进行分 析和讨论,得出相应的结论。
实验结果分析与讨论
实验误差分析
电离平衡与水解平衡
对电离平衡常数、水解平衡常数进行深入探讨。
常见问题解答与注意事项
01
02
03
化学计量问题
涉及物质的量、摩尔质量 、气体摩尔体积等计量概 念及计算方法。
有机化学基础
简要介绍有机物的通性、 烷烃、烯烃、炔烃等基本 概念及性质。
实验操作规范
强调实验操作规范性,如 试剂取用、仪器使用、实 验安全等注意事项。
高中化学竞赛辅导全套课件
汇报人: 202X-12-22
• 竞赛概述与准备 • 基础知识梳理与巩固 • 实验技能培养与实践操作指导 • 解题方法与技巧提升训练 • 心理素质培养与应对策略指导 • 模拟试题与答案解析
01
竞赛概述与准备
竞赛背景与目的
化学竞赛背景
高中化学竞赛是一项由学校或地区组织、学生自愿参加的课外竞赛活动,旨在 提高学生对化学知识的掌握和应用能力,培养其创新思维和实践能力。
hda【白猫杯】上海市“白猫杯”青少年应用化学与技能竞赛(高中组)初赛试卷及答案
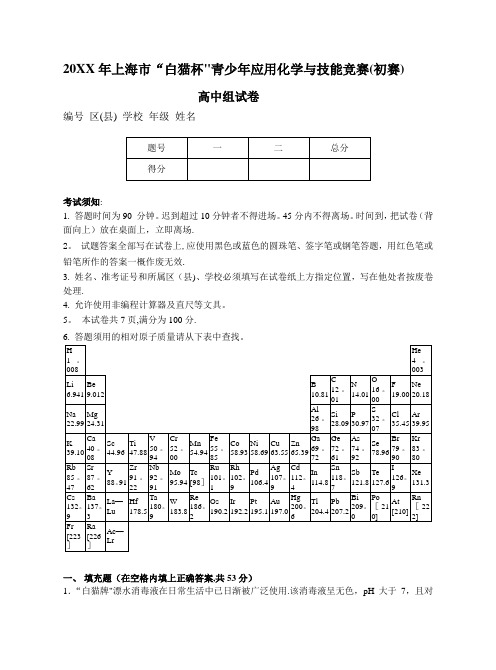
20XX年上海市“白猫杯"青少年应用化学与技能竞赛(初赛)高中组试卷编号区(县) 学校年级姓名考试须知:1. 答题时间为90 分钟。
迟到超过10分钟者不得进场。
45分内不得离场。
时间到,把试卷(背面向上)放在桌面上,立即离场.2。
试题答案全部写在试卷上,应使用黑色或蓝色的圆珠笔、签字笔或钢笔答题,用红色笔或铅笔所作的答案一概作废无效.3. 姓名、准考证号和所属区(县)、学校必须填写在试卷纸上方指定位置,写在他处者按废卷处理.4. 允许使用非编程计算器及直尺等文具。
5。
本试卷共7页,满分为100分.6. 答题须用的相对原子质量请从下表中查找。
一、填充题(在空格内填上正确答案,共53分)1.“白猫牌"漂水消毒液在日常生活中已日渐被广泛使用.该消毒液呈无色,pH大于7,且对某些有色物质有漂白作用。
试推测它的有效成分是___________________。
2.过去在市场上销售的含磷酸盐的洗衣粉如今几乎已全部被环保型无磷洗衣粉所取代,后者用一种不会引起环境污染的物质代替磷酸盐,该替代品是________________。
3.大气中所含氮氧化物的主要成分是。
测定大气中氮氧化物的方法通常是:首先用溶液将其吸收、氧化,然后用有机试剂使其发色,经过发色的溶液用分光光度计测定其消光度,最后根据消光度确定其含量.这种测定氮氧化物的方法称为________法,为使氮氧化物氧化,常用的氧化剂是。
4.埋藏在地下的矿石,经长年累月与环境之间的作用,其成分会发生很大的变化.例如金属的硫化物矿在流经其表面的溪水的作用下,会逐渐转化成水化的氧化物矿。
以黄铁矿为例,当溪水流过其表面时,在含氧溪水的作用下,先发生部分氧化、溶解,使溪水变成酸性,并含有一定浓度的Fe2+离子和SO42-离子。
当这些离子的浓度逐渐增大时,可与含氧溪水进一步发生氧化作用,转化成不溶的[FeO(OH)](即Fe2O3·H2O)而沉淀在小溪的底部,这就是针铁矿.而溪水的酸性也随之增大.这样,溪水下面的黄铁矿在经历若干年代之后,就变成了针铁矿。
高中化学奥林匹克竞赛辅导讲座第讲生物分子化合物和高分子化合物初步

高中化学奥林匹克竞赛辅导讲座第15讲 生物分子化合物和高分子化合物初步 【竞赛要求】糖的基本概念。
葡萄糖、果糖、甘露糖、半乳糖。
糖苷。
纤维素与淀粉。
氨基酸、多肽与蛋白质的基本概念。
DNA 与RNA 。
【知识梳理】 一、糖类糖类物质是指多羟基醛或多羟基酮以及能水解生成多羟基醛或多羟基酮的化合物。
糖类可分为单糖、低聚糖和多糖。
(一)单糖1、单糖的组成及结构 (1)葡萄糖的组成及结构 ①链状结构式由元素分析和分子量测定确定了葡萄糖的分子式为C 6H 12O 6。
其平面结构式为:CH 2OHCHOHCHOHCHOHCHOHCHO其费歇尔投影式为:D –(+)–葡萄糖CHOCH 2OH OH OHHO OH HHH H在葡萄糖的投影式中,定位编号最大的手性碳原子上的羟基位于右边,按照单糖构型的D 、L 表示法规定,葡萄糖属于D – 型糖,又因葡萄糖的水溶液具有右旋性,所以通常写为D –(+)– 葡萄糖。
葡萄糖是已醛糖,分子中有4个手性碳原子,应有16个光学异构体,其中8个为D 型,8个为L 型。
2、变旋光现象及环状结构式变旋光现象:某些旋光性化合物的旋光度在放置过程中会逐渐上升或下降,最终达到恒定值而不再改变的现象。
实验发现,结晶葡萄糖有2种。
一种是从乙醇溶液中析出的晶体(熔点146℃),配成水溶液测得其比旋光度为+112度,通常称为α – D –(+)– 葡萄糖,该水溶液在放置过程中,其比旋光度逐渐下降到 +52.7度的恒定值;另一种是从吡啶溶液中析出的晶体(熔点150℃),配成水溶液测得其比旋光度为+19度,称为β – D –(+)– 葡萄糖,该水溶液在放置过程中,比旋光度逐渐上升到 +52.7度的恒定值。
上述实验现象用开链式结构难以解释。
人们提出:葡萄糖具有分子内的醛基与醇羟基形成半缩醛的环状结构。
由于六元环最稳定,故由C 5上的羟基与醛基进行加成,形成半缩醛,并构成六元环状结构,组成环的原子中除了碳原子外,还有一个氧原子。
高中化学竞赛辅导课件-第四章-化学平衡

反应商判据:
J<K J=K J>K
反应正向进行; 系统处于平衡状态; 反应逆向进行。
4.2.3 计算平衡的组成
例题:已知反应CO(g)+Cl2(g) COCl2(g) 在恒温恒容条件下进行,373K时K =1.5108。
反应开始时c0(CO)=0.0350mol·L-1, c0(Cl2)=0.0270mol·L-1, c0(COCl2)=0。计算 373K反应达到平衡时各物种的分压和CO的 平衡转化率。
p(W2O6)=100.0
kPa
-
98.0 2
kPa=51.0
kPa
K
[
[ pGeWO4 / p ]2 pGeO/ p ]2[ pW2O6 /
p
]
2.0
98.0 1002
1002 51.0
100
4.
7103
平衡转化率:
def
B
n0
B neq n0 B
B
例如:
GeO 100.0 2.0kPa 100% 98%
平衡Ⅱ 0.300-
1.00×10-2 × 1.00×10-3+
cB/(mol·L-1) 1.00×10-2α2 (1- α2)
1.00×10-2 α2
3.2
1.0010-3 1.00 10-22
(0.300 1.0010-22 )[1.0010-2 (12 )]
2 43%
2 (Ag ) 1(Ag )
②对恒温恒容下已达到平衡的反应,引入 惰性气体,反应物和生成物pB不变,J= K , 平衡不移动。
③对恒温恒压下已达到平衡的反应,引 入惰性气体,总压不变,体积增大,反应物
和生成物分压减小,如果Σ n B ≠0,平衡向
化学竞赛相关ppt课件

国家队资格
.
竞赛知识要求
基础知识的掌握要准确,化学学习有自 身的特点,需要记住的知识点相对数学物 理较多,在准确理解基础上的记忆既是学 习的必要也是学习的捷径。
学习首先是知识的系统掌握和对化学现 象的理解。适当的做题和练习对内容的掌 握和加深理解有很大帮助,但做题不是目 的。
• 初赛试题采用考试现场传送方式,防止考 卷的泄密,因此考前需要做较多的工作。
• 考试结束试卷立即密封,等待阅卷工作 • 阅卷委员会现场打开考卷密封袋,装订线
保持完好,试卷阅毕,登分完成,拆除装 订,核对考生信息。
.
• 初赛成绩与考卷同时寄送中国化学会,申 报各奖项。
• 一等奖选手均有资格参加省队选拔(一般9月 底-10月初),通过系统培训、考试(理论和 实验),选出省代表队。
.
化学竞赛目的是普及化学知识,鼓励青 少年接触化学发展的前沿、了解化学对科 学技术、社会经济和人民生活的意义、学 习化学家的思想方法和工作方法,以激发 他们学习化学的兴趣和爱好;探索早期发 现和培养优秀中学生和未来人才的思想、 方法和途径;促进化学教学新思想与新方 法的交流,推动化学教学改革,提高化学 教学的水平。
.
• 主族元素:由上向下,随着核外电子层数 增大,核对最外层电子的束缚减弱,失电 子倾向增加,金属性增强
• 副族元素(包括主族长周期元素):由于d轨 道填充电子,变化规律不是很明显,核外 电子受到核引力与其它电子屏蔽双重影响 。稳定性与能量最低原理一致决定其反应 和特点
• S电子的径向分布特点,惰性电子对效应 • C元素的结构特点,有机化合物
校各种降分录取(最高一本线) • 全国初赛一等奖,可以获得各高校自主招
高中化学竞赛电化学PPT课件

F =L e = 6.023×1023mol-1×1.6022×10-19C F = 96484.4C.mol-1 = 96500C.mol-1
阴+
极 Cu
Cu2+
第4页/共113页
而阴、阳极则是以电极反应来区分的,发生氧化反应(失 去电子的反应)的电极称为阳极,发生还原反应(得到电子的 反应)的电极称为阴极。
在电解池中正极发生氧化反应,正极是阳极,负极发生还 原反应,负极是阴极。以后将会看到,在原电池中正极发生还 原反应,正极是阴极,负极发生氧化反应,负极是阳极。
推荐参考书:
1.傅献彩等.物理化学(下册).第四版.北京:高等教育出版社, 1990. 2. 北师大等三校合编.无机化学(上册).第四版.北京:高等教育 出版社,2002. 3.印永嘉等.物理化学简明教程.第三版.北京:高等教育出版 社,1992
第1页/共113页
§-1 电解质溶液
电解质溶液是指溶质在溶剂剂中溶解后完全或部分离解成 离子的溶液,该溶质则称为电解质。在溶液中完全离解的电解 质,称为强电解质。在溶液中只有部分离解,即便在较稀的溶 液中都有未离解成离子的电解质,称为弱电解质。
对于强电解质,摩尔电 导率在浓度较小的范围内与浓度 的平方根呈线性关系;而弱电解 质则无此关系。
电解质的电导,不但与浓度 有关(离子之间的相互作用),对 于弱电解质还要影响电解质的离 解度(导电物质的量随电离度增 大而增加),从而影响摩尔电导 率。
m/(Scm2 mol-1)
高中化学竞赛——大学有机化学31ppt课件

O
K2Cr2O7 H2SO4
苯胺黑(黑色染料)
漂白粉 显紫色(可用于苯胺的鉴别) 溶液
《有机化学》教学课件(76-04-1.0版)—第三十一讲
返回首页
芳胺容易被氧化,要想氧化芳胺环上的其它官能团 而不损害氨基,就必须先将氨基“保护”起来。
保护氨基的方法:先进行酰基化反应,待其它反应 完成后,再将酰基水解掉。
返回首页
C H N H 成盐3 :2 C · H · N + H H C 用l 3 途:C 3 遇H 分强离N H 碱提+ 纯C !3 l - - 2 强酸弱· H 碱C l 盐)
NH2 +H2SO4
NH2·H2SO4
(二)烷基化和酰基化
胺
遇 到
醇、 酚
1、烷基化
伯卤代烃和有活泼 卤原子的芳卤化物
.. RNH2 +RCH2Cl
②>④ > ① > ③
2、①丙胺、②2-氨基-1-丙醇、③3-氨基-1-丙醇 ① > ③> ②
3、①丙胺、②3-氯丙胺、③1-氯丙胺、④2-氯丙胺 ①>②>④>③
4、①苯胺、②对氯苯胺、③对硝基苯胺、④对溴苯胺、
⑤对甲氧基苯胺、⑥2,4-二硝基苯胺 ⑤>①>④>②>③>⑥
《有机化学》教学课件(76-04-1.0版)—第三十一讲
2、化学性质——★还原
NO2 H
酸性条件下:
NO H
NHOH H
NO2
NH2
Fe或HSn2//NHiCl
返回首页
NH2
★注意:
NO2 SnCl2/浓HCl
-CHO △
NH2 -CHO
在中性或碱性介质中的还原非常复杂,在此记住:
2
NO2 ZFne/NaOH
白猫杯化学竞赛辅导资料

白猫杯化学竞赛辅导资料1、含磷洗涤剂效果好,但污水会导致江河富营养化,导致水生植物疯长,污染水质。
水中氧气耗尽,鱼虾死亡,水发臭。
2、酶是一种活性成分,70℃以上死亡,所以使用加酶洗涤剂,水温不能超过70℃,否则使效力降低。
最好40℃。
洗油脂污血有特效。
3、洗碗的洗洁精中严禁使用荧光增白剂,会伤害人体。
荧光增白剂可使衣服更白,有光泽。
4、化学浆糊:a面粉加开水加热后形成糊精,可食用,易坏。
加入苯酚不会坏,但不可食用。
注:新米放两个月食用,可使残毒量降低至微量。
b:CMC加水捣一捣即可。
(羧甲基纤维素)5、肥皂:油脂(酯)跟氢氧化钠反应生成硬脂酸钠(高级脂肪酸钠)和甘油。
高级脂肪酸钠RCOONa中R-为烃基(碳氢化合物为烃)6、烃的命名C数量1---10为甲乙丙丁戊己庚辛壬癸大于等于11按数字命名7、烷烃的通式CnH2n+2饱和烃(碳碳单键)烯烃的通式CnH2n不饱和烃(碳碳双键)烷烃的通式CnH2n-2不饱和烃(碳碳叁键)8、聚乙烯是塑料的一种,可用于食品包装袋,无毒。
聚氯乙烯,不可放食品,有毒。
9、烃基:烃去掉一个或若干个氢原子的原子团,如:甲基:CH3-氢原子位置被取代羟基:-OH氢氧化合物去掉若干氢原子烃基与羟基结合为醇,醇是烃的衍生物的一种,如甲醇CH3OH 10、食用酒精为乙醇,工业酒精中含甲醇(剧毒,轻则失明,重则死亡).误食甲醇则用催吐方法,无效则服用泻药(上吐下泻)四氯化碳高效灭火剂。
11、烃的衍生物是结构上由烃衍变而来的有机化合物。
卤代烃:由卤素代替氢原子。
如氯乙烯,氟氯代烃(常见:氟利昂CI2F2)肥皂去污:肥皂溶于水C17H35COONa→C17H35COO-+Na+发生电离R-即C17H35-亲油基团-COOH亲水基团羧基-COOH醛基-CHO根据相似相溶原理:亲油基团作用于油污,亲水基团作用于水,油污乳化产生泡沫,用水冲净即可。
肥皂缺点:在硬水中效果不好,去污能力下降,因为硬脂酸钠在硬水中与钙镁离子反应生成硬脂酸钙硬脂酸镁沉淀。
2024年高中化学竞赛大学有机化学课件6(附加条款版)

高中化学竞赛大学有机化学课件6(附加条款版)高中化学竞赛大学有机化学课件6一、引言化学竞赛作为高中阶段学生提高化学素养、培养化学思维的重要途径,一直受到广泛关注。
有机化学作为化学竞赛的重要组成部分,对于参赛选手来说至关重要。
本课件旨在帮助高中化学竞赛选手更好地掌握大学有机化学知识,提高竞赛成绩。
二、有机化学基本概念1.有机化合物:含有碳元素的化合物,通常与生命活动密切相关。
2.有机反应:有机化合物在一定条件下发生的化学变化,包括合成、分解、取代、加成等。
3.有机化合物结构:碳原子之间的成键方式,包括单键、双键、三键以及环状结构等。
4.有机化合物的分类:根据分子结构、官能团、反应类型等不同特点进行分类。
三、有机化学基本反应1.烷烃的卤代反应:烷烃与卤素单质在光照条件下发生取代反应,卤代烷。
2.烯烃的加成反应:烯烃与卤素单质、水、卤化氢等发生加成反应,卤代烷、醇等化合物。
3.炔烃的加成反应:炔烃与卤素单质、水、卤化氢等发生加成反应,卤代烷、醛、羧酸等化合物。
4.醇的氧化反应:醇在酸性条件下与氧化剂如酸性高锰酸钾、铬酸等反应,醛、酮等化合物。
5.醛、酮的还原反应:醛、酮与还原剂如氢气、锂铝氢化剂等反应,醇。
6.羧酸的酯化反应:羧酸与醇在酸性条件下反应,酯。
7.芳香烃的取代反应:芳香烃在一定条件下与取代基发生取代反应,取代芳香烃。
四、有机化学合成策略1.反应途径的选择:根据目标产物的结构特点,选择合适的反应途径。
2.反应条件的优化:通过调整反应温度、压力、催化剂等条件,提高反应产率和选择性。
3.保护基的应用:在合成过程中,通过引入保护基,保护敏感官能团,提高反应可控性。
4.反应顺序的安排:合理安排反应顺序,避免不必要的副反应,提高合成效率。
五、有机化学竞赛实例分析1.合成题目分析:分析题目所给的反应物和产物,确定反应类型和合成路线。
2.反应机理探讨:根据反应类型,推导反应机理,理解反应过程。
3.实验操作注意事项:分析实验操作步骤,注意实验安全,提高实验技能。
【优】高中化学竞赛最全PPT资料

确定速率方程时必须特别注意,质量作用定律仅适用于一步
完成的反应——基元反应,而不适用于几个基元反应组成的总反 应——非基元反应。如N2O5的分解反应:
2N2O5 = 4NO2 + O2 实际上分三步进行:
N2O5 → NO2 + NO3
慢(定速步骤)
NO2 + NO3 → NO2 + O2 + NO 快
• 若将观察的时间间隔△t缩短,它的极限是△t→0,此时 的速率即为某一时刻的真实速率—— 瞬时速率:
(二)反应速率理论简介
1、碰撞理论 化学反应的发生,总要以反应物之间的接触为前提,即反应物 分子之间的碰撞是先决条件。 没有粒子间的碰撞,反应的进行则 无从说起。看如下计算数据。 (1)有效碰撞
并非每一次碰撞都发生预期的反应,只有非常少的碰撞是 有效的。首先,分子无限接近时,要克服斥力,这就要求分子具 有足够的运动速度,即能量。具备足够的能量是有效碰撞的必要 条件。其次,仅具有足够能量尚不充分,分子有构型,所以碰撞 方向还会有所不同,如反应:
式中M表示只参加反应物微粒碰撞而不参加反应的其他分 子,如器壁,它只起转移能量的作用。
(2)反应分子数 在基元步骤中,发生反应所需的最少分子数目称为反应分
子数。根据反应分子数可将反应区分为单分子反应、双分子反应 和三分子反应三种,如:
单分子反应 CH3COCH3 → CH4 + CO + H2 双分子反应 CH3COOH + C2H5OH → CH3COOC2H5 + H2O 三分子反应 H2 + 2I·→ 2HI
高中化学竞赛
【第七讲 速率与平衡】
河南省太康县第一高级中学----乔纯杰
【竞赛基本要求】
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
5. 气 体 净 化 装 置 的 连 接顺序
1).有多种杂质气体存 在时的除杂顺序
2).除杂和干燥的 顺序
3). 洗 气 瓶 和 干 燥 管 的 进出气顺序
6. 检 验 多 种 气 体 时 的 检 验顺序
7.用密封装置收集气体 时的进出口顺序
8. 装置连接的例题
专题2. 气密性检查
实验基本操作的试题分 析 例题4、 测定一定质量的 铝锌合金与强酸溶液反 应产生的氢气的体积, 可以求得合金中铝和锌 的质量分数。
共同点有: 1).联系科学、技术、社会和生
产已成为命题的重点。 2).考查对基础知识的理解深度,
反对题海术。 3).考查读图获取信息的能力。 4).尝试对科学方法的考查。 5).实验考查方法的多样性。
一、了解近年比赛命题的指导思想 (一)、重视教材、重视实验
该实验的仪器图直接取之于新 教材《高中二年级第一册》
3. 白猫杯赛题的特点:
近年高考: “稳”包括:
1).加强对学生基础性学历的考查, 保持题型、难度相对稳定。 2).遵循“依据教学大纲,但不拘 泥于教学大纲”的原则。 3).注重创设情景,考查学生的能 力与素质。
“变” 包括: 1).减少题量。 2).尝试对学生拓展性学力的考 查,有应用背景的情景试题略有 上升, 能力立意是试卷的主旋 律。 3).适当增加开放型试题,鼓励 有创造性答案。
Na2Cr2O4
← NaCrO2
2.离子反应、沉淀反 应等反应规律
3.物质结构:原子结 构、化学键、晶体等。
4.元素周期律 和元素周期表
5.化学反应速率和 化学平衡
6、化学计算:溶解 度、浓度、物质的 量、PH计算、反应 方程式等,还与实 验、生产、生活联 系,综合性强。
(二)、依托科学、 技术、社会、生产、 生活等开放的新情 景材料,复习和掌 握基础知识的应用。
(当然还包括新情景的综合实验题)
1, 化学实验的基本操作及其 试题分析
化学实验的基本操作包 括:P
专题1.实验装置的连接顺序 1.实验装置的组成部分
2.实验装置的选择 1).主体实验装置的选择
2). 气 体 净 化 装 置 的 选择
3.验证气体 1).验证气体的方法
2).防干扰措施
4.尾气处理
二、复习策略 (一)、根据“基本稳定、稳
中有变、变中求进”的原则, 必须掌握基本概念、基本理论、 基本技能,加强知识的理解和 应用。归纳重点知识是很有必 要的。
1.氧化还原反应: 配平、氧化剂及其能力、
还原剂及其能力、氧化产物、 还原产物、电子得失数、电 子转移等。
( 1)
(2)
Na2Cr2O7 → CrCl3 → Cr(OH)3 (5)↑ (4)↙ ↓(3)
6. 新 情 景 实 验 题试题分析
谢谢大家!
高中白猫杯化学竞赛辅导
主讲:华东师大王程杰
第一讲 化学实验设计与分析
引言:了解“ 白猫杯”应用化学 与技能竞赛的要求、特点
1.白猫杯竞赛题型 1).是非题 2).填充题 3).选择题 4).简答题 5).动手实验题
2.白猫杯竞赛基本要求 1).学好教材内容. 2),注竟拓宽科技知识面 3),重视实验、提高动手能力 4(3)著名科学家 (4)新型灭虫药 (5)诺贝尔化学奖 (6)工业废水含氰化物的处理 (7)制冷剂的研制历史
(8)石油工业,贵重金 属的回收
(9)塑料工业中的增塑 剂
(10)人类的首制农 药—无机铜杀菌剂波尔 多液。
三.中学化学实验习题分类 1,化学实验的基本操作题 2,物质的制备题 3,物质的分离提纯与检验题 4,定量实验题 5,化学实验方案的设计题
合金样品用铜网包裹的 目的:
2,物质的制备试题分析
3,物质的分离提纯 与检验试题分析
4,定量实验试题分析
例题13、某课外活动小组加热 炭粉(过量)和氧化铜的混合物, 再用下图装置对获得的铜粉(含 炭)样品进行实验。图中铁架台 等装置已略去。请你帮助
他们完成下列实验报告。
5,化学实验方案的设 计试题分析
6、航天飞行器座舱内空气更新 过程如图所示:
(二)、从知识立意向能力立 意转化。
1、阅读、观察能力:
(1) “吊白块” 。
2、逻辑思维、推理能力 (1)NO在大气层发生反应
3、看图表获取信息 的能力
(三)、命题的重点:联系科学、 技术、社会、生产、生活,让 学生学以致用。
采用的新情景材料既要贴 近中学生的实际,又要体现新 的时代生活、生产气息。 (ClO2).
