电感耦合等离子体ICP教材
电感耦合等离子体质谱仪使用方法说明书

电感耦合等离子体质谱仪使用方法说明书一、引言电感耦合等离子体质谱仪(简称ICP-MS)是一种现代化的分析仪器,广泛应用于地质学、环境科学、食品安全、医学等领域。
本说明书将详细介绍ICP-MS的使用方法,帮助用户正确操作仪器,获得准确的实验结果。
二、ICP-MS的基本原理ICP-MS利用电感耦合等离子体源(ICP)产生高温等离子体,并通过质谱仪分析样品中的离子。
其基本工作原理包括样品的注入与雾化、离子化、质量分析和离子计数等步骤。
三、ICP-MS的操作步骤1. 准备工作a) 确保实验室环境整洁干净,电源和仪器连接稳定。
b) 检查仪器各部件是否完好,如玻璃器皿、等离子体源和离子输送系统。
c) 根据实验要求,准备好样品和标准品,注意样品前处理和稀释的要求。
2. 仪器开机与预热a) 打开ICP-MS主机电源,并确保电源指示灯正常工作。
b) 打开冷却系统和气体供应系统。
c) 对等离子体源进行预热,根据仪器的要求设定温度和时间。
3. 样品注入与雾化a) 打开样品供液系统,使用适当的装置将样品注入到ICP-MS中。
b) 控制样品注入速度和流量,确保样品均匀进入等离子体源。
c) 调整雾化器和气体流量,使得样品得到充分雾化并形成稳定的样品云。
4. 离子化和分离a) 当样品进入等离子体后,通过电子轰击等离子体中的气体分子,产生离子。
b) 利用四极质谱仪对离子进行分离和选择,选择出感兴趣的离子种类。
c) 根据实验要求,设置质量分辨率和离子透过率等参数。
5. 离子计数与检测a) 在质谱仪中,离子通过电子倍增管放大,产生可以测量的电流信号。
b) 通过离子计数器将电流转化为离子数,并进行数据采集与分析。
c) 根据实验需要,设置离子测量时间和离子计数器的工作模式。
6. 数据处理与结果分析a) 通过计算机联机系统,对采集到的数据进行处理和分析。
b) 选择适当的质谱仪软件,进行质谱图谱绘制和质量分析。
c) 结合标准品或质控样品,进行结果校正和验证。
电感耦合等离子体-质谱法 ppt课件

PPT课件
37
基体效应:
ICPMS中所分析的试样,—般为固体含量其质量分数 小于1%,或质量浓度约为1000ug.mL-1的溶液试样。 当溶液中共存物质量浓度高于500—1000ug.mL-1 时, ICPMS分析的基体效应才会显现出来。共存物中含有 低电离能元素例如碱金属、碱土金属和镧系元素且超 过限度。由它们提供的等离子体的电子数目很多,进 而抑制包括分析物元素在内的其它元素的电离,影响 分析结果。试样固体含量高会影响雾化和蒸发溶液以 及产生和输送等离子体的过程。试样溶液提升量过大 或蒸发过快,等离子体炬的温度就会降低,影响分析 物的电离,使被分析物的响应下降、基体效应的影响 可以采用稀释、基体匹配、标准加入或者同位素稀释 法降低至最小。
Ion Optics Mass Separation Device
Turbo Molecular Pump
Turbo Molecular Pump
Mechanical Pump
RF Power Supply
Basic Instrumental Components of ICP-MS
PPT课件 10
PPT课件 33
同质量类型离子干扰
同质量类型离子干扰是指两种不同元素有几乎相 同质量的同位素。对使用四极质谱计的原子质谱仪来 说,同质量类指的是质量相差小于一个原于质量单位 的同位素。使用高分辨率仪器时质量差可以更小些。 周期表中多数元素都有同质量类型重叠的一个、二个 甚至三个同位素。 如:铟有113In+和115In+两个稳定的同位素 前者与113Cd+重叠,后者与115Sn+重叠。 因为同质量重叠可以从丰度表上精确预计.此干扰 的校正可以用适当的计算机软件进行。现在许多仪器 已能自动进行这种校正。
电感耦合等离子体质谱法(ICP-MS)

(六)电感耦合等离子体质谱法(ICP-MS)
ICP-MS的检出限给人极深刻的印象,其溶液的检出限大部份为ppt级,实际的检出限不可能优于你实验室的清洁条件。
必须指出,ICP-MS的ppt级检出限是针对溶液中溶解物质很少的单纯溶液而言的,若涉及固体中浓度的检出限,由于ICP-MS的耐盐量较差,ICP-MS 检出限的优点会变差多达50倍,一些普通的轻元素(如S、 Ca、 Fe 、K、 Se)在ICP-MS 中有严重的干扰,也将恶化其检出限。
ICP-MS由作为离子源ICP焰炬,接口装置和作为检测器的质谱仪三部分组成。
ICP-MS所用电离源是感应耦合等离子体(ICP),其主体是一个由三层石英套管组成的炬管,炬管上端绕有负载线圈,三层管从里到外分别通载气,辅助气和冷却气,负载线圈由高频电源耦合供电,产生垂直于线圈平面的磁场。
如果通过高频装置使氩气电离,则氩离子和电子在电磁场作用下又会与其它氩原子碰撞产生更多的离子和电子,形成涡流。
强大的电流产生高温,瞬间使氩气形成温度可达10000k的等离子焰炬。
被分析样品通常以水溶液的气溶胶形式引入氩气流中,然后进入由射频能量激发的处于大气压下的氩等离子体中心区,等离子体的高温使样品去溶剂化,汽化解离和电离。
部分等离子体经过不同的压力区进入真空系统,在真空系统内,正离子被拉出并按照其质荷比分离。
在负载线圈上面约10mm处,焰炬温度大约为8000K,在这么高的温度下,电离能低于7eV的元素完全电离,电离能低于10.5ev的元素电离度大于20%。
由于大部分重要的元素电离能都低于10.5eV,因此都有很高的灵敏度,少数电离能较高的元素,如C,O,Cl,Br等也能检测,只是灵敏度较低。
ICP-MS的原理和使用PPT课件

29
精选PPT课件
样品分析
(3)Standards(标准):输入标准溶液的名称和对应的浓 度;
(4)Quantification(定量):在Internal standard项下 在内标元素后选“using as Internal Standard”,在
待测元素后把它对应的内标元素选上。
(5)Sample list(样品列表):建序列 (6)保存方法,点击运行,开始测定
32
精选PPT课件
注意事项:
(1)实验结束后,把蠕动泵的夹子打开,松开样品管和废 液管,到一楼把氩气的主阀关闭,不需要关四楼的分压 阀。
(2)若仪器长期停用,可以考虑彻底关机,否则建议一直 保持真空状态,如果电压不稳定,时不时停电,也建议 用完后泄真空关机。
33
精选PPT课件
注意事项
如果想彻底关机,可以: (1)点击软件上Vacuum 里在Penning Pressure下
35
精选PPT课件
维护保养(视具体情况而定)
1、定期更换泵管(样品管和废液管,如果有老化的情况就 更换)
2、定期清洗样品锥、截取锥、嵌片、雾化器(如果连续做 的话,一周以上就需要清洗,样品锥和截取锥清洗的时 候放在纯水中超声30分钟)
36
精选PPT课件
维护保养
3、定期清洗矩管和中心管(清洗的时候拆下来用5%的 HNO3浸泡过夜)
31
精选PPT课件
样品分析
(9)点击Instrument Control 左上角的“OFF”,熄火。 熄火后先关闭氦气主阀,特别注意此时不要马上关掉水冷 机,观察软件左下角cooling glassware 直到变成 standby,并听到仪器里面咔嚓一声,并且RF Generator 下Plasma cooling water flow 从0.59变成 0,此时可以关闭水冷机。不需要点顶部的“Stop”,仪 器会自动停止采集。
ICP电感耦合等离子体发射光谱仪培训内容大纲

ICP电感耦合等离子体发射光谱仪培训内容大纲
ICP培训内容大纲
标液配制
母液3月一次(填记录)。
铍标液每次现用现配,其余每月一次。
仪器开机
开机顺序:通风罩、电脑、氩气、冷却器、空压机、稳态电源、蠕动泵管、主机、工作站,注意动作要慢,每步动作间隔1-2分钟。
水样测定
一定先点保存;
打开点火、运行、数据、图谱窗口
一般需点火两次;点火后关闭点火窗口
先测零点两次,再依次标液、样品(上清液)
仪器关机
先用2%硝酸冲洗,再用纯水冲洗,
打开点火窗口,点击关火,
其它与开机相反
数据处理
只开“非在线工作站”就可
置零点要选择上
打印原始记录时从标线最后一个点开机选就可
方法编制
钠方法特殊
维护保养
更换蠕动泵管;冷动液;
注意事项:
1开机状态时绝对不能打开火焰窗口。
2紧急状态时可以按红色暂停键。
3每月开机运行一次。
4仪器开机键:关机后需要再开机或开机后需要再关机一定需间隔15分钟或以上,严禁频繁开关机。
电感耦合等离子体质谱仪使用说明书

电感耦合等离子体质谱仪使用说明书一、前言感谢您购买我们的电感耦合等离子体质谱仪。
本使用说明书将为您提供详细的仪器操作指导,帮助您正确高效地使用该仪器。
在开始使用之前,请仔细阅读本说明书,并按照指导逐步操作,以确保测试准确性和使用安全。
二、仪器概述电感耦合等离子体质谱仪(以下简称ICP-MS)是一种高性能的分析仪器,结合了电感耦合等离子体源和质谱仪的优势,可用于快速、准确地分析各种元素及其同位素组成。
1. 主要组成部分- 离子源(电感耦合等离子体源)- 质谱仪- 接口系统- 检测系统- 数据采集系统- 控制和操作系统2. 主要特点和优势- 高灵敏度:ICP-MS可检测到非常低浓度的元素,通常可达到ppq (10的-15次方)或更低的水平。
- 宽线性范围:ICP-MS可在很大的浓度范围内进行分析,从ppq到ppm(10的-6次方)级别。
- 快速分析速度:ICP-MS具有快速的数据采集速度和高样品吞吐量,适用于高通量分析。
- 准确的同位素比测量:ICP-MS可通过同位素的测量提供更加可靠和准确的结果。
三、安全使用须知在使用ICP-MS时,请务必注意以下安全事项,以确保自身和实验室人员的安全。
1. 仪器放置- 请将ICP-MS放置在平稳、无振动的实验台或工作台上,保持仪器稳定。
- 仪器所在的实验室应具备良好的通风条件,确保室内空气的流通,排除有害气体积聚。
2. 电源连接- 连接ICP-MS的电源前,请确保电压和频率符合仪器要求,并使用接地插座。
- 所有仪器的电源线应远离液体和高温设备。
3. 操作规范- 在使用ICP-MS前,请穿戴适当的防护设备,如实验服、手套和安全眼镜。
- 尽量避免直接接触液体样品和化学物品,避免皮肤吸收或飞溅。
四、仪器操作方法以下将详细说明ICP-MS的操作方法,以供参考。
1. 准备工作- 打开仪器电源,确保仪器各个部件正常工作。
- 检查离子源中的等离子体气体、冷却液等是否符合要求,如不足请及时添加。
电感耦合等离子体质谱法 ppt课件

•
固体样品:除另有规定外,称取样品适量 (0.1g ~ 3g ),结合实验室条件以及样品基质 类型选用合适的消解方法。消解方法有敞口容 器消解法、密闭容器消解法和微波消解法。样
1. 标准品贮备液的制备:
分别精密量取铅、砷、镉、汞、铜单 元素标准溶液适量,用10%硝酸溶液 稀释制成每lmL分别含铅、砷、镉、 汞、铜为1μ g、0.5μ g、1μ g、 1μ g、10μ g的溶液。
1
2
坐标,浓度为横坐 标,绘制标准曲线。
测定,取3次读数的 平均值。从标准曲 线上计算得出供试 品溶液的浓度。
空白试验, 根据仪器说 明书的要求 扣除空白干
THANKS
18
铅、镉、砷、汞、铜测定法—— 电感耦合等离子体质谱法
目录
1
对仪器的一般要求 干扰和校正 供试品溶液的制备 注意事项 测定法 测定步骤
2
3
4
5
6
什么是电感耦合等离子体质谱法?
•
电感耦合等离子体质谱法(ICP-MS)是以等离子体为离子源 的一种质谱型元素分析方法。 主要用于进行多种元素的同时测定,并可与其他色谱分离技 术联用,进行元素价态分析。 测定时样品由载气(氩气)引入雾化系统进行雾化后,以气 溶胶形式进入等离子体中心区,在高温和惰性气氛中被去溶 剂化、汽化解离和电离,转化成带正电荷的正离子,经离子 采集系统进入质谱仪,质谱仪根据质荷比进行分离,根据元 素质谱峰强度测定样品中相应元素的含量。 本法具有很高的灵敏度,适用于各类药品中从痕量到微量的 元素分析,尤其是痕量重金属元素的测定。
•
选择内标时应考虑如下因素:
•
( 1 )待测样品中不含有该元素 ( 2 ) 与待测 元素质量数接近 ( 3 )电离能与待测元素电离
电感耦合等离子体光谱仪(ICP)及其应用介绍 PPT课件

4.样品处理
高压密封罐消解
高压密封罐由聚四氟乙烯密封罐和不锈钢套筒构成。试样和酸放在带盖的 聚四氟乙烯罐中,将其放入不锈钢套筒中,用不锈钢套筒的盖子压紧密封聚四 氟乙烯罐的盖子,放入烘箱中加热。加热温度一般在120~180℃。聚四氟乙烯 罐的壁较厚,导热慢一般要加热数小时。停止加热后必须冷却才能打开。溶剂: 硝酸;硝酸+过氧化氢
谱线强度与浓度的关系
1. 标准曲线法
在ICP-AES定量分析中,谱线强度I与待测元素浓 度c在一定的浓度范围内有很好的线性关系I=KCb。K与 光源参数、进样系统、试样的蒸发激发过程以及试样 的组成等有关。b与试样的含量、谱线的自吸有关,称 为自吸系数。在高浓度时,b1,曲线发生弯曲。
光谱定量分析的依据是: I = ACb
2.仪器结构
2.ICP发射光谱仪的构成
2.ICP结构-仪器类型
单道扫描型光谱仪 固定多通道型光谱仪 全谱直读型光谱仪
• 谱线选择灵活 • 定量、定性和半定量分
析 • 仪器价格低 • 分析速度慢,精度稍差
• 多元素同时测定,分析速 度快
• 分析精度高、稳定性好 • 操作简单,消耗少
全谱直读式的等离子光谱仪,它采用 中阶梯光学系统结合固体检测器(CID ,CCD),既具有单道的灵活性,又 有多道的快速与稳定。
Plasma点火原理
炬管中的原子氩并不导电,因而也不会形成放电 。当点火器的高频火花放电在炬管内使小量氩气电离 时,一旦在炬管内出现了导电的粒子,由于磁场的作 用,其运动方向随磁场的频率而振荡,并形成与炬管 同轴的环形电流。
原子、离子、电子在强烈的振荡运动中互相碰撞 产生更多的电子与离子。磁场的强度和方向随时间而 变化,受磁场加速的电子和离子不断改变其运动方向 ,导致焦耳发热效应并附带产生电离作用。这种气体 在极短时间内在石英的炬管内形成一个新型的稳定的 “电火焰”光源。
ICP-MS电感耦合等离子体质谱仪操作规程作业指导书

电感耦合等离子体质谱仪操作规程1.原理:ICP-MS全称电感耦合等离子体质谱(Inductively Coupled Plasma Mass Spectrometry),可分析几乎地球上所有元素(Li-U)。
ICP-MS以将ICP的高温(8000K)电离特性与四极杆质谱计的灵敏快速扫描的优点相结合而形成一种新型的最强有力的元素分析、同位素分析和形态分析技术。
该技术提供了极低的检出限、极宽的动态线性范围、谱线简单、干扰少、分析精密度高、分析速度快以及可提供同位素信息等分析特性。
这技术已广泛应用于环境保护、半导体、生物、医学、食品、冶金、石油、核材料分析等领域。
样品经一定前处理后,用ICP-MS进行检测,可同时测定多种元素。
2.操作步骤:2.1开机前准备:a.设备: NexION 1000 ICP-MS专用Concentric Nebulizer(同心雾化器)。
b.气体准备:•氩气压力 700KPa±3.5%•反应气(氢气和氦气)压力 40KPa±20KPac.循环水:•循环水的要求为:蒸馏水; 温度:15-20 ˚C 压力:230-400Kpa(33—58PSI)•循环水中加入50ml IPA ,防止生菌。
d.排风:•要求排风量为:5-7m3/min(4.7-6.6m/s) 。
2.2 开机:a. 开PC 显示器、打印机。
b. 开PC 主机。
c. 开ICP-MS 电源开关。
(仪器背后总电源及前面板左下角的电源开关)。
d. 双击桌面的“ICP-MS Top ”图标进入MassHunter,如下图所示:f. 从Instument菜单中选择“Instrument control”或者单击“Instrument control”图标,进入仪器控制面板。
从“Vacuum”菜单中选择“vacuum on”,抽真空,仪器由shutdown状态向 standby状态装换。
从Meters菜单中选择Meter Control Panel,进入如下图所示的画面,可以对真空、水流量、环境温度、雾室温度、气体压力及射频功率进行实时监测。
最新安捷伦电感耦合等离子体质谱仪(7500 icpms原理介绍教学讲义ppt

Title of Presentation Date
Agilent Restricted
Page 10
电感耦合等离子体的形成
石英同心炬管
辅助气Aux gas 载气carrier gas
RF工作线圈(内 通循环水)
等离子气Plasma gas
Title of Presentation Date
Agilent Restricted
射频电压诱导氩离子和电子快速震荡 ,产生热量(~8,000 K)
载气将样品气溶胶载到等离子 体的中心,进而样品发生干燥 、去溶剂、解离、原子化和电 离等过程 (中心温度~6800K)
Page 11
ICP离子源原理图
ICP最热部分~ 8000K
RF发生器频率27MHz, 样品通道 ~6800K以上
样品停留时间为几个毫秒 在采样锥口处样品以正离子 形态存在
。 因此,大多数元素在氩气等离子体环境中,只能电离成单电荷离子,进而可以很容易地由质谱仪器分离并加以检测
5 .0 E
5
m
/ z ->
1 02 03 04 05 06 07 08 09 1 0 01 011 021 031 041 051 061 071 081 092 002 012 022 032 042 052 06 0
等离子体色谱软件
1999年:HP4500按专业应用分为100型,200型,300型。
该技术提供了极低的检出限、极宽的动态线性范围、谱线简单、干扰少、分析精 密度高、分析速度快以及可提供同位素信息等分析特性。
自1984年第一台商品仪器问世以来,这项技术已从最初在地质科学研究的应用迅 速发展到广泛应用于环境保护、半导体、生物、医学、冶金、石油、核材料分析 等领域。
ICPMS(电感耦合等离子体质谱)基本原理讲课文档

• Scott双通道雾室 ( double-pass spray chamber)
ICP-MS 仪器最常使用的雾室
• 旋流雾室 ( cyclonic spray chamber)
• 撞击球雾室 (impact bead spray chamber)
ICP-MS
概述
• 检出限优于GFAA
• 比GFAA大得多的线性范围
意味着更少的稀释
•
与全谱直读ICP-OES一样的多元素分析能力和分析速
度
• 独特的同位素分析能力
• 干扰因素较少,擅长分析难测定元素
如稀土元素,贵金属,铀等
•
•
具有全质量扫描能力,可以进行半定量分析
快速的样品筛选
能与色谱分析联用进行元素形态研究
ICP-MS系统都将气动雾化器作为标准配件,其主要组成部分为:
蠕动泵
雾化器
雾室
一般对进样系统的要求:
• 雾化效率高,雾化器不易堵塞;
• 尽可能减少溶剂导入,以减少氧化物和其它干扰(通常采
导体制冷的双层雾室系统);
• 进样管路的长度尽可能短,减少记忆效应;
• 进样系统应外置,便于操作、更换或清洗。
用半
ICP-MCMS-多接受器等离子体质谱仪
ICP-TOFMS-飞行时间等离子体质谱仪
DQ-MS-离子阱三维四极等离子体质谱仪
第8页,共83页。
ICP-MS
概述
ICP-QMS:四极杆电感耦合等离子体质谱仪
一种利用ICP产生离子,而后以四极杆质谱进行分析,
从而完成元素定性和定量的测定方法:
1、ICP – 电感耦合等离子体
ICP电感耦合等离子体发射光谱仪-ICAP6300光谱仪原理及使用说明书

ICP电感耦合等离子体发射光谱仪-ICAP6300光谱仪原理及使用说明书赞(1)发布人:上海铸金分析仪器有限公司2014-11-08 11:32:48ICP电感耦合等离子体发射光谱仪-ICAP6300光谱仪原理及使用说明书一、ICP电感耦合等离子体发射光谱仪-ICAP6300光谱仪工作原理和结构(一)、ICP电感耦合等离子体发射光谱仪-ICAP6300光谱仪工作原理:ICP(即电感耦合等离子体)是由高频电流经感应线圈产生高频电磁场,使工作气体(Ar)电离形成火焰状放电高温等离子体,等离子体的最高温度10000K。
试样溶液通过进样毛细管经蠕动泵作用进入雾化器雾化形成气溶胶,由载气引入高温等离子体,进行蒸发、原子化、激发、电离,并产生辐射,光源经过采光管进入狭缝、反光镜、棱镜、中阶梯光栅、准直镜形成二维光谱,谱线以光斑形式落在540×540个像素的CID检测器上,每个光斑覆盖几个像素,光谱仪通过测量落在像素上的光量子数来测量元素浓度。
光量子数信号通过电路转换为数字信号通过电脑显示和打印机打印出结果。
(二)、ICP电感耦合等离子体发射光谱仪-ICAP6300光谱仪的结构ICP-AES由高频发生器、蠕动泵进样系统、光源、分光系统、检测器(CID)、冷却系统、数据处理等组成。
ICP光谱仪结构示意图:二、ICP电感耦合等离子体发射光谱仪-ICAP6300光谱仪操作规程(一).开机预热(若仪器一直处于开机状态,应保持计算机同时处于开机状态)1.确认有足够的氩气用于连续工作(储量≥1瓶)。
2.确认废液收集桶有足够的空间用于收集废液。
3.打开稳压电源开关,检查电源是否稳定,观察约1分钟。
4.打开氩气并调节分压在0.60—0.65Mpa之间。
保证仪器驱气1小时以上。
5.打开计算机。
6.若仪器处于停机状态,打开主机电源。
仪器开始预热。
7.待仪器自检完成后,启动iTEVA软件,双击“iTEVA”图标,进入操作软件主界面,仪器开始初始化。
电感耦合等离子发射光谱仪(ICP)操作规程
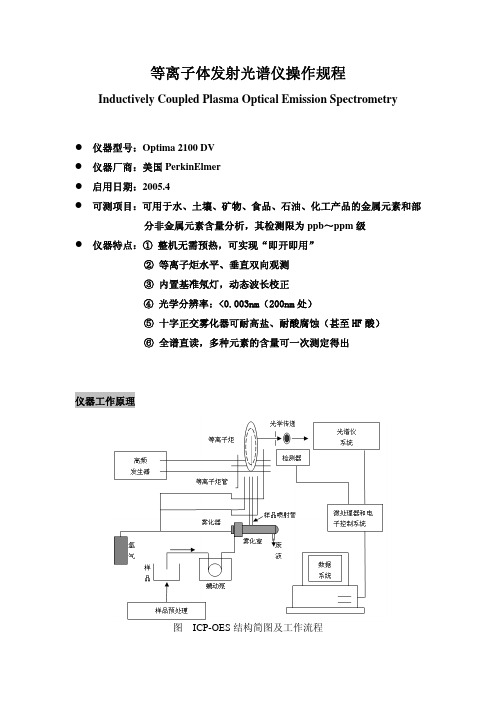
等离子体发射光谱仪操作规程Inductively Coupled Plasma Optical Emission Spectrometryz仪器型号:Optima 2100 DVz仪器厂商:美国PerkinElmerz启用日期:2005.4z可测项目:可用于水、土壤、矿物、食品、石油、化工产品的金属元素和部分非金属元素含量分析,其检测限为ppb~ppm级z仪器特点:① 整机无需预热,可实现“即开即用”② 等离子炬水平、垂直双向观测③ 内置基准氖灯,动态波长校正④ 光学分辨率:<0.003nm(200nm处)⑤ 十字正交雾化器可耐高盐、耐酸腐蚀(甚至HF酸)⑥ 全谱直读,多种元素的含量可一次测定得出仪器工作原理图ICP-OES结构简图及工作流程电感耦等离子体原子发射光谱分析是以射频发生器提供的高频能量加到感应耦合线圈上,并将等离子炬管置于该线圈中心,因而在炬管中产生高频电磁场,用微电火花引燃,使通入炬管中的氩气电离,产生电子和离子而导电,导电的气体受高频电磁场作用,形成与耦合线圈同心的涡流区,强大的电流产生的高热,从而形成火炬形状的并可以自持的等离子体,由于高频电流的趋肤效应及内管载气的作用,使等离子体呈环状结构。
如图所示,样品由载气(氩)带入雾化系统进行雾化后,以气溶胶形式进入等离子体的轴向通道,在高温和惰性气氛中被充分蒸发、原子化、电离和激发,发射出所含元素的特征谱线。
根据特征谱线的存在与否,鉴别样品中是否含有某种元素;根据特征谱线强度确定样品中相应元素的含量。
使用ICP-OES,大多数元素的方法检出限(MDL)为几十个ppb,校准曲线的线性范围较宽,可进行多元素同时或顺序测定。
测试步骤:1.打开空调设置20℃(冬天25℃,夏天18℃),打开抽湿机。
打开稳压电源总开关,打开空气压缩机,打开通风设备,打开氩气钢瓶总阀门,检查分压阀,使压力在0.55 MPa~0.825MPa之间,打开循环冷却水装置,确定电、气、水均正常运行,室内相对湿度低于60%后,开启主机。
电感耦合等离子体原子发射光谱分析讲课件

火焰 光源
略低
10005000 好
溶液、碱金属、 碱土金属
2024/8/8
感耦等离子体原子发射光谱分析
14
等离子体光源
最常用的等离子体光源是直流等离子焰 (DCP)、感耦高频等离子炬(ICP)、容耦微波等离 子炬(CMP)和微波诱导等离子体(MIP)等。
2024/8/8
感耦等离子体原子发射光谱分析
在氩气为工作气体时,氩气是单原子分子, 不存在分子的解离。在10000 K的氩气等离子体 成分中,Ar、Ar+和e占主要成分,Ar2+的浓度很 低。
在氮气为工作气体时,存在氮分子的解离。 在更高的温度下,还会产生N2+和N3+,因此在氮 气等离子体成分中,存在N2、N、e、N+、N2+和 N3+。
2024/8/8
2024/8/8
感耦等离子体原子发射光谱分析
10
直流电弧
优点:电极头温度相对比较高(40007000K, 与其它光源比),蒸发能力强、绝对灵敏度 高、背景小;
缺点:放电不稳定,且弧较厚,自吸现象严 重,故不适宜用于高含量定量分析,但可 很好地应用于矿石等的定性、半定量及痕 量元素的定量分析。
交流电弧
18
紫铜管(内通冷却水) 绕成的高频线圈
由三层同心石 英管构成,直 径为2.53cm
2024/8/8
外
内
感耦等离子体原子发射光谱分析
19
常温下氩气是不导电的,所以不会有感应电流,因而也就不会 形成ICP炬焰。但如果此时引入很少的电子或离子。这些电子或离 子就会在高频电场的作用下作高速旋转,碰撞气体分子或原子并 使之电离,产生更多的电子和离子。瞬间可使气体中的分子、原 子、电子和离子急剧升温,最高温度达到上万度,如此高的温度 足可以使气体发射出强烈的光谱来,形成像火焰一样的等离子体 炬。当发射出的能量与由高频线圈引入的能量相等时,电荷密度 不再增加,等离子体炬维持稳定。
电感耦合等离子体质谱联用仪使用方法说明书

电感耦合等离子体质谱联用仪使用方法说明书一、引言电感耦合等离子体质谱联用仪(简称ICP-MS)是一种广泛应用于环境监测、生物医学研究和地质化学等领域的分析仪器。
本说明书旨在提供用户在操作ICP-MS时的详细步骤和技巧,帮助用户正确、高效地使用该仪器。
二、仪器准备1. 确保ICP-MS连接正常,所有管道和接口处无泄漏。
2. 启动ICP-MS前,确保其相关设备(如气体供应系统、冷却系统等)已正常开启。
3. 检查离子源、质谱检测器和扫描盘等部件是否干净,无污染和异物。
三、仪器开机与预热1. 打开电源开关,并按照仪器的启动顺序启动ICP-MS。
2. 确认ICP-MS的灯丝已预热至设定温度,通常需要一段时间。
3. 在预热期间,检查气体流量、电源电压等参数是否稳定,并进行必要的调整。
四、样品准备1. 样品前处理:根据不同的样品类型,选择合适的前处理方法,如溶解、浸取等。
2. 样品浓度:确保待测样品浓度在ICP-MS检测范围内。
如有需要,进行适当稀释。
3. 样品容器:选择与样品相容的容器,避免与仪器接触的材料对样品造成污染。
4. 样品标记:使用标准的规定方法为样品进行标记,确保样品的追踪和准确性。
五、质谱分析1. 确认离子源已达到稳定状态后,选择合适的离子源模式和离子源参数,并设置相应的质量分辨率。
2. 针对不同元素进行优化:根据待测元素的特点,调整离子透镜、偏转器等参数,以提高灵敏度和准确度。
3. 校正:使用标准品进行校正,确保分析结果的准确性和可靠性。
4. 批量分析:设置合适的分析方法和程序,进行批量样品的自动分析,以提高工作效率。
六、数据处理1. 数据采集:确保质谱检测器和数据采集软件正常工作,按照所需的采集参数进行数据采集。
2. 数据处理:使用专业的数据处理软件进行峰拟合、定量分析和质谱图生成等处理工作。
3. 数据解释:结合相关的数据库和文献,对分析结果进行解读和验证,提取有用信息。
七、仪器维护与清洁1. 每日维护:每天结束工作后,进行必要的清洗和维护,包括离子源和采样系统的清洗,以及排空气体管道等。
电感耦合等离子发射光谱仪icpoesppt课件

5、准确度检验:有三种途径检验准确度。
最好用国家标准样品或国际标准样品来 检查测定结果与标准值的符合程度。
用通用的较成熟的其他方法进行数据比 对
加标回收发验证
6、检查回收率:对于样品处理过程比较复 杂,或怀疑样品中有易损失元素时,建 议要检测元素的回收率。
第四节 ICP光谱的应用
一、化学化工产品分析 包括化学试剂和化工产品;催化剂;塑
具体研究内容包括
1)铬鞣过程中,金属元素的蛋白质变性 的影响规律;
2)生物质降解过程,微量元素对催化反 应速率影响规律的定性描述;
3)微量元素对人体健康和环境污染影响 的定量描述。
第三节 ICP光谱分析程序
对结构简单、待测元素浓度较高的样品,可 以直接分析样品。
对较复杂的样品,应建立分析方法。一般程 序如下:
等离子体发射光谱仪
目前最广泛应用的原子发射光谱光源 是等离子体。包括:
电感耦合等离子体(Inductively Coupled Plasma,ICP)
直流等离子体(Direct-current Plasma,DCP) 微波等离子体(Microwave Plasma,MWP)
仪器名称介绍
ICP电感耦合等离子发射光谱仪 等离子体发射光谱仪 全谱直读等离子发射光谱仪
4、分析参数的优化(重要):
主要分析参数是载气流量(或压力)及 高频功率。
对一般的样品可用仪器说明书给出的折 中条件。
对于要求较高的样品可通过优化载气流 量、高频功率、观测高度等。原则是:
选择灵敏度、测量精密度等。
方法的精密度确定:选择有代表性的样 品或国家标准样品,平行测定11次,计 算相对标准偏差。
3、水质样品:饮用水、地表水、废水 4、环境样品:土壤、大气飘尘、粉煤灰 5、地矿样品:地质样品、矿石及矿物 6、化学化工产品:化学试剂、化工产品、
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
电感耦合等离子体ICP教材1. 原子光谱的理论基础光谱分析是根据物质的特征光谱来研究物质的化学组成、结构和存在状态的一类分析领域,它可分为原子发射光谱分析、原子吸收光谱分析、分子发射光谱分析、分子吸收光谱分析、X射线荧光光谱分析、原子和分子荧光光谱分析、红外和拉曼光谱分析等各类分析方法。
原子发射光谱分析是根据试样物质中气态原子(或离子)被激发以后,其外层电子辐射跃迁所发射的特征辐射能(不同的光谱),来研究物质化学组成的一种方法。
常称为光谱化学分析,也简称为光谱分析。
1. 1 原子的结构和辐射跃迁原子光谱是原子内部运动的一种客观反映,原子光谱的产生与原子的结构密切有关。
在原子光谱分析时,最被关心的是光谱线波长的选择,以及所选光谱线的强度,而谱线的波长以及影响谱线强度的因素与原子结构密切相关。
因此,一个光谱分析工作者有必要对原子结构及辐射跃迁过程有所了解。
早在19世纪中,人们已积累了一些原子光谱的实践知识。
Bunsen 及Kirchhoff最先将分光镜应用于元素的鉴定及分析,并将元素与特征谱线相联系,认识到线光谱是原子发射的。
1913年Bohr提出了原子结构学说,其要点如下:9) 电子绕核作圆周运行,可以有若干个分立的圆形轨道,在不同轨道上运行的电子处于不同的能量状态。
在这些轨道上运行的电子不辐射能量,即处于定态。
在多个可能的定态中,能量最低的态叫基态,其它称为激发态10) 原子可以由某一定态跃迁至另一定态。
在此过程中发射或吸收能量,两态之间的能量差等于发射或吸收一个光子所具有的能量,即=E2-E1νh上式称为Bohr频率条件。
式中,E2 E1。
如E2为起始态能量,则发射辐射;如E2为终止态能量,则吸收辐射。
h为planck常数(6.6262×10-34J•S)。
>17) 的正整数倍。
即π必须等于h/2Φ原子可能存在的定态只能取一些不连续的状态,即电子只能沿着特定的轨道绕核旋转。
在这些轨道上,电子的轨道运动角动量P = ΦP )⋯⋯(n=1,2,3πn•h/2此式称为Bohr量子化规则,n称为主量子数据。
Bohr的原子结构学说以及以后的量子力学逐步完善了原子的结构理论。
人们认识到:电子在能级间的跃迁时就产生谱线。
若电子由低能级向高能级跃迁时就产生吸收光谱,电子由高能级向低能级跃迁时,就产生发射光谱。
例如右图所示的钠离子有高于基态2.2ev和3.6ev的两个激发态(ev为“电子伏特”,表征能量高低),当处于基态的钠原子受外界能量激发时,原子核外的电子跃迁到高能级的激发态,但激发态电子是不稳定的,大约经过10-8秒以后,激发态电子将返回基态或其他较低能级,并将电子跃迁时所吸收的能量以光的形式释放出去,2.2ev 和3.6ev的能量的激发态回到基态分别发射589.0nm和330.3nm的谱线。
核外电子从第一激发态返回基态时所发射的谱线称为第一共振发射线。
由于基态与第一激发态之间的能级差异最小,电子跃迁几乎最大,故共振发射线最易产生,对多数元素而讲,它是所有发射谱线中最灵敏的(如钠的589.0nm),在原子发射光谱分析中通常以共振线为分析线。
1. 2 原子的激发和电离不同的原子具有不同的能级,在一般的情况下,原子处于能量最低的状态,即基态,当电子或其他粒子与原子相互碰撞,如果其动能稍大于原子的激发能,就可使该气态原子获得一定的能量,从原子的基态过渡至某一较高能级,这一过程叫做激发。
使原子由基态跃迁到较高能级(即激发态)所需的能量称激发能,以电子伏(ev)表示。
从原子能级图可以看出,原子可以被激发到不同的高能级。
不同的高能级都有其固定的能量即激发电位。
激发能最低的能级(第一激发态)所对应的能量为该原子的第一共振电位,由于其激发能最小,最容易被激发至该能级,因此第一共振线在元素中经常是最强的谱线,常被用作光谱定性分析的灵敏线及低浓度光谱定量分析的分析线。
当电子或其他粒子与原子相互碰撞时,如果其能量大于原子的电离能,则它们相互碰撞时就可能使气态原子电离成气态的一级离子,如果能量更大,还可使离子处于激发态,甚至更进一步变成二级、三级等高级离子。
因此,所谓激发能是指气态原子或离子,由基态最低能级过渡到激发态所需的能量,这种过渡称激发;而电离能是指从气态原子基态最低能级移去电子至电离状态所需的能量,移去一个电子所需能量称第一电离能,移去二个、三个电子所需能量相应为第二电离能、第三电离能。
激发能和电离能的高低是原子、离子结构固有的特征,是衡量元素激发和电离难易的程度和谱线灵敏度及波长位置的一个重要标志,其高低取决于原子或离子中原子核对外层电子的作用力的大小。
在光谱分析常用光源中激发的光谱主要是原子谱线和一次电离的离子谱线,只有在个别情况下出现二次电离的离子谱线。
在光谱分析中,对于原子光谱线通常在元素符号后加上罗马字I,如Na I 589.593nm,Mg I 285.2nm来表示,而对于一级或二级离子光谱线,则常在元素符号加上罗马字II、III来表示。
如Mg II 279.553nm、Ba II 455.403nm、La II 394.910nm,即为这些元素的一级离子光谱线。
习惯上我们按原子的一次电离能的大小把元素粗略地分为易激发易电离元素、中等激发中等电离元素和难激发难电离元素。
其与周期表的关系如图所示。
E=∆在痕量元素的光谱分析时,常选用灵敏的原子第一共振线作分析线,其分析线的波长范围可以用E2-E1= 3电子伏),因此这些元素第一共振线的波长处于可见及近红外区,例如:钾(K)的I<)来表示,由于元素的第一共振线的激发能在1.5-20电子伏之间,且在周期表中表现为规律性的变化,因此元素的第一共振线的波长在周期表中表现为规律性的变化,对于碱金属及碱土金属由于第一共振态激发能很小(λ=h(C/νh 766.490nm、纳(Na)的I 6电子伏),因此这些元素第一共振线的波长处于真空紫外区(10-200nm),例如:磷(P)的I>589.953nm;对于那些非金属元素,由于其第一共振态激发能很高(177.499nm、硫(S)的I 182.034nm;而对于大多数元素的第一共振态激发能在3-6电子伏之间,因而它们的第一共振线大多数处于近紫外区(200-380nm),例如:铁(Fe)的I 259.994nm、锌(Zn)的I 213.856nm;当用火花、等离子体等激发能量大的光源时,对碱土金属及过渡元素也常选用灵敏的一次离子的第一共振线作为分析线。
这些谱线的规律如同原子一样,它们的第一共振线也大多数处于近红外区,例如:钙(Ca)的II 393.366nm、钡(Ba)的II 455.403nm。
1. 3谱线的分裂和变宽5 塞曼效应:1896年塞曼(Zeeman)发现在约几千高斯以上的足够强的磁场中,谱线会分裂成几条偏振化的谱线,这种现象叫做塞曼效应。
一般场合,由塞曼分裂出来的各谱线波长相差极小,约为0.00x-0.0xnm。
6 斯塔克效应:1913年斯塔克(Stark)发现在外电场的作用下出现,出现谱线分裂,分裂的程度随电场强度的提高而增加,这种现象称为斯塔克效应。
在高压火化光源中,这种效应可能是显著的,但在ICP光源中,这种谱线变宽非常小,可以忽略。
7 超精细结构:谱线的超精密结构是由于原子核效应所引起的,即核的质量和核自旋的不同均可引起原子能级的超精细分裂,这种因核自旋和同位素效应引起光谱支项分裂造成的极微小的波长位移,称为原子光谱线的超精细结构,其分裂谱线之间的距离约0.00x-0.0xnm,与塞曼分裂相当。
8 谱线的自然宽度:原子发谱的光谱并不是严格的单色的线状光谱,它具有一定的宽度和轮廓,一般谱线的自然宽度在10-6-10-5nm。
9 谱线的多普勒变宽:多普勒(Doppler)变宽又称热变宽,它是由于原子在发射过程中朝着和背离检测器作随机的热运动而产生。
多普勒变宽随原子量增加而减小,但随温度增加而加宽。
一般这种变宽约在10-4-10-3nm。
10 谱线的碰撞变宽:发射跃迁的原子与同种原子或其他气体原子、分子相碰撞使振动受到阻尼时也可使谱线变宽。
与同种原子碰撞时引起的变宽称赫茨玛(Holtzmark)变宽;与不同种类原子或分子碰撞引起的称洛仑茨(Lorentz)变宽。
其中洛仑茨变宽较明显,一般中10-3nm左右。
在ICP光谱分析中,多普勒变宽及洛仑茨变宽是主要的变宽因素,由这两种效应确定的光谱线总轮廓称为沃伊特(Voigt)轮廓。
一般谱线宽度在10-4-10-3nm。
1. 4 光谱线的自吸收和自蚀从光源中部所产生的辐射,当通过其外围时有可能被同类基态原子吸收,这一现象一旦出现则称为自吸收。
一个原子、离子或分子当它是处于相关跃迁能级的粒子时,它很容易吸收与其能级相对应的光量子跃迁至较高能级。
在一个热光源中,被吸收的光量子仅有很小一部分的几率以荧光形式进行再辐射,由于第二类碰撞使激发能转化为粒子动能或振动能,因此,自吸收过程使光谱线的强度减弱且破坏了在等离子区中辐射强度与粒子浓度间的关系。
在光谱分析时,常引入一个经验常数,即自吸收系数来描述光谱定量关系式:I =ACb式中I为光谱线强度,C为被测元素的浓度,A是与蒸发、激发过程及试样组成有关的参数,B为经验常数即自吸收系数(b ≤ 1)。
由于光谱线是具有一定宽度和轮廓的谱线,即谱线轮廓是谱线强度随频率(或波长)而变化的分布曲线,由于自吸收的存在也影响其谱线的轮廓,使峰值强度或积分强度发生改变。
在实际光源中,辐射总是由处于较高温度的中心区通过低温蒸气的外部边缘部分进行发射的。
在光源中其中心部分激发温度高,存在较多的激发态的原子,但在光源的外围,是一个低温区,含有大量基态原子,当原子从光源中心所发射的谱线,其中心波长附近实际上完全被外围基态原子所吸收,被吸收的辐射由外围本身的辐射来代替,但发射很弱,不能完全补偿光源中心辐射的损失,因而在谱线中心吸收最严重,当原子浓度很高时,谱线轮廓在中央部就出现凹陷,即产生自蚀,如自吸收一样一般只有第一共振线才发生自蚀,如图是有自吸谱线轮廓。
2. 激发光源激发光源是原子发射光谱仪中一个极为重要的组成部分,它的作用是给分析试样提供蒸发、原子化或激发的能量。
在光谱分析时,试样的蒸发、原子化和激发之间没有明显的界限,这些过程几乎是同时进行的,而这一系列过程均直接影响谱线的发射以及光谱线的强度。
试样中组份元素的蒸发、离解、激发、电离、谱线的发射及光谱线强度除了与试样成份的熔点、沸点、原子量、化学反应、化合物的离解能、元素的电离能、激发能、原子(离子)的能级等物理和化学性质有关以外,还跟所使用的光源特性密切相关,不同的激发光源对各类样品、各种元素具有不同的蒸发行为和激发能量,因此要根据不同的分析对象,选择具有相应特性的激发光源。
