氯化钙水溶液物性(内容清晰)
氯化钙盐水换热计算

氯化钙盐水换热计算氯化钙(CaCl2)盐水是一种常见的换热介质,具有较高的热容和热导率,常用于工业领域的换热过程中。
在本文中,我将介绍如何计算氯化钙盐水的换热量。
首先,我们需要了解氯化钙盐水的热物性参数。
一般来说,热物性参数包括热容、热导率和密度等。
这些参数可通过实验测量或从文献中获取。
以20%浓度的氯化钙盐水为例,一些常用的热物性参数如下所示:-热容(C):约为3.16J/(g·℃),即每克盐水温度升高1摄氏度所需要的热量。
-热导率(λ):约为0.568W/(m·℃),即单位面积厚度为1米的氯化钙盐水层温度差为1摄氏度时,通过该层的热流量。
- 密度(ρ):约为1.42 g/cm3,即单位体积的盐水质量。
在换热计算中,我们通常关心两种常见的换热方式:传导和对流。
1.传导换热的计算:传导换热是指通过固体或液体介质中颗粒之间的碰撞传递热量。
根据傅里叶定律,传导换热的热流量(Q)与温度梯度(ΔT)、介质热导率(λ)和传导路径的横截面积(A)之间成正比。
换热的公式如下:Q=λ*A*ΔT例如,我们想要计算一个密封容器中的氯化钙盐水的传导换热情况。
假设该容器的两个平行侧面温度差为10摄氏度,侧面的面积为1平方米,且盐水的厚度为0.1米。
根据上述参数,热流量的计算如下:Q=0.568*1*10/0.1=56.8W2.对流换热的计算:对流换热是指通过流体介质的运动传递热量。
对流换热的热流量(Q)与温度差(ΔT)、换热面积(A)、对流传热系数(h)以及摩尔流量(m)之间成正比。
换热的公式如下:Q=h*A*ΔT对于氯化钙盐水,对流换热的传热系数通常为200-2000W/(m2·℃)。
假设我们希望计算容器中氯化钙盐水的对流换热情况,侧面的温度差为10摄氏度,面积为1平方米,传热系数为1000W/(m2·℃)。
根据上述参数,热流量的计算如下:综合考虑传导和对流换热的影响,总的换热量(Q)可表示为两者之和:Q=Q传导+Q对流使用这些换热计算公式,我们可以大致估计盐水换热过程中所需要的热量。
物性数据表
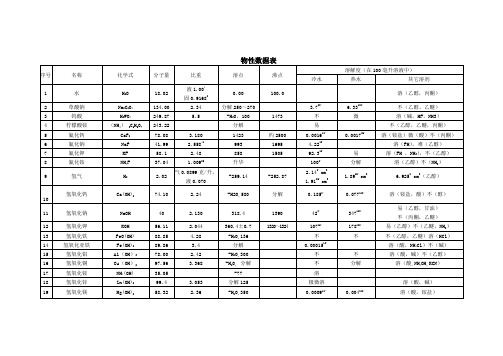
序号
名称
化学式
分子量
比重
溶点
沸点
溶解度(在100毫升溶液中)
冷水
热水
其它溶剂
1
水
H2O
18.02
液1.004
固0.91680
0.00
100.0
溶(乙醇,丙酮)
2
草酸钠
Na2C2O4
134.00
2.34
分解250~270
3.720°
6.33100°
不(乙醇、乙醚)
3
钨酸
H2WO4
249.87
5.5
-H2O,100
1473
不
微
溶(碱,HF,NH3)
4
柠檬酸铵
(NH4)3C6H5O7
243.22
分解
易
不(乙醇,乙醚,丙酮)
5
氟化钙
CaF2
78.08
3.180
1423
约2500
0.001618°
0.001726°
溶(铵盐)微(酸)不(丙酮)
6
氟化钠
NaF
41.99
2.55841
993
1695
2.284
-4H2O,110
-5H2O,150
31.60°
203.3100°
15.618°(甲醇);
不(乙醇)
83
硫酸铵
(NH4)2SO4
132.13
1.76950
分解235
70.60°
103.8100°
不(乙醇,丙酮,NH3)
84
硫酸银
Ag2SO4
311.8
5.4529.2
652
氯化钙的理化性质

兴湘氯化钙“厚德务实、开拓创新”
氯化钙的理化性质
(兴湘氯化钙)
物理性质
氯化钙氯化钙,分子式为CaCl2。
无色立方结晶体,白色或灰白色,有粒状、蜂窝块状、圆球状、不规则颗粒状、粉末状。
无毒、无臭、味微苦。
吸湿性极强,暴露于空气中极易潮解。
易溶于水,同时放出大量的热,其水溶液呈微碱性。
溶于醇、丙酮、醋酸。
低温下溶液结晶而析出的为六水物,逐渐加热至30℃时则溶解在自身的结晶水中,继续加热逐渐失水,至200℃时变为二水物,再加热至260℃则变为白色多孔状的无水氯化钙。
常见的是六水合氯化钙CaCl2·6H2O,无色三方晶体,易潮解,有苦咸味,密度1.71克/厘米3,29.92℃溶于结晶水。
加热至30℃时失去四个分子水而成二水合物(CaCl2·2H2O),系白色多孔而有吸湿性的固体,继续加热可生成一水合物。
化学性质
与氨或乙醇作用,分别生成CaCl2·8NH3和CaCl2·4C2H5OH络合物。
可溶的氯化钙可用来调配一些不溶于水的钙化合物沉淀:
3CaCl2(aq) + 2K3PO4(aq) →Ca3(PO4)2(s) + 6KCl(aq)
氯化钙电解后可得出纯钙:
CaCl2 →Ca(s) + Cl2(g)。
氯化钙常见特性

氯化钙常见特性氯化钙为无机化合物,一种由氯元素和钙元素构成的盐,为典型的离子型卤化物。
性状为白色、硬质碎块或颗粒。
微苦,无味。
氯化钙对氨具有突出的吸附能力和低的脱附温度,在合成氨吸附分离方面具有很大的应用前景。
但由于氯化钙不易形成稳定的多孔材料,与气氨的接触面积小,并且在吸附、解吸过程中容易膨胀、结块,因此使之难以在这方面付诸实际应用。
将氯化钙担载于高比表面载体上,可以大大提高氯化钙与气氨的接触面积。
已有相关研究表明,将氯化钙担载于分子筛上而制备的复合吸附剂比单一吸附剂有更好的吸附性能和稳定性。
氯化钙,一种由氯元素和钙元素构成的盐,化学式为CaCl2。
它是典型的离子型卤化物,室温下为白色固体。
它常见应用包括制冷设备所用的盐水、道路融冰剂和干燥剂。
因为它在空气中易吸收水分发生潮解,所以无水氯化钙必须在容器中密封储藏。
氯化钙及其水合物和溶液在食品制造、建筑材料、医学和生物学等多个方面均有重要的应用价值。
物理性质无色立方结晶体,白色或灰白色,有粒状、蜂窝块状、圆球状、不规则颗粒状、粉末状。
微毒、无臭、味微苦。
吸湿性极强,暴露于空气中极易潮解。
易溶于水,同时放出大量的热(氯化钙的溶解焓为-176.2cal/g),其水溶液呈微酸性。
溶于醇、丙酮、醋酸。
与氨或乙醇作用,分别生成CaCl2·8NH3和CaCl2·4C2H5OH络合物。
低温下溶液结晶而析出的为六水物,逐渐加热至30℃时则溶解在自身的结晶水中,继续加热逐渐失水,至200℃时变为二水物,再加热至260℃则变为白色多孔状的无水氯化钙。
化学性质5%水溶液pH值4.5~9.2。
1.7%水溶液同血清等渗。
该品以碳酸钙和盐酸为原料制得,为镁中毒时的解毒剂。
[3] 钙离子可与氟化物形成不溶性氟化钙,用于氟中毒解救。
主要应用工业用途1、用作多用途的干燥剂,如用于氮气、氧气、氢气、氯化氢、二氧化硫等气体的干燥。
生产醇、酯、醚和丙烯酸树脂时用作脱水剂。
氯化钙内容详解

氯化钙内容详解一、兴湘氯化钙产品说明 Calcium Chloride氯化钙化学式 CaCl2,为白色粉状、粒状、片状、块状物。
熔点782℃,沸点1600℃,密度2.15 克/厘米 3(25℃)。
氯化钙在水中的溶解度很大,0℃时100 克水能溶解 59.5 克氯化钙,100℃时溶解159 克。
能形成含 1、2、4、6 个结晶水的水合物,它们存在的温度范围是: CaCl2•6H2O 低于29℃; CaCl2•4H2O,29~45℃;CaCl2•2H2O, 45~175℃;CaCl2•H2O,200℃以上。
它也溶于乙醇,生成 CaCl2•4C2H5OH,与氨作用,形成 CaCl2•8NH3。
无水氯化钙是工业和实验室常用干燥剂,但不能用来干燥乙醇和氨。
氯化钙易潮解,可用于浇洒道路以消尘。
工业氯化钙分为固体氯化钙和液体氯化钙。
固体氯化钙为白色、灰白色或稍带黄色、红色的粉状、片状、颗粒状或块状固体;液体氯化钙为无色透明或稍微浑浊的透明液体。
氯化钙分子式 :无水氯化钙CaCl2二水氯化钙 CaCl2· 2H2O水合氯化钙CaCl2· nH2O氯化钙分子量:无水氯化钙111.98(按2007年国际相对原子质量)二水氯化钙147.01(按2007年国际相对原子质量)二、兴湘氯化钙用途1、道路、高速公路、停车场、机场、高尔夫球场等冬季除雪;2、石油钻探、钻井工作液、完井液、石油化工脱水液;3、防除尘埃、煤尘、矿尘;4、建筑行业早强剂,提高混凝土强度,生产涂料的凝固剂;5、用于防潮用干燥剂;工艺中气体和液体的干燥介质;6、橡胶行业乳胶凝结剂;7、黑色冶金工业氯化剂和添加剂;8、造纸工业添加剂及废纸张脱墨;9、化学工业的无机化工原料及硫酸根脱除剂,海藻酸钠的凝固剂;10、制冷工业用于制冷;11、用于防治小麦、苹果、白菜等腐烂及食品防腐剂;12、用于染料及印染工业生产中。
三、兴湘氯化钙产品品种(一)液体氯化钙(二)固体氯化钙1、按氯化钙所含含量结晶水的多少分为:(1)二水氯化钙a、二水氯化钙片状,含量为≥74%;b、二水氯化钙粒状,含量为≥74%;c、二水氯化钙粉状,含量为≥74%;d、二水氯化钙块状,含量为≥74%;(2)无水氯化钙a、无水氯化钙片状,含量为≥99%;b、无水氯化钙粒状,含量为≥99%;c、无水氯化钙粉状,含量为≥99%;2、按级别分为:(1)工业级氯化钙(2)食品级氯化钙工业氯化钙应符合表1要求。
氯化钙安全技术说明书

氯化钙
名称:氯化钙(此处指无水氯化钙;其水合物见二水氯化钙,六水氯化钙,四水氯化钙)
俗称:干燥氯化钙
英文名称:Calcium chloride(anhydrous calcium chloride)
分子式:CaCl2
分子量:110.98
CAS No.:10043-52-4
上游原料:长石粉、氢氧化钙、石灰石、盐酸、氧化钙、二水氯化钙
性状:白色多孔块状、粒状或蜂窝状固体。
味微苦,无臭。
水溶液为无色。
熔点:772℃(另有资料称782℃)
沸点:大于1600℃
相对密度:2.15
稳定性:稳定
溶解情况:溶于水(放出大量热)、乙醇、丙酮、醋酸、甲酸、肼、吡啶和乙酰胺,不溶于醚。
氯化钙在水中的溶解度很大,0℃时100克水能溶解59.5克氯化钙,20℃时能溶74g,100℃时溶解159克。
其它:空气中极易潮解。
与氨或乙醇作用,分别生成CaCl2·8NH3和CaCl2·4C2H5OH络合物。
液体氯化钙

关于液体氯化钙相关简述一、产品说明Calcium Chloride氯化钙通常有:工业级和食品级氯化钙。
品种有:液体氯化钙,固体氯化钙。
氯化钙在水中的溶解度很大,0℃时100克水能溶解59.5克氯化钙,100℃时溶解159克。
能形成含1、2、4、6个结晶水的水合物,它们存在的温度范围是:CaCl2•6H2O低于29℃;CaCl2•4H2O,29~45℃;CaCl2•2H2O,45~175℃;CaCl2•H2O,200℃以上。
它也溶于乙醇,生成CaCl2•4C2H5OH,与氨作用,形成CaCl2•8NH3。
固体氯化钙化学式CaCl2,为白色粉状、粒状、片状、块状物。
熔点782℃,沸点1600℃,密度2.15克/厘米³(25℃)。
二、产品用途1.用于污水处理。
2.道制冷剂(本产品呈弱碱性,可有效降低管道的腐蚀)。
3.分子筛原料。
4.液体氯化钙是制冷工业中重要的冷冻剂。
5.海藻酸钠行业。
6.豆制品行业的絮凝剂等。
三、产品品种(一)液体氯化钙(二)固体氯化钙按级别分为:(1)工业级氯化钙(2)食品级氯化钙五、工业氯化钙检测标准与方法六、产品比较现在市面上常见的氯化钙有液体氯化钙和固体氯化钙这两种物理形态,那么在使用的过程中:1.氯化钙用途广泛,一般常见的固体氯化钙含量有68%、74%、94%等,形状也各异,有片状、粉状、块状等,固体氯化钙使用例如有作为干燥剂,粒状或球状氯化钙,也可以调制成液态氯化钙使用。
2.如果使用氯化钙溶液,液体氯化钙占有优势,可以选择恰当浓度直接使用。
根据含量和纯度目前有电子级、医药级、化工级等,含量有15%-35%可供选用。
3.而液体氯化钙用的领域,固态氯化钙都可以,溶于水即可。
液体氯化钙不利于运输,尤其是长途运输,都需要特种车辆,运输成本高。
综上所述,选用液体氯化钙还是固体氯化钙,工艺不同要求也不同,因此还是要根据生产实际情况进行选择。
详细的氯化钙MSDS

详细的氯化钙MSDS1. 产品标识- 产品名称:氯化钙- 化学名称:氯化钙- 化学式:CaCl2- CAS号:-52-4- 分子量:110.98- 生产厂商:[制造商名称]2. 成分/组成信息- 主要成分:氯化钙(CaCl2)(化学式:CaCl2;CAS号:-52-4)- 其他成分:无3. 危害辨识- 急性毒性:有可能对人体产生刺激和腐蚀作用。
- 眼睛接触:可能引起眼睛刺激、疼痛和视力损害。
- 皮肤接触:可能引起皮肤刺激、炎症和灼伤。
- 吸入:可能引起呼吸道刺激和损伤。
- 摄入:可能引起食道、胃和肠道刺激、炎症和损伤。
4. 急救措施- 眼睛接触:立即用大量清水冲洗至少15分钟。
如持续不适,寻求医疗帮助。
- 皮肤接触:立即用大量清水冲洗受影响区域。
如发生红肿、疼痛或炎症,寻求医疗帮助。
- 吸入:迅速转移到空气新鲜处。
如出现呼吸困难,寻求医疗帮助。
- 摄入:立即漱口,并给予大量温水。
不要催吐,寻求医疗帮助。
5. 灭火措施- 灭火剂:适用于周围环境的灭火剂,如水雾、二氧化碳、泡沫。
- 不适合使用的灭火剂:无6. 操作处置和储存- 操作注意事项:佩戴适当的防护设备,避免吸入粉尘或接触皮肤和眼睛。
避免与强酸或强碱接触。
- 储存条件:储存在干燥、凉爽、通风的地方。
远离火源和可燃物。
7. 泄漏处置- 防护人员:穿戴适当的防护设备,包括呼吸器。
- 泄漏应急处理:避免直接接触,用适当的工具收集泄漏物。
将废物转移到密封中。
8. 接触控制/个体防护- 工程控制:确保通风良好,避免粉尘扩散。
- 个体防护措施:佩戴防护眼镜、防护手套和防护服。
9. 理化特性- 外观:白色结晶固体- 气味:无味- 熔点:772℃- 沸点:1935℃- 相对密度:2.15 g/cm³- 溶解性:可溶于水10. 稳定性和反应活性- 稳定性:稳定,但避免与强酸或强碱接触。
- 可能的危险反应:与强酸或强碱反应产生腐蚀性气体。
11. 毒理学信息- 急性毒性:LD50(大鼠,经口)为2500 mg/kg。
氯化钙

无机盐
01 性质
03 制备方法 05 主要应用
目录ቤተ መጻሕፍቲ ባይዱ
02 化学性质 04 鉴定方法 06 注意事项
07 相关限量
09 风险术语
目录
08 毒物学
氯化钙是一种由氯元素和钙元素组成的化学物质,化学式为CaCl2,微苦。它是典型的离子型卤化物,室温 下为白色、硬质碎块或颗粒。它常见应用包括制冷设备所用的盐水、道路融冰剂和干燥剂。
相关限量
1.GB 2760-96:罐头、豆制品的凝固剂,GMP;加工助剂。
GB 2760—2001:软饮料0.44~3.7g/kg;调制水100mg/L(以Ca计36rng/L)。
2.FAO/WHO(1984,mg/kg):番茄罐头,片装为800,整装为450(以Ca计);葡萄抽罐头350(以Ca计); 青豌豆、草莓、水果色拉等罐头350(以Ca计);成熟豌豆罐头350(以Ca计);果酱和果冻200(以Ca计);低 倍浓缩乳、甜炼乳、稀奶油,单用为2g/kg,与其他稳定剂合用3g/kg(无水物计);奶粉、奶油粉5g/kg(无水 物计);酸黄瓜250;一般干酪为所用牛乳的200。
制备方法
1、二水氯化钙(脱水法)法: 将食用二水氯化钙于200~300℃下进行干燥脱水,制得食用无水氯化钙成品。 其化学反应方程式: 对于中性氯化钙溶液,可采用喷雾干燥塔,在300℃热气流下进行喷雾干燥脱水,制得无水氯化钙粉末状成 品。 2、喷雾干燥脱水法:将已除去砷和重金属的精制中性氯化钙溶液,通过喷嘴从喷雾干燥塔上方喷成雾状,与 300℃热气流进行逆流接触达到干燥脱水,得到粉末状无水氯化钙,制得食用无水氯化钙成品。 3、母液法: 由氨碱法制纯碱时的母液,加石灰乳而得水溶液,经蒸发、浓缩、冷却、固化而成。 4、复分解法: 由碳酸钙(石灰石)与盐酸作用而得。 化学反应方程式:CaCO3+2HCl=CaCl2+H2O+CO2↑。
氯化钙常见特性

氯化钙常见特性氯化钙为无机化合物,一种由氯元素和钙元素构成的盐,为典型的离子型卤化物。
性状为白色、硬质碎块或颗粒。
微苦,无味。
氯化钙对氨具有突出的吸附能力和低的脱附温度,在合成氨吸附分离方面具有很大的应用前景。
但由于氯化钙不易形成稳定的多孔材料,与气氨的接触面积小,并且在吸附、解吸过程中容易膨胀、结块,因此使之难以在这方面付诸实际应用。
将氯化钙担载于高比表面载体上,可以大大提高氯化钙与气氨的接触面积。
已有相关研究表明,将氯化钙担载于分子筛上而制备的复合吸附剂比单一吸附剂有更好的吸附性能和稳定性。
氯化钙,一种由氯元素和钙元素构成的盐,化学式为CaCl2。
它是典型的离子型卤化物,室温下为白色固体。
它常见应用包括制冷设备所用的盐水、道路融冰剂和干燥剂。
因为它在空气中易吸收水分发生潮解,所以无水氯化钙必须在容器中密封储藏。
氯化钙及其水合物和溶液在食品制造、建筑材料、医学和生物学等多个方面均有重要的应用价值。
物理性质无色立方结晶体,白色或灰白色,有粒状、蜂窝块状、圆球状、不规则颗粒状、粉末状。
微毒、无臭、味微苦。
吸湿性极强,暴露于空气中极易潮解。
易溶于水,同时放出大量的热(氯化钙的溶解焓为-176.2cal/g),其水溶液呈微酸性。
溶于醇、丙酮、醋酸。
与氨或乙醇作用,分别生成CaCl2·8NH3和CaCl2·4C2H5OH络合物。
低温下溶液结晶而析出的为六水物,逐渐加热至30℃时则溶解在自身的结晶水中,继续加热逐渐失水,至200℃时变为二水物,再加热至260℃则变为白色多孔状的无水氯化钙。
化学性质5%水溶液pH值4.5~9.2。
1.7%水溶液同血清等渗。
该品以碳酸钙和盐酸为原料制得,为镁中毒时的解毒剂。
[3] 钙离子可与氟化物形成不溶性氟化钙,用于氟中毒解救。
主要应用工业用途1、用作多用途的干燥剂,如用于氮气、氧气、氢气、氯化氢、二氧化硫等气体的干燥。
生产醇、酯、醚和丙烯酸树脂时用作脱水剂。
氯化钙资料

氯化钙水溶液氯化钙水溶液作为低温的冷剂使用1、氯化钙水溶液的冰点2、氯化钙水溶液的结冰温度曲线3、氯化钙水溶液的粘度4、氯化钙水溶液的比热容计算图(作冷冻盐水用)5、氯化钙水溶液的导热系数盐水虽具有原料充沛、成本低、凝固点可调等优点,但由于盐水的浓度对盐水溶液的性质具有很大影响,故盐水作为载冷剂时应注意以下问题:(1)要合理地选择盐水的浓度。
盐水的浓度增高,虽可降低凝固点,但使盐水密度加大、比热减小。
而盐水密度加大与比热减小,都会使输液泵的功率消耗增大。
因此,不应选择过高的盐水浓度,而应根据使盐水的凝固点低于载冷剂系统中可能出现的最低温度为原则来选择盐水的浓度。
目前一般在选择盐水浓度时,使其凝固温度比制冷剂的蒸发温度低5~8℃为宜。
(2)注意盐水对设备及管道的腐蚀问题。
盐水对金属的腐蚀随溶液中含氧量的减少而变慢。
为此,最好采用闭式盐水系统,以减少盐水与空气接触机会,从而降低对设备及管道的腐蚀。
此外,盐水的含氧量随盐水浓度的降低而增高。
因而,从含氧量与腐蚀性来要求,盐水浓度不可太低。
另外,为了减轻盐水的腐蚀性,还应在盐水中加入一定量的防腐剂并使其具有合适的酸碱性。
一般1m3氯化钠水溶液中应加3.2kg重铬酸钠和0.88kg氢氧化钠;1m3氯化钙水溶液中应加1.6kg重铬酸钠和0.44kg氢氧化钠。
加入防腐剂后,必须使盐水呈弱碱性(pH=7.5~8.5),这可通过氢氧化钠的加入量进行调整。
添加防腐剂时应特别小心并注意毒性。
(3)盐水载冷剂在使用过程中,会因吸收空气中的水分而使其浓度降低。
为了防止盐水的浓度降低,引起凝固点温度升高,必须定期检测盐水的比重。
若浓度降低,应适当补充盐量,以保持在适当的浓度。
氯化钙溶液呈什么性

氯化钙溶液呈什么性
呈酸性。
CaCl2固体是无色立方结晶体,白色或灰白色,有粒状、蜂窝块状、圆球状、不规则颗粒状、粉末状。
微毒、无臭、味微苦。
吸湿性极强,暴露于空气中极易潮解。
易溶于水,同时放出大量的热,其水溶液呈微酸性。
CaCl2易溶于多种极性、质子性溶剂,20℃时在下列溶剂中的溶解度(g/100mL溶剂):甲醇:29.2,无水乙醇:25.8,正丙醇:15.8,正丁醇:25.0,正戊醇:11.5,乙二醇:21.6(25℃),甲酸:43.1,乙酸:15.0(30℃),联氨:16.0。
但在偶极溶剂及低极性溶剂中,如乙醚、四氢呋喃等则仅微溶或难溶。
与氨或醇作用,分别生成CaCl2·8NH3和CaCl2·4C2H5OH络合物。
CaCl2化学性质:5%水溶液pH值4.5~9.2。
1.7%水溶液同血清等渗。
该品以碳酸钙和盐酸为原料制得,为镁中毒时的解毒剂。
钙离子可与氟化物形成不溶性氟化钙,用于氟中毒解救。
氯化钙能溶于水吗

氯化钙能溶于⽔吗
氯化钙为⽩⾊晶体溶于⽔后,⽔溶液呈透明⾊,那肯定是易溶于⽔。
氯化钙,⼀种由氯元素和钙元素组成的化学物质,化学式为CaCl2。
微苦。
它是典型的离⼦型卤化物,室温下为⽩⾊、硬质碎块或颗粒。
它常见应⽤包括制冷设备所⽤的盐⽔、道路融冰剂和⼲燥剂。
知识拓展
因为它在空⽓中易吸收⽔分发⽣潮解,所以⽆⽔氯化钙必须在容器中密封储藏。
氯化钙在⾷品制造、建筑材料、医学和⽣物学等领域均有重要的应⽤价值。
氯化钙对氨具有突出的吸附能⼒和低的脱附温度,在合成氨吸附分离⽅⾯具有很⼤的应⽤前景。
将氯化钙担载于⾼⽐表⾯载体上,可以⼤⼤提⾼氯化钙与⽓氨的接触⾯积。
研究表明,将氯化钙担载于分⼦筛上⽽制备的复合吸附剂⽐单⼀吸附剂有更好的吸附性能和稳定性。
化学反应⽅程式
溶解度较⼤的氯化钙可发⽣复分解反应⽣成溶解度较⼩的沉淀:
3 CaCl2(aq) + 2 K3PO4(aq) →Ca3(PO4)2 (s) + 6 KCl (aq)
CaCl2(aq) + K2SO4(aq) →CaSO4(s) + 2 KCl (aq)
CaCl2(aq) + 2 KOH(aq) →Ca(OH)2(s) + 2 KCl (aq)
CaCl2(aq) + K2CO3(aq) →CaCO3(s) + 2 KCl (aq)
CaCl2(aq) + 2 KF(aq) →CaF2(s) + 2 KCl (aq)
氯化钙电解后可得出纯钙:
CaCl2 →Ca(s) + Cl2(g)。
