针对外显子设计PCR测序引物教程
PCR引物设计详细步骤

PCR引物设计详细步骤引言PCR(聚合酶链式反应)是一种在分子生物学中常用的技术,用于放大DNA片段。
在PCR过程中,引物的选择非常重要,因为引物的设计质量直接影响到PCR反应的效率和准确性。
本文将详细介绍PCR引物设计的步骤。
步骤1. 确定目标序列首先,需要确定所要放大的目标序列。
这可以是任何你感兴趣的DNA片段,如某个基因的编码区域,特定的DNA序列等。
2. 提取目标序列从已有的DNA样本中提取目标序列。
可以通过DNA提取试剂盒等方法进行提取,确保获得纯净的DNA。
3. 序列比对使用BLAST等工具将目标序列与已知的序列数据库进行比对,以确认目标序列的唯一性和可能存在的变异。
4. 引物设计原则根据目标序列,设计符合以下原则的引物:•引物长度通常在18-25个碱基对之间。
•碱基组成均匀,避免引物中存在大量的G或C碱基,以及连续多个重复的碱基。
•引物之间的互补性尽量避免,以防止二聚体的形成。
•避免引物末端存在碱基的互补序列,以防止非特异性扩增。
5. 引物设计工具使用引物设计工具,如Primer3、NCBI Primer-BLAST等,在目标序列中选择合适的引物。
这些工具可以根据给定的参数,自动设计合适的引物。
6. 引物评估对设计的引物进行评估,包括检查引物的反向互补性、引物的Tm值(熔解温度)、引物的二聚体和自身结构等。
确保引物的质量达到实验要求。
7. 引物合成将设计好的引物发送给合成公司进行合成。
确保引物的纯度和浓度符合要求。
8. PCR反应使用合成的引物进行PCR反应,按照标准的PCR反应体系和条件进行。
根据实验需求调整PCR反应的温度、时间等参数。
9. PCR产物验证通过凝胶电泳等方法验证PCR反应产物的大小和纯度。
确保PCR反应成功,并且没有非特异扩增的产物。
结论PCR引物设计是PCR反应成功的关键。
通过遵循引物设计的原则,结合引物设计工具的辅助,可以设计出合适的引物,弥补PCR技术在DNA放大中的巨大优势,为实验研究提供有效的工具。
PCR引物设计

PCR引物设计PCR(聚合酶链式反应)是一种常用的分子生物学方法,用于扩增特定的DNA片段。
PCR引物的设计对PCR反应的成功与否至关重要。
下面将详细介绍PCR引物的设计过程。
第一步,选择目标序列。
在设计PCR引物之前,首先需要确定要扩增的目标序列。
目标序列可以来自已知基因的特定片段,也可以通过测序等方法获得。
第二步,引物长度和温度。
PCR引物通常为单链DNA片段,一般长度在18-30个碱基对之间。
引物长度过短容易引起非特异性扩增,引物长度过长则会导致特异性降低。
此外,引物的长度还会影响PCR反应的温度。
一般情况下,引物的长度越长,PCR反应的温度就需要越高。
通常,引物的长度最好在20-24个碱基对之间。
第三步,引物序列的选择。
为了确保PCR反应的特异性,引物的选择至关重要。
引物应具有与目标序列完全互补的碱基序列,以确保引物能够精确结合到目标序列上。
此外,引物的序列还应避免序列内部的反向重复和结合位点之间的重复序列。
第四步,引物的熔解温度(Tm)的确定。
引物的熔解温度是引物与模板DNA结合的温度。
引物的熔解温度应该尽量接近反应的最低温度,以确保引物能够与目标序列特异性结合。
引物的Tm可以通过以下公式计算:Tm = 69.3 + 0.41 * (G+C%) - 650/length其中G+C%表示引物中鸟嘌呤(G)和胞嘧啶(C)的百分含量,length表示引物的长度。
第五步,特异性分析。
在设计引物之前,可以通过生物信息学工具对引物进行特异性分析。
特异性分析可以通过引物序列与目标序列的比对来进行。
引物在目标序列上应有唯一的结合位点,并且不应该与其他非目标序列有任何重复的位点。
第六步,引物的杂交性能。
为了确保引物的杂交性能,引物应具有适当的糖尖端修饰和杂交性能。
糖尖端修饰可以增强引物的杂交性能,并减少非特异性结合。
此外,引物的GC含量应该适中,过高或过低都可能导致非特异性结合的问题。
第七步,引物的交叉反应。
pcr操作流程测序方法

pcr操作流程测序方法PCR(Polymerase Chain Reaction)是一种常用的分子生物学技术,用于扩增DNA片段。
PCR操作流程通常包括DNA模板的提取、PCR试剂的配制、PCR反应的进行和PCR产物的分析等步骤。
在PCR反应中,DNA模板通过热循环反复复制,最终得到大量目标DNA片段。
PCR技术在基因克隆、基因检测、疾病诊断等领域有着广泛的应用。
PCR操作流程的第一步是DNA模板的提取。
DNA模板可以是从细胞、组织、血液等样本中提取的DNA。
提取DNA的方法包括酚氯仿法、琼脂糖凝胶法、商业DNA提取试剂盒等。
提取的DNA需要经过定量和纯化处理,以确保PCR反应的准确性和稳定性。
第二步是PCR试剂的配制。
PCR反应需要包括DNA模板、引物、核酸酶、缓冲液、dNTPs等组分。
引物是PCR反应的关键组分,它们是用于引导DNA合成的短寡核苷酸序列。
引物的设计需要考虑到目标DNA片段的长度、GC含量、Tm值等因素。
在配制PCR试剂时,需要根据实验设计和引物设计的要求,精确称量和混合试剂。
第三步是PCR反应的进行。
PCR反应通常在热循环仪中进行,包括三个步骤:变性、退火和延伸。
在变性步骤中,反应体系被加热至95℃,使DNA双链解旋成单链。
在退火步骤中,反应体系被降温至引物的Tm值,引物与DNA模板结合。
在延伸步骤中,核酸酶在适温下合成新的DNA链。
这三个步骤循环进行,每个循环会使目标DNA片段数量倍增。
最后一步是PCR产物的分析。
PCR产物可以通过琼脂糖凝胶电泳、实时荧光定量PCR、测序等方法进行分析。
琼脂糖凝胶电泳可以用于检测PCR产物的大小和纯度。
实时荧光定量PCR可以用于定量PCR产物的数量。
测序可以用于确定PCR产物的序列。
通过这些分析方法,可以验证PCR反应的成功性和准确性。
总的来说,PCR操作流程是一个重要的实验技术,可以用于扩增DNA片段、检测基因变异、诊断疾病等。
熟练掌握PCR技术的操作流程,可以为科研工作和临床诊断提供有力的支持。
针对外显子设计PCR测序引物教程

针对外显子设计PCR测序引物教程在园子搜索后,没有看到长基因(大与1000base)最简洁方法,而我现在欧洲实验室里从事这方面工作,作了大量这方面的工作。
自乐不如同乐,愿将我们设计引物技巧与大家分享,敲字很辛苦,请斑竹给点分。
可能有战友说了,我们的长基因都是交给测序公司用鸟枪法来测全基因的。
当然,您有钱当然可以这样做。
我们的方法适用于基因测序筛查突变,步骤相对简便,比较经济。
另外,本实验室最近的一偏文章采用该法发在了NEMJ上,可见该法已经是经典成熟的。
(1)基础知识我们知道gDNA由非编码区,外显子,内含子构成。
我们关心的基因是否突变在非编码区,外显字以及临近外显子的一小段内含子上。
至于其他的内含子(gDNA中的大头),发生突变与否并不是我们关心的,其临床意义也相当小。
因此我们只要设计引物来PCR上面三个重点区域就可以了。
(2)设计软件在线设计软件exon primerhttp://ihg2.helmholtz-muenchen.de/ihg/ExonPrimer.html大家从上图可以看到,网页提示我们现在需要输入两个序列,一个是cDNA,一个是gDNA。
由于我们还要考虑非编码区,而CDNA是没有非编码区UTR的。
因此,我们必须要用mRNA 输入网页中的cDNA栏。
否则我们得到的引物不会包含UTR。
要是有看官还看不懂的话,建议看下分子生物学教材关于cDNA和mRNA的区别。
下面我们以smurf2基因来说明如何设计针对外显子的测序引物。
(2)找到smurf2 mRNA打开gene bank/,注意要在database中选nucleotide如下图蹦出一大串序列。
找到我们要的人类的smurf2Homo sapiens SMAD specific E3 ubiquitin protein ligase 2 (SMURF2), mRNA直接点我们要的序列名字,就得到了mRNA了,Format:GenBank FASTA Graphics More Formats选项中当然要求点选FASTA形式了把mRNA序列拖选,拷贝下来再拷贝入在线设计软件exon primer (见第一贴)http://ihg2.helmholtz-muenchen.de/ihg/ExonPrimer.html好了。
(完整word版)PCR引物流程设计详解
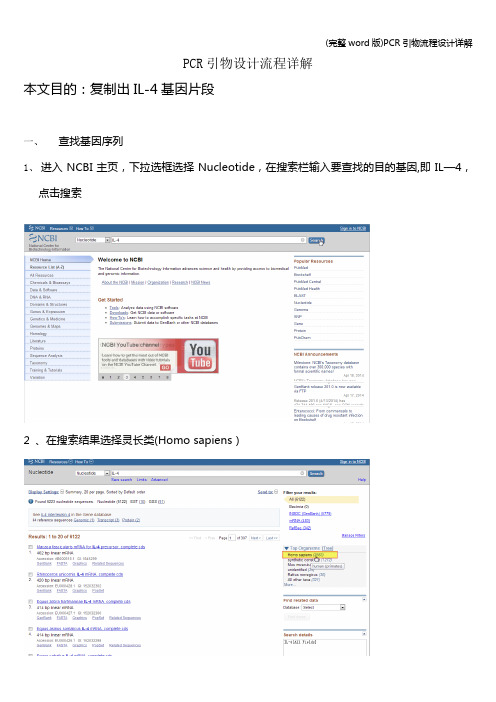
PCR引物设计流程详解本文目的:复制出IL-4基因片段一、查找基因序列1、进入NCBI主页,下拉选框选择Nucleotide,在搜索栏输入要查找的目的基因,即IL—4,点击搜索2 、在搜索结果选择灵长类(Homo sapiens)2、在灵长类IL-4基因中选择需要的mRNA序列3、查看基因的相关信息外显子区域CDs区域4、点击FASTA格式,并将序列保存到文档二、使用primer premier 5。
0设计引物1、建立新文件,将所得的序列复制进输入框内2、点击搜索按钮,搜索引物3、设置引物设计参数(因为在之前查找基因序列的时候获知,外显子区域分别为:1—200、201-248、249-425、426-618,又知在引物设计时引物位置最好跨越一个内含子,PCR产物长度通常为100—150bp,故设定上游引物位置为201—248,下游引物位置为249—425,产物长度为100-150bp)4、确认条件后,显示搜索结果4、双击选中得分最高的引物查看引物情况(上图为上游引物情况,下图为下游引物情况)5、将设计的上下游引物复制出来,保存到文档中三、使用oligo 6.0对设计的引物进行评价1、建立新文件,将从cnki上获得的cDNA复制进输入框,并点击accept接收2、接收后显示出该序列的相关信息3、点击edit按钮录入用primer设计的上游引物,每一次输入新数据后都需要点击accept按钮接收4、同理,录入下游引物5、分析上下游引物二聚体形成情况6、分析上下游引物发卡形成情况7、分析上下游引物GC%8、检测上下游引物与PCR模板其它位置错配情况9、分析PCR整体情况四、引物特异性检验(primer blast)1、进入NCBI主页,并选择blast2、选择primer blast3、在输入框内输入模板序列和上下游引物,并设定对比数据库,点击get primer进行对比4、查看blast结果Blast 结果显示,尽管IL—4与其它基因有相似区,但是引物的3’端没有完全互补。
全外显子测序实验的步骤详解

全外显子测序实验的步骤详解全外显子测序实验的步骤详解在这篇文章中,我将详细介绍全外显子测序实验的步骤。
全外显子测序是一种高通量测序技术,可以同时检测一个个体的所有外显子区域。
这项技术的广泛应用在生物医学研究、基因组学和临床诊断中。
通过全外显子测序,我们可以深入了解人类基因组和其他物种的遗传变异,从而加深对遗传疾病的认识,并为个体化医疗提供重要的支持。
全外显子测序实验的步骤一般可分为DNA提取、文库构建、测序和数据分析四个主要阶段。
下面我将详细介绍每一步的操作和技术。
第一步:DNA提取DNA提取是全外显子测序的首要步骤。
正确的DNA提取方法可以确保样本中的DNA完整性和纯度。
常用的DNA提取方法包括酚氯仿法、琼脂糖柱法和磁珠法等。
在这一步中,我们需要从样品中提取出高质量的基因组DNA,并通过比较纯净的样本质量和测序需求来选择适当的提取方法。
第二步:文库构建文库构建是全外显子测序的关键步骤之一。
在这一步中,我们需要将待测样本的DNA片段转化为可供测序的文库。
常用的文库构建方法包括PCR扩增、聚合酶链式反应(PCR)和各种商业化试剂盒。
在这一步中,我们需要优化文库构建的条件,包括选择合适的引物、调整反应体系、控制文库的片段大小和避免文库重组等。
第三步:测序测序是全外显子测序实验的核心步骤。
现代高通量测序技术包括Illumina测序、Ion Torrent测序和PacBio测序等。
在这一步中,我们将文库中的DNA片段与测序仪中的荧光标记引物结合,通过测序仪的扫描和记录,得到DNA片段的序列信息。
在测序过程中,我们需要合理选择测序深度,以保证测序质量和覆盖度的平衡。
第四步:数据分析数据分析是全外显子测序实验的最后关键步骤。
现代测序技术产生的数据量非常大,需要通过生物信息学分析来提取有用的信息。
数据分析的主要内容包括序列质量控制、序列比对、突变检测和功能注释等。
在这一步中,我们可以利用各种生物信息学工具和数据库对序列进行处理和解读,从而获得与个体的遗传特征、功能突变和疾病相关的信息。
PCR引物设计原理及方法

PCR引物设计基本思路1.根据实验需要,确定需要扩增的DNA序列,并知道其CDS区序列(编码结构基因区,即从起始密码子区至终止密码子区)ncbi网站查询RBS149..153/gene="eryF"CDS158..1372/gene="eryF"1ggatcccgat cgtgtcggag gaagaggcca agtcgcgccg ccccgaccag ctgctggtgc61tgccctggat ctaccgcgac gggttcgtcg aacgcgagca ggagttcctc gctggcggcg121gaaagctgat cttcccccta ccccgactgg aagtcgtatg acgaccgttc ccgatctcga181aagcgactcc ttccacgtcg actggtaccg cacctacgcc gagctgcgcg agaccgcgcc241ggtgacgccg gtgcgcttcc tcggccagga cgcgtggctg gtcaccggct acgacgaggc301gaaggccgcg ctgagcgacc tgcgcctgag cagcgacccg aagaagaagt acccgggcgt361ggaggtcgag ttcccggcat acctcggttt ccccgaggac gtgcggaact acttcgccac421caacatgggc accagcgacc cgccgaccca cacccggctg cgcaagctgg tgtcgcagga481gttcaccgtc cgccgcgtgg aggcgatgcg gccccgcgtc gagcagatca ccgcggagct541gctcgacgag gtgggcgact ccggcgtggt cgacatcgtc gaccgcttcg cccacccgct601gcccatcaag gtcatctgcg agctgctcgg cgtcgacgag aagtaccgcg gggagttcgg661gcggtggagc tcggagatcc tggtcatgga cccggagcgg gccgaacagc gcgggcaggc721ggccagggag gtcgtcaact tcatcctcga cctggtcgag cgccgccgca ccgagcccgg781cgacgacctg ctgtccgcgc tgatcagggt ccaggacgac gatgacggtc ggctcagcgc841cgacgagctg acctccatcg cgctggtgct gctgctggcc ggtttcgagg cgtcggtgag901cctcatcggg atcggcacct acctgctgct cacccacccg gaccagctcg cgctggtgcg 961gcgggacccg tcggcgctgc ccaacgccgt cgaggagatc ctgcgctaca tcgctccgcc 1021ggagaccacc acgcgcttcg ccgcggagga ggtggagatc ggcggtgtcg cgatccccca 1081gtacagcacg gtgctggtcg cgaacggcgc ggccaaccgc gacccgaagc agttcccgga 1141cccccaccgc ttcgacgtca cccgcgacac ccgcggccac ctgtcgttcg ggcagggcat 1201ccacttctgc atgggccggc cgctggccaa gctggagggc gaggtggcgc tgcgggcgct 1261gttcggccgc ttccccgctc tgtcgctggg aatcgacgcc gacgacgtgg tgtggcggcg 1321ttcgctgctg ctgcggggca tcgaccacct accggtgcgg ctcgacggat gagcacctgg 1381ctgcggcggt tcggtcctcc cgtcgagcac cgggcgcggc tggtgtgctt cccgcacgcg 1441ggagccgcgg ccgactccta cctcgacctc gcgcgcgcct tggcgcccga gatcgacgtg 1501cacgccgtgc agtacccggg gcgccaggac cgccgcgacg aggagcccct gggcaccgcc 1561ggcgagatcg ccgacgaggt ggccgccgtg ctgcgcgcgt cgggcggcga cggcccgttc 1621gccctgttcg ggcacagcat gggcgcgttg atcgcctacg agacggcgcg caggctcgaa 1681cgcgagcccg gcggcgggcc gctgcggctg ttcgtgtccg ggcagaccgc cccgcgcgtg 1741cacgagcgcc gcaccgacct gcccggcgac gacggtctgg tggacgagct gcgccggctc 1801ggcaccagcg aggcggcgct ggccgacgag gccctgctcg ccatgtcgct gccggtgctg 1861cgcgccgact accgcgtgct gcgctcctac gcctgggcgg acggaccacc gctgcgggcc 1921ggcatcaccg cgctgtgcgg cgacgccgac ccgctgaccg cgaccgggga cgccgagcgc 1981tggttgcagc actcggtcat ccccggccgg accaggacct tccccggcgg gcacttctac 2041ctgggtgaac aggtcaccga ggtggccggt gccgtgcgcc gggacctgct acgcgccggg 2101cttgcgggct gaggcgatca cgaagtcgag cgcgggcagc tcgcccttca tgcccgagtc 2161gctggtcagc gaccgcttga cctggctgta gaagagcctg ctcacgctct tcttgaacga2221ctcgtcctgc aggcacctgg ctg2.选择所需的载体,确定合适的酶切位点。
PCR引物设计方法及步骤

PCR引物设计方法及步骤查找目的基因序列并不能直接用于我们研究所用,因为查找到的基因序列只能算是基因的电子序列,并不是我们研究要用的现实中的序列,如何获得现实的基因序列呢?这就需要我们根据基因的电子序列来设计引物了,通过引物借助PCR方法才能获得我们的目的基因序列。
接下来,我们将介绍一下PCR方法并讲述如何设计引物。
PCR(polymerase chain reaction),即聚合酶链反应,又称基因体外扩增技术,是由一对引物介导、能在体外对特定DNA 片段进行快速酶促扩增的技术。
PCR能把很微量的遗传物质在数小时内扩增数百万倍达到检测水平.使原来无法进行分析和检测的许多项目得以完成。
PCR引物设计的目的是找到一对合适的核苷酸片段,使其能有效地扩增模板DNA序列。
引物的优劣直接关系到PCR的特异性与成功与否。
对引物的设计不可能有一种包罗万象的规则确保PCR的成功,但遵循某些原则,则有助于引物的设计。
1.引物的特异性引物与非特异扩增序列的同源性不要超过70%或有连续8个互补碱基同源。
2.避开产物的二级结构区某些引物无效的主要原因是引物重复区DNA二级结构的影响,选择扩增片段时最好避开二级结构区域。
用有关计算机软件可以预测估计mRNA的稳定二级结构,有助于选择模板。
实验表明,待扩区域自由能(△G°)小于58.6lkJ/mol时,扩增往往不能成功。
若不能避开这一区域时,用7-deaza-2′-脱氧GTP取代dGTP对扩增的成功是有帮助的。
3.长度寡核苷酸引物长度为15~30bp,一般为20~27mer。
引物的有效长度:Ln=2(G+C)+(A+T)Ln值不能大于38,因为>38时,最适延伸温度会超过T aq DNA聚合酶的最适温度(74℃),不能保证产物的特异性。
4.G+C含量G+C含量一般为40%~60%。
其Tm值是寡核苷酸的解链温度,即在一定盐浓度条件下,50%寡核苷酸双链解链的温度,有效启动温度,一般高于Tm值5~10℃。
全外显子组测序的具体方法及步骤

全外显子组测序的具体方法及步骤全外显子组测序(Whole Exome Sequencing,简称WES)是一种高通量测序技术,用于测定一个个体的所有外显子区域的DNA序列。
外显子是编码蛋白质的基因组区域,占据了人类基因组的约1-2%。
WES可以用于寻找致病基因突变,特别是在遗传性疾病的分子诊断中有广泛的应用。
下面将详细介绍WES的具体方法及步骤。
1.样品准备:-提取DNA:从待测个体的外周血或组织样品中提取总DNA。
-细胞裂解:使用特定组织裂解缓冲液将细胞或组织样品裂解,释放DNA。
-纯化DNA:通过离心等步骤,去除杂质,纯化DNA。
2.外显子库建立:- 靶向捕获:使用外显子组富集探针(baits)将DNA中的外显子区域进行加权,并去除非外显子区域的DNA片段。
-杂交反应:将靶向探针与DNA样品进行杂交反应,使探针与待测DNA的外显子区域发生特异性结合。
-洗涤:将未结合的探针洗掉,保留结合的外显子区域DNA片段。
-PCR扩增:对靶向捕获得到的DNA片段进行PCR扩增,以增加样品中外显子区域的DNA原料。
3.高通量测序:-数据库构建:将PCR扩增得到的外显子DNA片段建立一个DNA文库,用于测序。
- 测序反应:使用高通量测序平台(如Illumina HiSeq X)进行DNA文库的测序,得到大量的短序列片段(reads)。
- 数据处理:通过对这些reads进行去除低质量序列、比对到参考基因组等处理,获得高质量的测序数据。
4.数据分析:- 变异检测:使用专门的变异检测软件对样品中的变异进行分析,包括单核苷酸多态性(Single Nucleotide Polymorphisms,简称SNPs)和小片段插入缺失等。
-数据解读:将检测到的变异与公开的数据库进行对比,筛选出可能与疾病相关的变异。
-功能注释:对筛选出的变异进行功能注释,评估其潜在影响,进一步缩小候选基因的范围。
- 候选基因验证:对最终候选基因进行进一步的实验验证,如Sanger测序。
手把手教你做PCR引物设计来自小木虫

PCR引物设计的黄金法例1.引物最幸亏模板 cDNA的守旧区内设计。
DNA序列的守旧区是经过物种间相像序列的比较确立的。
在NCBI上搜寻不一样物种的同一基因,经过序列剖析软件(比方DNAman)比对(Alignment ),各基因同样的序列就是该基因的守旧区。
2.引物长度一般在 15~30 碱基之间。
引物长度( primer length )常用的是 18-27 bp,但不该大于 38,由于过长会致使其延长温度大于 74℃,不适于 Taq DNA 聚合酶进行反响。
3.引物 GC含量在 40%~60%之间, Tm值最好靠近 72℃。
GC含量( composition )过高或过低都不利于引起反响。
上下游引物的 GC含量不可以相差太大。
此外,上下游引物的 Tm值( melting temperature )是寡核苷酸的解链温度,即在必定盐浓度条件下, 50%寡核苷酸双链解链的温度。
有效启动温度,一般高于Tm值 5~10℃。
若按公式 Tm= 4(G+C)+2(A+T)预计引物的Tm值,则有效引物的Tm为 55~80℃,其 Tm值最好靠近 72℃以使复性条件最正确。
4.引物 3′端要避开密码子的第 3 位。
如扩增编码地区,引物3′端不要停止于密码子的第 3 位,因密码子的第 3 位易发生简并,会影响扩增的特异性与效率。
5.引物 3′端不可以选择 A,最好选择 T。
引物 3′端错配时,不一样碱基引起效率存在着很大的差别,当末位的碱基为 A 时,即便在错配的状况下,也能有引起链的合成,而当末位链为 T 时,错配的引起效率大大降低,G、C错配的引起效率介于A、T 之间,所以 3′端最好选择 T。
6.碱基要随机散布。
引物序列在模板内应当没有相像性较高,特别是3’端相像性较高的序列,不然简单致使错误引起(False priming )。
降低引物与模板相像性的一种方法是,引物中四种碱基的散布最好是随机的,不要有聚嘌呤或聚嘧啶的存在。
qPCR引物设计原则及具体操作步骤
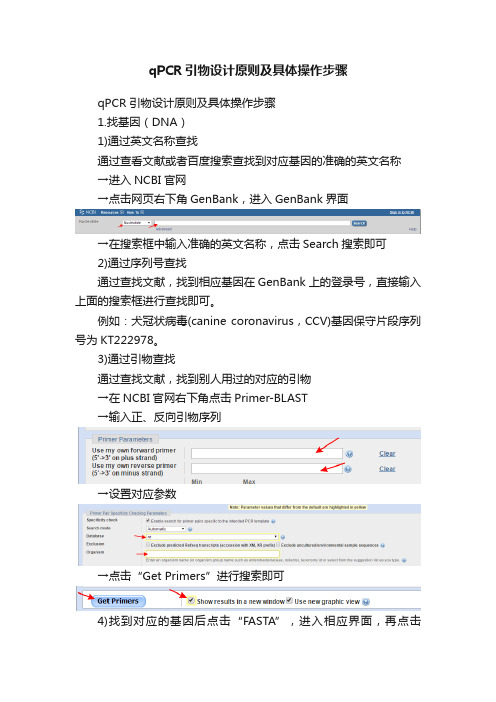
qPCR引物设计原则及具体操作步骤qPCR引物设计原则及具体操作步骤1.找基因(DNA)1)通过英文名称查找通过查看文献或者百度搜索查找到对应基因的准确的英文名称→进入NCBI官网→点击网页右下角GenBank,进入GenBank界面→在搜索框中输入准确的英文名称,点击Search搜索即可2)通过序列号查找通过查找文献,找到相应基因在GenBank上的登录号,直接输入上面的搜索框进行查找即可。
例如:犬冠状病毒(canine coronavirus,CCV)基因保守片段序列号为KT222978。
3)通过引物查找通过查找文献,找到别人用过的对应的引物→在NCBI官网右下角点击Primer-BLAST→输入正、反向引物序列→设置对应参数→点击“Get Primers”进行搜索即可4)找到对应的基因后点击“FASTA”,进入相应界面,再点击“Send to”选择相应格式,保存序列。
2.qPCR引物和TaqMan探针的设计1)引物设计注意事项a)引物长度17bp-25bp为佳。
太短的引物容易导致扩增效率降低;太长的引物会导致出现引物高级结构的几率增加。
两者都会干扰定量结果的准确性b)扩增片段长度为:90-150 bp(最低不能超过70,最高不能超过180)c)引物的Tm值为:最小57℃,最大63℃,最适为60℃,两条引物之间退火温度得差距不超过1℃,推荐使用Primer Premier 5进行Tm值计算;d)引物A、G、C、T整体分布尽量要均匀,避免使用GC或者TA 含量高的区域,尤其是3’端,必须避开GC含量不均匀的区域。
e)引物设计时请尽量避开TC或者AG的连续结构。
f)3’端不能超过3个以上碱基互补,自互补碱基数不超过3;3’端最后一个碱基绝对不能搭上g)特异性要有保证,与非特异模板3’端互搭碱基数不超过3,不连续出现4个及以上的GC互搭h)引物3’端最后五个碱基不能包含超过2个以上的G或者Ci)引物的GC含量控制在40%-60%之间为好,最佳为45%-55%之间j)正向或者反向引物应尽量接近探针序列但是不能和探针序列有重合区域k)在Primer-BLAST设计时,在Organism 处选择相应物种l)需跨外显子设计,避免基因组污染2)TaqMan探针设计指南a)探针序列应尽量接近正向或者反向引物,但是不能与之有重合区域;一般相隔1~5个碱基(一般10个以内,最好是1个碱基)。
手把手教你做PCR引物设计

手把手教你在线做PCR引物设计POST by Bingsen Xu前言:我是刚刚注册到丁香园,在PCR技术讨论版看见置顶贴,“请求助引物设计的战友先进来这里!”稍微浏览了一下,发现很多朋友对PCR引物设计还不是很熟悉,我愿意把自己积累的一点引物设计方面的经验和大家分享,希望不会做引物设计的朋友看完之后,可以不用再发求助贴而是自己动手做引物设计或者引物检验。
开始之前:其实非常简单,不需要你下载任何软件,但是你得有一台电脑能上网。
当然,最重要的是,你要很清楚用于做引物的模板序列,至于怎么找模板序列,不再本贴的讨论范围。
另外,要先对PCR目的序列的长度有个大致估计,好了,马上开始吧:第一步:找到Primer3的站点。
你不用记住这个站点,但是要记住“Primer3”这个词,然后打开GOOGLE首页,输入Primer3,跳出来的第一个项目就是了“Primer3 Input 0.4.0 (primer3-web/htdocs/input-040.htm)”网址是/。
第二步:贴上模板序列。
进入Primer3站点,可以看到一个引物设计的界面。
(附件Word文档里有图)在“Paste source sequence below (5'->3'…..”下面的大空框里面把你的模板序列粘帖进去。
注意是5'->3'方向的,数字或者空格都没关系,软件会自动过滤的。
第三步:重要参数设定。
首先是“Product Size Ranges”,如果你不希望软件给你随便做的话,首先要调整的就是这个参数。
默认的参数实际上是从100到1000,这个你得自己改,如果你希望产物的大小符合你的预期,尽可能把范围改小,比如480-500,具体看情况调整。
第二个参数是“Primer Size”,默认值一般可以用,但是,当你用熟了这个软件,你自己就知道该怎么改了。
第三个参数是”Primer Tm”这个和Primer Size差不多。
外显子捕获测序原理

外显子捕获测序原理外显子捕获测序是一种高效的基因组测序方法,它可以选择性地富集目标基因组的外显子区域,并对其进行测序。
这种方法的原理是利用特异性探针或引物,将外显子区域与其他非编码区域分离开来,从而提高测序效率和准确性。
外显子是基因组中编码蛋白质的区域,占据了整个基因组的很小一部分。
然而,它们却承载着大部分与遗传疾病相关的突变。
因此,通过对外显子进行测序,可以更好地理解基因变异与疾病之间的关系。
外显子捕获测序的步骤如下:1. 设计探针或引物:根据目标基因组的外显子序列,设计一组特异性的探针或引物。
这些探针或引物可以与外显子区域的序列互补配对,并将其与其他非编码区域分离开来。
2. 捕获外显子:将设计好的探针或引物与待测样本中的DNA或RNA杂交。
这样,只有与外显子序列互补的探针或引物才能与样本中的外显子结合,形成稳定的杂交复合物。
3. 分离非特异性序列:通过洗涤步骤,将与非编码区域结合的探针或引物去除,只保留与外显子区域结合的探针或引物。
这样,就实现了对外显子的选择性富集。
4. 扩增和测序:对富集后的外显子区域进行扩增和测序。
扩增可以使用PCR等方法,将外显子序列扩增为足够数量的DNA片段。
然后,通过高通量测序技术对这些DNA片段进行测序,得到外显子的序列信息。
外显子捕获测序的优势在于可以高效地测序目标基因组的外显子区域,避免了对整个基因组进行测序的复杂性和高成本。
此外,外显子捕获测序还可以提高测序的深度和准确性,使得检测到的突变更加可靠。
外显子捕获测序在医学研究和临床诊断中具有广泛的应用。
它可以用于寻找与遗传疾病相关的突变,帮助科学家和医生更好地理解疾病的发生机制。
此外,外显子捕获测序还可以用于个体化医学,根据个体的基因组信息,为患者提供更精准的治疗方案。
外显子捕获测序是一种高效、准确的基因组测序方法。
通过选择性富集外显子区域,可以更好地理解基因变异与疾病之间的关系,为医学研究和临床诊断提供有力支持。
PCR引物设计方法和原理

实验试错法是一种相对原始的引物设计方法,通过实验尝试和调整来找到最佳的引物序列。该方法适用于实验条 件不明确或缺乏先验知识的情况,通过反复实验和调整来获得最佳的引物组合。虽然实验试错法效率较低,但对 于探索新领域和未知情况具有一定的价值。
04 pcr引物设计的原理
引物的特异性原理
引物的特异性原理是指引物与模板DNA的结合具有严格的特 异性和专一性。在PCR扩增过程中,引物与模板DNA的结合 位点是特定的,只有当引物的序列与模板DNA完全互补时, 引物才能与模板结合,进行有效的扩增。
为确保引物的特异性,通常要求引物在3'端具有18-20个与模 板DNA互补的序列,以形成稳定的氢键,同时要求引物之间 不存在互补性,以避免形成引物二聚体。
引物的长度和浓度原理
引物的长度和浓度是影响PCR扩增的重要因素。引物的长 度通常在18-30个核苷酸之间,过短可能无法有效结合模 板,过长则可能导致结合不稳定。
引物的浓度也需进行优化,过高可能导致非特异性结合,过 低则可能影响扩增效率。根据经验,一般将引物浓度设定在 0.1-0.5μM之间,具体浓度根据引物的长度和序列特性进行 适当调整。
引物的温度和平衡原理
引物的温度和平衡原理是指在PCR扩增过程中,需要选择合适的温度使引物与模板DNA结合,并保持引物与模板之间的平衡 状态。
详细描述
计算机辅助设计法利用专业的引物设计软件,根据输入的目标序列和实验条件,自动筛 选出符合要求的引物序列。该方法能够大大提高引物设计的效率和准确性,减少人工误
差和实验时间。常用的引物设计软件包括Primer3、Oligo等。
实验试错法
总结词
通过实验尝试和调整来找到最佳引物的方法,适用于未知情况和新领域。
pcr引物设计操作流程

pcr引物设计操作流程
PCR引物设计是PCR技术中非常重要的一步,引物的设计质量直接影响到PCR反应的效果和结果。
下面是PCR引物设计的操作流程:
1. 确定目标序列:首先需要确定要扩增的目标序列,这个序列可以是基因、DNA片段或RNA序列等。
2. 选择引物设计工具:选择合适的引物设计工具,比如NCBI Primer-BLAST、Primer3等在线工具或者专业的引物设计软件。
3. 设定引物设计参数:根据实验需求设定引物设计的参数,比如引物长度、GC含量、Tm值等。
4. 引物设计:根据目标序列和设定的参数,使用引物设计工具进行引物设计。
通常需要设计一对引物,一个用于扩增目标序列的前端,一个用于扩增目标序列的后端。
5. 引物评估:对设计出的引物进行评估,包括检查引物的特异性、二聚性、自身互补性等。
6. 引物合成:将设计好的引物提交给引物合成公司进行合成。
通常引物的长度在18-25个碱基对之间。
7. PCR反应:将合成好的引物与DNA模板、PCR反应缓冲液、
DNA聚合酶等混合,进行PCR反应。
根据引物的设计,可以选择不同的PCR条件进行扩增。
8. PCR产物分析:对PCR反应产物进行分析,比如琼脂糖凝胶电泳、测序等,确认扩增的目标序列是否正确。
总的来说,PCR引物设计是PCR技术中至关重要的一步,需要仔细设计和评估引物,确保PCR反应的准确性和可靠性。
通过以上的操作流程,可以有效地设计出高质量的引物,为PCR实验的成功提供保障。
全外显子测序实验步骤

全外显子测序实验步骤简介全外显子测序是一种高通量测序技术,可以对人类基因组中的所有外显子进行测序。
外显子是基因组中编码蛋白质的部分,全外显子测序可以帮助我们了解基因组中的变异和突变,从而揭示与疾病相关的基因变异。
全外显子测序实验涉及多个步骤,本文将详细介绍这些步骤,包括样本准备、DNA提取、文库构建、测序和数据分析等。
步骤1. 样本准备全外显子测序实验首先需要准备样本,通常是从患者或实验动物中获取的血液、组织或细胞样本。
样本的选择应根据研究目的和样本可获得性进行。
2. DNA提取从样本中提取DNA是进行全外显子测序的关键步骤。
DNA提取方法可以根据样本类型选择,常见的方法包括酚氯仿法、盐析法和商用DNA提取试剂盒等。
3. 文库构建文库构建是将提取的DNA样本转化为可以进行测序的文库的过程。
文库构建的主要步骤包括DNA片段化、末端修复、连接测序适配体和文库富集等。
•DNA片段化:将提取的DNA样本通过超声波或酶切等方法打断成较小的片段,通常大小为200-300碱基对。
•末端修复:对DNA片段的末端进行修复,包括去除3’和5’的过度突出部分,以及在末端添加磷酸基团。
•连接测序适配体:将修复的DNA片段与测序适配体连接,适配体含有测序引物和标识序列,用于后续的测序反应。
•文库富集:通过PCR扩增等方法富集连接好的文库,以增加测序效率和准确性。
4. 测序文库构建完成后,接下来进行测序。
全外显子测序通常采用高通量测序技术,如Illumina HiSeq或NovaSeq等。
•测序前处理:将文库中的DNA片段固定到测序芯片上,通常使用PCR扩增和桥式PCR等方法。
•测序反应:在测序芯片上进行碱基的顺序测定,根据测序适配体上的引物和标识序列识别碱基。
•数据生成:测序仪器会生成原始测序数据,通常以FASTQ格式存储。
5. 数据分析测序完成后,需要进行数据分析以获得有用的信息。
数据分析的主要步骤包括:•数据质控:对原始测序数据进行质量评估和过滤,去除低质量的序列。
PCR引物流程设计详解
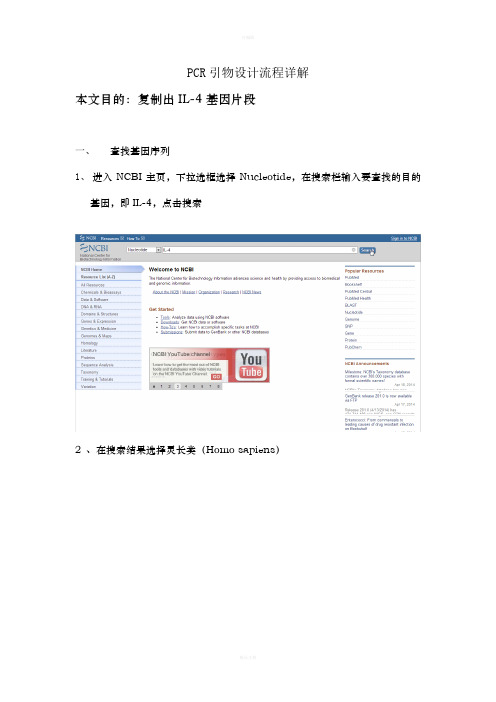
PCR引物设计流程详解本文目的:复制出IL-4基因片段一、查找基因序列1、进入NCBI主页,下拉选框选择Nucleotide,在搜索栏输入要查找的目的基因,即IL-4,点击搜索2 、在搜索结果选择灵长类(Homo sapiens)2、在灵长类IL-4基因中选择需要的mRNA序列3、查看基因的相关信息外显子区域CDs区域4、点击FASTA格式,并将序列保存到文档二、使用primer premier 5.0设计引物1、建立新文件,将所得的序列复制进输入框内2、点击搜索按钮,搜索引物3、设置引物设计参数(因为在之前查找基因序列的时候获知,外显子区域分别为:1-200、201-248、249-425、426-618,又知在引物设计时引物位置最好跨越一个内含子,PCR产物长度通常为100-150bp,故设定上游引物位置为201-248,下游引物位置为249-425,产物长度为100-150bp)4、确认条件后,显示搜索结果4、双击选中得分最高的引物查看引物情况(上图为上游引物情况,下图为下游引物情况)5、将设计的上下游引物复制出来,保存到文档中三、使用oligo 6.0对设计的引物进行评价1、建立新文件,将从cnki上获得的cDNA复制进输入框,并点击accept接收2、接收后显示出该序列的相关信息3、点击edit按钮录入用primer设计的上游引物,每一次输入新数据后都需要点击accept按钮接收4、同理,录入下游引物5、分析上下游引物二聚体形成情况6、分析上下游引物发卡形成情况7、分析上下游引物GC%8、检测上下游引物与PCR模板其它位置错配情况9、分析PCR整体情况四、引物特异性检验(primer blast)1、进入NCBI主页,并选择blast2、选择primer blast3、在输入框内输入模板序列和上下游引物,并设定对比数据库,点击getprimer进行对比4、查看blast结果Blast 结果显示,尽管IL-4与其它基因有相似区,但是引物的3’端没有完全互补。
PCR引物流程设计详解

PCR引物流程设计详解PCR(Polymerase Chain Reaction)引物流程设计是在进行PCR反应过程中引物的设计。
PCR反应是一种体外的DNA复制技术,可在短时间内扩增特定DNA序列。
引物在PCR反应中起到了至关重要的作用,因此设计合适的引物是成功进行PCR反应的关键。
1.目标序列选择:首先需要明确PCR反应的目标序列,即要扩增的特定DNA序列。
选定目标序列后,需要使用相应的软件分析该序列的特性,如GC含量、碱基组成、互补性等。
这些特性将有助于引物的设计和优化。
2. 引物长度:引物的长度通常在18-30bp之间。
较短的引物能提高PCR反应的特异性,但较长的引物能提高PCR反应的特异性和效率。
引物长度不宜超过30bp,以免在PCR反应过程中产生副产物。
3. 引物序列设计:PCR反应通常需要设计两个引物,一个称为前向引物(forward primer),另一个称为反向引物(reverse primer)。
两个引物应该在目标序列两侧的互补区域上设计,以确保引物能够结合在目标序列的两端。
为了提高特异性,引物的3'端应尽可能与目标序列互补,而5'端则可根据需要进行一定的修改,如添加限制性酶切位点、引入Tm值调整等。
4.引物Tm值计算:Tm值可用于估计引物与目标序列结合的稳定性。
Tm值是引物在PCR反应中的解链温度,通常在50-60°C之间。
使用软件计算引物的Tm值时需要考虑引物的长度、碱基组成和浓度等因素,确保引物的Tm值相近。
5.引物特异性检验:根据引物设计的序列,使用引物设计软件进行特异性检验,确保引物只结合在目标序列上而不结合在其他非特定序列上。
特异性检验可通过引物序列的BLAST分析和二聚体结构预测等方法进行。
6.引物修饰:在一些情况下,可以根据需要对引物进行特定的修饰,以增强PCR反应的效果。
常见的修饰方法包括添加引物标记(如荧光标记)、引物末端修饰(如磷酸化)等。
针对外显子设计PCR测序引物教程

针对外显子设计PCR测序引物教程外显子是基因组中编码蛋白质的区域,研究外显子可以帮助我们理解基因的功能和相关疾病的发生机制。
PCR测序引物是进行PCR扩增和测序的关键组分,合理的引物设计可以提高PCR测序的准确性和可靠性。
本教程将介绍如何针对外显子设计PCR测序引物。
一、引物设计原则1.引物长度:一般而言,引物的长度应在18-30个碱基对之间,太短会导致非特异性扩增,太长则会影响扩增效率。
2.引物Tm值:引物的熔解温度(Tm)应在52-58℃之间,以确保引物在PCR反应中的稳定性。
3.引物互补性:引物之间以及引物与模板DNA的互补性应避免或最小化,以防止非特异性扩增。
4.引物特异性:引物应特异性地结合到目标外显子区域,而不结合到其他区域。
可以通过BLAST等工具对引物进行序列比对,确保引物的特异性。
5.引物GC含量和GC均匀性:引物的GC含量应在40-60%之间,同时引物的GC均匀性也应较好。
GC含量过高或过低会影响PCR反应的效率。
二、引物设计步骤2. 引物定位:根据目标外显子序列,确定引物的起始位置和结束位置。
一般而言,引物应位于外显子的边界处,以确保扩增目标外显子。
同时,可使用软件工具(如ExonPrimer、Primer3等)进行自动引物定位。
3.引物设计:根据引物设计原则,设计一对特异性引物。
通常,外显子扩增需要一对引物,即前向引物和反向引物。
前向引物应与目标外显子的正链序列互补,反向引物则应与目标外显子的负链序列互补。
4. 引物评价:使用引物评价工具(如OligoAnalyzer等)评估引物的物理性质,如Tm值、互补性和自身形成二聚体等。
并根据评价结果对引物进行优化调整,确保引物质量。
5.引物合成:将引物序列提交给合成引物的机构进行合成。
三、实验操作注意事项1.引物浓度:引物的最佳浓度应在10-50uM之间。
过高或过低的引物浓度都会影响PCR反应的效率。
2.引物储存:琼脂糖电泳检测双峰带应将引物储存在-20℃的冰箱中,避免反复冻融。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
针对外显子设计PCR测序引物教程
在园子搜索后,没有看到长基因(大与1000base)最简洁方法,而我现在欧洲实验室里从事这方面工作,作了大量这方面的工作。
自乐不如同乐,愿将我们设计引物技巧与大家分享,敲字很辛苦,请斑竹给点分。
可能有战友说了,我们的长基因都是交给测序公司用鸟枪法来测全基因的。
当然,您有钱当然可以这样做。
我们的方法适用于基因测序筛查突变,步骤相对简便,比较经济。
另外,本实验室最近的一偏文章采用该法发在了NEMJ上,可见该法已经是经典成熟的。
(1)基础知识
我们知道gDNA由非编码区,外显子,内含子构成。
我们关心的基因是否突变在非编码区,外显字以及临近外显子的一小段内含子上。
至于其他的内含子(gDNA中的大头),发生突变与否并不是我们关心的,其临床意义也相当小。
因此我们只要设计引物来PCR上面三个重点区域就可以了。
(2)设计软件
在线设计软件exon primer
http://ihg2.helmholtz-muenchen.de/ihg/ExonPrimer.html
大家从上图可以看到,网页提示我们现在需要输入两个序列,一个是cDNA,一个是gDNA。
由于我们还要考虑非编码区,而CDNA是没有非编码区UTR的。
因此,我们必须要用mRNA 输入网页中的cDNA栏。
否则我们得到的引物不会包含UTR。
要是有看官还看不懂的话,建议看下分子生物学教材关于cDNA和mRNA的区别。
下面我们以smurf2基因来说明如何设计针对外显子的测序引物。
(2)找到smurf2 mRNA
打开gene bank
/,注意要在database中选nucleotide
如下图
蹦出一大串序列。
找到我们要的人类的smurf2
Homo sapiens SMAD specific E3 ubiquitin protein ligase 2 (SMURF2), mRNA
直接点我们要的序列名字,就得到了mRNA了,Format:GenBank FASTA Graphics More Formats选项中当然要求点选FASTA形式了
把mRNA序列拖选,拷贝下来
再拷贝入在线设计软件exon primer (见第一贴)
http://ihg2.helmholtz-muenchen.de/ihg/ExonPrimer.html
好了。
下面就要找gDNA了。
(3)ensembl在线查找gDNA
/Homo_sapiens/Info/Index
进入人类基因序列库
输入smurf2
得到下面的信息
点击Ensembl protein_coding Gene: ENSG00000108854 (HGNC (automatic): SMURF2
得到两段序列,201和202,其实两段序列是不同机构作出来的,大同小异.点第一个
得到如下页面
点页面里的supporting evidence,再点exon,就得到了smurf2的全基因序列,我们可以看到大写的碱基为外显子,小写的碱基为内含字.其实ensembl不同于ncbi的最大优势在于分开了外显字和内含字.我们设计的引物就知道是在外显子还是内含子上了.
现在将全部的gDNA用鼠标拖选起来,大家注意到两点(1)务必使内涵子全部显示,我们在页面左下角的
Configure this page里有这个选项.(2)鼠标拖选后,里面会有一些页面里的单词,比如ENSE00001331843什么的,必须把这类字母过滤掉.
可以用DNA-Star 工具软件里的Editseq(网上有下),将序列过滤,仅保留ATCG字母.或者用下列在线过滤工具
/sms/index.html
将过滤后的ATCG拷入
在线设计软件exon primer 的gDNA栏中(见第一贴)
http://ihg2.helmholtz-muenchen.de/ihg/ExonPrimer.html
默认的参数不变. done!
就得到了我们要的外显子引物了.大家可以发现我们的引物cover了非编码区,外显字以及临近外显子的一小段内含子.大功告成!(全文完)。
