第28届全国高中生化学竞赛初赛模拟试题
第28届全国高中生化学竞赛

第28届全国高中生化学竞赛(省级赛区)模拟题11-1说明为何AlF 3和三卤化硼BX 3均不形成双聚体的原因,比较B 2H 6与Al 2Cl 6结构上的异同点。
(3分)1-2酸化的Co 2+的溶液可在空气中保存较长时间,但加入氨水先得到红棕色的溶液,然后立即变成紫红色,分析原因。
用适当的方程式表示。
(2分)1-3结合离子方程式回答:用CrO 42-溶液检出Pb 2+为什么只能在弱酸或弱碱性介质中进行?(2分)1-4向硝酸酸化的)(3NaBiO aq 中慢慢滴入)(2MnCl aq ,先出现紫色,然后紫色又逐渐变成棕色,用离子方程式解释之。
(2分)1-5已知钴的两种配离子A 和B ,A 的化学式为[Co 2(NH 3)10H 2O 2]4+,B 的化学式为[Co(NH 3)5(OH)]2+,A 离子含有桥键,A 离子的桥键均裂后产生两个B 离子。
画出A 、B 两种离子的结构式,指出钴元素的氧化态及钴离子的杂化轨道类型,并判断这两种离子是顺磁性还是抗磁性。
(6分)1-6 以“O 2”为基础通过得失电子可以形成多种重要的含氧化合物,如Na 2O 2、BaO 2、KO 2、O 2+PtF 6-。
试写出O 2、O 22-、O 2-、O 2+的键级,并比较其稳定性。
(2分)1-7 用BK 249轰击Ca 48靶产生了117号元素(X )的两种同位素。
已知X 的一种同位素经过6次α衰变转化为元素R 270,X 的另一种同位素经过3次α衰变转化为元素T 281。
(1)写出合成117号元素的核反应方程式。
(1分)(2)写出X 的两种同位原子发生α衰变分别变为元素R 、T 的核反应方程式(用元素周期表中 给定的元素符号表示,左下标核电荷数,左上标质量数)。
(2分)1-8 硝酸工业的尾气中主要含有氮氧化物NO x ,对环境十分有害。
为除去NO x 通常可采用碱液吸收法及催化还原法。
(1)碱液吸收法通常是用NaOH 溶液将尾气吸收,使其转化为有用的化工原料,写出反应方程式。
全国高中化学竞赛初赛模拟考试1word含答案.doc

高中化学竞赛初赛模拟试卷(01)(时间:3小时满分:100分)第一题(6分)锦上添花:(根据已有内容的规律进行增补)1.填分子式:(1)①C2H6②C8H18③________ ④C80H162(2)①________ ②MgO ③SO3④CuSO4(3)①Fe2O3②③Na2O2④FeSO4·7H2O ⑤CuSO4·5H2O ⑥2.填化学方程式:①2Na+2H2O=2NaOH+H2↑②2C+SiO2=Si+CO↑③2H2S+O2=2S+2H2O ④____________________________。
第二题(12分)1.2003年底,重庆发生井喷毒气伤人事件,这主要是混杂在中的H2S、______等有毒气体使人中毒。
检测H2S可用试纸。
2.硫和氧都是ⅥA族的元素,硫化氢中的一个H可以被乙基替代,得到乙硫醇,其化学式为。
其同系物异丙硫醇的化学式分别是。
3.类似地,如果丙酮中的O被S替代,得到CH3-CS-CH3,则其命名为;同样,已知CH3-CO-SH命名为乙硫羟酸,则CH3-CS-OH可命名为。
4.苯硫酚的酸性比苯酚。
5.1mol化合物HSCH2CH(NH2)COOH能与mol的NaOH反应。
6.HSCH2CH(NH2)COOH电离常数分别Ka1、Ka2、Ka3(Ka1>Ka2>Ka3),指出Ka1、Ka2、Ka3相对应的基团各是哪个?1完成下列各步反应的化学反应式1.由AgCl制备AgNO3:将gCl溶解在氨水中,电解,所得产物溶于硝酸;2.由Hg2Cl2得到Hg:浓硝酸氧化,加热至干,溶于热水后电解;3.由Pb5(VO4)3Cl得到V:盐酸加热溶解(无气体产生),金属铝还原。
第四题(6分)某溶液含Fe 10.0mg,现将它苹取入某有机溶剂中,其分配比为D=99。
1.当用等体积的该溶剂萃取两次后,水相中剩余的Fe是多少mg?2.若用等体积水将上述合并后的有机相洗一次,将损失多少mg的Fe?3.若将洗后分出的水相以适当的方法显色后,定容至50.00mL,然后用1.0cm的比色皿测其吸光度,设摩尔吸光系数ε为2.0×104L·mol-1·cm-1,计算其吸光度。
全国中学生化学竞赛初赛模拟题(28)

全国中学生化学竞赛初赛模拟题(28)第1题(12分)将H2O2慢慢加入到SbF5的HF溶液中得一白色固体A,A是一种盐类,其阴离子呈八面体结构。
1-1A的结构简式,生成A的化学方程式。
1-2A不稳定,能定量分解,B是产物之一,其中亦含有八面体结构,B的结构简式为。
1-3若将H2S气体通入SbF5的HF溶液中,则得晶体C,C中仍含有八面体结构,写出C的结构简式。
生成C的化学反应方程式是。
1-4将H2O2滴入液氨中得白色固体D, D是一种盐,含有正四面体结构,写出D的结构式和生成反应方程式1-5比较H2O2和H2S的性质异同。
第2题(12分)锂电池由于其安全可靠的性能, 体积小、质量轻、高效能及可逆等卓越品质被广泛应用于移动电话、笔记本电脑、数码相机等便携式电子器材中。
下图为锂电池工作原理图, 阴极材料由LiMO2 (M=Co, Ni, V, Mn)构成, 阳极材料由石墨构成, 阴、阳两极之间用半透膜隔开, 充电时锂离子由阴极向阳极迁移, 放电时则相反, 电池可表示为:(-)C n/LiClO4/LiMO2(+)2-1写出锂电池充放电时的可逆电极反应。
2-2 根据上图所示的LiMO2的尖晶石结构, 写出氧的堆积方式, 并指出Li和M占据何种空隙, 画出2-3 锂离子在阳极与石墨形成固体混合物, 试推测并画出锂离子嵌入石墨的可能结构。
第3题(10分)固体发光材料是一种能将激发的能量转变为可见光的固体物质。
在基质中掺入杂质, 含量可达千分之几或百分之几, 可调整发光效率、余辉及发光光谱。
如在刚玉Al2O3基质中掺入0.05~1.0%的Cr3+及在Y2O3基质中掺入Eu3+等均可制成固体发光材料。
3+的发光原理。
2323立方体内的四面体空隙, 画出这样四个小立方体, 指出Y和O的配位数。
第4题(8分)本题涉及4种组成不同的配合物,它们都是平面正方形结构。
4-1 PtCl2·2KCl的水溶液与二乙硫醚(Et2S)反应(摩尔比1:2)得到两种结构不同的黄色配合4-2 PtCl2·2KCl的水溶液与足量Et2S反应获得的配合物为淡红色晶体,它与AgNO3反应(摩尔比1:第料中提取钯通常得到的物料是二氯二氨合钯,然后再用复杂的工艺得到氯化钯,并且环境污染严重,转化率低。
2014-2017全国高中生化学竞赛(初赛)试题及解析

第28届中国化学奥林匹克初赛试题第1题(6分)合成氨原料气由天然气在高温下与水和空气反应而得。
涉及的主要反应如下:(1)CH4(g)+H2O(g)→CO(g)+3H2(g)(2)2CH4(g)+O2(g)→2CO(g)+4H2(g)(3)CO(g)+H2O(g)→H2(g)+CO2(g)假设反应产生的CO全部转化为CO2,CO2被碱液完全吸收,剩余的H2O通过冷凝干燥除去。
进入合成氨反应塔的原料气为纯净的N2和H2。
1-1为使原料气中的N2和H2的体积比为1∶3,推出起始气体中CH4和空气的比例。
设空气中O2和N2的体积比为1∶4,所有气体均按理想气体处理。
1-2计算反应(2)的反应热。
已知:(4)C(s)+2H2(g)→CH4(g)ΔH4=-74.8kJ mol-1(5)C(s)+1/2O2(g)→CO(g)ΔH5=-110.5kJ mol-1第2题(5分)连二亚硫酸钠是一种常用的还原剂。
硫同位素交换和核磁共振实验证实,其水溶液中存在亚硫酰自由基负离子。
2-1写出该自由基负离子的结构简式,根据VSEPR理论推测其形状。
2-2连二亚硫酸钠与CF3Br反应得到三氟甲烷亚磺酸钠。
文献报道,反应过程主要包括自由基的产生、转移和湮灭(生成产物)三步,写出三氟甲烷亚磺酸根形成的反应机理。
第3题(6分)2013年,科学家通过计算预测了高压下固态氮的一种新结构:N8分子晶体。
其中,N8分子呈首尾不分的链状结构;按价键理论,氮原子有4种成键方式;除端位以外,其他氮原子采用3种不同类型的杂化轨道。
3-1画出N8分子的Lewis结构并标出形式电荷。
写出端位之外的N原子的杂化轨道类型。
3-2画出N8分子的构型异构体。
第4题(5分)2014年6月18日,发明开夫拉(Kevlar)的波兰裔美国女化学家Stephanie Kwolek 谢世,享年90岁。
开夫拉的强度比钢丝高5倍,用于制防弹衣,也用于制从飞机、装甲车、帆船到手机的多种部件。
第28届全国高中生化学奥林匹克竞赛(江苏赛区)初赛试题

26.写出N2H4与NO2作火箭推动剂的反应方程式:___________
27.用NaClO氧化NH3可以制备N2H4,写出方程式:___________
28.用碳酸二甲酯和一水合肼在70°C下可合成碳酰肼(CON4H6)。请画出碳酰肼的结构式:___________
13.pC类似于pH,是指极稀溶液中的溶质浓度的常用对数的负值。如某溶液中某溶质的浓度1×10-3mol·L-1,则该溶液中该溶质的pC=-lg(1×10-3)=3,如图为25°C时H2CO3,溶液的pC-pH图(若离子浓度小于10-5mol·L-1,可认为该离子不存在)。下列叙述正确的是
A.在同一溶液中,H2CO3、HCO 、CO 可以大量共存
29.请写出制备磷酸铁锂的化学方程式:___________
30.请写出磷酸铁锂电池充电、放电时的总反应方程式:___________
31.现有10g磷酸二氢锂,全部用于制备磷酸铁锂作为正极材料,则制成的磷酸铁锂电池理论上最多有多大的电池容量(即最大可放出多少电量)?答:___________(mAh)。(注:1摩尔电子所带的电量约为96500库仑,3.6库仑=1mAh。)
六、原理综合题
磷酸铁锂电池是指用磷酸铁锂(LiFePO4)作为正极材料的锂离子电池,属于一种新型锂离子二次电池,主要用作动力电池,具有安全性高、寿命长、容量大、高温性能好、无记忆效应和无污染等特点。磷酸铁锂可以由磷酸二氢锂、三氧化二铁和过量炭粉通过高温固相反应制备,反应中产生还产生H2O和CO。LiFePO4电池的工作原理是:电池充电时,正极(橄榄石结构的LiFePO4)部分转化为磷酸铁(设摩尔转化率为x),放出的锂离子(Li+)通过聚合物隔膜向负极(石墨)迁移,还原并嵌入石墨形成复合材料C6Lix;电池放电时,锂离子又从负极中脱出来,穿过隔膜回到正极材料中。(注:锂离子电池就是因锂离子在充放电时来回迁移而命名的,所以锂离子电池又称“摇椅电池”)
第28届化学竞赛省级赛区模拟试题1

命题人:王圣钦,李俊泽● 竞赛时间3小时。
迟到超过半小时者不能进考场。
开始考试后1小时内不得离场。
时间到,把试卷(背面朝上)放在桌面上,立即起立撤离考场。
● 试卷装订成册,不得拆散。
所有解答必须写在指定的方框内,不得用铅笔填写。
草稿纸在最后一页。
不得持有任何其他纸张。
● 姓名、报名号和所属学校必须写在首页左侧指定位置,写在其他地方者按废卷论处。
● 允许使用非编程计算器以及直尺等文具。
1.008Zr Nb Mo Tc Ru Rh Pd Ag CdIn Sn Sb Te I Hf Ta W Re Os Ir Pt Au Hg Tl Pb Bi Po At Ac-Lr HLi BeB C N O F Na MgAl Si P Cl S K Ca Sc Ti V Cr MnFe Co Ni CuZn Ga GeAs SeBr Rb Cs Fr Sr BaRaY La Lu -6.9419.01222.9924.3139.1040.0885.4787.62132.9137.3[223][226]44.9647.8850.9452.0054.9455.8558.9363.5558.6965.3910.8126.9869.7212.0128.0972.61114.8204.4118.7207.2112.4200.6107.9197.0106.4195.1102.9192.2101.1190.298.91186.295.94183.992.91180.991.22178.588.9114.0116.0019.0030.9774.92121.8209.032.0778.96127.6[210][210][210]126.979.9035.454.00320.1839.9583.80131.3[222]He Ne Ar KrXe Rn 相对原子质量Rf Db Sg Bh Hs Mt第1题 (12分)写出下列方程式:和一比一的气体的反应方程式。
第28届全国高中学生化学竞赛试题

第28届全国高中学生化学竞赛试题第28届全国高中学生化学竞赛试题28届化学竞赛篇一:第28届全国高中学生化学竞赛一.完成下列化学方程式,(12分)(1)橘红色晶体粉末加热分解,冒出大量气体,并伴有火山爆发的现象。
(2)黄血盐加热形成FeC2及一种剧毒物质。
(3)三硫化二砷溶于氢氧化钠溶液形成两种盐。
(4)二氧化锰与过氧化钠共熔形成锰盐。
(5)用叠氮化钠制取光谱纯的氮气。
(6)硝酸亚汞溶液通入硫化氢气体产生黑色沉淀。
二.回答下列问题。
(23分)(1)三氧化硫在一定条件下可以形成一种聚分子。
该分子仅含有一个三次旋转轴,以及三个相交交线为三次旋转轴的对称面。
请画出该分子的结构。
(2)均苯三甲酸在固态时为片状晶体,其层间通过分子间作用力连接。
请画出连接的一个结构基元,并指出连接的分子间作用力为何种作用力。
(3)为在酸性条件下砷酸能够氧化氢碘酸,而在碱性条件下该反应逆向发生,做出合理解释。
(4)气态三氯化铝和三氯化金均形成二聚体。
画出二聚体的结构式,并指出杂化类型。
(5)用水煤气(CO,H2)在823k,常压下还原金属氧化物MO时,会发生如下反应。
MO+CO=可逆=M+CO2 kp=480MO+H2=可逆=M+H2O kp=67生成的混合气体中,测得其中水含量1.1235 g,二氧化碳含量1.6635g计算生成的混合气体中,H2和CO的分压,以及还原得到的M的物质的量。
(6)邻硝基苯胺可与三氯化铬在强碱条件下形成若干种单核电中性配位化合物。
画出该配合物可能的异构体。
配体用表示。
三.肼的衍生物A在有机合成中是一个不常用的自由基引发剂。
它的可以由一种偶极矩很小的分子B用Cu还原而成。
B含氮量为19.73%。
A与还原剂苯硫酚反应可生成一种化合物C,C含氮量26.42%。
C与KF反应形成一比一加合物,加合物再分解得到了一种不常见的.分子D,D有顺式反式两种结构。
下面给出一些D的数据。
注意,异构化反应熵变(1)写出A,B,C,D的化学式。
全国高中化学竞赛初赛模拟试题

20XX 年第28届全国高中学生化学竞赛(省级赛区)模拟试卷1.008Zr Nb Mo T c RuRh Pd Ag Cd In S n S b Te I Hf Ta W Re OsIr Pt Au Hg Tl Pb Bi Po At Ac-Lr HLi BeB C N O F Na MgAl S i P Cl S K Ca S c Ti V Cr Mn Fe Co Ni Cu Zn G a G e As S e BrRb Cs Fr S r Ba RaY La Lu -6.9419.01222.9924.3139.1040.0885.4787.62132.9137.3[223][226]44.9647.8850.9452.0054.9455.8558.9363.5558.6965.3910.8126.9869.7212.0128.0972.61114.8204.4118.7207.2112.4200.6107.9197.0106.4195.1102.9192.2101.1190.298.91186.295.94183.992.91180.991.22178.588.9114.0116.0019.0030.9774.92121.8209.032.0778.96127.6[210][210][210]126.979.9035.454.00320.1839.9583.80131.3[222]He Ne Ar Kr Xe Rn 相对原子质量Rf Db Sg Bh Hs Mt第1题(8分)X 是碘一氧系中研究得最多的稳定化合物,白色粉状固体,分解温度573K ,相对分子质量334。
在343K 时能将一氧化碳定量地转变为CO 2,这一性质被用于合成氨厂中测定合成气中CO 的含量。
1—1写出X 的化学式及其热分解反应方程式1—2写出X 与CO 反应的化学方程式,并简述X 能用于测定合成气中CO 含量的理由。
全国高中化学竞赛(初赛)模拟试题20套05教案

高中化学比赛初赛模拟试卷(05)(时间: 3 小时满分: 100 分)题号1 2 3 4 5 6 7 8 9 10 满分 6 8 11 6 11 9 10 17 9 13H相对原子质量He1.008 4.003 Li Be B C N O F Ne 6.941 9.012 10.81 12.01 14.01 16.00 19.00 20.18 Na Mg Al Si P S Cl Ar 22.99 24.31 26.98 28.09 30.97 32.07 35.45 39.95 K Ca Sc Ti V Cr Mn Fe Co Ni Cu Zn Ga Ge As Se Br Kr 39.10 40.08 44.96 47.88 50.94 52.00 54.94 55.85 58.93 58.69 63.55 65.39 69.72 72.61 74.92 78.96 79.90 83.80 Rb Sr Y Zr Nb Mo Tc Ru Rh Pd Ag Cd In Sn Sb Te I Xe 85.47 87.62 88.91 91.22 92.91 95.94 [98] 101.1 102.9 106.4 107.9 112.4 114.8 118.7 121.8 127.6 126.9 131.3 Cs Ba La-Hf Ta W Re Os Ir Pt Au Hg Tl Pb Bi Po At Rn 132.9 137.3 Lu 178.5 180.9 183.8 186.2 190.2 192.2 195.1 197.0 200.6 204.4 207.2 209.0 [210] [210] [222] Fr Ra Ac -Rf Db Sg Bh Hs Mt Ds[223] [226] LaLa 系La Ce Pr Nd Pm Sm Eu Gd Tb Dy Ho Er Tm Tb Lu 138.9 140.1 140.9 144.2 144.9 150.4 152.0 157.3 158.9 162.5 164.9 167.3 168.9 173.0 175.0第一题( 6 分)1.碳氢化合物是大气污染物之一,以下现象的产生与碳氢化合物相关的是A 臭氧空洞B 酸雨C 温室效应D 光化学烟雾2.以下分子中所有的原子都知足最外层8 电子构造的是A 次氯酸B 甘汞C 三氟化硼D 氯化硫(Ⅰ)3. 2000 年美国《科学》杂志报导,意大利科学家合成了一种新式氧分子,它由 4 个氧原子构成的O4分子,专家以为它液化后的能量密度比一般氧分子高得多。
最新28届化学竞赛初赛题、答、评分标准

第28届中国化学奥林匹克初赛试题、答案和评分标准第1题(6分) 合成氨原料气由天然气在高温下与水和空气反应而得。
涉及的主要反应如下:(1) CH4(g) + H2O(g) → CO(g) + 3H2(g)(2) 2CH4(g) + O2(g) → 2CO(g) + 4H2(g)(3) CO (g) + H2O(g)→ H2(g) + CO2(g)假设反应产生的CO全部转化为CO2,CO2被碱液完全吸收,剩余的H2O通过冷凝干燥除去。
进入合成氨反应塔的原料气为纯净的N2和H2。
1-1为使原料气中N2和H2的体积比为1 : 3,推出起始气体中CH4和空气的比例。
设空气中1-2计算反应(2)的反应热。
已知:(4) C(s) + 2H2(g) → CH4(g) ΔH4 = -74.8 kJ mol-1-1第2题(5分) 连二亚硫酸钠是一种常用的还原剂。
硫同位素交换和顺磁共振实验证实,其水溶液中存在亚磺酰自由基负离子。
2-1写出该自由基负离子的结构简式,根据VSEPR理论推测其形状。
2-2连二亚硫酸钠与CF3Br反应得到三氟甲烷亚磺酸钠。
文献报道,反应过程主要包括自由基的产生、转移和湮灭(生成产物)三步,写出三氟甲烷亚磺酸根形成的反应机理。
第3题 (6分) 2013年,科学家通过计算预测了高压下固态氮的一种新结构:N 8分子晶体。
其中,N 8分子呈首尾不分的链状结构; 按价键理论,氮原子有4种成键方式; 除端位以外,其他氮原子采用3种不同类型的杂化轨道。
分子的Lewis 结构并标出形式电荷。
写出端位之外的N 原子的杂化轨道类型。
2分;个扣0.5分,扣完为止;答案中未示出的分子的构型异构体。
两种异构体中,若省略了孤对电子,不扣分。
第4题 (5分) 2014年6月18日,发明开夫拉 (Kevlar) 的波兰裔美国女化学家Stephanie Kwolek 谢世,享年90岁。
开夫拉的强度比钢丝高5倍,用于制防弹衣,也用于制从飞机、装甲车、帆船到手机的多种部件。
【免费下载】全国高中化学竞赛初赛模拟试题
第1题(8分)X 是碘一氧系中研究得最多的稳定化合物,白色粉状固体,分解温度573K ,相对分子质量334。
在343K 时能将一氧化碳定量地转变为CO 2,这一性质被用于合成氨厂中测定合成气中CO 的含量。
1—1写出X 的化学式及其热分解反应方程式1—2写出X 与CO 反应的化学方程式,并简述X 能用于测定合成气中CO 含量的理由。
1—3画出X 的分子结构示意图1—4X 的水溶液中添加盐酸并将逸出的气体通入氯仿中得化合物Y ,Y 是制造一种灭火器的原料,写出上述两步反应的化学方程式。
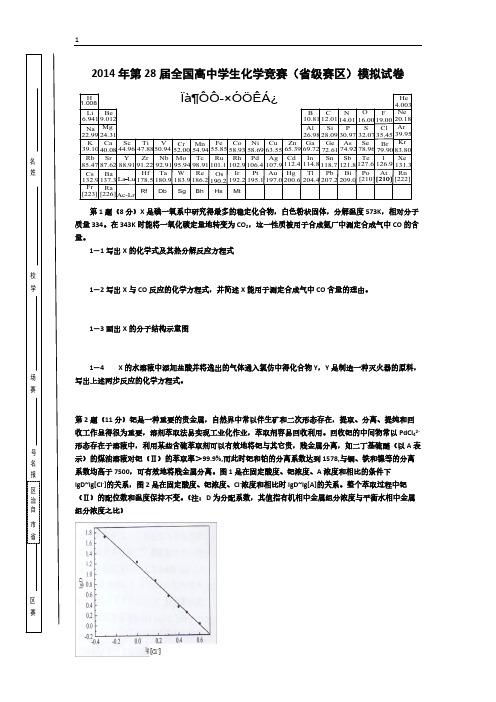
第2题(11分)钯是一种重要的贵金属,自然界中常以伴生矿和二次形态存在,提取、分离、提纯和回收工作显得很为重要,溶剂萃取法易实现工业化作业,萃取剂容易回收利用。
回收钯的中间物常以PdCl 42-形态存在于溶液中,利用某些含硫萃取剂可以有效地将钯与其它贵,贱金属分离,如二丁基硫醚(以A 表示)的煤油溶液对钯(Ⅱ)的萃取率>99.9%,而此时钯和铂的分离系数达到1578,与铜、铁和镍等的分离系数均高于7500,可有效地将贱金属分离。
图1是在固定酸度、钯浓度、A 浓度和相比的条件下lgD~lg[Cl -]的关系,图2是在固定酸度、钯浓度、Cl -浓度和相比时lgD~lg[A]的关系。
整个萃取过程中钯(Ⅱ)的配位数和温度保持不变。
(注:D 为分配系数,其值指有机相中金属组分浓度与平衡水相中金属组分浓度之比)姓名学校赛场报名号赛区省市自治区2—1 推断萃取配合物的化学组成(列出推断过程)及写出萃取钯的化学反应方程式。
2—2 写出萃取配合物的结构式及其异构体。
2—3 简述A能高效萃取钯的原因。
2—4萃取过程属什么反应类型。
第3题(11分)3—1 PCl3和NH3在CHCl3中于195K时生成A物质,A不稳定在稍高温度下即分解为一种不溶于液氨、氯仿等溶剂中的黄色无定形物质B,B中含磷68.89%。
写出生成A的化学反应方程式和A分解为B的反应方程式,画出B的路易斯结构式。
2014年第28届全国高中化学奥林匹克竞赛初赛试题

第28届中国化学奥林匹克初赛试题及标准答案第1题(6分)合成氨原料气由天然气在高温下与水和空气反应而得。
涉及的主要反应如下:(1)CH4(g)+H2O(g)→CO(g)+3H2(g)(2)2CH4(g)+O2(g) →2CO(g)+4H2(g)(3)CO(g)+H2O(g) →H2(g)+CO2(g)假设反应产生的CO全部转化为CO2,CO2被碱液完全吸收,剩余的H2O通过冷凝干燥除去。
进入合成氨反应塔的原料气为纯净的N2和H2。
1-1 为使原料气中N2和H2的体积比为1:3,推出起始气体中CH4和空气的比例。
设空气中O2和N2的体积比为1:4,所有气体均按理想气体处理。
1-2 计算反应(2)的反应热。
已知:(4)C(s)+2H2(g) →CH4(g) ΔH4=-74.8 kJ·mol-1(5)C(s)+1/2O2(g) →CO(g) ΔH5=-110.5 kJ·mol-11-14份N2,需12份H2;4份N2由空气引入时,同时引入l份O2。
由反应(2)和(3),l份O2需2份CH4,产生6份H2;另外的6份H2由反应(l)和(3)提供,再需要6/4份CH4;因此,起始体系中CH4和O2的比例为3.5:1,故CH4和空气的比例为3.5:5,即7:10。
1-2 反应(5)×2-1反应(4)×2,得反应(2),(2)的反应热:ΔH2=-110.5 kJ·mol-1×2-(-74.8 kJ·mol-1×2)=-71.4 kJ·mol-1第2题(5分)连二亚硫酸钠是一种常用的还原剂。
硫同位素交换和顺磁共振实验证实,其水溶液中存在亚磺酰自由基负离子。
2-1 写出该自由基负离子的结构简式,根据VSEPR理论推测其形状。
2-2 连二亚硫酸钠与CF3Br反应得到三氟甲烷亚磺酸钠。
文献报道,反应过程主要包括自由基的产生、转移和湮灭(生成产物)三步,写出三氟甲烷亚磺酸根形成的反应机理。
全国高中生化学竞赛初赛模拟试题
全国高中生化学竞赛初赛模拟试题(02 )(时间:3小时满分:100分)第一题(11分)除糖类和蛋白质外,类脂化合物也是维持正常的生命活动不可缺少的物质。
1 •由动物或植物中取得的油脂是多种物质的混合物,其主要成分是______________________ ;2. 桐油酸和蓖麻油酸的结构简式分别为CH(CH2)3(CH= CH)3(CH2)7COOH和CH(CH2)5CH(OH)CHCH =CH(CH)7COOH请分别命名。
3. ____________________________________________________________油脂在空气中氧、水分和霉菌的作用下酸败的主要产物是_______________________________________________、__________ 等(类别)。
4 .表面活性剂是能降低 ____________________ 的物质,阴离子型表面活性剂是其中一类,如CH(CH2)1o CHOSONa、RSONa、R—「一【一SONa,主要用于_____ 。
5. 蜡和石蜡的物态、物性相近,而化学性质完全不同,蜡的主要组分是高级脂肪酸的高级饱和一元醇酯,而石蜡是___________________ 。
列举蜡的一种用途____________ 。
6. 磷脂是一类含磷的脂类化合物,他们在结构上的共同点是分子中同时有______ 与______ ,使得磷脂类化合物在细胞膜中起着重要的生理作用。
7. 萜类化合物广泛存在于动植物界,它们的共同点是分子中的碳原子数都是_的整数倍。
(填数字)8 .甾体化合物也叫类固醇化合物,广泛存在于动植物界。
它们的共同特点是都含有一个由与氢化菲并联的骨架。
第二题(7分)云母是一种重要的硅酸盐,它具有韧度、弹性、透明度、高介电强度、化学惰性和热稳定性。
白云母可看作叶腊石中1/4的Si "被Al "所取代,再由Q平衡其电荷后形成的。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
第28届全国高中生化学竞赛(省级赛区)模拟试题考试时间3小时,迟到超过30分钟不能进考场。
开始考试30分钟内不能离开考场。
本试题由题卷和答题卷组成,用黑色签字笔或黑色圆珠笔答题。
在答卷题序号设定的方框内答 题,答在其它地方无效。
第1题(17分)1-1 以“O 2”为基础通过得失电子可以形成多种重要的含氧化合物,如Na 2O 2、BaO 2、KO 2、O 2+PtF 6-。
试写出O 2、O 22-、O 2-、O 2+的键级,并比较其稳定性。
(2分) 1-2 用BK 249轰击Ca 48靶产生了117号元素(X )的两种同位素。
已知X 的一种同位素经过6次α衰变转化为元素R 270,X 的另一种同位素经过3次α衰变转化为元素T 281。
1-2-1 试推断R 、T 分别是多少号元素,写出其同位素的符号(用元素周期表给定的元素符号表示,左下标核电荷数,左上标质量数)。
(2分) 1-2-2 写出合成117号元素的核反应方程式。
(1分)1-2-3 写出X 的两种同位原子发生α衰变分别变为元素R 、T 的核反应方程式(用元素周期表中 给定的元素符号表示,左下标核电荷数,左上标质量数)。
(2分) 1-3 用Ag +的标准溶液滴定KCl 和KSCN 的中性溶液,测定其导电性得到电位滴定曲线,其拐点依次位于M 、N 、P 。
1-3-1 请分别写出达到M 、N 、P 处滴定终点的离子反应方程式(3分);1-3-2 在N 处的物质是无支链的线型聚合物,请至少画出三个单元表示其结构(2分)。
1-4 硝酸工业的尾气中主要含有氮氧化物NO x ,对环境十分有害。
为除去NO x 通常可采用碱液吸收法及催化还原法。
1-4-1 碱液吸收法通常是用NaOH 溶液将尾气吸收,使其转化为有用的化工原料,写出反应方程式。
(2分)1-4-2 催化还原法通常是用CO 、NH 3、CH 4等气体在催化作用下将尾气中的NO x 还原成无毒害的气体再排放。
写出有关反应方程式。
(3分) 第2题(15分)2-1NCo BrCl N( 代表α -氨基乙酸根)2-1-1 写出该配离子的名称。
(1分)2-1-2 画出该配离子的另外几个八面体构型的异构体。
(5分)2-2 EDTA 是一种重要的配位试剂。
在分析化学及药物制剂等领域有重要应用。
2-2-1 写出EDTA 的化学名称。
(1分)2-2-2 通常把EDTA 制成二钠盐作为测定金属离子的分析试剂,写出其二钠盐的通用化学式,说明为什么要制成二钠盐?写出用EDTA 二钠盐标准溶液测Cu 2+含量的离子方程式。
(2分)2-2-3 EDTA 与Ca 2+形成稳定的螯合钙是一种重要的人体补钙试剂及重金属解毒剂。
在下面方框内画出此螯合钙的结构。
(2分)2-2-4 用静脉注射螯合钙针剂可以解除Pb 2+等重金属离子对人体的毒害。
试结合反应方程式分析其解毒原理,并回答能否注射EDTA 二钠盐作为人体重金属离子的解毒剂。
(2分)2-3 在CuSO 4溶液的碱性溶液中加入缩二脲HN(CONH 2)2会得到特征的紫色物质,该物质为-2价的配位阴离子,具有对称中心和不通过Cu 2+的二重旋转轴,无金属—金属键,请画出该阴离子的结构(2分) 第3题(14分)硼元素与元素周期表中同族元素相比有许多特殊的化学性质。
3-1 硼原子的价电子组态为 。
B 2O 3溶于水生成硼酸,硼酸为一元弱酸,写出其在水溶液中的电离方程式。
(2分)3-2 用标准碱液滴定硼酸时,往往需事先向样品溶液中加入甘露醇处理。
这是为什么,写出有关反应方程式。
(2分)3-3 硼酸与甲醇在浓H 2SO 4作用下生成酯,该酯类物质在高温下燃烧产生特殊的绿色火焰。
此反应用于鉴别硼酸、硼酸盐等含硼化合物。
写出有关反应方程式。
(2分)3-4 自然界中的硼酸盐主要是硼砂,其化学式为 。
硼砂与稀H 2SO 4作用可生成硼酸,写出其离子反应方程式。
(2分)3-5 BCl 3与NH 4Cl 在一定条件下反应,再经NaBH 4还原可形成类似于苯的化合物叫无机苯,写出有关反应方程式。
(2分)3-6 无机苯可与HCl 发生加成反应,写出其反应方程式(用结构式表示无机苯及加成产物)(1分) 3-7 NaBH 4是一种重要的还原剂,在有机合成中有广泛应用。
(3分) 3-7-1 写出由硼酸甲酯与NaH 制取NaBH 4的化学方程式。
3-7-2 写出NaBH 4分别与H 2O 、H 2O 2反应的离子方程式。
第4题(13分)有一橙红色固体A 受热后得绿色的固体B 和无色的气体C ,加热时C 能与镁反应生成灰色的固体D 。
固体B 溶于过量的NaOH 溶液生成绿色的溶液E ,在E 中加适量H 2O 2则生成黄色溶液F 。
将F 酸化变为橙色的溶液G ,在G 中加BaCl 2溶液,得黄色沉淀H 。
在G 中加KCl 固体,反应完全后则有橙红色晶体I 析出,滤出I 烘干并强热则得到的固体产物中有B ,同时得到能支持燃烧的气体J 。
NO4-1 A、B、C、D、E、F、G、H、I、J各代表什么物质?写出其化学式。
(5分)4-2 写出有关的反应方程式。
(6分)第5题(8分)在25℃和101.325kPa下,用Pt做阴极,Ag做阳极,以0.06158A的直流电源电解0.01mol·L-1NaNO3和HNO3混合溶液。
阴极析出H2,阳极银溶解生成Ag+。
电解一段时间后,用0.1012mol·L-1的NH4SCN标准溶液滴定生成的Ag+,以硫酸铁铵作指示剂,滴定终点消耗NH4SCN 标准溶液50.65mL。
5-1 写出滴定过程中的离子反应方程式。
(2分)5-2滴定终点溶液颜色怎样变化?能否用FeCl3溶液作指示剂?(2分)5-3计算在理论上阴极可生成多少mLH2?(2分)5-4 计算电解时间是多少小时?(2分)第6题(6分)在滴定分析时,通常采用邻苯二甲酸氢钾(KHC8H4O4)基准物标定NaOH溶液浓度:KHC8H4O4+NaOH==KNaC8H4O4+H2O准确称取0.6126 g邻苯二甲酸氢钾置于一烧杯中,加适量水溶解,采用NaOH溶液滴定,当酚酞指示剂刚刚变色,即到达终点时用去29.40 mL NaOH溶液。
6-1计算邻苯二甲酸氢钾的摩尔数和NaOH溶液的摩尔浓度。
[M(KHC8H404)=204.2 g·mol-1](2分)6-2 写出NaOH滴定H2SO4的化学反应方程式。
若采用酚酞指示剂,到达终点时的滴定体系溶液是什么颜色?(选择无色、黄色、微红色或其它颜色一种答案)(2分)6-3 现有一H2SO4样品液,先将其用纯水准确稀释10倍,然后移取10.00 mL稀释后的H2SO4溶液,采用上述NaOH标准溶液直接滴定,到达终点时用去22.00 mL NaOH标准溶液,求原来H2SO4样品液的摩尔浓度。
(2分)第7题(14分)分子式为C3H6的化合物存在2个异构体A和B,A能迅速与溴单质反应生成互为立体异构体的产物C和D;B的同系物与溴单质只能在光照下反应,并伴有副产物HBr生成,而B却能在无光照条件下与溴单质反应生成单一产物E。
E是C,D的异构体。
本题非立体结构式用结构简式或键线式,立体结构式用虚线—楔线式表达,如:7-1 写出化合物A,B,C,D,E的结构式并分别用系统命名法命名。
(5分)7-2写出含5个碳原子的B的同系物与溴单质在光照下反应的反应式(用键线式表示)并指出其反应类型(取代反应、消去反应或加成反应)。
(1分)7-3 A或B分子中的一个氢原子被其同位素氘置换后,得到分子式为C3H5D的化合物。
用键线式或虚线—楔线式表示这些化合物的可能结构(含立体异构体)。
(2.5分)7-4如果将A分子中的2个氢原子用氘置换,则得到7个分子式为C3H4D2的化合物,依次标记为A1-A7。
A1分子中的2个氘原子所处的环境完全相同,而其余的6个化合物分子中2个氘原子所处的环境均不相同。
用键线式表示A1的结构。
(0.5分)7-5在金属把催化剂存在下,A1-A7分别与氘气(D2)反应得到分子式为C3H4D4的化合物,其中有的生成单一产物,有的则得到一对对映异构体。
A1,A2,A3生成的是相同的一对对映体X1和X2,而A7生成的是另一对对映体;A4,A5生成相同的单一产物Y,而A6则生成另一产物Z。
用键线式或虚线—楔线式表示A2-A7,X1,X2,Y和Z的结构。
(5分)第8题(4分)某萜烯醇A(C10H18O)经选择性氧化得到的产物或是一个十碳原子的醛,或是一个十碳原子的羧酸;A与二摩尔的溴反应,生成一个四溴化合物,分子式为C10H18OBr4(B);A经臭氧分解、氧化反应后,生成下列三个化合物:CH3C OCH3O C CH2OHCH2C OCH3O C COHOOH化合物A也能与氢溴酸(HBr)反应,生成几种化合物——包括分子式为C10H17Br的两个开链的溴化物。
8-1画出化合物A、B的结构。
(2分)8-2画出分子式为C10H17Br的两个开链溴化物的结构。
(2分)第9题(9分)增塑剂(又称塑化剂)不是食品添加剂,而是工业上广泛使用的塑料添加剂,长期食用含增塑剂的食品对人体健康十分有害。
2011年5月起台湾食品中先后检出DEHP等多种增塑剂,2011年6月1日卫生部紧急发布公告,将某些增塑剂列入食品中可能违法添加的非食用物质和易滥用的食品添加剂名单。
DEHP在碱性条件下水解并酸化后,得到两个化合物A(C8H6O4)和B(C8H18O),两者的摩尔比为1:2。
A是一种含苯环的酸性物质,发生硝化反应时,仅生成两种一元硝化产物。
B为饱和化合物,在室温下易被KMnO4氧化生成C(C8H16O2)。
日在A12O3存在下加热生成D(C8H16),D 与K2Cr2O7/H2SO4反应生成3-庚酮和二氧化碳。
用CrO3/吡啶可将B转化为E(C8H16O),E能与Ag(NH3)2OH发生银镜反应并生成F。
9-1请写出化合物A-F的结构简式。
(6分)9-2另一种增塑剂DEEP的合成方法如下,请写出DEEP的结构简式、G-K所代表的试剂及必要反应条件或产物的结构简式:(3分)第7题(10分)评分总则:在计算式中,未带入单位不扣分。
但计算结果表示应考虑有效数字和单位。
本题所有求算结果均为四位有效数字,第一次有效数字错误扣0.5分;求算物理量均需正确标注单位,第一次单位错误扣0.5分,但有效数字和单位错误累计扣分不超过1分。
7-1 4分7-2 2分第8题(15分)8-2 2分第10题(9分)10-16分,每个1分DCH 3CH 2CH 2CH 2C CH 2CH 2CH 3ECH 3CH 2CH 2CH 2CHCHO CH 2CH 3FCH 3CH 2CH 2CH 2CHCO 2CH 2CH 3写成酸不扣分。
