第八章 酰基化
酰基化反应详细资料大全

酰基化反应详细资料大全
酰基化反应是一种化学反应,在伯、仲胺与酰氯、酸酐或羧酸等酰基化试剂反应中,氨基的氢原子可被酰基取代,生成N―取代酰胺或N,N-二取代酰胺,这一过程称之为酰基化反应。
基本介绍
•中文名:酰基化反应
•适用条件:酰氯、酸酐
•被酰化物结构:芳核:呋喃>苯>吡啶
•溶剂:收率和引入位置
概况,套用,影响反应的主要因素,
概况
伯、仲胺与酰氯、酸酐或羧酸等酰基化试剂反应,氨基的氢原子可被酰基取代,生成N―取代酰胺或N,N-二取代酰胺。
叔胺不能进行酰基化反应。
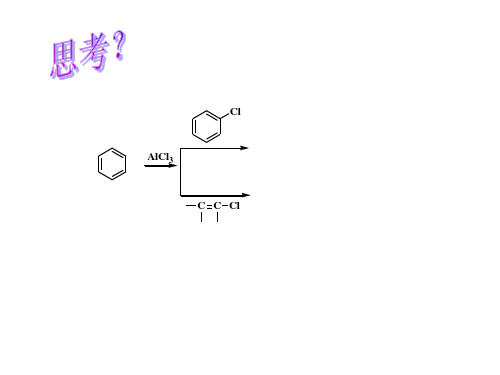
另外,在无水氯化铝的催化下,芳烃与酰氯、酸酐或羧酸等酰基化试剂作用,环上的氢原子被酰基取代,也是酰基化反应。
套用
有重要意义N―取代酰胺是晶体,有确定的熔点,故酰基化反应可鉴定胺酰胺基不易被氧化,芳胺酰化反应在有机合成中用于氨基的保护或降低氨基对芳环的致活能力,反应结束后再使酰胺水解恢复为原来的胺引入永久性酰基。
是合成许多药物时常用的反应如:扑热息痛(对羟基乙酰苯胺)的合成(一种解热镇痛药),其制备经过乙酰基化反应异氰酸酯的合成及套用——合成芳香族伯胺与碳酰氯(俗称光气)依次进行酰化、脱氯化氢生成异氰酸酯 C-酰基化反应
影响反应的主要因素
(1)被酰化物结构——芳核:呋喃>苯>吡啶芳环上取代基:给电子基易,吸电子基难(2)酰化剂:酰卤>酸酐>羧酸(3)催化剂和溶剂催化剂:活性—Lewis>质子酸适用条件:酰氯、酸酐——Lewis酸(AlCl3 , BF3 ,ZnCl2) 羧酸——质子酸(HF , H2SO4 ,H3PO4) 溶剂:收率和引入位置。
第八章 胺和酰胺

宁德职业技术学院
宁德职业技术学院
(3) 叔胺 脂肪族叔胺由于氮原子上没有氢原子, 只能与亚硝酸 作用, 生成不稳定的水溶性亚硝酸盐(无名显现象). 此盐 用碱处理后, 又重新得到游离的脂肪族叔胺.
芳香族叔胺与亚硝酸作用, 不生成盐, 而是在芳环上引 入亚硝基, 生成有色的对亚硝基芳叔胺. 如对位被其它基团 占据,则亚硝基在邻位上取代.
宁德职业技术学院
“摇头丸”是冰毒的衍生物,名为3,4-亚甲二氧基甲基 苯丙胺英文缩写为 MDMA ,属中枢神经兴奋剂. 我国从 1990 年起, 摇头丸开始在舞厅流行 , 通常以 60~120 毫克的药丸或 胶囊形式服用. 服用后会使人有快乐的感觉,出现幻觉,进而 使人多话而不知停止, 头颈左右摇摆不止等中枢神经系统高度 兴奋的症状. “摇头丸” 对健康的损害是相当严重而且无法预 期的,服用摇头丸会诱发突发性的恶性高血压、自发性脑出血 或脑血管阻塞、胸痛、肝炎及肝衰竭等疾病的发生,导致严重 的后果,并可能诱发潜在的精神疾病.
宁德职业技术学院
苯胺能与稀盐酸、硫酸等成盐, 但不能和乙酸成 盐,二苯胺只能与浓的盐酸、硫酸成盐,但形成的盐遇 水立即水解,三苯胺则接近中性,不能和浓盐酸等成盐. 芳脂胺的碱性,由于氨基氮原子上孤对电子对不 能和苯环发生P-π共轭, 所以碱性一般比苯胺强些. 如 苄胺的碱性强于苯胺.
宁德职业技术学院
第八章 胺和酰胺
第一节 胺
宁德职业技术学院
NH3(氨)分子中的氢原子被R-或Ar-取代后的衍生 物叫做胺. 胺类广泛存在于生物界, 许多生物碱具有生理 或药理作用.
宁德职业技术学院
一.胺的分类和命名 1.胺的分类 (1) 根据分子中与氮原子连接的烃基数来分
胺与醇的分级依据不同. 胺的分级着眼于氮原子上烃 基的数目;醇的分级立足于 羟基所连的碳原子的级别 .
酰化反应-第八章习题

第八章酰化反应
1.试比较C—烷基化和C—酰基化反应的异同
答:相同点:都是亲电取代反应历程,催化剂都是路易斯酸、质子酸等;不同点:所用试剂不同,C-烷基化用卤烷、烯烃或醇作为烷基化剂,C-酰基化用酰卤或酸酐作为酰基化剂;C-烷基化是连串反应、可逆反应并且烷基会发生重排和异构化,C-酰基化都不具备上述特点;所用催化剂的用量不同。
2.下列化合物进行C-酰化反应最难的是:( A )
A.B.C.D.
答:C-酰化反应是亲电取代历程,被攻击的原子上电子云密度越高,反应越容易;相反,电子云密度越低,反应越难进行。
3.完成反应
ClH2COC NHCOCH3
答:对位取代的,用-CO-CH2Cl取代对位的H。
无水三氯化铝作催化剂,CS2是溶剂。
8-酰化反应解析

O O R C + R C OAlCl2 Cl
O R C OAlCl2
AlCl3
O RCOCl + Al Cl
后者转化率不高,实际只让 酸酐 中的一个酰基参加反应。
R C R C
O O +2 AlCl3 + O
O O AlCl3 + R C OAlCl2 C R + HCl
酸酐中一个酰基参加反应,1 mol 酸酐至少要2 mol AlCl3。 实际使用过程中, AlCl3再过量10%~50%。
时将以烷基化反应产物为主,故不应以卤代烷为溶剂。
(iii). 处于两种极端状态之间时,烷基化反应不可忽略,也 不应以卤代烷为溶剂。
2、浓度效应
① 酰氯高浓度有利;
② 尽可能没有卤代烷; ③ 芳烃高浓度好。
酰化的主副反应的综合(连串、平行)分析
① 消除平行副反应:不以卤代烷为溶剂可消除烷基化反应。
3、加料方式
芳烃、酰卤的高浓度均有利于酰化反应。由于 AlCl3 与 酰卤的溶解、络合放热,芳烃与酰卤的一次性加入难于控 制,因而一般酰卤采取滴加方式以使控制热量缓慢放出。 由浓度效应分析,加酰卤时宜快不宜慢,只要温度可控即 可。
⑵ σ络合物的生成:受 亲电试剂 和 芳烃电子云密度 两个因 素影响;(亲电性) 烷基正离子 > 酰基正离子; (芳烃电子云密度对反应的影响)酰基正离子 > 烷基正离子。
⑶ 烷基化(烷基正离子生成)和酰化反应(σ络合物生成)
的控制步骤不同,见下图。
Ev2
能 量
酰基化(σ络合物生成)
Ev'1 Ev'2
烷基化(烷基正离子生成)
E v1
正离子
化学竞赛PPT-第八章 芳烃-第82
CH3 NO2 +
CH3
NO2
§8.4 取代苯的亲电取代反应——定位效应
大量实验证明,一取代苯发生亲电取代反应时, 苯环上原有取代基的性质对发生亲电取代反应的速度 和亲电试剂(第二个取代基)进入苯环位置都有影响。 也影响反应的难易程度。
这种原有取代基对新引入取代基进入苯环位置的 决定作用称为取代基的定位效应。
(1) 含有未共用电子对的原子与芳环成键,形成大键 ; (2) 含有电子的基团,例如: C C C6H5(3) 可通过诱导效应或超共轭效应产生给电子效应的烷基等。
2. 第二类定位基——间位定位基
使新引入的取代基主要进入原基团间位(间位产物大于 50%),且钝化苯环,使取代反应比苯难进行。此类定位基 为吸电子基,钝化基。
XY
有 些 容 易 混 淆 的 基 团 , 譬 如 —COOCH3 和 — OCOCH3 、 —CONHCH3 和 —NHCOCH3 , 按 此 方 法 均 可以正确判断:
—COOCH3 和 —CONHCH3 为 吸 电 子 基 , 而 — OCOCH3和—NHCOCH3为给电子基。
对于—CH2Cl、—CH2OH、—CH2OCH3、—CH2CN 则属例外,它们仍是给电子基。这些基团可以看成—CH3 上的1个H被取代,但其余C—H还可以通过σ-p超共轭作用 发挥给电子作用。
:OCH3
C 第三类定位基(卤素)定位效应的解释
第三类定位基卤素的电负性X > C, 具有 -I 效应;但X 的电子对与苯形成 p-π 共轭,具有 + C 效应。由于卤素 的+C < -I,因而苯环上的电荷密度总体降低,反应速度 减慢,但+C效应使邻、对位电荷密度较大,因而为邻对
酰基化反应介绍

一、酰基化反应介绍 二、酰基化试剂
第一节 概述
一、酰基化反应介绍
1. 研究意义: (1) 在羟基或氨基等官能团上引入酰基后可改变原化合物性质和功能。如 染料的染色性能和牢度指标有所改变,药物分子中引入酰基可改变药性; (2)可用来保护氨基,反应完成后再将酰基水解去掉。
如:在苯胺上引入硝基时,我们一般用苯胺与混酸发生亲电取代反应即 可。但苯胺非常易被氧化,甚至空气中的氧气就能将无色透明的苯胺液体在 几个小时内氧化成黑色的苯醌染料,混酸更是一种强氧化剂,所以必须先将 氨基保护起来才能用混酸硝化。 O
O O H C OH H3C O C OH 苯 甲 酰基 C OH
甲 酰基
乙 酰基
或羧酸 C 酰基化反应,C原子上的H被酰基取代生成醛、酮 3. 分类: N原子上的H被酰基取代生成酰胺 N 酰基化反应,氨基 O 酰基化反应,O原子上的H被酰基取代生成酯,又 称为酯化反应
★二、酰基化试剂
★ 二、N-酰化方法
2. 用酸酐的N-酰化
NO 2 NCH 3
O
O O C CH 3
H 2SO4
NO 2
O
N C CH 3+ NhomakorabeaH 3C
C
CH 3
+ CH 3COOH
H
反应不可逆。最常用的酸酐是乙酸酐,它的酰化活性较高,在20℃~ 90℃时反应即能顺利完成。 对于二元胺类,如果希望只酰化其中的一个氨基时,可以先用等物质 的量比的盐酸,使二元胺中的一个氨基成为盐酸盐,加以保护,然后再 按一般的方法进行酰化。
NH 2
NH 2
H-Cl
NH 2
NHCOCH 3
(CH 3CO) 2O - CH 3COOH
第八章 酰化反应

COCH 2CH 2CH 3
Z
加 Cl, g, H n-H
2N
热
CH 2CH 2CH 2CH 3
H
NH
2,H
O,加
热
CH 2CH 2CH 2CH 3
影响反应的主要因素:
• 被酰化物的结构
芳环上有供电子基时反应易于进行,芳环上
2
RCONHR' + H2O
①可逆反应,除水;②主要 羧酸腐蚀性强,宜用铝 制或玻璃反应器 用甲酸、冰乙酸,且需过量; ③强酸催化 ①常用乙酐,过量5~10 %;②加入三级胺缚酸剂; ③反应温度20~90℃, 不加催化剂 对于活性较弱(如有较 多吸电子基或空阻大) 的芳胺,有时加少量强 酸作催化剂
酸酐
•为了加速N-酰化反应,有时需加入少量强 酸做催化剂。
OH
RCOOH + H
R—C
OH
O
— —
R—C
OH
+ N—R'
H
R—C—N—R' OH H
— —
OH
H
OH H
R—C—NHR + H3O
•举例
NHCOCH 3
NHCOCH 3 OCH 3
解热镇痛药
染料、医药中间体
OC 2H5
OH + 3ArNH2 + PCl3 COOH
o
NH—CO—
+
+ HCl
OC 2H5
OC 2H5
COCl + NH 2CH 2COOH
水,NaOH
CONHCH 2COOH + HCl
08 第八章 酰基化

进行酰化反应。因此,硝基苯可作为酰化反应的溶剂。 当芳环上引入一个酰基后,由于酰基属吸电子基,芳环上很难再引入第二个酰基。
+
C H3 C O Cl A l C l3
C O C H3
C H3 C O Cl A l C l3
不继续反应
C H3 Cl A l C l3 快
H3 C C H3
与C -烷基化反应进行对比:
O
C
O : A l C l3
5 5 ~6 0 ℃
O
C
+
+ 2 A lC l 3
C + C O O A l C l2 HCl
苯 溶剂
O
O : A l C l3 C C O O A l C l2 + 3 H 2S O 4
水介质
O C C O OH + A l2(S O 4)3 + 5H Cl
3. 用其它酰化剂的C-酰化
(2)精制 将粗品加热水使其溶解,加入活性炭(脱色),加热至沸腾,过滤,滤液 放入预先盛有适量的亚硫酸氢钠的结晶釜内,冷却结晶(必要时重结晶一次)。 离心过滤,甩干,100℃以下干燥,过筛,得成品。总收率77.7~84.0%(以对 氨基酚计)。
第三节 C-酰化
复习:付氏烷基化反应 C-酰化指的是碳原子上的氢被酰基所取代的反应。 在芳环上引入酰基得到芳酮或芳醛的反应又称为傅列德尔(Friedel)- 克拉夫茨(Crafts)酰化反应,主要用于制备芳酮、芳醛以及羟基芳酸。 一、C-酰化反应原理 二、C-酰化方法 三、生产实例
生成的2,4-二羟基苯乙酮是制备医药的中间体。
三、生产实例
医药和染料中间体α-萘乙酮的合成: 萘与乙酐在AlCl3存在下进行C-酰化反应得到α-萘乙酮。
酰基化

CH3
NO2
芳香族酰化剂的活性低 于脂肪族酰氯,一般不易水 解,因而可以在弱碱性介质 (用碳酸钠或氢氧化钠)中 直接滴加酰化剂进行反应 。
NH2
+
SO2Cl
水,Na2CO3 97℃
O2 HN S
+
HCl
CH3
CH3
(4)用三聚氰酰氯N-酰化
Cl N Cl N N Cl
别名:2,4,6-三氯-1,3,5-三嗪; 氰脲酰氯
NH2
酰化产物
H N O C HO
名称
色酚AS
NH2 CH3
OH COOH
2-羟基萘-3-甲酸(简称2,3-酸)
O H N C CH3 HO O C HO
色酚AS-D
H2 N
OCH3
H N
PCl3
NH2
H3CO
色酚AS-RL
O HN C HO
色酚AS-BO
(3)用芳磺酰氯N-酰化
SO2Cl SO2Cl SO2Cl
OH + CHCl3 10% Байду номын сангаасaOH OH CHO + CHO OH
常用的碱溶液是氢氧化钠、碳酸钾、碳酸钠水溶液,产 物一般以邻位为主,少量为对位产物。如果两个邻位都被占 据则进入对位。不能在水中起反应的化合物可在吡啶中进 行,此时只得邻位产物。
3.N-酰基化
3.1 定义
N-酰化反应是胺类化合物与酰化剂反应,在氨基的氮原 子上引入酰基而成为酰胺衍生物,是有机合成中一种常用的 方法。
O CH3C 酸酐: O CH3C O
O C O C O
CO2(碳酸酐) CO(甲酸酐)
O
酰氯: CH3CCl
第八章 醛和酮(一)醛和酮的命名(二)醛和酮的结构(三)醛和

N
六亚甲基四胺(乌咯托品)
(己)与Wittig试剂加成
Ph3P + CH3CH2Br C6H6
PhLi
Ph3PCH2CH3 Br
Ph3P=CHCH3 + C6H6+LiBr
Ph3P CHCH3
O CH3 C CH3 + Ph3P=CHCH3
O PPh3 CH3 C CHCH3
CH3
O PPh3 CH3 C CHCH3 0oC CH3 C CHCH3 + Ph3P O
C
O
92%
(4)羧酸衍生物的还原
COCl
LiAl(OBu-t)3H OCH3 乙醚,-78 oC
CH3
H+/H2O
CHO
OCH3 CH3
60%
CH3(CH2)10
COOC2H5
Al(Bu-n)2H 己烷,-78 oC
H+/H2O CH3(CH2)10 CHO 88%
(5)芳烃的氧化
V2O5 CH3 + O2(air) 350-360oC
CH CCOOH CH3
(丙)Mannich反应
O CCH3 HCHO
HN(CH3)2 HCl
O CCH2CH2N(CH3)2
H3C
CO +HCl AlCl3_ CuCl, 20oC
H3C
CHO
(四)醛和酮的物理性质
沸点:介于烃、醚与醇、酚之间。
CH3CH2CH2CH3 CH3OCH2CH3 CH3CH2CHO CH3COCH3 CH3CH2CH2OH
沸点/ oC -0.5
8
49
56
97
CH2CH3
CHO
第八章 酰化反应

具有抗凝血性, 这些材料可作为生物医用材料广泛用 于生物医学工程领域。
8.2 N-酰化
N-酰化的目的 N-酰化反应历程 用不同酰化试剂的N-酰化反应
8.2 N-酰化
8.2.1 N-酰化的目的
永久性酰化(赋予染料或有机物新的性能)
Cl
SO3H N=N
SO3Na
活性艳红
荧光增白剂
三聚氰胺:2 ,4 ,6- 三氨基-1,3,5-三嗪 面粉增白剂:BPO(过氧化二苯甲酰)
8.2 N-酰化
双乙烯酮(合成乙酰乙酰芳胺的最好方法)
(1)酰化活性高;
CO
(2)酰化剂成本低廉;
O
(3)酰化收率高(95%),
产品质量好;
(4)双乙烯酮生产工艺复杂,
习题:
1.甲苯乙酰化,下列酰化试剂中()酰化能力最强。 A.乙酸乙酯 B 乙酸酐 C 乙酰氯 D 冰醋酸 2.金属氯化物是酰化的催化剂,催化作用最强的是() A FeCl3 B AlCl3 C CuCl2 D ZnCl2 3.间苯二酚以无水ZnCl2为催化剂,宜选用酰化剂()进
行酰化。 A 所酸酯 B 羧酸酐 C 酰氯 D 羧酸
酰化剂结构:酰卤(不同酰卤);酸酐;羧酸; 催化剂:Lewis、质子酸(活性顺序); 溶剂:如硝基苯等。
8.3 C-酰化
8.3.2 用酰氯的C-酰化
COCl
OC
Hale Waihona Puke +2AlCl3OCH3
+
H3CO
CO
AlCl3
COCl H3CO
OCH3 O
H2SO4 水解
OH O
第八章-酰化反应

CH3 NCO + 4HCl
NCO
§8.2 N-酰化 § 8.2.6 酰基水解
碱催化下的反应机理:
材料学院·应用化学
O
OH-
R NHR'
O R NHR'
OH
O + R'NH
R OH
酸催化下的反应机理:
O R O + R'NH2
O + H+
R NHR'
OH H2O
R NHR'
OH
质子转移
§8.3 C-酰化 § 8.3.2 Friedel-Crafts反应影响因素 (1)被酰化物结构
材料学院·应用化学
芳胺类化合物进行C-酰化反应时,必须先将氨 基保护起来。
NH2 + (CH3CO)2O
NHCOCH3 + (CH3CO)2O
AlCl3
NHCOCH3 H+
heat
COCH3
NH2 COCH3
HNO3 H2SO4
NHCOCH3 H+
heat
NO2
NH2 NO2
§8.2 N-酰化 § 8.2.2 N-酰化反应机理
(1)反应机理:加成消除反应
材料学院·应用化学
O RNH2 + R' Z
O R' Z NH2R
O R' NHR + HZ
Z = X, OH, RCOO-, RO-
§8.2 N-酰化 § 8.2.2 N-酰化反应机理 (2)被酰化物活性
§ 8.3.3 芳烃的甲酰基化
(2)氯仿甲酰基化(Reimer-Tiemann反应)
酚类与氯仿在强碱条件下加热,生成芳香族羟 基醛的反应称为Reimer-Tiemann反应。
第八章 胺和酰胺

(三) 化学性质
1.碱性 碱性 胺分子中氮原子上的孤对电子对,能接受质子 因此胺呈碱性 碱性. 胺分子中氮原子上的孤对电子对,能接受质子, 因此胺呈碱性 孤对电子对
宁德职业技术学院
胺的碱性强弱取决于氮原子上末共用电子对和质子结 胺的碱性强弱取决于氮原子上末共用电子对和质子结 合的难易, 而氮原子接受质子的能力, 既与氮原子上电子云 合的难易 而氮原子接受质子的能力 既与氮原子上电子云 密度大小, 又与氮原子上所连基团的空间阻碍有关. 空间阻碍有关 密度大小 又与氮原子上所连基团的空间阻碍有关 脂肪族 胺的氨基氮原子上所连接的基团是脂肪族烃基. 胺的氨基氮原子上所连接的基团是脂肪族烃基 从供电子 诱导效应看, 氮原子上烃基数目增多, 诱导效应看 氮原子上烃基数目增多 则氮原子上电子云 密度增大, 碱性增强. 因此脂肪族仲胺碱性比伯胺强, 密度增大 碱性增强 因此脂肪族仲胺碱性比伯胺强 它 们碱性都比氨强, 从烃基的空间效应看, 烃基数目增多, 们碱性都比氨强 但从烃基的空间效应看 烃基数目增多 空间阻碍也相应增大, 空间阻碍也相应增大 三甲胺中三个甲基的空间效应比供 电子作用更显著, 所以三甲胺的碱性比甲胺还要弱. 电子作用更显著 所以三甲胺的碱性比甲胺还要弱 (但在 气相中三甲胺的碱性最强 三甲胺的碱性最强). 气相中三甲胺的碱性最强).
苯胺氮原子的孤对电子对所占杂化 苯胺氮原子的孤对电子对所占杂化 氮原子 轨道的P成分比氨多. 因此, 成分比氨多 轨道的 成分比氨多 因此 苯胺氮原子 孤对电子对所占的轨道与苯环上的 的孤对电子对所占的轨道与苯环上的 P 轨道虽不完全平行 但仍可与苯环的π 虽不完全平行, 轨道虽不完全平行,但仍可与苯环的 轨道形成一定程度的共轭 形成一定程度的共轭. 轨道形成一定程度的共轭 H-N-H平面 平面 与苯环平面的夹角为39.4° 与苯环平面的夹角为 °
第八章酰化反应

OC2H5 NH CO + HCl
OC2H5
OC2H5
NH2 + CH3
SO2Cl
水,Na2CO3 97℃
HN
O2 S + HCl
CH3
染料中间体
3. 光气(碳酰氯)
(1)酰化活性很高; (2)有剧毒。
O RNH2 + Cl-C-Cl
O O R-NH-C-Cl R'OH R-NH-C-OR'
氨基甲酰氯 氨基甲酸酯
加热
催化机理同样是生成反应活性高的酰基正碳离子
伯胺用酸酐酰化时,在一定条件下有可能 生成二酰化物。
R'NH2 R'NHCOR R'N(COR)2
但第二个酰基非常活泼,容易水解消除。
对于二元胺,如果希望只酰化一个氨基时, 可以先用等摩尔比的盐酸生成盐酸盐来保护, 然后酰化,再中和。
NH2
HCl
NHCOCH2COCH3
NHCOCH2COCH3 Cl
NHCOCH2COCH3 OCH3
8.1.6 N-酰化反应终点的控制
利用芳胺的特性(能发生重氮化,而酰化物 不能)在滤纸上做渗圈试验,来定性检测; 用标准亚硝酸钠溶液滴定未反应的芳胺来定 量检测。
8.2 C-酰化
C-酰化反应主要用于制备芳酮,芳醛和芳 羧酸。
O R C + HZ + H2O
O R C
H + N H R'
O R C NHR'
注意问题
A,质子可与-NH2结合成铵盐,从而阻碍 -NH2与酰化试剂的反应,因此必须适当 控制反应介质的酸碱度 B,为防止羧酸的腐蚀,应选用铅质或搪 瓷反应釜 。
酰基化

★二、酰基化试剂
常用的酰化剂是酰氯、酸酐和羧酸。 如乙酰氯、乙酸酐、顺 丁烯二酸酐、甲酸、乙酸、草酸等。
其活性排列次序为:酰氯>酸酐>羧酸。
第二节 N-酰化反应
N-酰化是制备酰胺的重要方法。 一、N-酰化反应基本原理
用酰氯的N 酰化 用酸酐的N 酰化 二、N-酰化方法 用羧酸的N 酰化 用其它酰化剂的 N 酰化 酰基的水解
NH 2
NH 2
H-Cl
NH 2
NHCOCH 3
(CH 3CO) 2O - CH 3COOH
NH 2 · H-Cl
NH 2 · H-Cl
★ 二、N-酰化方法
3.用羧酸的N-酰化
O
O
N H H
+
H 3C
C
OH
N H
C
CH 3
+
H-OH
由于羧酸的活性较弱,反应属于可逆反应。 为了使可逆反应尽量向正反应方向进行,加快N-酰化反应的速度, 通常采用两种方法。一是加入少量强酸作催化剂,或者用脱水剂移去反 应生成的水;二是加入过量的羧酸,当反应达到平衡以后逐渐蒸出过量 的乙酸,并将水分带出。
★ 二、N-酰化方法
1. 用酰氯的N-酰化
(1)举例:
OC 2H 5 NH 2 COCl
OC 2H 5
+
缚酸 剂 NaOH
NHCO
+
NaCl
+放热且剧烈的,所 以通常是在冷却的条件下进行。
(2)加入缚酸剂的原因及作用:
由于酰化时生成的氯化氢与游离氨结合成盐,降低了N-酰化反应的速度, 因此在反应过程中一般要加入缚酸剂来中和生成的氯化氢,使介质保持中 性或弱碱性,并使胺保持游离状态,以提高酰化反应速度和酰化产物的收 率。 常用的缚酸剂有:氢氧化钠、碳酸钠、碳酸氢钠、醋酸钠及三乙胺等有机 叔胺。
第八章 次生代谢产物的生物合成
四、甲羟戊酸及其衍生物
五、环多醇和氨基环多醇
肌醇
肌醇
以鲨烯为母体共价结合肌醇而成的直链三萜衍生物。
ห้องสมุดไป่ตู้
六、碱基及其衍生物
第三节 次生代谢产物的生物合成过程
一、构成单位的合成 二、构成单位的连接 三、产物合成后修饰
一、构成单位的合成
次生代谢产物的合成是首先合成各个构建单位。
二、构成单位的连接
构成单位合成后,在一些合成酶、连接酶、脱水酶、转氨酶等 酶作用下,各个构成单位相互连接,形成次级代谢产物的基本框架。
三、初生代谢产物与次级代谢产物的关系
1. 初级代谢产物是次级代谢产物的前体。
青霉素合成的起始产物是:α-氨基已二酸、L-半 胱氨酸、 L-缬氨酸 阿维菌素合成的起始产物:异亮氨酸、缬氨酸 多肽类抗生素:多种氨基酸首尾连接而成
2. 初级代谢产物的调控影响次级代谢产物的生物 合成。
分叉中间体:微生物代谢过程中的一些中间产物既可 以用来合成初级代谢产物,也可以被用来合成次级代 谢产物。
三、产物合成后修饰
次生代谢产物由几个部分合成之后,往往不具有生物活性, 还需经过修饰过程才能产生具有生物活性的代谢产物,后修饰过 程包括氨基化、甲基化、酰基化、羟基化等。
思考题
1. 名称解释:
初生代谢产物、次生代谢产物、分叉中间体
2. 次生代谢产物有哪些特点?
3. 次生代谢产物的生物合成主要过程是什么?
氨基酸的分族
柠檬酸循环
α-酮戊二酸
谷氨酸
谷氨酰胺 脯氨酸 精氨酸
草酰乙酸
天冬氨酸
天冬酰胺 甲硫氨酸 赖氨酸 苏氨酸
(谷氨酸族)
(天冬氨酸族)
糖酵解 丙酮酸
酰基化反应

(1)卤化
——苯胺与氯和溴的卤化反应,不要催化剂可直接生成三卤苯胺
其中,2,4,6-三溴苯胺的碱性很弱,在水中不能与氢溴酸成盐。反
应定量,可用于苯胺的定性和定量分析(与苯酚的反应比较)
NH2 + Br 2 H2O Br
Br
NH2 Br
(白色)
+
HBr
——欲制备一溴化物,可先将氨基酰化,降低反应活性后,再卤
生在β位
由于五元杂环化合物亲电取代反应活性大,所以硝化和
磺化时需要比较温和的条件,如低温、无催化剂或使用弱亲电试
剂等。而吡啶环亲电取代反应活性小,硝化和磺化必须在高温下
才能进行。例如下页第2式为硝基而非氯:
2019/11/21
18
O
+ Cl 2 - 40℃
O Cl + HCl
O + CH 3COONO 2 - 5℃~ - 30℃ O Cl + CH 3COOH
3. 酰基化反应 概况
——伯、仲胺与酰氯、酸酐或羧酸等酰基化试剂反应,氨基的氢原 子可被酰基取代,生成N―取代酰胺或N,N-二取代酰胺。叔胺不 能进行酰基化反应
CH3CH2CH2NH2 + CH 3COCl NH2 + (CH 3CO) 2O
CH3CONHCH 2CH2CH3 + HCl O
NHCCH 3
HgSO4 200℃ ~300℃
SO3H + H 2O
N
N
2019/11/21
19
呋喃环的反应活性最大,可以表现出共轭二烯的性质而发生
狄尔斯—阿尔德反应
CO
O+
O
CO
CO O
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
三、生产实例
一、C-酰化反应原理
★ 1.C-酰化反应历程
首先酰氯与无水三氯化铝作用生成各种正碳离子活性中间体(a)、( b)和(c)。
反应历程属亲电取代反应。
一、C-酰化反应原理
★ 2.反应特点: (1) 1mol酰氯理论上需消耗1mol三氯化铝,但催化剂的实际用量还需过
常用的缚酸剂有:氢氧化钠、碳酸钠、碳酸氢钠、醋酸钠及三乙胺等有机 叔胺。
★ 二、N-酰化方法
2. 用酸酐的N-酰化
反应不可逆。最常用的酸酐是乙酸酐,它的酰化活性较高,在20℃~ 90℃ 时反应即能顺利完成。 对于二元胺类,如果希望只酰化其中的一个氨基时,可以先用等物质的 量比的盐酸,使二元胺中的一个氨基成为盐酸盐,加以保护,然后再按一 般的方法进行酰化。
若使用对氨基甲苯直接发生氧化反应则得到醌类产物。
三、应用实例
对乙酰氨基酚(扑热息痛)的合成 1.:反应原理:
2. 生产工艺过程: (1)酰化 在酰化釜中先加入稀乙酸,加热至沸腾,再加入对氨基酚,边回流边蒸
馏,保持120~126℃反应4~5h;再加入冰乙酸,继续回流蒸出水,在130~ 140℃下反应5~6h。然后减压蒸出水,待反应液温度达145~152℃时,放料 至80~90℃热水或精制母液中,析出粗品。离心过滤,用水洗涤得粗品结晶 。
催化剂:三氯化铝(Aluminum Trichloride)
纯品是白色粉末或颗粒,工业品含游离氯和铁为淡黄色, 易溶于水、醇、氯仿、四氯化碳,微溶于苯,有强烈吸水 性,与水接触剧烈分解,有时能引起爆炸。
一、C-酰化反应原理
★ 3.C-酰化的影响因素
(1)被酰化物的结构: 芳环上有给电子基取代基时,酰化反应容易进行;芳环上有吸电子基时,反应就很 难进行。因为酰化反应属于亲电取代反应。当芳环上有硝基或磺基取代后,就不能再 进行酰化反应。因此,硝基苯可作为酰化反应的溶剂。 当芳环上引入一个酰基后,由于酰基属吸电子基,芳环上很难再引入第二个酰基。
第八章 酰基化
2020年4月22日星期三
第一节 概述
一、酰基化反应介绍 二、酰基化试剂
一、酰基化反应介绍
酰基 —— 含氧酸中除去羟基后所剩余的部分(RCO-),如 :
一、酰基化反应介绍
1. 研究意义:
(1) 在羟基或氨基等官能团上引入酰基后可改变原化合物性质和功能。如 染料的染色性能和牢度指标有所改变,药物分子中引入酰基可改变药性;
(2)可用来保护氨基,反应完成后再将酰基水解去掉。
如:在苯胺上引入硝基时,我们一般用苯胺与混酸发生亲电取代反应即可 。但苯胺非常易被氧化,甚至空气中的氧气就能将无色透明的苯胺液体在几 个小时内氧化成黑色的苯醌染料,混酸更是一种强氧化剂,所以必须先将氨 基保护起来才能用混酸硝化。
若不保护氨基,则 :
(2)精制 将粗品加热水使其溶解,加入活性炭(脱色),加热至沸腾,过滤,滤液
放入预先盛有适量的亚硫酸氢钠的结晶釜内,冷却结晶(必要时重结晶一次) 。离心过滤,甩干,100℃以下干燥,过筛得成品。总收率77.7~84.0%(以 对氨基酚计)。
第三节 C-酰化
复习:付氏烷基化反应
C-酰化指的是碳原子上的氢被酰基所取代的反应。 在芳环上引入酰基得到芳酮或芳醛的反应又称为傅列德尔(Friedel)- 克拉夫茨(Crafts)酰化反应,主要用于制备芳酮、芳醛以及羟基芳酸。
氨基氮原子上电子云密度越高,碱性越强,则胺被酰化的反应性越强。 胺类被酰化的反应活性是:伯胺>仲胺,脂肪胺>芳胺
对于芳。胺,环上有供电子基时,碱性增强,芳胺的反应活性增强。反之,环 上有吸电子基时,碱性减弱,反应活性降低。
(3)空间位阻效应 :
无空间阻碍的胺的活性高于有空间阻碍的胺。
★ 二、N-酰化方法
4. 用其它酰化剂的N-酰化
如甲苯二异氰酸酯(TDI)的合成,它是粘合剂及塑料的重要原料 。
★ 二、N-酰化方法
5. 酰基的水解 酰胺基可以在酸或碱催化下水解生成相应的羧酸和胺。这是将氨基酰化成
为酰胺是保护氨基的最为便利的方法。 如:
酰基水解在有机合成中的应用 : 例:由对胺基甲苯合成对氨基苯甲酸 :
1. 用酰氯的N-酰化
(1)举例:
反应不可逆。酰氯是一强酰化剂,与胺类的酰化反应是放热且剧烈的,所 以通常是在冷却的条件下进行。 (2)加入缚酸剂的原因及作用:
由于酰化时生成的氯化氢与游离氨结合成盐,降低了N-酰化反应的速度
,因此在反应过程中一般要加入缚酸剂来中和生成的氯化氢,使介质保持 中性或弱碱性,并使胺保持游离状态,以提高酰化反应速度和酰化产物的 收率。
量10% ~50%。
(2) 用酸酐作为酰化剂时,酸酐中的一个酰基首先与三氯化铝作用,转 化成酰氯然后酰氯再接上述历程完成酰化反应:
所以用酸酐作为酰化剂时三氯化铝的实际用量为:酸酐与三氯化铝的摩
尔比1:2,再过量10% ~50%。
如1mol甲苯与1mol醋酐反应时需要2molAlCl3:
一、C-酰化反应原理
黑色染料——苯醌
一、酰基化反应介绍
2. 定义 : 酰基化反应指的是有机化合物分子中与碳原子、氮原子、氧原子或硫原子
相连的氢被酰基所取代的反应。
3. 分类
:
★二、酰基化试剂
常用的酰化剂是酰氯、酸酐和羧酸。 如乙酰氯、乙酸酐、顺 丁烯二酸酐、甲酸、乙酸、草酸等。
其活性排列次序为:酰氯>酸酐>羧酸。
第二节 N-酰化反应
★ 二、N-酰化方法
3.用羧酸的N-酰化
由于羧酸的活性较弱,反应属于可逆反应 。
为了使可逆反应尽量向正反应方向进行,加快N-酰化反应的速度,
通常采用两种方法。一是加入少量强酸作催化剂,或者用脱水剂移去反 应生成的水;二是加入过量的羧酸,当反应达到平衡以后逐渐蒸出过量 的乙酸,并将水分带出。
二、N-酰化方法
N-酰化是制备酰胺的重要方法 。一、N-酰化反应基本原理
二、N-酰化方法
三、应用实例 对乙酰氨基酚(扑热息痛)的合成 :
★ 一、N-酰化反应基本原理
1. N-酰化反应历程:
属于亲电取代反应
产物可用作表面活性剂
2. N-酰化影响因素:
(1)酰化剂的活性的影响 反应活性如下: 酰氯>酸酐>羧酸 : (2)胺类结构的影响 :
