有机物的十种分离提纯方法
有机物分离和提纯的常用方法
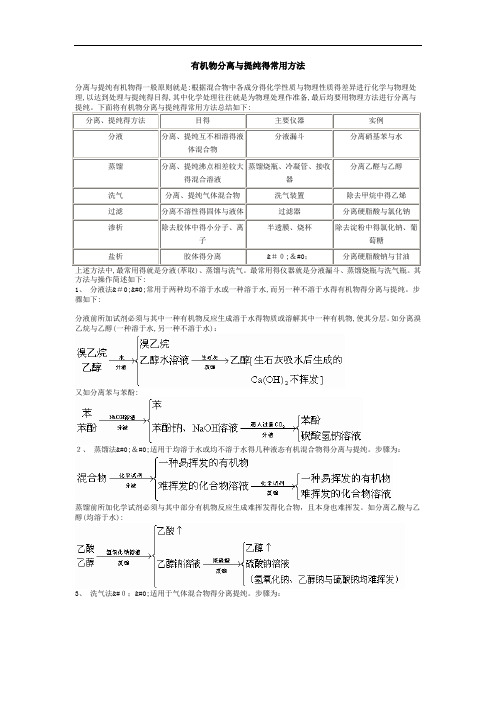
有机物分离与提纯得常用方法分离与提纯有机物得一般原则就是:根据混合物中各成分得化学性质与物理性质得差异进行化学与物理处理,以达到处理与提纯得目得,其中化学处理往往就是为物理处理作准备,最后均要用物理方法进行分离与分离、提纯得方法目得主要仪器实例分液分离、提纯互不相溶得液体混合物分液漏斗分离硝基苯与水蒸馏分离、提纯沸点相差较大得混合溶液蒸馏烧瓶、冷凝管、接收器分离乙醛与乙醇洗气分离、提纯气体混合物洗气装置除去甲烷中得乙烯过滤分离不溶性得固体与液体过滤器分离硬脂酸与氯化钠渗析除去胶体中得小分子、离子半透膜、烧杯除去淀粉中得氯化钠、葡萄糖盐析胶体得分离��分离硬脂酸钠与甘油方法与操作简述如下:1、分液法��常用于两种均不溶于水或一种溶于水,而另一种不溶于水得有机物得分离与提纯。
步骤如下:分液前所加试剂必须与其中一种有机物反应生成溶于水得物质或溶解其中一种有机物,使其分层。
如分离溴乙烷与乙醇(一种溶于水,另一种不溶于水):又如分离苯与苯酚:2、蒸馏法��适用于均溶于水或均不溶于水得几种液态有机混合物得分离与提纯。
步骤为:蒸馏前所加化学试剂必须与其中部分有机物反应生成难挥发得化合物,且本身也难挥发。
如分离乙酸与乙醇(均溶于水):3、洗气法��适用于气体混合物得分离提纯。
步骤为:例如:此外,蛋白质得提纯与分离,用渗析法;肥皂与甘油得分离,用盐析法。
有机物分离与提纯得常用方法1,洗气 2,萃取分液溴苯(Br2),硝基苯(NO2),苯(苯酚),乙酸乙酯(乙酸) 3, a,制无水酒精:加新制生石灰蒸馏 b,酒精(羧酸)加新制生石灰(或NaOH固体)蒸馏 c,乙醚中混有乙醇:加Na,蒸馏 d,液态烃:分馏 4,渗析a,蛋白质中含有Na2SO4 b,淀粉中KI 5,升华奈(NaCl)鉴别有机物得常用试剂所谓鉴别,就就是根据给定得两种或两种以上得被检物质得性质,用物理方法或化学方法,通过必要得化学实验,根据产生得不同现象,把它们一一区别开来、有机物得鉴别主要就是利用官能团得特征反应进行鉴别、鉴别有机物常用得试剂及特征反应有以下几种:1ﻫ、水ﻫ适用于不溶于水,且密度不同得有机物得鉴别、例如:苯与硝基苯、ﻫ2、溴水ﻫ(1)与分子结构中含有C=C键或键得有机物发生加成反应而褪色、例如:烯烃,炔烃与二烯烃等、(2)与含有醛基得物质发生氧化还原反应而褪色、例如:醛类,甲酸、ﻫ(3)与苯酚发生取代反应而褪色,且生成白色沉淀、ﻫ3、酸性溶液(1)与分子结构中含有C=C键或键得不饱与有机物发生氧化还原反应而褪色、例如:烯烃,炔烃与二烯烃等、ﻫ(2)苯得同系物得侧链被氧化而褪色、例如:甲苯,二甲苯等、(3)与含有羟基,醛基得物质发生氧化还原反应而使褪色、例如:醇类,醛类,单糖等、4、银氨溶液(托伦试剂)ﻫ与含有醛基得物质水浴加热发生银镜反应、例如:醛类,甲酸,甲酸酯与葡萄糖等、5、新制悬浊液(费林试剂)(1)与较强酸性得有机酸反应,混合液澄清、例如:甲酸,乙酸等、ﻫ(2)与多元醇生成绛蓝色溶液、如丙三醇、ﻫ(3)与含有醛基得物质混合加热,产生砖红色沉淀、例如:醛类,甲酸,甲酸酯与葡萄糖等、ﻫ6、金属钠与含有羟基得物质发生置换反应产生无色气体、例如:醇类,酸类等、ﻫ7、溶液与苯酚反应生成紫色溶液、8、碘水遇到淀粉生成蓝色溶液、ﻫ9、溶液ﻫ与酸性较强得羧酸反应产生气体、如:乙酸与苯甲酸等、10、浓硝酸ﻫ与含有苯环得蛋白质反应生成黄色沉淀、ﻫ在鉴别得过程中对实验得要求就是:(1)操作简便;(2)现象明显;(3)反应速度快;(4)灵敏度高、一、相似相溶原理1.极性溶剂(如水)易溶解极性物质(离子晶体、分子晶体中得极性物质如强酸等);2.非极性溶剂(如苯、汽油、四氯化碳、酒精等)能溶解非极性物质(大多数有机物、Br2、I2等); 3.含有相同官能团得物质互溶,如水中含羟基(—OH)能溶解含有羟基得醇、酚、羧酸二、有机物得溶解性与官能团得溶解性1.官能团得溶解性:(1)易溶于水得官能团(即亲水基团)有—OH、—CHO、—COOH、—NH2。
有机物的十种分离提纯方法

有机物的十种分离提纯方法
有机物的分离提纯是化学实验中非常重要的一个步骤,可以通过一系列方法将混合物中的目标有机物从杂质中分离出来,得到纯净的有机化合物。
下面列举了十种常用的有机物分离提纯方法。
1.晶体分离:适用于存在结晶性有机化合物的混合物,在适当溶剂中溶解样品,通过逐渐降低温度或加入杂质抑制结晶来分离出目标物质的晶体。
2.萃取:利用两相系统中的物理化学差异,将目标物质从混合物中提取到另一相中。
常见的有机溶剂萃取包括液液萃取和固相萃取。
3.蒸馏:根据不同有机物的沸点差异,将混合物加热至沸腾,通过冷凝再液化得到不同沸点的有机物分离。
4.色谱法:包括气相色谱和液相色谱。
根据溶解度、分配系数、吸附性质等原理,将混合物中的有机物在固定相或移动相中按照一定顺序分离出来。
5.结晶分离:通过溶解混合物,加入合适溶剂后的缓慢结晶,从溶液中分离出结晶纯净有机物。
6.真空干燥:通过在低压下升高温度,将溶液中的溶剂蒸发,得到纯净有机物。
7.洗涤:用溶剂或其中一化合物在混合物中溶解目标物质,然后将其分离出来。
8.冷冻分离:通过低温处理对有机物具有较低溶解度的杂质,使其相对分离出来。
9.蒸发浓缩:通过加热溶液使其溶剂部分蒸发,获得更浓缩的有机物。
10.过滤分离:使用不同孔径的滤纸、滤膜或滤网,将混合物中的悬
浮物或杂质分离出来。
这些分离提纯方法可以单独使用,也可以根据实验需要进行组合使用,以达到更高的纯度要求。
在实际操作中,需要根据混合物的成分、性质以
及目标有机物的特点选择合适的方法。
污水中的有机物的十种分离提纯方法

污水中的有机物的十种分离提纯方法
1.活性炭吸附法:活性炭对有机物具有很强的吸附能力,可以使用活性炭吸附剂将污水中的有机物吸附下来,从而实现分离提纯。
2.膜分离技术:膜分离技术包括微滤、超滤、逆渗透等方法,通过膜的选择性通透性,可以将污水中的有机物与其他杂质分离开来,从而提高水质。
3.气体吸附技术:利用气体吸附剂对污水中的有机物进行吸附,然后通过更换吸附剂,可以实现有机物的分离和提纯。
4.活性污泥法:活性污泥法是一种将有机物转化为污泥的生物处理方法,通过特定条件下的生物降解反应,将污水中的有机物分解成无机物,从而实现分离和提纯。
5.真菌生物技术:真菌生物技术利用具有降解有机物能力的真菌,将污水中的有机物进行降解分解,从而达到有机物的分离和提纯。
6.搅拌沉淀法:通过加入适宜的沉淀剂和搅拌设备,使污水中的有机物与沉淀剂结合生成沉淀物,从而实现有机物的分离和提纯。
7.气浮法:气浮法通过向污水中注入气体,使有机物沉降速度减慢,从而使得有机物浮升至水面,通过刮板等设备进行分离和提纯。
8.溶剂萃取法:溶剂萃取法是利用有机溶剂与污水中的有机物形成互溶体系,从而实现有机物的分离和提纯。
9.离子交换法:通过在污水中添加合适的离子交换树脂,可以将污水中的有机物与其他离子物质进行交换,从而实现有机物的分离和提纯。
10.光催化氧化法:利用光催化剂催化有机物的氧化反应,将有机物氧化成无害的物质,从而实现有机物的分离和提纯。
这些方法各有优劣,选择合适的分离提纯方法需要根据具体情况和要求来决定,同时也需要考虑经济性和可持续性。
有机物分离和提纯的常用方法(实用)
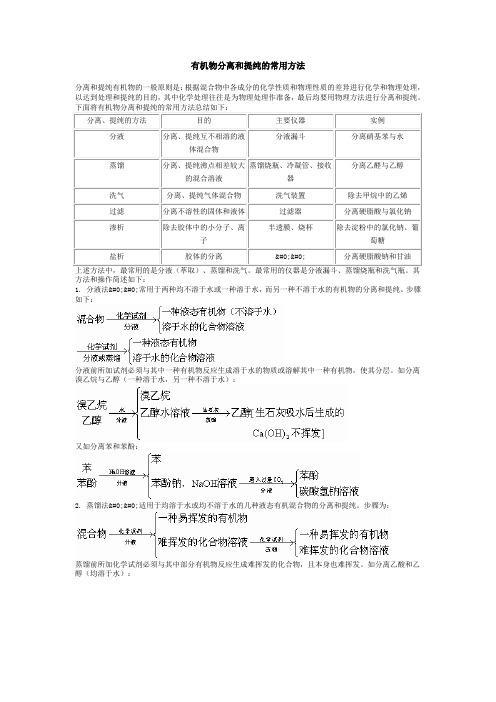
有机物分离和提纯的常用方法分离和提纯有机物的一般原则是:根据混合物中各成分的化学性质和物理性质的差异进行化学和物理处理,以达到处理和提纯的目的,其中化学处理往往是为物理处理作准备,最后均要用物理方法进行分离和提纯。
方法和操作简述如下:1. 分液法��常用于两种均不溶于水或一种溶于水,而另一种不溶于水的有机物的分离和提纯。
步骤如下:分液前所加试剂必须与其中一种有机物反应生成溶于水的物质或溶解其中一种有机物,使其分层。
如分离溴乙烷与乙醇(一种溶于水,另一种不溶于水):又如分离苯和苯酚:2. 蒸馏法��适用于均溶于水或均不溶于水的几种液态有机混合物的分离和提纯。
步骤为:蒸馏前所加化学试剂必须与其中部分有机物反应生成难挥发的化合物,且本身也难挥发。
如分离乙酸和乙醇(均溶于水):3. 洗气法��适用于气体混合物的分离提纯。
步骤为:例如:此外,蛋白质的提纯和分离,用渗析法;肥皂与甘油的分离,用盐析法。
有机物分离和提纯的常用方法 1,洗气 2,萃取分液溴苯(Br2),硝基苯(NO2),苯(苯酚),乙酸乙酯(乙酸) 3, a,制无水酒精:加新制生石灰蒸馏 b,酒精(羧酸)加新制生石灰(或NaOH固体)蒸馏c,乙醚中混有乙醇:加Na,蒸馏 d,液态烃:分馏 4,渗析 a,蛋白质中含有Na2SO4 b,淀粉中KI 5,升华奈(NaCl)鉴别有机物的常用试剂所谓鉴别,就是根据给定的两种或两种以上的被检物质的性质,用物理方法或化学方法,通过必要的化学实验,根据产生的不同现象,把它们一一区别开来.有机物的鉴别主要是利用官能团的特征反应进行鉴别.鉴别有机物常用的试剂及特征反应有以下几种:1. 水适用于不溶于水,且密度不同的有机物的鉴别.例如:苯与硝基苯.2. 溴水(1)与分子结构中含有C=C键或键的有机物发生加成反应而褪色.例如:烯烃,炔烃和二烯烃等.(2)与含有醛基的物质发生氧化还原反应而褪色.例如:醛类,甲酸.(3)与苯酚发生取代反应而褪色,且生成白色沉淀.3. 酸性溶液(1)与分子结构中含有C=C键或键的不饱和有机物发生氧化还原反应而褪色.例如:烯烃,炔烃和二烯烃等.(2)苯的同系物的侧链被氧化而褪色.例如:甲苯,二甲苯等.(3)与含有羟基,醛基的物质发生氧化还原反应而使褪色.例如:醇类,醛类,单糖等.4. 银氨溶液(托伦试剂)与含有醛基的物质水浴加热发生银镜反应.例如:醛类,甲酸,甲酸酯和葡萄糖等.5. 新制悬浊液(费林试剂)(1)与较强酸性的有机酸反应,混合液澄清.例如:甲酸,乙酸等.(2)与多元醇生成绛蓝色溶液.如丙三醇.(3)与含有醛基的物质混合加热,产生砖红色沉淀.例如:醛类,甲酸,甲酸酯和葡萄糖等.6. 金属钠与含有羟基的物质发生置换反应产生无色气体.例如:醇类,酸类等.7. 溶液与苯酚反应生成紫色溶液.8. 碘水遇到淀粉生成蓝色溶液.9. 溶液与酸性较强的羧酸反应产生气体.如:乙酸和苯甲酸等.10. 浓硝酸与含有苯环的蛋白质反应生成黄色沉淀.在鉴别的过程中对实验的要求是:(1)操作简便;(2)现象明显;(3)反应速度快;(4)灵敏度高.一、相似相溶原理1.极性溶剂(如水)易溶解极性物质(离子晶体、分子晶体中的极性物质如强酸等);2.非极性溶剂(如苯、汽油、四氯化碳、酒精等)能溶解非极性物质(大多数有机物、Br2、I2等);3.含有相同官能团的物质互溶,如水中含羟基(—OH)能溶解含有羟基的醇、酚、羧酸二、有机物的溶解性与官能团的溶解性1.官能团的溶解性:(1)易溶于水的官能团(即亲水基团)有—OH、—CHO、—COOH、—NH2。
有机物分离和提纯的常用方法

有机物分离和提纯的常用方法1.蒸馏:蒸馏是一种经典的分离和提纯方法,适用于具有不同沸点的有机物混合物。
通过加热混合物,使其中沸点较低的有机物蒸发为气体,然后在冷凝器中冷凝为液体,从而实现分离。
常用的蒸馏方法包括简单蒸馏、真空蒸馏和分馏等。
2.萃取:萃取是利用不同有机物在不同溶剂中的溶解度不同,从而实现分离和提纯的方法。
常见的萃取方法包括常压萃取和反萃取。
常压萃取是将待分离的混合物与适合的溶剂接触,使其中一个或多个有机物溶解到溶剂中,从而实现分离。
反萃取是从溶剂中将之前溶解的有机物重新提取出来。
3.结晶:结晶是通过控制溶液中溶质在溶剂中的浓度,使溶质逐渐从溶液中析出晶体的过程。
通过结晶可以实现有机物的纯化和提纯。
常见的结晶方法包括普通结晶、溶剂结晶和慢性结晶等。
4.纯化:纯化是指通过对有机物进行一系列的加工和处理,去除其中的杂质,使有机物达到较高纯度的过程。
常用的纯化方法包括重结晶、冻结干燥、溶剂萃取和分离纯化等。
5.凝固:凝固是指通过控制温度使有机物从液态转变为固态的过程。
通过凝固可以实现有机物的分离和提纯。
常见的凝固方法包括冷却和冷冻等。
6.过滤:过滤是将固体颗粒从液体中分离的方法。
常见的过滤方法包括重力过滤、压力过滤和吸滤等。
过滤可以用于分离具有不同粒径和不溶性的固体颗粒。
7.分液:分液是利用具有不同密度的有机物在溶剂中的分层现象进行分离的方法。
常见的分液方法包括漏斗分液和离心分液等。
除了上述常用的分离和提纯方法,还有许多其他的方法,如层析、电离、扩馏和萃取桶等。
这些方法在不同的实验和工业环境中都有广泛的应用。
选择适合的方法取决于具体的有机物性质、分子量、溶解度等因素。
有机物的分离提纯汇总

有机物的分离提纯汇总
下面是有机物的分离提纯方法的汇总:
1. 溶剂萃取法:利用不同的溶剂的相对亲和力不同的特性,将混合物中的有机物分离出来,再用蒸馏、浓缩等方法提纯。
2. 极性萃取法:利用不同的极性物质之间的相互作用,将混合物中的有机物分离出来,再用蒸馏、浓缩等方法提纯。
3. 柱层析法:将混合物通过一个填料柱,根据各种化合物在填料柱中的不同亲和力,让它们逐步分离出来,然后用蒸馏、浓缩等方法提纯。
4. 液液萃取法:在两种不相溶的液体中,利用它们之间的相对亲和力不同的特性,将混合物分离出来,再用蒸馏、浓缩等方法提纯。
5. 蒸馏法:利用不同物质的沸点不同的特性,将混合物中的有机物分离出来。
6. 冷冻法:通过控制温度,将混合物中的有机物冷冻出来,然后用滤纸或离心机提取分离。
7. 结晶法:通过溶解混合物,然后控制温度和溶剂的浓度,将有机物结晶出来,再用滤纸或离心机提取分离。
8. 超声波法:利用超声波的作用,改变溶液的物理和化学性质,以分离提纯有机物。
如何进行常见的有机实验室分离和提纯

如何进行常见的有机实验室分离和提纯实验室中的有机合成通常需要进行分离和提纯步骤,以获得纯净的有机物。
本文将介绍常见的有机实验室分离和提纯方法,并提供相应的操作步骤。
以下为具体内容:一、萃取法萃取法常用于从混合溶液中分离两种不同溶液之间的组分。
其主要原理是利用两相(有机相和水相)不相溶的特性,通过选择合适的溶剂将目标化合物从混合溶液中分离出来。
操作步骤:1. 准备两个分液漏斗,一个用于有机相,一个用于水相。
2. 将待分离的混合溶液倒入一个分液漏斗中。
3. 加入一个适当的溶剂,与混合溶液中的目标化合物有较好的亲和性,在混合溶液中进行摇匀。
4. 等待分离后,打开分液漏斗的滴液管,将有机相和水相分别放入两个干净的容器中。
5. 重复以上步骤,直到目标化合物完全从混合溶液中分离出来。
二、结晶法结晶法是常见的提纯有机化合物的方法。
它基于化合物在溶液中饱和度的变化,通过使溶液过饱和来诱导化合物结晶,从而分离出纯净的晶体。
操作步骤:1. 将待提纯的溶液放在烧杯中,加热搅拌使其溶解。
2. 慢慢加入适量的溶剂,使溶液过饱和,即形成结晶。
3. 静置一段时间,待结晶完全形成后,用过滤器将其分离。
4. 用冷溶剂洗涤结晶体以去除杂质。
5. 将结晶体晾干或在低温下干燥,得到纯净的晶体。
三、蒸馏法蒸馏法常用于分离和提纯液体混合物。
它利用不同组分在不同温度下的沸点差异,通过恰当控制温度和收集冷凝产物来实现分离和提纯。
操作步骤:1. 准备蒸馏仪并装置好冷凝管。
2. 将待分离的液体混合物倒入蒸馏烧瓶中。
3. 加热烧瓶,在适当的温度下进行蒸馏,使其中一个组分沸腾,而另一个组分保持液态。
4. 冷凝管中的冷却水冷却蒸馏产物,使其在冷凝管中液化。
5. 收集冷凝产物,得到目标化合物。
除了上述常见的分离和提纯方法外,还有许多其他的方法,例如纯化层析法、萃取液萃取法等,可以根据实际需要选择合适的方法进行操作。
总结:在实验室进行有机实验时,分离和提纯是获得纯净有机物的关键步骤。
有机合成提纯的方法

有机合成提纯的方法
有机合成提纯的方法有很多,以下是一些常用的方法:
1. 结晶提纯:通过溶剂对反应混合物进行结晶,利用溶剂的溶解度差异,得到纯净的晶体产物。
2. 活性炭吸附:使用活性炭吸附杂质,然后通过过滤或者离心等方法将活性炭与溶液分离,得到纯净的溶液。
3. 蒸馏提纯:利用不同组分的沸点差异,将混合液加热并收集沸点在一定范围内的蒸汽,然后通过冷凝的方法得到纯净的液体。
4. 水蒸汽蒸馏:通过在混合物中通入水蒸汽,利用有机化合物与水蒸汽的亲和性差异,将有机化合物转移到水相,然后再进行后续的分离和提纯。
5. 溅射提纯:将混合物溅射在高温的表面上,通过挥发和冷凝得到纯净的产物。
6. 吸附柱层析:利用吸附柱将混合物按照不同的亲和性分离,然后再用适当的溶剂洗脱产物,得到纯净的化合物。
7. 气相色谱法:利用不同化合物在固定相上的吸附分离特性,通过控制温度和气流,实现有机化合物分离和提纯。
以上只是一些常用的有机合成提纯方法,具体的方法选择会根据化合物的性质和实际需求来决定。
有机物的分离方法

有机物的分离方法
有机物的分离方法有很多种,以下列举几种常用的分离方法:
1. 蒸馏:适用于有机物混合物中的成分具有不同的沸点的情况。
通过加热、蒸发以及冷凝可以将沸点不同的有机物分离出来。
2. 萃取:适用于有机物在不同溶剂中溶解度不同的情况。
通过选择合适的溶剂进行萃取,可以实现有机物的分离。
3. 结晶:适用于有机物在溶液中能够形成晶体的情况。
通过等温冷却或者蒸发溶剂,可以使有机物晶体形成并与其他物质分离。
4. 离心:适用于有机物和溶剂或者悬浊液分离的情况。
通过快速旋转离心机,可以使悬浊液中的固体或液体沉淀,并与溶液分离。
5. 色谱法:包括气相色谱法和液相色谱法。
适用于有机物混合物中的成分具有不同的挥发性或亲水性的情况。
通过萃取柱或者填充柱将有机物分离出来。
6. 薄层色谱法(TLC):适用于有机物混合物中的成分在固定相和移动相的作用下有不同的迁移速率的情况。
通过将混合物在薄层上进行展开,可以实现有机物的分离。
以上是一些常见的有机物分离方法,不同的方法适用于不同的情况。
在实际应用中,还可以根据具体情况选择合适的分离方法。
空气中的有机物的十种分离提纯方法

空气中的有机物的十种分离提纯方法
1. 活性炭吸附法:通过将活性炭与空气中的有机物接触,使有机物被活性炭吸附,进而实现分离提纯。
2. 沸石吸附法:利用沸石材料的微孔结构,在一定温度下吸附空气中的有机物,并通过调节温度进行分离提纯。
3. 干燥剂吸附法:使用适当的干燥剂,如硅胶、分子筛等,将空气中的有机物吸附,然后通过再生干燥剂实现分离提纯。
4. 膜分离法:利用薄膜材料的选择性渗透性质,将空气中的有机物从气相中分离出来,达到提纯的目的。
5. 液液萃取法:通过将特定溶剂与空气中的有机物接触,使有机物在溶剂中分配,然后通过分离得到有机物的纯净溶液。
6. 常温浓缩法:将空气中的有机物通过常温下的蒸发浓缩,使有机物的含量提高,进而实现分离提纯。
7. 凝聚分离法:将空气中的有机物冷却或加热,使有机物凝结成液体或固体状,再通过过滤、离心等方法分离提纯。
8. 超临界流体提取法:利用超临界流体的溶解性和扩散性,将空气中的有机物从气相中提取出来,达到分离提纯的目的。
9. 离子交换法:利用离子交换树脂的吸附和释放特性,将空气中的有机物吸附在树脂上,再通过洗脱得到纯净的有机物。
10. 气相色谱法:通过气相色谱柱的分离作用,将空气中的有机物按照其挥发度进行分离,从而实现提纯。
矿石中的有机物的十种分离提纯方法

矿石中的有机物的十种分离提纯方法
有机物在矿石中的分离提纯是化学研究和工业生产中的关键步骤之一。
下面介绍了十种常用的矿石中有机物分离提纯方法。
1. 溶剂萃取法:使用合适的溶剂将有机物从矿石中提取出来,并通过溶剂的挥发或萃取剂的回收实现分离纯化。
2. 蒸馏法:利用有机物的沸点与其他物质的差异,通过加热使有机物转变为气态,然后冷凝收集,实现分离提纯。
3. 结晶法:通过调节温度和溶剂浓度,使有机物形成晶体,然后通过过滤等步骤分离纯化。
4. 透析法:利用溶液中溶质浓度的差异,通过半透膜使溶质与溶剂分离,实现有机物的分离提纯。
5. 脱水法:利用水的溶解特性,通过适当方法去除矿石中的水分,从而分离有机物。
6. 洗涤法:利用溶剂的选择性溶解性,通过洗涤矿石使有机物与其他物质分离。
7. 离子交换法:利用离子交换树脂的选择吸附性和解吸性,实现有机物的分离提纯。
8. 萃取法:利用二相不同溶解度的选择性,通过分液漏斗等手段将有机物从矿石中分离出来。
9. 电解法:利用电解池中阳极和阴极之间的电解作用,通过电解分解和析出的方式分离提纯有机物。
10. 倾析法:利用固体颗粒之间的相对密度差异,通过溶液在颗粒上的流动和分布,实现有机物的分离。
以上是十种常用的矿石中有机物的分离提纯方法,每种方法在实际应用中都有其适用的场景和条件,需要根据具体情况选择合适的方法。
污水中的有机物的十种分离提纯方法

污水中的有机物的十种分离提纯方法有机物是污水中主要的污染物之一,分离和提纯有机物有助于减少对水体环境的污染。
以下是十种常用的污水中有机物分离提纯方法:1. 沉淀法:利用重力作用使有机物沉淀,通过沉淀与水的分离来提纯。
沉淀法:利用重力作用使有机物沉淀,通过沉淀与水的分离来提纯。
2. 过滤法:将污水通过过滤介质,如滤纸或滤网,将有机物与水分离。
过滤法:将污水通过过滤介质,如滤纸或滤网,将有机物与水分离。
3. 蒸馏法:利用有机物和水的不同沸点,通过蒸发和凝结分离有机物。
蒸馏法:利用有机物和水的不同沸点,通过蒸发和凝结分离有机物。
4. 萃取法:利用有机物在溶剂中的溶解性差异,通过溶剂与水的萃取分离。
萃取法:利用有机物在溶剂中的溶解性差异,通过溶剂与水的萃取分离。
5. 离心法:利用离心力将有机物与水分离,提高分离效率。
离心法:利用离心力将有机物与水分离,提高分离效率。
6. 气相吸附法:利用有机物在吸附剂上的亲和力,通过吸附剂的吸附与再生分离有机物。
气相吸附法:利用有机物在吸附剂上的亲和力,通过吸附剂的吸附与再生分离有机物。
7. 离子交换法:利用离子交换树脂将有机物与离子分离,通过树脂再生来提纯有机物。
离子交换法:利用离子交换树脂将有机物与离子分离,通过树脂再生来提纯有机物。
8. 膜分离法:利用半透膜的选择性通过滤除不需要的成分来提纯有机物。
膜分离法:利用半透膜的选择性通过滤除不需要的成分来提纯有机物。
9. 氧化法:通过氧化剂氧化有机物,然后通过沉淀或滤除等方式分离纯净的有机物。
氧化法:通过氧化剂氧化有机物,然后通过沉淀或滤除等方式分离纯净的有机物。
10. 生物降解法:利用微生物的生物化学反应将有机物分解,然后通过沉淀或滤除等方式分离提纯。
生物降解法:利用微生物的生物化学反应将有机物分解,然后通过沉淀或滤除等方式分离提纯。
这些分离提纯方法可以根据具体的有机物和污水特性进行选择和组合使用,以达到高效分离和提纯有机物的目的。
有机物的分离与纯化方法

有机物的分离与纯化方法有机物的分离与纯化方法主要包括物理方法和化学方法两大类。
物理方法主要通过物质的物理性质差异进行分离和纯化,包括蒸馏、萃取、结晶、过滤和凝固等方法。
化学方法主要是通过化学反应使混合物中的一成分转化为易分离的产物,再进行分离和纯化。
一、物理方法:1.蒸馏:利用物质的沸点差异,使混合物中的液体成分蒸发并冷凝,将蒸发出的液体收集,可用于分离液体混合物。
2.萃取:利用溶质在不同溶剂中的溶解度差异,将溶质从混合物中转移到另一溶剂中,再将溶剂蒸发或抽取,可用于分离挥发性有机物和不挥发性有机物的混合物。
3.结晶:利用物质的溶解度差异,通过调整温度和溶剂浓度使溶质结晶成固体,然后通过过滤得到纯净的溶质。
4.过滤:利用物质的颗粒大小差异,通过过滤器将混合物中的固体颗粒分离出来,可用于分离固体与液体的混合物,或者固体与固体的混合物。
5.凝固:利用物质的沸点差异,将液体混合物放在低温环境下使其中的一种成分凝固,从而分离出来。
二、化学方法:1.氧化还原反应:通过物质之间的氧化还原反应将混合物中的一成分转化为易分离的氧化产物或还原产物,然后通过一系列操作将其分离出来。
2.酸碱中和反应:通过加入酸或碱使混合液体的pH值发生变化,使其中的一种组分以固体形式沉淀出来,然后通过过滤或离心取得纯净物质。
3.沉淀反应:通过加入沉淀剂使混合液体中的其中一种组分以固体沉淀的形式分离出来,再通过过滤或离心取得纯净物质。
4.光谱分析:利用物质吸收或发射特定波长的光的特性,可以通过对样品的光谱分析来分离和纯化混合物中的有机物。
以上仅为有机物分离与纯化的部分方法,根据具体情况,如混合物的成分、性质和纯化要求等,可以选择合适的方法进行操作。
同时,有机物分离与纯化方法也在不断发展和完善中,如超临界流体萃取、逆流蒸发、层析法等也是目前较为使用的方法之一。
有机物分离方法总结

有机物分离方法总结1.萃取法:萃取法是将混合物中的有机物通过溶剂的选择性溶解性差异进行分离的方法。
常用的溶剂有水、醚类、醇类等。
该方法适用于萃取物溶解度差异较大的混合物。
2.蒸馏法:蒸馏法是利用混合物中组分的沸点差异进行分离的方法。
通过控制温度使得其中一种组分沸点,从而将其分离出来。
该方法适用于沸点差异较大的有机物混合物。
3.结晶法:结晶法是通过控制混合物中溶剂的蒸发速率和温度,使得其最易溶解的组分首先结晶出来,从而实现分离。
该方法适用于溶解度差异较大的有机物混合物。
4.色谱法:色谱法是通过溶剂向上流动的方式将混合物中的组分分离出来的方法。
常用的色谱法有薄层色谱、气相色谱和高效液相色谱等。
该方法适用于挥发性物质、高沸点物质和疏水性物质的分离。
5.水解法:水解法是通过将混合物中的有机化合物与水反应,将其转化为易于分离的物质。
常用的水解方法有酸水解、碱水解和酶水解等。
该方法适用于有机物与水反应产生水溶性物质的分离。
6.聚合物吸附法:聚合物吸附法是通过将混合物中的有机物与聚合物表面发生吸附作用,将其分离出来的方法。
常用的聚合物有活性炭、硅胶和树脂等。
该方法适用于有机物与聚合物表面吸附性差异较大的混合物。
7.膜分离法:膜分离法是通过利用膜的选择性通透性将混合物中的组分分离出来的方法。
常用的膜分离法有超滤、逆渗透和离子交换膜等。
该方法适用于分子量、电荷和大小差异较大的有机物混合物。
总结起来,有机物分离方法包括萃取法、蒸馏法、结晶法、色谱法、水解法、聚合物吸附法和膜分离法等。
根据混合物中有机物的特性和分离要求,可以选择适合的方法进行分离。
同时,结合不同的方法,可以更加有效地进行有机物的分离和纯化。
有机物分离方法总结

有机物分离方法总结有机物分离是化学实验中经常使用的重要技术手段之一。
通过分离有机物,可以清晰地观察和研究不同有机物的性质和特点。
有机物的分离方法多种多样,本文将对常见的有机物分离方法进行总结。
1. 蒸馏分离法:蒸馏是根据物质在不同温度下的沸点差异而进行分离的方法。
当混合物中的有机物之间的沸点差异较大时,可以通过加热混合物,使沸点较低的有机物先蒸发,然后冷凝收集,从而实现有机物的分离。
2. 萃取分离法:萃取是利用溶剂选择性提取物质的方法。
当混合物中的有机物与溶剂之间有较高的亲和力时,可以通过添加适当的溶剂来实现有机物的分离。
例如,酚类物质常常通过碱萃取法进行分离,将酚通过酸碱反应转化为盐,然后用有机溶剂提取盐,最后通过酸化再将有机物恢复。
3. 结晶分离法:结晶是指溶解物质在溶液中由于浓度增大而形成固体结晶的过程。
当混合物中的有机物与溶剂之间的溶解度差异较大时,可以通过加热和冷凝的方式,使溶解度较小的有机物首先结晶出来,从而实现有机物的分离。
4. 色谱分离法:色谱是一种可以根据物质在固定相和流动相之间的相互作用力不同而进行分离的方法。
在有机物分离中,常用的色谱方法有薄层色谱、气相色谱和液相色谱等。
其中,薄层色谱是将混合物溶解在适合的溶剂中,在薄层吸附剂上进行分离;气相色谱是利用气体作为流动相进行分离;液相色谱则是利用液体作为流动相进行分离。
5. 水相萃取法:水相萃取是指利用水的亲水性质将混合物中的有机物提取出来的方法。
在水相萃取中,通常需要调节溶液的酸碱性和溶液中有机物的溶解度,以实现有机物的分离。
6. 聚合物吸附法:聚合物吸附是利用聚合物与有机物之间的亲和力进行分离的方法。
通过将混合物溶解在适当的溶剂中,然后在聚合物表面进行吸附,随后再用适当的溶剂洗脱有机物,从而实现分离。
7. 水蒸汽蒸馏法:水蒸汽蒸馏是利用水蒸汽带走有机物质的方法。
当有机物的沸点较高,且与水有亲和力时,可以利用水蒸气使有机物挥发,然后冷凝收集有机物。
土壤中的有机物的十种分离提纯方法

土壤中的有机物的十种分离提纯方法
土壤中的有机物分离和提纯是进行土壤环境研究的重要步骤之一。
有机物的分离和提纯可以帮助我们更好地了解土壤中的有机成
分性质和含量,进一步揭示土壤的环境特征和生命活动。
下面介绍
了十种常用的土壤中有机物的分离提纯方法:
1. 溶剂提取法:利用溶剂的溶解性差异将有机物与土壤颗粒分离,常用的溶剂包括甲醇、丙酮、乙醚等。
2. 超声提取法:通过超声波震荡使有机物从土壤中析出,提高
提取效率和速度。
3. 离子交换树脂法:利用离子交换树脂的亲水性和亲疏水性对
有机物进行分离,可以选择合适的树脂类型和洗脱溶剂。
4. 膜分离法:利用膜的选择性透过性,将有机物从土壤中分离,常见的方法有微滤、超滤和逆渗透等。
5. 趋化分离法:通过有机物与化学试剂之间的亲和作用实现分离,常用的试剂包括酸、碱、盐和络合剂等。
6. 液-液萃取法:利用两种不相溶的溶剂对有机物进行分离,常用的溶剂包括正己烷、苯酚、乙醚等。
7. 热解析法:通过在高温下加热土壤样品,使有机物发生热解分解,然后进行提取和分离。
8. 蒸馏法:利用物质的不同沸点进行分离提纯,可以根据不同有机物的沸点差异选择适当的蒸馏条件。
9. 色谱法:利用色谱柱的分离效应将有机物进行分离,常见的色谱方法包括气相色谱和液相色谱等。
10. 电泳法:利用电场作用将有机物分离,常用的电泳方法包括凝胶电泳和毛细管电泳等。
需要根据具体研究目的和实验条件选择适当的分离提纯方法,合理运用这些方法可以帮助我们更全面地研究土壤中的有机物。
在
实验过程中,需要注意实验操作规范,确保实验结果的准确性和可重复性。
分离有机物的方法

分离有机物的方法
有机物可以通过以下几种方法进行分离:
1. 提取:利用有机溶剂的溶解性差异,将混合物溶解于合适的有机溶剂中,通过分液漏斗或离心机等设备将有机溶液与水相分离,从而分离有机物。
2. 蒸馏:利用不同的沸点,通过加热混合物,使其中沸点较低的有机物蒸发,然后在冷凝器中冷凝收集,从而分离有机物。
3. 结晶:利用有机物的溶解度差异,将混合物溶解于适当的溶剂中,通过调节温度或者加入反溶剂使有机物结晶析出,然后通过过滤或离心等步骤分离固体有机物。
4. 色谱:利用不同物质在固相或液相中流动速度的差异,通过色谱柱将混合物分离成不同组分。
5. 洗涤:利用不同有机物的溶解性差异,将混合物溶解在适当的溶剂中,通过反复的萃取和洗涤,使不同的有机物溶于不同的溶剂中,从而分离有机物。
6. 离子交换:利用树脂吸附不同离子的原理,将混合物溶解于适当的溶液中,通过与树脂的相互作用,使不同离子被树脂吸附,然后通过洗脱等步骤分离有机物。
以上方法是常见的有机物分离方法,根据需要和具体情况选择合适的方法进行分离。
有机物的分离和提纯方法

有机物的分离和提纯方法1.结晶法结晶法是最常用的分离和提纯方法之一、通过在溶液中冷却或者加入合适的溶剂,使溶质在饱和溶液中析出结晶,从而实现分离和提纯的目的。
结晶法适用于溶解度随温度变化较大的化合物,比如有机物中一些酮、醛、酸类物质等。
2.蒸馏法蒸馏法是一种通过液体混合物的沸点差异来实现分离和提纯的方法。
通常情况下,液体混合物会在加热的作用下产生汽化,然后通过冷凝器冷却回至液态。
不同成分的汽化温度不同,可以通过控制温度来使目标物质单独汽化,从而实现分离和提纯。
蒸馏法适用于成分之间的沸点差异较大的化合物混合物。
3.萃取法萃取法是通过溶剂的选择性溶解性来实现分离和提纯的方法。
通常情况下,在含有两个或多个有机溶剂的体系中,将需要提纯的有机物溶于其中一个溶剂中,其他杂质则溶解于另外一个溶剂中。
通过分离这两个相,然后将目标物质从溶剂中蒸发或者析出结晶,从而实现分离和提纯的目的。
4.色谱法色谱法是一种通过固定相和流动相的选择性吸附和移动性来实现分离和提纯的方法。
根据固定相的性质,色谱法分为很多种,比如薄层色谱、柱层析、气相色谱等。
色谱法适用于物质之间的吸附性质差异较大的化合物。
5.洗涤法洗涤法是利用溶剂的吸附性质来实现分离和提纯的方法。
通常情况下,将混合溶液与吸附剂接触,使目标物质被吸附在吸附剂上,然后通过适当的洗涤提取和洗滤来得到目标物质。
洗涤法适用于有机物与杂质之间的吸附性质差异较大的情况。
以上是一些常用的有机物的分离和提纯方法。
在实际操作中,还应该根据具体的化合物性质和实验条件选择合适的方法进行分离和提纯。
有机物的十种分离提纯方法

有机物的十种分离提纯方法有机物的分离和提纯是化学实验和生产过程中非常重要的步骤。
以下是十种常见的有机物分离和提纯方法。
1.蒸馏:蒸馏是一种通过液体的沸点差异将混合物中的组分分离的方法。
常见的蒸馏方法有简单蒸馏和分馏蒸馏。
简单蒸馏适用于沸点差异较大的组分的分离。
分馏蒸馏适用于沸点差异较小的组分的分离。
2.结晶:结晶是一种通过溶解物质在溶剂中的逐渐降低的溶解度来分离物质的方法。
通常通过加热溶液使溶质全部溶解,然后慢慢冷却溶液,物质从溶液中结晶出来,可以得到纯净的物质。
3.萃取:萃取是一种通过两种不相溶的溶剂之间的分配系数差异将混合物中的组分分离的方法。
在酸碱中和反应中,可以通过选择萃取剂和适当的pH值来分离出所需的产物。
4.过滤:过滤是一种将固体和液体分离的方法。
通过过滤器将混合物通过,液体部分透过过滤器,固体部分被滤下来,可以得到纯净的液体。
5.色谱法:色谱法是一种通过溶解度差异和吸附性的差异将混合物中的组分分离的方法。
常见的色谱法包括薄层色谱和柱层析。
通过将样品和溶剂共同移动在固体或液体相上,不同物质在色谱介质上的保留时间不同,从而分离它们。
6.洗涤:洗涤是一种通过溶解度差异和溶剂性质的差异将混合物中的组分分离的方法。
可以通过水、酸、碱等溶液来洗涤混合物,将所需的组分溶解或转移到其他相中。
7.结合物法:结合物法是一种将混合物中的组分通过生成结合物来分离的方法。
例如,气相色谱中的衍生化反应可以将不易分析的有机物转化为易于分析的结合物,从而实现分离和提纯。
8.质谱法:质谱法是一种通过将混合物中的组分离子化并通过质谱仪进行分析和分离的方法。
通过对离子质荷比的测量,可以将混合物中的组分分离并得到纯净的组分。
9.蒸发:蒸发是一种通过将混合物中的溶剂蒸发掉,从而分离溶质的方法。
适用于溶质溶解度较小于溶剂的情况,溶质会随着溶剂的蒸发逐渐沉淀下来。
10.气相萃取:气相萃取是一种通过气相萃取设备将混合物中的有机组分转移到气相中的方法。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
有机物的十种分离提纯方法
一、过滤
1、原理:根据固体的溶解度不同,将不溶性固体从溶液中分离出来的方法。
2、条件:一种固体不溶,一种固体可溶。
3、范围:适用于不溶固体和液体的分离。
4、仪器:漏斗、铁架台、烧杯、玻璃棒、滤纸
5、注意:一贴二低三靠;对于有些溶液温度下降,会有晶体析出,应该趁热过滤。
6、列举:草酸钙中混有醋酸钙:加水溶解,过滤除去醋酸钙溶液。
二、洗气
1、原理:利用气体的溶解性或者化学性质不同,将混合气体分离开来的方法。
2、条件:一种气体不溶或不反应,一种气体可溶或可反应。
3、范围:适合于混合气体的分离。
4、仪器:洗气瓶、导管
5、注意:不要引进新的气体杂质,最后能够产生被提纯的气体。
6、列举:甲烷中混有乙烯:将混合气体通过溴的四氯化碳溶液,洗去乙烯。
三、蒸发
1、原理:把可溶性固体从溶剂中分离出来的方法。
2、条件:固体可溶
3、范围:适合于把可溶性固体从溶剂中分离出来。
4、仪器:铁架台、蒸发皿、酒精灯、玻璃棒
5、注意:玻璃棒作用;溶剂易挥发或易燃烧,采用水浴加热。
6、列举:从醋酸钠溶液中提取醋酸钠:蒸发溶液,使醋酸钠析出。
四、结晶
1、原理:通过蒸发溶剂或者降低温度使溶质的溶解度变小,从而使晶体析出的方法。
2、条件:固体的溶解度小或者固体的溶解度随温度升高变化较大。
3、范围:固体的溶解度小一般用蒸发结晶法;固体的溶解度随温度升高变化较大,一般用冷却结晶法或者重结晶法。
4、仪器:过滤、蒸发仪器。
5、注意:基本环节:溶解—蒸发浓缩—趁热过滤—冷却结晶—洗涤干燥
6、列举:苯甲酸钠中混有氯化钠:加水溶解,蒸发浓缩,冷却结晶,就可以除去氯化钠。
五、分液
1、原理:把互不相溶的液体分离开来的方法。
2、条件:液体互不相溶
3、范围:适合于互不相溶的液体分离。
4、仪器:分液漏斗、烧杯
5、注意:分液漏斗的基本操作
6、列举:己烷中混有己烯:加入酸性高锰酸钾溶液,振荡后用分液漏斗分离。
六、萃取
1、原理:利用溶质在互不相溶的溶剂中溶解度的不同,选择萃取剂将溶质从一种溶剂中转移到另一种溶剂中的方法。
2、条件:萃取剂与原溶剂互不相溶;溶质在萃取剂中的溶解度大于在原溶剂中的溶解度。
3、范围:适合于溶质在互不相溶的液体中的分离。
4、仪器:分液漏斗、烧杯
5、注意:物质在不同溶剂中的溶解性。
6、列举:从碘水中提取碘,加四氯化碳,振荡后用分液漏斗分离。
七、蒸馏
1、原理:利用液体的沸点不同,经过加热冷凝使液体分离的操作。
2、条件:液体的沸点相差比较大。
3、范围:适合于沸点不同的液体的分离。
4、仪器:酒精灯、铁架台、石棉网、蒸馏烧瓶、冷凝管、接应管、锥形瓶、温度计
5、注意:温度计位置;逆流冷凝。
6、列举:酒精中混有水,加氧化钙,蒸馏可除去水。
八、渗析
1、原理:利用半透膜能够透过离子或分子,不能透过胶粒的性质分离提纯胶体的操作。
2、条件:一种是胶体,一种是溶液
3、范围:适合分离胶体和溶液。
4、仪器:烧杯、半透膜袋
5、注意:最好在流动的水中进行
6、列举:鸡蛋白中混有少量氯化钠:把混合溶液装在半透膜袋中,置于流动的水中。
九、盐析
1、原理:利用轻金属盐能够降低胶体的溶解度的性质,分离提纯胶体的方法。
2、条件:一种是胶体,一种是溶剂
3、范围:适合胶体和溶剂的分离
4、仪器:烧杯、过滤装置
5、注意:方法是盐析,操作是过滤
6、列举:硬脂酸钠中混有甘油:加少量食盐,使硬脂酸钠析出,然后过滤分离。
十、色谱
1、原理:利用吸附剂对不同有机物的吸附作用不同分离提纯有机物的操作。
2、条件:同一吸附剂吸附有机物能力不同。
3、范围:适合分离吸附能力不同的有机物。
4、仪器:吸附柱
5、注意:选择碳酸钙、硅胶、氧化铝、活性炭等吸附剂
6、列举:叶绿素和叶黄素的分离:以碳酸钙粉末为吸附剂,装入吸附柱中,加入混合物分离。
【鉴别】
说明:A.醇、酚、羧酸的监别能用其它方法时不能用金属钠。
B.不同有机物的监别有时也可利其水溶性
(2).除杂质。
