红外光谱
红外光谱解析

10 (cm ) (m)
1
4
各种振动方式及能量
分子振动方式分为:
伸缩振动 -----对称伸缩振动 s ----反对称伸缩振动 as 弯曲振动 ----面内弯曲振动 ----剪式振动 s -----平面摇摆 -----面外弯曲振动- ----非平面摇摆 -----扭曲振动 按能量高低为: as >
的,只有在立体结构上互相靠近的基团之间才能产生F效应, 例如:
环己酮 4,4-二甲基环己酮 2-溴-环己酮 4,4-二甲基-2-溴-环己酮
C=O
1712
1712
1716
1728
-氯代丙酮的三个异构体的C=O 吸收频率不同
氢键效应
氢键使吸收峰向低波数位移,并使吸收强度加强,
例如: - 和-羟基蒽醌
二氧化碳的IR光谱
O=C=O
对称伸缩振动 不产生吸收峰
O=C=O
反对称伸缩振动 2349
O=C=O
面内弯曲振动 667
O=C=O
面外弯曲振动 667
因此O=C=O的 IR光谱只有2349 和 667/cm 二个吸收峰
二、IR光谱得到的结构信息
IR光谱表示法:
红外光谱

不明显
醇、酚、醚
C-O RNH2 R2NH
胺
特征峰
类别 醛、酮
键和官能团
C=O R-CHO C=O
拉
1750-1680 2720
伸 (cm-1)
说
明
上的氢) (C=O上的氢) 上的氢
与CH3和CH2容易区分 和 容易区分
羧酸 OH 酰卤 酸酐 酯 酰胺 腈 C=O C=O C=O; C-O-C C=O NH2 C≡N ≡
2、必须能引起分子偶极矩变化的振动才能产生红外 必须能引起分子偶极矩变化的振动才能产生红外 偶极矩变化 吸收光谱 偶极矩变化与原子电负性、 偶极矩变化与原子电负性、振动类型以及分子 的对称性有关。 的对称性有关。
H2、O2、N2 电荷分布均匀,振动不能引起红外吸收。 电荷分布均匀,振动不能引起红外吸收。 C≡C
3、影响吸收峰减少的因素 、 (1) (2) (3) 偶极矩不发生变化的, 偶极矩不发生变化的,没有红外吸收 发生峰的简并 吸收峰在中红外区外
(4) 吸收强度太弱 (5) 强峰对弱峰的覆盖
三、分子的振动类型 (1) ) 伸缩振动: 伸缩振动:
沿轴振动,只改变键长,不改变键角
C
称 缩 动 对 伸 振 (νs) -1 (2853 cm )
二、分子振动 1、双原子分子振动为近似的简谐振动 、双原子分子振动为近似 近似的简谐振动 简正振动:反映的是某一化学键的键长和键角变化, 简正振动:反映的是某一化学键的键长和键角变化, 吸收频率为化学键的特征吸收峰。 吸收频率为化学键的特征吸收峰。 光谱选律为 双原子分子可产生 红外吸收峰 ∆ν =±1 的振动。 ∆ν = ± 3的振动。 ∆ν = ± 1 的跃迁所产生的吸收 ∆ν = ± 2 的跃迁所产生的吸收 ∆ν = ± 2或
红外光谱(最全-最详细明了)

1. 收集谱图数据
通过红外光谱仪获取样品的光 谱数据。
3. 峰识别与标记
识别谱图中的特征峰,并对其 进行标记。
5. 结果输出
得出样品成分的红外光谱解析 结果。
谱图解析技巧
1. 峰归属参考
查阅相关资料,了解常见官能团或分子结构 的红外光谱峰归属。
3. 多谱图比对
将待测样品谱图与标准样品谱图进行比对, 提高解析准确性。
红外光谱与其他谱学的联用技术
红外光谱与拉曼光谱联用
拉曼光谱可以提供分子振动信息,与红外光 谱结合,可更全面地解析分子结构和化学组 成。
红外光谱与核磁共振谱联用
核磁共振谱可以提供分子内部结构的详细信息,与 红外光谱结合,有助于深入理解分子结构和化学键 。
红外光谱与质谱联用
质谱可以提供分子质量和结构信息,与红外 光谱结合,有助于对复杂化合物进行鉴定和 分析。
红外光谱在大数据与人工智能领域的应用
红外光谱数据的处理与分析
利用大数据技术对大量红外光谱数据进行处理、分析和挖掘,提取有用的化学和物理信息 。
人工智能在红外光谱中的应用
利用人工智能技术对红外光谱数据进行模式识别和预测,提高红外光谱的解析能力和应用 范围。
红外光谱数据库的建立与完善
建立和完善红外光谱数据库,为科研和工业界提供方便、快捷的红外光谱查询和服务。
分子振动与转动能级
1 2
分子振动
分子中的原子或分子的振动,产生振动能级间的 跃迁。
转动能级
分子整体的转动,产生转动能级间的跃迁。
3
振动与转动能级间的耦合
某些特定的振动模式会导致分子的转动能级发生 跃迁。
红外光谱的吸收峰与跃迁类型
吸收峰
由于分子振动或转动能级间的跃迁,导致光谱上出现暗线或 暗带。
红外光谱计算公式

红外光谱计算公式红外光谱是一种用于研究物质结构和特性的重要分析方法。
它通过检测物质对红外辐射的吸收或散射来确定物质的分子组成、化学结构和功能基团等信息。
红外光谱计算公式可以帮助解释红外光谱的吸收带和峰值位置,进一步了解物质的性质。
1.波数和波长的换算关系光谱中所用的波数和波长之间存在一定的换算关系,常用的换算公式为:波长(λ)=c/波数(ν)其中,λ表示波长,ν表示波数,c为光速。
2.峰值强度的计算红外光谱中吸收峰的强度通常用吸收峰的阿贝尔吸收系数计算。
阿贝尔吸收系数与吸收能级大小和浓度成正比。
一般情况下,峰值强度与阿贝尔吸收系数呈线性关系。
3.波数和振动模式的关系红外光谱可以提供物质的分子振动信息。
不同的振动模式对应特定的波数范围。
例如:- C-H伸缩振动的波数范围为2850-3000 cm^-1- C=O伸缩振动的波数范围为1630-1850 cm^-1- N-H伸缩振动的波数范围为3200-3600 cm^-14.化学官能团和峰位的关系红外光谱中的吸收峰位可以与特定的化学官能团相关联。
通过对红外光谱的解析,可以确定物质中存在的化学官能团。
例如,瞬时电偶极矩较大的双键会导致吸收峰位置向高波数方向移动。
5.标准物质和未知物质的比较红外光谱通常会与已知化合物的光谱进行比较,以确定物质的成分。
比较时,需要注意相同官能团或化学键所对应的吸收峰的位置和强度。
如果未知物质的红外光谱与其中一种标准物质的光谱非常接近,可以确定未知物质与标准物质的化学结构相似。
总的来说,红外光谱计算公式主要涉及波数与波长的换算、峰值强度的计算、波数与振动模式的关系、化学官能团与峰位的关系以及未知物质的比较等方面。
通过运用这些计算公式,可以准确解读红外光谱,深入了解物质的结构和特性。
红外光谱计算公式的应用广泛,对于化学、材料科学、生物医药等领域的研究有着重要意义。
红外光谱实验步骤

红外光谱实验步骤
红外光谱实验是一种用于分析物质结构的方法,具体步骤如下:
1. 准备样品:选择需要分析的样品,通常需要将样品制备成透明的薄片或溶液。
对于固体样品,可以使用金刚石压片机将其压制成薄片。
2. 设置光谱仪:打开红外光谱仪,在仪器上选择红外光谱扫描模式。
3. 校准仪器:根据仪器的要求,进行波数校准,通常使用气体或参考样品进行校准。
4. 选择检测方法:红外光谱实验可以采用不同的检测方法,最常用的是透射法和反射法。
透射法是将红外光通过样品后进行检测,反射法是将红外光照射在样品表面后进行检测。
5. 放置样品:将样品放置在光谱仪的光路中,根据实验要求选择透射池、反射杯等装置。
6. 开始实验:启动光谱仪,选择适当的波数范围和扫描速度,开始记录红外光谱。
7. 分析结果:根据实验记录的红外光谱图,观察吸收峰的位置和强度,进行物质结构的分析和鉴定。
8. 清洗仪器:实验结束后,关闭光谱仪,并进行相应的清洗和
维护工作,保持仪器的良好状态。
以上是典型的红外光谱实验步骤,具体步骤可能会根据不同的实验要求和仪器设备而略有变化。
红外光谱

红外光谱法一、红外光谱1.1 简介各种物质对不同波长(或波数)红外辐射的吸收程度是不同的,因此当不同波长(或波数)的红外辐射依次照射到样品物质时,由于某些波长的辐射能被样品选择吸收而减弱于是形成红外吸收光谱。
通常用透过(或吸收)与波长(或波数)所作的红外吸收光谱曲线来表征各种物质的红外吸收光谱,简称红外图谱或红外谱图。
1.2红外光谱分析原理将一束不同波长的红外射线照射到物质的分子上,分子发生振动能级迁移,某些特定波长的红外射线被吸收,从而形成这一分子的红外吸收光谱。
每种分子都有其组成和结构决定的独有的红外吸收光谱,红外光谱分析可用于研究分子的结构和化学键,也可以作为表征和鉴别化学物种的方法。
红外光谱的范围很广,为0.75~1000μm(13300~10 cm-1)。
按应用波段不同,红外光谱划分为三个区域:a.近红外(NIR)区:0.75~2.5μm(13300~4000 cm-1),b.中红外(MIR)区:2.5~25μm(4000~400 cm-1).远红外(FIR)区25~1000 μm(400~10 cm-1)。
远红外光谱主要由小分子的转动能级跃迁产生的转动光谱。
此外还包括离子晶体、原子晶体和分子晶体产生的晶格振动光谱以及原子量较大或键力常数较小分子的振动光谱;中红外和近红外光谱是由分子振动能级跃迁产生的振动光谱。
在各类分子中只有简单的气体或气态分子才产生纯转动光谱,而对于大量复杂的气、液、固态物质分子主要产生振动光谱。
并且目前被广泛应用于化合物定性、定量和结构分析以及其他化学过程研究的红外吸收光谱,主要是波长处于中红外区的振动光谱。
在红外光谱分析中,2.5~15μm(4000~667 cm-1)的中红外区域是应用最广泛的光潜区。
其中2.5~7.5μm(4000~1330 cm-1)称为特征谱带区。
因为羟基、胺基、甲基、亚甲檗、各类羰基和羧酸盐基等官能团的特征吸收峰都出现在这区域,所以又称它为基团区;7.5~15μm(1330~667cm-1)称为指纹区,物质分子的红外吸收峰在这一区域特别多,像人的指纹一样稠密,又有一定的特征性,所以称它为指纹区。
2红外光谱

C-H (2000-1667cm-1)
-(CH2)n- (900-600cm-1)
一、红外光的区划
红外线:波长在0.76~500μm (1000μm) 范围内的电磁波
近红外区:0.76~2.5μm 主要用于研究O-H、N-H、C-H键的倍频吸收或组
频吸收,此区域吸收峰强度较弱。
中红外区:2.5~25μm (400-5000cm-1) 振动、伴随转动光谱主要研究
基本形式 伸缩振动:原子沿键轴方向伸缩,键长变化但键角不变的振动。 变形振动:基团键角发生周期性变化,但键长不变的振动。又称 弯曲振动或变 角振动。 下图给出了各种可能的振动形式(以甲基和亚甲基为例)。
HH C
对称伸缩振动 s
symmetric stretching
HH C
面内弯曲振动或剪切振动 s
红外吸收强度
红外吸收强度由振动时偶极矩变化的大小决定。 分子中含有杂原子时,其红外谱峰一般都较强。
如C=C,C-C因对称度高,其振动峰强度小;而C=X,C-X,因对
称性低,其振动峰强度就大。峰强度可用很强(vs)、强(s)、 中(m)、弱(w)、很弱(vw)等来表示。
五 、红外谱图解析
红外吸收波段
面内弯曲振动 ✓ 特点:吸收峰密集、难辨认→指纹 ✓ 注:相关峰常出现在指纹区
• 经典力学导出的波数计算式为近似式。因 为振动能量变化是量子化的,分子中各基 团之间、化学键之间会相互影响,即分子 振 动的波数与分子结构(内因)和所处的化 学环境(外因)有关。
六、影响吸收峰位的因素
1.内部因素:化学键的振动频率不仅与其性质有关, 还受分子的内部结构和外部因素影响。相同基团的特 征吸收并不总在一个固定频率上。 (1)诱导效应(吸电效应): 使振动频率移向高波数区
什么是红外光谱

什么是红外光谱
红外光谱又称分子振动转动光谱,属分子吸收光谱。
样品受到频率连续变化的红外光照射时,分子吸收其中一些频率的辐射,分子振动或转动引起偶极矩的净变化,使振-转能级从基态跃迁到激发态,相应于这些区域的透射光强减弱,记录百分透过率T%对波数或波长的曲线,即为红外光谱。
红外光谱与紫外光谱、质谱、核磁共振并称物质结构分析“四大谱”,是仪器分析中重要的分析手段之一。
通过与标准谱图比较,可以确定化合物的结构;对于未知样品,通过官能团、顺反异构、取代基位置、氢键结合以及络合物的形成等结构信息可以推测结构。
以上信息仅供参考,建议查阅专业书籍或咨询专业人士。
红外光谱(超级实用版)

1820~1750 cm-1 , 氢键,二分子缔合体;
10:59:21
4. X—Y,X—H 变形振动区 < 1650 cm-1
指纹区(1350 650 cm-1 ) ,较复杂。 C-H,N-H的变形振动; C-O,C-X的伸缩振动; C-C骨架振动等。精细结构的区分。 顺、反结构区分;
吸 收 带
变 形 振
C-N-O H-C=C-H
500 960(反)
动
R-Ar-H
650-900
H-C-H
1450
常见基团的红外吸收带
=C-H
C-H
CC
C=C
O-H
O-H(氢键) S-H P-H
C-C,C-N,C-O C=O
N-O N-N C-F
C-X
N-H
CN
C=N
3500
3000 2500 特征区
H H
H
与一定结构单元相联系的、在一定范围内出现的化学键振动频率——基团 特征频率(特征峰);
例: 2800 3000 cm-1 —CH3 特征峰; 1600 1850 cm-1 — C=O 特征峰;
基团所处化学环境不同,特征峰出现位置变化:
—CH2—CO—CH2— 1715 cm-1 酮
—CH2—CO—O—
注意:溴化钾必须干燥 溴化钾研磨很细 控制溴化钾与样品的比例
此法适用于可以研细的样品,但对于不稳定的化合物, 如发生分解、异构化、升华等变化的化合物不宜使用 压片法。注意样品的干燥,不能吸水。
红外实验所需的油压机以及模具
红外实验所需的样品架
•糊剂法:
对于吸水性很强、有可能与溴化钾发生 反应的样品采用制成糊剂的方法进行测量。 取2mg样品与 1滴石蜡油研磨后,涂在溴 化钾窗片上测量。
红外光谱分析(FT-IR)
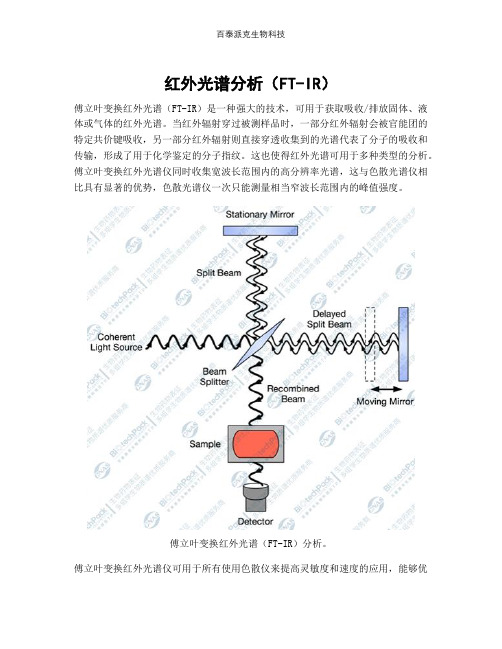
红外光谱分析(FT-IR)傅立叶变换红外光谱(FT-IR)是一种强大的技术,可用于获取吸收/排放固体、液体或气体的红外光谱。
当红外辐射穿过被测样品时,一部分红外辐射会被官能团的特定共价键吸收,另一部分红外辐射则直接穿透收集到的光谱代表了分子的吸收和传输,形成了用于化学鉴定的分子指纹。
这也使得红外光谱可用于多种类型的分析。
傅立叶变换红外光谱仪同时收集宽波长范围内的高分辨率光谱,这与色散光谱仪相比具有显著的优势,色散光谱仪一次只能测量相当窄波长范围内的峰值强度。
傅立叶变换红外光谱(FT-IR)分析。
傅立叶变换红外光谱仪可用于所有使用色散仪来提高灵敏度和速度的应用,能够优于红外光谱分析的色散法或滤光片法取决于其:1,非破坏性;2,无需外部校准;3,速度更快;4,灵敏度更高;5,光通量更高;6,操作更简单。
傅立叶变换红外光谱仪分析应用。
1.基于同质异性、同系物、几何和光学异构体的光谱差异进行化学鉴定;2.根据吸收的波长鉴定被测化学品中的官能团;3.通过研究潜在污染物的峰值进行纯度估算;4.通过比较特定官能团的峰跟踪化学反应过程;5.通过监测特定峰对化学物质进行定量分析。
百泰派克生物科技BTP基于CNAS/ISO9001双重质量认证体系建立七大检测平台,采用Thermo公司Nicolet系列仪器建立FT-IR分析平台,测定样品中蛋白和多肽的红外光谱,并进行后续的基线校正、Gaussian去卷积、二阶导数拟合,最终根据峰面积确定样品中蛋白和多肽的二级结构信息。
联系我们,免费项目咨询。
百泰派克生物科技生物制品表征服务内容。
FT-IR分析一站式服务。
您只需下单-寄送样品。
百泰派克生物科技一站式服务完成:样品处理-上机分析-数据分析-项目报告。
红外吸收光谱和红外反射光谱

红外吸收光谱和红外反射光谱
红外吸收光谱和红外反射光谱都是利用红外光进行光谱分析的技术,但它们在应用方向和检测方式上存在明显的区别。
1. 红外吸收光谱:
红外吸收光谱是利用红外光通过样品时,样品对红外光的吸收作用进行的光谱分析技术。
其主要是研究分子振动能级跃迁而产生的吸收光谱,只有引起分子偶极矩变化的振动才能产生红外吸收。
红外吸收光谱主要用于结构分析、定性鉴别及定量分析。
其优点在于可以获得分子基团的特征吸收峰,从而推断出分子结构式。
例如,在1300cm-1附近的特征吸收峰对应于亚甲基和甲基的伸缩振动,而在1650cm-1附近出现的特征吸收峰对应于C=O的伸缩振动等。
2. 红外反射光谱:
红外反射光谱是一种利用红外反射光研究吸附薄层的光谱分析技术,其与吸附薄层和金属载体的光学常数、入射角及入射光的极化性质有关。
这种技术主要被用于研究表面的吸附特性,如催化剂表面吸附、生物薄膜的形成等。
虽然红外反射光谱不直接给出有关分子基团的信息,但它可以提供关于表面结构、化学组成以及物理性质(如粗糙度、吸附层厚度等)的信息。
总的来说,红外吸收光谱主要适用于分析样品的内部结构和化学组成,而红外反射光谱则主要用于研究表面的结构和化学组成。
红外光谱给出的信息

红外光谱给出的信息
红外光谱是一种常用的分析技术,通过检测物质在红外光区的吸收和散射现象来获取样品的结构和化学组成信息。
红外光谱给出的信息包括以下几个方面:
1. 分子结构信息:红外光谱可以提供物质的分子结构信息,通过分析吸收峰的位置和形状,可以判断化学键的类型和存在。
例如,C-H键、O-H键、N-H键和C=O键等具有特征性的吸收峰。
2. 分子功能团信息:红外光谱可以帮助确定样品中的各种化学官能团的存在与否,如羟基、胺基、醛基、羧基等。
不同功能团在红外光谱中具有不同的吸收特征,这些特征帮助确定化合物的结构。
3. 定量分析信息:红外光谱还可以用于定量分析,通过测量样品中某种官能团的吸收强度与浓度之间的关系,可以确定未知样品中该官能团的浓度。
4. 晶体结构信息:红外光谱还可以表征晶体材料的结构信息,例如晶格振动模式和键的振动强弱可以被红外光谱所观察到。
总的来说,红外光谱提供了样品的分子结构、化学组成、官能团和晶体结构等方面的信息,对于化学、材料科学等领域的研究和分析具有广泛的应用。
红外光谱

KK
1 1
m m m m
ν (cm )
-1
-1
C 2150
C
C 1650
C
C 1200
C
b、轨道中S成分越多,键的强度越大,吸收频率越高
ν (cm )
C__H sp 3300
C__H sp2 3100
C__H sp3 2900
1 K 1 c、原子的质量越大,振动吸收频率越低。 m1 m2 2 m1 m2 2 __ __ __ -1 C H C C C O (cm ) 3000 1200 1100
C-H N-H O-H S-H
C=C C=O
C=N
六.各类有机物的红外吸收:
1.烷烃的红外吸收:
正辛烷
甲基: Vas=2960, Vs=2860,δas=1450, 亚甲基: Vas=2930, Vs=2850, δas=1450 4个以上亚甲基: δs =720(cm-1)
δs =1380
2.烯烃的红外吸收
6 9 0 c m-1 6 9 0 c m-1 C=C H C=C H
2
2-甲基-1-丙烯
(E)-2-己烯
(Z)-3-己烯
3.炔烃的红外吸收:
1-己炔
C H 伸缩振动 3300
C C 伸缩振动 2100
C H 弯曲振动 630
2-己炔
HC
CCH2CH2CH2CH2CH2CH3
CH3C
CCH2CH2CH2CH2CH3
H H2 N , O 2 к Ó ìÍ âÎ üÕ Ê
CH3-CH2-C C-H Ð ÓÍ 箭头表示振动方向 O C O Þ Î ì º â ü Î CH -CH -C 3 2 âÎ Í üÊ Õ
光谱的红外区域

光谱的红外区域
光谱的红外区域是指位于可见光红色端之外的那部分光谱。
红外辐射在光谱中的位置紧跟在可见光的红色之后,因此被称为“红外”(即“红色之外”)。
红外光谱的特点和应用包括:
1.波长范围:红外区域的波长一般在大约700纳米
(nm)到1毫米(mm)之间。
这个范围被进一步划
分为近红外(约700 nm至2,500 nm)、中红外(约
2,500 nm至50,000 nm)和远红外(约50,000 nm
至1 mm)。
2.热辐射:红外辐射通常与热相关联。
物体发出的红
外辐射强度取决于其温度,因此红外技术常用于热
成像和温度测量。
3.分子振动和旋转:红外辐射能够引起分子的振动和
旋转,因此在化学中,红外光谱学是用来识别和分
析化合物的重要手段。
通过分析样品吸收红外辐射
的特定波长,可以确定其化学结构。
4.遥感应用:红外遥感技术广泛应用于地球科学和天
文学。
它可以用于观测地表温度、植被状态、云层
和大气成分,以及探测宇宙中的天体。
5.通信技术:近红外波段常用于光纤通信,因为在这
个波段光纤的损耗较低,有利于长距离传输。
6.生物医学应用:红外光谱也在生物医学领域有应
用,例如在组织成像和生物分子分析中。
7.安全检测:红外辐射用于安全和监控应用,例如夜
视设备和热成像相机,可以在无光或低光条件下进
行监控。
红外光谱的这些特性使其成为科学研究、工业应用和日常生活中的一个重要工具。
红外光谱的范围

红外光谱的范围红外光谱,也被称为傅立叶变换红外光谱(FTIR),是一种广泛应用在化学、物理、生物等领域的分析技术。
它通过测量分子对不同波长的红外辐射的吸收情况,来获取样品中各种化合物的信息。
一、红外光谱的基本原理红外光谱的工作原理基于分子振动理论。
当一个分子受到红外光照射时,如果入射光的能量与分子内部某些特定振动模式的能量相匹配,就会发生共振吸收,从而导致光强的下降。
这个过程就像音叉在接收到与其固有频率相同的声波时会产生共振一样。
根据所吸收的红外光的波长和强度,可以推断出分子中存在哪些化学键以及它们的相对强度。
二、红外光谱的范围红外光谱通常被分为三个区域:近红外区(NIR)、中红外区(MIR)和远红外区(FIR)。
这三个区域分别对应着不同的光子能量和分子振动类型。
1. 近红外区(NIR):近红外区的波长范围大约为780-2500纳米(对应频率为12825-4000厘米^-1),主要包含分子的非谐振性振动和电子跃迁。
在这个范围内,由于吸收较弱,主要用于测定样品的水分、脂肪、蛋白质、糖类等大分子物质的含量。
2. 中红外区(MIR):中红外区是红外光谱的主要工作区域,其波长范围约为2.5-25微米(对应频率为4000-400厘米^-1)。
在这个范围内,大多数有机化合物的化学键都能产生特征吸收峰,因此常用于定性和定量分析。
3. 远红外区(FIR):远红外区的波长范围约为25-1000微米(对应频率为400-10厘米^-1),主要涉及分子的整体旋转和低频振动。
这一区域的吸收信息对于研究晶格振动、热性能、晶体结构等方面具有重要意义。
三、红外光谱的应用红外光谱在各个领域都有广泛的应用。
例如,在化学工业中,它可以用于鉴定未知化合物、监控生产过程;在环境科学中,可用于检测大气污染物、水质监测等;在生物学中,可用于研究生物大分子如蛋白质、核酸的结构和功能;在材料科学中,可用于研究新型材料的性质和结构等。
红外光谱

13
水分子——非线性分子
f 3 3 6 3
1 as 3756 cm OH 1 s 3652 cm OH
OH 1595cm 1
14
CO2分子 ——线性分子
f 3 3 5 4
S CO 1388 as CO 2349 CO 667 CO 667
三、红外光谱的吸收强度
四、红外吸收强度及其表示符号
摩尔消光系数(ε)
>200 75~200 25~75 5~25
强度
很强 强 中等 弱
符号
VS S M W
0~5
很弱
VW
分子振动
一、红外光谱产生的第一个条件
•
当一束具有连续波长的红外光通过物质,物质分 子中某个基团的振动频率或转动频率和红外光的 频率一样时,分子就吸收能量由原来的基态振(转 动能级跃迁到能量较高的振(转)动能级,分子吸收 红外辐射后发生振动和转动能级的跃迁,该处波 长的光就被物质吸收。所以,红外光谱法实质上 是一种根据分子内部原子间的相对振动和分子转 动等信息来确定物质分子结构和鉴别化合物的分 析方法。将分子吸收红外光的情况用仪器记录下 来,就得到红外光谱图。红外光谱图通常用波长 (λ)或波数(σ)为横坐标,表示吸收峰的位置,用透 光率(T%)或者吸光度(A)为纵坐标,表示吸收强度
23
第三节
红外分光光谱仪与制样
一、 傅立叶变换红外吸收光谱仪(FT-IR)
光源
迈克尔逊干涉仪
吸收池
干涉图 检测器
傅里叶变换
红外吸收光谱 图
数据处理 仪器控制
二、制样方法
(1) 气体样品: 气态样品 可在玻璃气槽内进行测定, 它的两端粘有红外透光的NaCl或KBr窗片。先将气槽抽 真空,再将试样注入。 (2) 液体和溶液样品(液体池):液体样品可滴在可
红外光谱(最全-最详细明了)、、

υC=O(cm–1) 1663 1686 1693
(7)振动偶合效应:分子内有近似相同频率且位于相邻部位的振动基团彼此相互作用,产生两种以上基团参加的混合振动。
波数即波长的倒数,表示单位(cm)长度光中所含光波的数目。波长或波数可以按下式互换:
一般扫描范围在4000~400cm-1。
4.红外吸收光谱产生的条件
满足两个条件: (1)辐射应具有能满足物质产生振动跃迁所需的能量 (2)辐射与物质间有相互偶合作用。
对称分子:没有偶极矩,辐射不能引起共振,无红外活性。如:N2、O2、Cl2 等。 非对称分子:有偶极矩,红外活性。
*
(3) 检测器 真空热电偶;不同导体构成回路时的温差电现象 涂黑金箔接受红外辐射; 傅立叶变换红外光谱仪采用热释电(TGS)和碲镉汞(MCT)检测器; TGS:硫酸三苷肽单晶为热检测元件;极化效应与温度有关,温度高表面电荷减少(热释电); 响应速度快;高速扫描;
如乙酰乙酸乙酯有酮式和烯醇式结构,两者的吸收皆能在红外谱图上找到,但烯醇式的υC=O较酮式υC=O弱,说明稀醇式较少。
CH3-CO-CH2-COO-C2H5 CH2-C(OH)=CH-COOC2H5 υC=O 1738(s),1717(s) υC=O与υC=C在1650cm-1(w) υOH3000cm-1
两种类型:色散型 干涉型(傅立叶变换红外光谱仪)
*
日本岛津公司的 DT-40 FT-IR
*
干涉仪
光源
样品室
检测器
显示器
绘图仪
计算机
干涉图
光谱图
FTS
*
红外光谱

(2853
cm-1
)
面外摇摆弯曲振动 对称伸缩振动s
(2853cm-1)
剪式弯曲振动 (1456 cm-1)
面内摇摆弯曲振动 (1456 cm-1)
面外摇摆弯曲振动 (1300 cm-1)
卷曲弯曲振动 (1250 cm-1)
分子吸收红外辐射的条件及吸收强度
如:
质量m大, μ增大,化学键的振动波数低 。
C-C(1430cm-1) < C-N(1330cm-1) < C-O(1280cm-1)(力常数相近) O-H的伸缩振动= 3700cm-1> O-D的 =2600cm-1
C-Cl的 =800-600cm-1> C-Br的 =600-500cm-1> C-I的 =530-470cm-1
分子内原子不停地在振动,在振动过程中是不变的,而正负电荷的中心 距离r会发生改变,因此分子的偶极矩也发生改变。对称分子由于正负电荷 中心重叠,r=0,因此对称分子中原子振动不会引起偶极矩的变化。 用一定频率的红外光照射分子,如果分子中某个基团的振动频率和它 一样,则两者就会产生共振,光的能量通过分子偶极矩的变化传递给分子, 分子中某个基团就吸收了一定频率的红外光。分子就由原来的基态振动能 级跃迁到较高的振动能级,产生红外光谱。 这说明并非所有的振动都能引起红外吸收,只有引起偶极矩变化的振动, 才能产生共振吸收。对于完全对称的分子如N2、H2、O2等就不会产生红外 吸收光谱。
19
双键伸缩振动区(1900~1200cm-1)
C=O
1900-1650
C=O C 1680-1620
苯衍生 物的泛 频
2000-1650
红外光谱

例:某化合物分子式为C12H24O2,推测结构。
14
解 :
不饱和度
=
1
+
12
+
1 2
×(0 - 24) = 1
由最强的吸收峰1703 cm-1知此化合物含羰基,与不饱
பைடு நூலகம்
和度为1吻合;
2920 cm-1、2851cm-1处吸收很强,而2956 cm-1、2866
cm-1处吸收较弱,说明-CH2-的数目多于-CH3的数目; 在723cm-1处(相当于720cm-1处)有吸收峰,证明有长
770~735cm-1
810~750cm-1 710~690cm-1 833~810cm-1
尖、强 一取代
强 二取代(邻位)
强 二取代(间位) 中 强 二取代(对位)
10
红外谱图解析
1. 观察特征频率区,找出特征吸收峰,判断苯环、双 键、羰基、三键、羟基、胺基等官能团,以确定所 属化合物的类型。
2. 观察指纹区,进一步确定基团的结合方式。指纹区 对用已知物鉴别未知物十分有用。
主要是:C-C、C-N、C-O等单 键和各种弯曲振动的吸收峰,其特 点是谱带密集、难以辨认。
3
各主要官能团红外光谱的特征吸收峰频率
4000cm-1
650cm-1
3600-3200 NH, OH d, br, s
3300
CC H
strong
2700 -CHO double
2960-2850 -C-H strong
5
-NH2: 与 –OH 相似,游离的 –NH2 在 3300~3500 cm-1,缔合
后吸收峰的位置会降低 100 cm-1,这里要区别几种不同的胺 : ①伯胺有两个吸收峰,原因在–NH2有两个N-H键,振动有 对称和非对称两种伸缩振动,所以与–OH区别较大,吸收 强度比–OH弱; ②仲胺只有一种振动,吸收峰比 –OH 要尖锐; ③叔胺因 N 上无 H ,所以在此区域无吸收。
红外光谱原理及解析

红外光谱原理及解析红外光谱(Infrared Spectroscopy)是一种常见的分析技术,通过检测物质在红外辐射下发生的振动、转动和伸缩等分子的运动引起的能级跃迁,来获取物质的结构信息和化学特性。
红外光谱广泛应用于化学、生物、药物、材料等领域,为科学研究和工业生产提供了有力的工具。
红外光谱的原理主要基于分子吸收红外辐射的现象。
分子由原子通过共价键连接而成,光谱的测量是根据分子中一些特定键的振动模式对入射光的吸收。
利用红外光谱仪,通过在样品中通过红外光或者红外辐射,使样品中的分子以不同的方式振动,然后测量样品中被吸收或反射的红外光强度的变化。
红外光谱通常使用波数(cm-1)作为横坐标,波数是以光的频率而非波长为单位的。
不同的分子和它们的化学键具有不同的振动频率和振动强度,这些不同的频率和强度表现为光谱上不同的峰和强度。
红外光谱可以分为三个区域:近红外区(4000-1400 cm-1)、中红外区(4000-400 cm-1)和远红外区(400-10 cm-1)。
在这三个区域,最常用的是中红外区域,因为大多数有机化合物和无机物的振动吸收位于该区域。
中红外光谱主要包括振动伸缩、弯曲、转动和振转结合等谱带。
振动伸缩谱带主要来自于有机分子中的C-H、O-H、N-H和C-O键等的振动。
弯曲谱带来自于烷基、芳香和杂环等分子中的键角弯曲振动。
转动谱带来自于小分子和气体的转动运动。
而振转结合谱带是指一些具有较高分子对称性的物质在红外光谱中表现出的特殊谱带。
红外光谱的解析和分析可以通过比对红外光谱仪测得的光谱图和对应的标准谱图库进行。
这些标准谱图库包括已知物质的红外光谱图,可以通过比对谱带的位置和强度与标准样品进行鉴定和分析。
此外,红外光谱还可用于物质浓度测定、物质含量定量、反应动力学研究等。
在实际应用中,红外光谱常常与其他技术结合使用,如液相色谱(HPLC)、气相色谱(GC)等。
通过与这些技术结合,可以实现对混合物中不同组分的定性和定量分析,提高分析能力和准确性。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
红外光谱(IR)在沸石分子筛中的应用摘要:本文阐述了红外光谱(IR)在沸石分子筛研究中的作用,指出了红外光谱在分子筛研究中主要应用于骨架振动、硅铝比和杂原子取代、表面羟基以及酸性、阳离子振动等方面。
关键词:红外光谱;沸石分子红外光谱(IR)可以表征化学键进而表征分子结构。
IR光谱可以用来识别化合物和结构中的官能团。
红外光谱方法具有样品用量少、样品处理简单、测量手段快、操作方便等优点。
在分子筛的结构研究中,红外光谱也是一种不可缺少的重要工具。
在分子筛研究中的应用主要有:分子筛骨架构型的判别、骨架元素的主成分析、阳离子分布情况、表面羟基结构、表面酸性、催化性能以及分子筛的客体的结构等方面[1]。
研究沸石骨架振动多采用溴化钾压片法(或简单地与溴化钾粉末混合)或矿物油涂膜法制备样品[2-4],有时则需要纯沸石样品进行脱水、酸性或催化反应等的原位表征[5]。
测定区域一般为200~4000cm-1,晶格水及羟基谱带分布在3700 cm-1及1600 cm-1附近,200~1300 cm-1区域的谱峰主要是分子筛骨架振动谱带。
1 骨架振动沸石骨架振动引起的谱带多在中远红外区。
内部振动的谱带位置对骨架结构变化不敏感,而外部连接振动对骨架结构比较敏感。
图一,为中孔分子筛MCM-41型沸石的红外谱图。
由图可以看出,合成样品的红外图谱在1640cm-1左右出现了较弱的吸收峰,它是分子筛所吸附的水羟基振动所致,在1095 cm-1出现了很强的吸收峰,它是Si-O-Si键反对称伸缩振动所致,在800 cm-1左右的吸收峰是Si-O-Si键的对称伸缩振动吸收峰,在460 cm-1左右出现的吸收峰是Si-O键的弯曲振动所致,这些都是中孔分子筛的特征吸收谱带。
960 cm-1处出现的吸收峰是Al取代Si后骨架局部不对称所致,有的认为是Si-O键伸缩振动而引起的特征吸收,有的认为是由于缺陷位造成的骨架局部不对称性所致,纯硅中孔分子筛亦存在一定的缺陷位,因而也出现了此谱带。
图二为微孔分子筛ZSM-3分子筛的红外光谱,从红外光谱图中看到在3400 cm-1出现了强的吸收峰,它是ZSM-3分子筛吸收的水分子的振动吸收峰;在1660cm-1左右出现了较弱的吸收峰,它是分子筛所吸附的水羟基振动所致,在1109 cm-1出现了很强的吸收峰,它是Si-O-Si键反对称伸缩振动所致,在800 cm-1左右的吸收峰是Si-O-Si键的对称伸缩振动吸收峰,在470 cm-1左右出现的吸收峰是Si-O键的弯曲振动所致,这些都是微孔分子筛的特征吸收谱带。
图一MCM-41分子筛的IR图谱图图二ZSM-3分子筛的IR图谱由以上两个例子分析可知硅铝沸石和磷酸铝分子筛骨架振动谱带具有一些特点:(1)在1000 cm-1附近有很强的吸收;(2)在450 cm-1有较强的吸收;(3)在450~1000 cm-1与200~400 cm-1区间,各种骨架构型的沸石或沸石分子筛的红外吸收谱带变化十分复杂;(4)相同构型的沸石或分子筛,其组成上差别也会引起谱峰的变化,但谱带形状基本相同,与标准谱图对照,可以初步鉴定样品的骨架构型。
对于沸石骨架红外谱带的主要经典归属可以分为以下几方面[1]:(1)内部四面体振动:不对称伸缩振动(n asym)1250~920 cm-1对称伸缩振动(n sym)720~650 cm-1;T—O弯曲振动500~420 cm-1。
(2)外部连接振动:双环振动650~500 cm-1;不对称振动1150~1050 cm-1;对称伸缩振动820~750cm-1;孔口(窗口)振动420~300cm-1,一般来说,环越大,其振动频率越低。
如A型沸石中的八元环的特征吸收频率在378 cm-1,而X型沸石的十二元环孔口的特征频率在365 cm-1左右,硅铝比较高的Y型沸石的吸收频率移到370~380 cm-1附近。
2 硅铝比以及杂原子取代在红外光谱图中尽管不能区分硅氧和铝氧振动,但不对称伸缩振动和对称伸缩振动的谱带位置与沸石骨架的硅铝比有关。
其原因可以从硅氧键和铝氧键的键长不同予以解释:硅和铝的质量相差不大,而Si—O键长为1.61埃,Al—O键长为1.75埃,又因为铝的电负性较小,因此,Al—O键的结合力较Si—O键弱,其价键力常数必然较小,尽管多原子分子的振动光谱远非如此简单,但可以推断键长增大或电负性降低,引起键的力常数减少,从而使振动频率降低。
这就是说,Al—O键的振动频率比Si—O键的振动频率低。
因此,随着骨架中铝的摩尔数的增加,这些骨架振动的红外谱带均向低波数方向位移。
在工业生产中,红外光谱可用来快速测定产物的硅铝比;在科学研究中,红外光谱可以很好地跟踪脱铝化过程及其处理过程所引起的沸石骨架硅铝比的变化。
活性元素在中孔分子筛的骨架负载是指在合成中孔分子筛的溶胶中加入含活性元素的溶液,使在中孔分子筛生成的过程中,活性元素代替硅氧四面体中的硅或铝进入中孔分子筛骨架。
活性元素负载后,分子筛的IR图谱上显示出活性元素和骨架中桥氧或非桥氧或羟基结合形成新键所致的吸收谱带,可用此来判别活性元素在分子筛中的负载形式,特别是960 cm-1处的吸收峰,虽然存在一定争论,但许多文献都把其作为活性元素负载后形成新键或进入骨架的标志[6]。
由图三和表一可以看出负载后的红外图谱上,Si-O-Si的Vas振动(1111.8 cm-1)和Vs振动(819cm-1)介于在相同条件下合成的纯MCM-41 和La2O3相应的波数之间,这是由于La-O的反对称伸缩振动和伸缩振动的键能大于Si-O的键能,所以硅氧四面体中显示的反对称伸缩振动是二者的协同振动。
这证明镧进入了硅氧四面体的骨架,取代了硅,参与了骨架振动。
La-O nb 弯曲振动出现在640cm-1左右,负载后,此吸收峰在615 cm-1出现但很弱,这可能是由于La-O的键能大于Si-O的键能,且镧的共价半径较大,镧进入骨架取代硅后,使弯曲振动更加困难所致,同时此谱带的出现也说明镧进入骨架后不能和其它四面体完全共顶角连接,存在非桥氧。
负载后的Si-O nb的弯曲振动变大,可能是因为镧进入骨架后,硅氧四面体变形所致。
负载后,Si-O-Si键的弯曲振动相对于负载前的波数减少,这是因为镧进入骨架后,使Si-O-Si弯曲振动更加困难。
表一样品的红外图谱的吸收谱带对比(单位:cm-1)图三负载前后样品的IR图谱(A-La2O3,B-MCM-41,C-La-MCM-41)3 表面羟基以及酸性质在沸石表面化学研究中,红外光谱主要用于以下研究:(1)沸石的羟基结构与性质;(2)沸石表面酸及其性质;(3)沸石催化反应机理及动力学表面羟基是产生分子筛表面酸性的重要来源,它们的位置与数量及其环境等和催化剂的活性有密切关系。
与分子筛酸性有关的羟基在3600cm-1附近有特征谱带,但是过量的水会掩盖此特征,因此只有非常干燥的样品才适于作此测试。
例如,(1)对于部分脱氨后的HY分子筛,其羟基的伸缩振动在3643~3650cm-1,3530~3540cm-1与3745cm-1等处都出现吸收峰,其3650cm-1附近的吸收峰是由在超笼中S位置的羟Ⅱ基引起的,它的强度随HY分子筛吸附其他分子而发生变化,表明这些羟基处于吸附分子自由出入的位置上,3530cm-1左右的羟基吸收峰不易被吸收分子所改变,它是在位置上,或者在方钠石笼内,3745cm-1吸收峰与无定形氧化硅的表面双六元环中的SⅠ羟基有关。
(2)高温漫反射红外光谱法研究结果表明3612cm-1和3597cm-1吸收峰表征的羟基位于SAPO-34分子筛的晶格中,归属于两种桥联羟基(SiOHAl),两种羟基均具有酸性,在823K时仍然稳定。
(3)脱水的H-SAPO-37的桥羟基(位于超笼和方钠石笼内)的红外吸收谱带3640cm-1和3575cm-1。
IR可以检测某些非骨架物种,最著名的例子就是利用碱性碳针分子(如吡啶、氨、三甲胺)测定酸性,不同类型酸中心在吸附前后谱峰有所不同,因此可以从表征酸的类型这一原理出发,用B酸或L酸的特征谱峰面积的大小定量地求出这些酸中心的多少,通过不同温度的吸附,从这些特征谱峰的变化可以测定这些酸的强度分布。
在较低温度下被脱附的酸中心属于强度较弱的,而强度较大的酸中心只能在较高温度下才能脱附。
4 阳离子振动金属阳离子对沸石分子筛红外光谱的影响表现为金属离子本身振动谱带和金属离子对沸石骨架振动带来的影响。
一般金属离子质量较大,阳离子本身振动出现远红外区(50~200cm-1)。
所对应的IR谱带位置与阳离子的性质和它们所在的位置有关。
碱金属交换的X、Y、ZSM-5沸石的IR谱带随阳离子的质量增加(Na+、K+、Rb+、Cs+)而向低频方向移动(红移)。
而金属与骨架氧形成的金属氧键与它们的金属氧化物相比,由于它们的化学环境相差较大,因而其吸收峰位置变化较大,若谱峰强度不大时,很可能被隐没在分子筛的骨架振动谱带之中。
5 应用小结红外光谱在沸石和其它分子筛的结构表征和性质研究中应用较广,包括以下几方面:(1)沸石分子筛骨架类型的判别:主要是通过与标准谱图相比较;(2)判断分子筛晶化的过程:观察特殊骨架振动的特征吸收峰的出现或无定形原料(或中间物)吸收峰的消失;(3)晶化机理的研究:跟踪整个晶化过程的红外吸收峰变化;(4)沸石分子筛的晶化度(半定量)估计:选择较强的吸收峰,计算它们面积,估计含量;(5)表面羟基与表面酸性的测定:直接测量或使用探针分子;(6)分子筛催化反应及其机理研究:考察活性中心与反应物及生成物之间的相互作用;(7)金属阳离子的行为:采用远红外光谱直接测量与金属阳离子有关的振动谱带。
参考文献:[1] 袁忠勇,沸石类分子筛合成研究进展,化学进展2001,13 (2).113-115[2] Flanigen E M,Khatami H,Seymensi H A.in Adv. Chemistry Series101, E.M. Flanigen, L B.Sand (eds.), American Chemical Society.Washington, D.C.1971.201~228[3] Geidei E,Bohlig H,PeuKer Ch et al. Stud. Surf. Sci. Catalysis 65,G. Oklmann, H.Pfeifer, R. Fricke (eds),Elsevier, Amesterdam,1991. 511~519[4] Bauer F, Geidel E,Peuker C et al. Vibrational spectra of O—18—exchanged NaZSM—5 and HZSM—5, Zeolites.1996,17:278~282[5] Karge H G,Niessen W.Catalysis Today.1991,8:451[6] 冯考庭等,吸收分离技术. 北京:化学工业出版社,2000。
