中国药典与BP、EP、JP中溶解度规定比较
2019-2020年天津市资格从业考试《药学专业知识一》复习题精选含答案解析(第三十四篇)

2019-2020年天津市资格从业考试《药学专业知识一》复习题精选含答案解析(第三十四篇)一、单选题-1《中国药典》规定注射用水应该是A分子结构B温度C药物晶型D粒子大小E药物颜色【答案】E【解析】影响药物溶解度的因素包括①药物分子结构与溶剂②温度③药物的晶型④粒子大小⑤加入第三种物质:溶液中加入溶剂、药物以外的其他物质可能改变药物的溶解度二、单选题-2可作为气雾剂抛射剂的是A乙醇B七氟丙烷C聚山梨酯80D维生素CE液状石蜡【答案】A【解析】气雾剂中常与水形成潜溶剂的有乙醇、丙二醇、甘油和聚乙二醇等。
三、单选题-3美国药典的缩写是ABPBUSPCChPDEPENF【答案】B【解析】美国药典的缩写是USP,英国药典的缩写是BP,欧洲药典的缩写是EP,日本药典的缩写是JP,中国药典的缩写是ChP。
四、单选题-4来源于天然植物,长期使用会产生骨髓抑制作用的抗痛风药物是A丙磺舒B苯溴马隆C别嘌醇D秋水仙碱E盐酸赛庚啶【答案】D【解析】秋水仙碱为一种天然产物,为百合科植物丽江山慈菇的球茎中得到的一种生物碱,略有引湿性。
可在痛风急症时使用,长期用药可产生骨髓抑制,胃肠道反应是严重中毒的前兆,症状出现应立即停药。
五、单选题-5在脂质体的质量要求中,表示脂质体化学稳定性的项目是A载药量B渗漏率C磷脂氧化指数D释放度E包封率【答案】C【解析】表示脂质体的化学稳定性的项目:①磷脂氧化指数,一般规定磷脂氧化指数应小于0.2;②磷脂量的测定,基于每个磷脂分子中仅含1个磷元素,即可推算出磷脂量;③防止氧化的一般措施有充入氮气,添加抗氧剂,也可直接采用氢化饱和磷脂。
六、单选题-6应用非那西丁期间发生间质性肾炎属于下列哪种类型的不良反应AA型不良反应BB型不良反应CC型不良反应。
四国药典细菌内毒素对比

.CP(2015版)1143EP(8.0)2.6.14USP(36)85JP(16)6.06定义CP(2015) EP(8.0) USP(36) JP(16)本法系利用鲎试剂来检测或量化由革兰阴性菌产生的细菌内素素本法利用鲎试剂(从美洲鲎或中华鲎——阿米巴细胞溶解产物制备而来)检测由革兰氏阴性菌产生的细菌内毒素或对内毒素进行定量检查和定量供试品内毒素的方法。
本法利用鲎(美洲鲎或中华鲎)阿米巴细胞溶解产物制备的用于内毒素检测的鲎试剂( LAL)检定内毒素本法利用鲎试剂(从美洲鲎或中华鲎——阿米巴细胞溶解产物制备而来)检测由革兰氏阴性菌产生的细菌内毒素或对内毒素进行定量方法CP(2015) EP(8.0)一、凝胶法二、光度测定法1、浊度法2、显色基质法方法 A:凝胶法:限度试验方法 B:凝胶法:定量试验方法 C:动态浊度法方法 D:终点显色法方法 F:终点浊度法.USP(36) JP(16)仪器CP(2015) EP(8.0) USP(36) JP(16)一、凝胶法二、光度测定法1、浊度法2、显色法一、凝胶法二、光度测定法1、浊度法2、显色法干热灭菌法(250℃, 30 分钟以上),塑料器具应无内毒素并且对试验无干扰干热灭菌法(250℃, 30 分钟以上),塑料器具应无内毒素并且对试验无干扰干热灭菌法(250℃, 30 分钟以上),塑料器具应无内毒素并且对试验无干扰干热灭菌法(250℃, 30 分钟以上),塑料器具应无内毒素并且对试验无干扰溶液制备CP(2015) EP(8.0)供试品溶液的制备某些供试品需进行复溶、稀释或在水性溶液中浸提制成供试品溶液。
必要时,可调节被测溶液( 或其稀释液)的pH值,一般供试品溶液和鲎试剂混合后溶液的pH 值在 6.0-8.0的范围内为宜,可使用适宜的酸、碱溶液或缓冲液调节pH 值。
酸或碱溶液须用细菌内毒素检査用水在已去除内毒素的容器中配制。
缓冲液必须经过验证不含内毒素和干扰因子。
重金属四国药典比较

对照溶液:4ml 250g/l的硫酸镁溶液(稀硫酸溶解硫酸镁),规定量的标准铅溶液(10ppmPb)。
按供试溶液的制备方法,加热灼烧,加盐酸,加酚酞试液,加氨水及冰醋酸等,并用水稀释至20ml。
取10ml的该溶液,加2ml待测液,2ml pH3.5的缓冲溶液,混合。
加1.2ml的硫代乙酰胺试液,立即混合。
监控液:按照供试溶液方法制备,只是在称量样品后需加入10ppm的铅溶液,取该液10ml,加入2ml供试液,加2ml pH3.5的缓冲溶液,混合。
加1.2ml硫代乙酰胺试液,立即混合。
空白溶液:10ml的水,加2ml待测液,2ml pH3.5的缓冲溶液,混合。
加1.2ml硫代乙酰胺试液,立即混合。
如果对照液与空白溶液比较,不显示浅棕色,或者监控溶液所显的颜色浅于对照液的颜色,那么该检测结果无效。
方法D供试溶液:在坩埚内,充分的混合规定量的待测物质和0.5克的氧化镁,灼烧退去暗红色,直至出现同质的白色或灰白色物质。
如果灼烧30分钟后仍有颜色取出冷却,用玻璃棒混和,重复进行灼烧。
如有必要,重复此项操作。
在800℃加热约1小时。
分别制备两份残渣,各加5mL等体积的盐酸和水的混和溶液。
加0.1ml 酚酞试液,然后滴加浓氨水直至出现粉红色。
冷却,加冰醋酸直到溶液褪去颜色,再多加0.5ml 冰醋酸。
如有必要,过滤并冲洗过滤器。
加水稀释至20ml。
对照溶液(标准):按供试溶液的制备方法,用规定量的铅标准溶液(10ppm Pb)代替待测物质并在100-105℃烘箱中干燥。
取10ml的该溶液,加2ml待测液。
监测溶液:按供试溶液的制备方法,向待测物质中加入配制对照溶液规定量的铅标准溶液(10ppm Pb)并在100-105℃烘箱中干燥。
取10ml的该溶液,加2ml待测液。
空白溶液:10ml的水和2ml待测液混合。
向12ml每种溶液中,加入2ml pH为3.5的缓冲溶液。
混合后加1.2ml的硫代乙酰胺试液,立即混合。
ChP、USP、EP、JP、BP对系统适用性的要求
ChP、USP.EP、JP、BP对系统适用性的要求系统适用性是液相和气相色谱方法的重要组成部分,用来确认色谱系统的分离度和重复性能够满足特定的分析要求。
测试是基于将仪器、电路、实验者和样品作为一个整体进行的。
美国药典规定任何色谱试验一定要进行系统适用性测试,否则,这台仪器做出的数据一律无效;ICH 提出一定要将系统作为整体来测试;FDA提到应确定一SOP进行测试确保系统可用;英国药典规定建立系统适用性是为了任何使用方法时都是有效的;欧洲药典提出系统适用性测试反映了色谱系统性能,是建立分析方法不可或缺的一部分;日本药典与美国药典叙述基本一致;GMP指出检查分析方法验证过程时,应涉及是否开发了系统适用性试验,并且对每一项系统适用性试验的参数都进行定义;中国药典并没有单独对系统适用性目的进行叙述,国内色谱工作者往往对系统适用性不够重视,看似简单的系统适用性其实有很多需要关注的地方,其重要性不比方法学中其他验证项差。
一、美国药典系统适用性的要求美国药典并没有明确对分离度、理论塔板数、拖尾因子、重复性及灵敏度的统一要求,在药典正文中各个品种项下分别规定。
当采用标准品或标准品溶液需要重复进样以判断系统的精密度,除非个论中有规定,系统适用性5针的数据的相对标准偏差不得超过2.0%,当超过2.0%时,需要计算连续6针进样的数据。
在含量测定中,系统适用性的相对标准偏差与进样次数和含量限度上限有关,表1是USP对含量系统适用性测试相对标准偏差的规定。
表1USP对含量系统适用性RSD的要求关于对称因子规定参考笔者撰写《拖尾因子、对称因子和不对称因子区别理论》,在此不做赘述。
当系统适用性不符合要求时可以适当调整方法参数,不过每个变量的最大值都应该进行验证其系统适用性,对改变后的方法进行重新评价。
表2是USP对参数调整的规定。
表2USP对系统参数再调整的规定二、欧洲药典和英国药典系统适用性的要求欧洲药典和英国药典对系统适用性要求也做了非常详细的规定,并且对保留时间、保留体积、死体积、死时间等概念做了详细描述。
EP欧洲药典和CP中国药典关于澄清度和溶解度的异同

出自20斤不是肉
1、澄清度检查法 Clarity and Degree of Opalescence
• CP2020 中国药典2020 P124 • EP 9.8 2.2.1
出自20斤不是肉
澄清度——标准
CP
• 品种项下规定的“澄清”,系指供试品溶液的 澄清度与所用溶剂相同,或不超过0.5号浊 度标准液的浊度。“几乎澄清”,系指供试品 溶液的浊度介于0.5号至1号浊度标准液的浊 度之间。
标准液应临用时制备,使用前充分摇匀。
2.2.1.-1. Mix and shake before use.
出自20斤不是肉
2、溶解度 Solubility
• CP 2020 凡例第十五项性状 • EP 9.8 General notices-CHARACTERS
出自20斤不是肉
溶解度
CP
•
•溶 解 度 是 一 种 物 理 性 质 。 各 品 种 项 下 选 用 的 部 分 溶 剂 及 其 在 该 溶 剂中的溶解性能,可供精制或制备溶液时参考;对在特定溶剂中的溶 • 解性能需作质量控制时,在该品种检查项下另作具体规定。相关名 词术语如下:
不同之处:CP的目视法没提到做系统适应性,但是仪器法有做。
出自20斤不是肉
澄清度——浊度标准储备液 Primary opalescent suspension
CP
EP
• Hydrazine sulfate solution:
• 称取于105℃干燥至恒重的硫酸肼1.00g, 置100ml量瓶中,加水适量使溶解,必要时 可在40℃的水浴中温热溶解,并用水稀释至 刻度,摇匀,放置4-6小时;取此溶液与等
EP欧洲药典和CP中国药典关 于澄清度和溶解度的异同
各国药典比较ppt课件

英国药典
• 版本简介
英国 The Stationery Office出版社在 2001年五月出版发行的《英国药典 (2001)》(British Pharmacopoeia 2001) 的最新版本。收录有2760篇医药专论,其 中1305篇出自英国本土;其余1455篇套录 自欧洲药典(European Pharmacopiea) (第三版)。
内容基本介绍
• 英国药典是英国制药标准的重要来源。各
条目均以药品名称字母顺序排列,内容包 括药品性质、制法、血产品、免疫产品、 电磁药品制法及外科材料等部分。英国药 典书后附有全部内容关键词索引。不仅为 读者提供了药用和成药配方标准以及公式 配药标准,而且也向读者展示了许多明确 分类并可参照的欧洲药典专著。英国药典 出版周期不定,最新的版本为2004年的第 21版。
日本药典
• 版本简介
由日本药局方编辑委员会编纂,日本厚 生省颁布执行。分两部出版,第一部收载 原料药及其基础制剂,第二部主要收载生 药,家庭药制剂和制剂原料 。2005年11月 22日,日本厚生劳动省制定了日本药典第 15版,废除日本药典第14版。最新版本 JP15拟定生效日期为2006年4月1日。
各国药典比较
基本介绍 • 药典是通过建立国家技术标准来保证人 类和牲畜使用的药物的质量、剂量和药物纯 度和浓度标准的权威性出版物。它是在专业 的,通常是政府的权威人士的监督下进行编 辑,并且是所有药物的制造、分配和药物治 疗所必须遵照的标准 。 • 目前常用的药典标准有英国药典(BP)、 欧洲药典(EP)、美国药典(USP)、德国 药典(DAP)、日本药典(JP)、中国药典 (CP)。
该药典囊括了几千篇颇有价值医学专 题论文,其中有几百篇是医学新论。它不 仅为读者提供了药用和成药配方标准以及 公式配药标准,而且也向读者展示了所有 明确分类并可参照的欧洲药典专著。对于 制药厂和化学工业、政府管理者、医学研 究院及学习制药的学生都是一部必不可少 的工具书。
药物分析

1.现行《中华人民共和国药典》2010版收载国家药品标准。
内容包括凡例、正文、附录、索引。
凡例是为正确使用《中国药典》进行药品质量检定的基本原则,是对《中国药典》正文、附录、及质量检定有关的共性问题的统一规定。
(内有对溶解度的解释)正文:药典收载的正文就是药品标准。
药典附录:主要收载制剂通则、通用检测方法和指导原则。
一部收载药材和饮片、植物油脂和提取物、成方制剂和单位制剂等,品种共计2165种,包括439个饮片标准;二部收载化学药品、抗生素、生化药品、放射性药品以及药用辅料等,品种共计2271种;三部收载生物制品,共计131种2.中国药典(ChP)的进展:第一版1953年,2005年版开始分3部共9版美国药典(USP)英国药典(BP)欧洲药典(Ph.Eur 或EP)日本药局方(JP)国际药典(Ph.Int)3.GLP:药物非临床研究质量管理规范GCP:药物临床试验质量管理规范GMP:药品生产质量管理规范GSP:药品经营质量管理GAP:中药材生产质量管理规范(试行)4.药品中文名称须按照《中国药品通用名称》CAND收载的名称及其命名原则命名。
药品英文名称除规定外,均采用国际非专利药名(INN)。
IUPAC:国际纯粹与应用化学联合会5.制剂的规格:指每一支、片或其他每一个单位制剂中含有主药的重量(或效价)或含量(%)或装量,即制剂的标示量。
6.原药料的含量(%),如规定上限为100%以上时,系指用现行药典规定的分析方法测定时可能达到的数值,它为药典规定的限度或允许偏差,并非真实含有量;如未规定上限时,系指不超过101.0%7.滴定液和试液的浓度:以mol/L表示者,其浓度要求精密标定液用“XXX滴定液(YYYmol/L)”表示;作其他用途不需要精密标定其浓度时,用“YYYmol/L XXX溶液”表示,以示区别。
8.溶液后记示的“1→10”等符号,系指固体溶质1.0g或液体溶质1.0ml加溶剂使成10ml等的溶液9.0.1g:指0.06-0.14, 2g:指1.5-2.5g 2.0:指1.95-2.05g 2.00:指1.995-2.005g“四舍六入五成双”10.精密称定:称取重量应准确至所取重量的千分之一。
各国药典比较

国际药典(Ph.Int) 国际药典(Ph.Int)
• 基本介绍
由联合国世界卫生组织主持编订。第一版于1951和 由联合国世界卫生组织主持编订。第一版于1951和 1955年分两卷用英、法、西班牙文出版,于1959出版增 1955年分两卷用英、法、西班牙文出版,于1959出版增 补本。第二版于1967年用英、法、俄、西班牙文出版。现 补本。第二版于1967年用英、法、俄、西班牙文出版。现 行版为第三版,于1979、1981、1988年、1994、2003分 行版为第三版,于1979、1981、1988年、1994、2003分 5卷出版,第1卷收载42项分析测试方法。第2、3两卷共 卷出版,第1卷收载42项分析测试方法。第2 收载药品383种。第4 收载药品383种。第4卷收载有关试验、方法的信息,以及 药品原料、赋形剂的一般要求和质量说明,以及剂型。第 5卷收载制剂通则以及药品原料和片剂的质量标准,这实 际上将涵盖目录上的有机合成药物以及一些抗疟疾药物及 其最广泛应用剂型的所有各论。
内容简介
• 美国药典正文药品名录分别按法定药名字
母顺序排列,各药品条目大都列有药名、 结构式、分子式、CAS登记号、成分和含量 结构式、分子式、CAS登记号、成分和含量 说明、包装和贮藏规格、鉴定方法、干燥 说明、包装和贮藏规格、鉴定方法、干燥 失重、炽灼残渣、检测方法等常规项目, 失重、炽灼残渣、检测方法等常规项目, 正文之后还有对各种药品进行测试的方法 和要求的通用章节及对各种药物的一般要 求的通则。可根据书后所附的USP和NF的 求的通则。可根据书后所附的USP和NF的 联合索引查阅本书。
图书版本
• • • • • •
最新版本: 最新版本: USP 33-NF 28重新发行版: 3328重新发行版 重新发行版: 2010年10月 日生效。 2010年10月1日生效。 增补版1 2010年 月出版,2010年10月 增补版1于2010年4月出版,2010年10月1日生效。 增补版2 2010年 月出版,2011年 增补版2于2010年6月出版,2011年1月1日生效。 U.S. Pharmacopeia / National Formulary《美国 Formulary《 药典/国家处方集》(简称USP/NF)。由美国政 药典/国家处方集》(简称USP/NF)。由美国政 府所属的美国药典委员会(The 府所属的美国药典委员会(The United States Pharmacopeial Convention)编辑出版。 Convention)编辑出版。
2010年版《中国药典》和2005年版《中国药典》、《美国药典》31版甲氨蝶.呤质量指标的对比
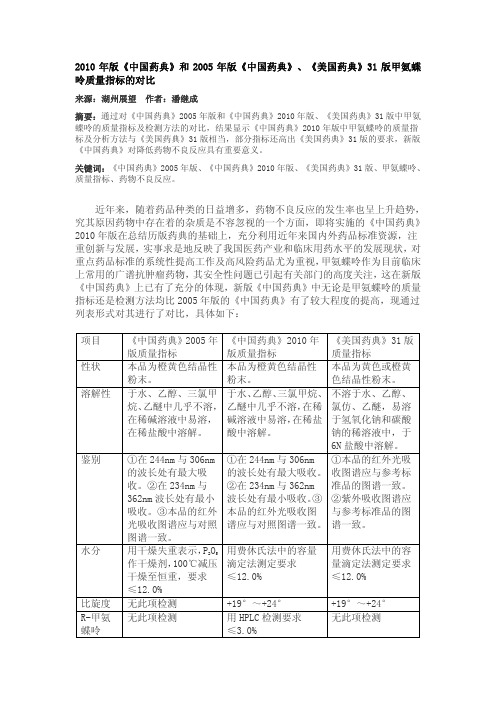
≤12.0%
≤12.0%
无此项检测
+19°~+24°
+19°~+24°
无此项检测
用 HPLC 检测要求
无此项检测
≤3.0%
有关物 质 炽灼残 渣
重金属 含量
单杂质、总杂质: 无此项检测 无此项检测
无此项检测 HPLC 法以干燥品计 ≥90.0%
单杂质:≤0.5% 总杂质:≤2.0% 于 700~800℃炽灼至 恒重,要求≤0.1%
362nm 波长处有最小 波长处有最小吸收。③ ②紫外吸收图谱应
吸收。③本品的红外 本品的红外光吸收图 与参考标准品的图
光吸收图谱应与对照 谱应与对照图谱一致。 谱一致。
图谱一致。
用干燥失重表示,P2O5 用费休氏法中的容量 用费休氏法中的容
作干燥剂,100℃减压 滴定法测定要求
量滴定法测定要求
干燥至恒重,要求 ≤12.0%
2010 年版《中国药典》和 2005 年版《中国药典》、《美国药典》31 版甲氨蝶 呤质量指标的对比
来源:湖州展望 作者:潘继成
摘要:通过对《中国药典》2005 年版和《中国药典》2010 年版、《美国药典》31 版中甲氨 蝶呤的质量指标及检测方法的对比,结果显示《中国药典》2010 年版中甲氨蝶呤的质量指 标及分析方法与《美国药典》31 版相当,部分指标还高出《美国药典》31 版的要求,新版 《中国药典》对降低药物不良反应具有重要意义。
要求≤50PPm HPLC 法以无水物计为 98.0%~102.0%
单杂质:≤0.5% 总杂质:≤2.0% 于 800±25℃下炽 灼至恒重,要求 ≤0.1% 无此项检测 HPLC 法以无水物计 为 98.0%~102.0%
中国药典与美英药典微生物限度比较

大豆酪蛋白消 化ห้องสมุดไป่ตู้养基 35~37℃24~48 h
增菌
大豆酪蛋白消化培养基 35~37℃18~48h
Cetrimide琼脂,培养18~72h 大豆酪蛋白消化培养基 41~43℃ 18~48h。薄膜过滤 大豆酪蛋白消化培养基18~48h, Cetrimide琼脂平板
分离
Cetrimide琼 脂 35~37℃72h 3种
BL增菌培养基 35~37℃18~24 h
BP I法 1 pH7.0氯化钠蛋白胨缓冲液 大豆酪胨肉汤 35~37℃18~48h Mac 肉汤 43~45℃18~24h Mac.琼脂平板 35~37℃18~72h +
USP IMViC法 10 乳糖液体培养基
MI法 1 09%氯化钠溶 液
乳糖液体培养基 35~37℃24~48h Mac 、 EMB 琼 脂 平板 35~37℃24~48h +
乳糖肉汤
1份80℃10min 另1份不加热 100ml 梭 菌 增 菌 培 养 基 35~37℃厌氧48h 含和不含庆大霉素哥 伦比亚琼脂平板 35~37℃48h
分离
过氧化氢酶 试 验
+
+
12.结果判断及复试 CP BP USP
中国药典与BP、EP、JP中溶解度规定比较

中国药典、BP、EP、JP中溶解度规定描述总结我们在查文献时,对英文或日文中的溶解度描述常不知对应中国药典的准确翻译是什么,下面汇总各国药典溶解度的对比,大家不会再迷惑:一、快速对比检索中文描述英文描述日文描述 溶解性质极易溶解Very soluble 極めて溶やすい<1 易溶Freely soluble 溶けやすい1to10溶解Soluble やや溶けやすい10to30略溶Sparingly soluble やや溶けにくい30to100微溶Slightly soluble 溶けにくい100to1000 极微溶解Very slightly soluble 極めて溶けにくい1000to10,000 几乎不溶或不溶Practically insoluble, or Insoluble ほとんど溶けない≥10,000二、中国药典2010版二部标准凡例中关于溶解度的规定:溶解度是药品的一种物理性质。
各正文品种项下选用的部分溶剂及其在该溶剂中的溶解性能,可供精制或制备溶液时参考;对在特定溶剂中的溶解性能需作质量控制时,应在该品种检查项下另作具体规定。
药品的近似溶解度以下列名词表示:极易溶解 系指溶质1g(ml)能在溶剂不到1ml中溶解;易溶 系指溶质1g(ml)能在溶剂1~不到10ml中溶解;溶解 系指溶质1g(ml)能在溶剂10~不到30ml中溶解;略溶 系指溶质1g(ml)能在溶剂30~不到100ml中溶解;微溶 系指溶质1g(ml)能在溶剂100~不到1000ml中溶解;极微溶解 系指溶质1g(ml)能在溶剂1000~不到10000ml中溶解;几乎不溶或不溶 系指溶质1g(ml)在溶剂10000ml中不能完全溶解。
试验法:除另有规定外,称取研成细粉的供试品或量取液体供试品,置于25℃±2℃一定容量的溶剂中,每隔5分钟强力振摇30秒钟;观察30分钟内的溶解情况,如看不见溶质颗粒或液滴时,即视为完全溶解。
药物分析习题及答案

三、问答题
1. 药品的概念?对药品的进行质量控制的意义?
答: 1)药品是指用于预防、治疗、诊断人的疾病,有目的地调节人的生理机能并规定有适应证或者功能主治、用法用量的物质,是广大人
民群众防病治病、保护健康必不可少的特殊商品。用于预防治疗诊断人的疾病的特殊商品。2)对药品的进行质量控制的意义:保证药品质
ቤተ መጻሕፍቲ ባይዱ
8. 中国药典和国外常用药典的现行版本及英文缩写分别是什么?答: 中华人民共和国药典:Ch.P 、日本药局方:JP、英国药典:BP、美 国药典:USP、欧洲药典:Ph.Eur、国际药典:Ph.Int 9. 药典的内容分哪几部分?建国以来我国已经出版了几版药典? 答: 药典内容一般分为凡例,正文,附录,和索引四部分。建国以来 我国已经出版了九版药典。(1953 年,1963 年,1977 年,1985 年,1990 年,1995 年,2000 年,2005 年,2010 年) 10.简述药物分析的性质?答: 它主要运用化学,物理化学,或生物化学的方法和技术研究化学结构已明确的合成药物或天然药物及其制 剂的质量控制方法,也研究有代表性的中药制剂和生化药物及其制剂的质量控制方法。 11.试述质量标准的定义 答:药品质量标准是国家对药品质量、规格及检验方法所作的技术规定;是药品生产、供应、使用、 检验和药 政管理部门共同遵循的法定依据。 12.制定药品质量标准的原则是什么? 答:必须坚持“科学性、先进性、规范性、权威性”质量第一,充分体现“安全有效、技术先进、 经济合理、不断完善”的原则。制订出既符合我国国情,又具较高水平的药品质量标准。
(1)英国药典
(B)
(2)良好药品实验研究规范 (C)
第二章 药物的鉴别试验
一、选择题
1. 下列叙述中不正确的说法是 () (A)鉴别反应完成需要一定时间 (B)鉴别反应不必考虑“量”的问题 (C)鉴别反应需要有一定的专属性 (D)鉴别反应需在一定条件下进行 (E)温度对鉴别反应有影响
经典药学专业知识一常考题50题(含答案

经典药学专业知识一常考题50题(含答案)单选题1、药源性疾病的防治原则不包括A加强认识,慎重用药B加强药品的监督管理C加强临床药学服务D加强医药科普教育E尽量使用新药答案:E药源性疾病的防治 1.加强认识,慎重用药 2.加强管理 3.加强临床药学服务 4.坚持合理用药5.加强医药科普教育 6.加强药品不良反应监测报告制度单选题2、片剂中常作润滑剂的是A氟利昂B可可豆脂C羧甲基纤维素钠D滑石粉E糊精答案:D常用润滑剂:硬脂酸镁、微粉硅胶、滑石粉、氢化植物油、聚乙二醇类、十二烷基硫酸钠等。
单选题3、既可以作为片剂的填充剂(稀释剂),也可以作为粉末直接压片的黏合剂的是A乙基纤维素B醋酸纤维素C羟丙基纤维素D低取代羟丙基纤维素E微晶纤维素答案:E微晶纤维素(MCC)具有较强的结合力与良好的可压性,亦有“干黏合剂“之称。
单选题4、局部用散剂通过七号筛的细粉重量不应低于A可溶性颗粒B混悬颗粒C泡腾颗粒D缓释颗粒E控释颗粒答案:C泡腾颗粒系指含有碳酸氢钠和有机酸,遇水可放出大量气体而呈泡腾状的颗粒剂。
泡腾颗粒中的药物应是易溶性的,加水产生气泡后应能溶解。
有机酸一般用枸橼酸、酒石酸等。
单选题5、下列属于欧洲药典的缩写的是AUSPBBPCChPDEPEJP答案:DUSP是美国药典;EP是欧洲药典;BP是英国药典;JP是日本药典;ChP是中国药典。
单选题6、某患者,男,58岁,肺癌晚期,为缓解疼痛医生开具吗啡控释片。
如果按照致依赖性药物的分类,吗啡属于A阿片类B可卡因类C大麻类D中枢兴奋药E致幻药答案:A致依赖性药物分类如下:(1)麻醉药品:①阿片类,包括阿片粗制品及其主要生物碱吗啡、可待因、二乙酰吗啡即海洛因、哌替啶、美沙酮、芬太尼等;②可卡因类,如可卡因;③大麻类,如印度大麻。
(2)精神药品:①镇静催眠药和抗焦虑药,如巴比妥类和苯二氮(艹卓)类;②中枢兴奋药,如苯丙胺、右苯丙胺、甲基苯丙胺(冰毒)、亚甲二氧基甲基苯丙胺(摇头丸);③致幻药,如麦角二乙胺、苯环利定、氯胺酮。
中国药典和欧洲药典中关于溶液的澄清度和颜色检查的异同比较

中国药典和欧洲药典中关于溶液的澄清度和颜色检查的异同比较发布日期20060717栏目化药药物评价>>化药质量控制标题中国药典和欧洲药典中关于溶液的澄清度和颜色检查的异同比较作者张震部门正文内容审评四部审评八室张震关键词:中国药典,欧洲药典,溶液的澄清度和颜色,异同摘要:本文对中国药典2005年版和欧洲药典第5版中溶液的澄清度和颜色检查进行了异同比较,在以欧洲药典或某些进口标准为依据进行药品研发以及药品审评工作中时应注意其中的差别,不能简单套用。
溶液的澄清度和颜色检查是控制原料药和注射剂质量的重要指标,能在一定程度上反映药物的纯度,中国药典(以下简称CP)和欧洲药典(以下简称EP)中皆纳入了该项检查。
但不同药典中对溶液的澄清度和颜色检查的方法和限度仍有所差别,因而在以EP或某些进口标准为依据进行药品研发以及药品审评工作中时应注意其中的差别,并进行相应的修改,不能简单套用。
下文对CP2005年版和EP第5版中溶液的澄清度和颜色检查的异同进行了比较。
一、溶液的澄清度(CP2005二部附录IX B;EP5方法2.2.1)1、比较系统:CP和EP中皆采用1%硫酸肼溶液-10%乌洛托品溶液(1:1)的混合溶液作为浊度标准原液,皆采用目测法,二者没有区别。
2、浊度级号设置:CP中设置了1~4号浊度标准液,对应于EP 中的I~IV号浊度标准液,相同浊度级号(如:4号或IV号)的配制方法完全相同;不同之处在于CP还设置了0.5号浊度标准液,而EP 中则未设置该浊度级号。
3、“澄清”判定:CP中规定:“供试品溶液的澄清度与所用溶剂相同,或未超过0.5号浊度标准液”,则判为“澄清”;而EP中则规定“供试品溶液的澄清度与所用溶剂相同,或未超过I号浊度标准液”。
CP中的“澄清”的较EP更为严格,要求我们在进口药的审评中对这点进行关注。
二、溶液的颜色(CP2005二部附录IX A;EP5方法2.2.2)CP中溶液的颜色检查法分为第一法(比色法)、第二法(分光光度法)和第三法(色差计法),其中比色法为较常用的方法,而分光光度法和色差计法较少使用,这里不作重点讲述;而EP中颜色检查法仅有比色法。
中国药典的化学对照品

中国药典的化学对照品摘要:药品检验是验证药品质量的一个重要手段,是国家药品监督保证体系的重要组成部分,在保障药品安全有效方面有着重要的不可替代的作用。
在药品检验工作中我们常会用到一种用来检查药品质量的特殊参照物——药品标准物质(标准品或对照品),以它作为确定药品真伪优劣的对照标准。
药品标准物质在药品检验中具有十分重要的地位。
随着仪器分析的广泛使用,必将越来越多地使用药品标准物质。
笔者就化学对照品的类别、制备、标化、发放、保存和使用等作一简介。
关键词:中国药典化学对照品药品检验药品标准物质l 标准品与对照品1.1 标准品标准品系指用于生物检定、抗生素或生化药品中含量或效价测定的标准物质,按效价单位(或g)计,以国际标准品进行标定。
例如卡那霉素标准品、胰岛素标准品、凝血酶标准品等。
1.2 对照品对照品系指用于化学合成药物及中药有效成分测定的标准物质,包括杂质对照品,但不包括色谱法中的内标物质。
例如水杨酸对照品、地高辛对照品、环丙沙星对照品等。
2 对照品的分类根据用途,对照品可以分为以下5类:(1)鉴别用对照品。
用于药品鉴别项下的红外、薄层色谱等的鉴别。
(2)检查用对照品。
用于药品检查项下有关物质、溶出度及含量均匀度的检查。
一般情况下,鉴别检查用对照品的纯度应不低于99.0%。
(3)含量测定用对照品。
用于含量测定,纯度要求较高。
一般情况下,含量测定用对照品的纯度应不低于99.5%。
(4)熔点标准品。
为一系列具有不同熔点的标准物质,用于熔点温度计的校正。
例如偶氮苯(熔点69℃)、磺胺(熔点166℃)、双氰胺(熔点210.5℃)、糖精(熔点229℃)、酚酞(熔点263℃)等。
(5)溶出度校正片。
为特殊制备的某种药片,通常为水杨酸校正片,用于溶出度仪的校正及实验操作技术的校正。
3 对照品的来源与制备对照品通常来源于原料药的精制品,其中:(1)国内对照品:由国内生产厂家提供精制原料,再经中检所精制、标化和分发。
药分

中国药典Phar macopoeia of the People's Republic of China (Ch.P)美国药典the Pharmacopoeia of the United States of American (USP)美国国家处方集National formulation (NF)英国药典BP 日本药局方JP 欧洲药典Ph.Eur药典内容:凡例正文附录索引凡例内容:1、记载项目:外观嗅味溶解度物理常数近似溶解度以下列名词表示:极易溶解:溶质1g(ml)能在溶剂不到1ml中溶解易溶:1g(ml)——1~10ml 溶解:1g(ml)——10~30ml略溶:1g(ml)——30~100ml 微溶:1g(ml)——100~1000ml极微溶解:1g(ml)——1000~10000ml几乎不溶或不溶:溶质1g(ml)在溶剂10000ml中不能完全溶解2、有关检验方法和限度的规定有效数字——4舍6入5留双原料药含量(%):如规定上限为100%以上指测定时可能达到的数值,为药典规定的限度或允许偏差,并非真实含有量;如未规定上限,指不超过101.0%3、标准品指用于生物检定、抗生素或生化药品中含量或效价测定的标准物质,按效价单位计,以国际标准品进行标定;对照品除另有规定,均按干燥品(或无水物)进行计算后使用4、有关计量规定乙醇的百分比,指在20℃时容量的比例;乙醇未指明浓度,均指95%(ml/ml)的乙醇液体的滴指在20℃时,以1.0ml水为20滴进行换算溶液后记示(1→10),指固体溶质1.0g或液体溶质1.0ml加溶剂使成10ml溶液5、有关精确度的规定精密称定:指称取重量应准确至所取重量的千分之一;称定——百分之一精密量取:指量取体积的准确度符合国家标准中对该体积移液管的精确度要求量取:指用量筒或按照量取体积的有效数位选用量具恒重:除另有规定,指供试品连续两次干燥或炽灼后的重量差异在0.3mg以下的重量6、有关试药、试液、指示剂规定:酸碱度检查所用的水,均指新沸并放冷置室温的水。
四国药典有关药品微生物限度标准的比较

四国药典有关药品微生物限度标准的比较微生物限度规定的作用,是为药品生产提供一个标准或指导,以确保药品使用的安全。
各国药典标准分为强制性的和非强制性的可达到的限度标准,这些指标正确、有效地规范了药品生产、检定和监督的程序。
药品要能反映不引起生物降解物和没有药源性污染的微生物存在是必要的,严格控制条件致病菌及致病菌。
一、CP、USP、BP、JP的微生物限度要求的特点及其发展趋势⒈各国药典收载微生物限度检查法的时间不同(见表1)表1 各国药典收载微生物限度检查法的时间各国药典CP USP BP JP收载微生物限度检查法的时间1995版* 1975(19)1973---方法1988---品种**第十三改正版****1978年颁布第一个药品卫生标准;1986年颁布了修改的药品卫生标准;1989年下发药品卫生标准补充规定和说明,1995年版中国药典收载微生物限度检查法(标准仅为少数剂型)**品种98版43个,其中原料药品种38个,制剂品种仅5个。
***仅有6个品种。
⒉品种不断扩大USP版本19(1975)22(1990)23 24(2000)*217种包括原料药品种72个(占1/3);制剂品种(占2/3)。
⒊活菌数要求各有特点⒋控制菌的要求各有特点a 10g或10ml样品不得检出。
b 1g或1ml 样品不得检出。
c 仅为个别品种要求10~103/1g或1ml。
*d 不列在剂型项内而以说明提出,意即不作为常规检查,如有检出,以不合格处理的依据。
二、稀释剂的种类* pH7.0缓冲氯化钠-蛋白胨水:磷酸二氢钾3.56g,磷酸氢二钠4.30g,蛋白胨(肉胨或酪胨1.0g纯水1000ml/L。
溶解以上成份,加入1~10g 吐温-20或吐温-80。
121℃高压蒸汽灭菌30min。
作用:可调节供试液pH至近中性,其中蛋白胨对菌细胞有保护作用,有利于菌数及控制菌的测定。
吐温加入对含油性供试品的助溶具有作用。
** USP、BP微生物限度(污染)检查用稀释剂,除磷酸盐缓冲液、磷酸盐缓冲胨水外,尚采用以上两种培养基,直接稀释供试品并作增菌培养.。
中国药典与BP、EP、JP中溶解度规定比较

中国药典、BP、EP、JP中溶解度规定描述总结我们在查文献时,对英文或日文中的溶解度描述常不知对应中国药典的准确翻译是什么,下面汇总各国药典溶解度的对比,大家不会再迷惑:一、快速对比检索中文描述英文描述日文描述 溶解性质极易溶解Very soluble 極めて溶やすい<1 易溶Freely soluble 溶けやすい1to10溶解Soluble やや溶けやすい10to30略溶Sparingly soluble やや溶けにくい30to100微溶Slightly soluble 溶けにくい100to1000 极微溶解Very slightly soluble 極めて溶けにくい1000to10,000 几乎不溶或不溶Practically insoluble, or Insoluble ほとんど溶けない≥10,000二、中国药典2010版二部标准凡例中关于溶解度的规定:溶解度是药品的一种物理性质。
各正文品种项下选用的部分溶剂及其在该溶剂中的溶解性能,可供精制或制备溶液时参考;对在特定溶剂中的溶解性能需作质量控制时,应在该品种检查项下另作具体规定。
药品的近似溶解度以下列名词表示:极易溶解 系指溶质1g(ml)能在溶剂不到1ml中溶解;易溶 系指溶质1g(ml)能在溶剂1~不到10ml中溶解;溶解 系指溶质1g(ml)能在溶剂10~不到30ml中溶解;略溶 系指溶质1g(ml)能在溶剂30~不到100ml中溶解;微溶 系指溶质1g(ml)能在溶剂100~不到1000ml中溶解;极微溶解 系指溶质1g(ml)能在溶剂1000~不到10000ml中溶解;几乎不溶或不溶 系指溶质1g(ml)在溶剂10000ml中不能完全溶解。
试验法:除另有规定外,称取研成细粉的供试品或量取液体供试品,置于25℃±2℃一定容量的溶剂中,每隔5分钟强力振摇30秒钟;观察30分钟内的溶解情况,如看不见溶质颗粒或液滴时,即视为完全溶解。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
中国药典、BP、EP、JP中溶解度规定描述总结我们在查文献时,对英文或日文中的溶解度描述常不知对应中国药典的准确翻译是什么,下面汇总各国药典溶解度的对比,大家不会再迷惑:
一、快速对比检索
中文描述英文描述日文描述溶解性质
极易溶解Very soluble 極めて溶やすい<1 易溶Freely soluble 溶けやすい1to10
溶解Soluble やや溶けやすい10to30 略溶Sparingly soluble やや溶けにくい30to100 微溶Slightly soluble 溶けにくい100to1000 极微溶解Very slightly soluble 極めて溶けにくい1000to10,000 几乎不溶或不溶Practically insoluble, or Insoluble ほとんど溶けない≥10,000
二、中国药典2010版二部标准凡例中关于溶解度的规定:
溶解度是药品的一种物理性质。
各正文品种项下选用的部分溶剂及其在该溶剂中的溶解性能,可供精制或制备溶液时参考;对在特定溶剂中的溶解性能需作质量控制时,应在该品种检查项下另作具体规定。
药品的近似溶解度以下列名词表示:
极易溶解系指溶质1g(ml)能在溶剂不到1ml中溶解;
易溶系指溶质1g(ml)能在溶剂1~不到10ml中溶解;
溶解系指溶质1g(ml)能在溶剂10~不到30ml中溶解;
略溶系指溶质1g(ml)能在溶剂30~不到100ml中溶解;
微溶系指溶质1g(ml)能在溶剂100~不到1000ml中溶解;
极微溶解系指溶质1g(ml)能在溶剂1000~不到10000ml中溶解;
几乎不溶或不溶系指溶质1g(ml)在溶剂10000ml中不能完全溶解。
试验法:除另有规定外,称取研成细粉的供试品或量取液体供试品,置于25℃±2℃一定容量的溶剂中,每隔5分钟强力振摇30秒钟;观察30分钟内的溶解情况,如看不见溶质颗粒或液滴时,即视为完全溶解。
三、EP中对溶解度试验方法和定义规定
European Pharmacopoeia7.0关于溶解度的规定:
SOLUBILITY
For this test a maximum of 111 mg of substance (for each solvent) and a maximum of 30 ml of each solvent are necessary.
Dissolving procedure
Shake vigorously for 1 min and place in a constant temperature device, maintained at a temperature of
25.0 ± 0.5 °C for 15 min. If the substance is not completely dissolved, repeat the shaking for 1 min and place the tube in the constant temperature device for 15 min.
Method
Weigh 100 mg of finely powdered substance (90) (2.9.12) in a stoppered tube (16 mm in internal diameter and 160 mm long), add 0.1 ml of the solvent and proceed as described under Dissolving Procedure. If the substance is completely dissolved, it is very soluble.
If the substance is not completely dissolved, add 0.9 ml of the solvent and proceed as described under Dissolving Procedure. If the substance is completely dissolved, it is freely soluble.
If the substance is not completely dissolved, add 2.0 ml of the solvent and proceed as described under Dissolving Procedure. If the substance is completely dissolved, it is soluble.
If the substance is not completely dissolved, add 7.0 ml of the solvent and proceed as described under Dissolving Procedure. If the substance is completely dissolved, it is sparingly soluble.
If the substance is not completely dissolved, weigh 10 mg of finely powdered substance (90) (2.9.12) in a stoppered tube, add 10.0 ml of the solvent and proceed as described under Dissolving Procedure. If the substance is completely dissolved, it is slightly soluble.
If the substance is not completely dissolved, weigh 1 mg of finely powdered substance (90) (2.9.12) in a stoppered tube, add 10.0 ml of the solvent and proceed as described under Dissolving Procedure. If the substance is completely dissolved, it is very slightly soluble.
所以欧洲药典的溶解度与中国药典是等同,但又不完全等同中国药典,因为试验方法略有不同O(∩_∩)O~
四、BP中对溶解度试验方法和定义规定
General Notices Part II
Solubility
The following table indicates the meanings of the terms used in statements of approximate solubilities.
Descriptive term Approximate volume of solvent in millilitres per gram of solute
very soluble less than 1
freely soluble from 1 to 10
soluble from 10 to 30
sparingly soluble from 30 to 100 对应Ch.P凡例,应该是“略溶”
slightly soluble from 100 to 1000
very slightly soluble from 1000 to 10 000
practically insoluble more than 10 000。
