第四讲过渡元素-2015
第四讲+广播电视的媒介构成、传播特性及节目类型

北京大学继续教育学院广播电视概论课程第四讲广播电视的媒介构成、传播特性与节目类别一、广播电视的传播符号◆声音◆图像◆文字(一)声音◆声音的类别:◆语言◆音乐◆音响1.语言——内容的主要载体◆狭义层面上的语言,主要是指广播电视中的口头表达语言◆是最基本、最直接、最主要的表现手段◆最大特征是以时间顺序为线索(线性结构)语言的三种基本形态◆播音、解说语言◆新闻报道语言◆实况语言新闻播音语言◆所谓新闻播音语言是指新闻信息传播机构中承担向受众口头传播语言信息(即播音)工作的人在播讲稿件时使用的语言。
◆特点:◆与信息发出者的关系:非模仿性语言再现◆与语境的关系:非现场单向传播◆信息形式:规范性信息新闻播音语言的3种表达样式◆播报式◆上个世纪50年代到60年代,播音员的语速是每分钟160到180字,到了1980年代就变成了每分钟220字到240字,1990年代以后,变成了每分钟280字◆邢质斌 329◆张宏民 350◆李瑞英 265◆李修平 343◆罗京 280◆徐俐 340◆宣读式讲述式陈鲁豫陈晓楠新闻报道语言◆新闻信息传播机构中承担信息采集、编辑报道工作的人为报道新闻而播讲报道词、解说词时使用的语言◆区别于播音语言◆规范性标准相对降低◆采编一体化的结果3.实况语言◆实况语言是现实事件及采访活动中发生的语言事实,具有原始的真实性。
◆其本质是口语与信息源的同一性。
◆两大类别:◆与采访语境无内在关联的采访活动引发的语言——实况语言◆被事件包容的和与采访语境存在内在关联的语言——现场实况语言2.音乐节目音乐的作用:◆通过节目配乐,强化内容的情感、情绪力度,烘托气氛◆作为编辑手段,凸显、整合节目,创造蒙太奇效果◆作为节目的声音标志◆作为节目的间隔或过渡◆填充时间空档3.音响音响可以分为实况音响和音响效果两种实况音响的作用:(1)再现事实的声音感性形态,提供可感受的具体事实信息,增强传播效果。
(球场、会场上的背景声)(2)具有一定的叙述作用(3)与语言、音乐、文字、图像同步或相继各自传播不同时空的信息,创造蒙太奇效果实况音响的作用(4)实况音响可以突破视像的框限,拓展空间,增大信息容量(5)音响的连贯性可以削弱镜头衔接产生的断裂感,使信息传达与接受更为顺畅。
过渡元素课件

Cr3+的配合物有数千种,绝大多数配位数:6 常见的是:[Cr(H2O)6]3+, 配合物多有颜色
[Cr(H2O)6 ]Cl2紫色 [Cr(H2O)5Cl]Cl2 H2O蓝绿色
[Cr(H2O)4Cl2 ]Cl 2H过渡2元O素绿色
18
12.2.4 铬(Ⅵ)盐 1. Cr2O72-与CrO42-间的转化
4.形成多种配合物
过渡元素
11
12.1 过渡元素通性
过渡元素
12
12.1 过渡元素通性
5.催化性
许多过渡元素及其化合物具有独特的催化性能,Pt,Pd, Fe,Cu,V,…..,PdCl2 , V2O5….等常用的催化剂
6.磁性
多数过渡金属原子或离子有未成对电子,具有顺磁性,未 成对电子数越多,磁矩越大
Sc
Ti
Eθ M 2 /M
/
V
可溶该金属 的酸 元素
---
各种酸 Fe
-1.63
热 HCl HF Co
E / V θ M2 /M
可溶该金属 的酸
-0.44
稀 HCl H2SO4 等
-0.29
缓溶解在 HCl 等酸中
V -1.2 (估算值) HNO3,HF 浓 H2SO4 Ni
-0.25
稀 HCl H2SO4 等
Cr 2H (稀) Cr2( 蓝) H2
O2 Cr3 (紫)
2Cr
2H 2SO 4
(浓)
Cr(2 SO
)
43
3SO2
H2O
在冷、浓硝酸中钝化
2. 铬(Ⅲ)的化合物
(1)Cr2O(3 铬绿) ——两性氧化物 制备:4Cr 3O2 Δ 2Cr2O3
第九章 过渡元素

Cu(OH)2 氢氧化铜为浅兰色粉末,难溶于水,稍有两性,易溶于酸, 只溶于较浓的强碱。 Cu(OH)2 + 2OH[Cu(OH)]2-
9.2.3 银的化合物 银通常形成氧化值为+1的化合物,其中只有AgNO3易溶于水其他如Ag2O、 卤化银等均难溶。银的化合物有不同程度的感光性,银和许多配体易形成配合物。 硝酸银 AgNO3是最重要的可溶性银盐,用途广泛。它在干燥的空气中比较稳 定,潮湿状态下易见光分解,析出单质银而变黑
(1) 氧化铜和氢氧化铜 CuO 氧化铜为黑色粉末,难溶于水。它是偏碱性氧化物,溶于稀酸: CuO + 2H+ Cu2+ + H2O
由Cu(NO3)2或Cu2(OH)2CO3受热分解都能指得CuO:
2Cu(NO3)2 Δ Cu2(#43; 4NO2 + O2 2CuO + CO2 + H2O
第九章
过渡元素
9.1过渡元素的结构特点
过渡元素位于周期表中部d区ⅢB(3)—Ⅷ(8)族8个直列24个元素(不包括镧以 外的镧系,锕以外的锕系元素)。表9—1列出了第一过渡系列元素的电子构型
表9—1 第一过渡系列元素的电子构型
过渡元素电子结构的特点是具有未充满的d轨道(Pd例外),最外层 电子为1~2个,最外两个电子层都是未充满的,其特征电子构型为(n-1) d1-9ns1-2。也有把ds区的铜族,锌族元素作为过渡元素,其电子构型为 (n-1)d1-10ns1-2。最近有人只把铜族元素列入过渡元素(而锌族不列 入),因为铜的重要氧化态Cu(Ⅱ)为3d9、Ag(Ⅱ)为4d9、Au(Ⅲ) 为5d8构型,而且它们的性质与过渡元素极为相似,故过渡元素包括铜族 元素较合适。 过渡元素与典型元素不同,周期性变化规律并不明显。如同周期的金 属性递变不显著,原子半径,电离势等随原子序数增加,虽有变化但不显 著,都反映出各元素间从左至右的水平相似性(表4—6)。因之,将这些 过渡元素按周期分为三个系列。位于周期表中第四周期的Sc—Ni为第一过 渡系列元素;第五周期中的Y—Pd为第二过渡系列元素;第六周期中的 La—Pt为第三过渡系列元素。习惯上把第一过渡系列元素称为轻过渡元素, 把第二、第三过渡系列称为重过渡元素。本节主要讨论第一过渡系列元素。
过渡元素

简介
综合介绍
信息介绍
性质特征
信息介绍
周期表中从IIIB族到VIII族的元素。共有三个系列的元素(钪到镍、钇到钯和镧到铂),电子逐个填入他 们的3d、4d和5d轨道。有时人们把过渡元素的范围扩大到包括镧系元素和锕系元素。因此有时也把铜族元素包括 在过渡元素范围之内。锌族元素(IIB)形成稳定配位化合物的能力上与过渡元素很相似,因此也有人建议把锌 族元素归入过渡元素范围。各系列过渡元素的与阿兹半径自左而右缓慢递减,各族元素的半径自上而下略有增加, 但不像主族元素增加的那样显著。
制作模式
过渡金属大多有其独特的生产方法:电解法、金属热还原法、氢还原法和碘化物热分解法。 存在: 大多数过渡金属都是以氧化物或硫化物的形式存在于地壳中,只有金、银等几种单质可以稳定存在。
催化剂
过渡金属催化剂或是生命起源的关键
要解释生命如何在地球上出现这个悬而未决的大问题,就像是回答先有鸡还是先有蛋的悖论:诸如氨基酸和 核苷酸这样的基本生化物质,是如何在生物催化剂(蛋白质或核酶)出现之前而完成其构造的?在最新一期《生 物学通报》上,科学家发表论文指出,或是第三种类型的催化剂启动了深海热泉中的新陈代谢以及生命。
原子结构
原子构型
原子半径
原子构型
过渡元素原子电子构型的特点是它们的d轨道上的电子未充满(Pd例外),最外层仅有1~2个电子,它们的 价电子构型为(n-1)d1-9ns1-2(Pd为4d5s)。
过渡元素原子的价电子层结构和氧化态 注:划横线的表示比较常见、稳定的氧化态;带括号的表示不稳定的氧化态。 多电子原子的原子轨道能量变化是比较复杂的,由于在4s和3d、5s和4d、6s和5d轨道之间出现了能级交错 现象,能级之间的能量差值较小,所以在许多反应中,过渡元素的d电子可以部分或全部参加成键。
过渡元素的性质介绍

③、2VOCl3+3H2O==V2O5+6HCl
性 砖红色,无臭,无味,有毒,针状晶体, 质 微溶于水,两性片酸性氧化物,易溶于碱。
V2O5+2NaOH ==2NaVO3+H2O
此反应用于鉴定12MoO42-离子。
其它的杂多酸的结构和 一些性质见P971-973 (略)。
5-1 锰元素的概述
1、存在:
软锰矿(MnO2·xH2O),黑锰矿(Mn3O4), 水锰矿(MnO(OH))和锰结核(海底)。 丰度为0.085%。
二、常见氧化态
Mn有多种氧化态 +2、+3、+4、+6、+7, 在某些配位化合物中还显低氧化态+1、 0、-1、-2和-3。
为什么Ti 4+所形
成的配合物都没
在Ti(Ⅳ)与H2O2则可形成有色有的颜色配?合?物, 强酸溶液中显红色稀酸或中性溶液显橙 色配合物[TiO(H2O2)]2+:
TiO2+ + H2O2 == [TiO(H2O2)]2+ 可利用此反应测定钛。
注意: 在溶液中不存在简单 的Ti(H2O)64+,只存 在[Ti(OH)2(H2O)4]2-可简写 为[TiO(H2O)5]2+称为钛酰离子。
②、TiOSO4+2H2O=H2TiO3↓+H2SO4
或Ti(SO4)2+H2O=TiOSO4+H2SO4
③、H2TiO3==TiO2+H2O(煅烧)
④、TiO2+2C+2Cl2==TiCl4+CO↑(△)
⑤、TiCl4+2Mg=2MgCl2+Ti (△)
过渡元素
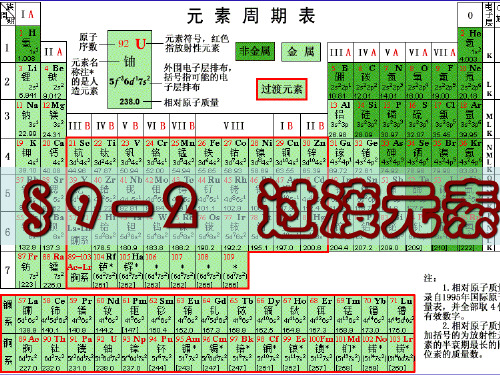
2、分类
为了讨论的方便,可以根据过渡元素的综合化学性质进行分类:
★周期表
位置
前过渡元素:IVB-VIIB,不包括Mn,位于d区前部, 其特征是其高价离子在水溶液中常发生聚合作用。 后过渡元素: Mn到Cu,第一过渡系的后部,其特点 是以水溶液化学和配位化学为其特征。
(1) Cr2O3(铬绿) 微溶于水, 具有-Al2O3的结构
[制备]
4Cr 3O2 2Cr2O3 ( NH 4 )2 Cr2O7 Cr2O3 N 2 4 H 2O
[两性]
Cr2O3 6 H 2Cr 3 3H 2O
亚铬盐(紫色)
3H 2O Cr2O3 2OH 2Cr (OH ) 4 亚铬酸盐(绿色)
★贵金属元素:Ⅷ的第五、六周期元素有:Ru、Rh、Pd,Os、 Ir、Pt,再加上Ag、Au,特征:丰富的配位化学。 ★不同 周期
★电子进
第四周期:第一过渡系,又称轻过渡元素;
第五、第六周期:第二、三过渡系,又称重过渡元素。
第一、第二和第三过渡系总称为“主过渡元素”;
f区元素称为“内过渡元素”。
入轨道
3)过渡元素的多变氧化态
过渡元素一般都有多变的氧化态。 如:Fe有+2、+3、+6 三种氧化态(FeO、Fe2O3、Na2FeO4等) Cr有+2、+3、+6 三种氧化态(CrO、Cr2O3、CrO3等) Mn有+2、+3、+4、+6、+7 多种氧化态(MnO、Mn2O3、 MnO2、K2MnO4、KMnO4等)
第一过渡系
过渡金属元素讲课文档

第7页,共134页。
配体异构:
例:组成为CrCl3·6H2O的配合物有三种结构 异构体:
[Cr(H2O)6]Cl3(紫色) [CrCl(H2O)5]Cl2·H2O(灰绿色) [CrCl2(H2O)4]Cl·2H2O(深绿色)
o/cm-1 17600
14000 13600 19200
[Co(H2O)6]3+ [CoF6]3- [Co(NH3)6]3+ [Co(CN)6]3-
o/cm-1 13000 18600 22900
34000
四面体场 4.45 Dq
第3页,共134页。
10.1.1 配合物的空间构型
配合物的空间构型:
把围绕中心原子的配位原子看作点,并以线(注 意并非实际存在的共价键)连接各点,得到的多面体 就称为配位多面体。通常用配位多面体用来描述配合 物的空间构型。
配合物分子或离子因配位数的不同,为了形成 稳定的结构,采取一定的空间构型。所以配合物
异构体数目 1
2
2
3
第10页,共134页。
例: 八面体配合物[CoCl2(NH3)4]
[CoCl2(NH3)4] 顺式
[CoCl2(NH3)4] 反式
正八面体配合物几何异构体的数目
类型
MA5B MA4B2 MA3B3 MA3B2C MA2B2C2
异构体数目 1
2
2
3
5
第11页,共134页。
面式-[Co(NH3)3(NO2)3]
第27页,共134页。
例:根据价键理论分析下列配离子的结构,并完成下 表。
过渡元素

油状 绿色
MnO2+O2+O3
MnO42- +CO2 MnO2 + CO2 Mn2++CO2
由软锰矿制备KMnO4
软锰矿 粉碎
氧化剂
OH- △
K2MnO4 墨绿色
常用的氧化剂有O2、KNO3和KClO3。反应介质为KOH或K2CO3。
2MnO2+4KOH+O2 == 2K2MnO4+2H2O 3MnO2+6KOH+KClO3 == 3K2MnO4+KCl+3H2O MnO2+K2CO3+KNO3 == K2MnO4+KNO2+CO2↑
过渡元素的通性
具有部分填充d或f壳层电子的元素。 狭义:(n-1)d1~8ns1~2 ⅢB~Ⅷ 8列 10列
广义:(n-1)d1~10ns1~2 ⅢB~ⅡB
过渡元素全部为金属,其化合物颜色多、 变 价多、形成配合物多。
• (n-1)d1~10ns1~2 (Pd:4d105s0) • d电子数较多. • d电子可部分或全部成键. • d轨道未充满可接受孤电子
1.33V -0.41V -0.91V 2-————Cr3+————Cr2+————Cr
Ea
θ:
Cr2O7
酸性介质氧化性强,碱性介质还原性强
Cr2O7
酸 性 Cr3+ 介 质 MnO 4-+H+
Ag+
2- +ຫໍສະໝຸດ SO42-S2O82-
H2O2 碱 性 CrO2- 介 质 Br2
CrO42-+H2O
第四讲 碱 金 属(高三第一轮复习学案教案、习题大全)

第四讲碱金属主讲人车琳(甘肃省清水县第六中学)高考考点1、掌握钠及钠的重要化合物的重要性质及用途。
2、掌握碱金属元素的相似性及递变规律。
3、了解碱金属离子的检验方法——焰色反应。
本讲序列【阅读议点】一.金属元素总述目前周期表中共有种元素,其中金属元素有种,位于周期表的____,碱金属位于第__族,ⅡA族为碱土金属,___和___族统称为过渡元素或过渡金属。
1.金属单质的物理性质(1)通性:具有___,不透明,__、__性和__性.绝大多数金属为__色,例外的有_____.金属粉末的颜色又有变化,如铁粉、银粉为__色,锌粉、铝粉为__色.(2)金属之最:①应用最广__;②地壳中含量最多__;③最活泼__、最稳定__;④密度最小__;⑤熔点最高__;⑥熔点最低___;⑦硬度最大__;⑧导电性最强__;⑨延展性最好___。
2.判断金属活动性的方法:①金属与水或酸反应越剧烈,则金属越___②金属元素的最高氧化物对应的水化物的碱性越强,则金属越___;③一种金属能从另一种金属盐的溶液(或熔融盐)中将其置换出来,则该金属比另一金属___;④两种金属能构成原电池时,做负极的金属比做正极的金属___;⑤在电解过程中,一般地先得电子的金属阳离子对应的金属比后得电子的金属阳离子对应的金属____。
3.金属的冶炼①电解法——冶炼金属。
如:等;写出制备Na、Mg ________________________。
②还原法——冶炼金属,如等,常用的还原剂有_____等。
【问题讨论】例1:有四种金属A、B、C、D,将C置于A的盐溶液中放出无色气体且生成A的氢氧化物,若将B、D用导线连接后插入硝酸银溶液中,则在B上析出银;由A、D组成的合金放置在潮湿的空气中,A先腐蚀。
判断A、B、C、D的还原性由强到弱的顺序是()A.A C B D B.B D A C C.C B A D D.C A D B例2:下列金属氧化物跟铝粉混和后不能构成铝热剂的是()A.MnO2B.Fe2O3C.MgOD.Cr2O3③加热法——常用于冶炼金属。
第四讲 碳族元素分解

适量OHH+
α
-
H2SnO3 (s,白)
放
置
Sn 浓HNO3β - H2SnO3 (s,白)
不溶于酸或碱
Sn 4HNO3(浓) β-H2SnO3 4NO2 H2O
12
Sn(II)的强还原性
Sn2 2HgCl 2 4Cl- Hg 2Cl2 (s,白) SnCl62Sn2 Hg 2Cl2 4Cl- 2Hg(l,黑) SnCl62Sn2 2Fe3 Sn4 2Fe2 2Bi(OH) 3 3[Sn(OH)4 ]2- 2Bi(s,黑) 3[Sn(OH)6 ]2-
多数难溶:PbCl
2,PbI
2,PbSO
4,PbCO
等
3
(重难点)
PbCl
溶于热水,也溶于盐酸
2
:
PbCl 2 2HCl H2[PbCl 4 ]
PbSO
溶于浓硫酸,生成
4
Pb(HSO
4
)2。
PbI
溶于浓
2
KI
溶液中。
16
Pb2+的鉴定:
Pb2 CrO24Pb 2H2S 2PbS 4H2O2
第四讲 碳族元素
4.1 碳族元素概述 4.2 碳族元素的单质 4.3 碳的化合物 4.4 硅的化合物 4.5 锡、铅的化合物
1
4.1 碳族元素概述
碳族(IVA):C, Si, Ge, Sn, Pb
典型非金属 准金属 典型金属
价电子构型:ns2np2
主要氧化值
0、+2、+4
2
4.2 碳族元素的单质
C:sp杂化
:O C
O
:Π
4 3
4
4.3 碳的化合物 2.碳酸及其盐
过渡元素

(3)还原法
原理:用还原剂还原化合物(如氧化物等)来制取单 质,一般常用的还原剂是焦炭,CO、H2、活泼金属等。
例: 高炉炼铁: Fe2O3+3CO 2Fe+3CO2 铝热剂法: Fe2O3+2Al 2Fe+Al2O3 应用范围:用于制取活泼性不是很强的金属及以正氧 化值存在的非金属单质。 氧化物能否被还原,可以用消耗1mol O2生成氧化物过 程的△G变化对温度作图(见p322图8-5,Ellingham图)来 分析。 一些金属还可以从卤化物中用还原法提取,也可采用 电解、水溶液电积等方法提取。
0 5 10 15 20 24
3d
r/a0
8.2.2(n-1)d与ns轨道能级高低
▲ 电子组态:由n,l表示的电子排布方式。 ● 多电子原子核外电子的填充顺序:
1s,2s,2p,3s,3p,4s,3d,4p,5s,4d,5p,6s,4f,5d,6p,7s,5f,6d,7p…
▲ 过渡元素在周期表中为何延迟出现?3d排在4s之后,4d 在5s后,4f,5d在6s后,5f,6d在7s后。 ● 电子在原子轨道中的填充顺序,并不是原子轨道能级高低 的顺序,填充次序遵循的原则是使原子的总能量保持最低。 填充次序表示,随Z增加电子数目增加时,外层电子排布的规 律。(见 图8-4,p317)
2、单质的制取方法 通常有五种:物理分离法,热分解法,还原法,氧
化法和电解法。 (1)物理分离法 原理:单质与杂质在某些物理性质(如密度、沸
点等)上有显著差异的特点。 例: “沙里淘金”(密度差异);
应用范围:分离、提取以单质状态存在,且某些物理 性质与杂质差异较大的元素。
无机化学 f区过渡元素

第十章: f 区过渡元素
如:Ln3+水解生成 Ln(OH)3沉淀的趋势随 原子序数的增加(即碱 度减弱)而增加, 当加入 NaOH时, 溶解度最小、 碱度最弱的Lu将最先 以Lu(OH)3的形式沉 淀出来, 而溶解度最大, 碱度最强的La将最后 以La(OH)3沉淀析出。
4 配合物 f电子的配体场效应, 配合物的特点 5 锕系元素的一般性概貌
习题:1(2),(4),(6),,2,4,5,6(2),(4),(6),(8),7,9,13
第十章: f 区过渡元素
10.1 概述
镧系和锕系通常称为f区元素。一般地, f区元素是指最后 一个电子填入(n-2)f亚层的元素, 也称为“内过渡元素”。
第二个原因是Eu和Yb的碱土性较强, 其性质接近于碱 土Ba, 因而半径较大。
第三个原因是Eu和Yb分别是半充满(f7)和全充满(f14)的 结构, 这种结构稳定, 屏蔽效应强, 核对外层电子吸引力小,
故半径较大。
第十章: f 区过渡元素
原子序数
离子半径
镧系元素+3价离子从f 0的 La3+到f14 的Lu3+, 依次增加4f电 子(与原子的电子排布不一样), 因而随着原子序数的增加离子的 半径依次单调减小(没有峰谷现 象), 收缩的程度比原子半径更大, 由La3+的106.1 pm到Lu3+的84.8 pm, 共缩小了21.3 pm, 平均每两 个相邻元素间缩小了21.3/14≈ 1.5 pm。
这是因Gd3+具有f7半满稳定结构, 屏蔽稍大, 半径略 有增大之故。
第十章: f 区过渡元素
原子序数 第十章: f 区过渡元素
第四讲:配合物

Fe:4s23d6价电子数为8,故可与5个 CO形成Fe(CO)5;
若中央金属原子价电子数为奇数时,可通过 形成金属原子间键(即多核络合物)来补足 18电子层结构。 例:Mn:4s23d5价电子数为7,
(18-7) ÷2=5.5, 取5,剩下的半个由Mn-Mn键补偿。 形 成Mn2(CO)10; 习题:Co:4s23d7价电子数为9形成什么 络合物?
1、主价和副价 主价指氧化数,副价指配位数。
2、倾向于既要满足主价,又要满足副价。 3、副价指向空间的确定位置。
㈡、价键理论:
中心离子和配位原子都是通过杂化了的共价配位键结合的。
(1)配位键的本质: a、σ配位键:
b、π配位键: K[(CH2=CH2)PtCl3]
C2H4的π电子与Pt2+配位。
(2)杂化轨道与空间构型
配合物的命名
配合物的命名与一般无机化合物的命名原则相同。 若配合物的外界是一简单离子的酸根,便叫某化某; 若外界酸根是一个复杂阴离子,便叫某酸某(反之,若外界为 简单阳离子,内界为配阴离子的配合物也类似这样叫法)。 若配离子的内界有多种配体,须按下列顺序依次命名: 简单离子—复杂离子—有机酸根离子; 而中性分子配位体的命名次序为:H2O—NH3—有机分子。 配位体的个数则用一、二、三等写在配位体前面。 例如下列配合物命名为: [Co(NH3)3(H2O)Cl2]Cl 一氯化二氯一水三氨合钴(Ⅲ) K[Co(NH3)2(NO2)4] 四硝基二氨合钴(Ⅲ)酸钾 这里要提醒注意的是在配合物的命名中,有的原子团使用 有机物官能团的名称。如-OH羟基,CO羰基,-NO2硝基等。
配合物的类型
(1)单核配合物 这类配合物是指一个中心离子或原子的周围 排列着一定数量的配位体。中心离子或原子与配位体之间通过 配位键而形成带有电荷的配离子或中性配合分子。 如[Cu(NH3)4]SO4、K4[Fe(CN)6]等皆属于此类配合物。
过渡元素的一般定义及其分类d轨道的特征和过渡元素的价电子结构讲解

7.3 第一过渡系元素的化学
7.3.1 单质及化合物的制备 一 单质的提取 1 方法 (1) 以天然状态存在的单质的物理分离法 如淘金 (2) 热分解法 △ △ 2HgO 2Hg+O2 2Ag2O 4Ag+O2 (3) 热还原法 △ a 以C作还原剂 ZnO + C Zn+CO 1473K b 用氢作还原剂 WO3+3H2 W+3H2O c 用比较活泼的金属作还原剂 Cr2O3+2A1 2Cr+A12O3 TiC14+2Mg Ti+2MgC12 电解 (4) 电解法 NaC1 Na+1/2C12
7.2.1 d轨道的特征
1 d 轨道比s、p轨道的数目多,成键可能性大;
2 (n-1)d 轨道的能量与ns、np接近,是易参与成键的内层轨道。
据实验测定发现,(n-1)d与ns或np轨道的能量差远较主族元素 的ns与np轨道的能量差小得多。
3 d 轨道在空间的取向和角度分布
五条d 轨道的角度函数按其极大值在空间的分布可分为两组, 一组在轴上,包括dz2、dx2-y2,另一组在轴间夹角45°线上,包括 dxy、dxz、dyz。 d 轨道都有对称中心,是偶函数,具有g对称性。
ⅢBⅣBⅤBⅥBⅦB
ⅧB
IBIIB
超
新超
目前人们对过渡元素的认识并不一致。
现在,对“过渡元素”概念上的理解,大体有如下三种:
●认为“过渡元素”是指从ⅢB-ⅧB族的元素,即除了Cu、 Zn副族外的所有副族,共 8个竖行,其原子的电子结构特点是有 未充满的d电子亚层。电子构型为(n-1)d1-9ns1-2。 ●认为“过渡元素”是指从ⅢB-IB族的元素,包括Cu副族 (不包括Zn副族),共9个竖行,其原子的电子结构特点是原子及 其重要的氧化态有未充满的d亚层,电子构型是(n-1)d1-10ns1-2。 ●认为“过渡元素”是指从ⅢB - IIB 的全部副族元素,共 10个竖行。在这种划分中,“过渡” 的含义是指从金属元素到 非金属元素的过渡或由周期表 s区元素过渡到 p区元素,电子构 型为 (n-1)d1-10ns2。
过渡金属元素ppt课件

其中:ΦA / V
Cr2O72 -/ Cr3+
1.33
MnO4- / Mn2+
1.49
FeO42- / Fe2+ NiO42- / Ni2+
1.84 1.75
5
(三)氧化态的稳定性
2.同一族
高稳氧 氧定化 化性性 态↗↘
Ⅵ
CrO42-/Cr3+ MoO4-/M3+ WO42-/W3+
Ⅶ
MnO4-/Mn2+ TcO4-/Tc+3 ReO4-/Re3+
ⅢB ⅦB Ⅷ
+3 +7 +6 最高氧化态氧化性↗ 最高氧化态稳定性↘
低氧化态稳定性↗
例 第一过渡系列:
氧化性 稳定性
Sc3+ < TiO2+ < VO2+ < Cr2O72 - < MnO4- < FeO42Sc3+ > TiO2+ > VO2+ > Cr2O72- > MnO4- > FeO42-
例:r / pm 57 La 187.7, 71 Lu 173.5
Δr
187.7 173.5 = 71 57
≈ 1 pm
9
三、原子半径:
“镧系收缩”
——从 57 Ln – 71 Lu,随着原子序数递增,增加的电子进入 (n-2) f(即 4f)轨道(4f 0 ~145d 0~16s 2);对于最外层 6s 电子而言,4f 电子位于次外层, Z*增加很小,因此
过渡金属元素
(ⅢB~ⅤⅢ族,d 区)
(n-1)d1~9 ns1~2 (例外 Pd 4d10 5s0 )
第9章过渡元素概论

9.1
过渡元素概述
过渡元素的通性
具有部分填充d或f壳层电子的元素。
狭义:(n-1)d1~8ns1~2 广义:(n-1)d1~10ns1~2 IIIB~VIII IIIB~IIB 8列 10列
1. 过渡元素定义:
轻过渡元素:第四周期过渡元素 重过渡元素:第五、六周期过渡元素
IIA IIIB Be Mg Ca Sc Sr Y Ba La Ra Ac
1. 羰基配合物:通常金属价态较低
(1) 金属与羰基成键特征:以Ni(CO)4为例
Ni(0) 3d84s2 ↑↓ ↑↓ ↑↓ ↑ ↑ 3d Ni(CO)4 ↑↓ ↑↓ ↑↓ ↑↓ ↑↓ ↑↓
—— —— ——
4s
—— —— —— ——
4p
×× ×× ×× ×× 四面体 sp3杂化
问
实测:Ni—C键长184pm
理论:Ni—C键长198pm;
CO把电子给予Ni,Ni上负电荷过多,使该化合物不稳 定,而事实Ni(CO)4十分稳定。
题
CO的分子轨道
接受Ni的d电子
(σ1s)2 (σ1s*)2 (σ2s)2 (σ2s*)2 (π2p)4 (σ2px)2 (π2p*)0 (σ2p*)0
点击观看动画
给与Ni的sp3杂化轨道
π反馈键。
协同成键作用加强了金属与N2分子的作用力,但却削弱 了N2分子内部的键,相当于活化了N2分子。过渡金属双氮配
合物的出现为常温、常压下固氮提供了途径 。
(2)一氧化氮配合物(亚硝酰配合物)
NO作为配位体(NO+为亚硝酰离子)与过渡金属原子 通常有三种键合方式:
A.直线形端基配位
B. 弯曲型端基配位
上
170 160 150 140 130 120 110 100 20 30
《过渡元素概述》课件

1 鼠标悬停
当鼠标悬停在元素上时,使用过渡元素可以 实现平滑的鼠标移入效果,为网页添加互动 性。
2 点击事件
当元素被点击时,使用过渡元素可以实现点 击后的过渡动画,让用户感知到元素被点击 的反馈。
3 属性变化
当元素的属性发生变化时,使用过渡元素可 以使属性的变化平滑过渡,使网页的交互更 加自然。
4 页面加载
过渡元素的注意事项
性能 浏览器兼容性
过渡元素的性能较差,不宜过度使用。
不同浏览器上的过渡元素表现可能会有所不同, 需考虑兼容性问题。
当页面加载时,使用过渡元素可以实现页面 的平滑过渡效果,给用户更好的视觉体验。
如Байду номын сангаас使用过渡元素?
CSS属性transition
使用transition属性来指定需要过渡的属性以及过渡 时长。可以控制过渡效果的速度曲线和循环播放。
CSS属性transform-origin
使用transform-origin属性来规定3D变换的基点,可 以控制元素转换的中心点位置。
《过渡元素概述》PPT课 件
过渡元素指的是在CSS中,可以在不同状态之间实现平滑过渡效果的元素。 通过过渡元素可以让网页更加丰富、更加生动。
过渡元素是什么?
过渡元素是CSS中能够实现平滑过渡效果的元素。通过改变元素的属性,我们可以在不同状态之间实现流畅 的过渡效果,从而增加网页的动感和吸引力。
过渡元素的使用场景
副族元素

第 20 章
过渡元素 (I)
Chapter 20
The transition elements (I)
20.1.1 过渡区元素简介
过渡元素在元素周期表中的位置
过渡元素
. 过渡元素包括 d 区和 ds 区元素,即周期系第 IIIB ~
VIIB,VIII,IB ~ IIB 元素,不包括镧系和锕系元素。 其在周期表中位于 s 区元素和 p 区元素之间,均为金属, 因此也称为过渡金属。
第一过渡系元素 第二过渡系元素 第三过渡系元素
20.1.4 过渡元素单质的化学性质
过渡元素单质的化学性质概述 过渡金属第一过渡系(四周期):较活泼的轻过渡金属; 过渡金属第二、三过渡系(五、六周期):不活泼的重 过渡金属(原因也是由于“镧系收缩”的结果)。 同一周期元素:从左向右过渡,总的变化趋势是电极电势 E (M2+/M) 值逐渐变大,即其活泼性逐渐减弱。 钝化作用的影响:金属的表面性质,如一些金属的表面易 形成致密的氧化膜,也影响其化学活性。
d6
[Fe(H2O)6]2+ 淡绿色
d2
[V(H2O)6]3+ 绿色
d6
[Co(H2O)6]3+ 蓝色
d3
[Cr(H2O)6]3+ 紫色
d7
[Co(H2O)6]2+ 粉红色
d3
[V(H2O)6]2+ 紫色
d8
[Ni(H2O)6]2+ 绿色
d4
[Cr(H2O)6]2+ 蓝色
d9
[Cu(H2O)6]2+ 蓝色
. 过渡金属元素的原子的价电子层构型 :
(n-1)d1-10 ns1-2 (Pd 为 5s0)
过渡元素的结构特点与基本性质

过渡元素的结构特点与基本性质元素周期表中第四、五、六七周期元素中,第ⅢB~ⅤⅢ族,共25种元素,统称为过渡元素。
过渡元素的单质都是金属,所以也称为过渡金属元素。
见表16.1.过渡金属元素属于ⅢB~ⅤⅢ族,d区,外层电子排布为(n-1)d ns(Pd,4d10 5s0,是一种例外的电子排布)。
镧系、锕系的元素的电子排布,增加的电子填入(n-2)f亚层,例如:57La 4f 05d1 6s 2,在结构上,它们最外层二个电子层都是未充满的,因此在元素周期表的划分上不属于过渡金属元素,而属于内过渡元素。
也称之为镧系、锕系元素。
镧系57La ~ 71Lu (15种元素) 4f 0~145d0-1 6s2锕系89Ac~103Lr铹(15种元素)5f 0~146d0~1 7s216.1.1 价电子构型过渡金属价电子构型的通式为:(n-1)d1~9 ns1~2。
原子核外电子排布遵循能量最低原理、保里不相容原理和洪特规则。
L. Pauling 原子轨道近似能级图如下:1s; 2s 2p ; 3s 3p; 4s 3d 4p; 5s 4d 5p; 6s 4f 5d 6p ; 7s 5f 6d也有一些电子排布例外的情况,例如:Z = 24,41 ~ 46:Nb 铌4d45s1不是4d35s241W 钨 5d46s2不是4d55s142Ru 钌4d75s1不是4d65s244Rh 铑4d85s1不是4d75s245Pd 钯4d105s0 不是4d85s24616.1.2 氧化态的规律过渡金属元素常表现为多种氧化态,其根本原因在于内层电子的排布,过渡金属外层电子排布为:(n-1)d1~9 ns1~2 ,(n-1)d轨道与ns轨道能量相近,部分(n-1)d电子参与成键。
例:Mn:+2 ~ +7均出现,主要+2,+3,+4,+6,+7.Fe:+2 ~ +6均出现,主要+2,+3,+6.过渡金属元素的最高氧化态与所在的族相等,最高氧化态= 所处的族数例:Sc +3 Ⅲ3d14s2Cr +6 Ⅵ3d54s1Mn +7 Ⅶ3d54s1但Ⅷ族:多数最高氧化态小于其族数,是因为随着有效核电荷的增加(Z *↑),不是所有(n-1)d 电子都参与成键。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
一、过渡元素的通性
2、原子半径的变化规律
(1)同一周期内,从IIIB到VIIB族原子半径逐渐减小, 这是由于原子序数增加,有效核电荷增加,金属键增 强所致;VIIB族以后,原子半径又有所回升,这是由 于金属键减弱占据主导地位,而有效核电荷增加影响 为次所致。
(2)同一族内,从上到下,随着原子层数的增加,第 一过渡元素的原子半径小于相应第二过渡系元素的原 子半径,而第三过渡系元素的原子半径与第二过渡系 元素相比,差别不大。这是由于镧系收缩所致。
的颜色。
(2)物质显色的若干规律(常温,太阳光)
(a)绝大多数具有d1-9电子组态的过渡元素和f1-13
电子组态的稀土元素的化合物都有颜色
f 区
氧化值
Hf
Ta W Re Os Ir Pt Au Hg
5d25s2
5d35s2 5d45s2 5d55s2 5d65s2 5d75s2 5d95s1 5d105s1 5d105s2
2227
2996 3387 3180 3045 2447 1769 1064 -39
4450
5429 5900 5678 5225 2550 3824 2856 357
一、过渡元素的通性
4、过渡元素离子的颜色
过渡元素的水合离子以及与其它配 体形成的配离子,往往具有特征的颜色, 这是区别于S区和P区金属离子的重要特 征。d-d跃迁是显色的一个重要原因。
(1)第一过渡系水合离子的颜色
Mn (Ⅱ) Fe(Ⅱ) Co(Ⅱ) Ni(Ⅱ) Cu(Ⅱ) Zn(Ⅱ)
对于某些具有颜色的含氧酸根离子,如VO43-
(淡黄色)、CrO42-(黄色)、MnO4-(紫红色)
等,它们的颜色被认为是电荷迁移引起的。在上述 离子中的金属元素都处于最高氧化态,其形式电荷 分别为V5+、Cr6+、Mn7+,它们都具有d0电子构型, 有较强的夺取电子的能力,这些酸根离子吸收了一 部分可见光的能量后,氧阴离子的电荷会向金属离 子迁移。伴随电荷迁移,这些离子呈现出各种不同
第一 过渡 系 Sc Ti V
价层电 子结构 3d14s2 3d24s2 3d34s2
熔点 /℃ 1541 1668 1917
沸点 /℃ 2836 3287 3421
原子 半径
第一电 离能
氧化值
pm
161 145 132
kJ·mol-1
639.5 664.6 656.5 3 -1, 0, 2, 3, 4 -1, 0, 2, 3, 4, 5
-2, -1, 0, 2, 3, 4, 5, 6, 7 0, 2, 3, 4, 5, 6 0, 2, 3, 4 0, 2, 3, (4)
Cu
Zn
3d104s1
3d104s2
1085
420
2562
907
128
133
751.7
912.6
1, 2, 3
2
第二过 渡系 Y Zr Nb Mo Tc Ru Rh
第一电离 能 kJ·mol-1 606.4 642.6 642.3 691.2 708.2 707.6 733.7 3
氧化值
2, 3, 4 2, 3, 4, 5 0, 2, 3, 4, 5, 6 0, 4, 5, 6, 7 0, 3, 4, 5, 6, 7, 8 0, (1), 2, 3, 4, 6
原子半径 / pm
过渡元素的原子半径
一、过渡元素的通性
3、过渡元素单质的性质
(1)物理性质 与主族相比,过渡元素晶格中,不仅ns电子参与 成键,(n-1)d电子也参与成键;此外,过渡元素原子 半径小,单位体积内原子个数多。故过渡元素的熔点、 密度和硬度比主族元素要高。 熔点最高的金属是钨(W); 密度最大的金属是锇(Os); 硬度最高的金属是铬(Cr)。 (2)化学性质-金属活性 同周期,从左到右,金属活性减弱 同 族,从上到下,金属活性降低
159
143 137 137 134 136 136 144 160
660.7
720.3 739.3 754.7 804.9 874.7 836.8 896.3 1013.3
2, 3, 4
2, 3, 4, 5 0, 2, 3, 4, 5, 6 0, 2, 3, 4, 5, 6, 7 0, 2, 3, 4, 5, 6, 7, 8 0, 2, 3, 4, 5, 6 0, 2, 4, 5, 6 1, 3 1, 2
Cr
Mn Fe Co Ni
3d54s1
3d54s2 3d64s2 3d74s2 3d84s2
1907
1244 1535 1494 1453
2679
2095 2861 2927 2884
125
124 124 125 125
659.0
723.8 765.7 764.9 742.5
-2, -1, 0, 2, 3, 4, 5, 6
价层电 子结构 4d15s2 4d25s2 4d45s1 4d55s1 4d55s2 4d75s1 4d85s1
熔点 /℃ 1522 1852 2468 2622 2157 2334 1963
沸点 /℃ 3345 3577 4860 4825 4265 4150 3727
原子 半径 pm 181 160 143 136 136 133 135
Pd Ag
Cd
4d105s0 4d105s1
4d105s2
1555 962
321
3167 2164
765
138 144
149
810.5 737.2
874.0
0, (1), 2, 3, 4 1, 2, 3
2
第三过 渡系 Lu
价层电 子结构 5d15s2原子半 第一电离 径 能 pm 173 kJ·mol-1 529.7 3
化学奥林匹克系列讲座
过渡元素
元素周期表分区
一、过渡元素的通性
1、过渡元素的氧化态 2、原子半径的变化规律 3、过渡元素单质的性质 4、过渡元素离子的颜色 5、过渡金属及其化合物的磁性 6、过渡元素易形成配合物 7、形成多碱、多酸
一、过渡元素的通性
1、过渡元素的氧化态
有可变的氧化数—— (1)第一过渡系,随原子序数增加,氧化态升高, 高氧化态趋于稳定,当d电子超过5时,3d轨道趋向 稳定,低氧化态趋于稳定; (2)第二、第三过渡系变化趋势与第一过渡系相似, 但高氧化态趋于比较稳定; (3)同一族从上到下,特征氧化态升高,高价态趋 于稳定。
