水的电离平衡
水的电离平衡常数

水的电离平衡常数
水的电离平衡常数为:Kc=[H+][OH-]、[H2O]。
电离常数计算公式是
K(电离)=C[A+]^·C[B-]^y、C[ABy],式中C[A+]、C[B-]、C[AB]分别表
示A+、B-和ABy在电离平衡时的物质的量浓度。
影响电离平衡常数的因素是温度,对于吸热反应,温度越高,k越大,对于放热反应则相反。
只有温度变化才变,压强变化引越平衡移动时,其
值不变。
电离平衡常数的应用
电离平衡常数表示弱酸的相对强弱,由弱酸生成的盐就会发生水解,
由越弱越水解的原理,可以判断盐溶液中离子离子浓度大小关系。
总之涉及电离平衡常数的题目必须先根据电离常数判断出酸的相对强弱,把酸的相对强弱由强到弱的顺序排好,然后按照题目要求进行回答,
遇到图像要看清楚图像代表的含义,关键的点表达的意义要清晰。
水的电离平衡和影响平衡的因素

【温馨提示】(1)混合后溶液呈酸性时,一定用 c(H+)计算pH;呈碱性时,一定用c(OH-)计算pH。 (2)若强酸(pH=a,体积为V酸)强碱(pH=b,体积 为V碱)混合后呈中性,则有:V酸/V碱=10(a+b- pKW)
1.(2010· 广东茂名4月调研)已知在100 ℃的温度下(本 题涉及的溶液其温度均为100 ℃),水的离子积KW= 1×10-12。下列说法正确的是( A ) A.0.05 mol· L-1的H2SO4溶液pH=1 B.0.001 mol· L-1的NaOH溶液pH=11 C.0.005 mol· L-1的H2SO4溶液与0.01 mol· L-1的NaOH 溶液等体积混合,混合溶液pH为6,溶液显酸性 D.完全中和pH=3的H2SO4溶液50 mL,需要pH=11 的NaOH溶液50 mL
2.碱性溶液 步骤:先求出溶液中氢氧根离子浓度即c(OH-), 然后根据KW求出溶液中氢离子浓度即c(H+),最 后求出溶液的pH。 c(OH-)的求算式与酸性溶液中c(H+)的求算式 相似,只需把公式中的H+改为OH-,酸改为碱即 可。 说明:若忽略混合前后溶液体积的变化,则混合 后溶液体积近似等于混合前各溶液体积之和,即 V混=V1+V2。
【考点释例2】将pH=3的H2SO4溶液和pH=12的 NaOH溶液混合,当混合溶液的pH=10时,强酸和 强碱的体积之比为( B ) A.1∶9 B.9∶1 C.10∶1 D.1∶10 【解析】pH=10时,c(H+)=1×10-10 mol· L-1, c(OH-)=1×10-4 mol· L-1。
【解析】0.05 mol· L-1的H2SO4溶液中c(H+)=0.10 mol· L-1,pH=1。 2.(1)pH=a的CH3COOH溶液稀释100倍后所得溶 液pH < a+2(填“>”或“<”)。 (2)0.01 mol/L CH3COOH溶液的pH > 2(填“>”或 “<”)。 (3)0.1 mol/L CH3COONa溶液的pH > 7(填“>”或 “<”)。
水的电离平衡常数和水的离子积有什么区别

水的电离平衡常数和水的离子积有什
么区别
水的离子积和电离平衡常数没有什么区别。
如果说有区别的话,离子积是水中氢离子和氢氧跟离子浓度的乘积而电离平衡常数是溶液中离子浓度的乘积/平衡时原物质的浓度.因为水是纯液体,所以其浓度不写入平衡常数,即平衡时原物质的浓度默认为1.所以二者数据相同,
在一定温度下,水中[H ]和[OH-]的乘积(Kw)是一个常数,这个常数叫做水的离子积(曾用名:离子积常数).水的离子积又叫水的自电离常数.
水是纯液体,[H2O]可看作是一个常数,所以Kw=[H ][OH-].Kw值跟温度有关,在25℃,Kw=[H ][OH-]=1×10-7=×1×10-7=1×10-14.为了计算简化,常常把这个值作为室温下水的离子积.在物质的稀水溶液中,[H2O]和纯水的[H2O]几乎相同,因此Kw也几乎相等.这就是说,在任何酸
性(或碱性)溶液中,同时存在H 和OH-,只不过[H ]和[OH-]的相对大小不同而已.在常温下,[H ]和[OH-]的乘积等于1×10-14.因此,水溶液的酸碱性只要用一种离子(H 或OH-)的浓度表示.。
水的电离平衡教案教学设计

授课主题水的电离平衡教学目的1、认识水的电离存在电离平衡,掌握水的电离平衡的影响因素,知道水的离子积常数2、认识溶液的酸碱性及pH,掌握检测溶液pH的方法3、能进行pH的简单计算,并能计算各类混合溶液的pH重、难点溶液pH的计算教学内容课程导入【知识点讲解一】:水的电离一、水的电离1、水的电离:水是一种极弱的电解质,电离方程式为H2O+H2O H3O++OH-或H2O H++OH-2、水的电离平衡常数:)()()(2OH c OHcHcK —电离•=+因为水的电离极其微弱,在室温下1L纯水(即55.6 mol)只有1×10-7mol H2O电离,电离前后H2O的物质的量几乎不变,因此c(H2O)可以视为常数,上式可表示为:c(H+)·c(OH—)=K电离·c(H2O)。
其中常数K电离与常数c(H2O)的积作为一新的常数,叫做水的离子积常数,简称水的离子积,记作K W,即K W= c(H+)· c(OH—) 3、水的离子积常数(K W)(1)表达式:K W=c(H+)·c(OH-),25℃时,K W=1.0×10-14(2)影响因素:只与温度有关,温度一定,则K W值一定。
水的电离是吸热过程,升高温度,K w增大。
25℃时, [H+]=[OH-] =10-7 mol/L ; K W = [H+]·[OH-] = 1.0×10-144、外界条件对水的电离平衡的影响(1)温度(升高温度,促进水的电离):水的电离是吸热过程,升高温度,水的电离平衡向右移动,电离程度增大,c(H+)和c(OH―)同时增大,K W增大,但由于c(H+)和c(OH-)始终保持相等,故仍呈中性(2)加入酸、碱或强酸的酸式盐(抑制水的电离):向纯水中加入酸或NaHSO4、碱,由于酸(碱)电离产生的H+(OH―),使溶液中c(H+)或c(OH―)增大,使水的电离平衡左移,水的电离程度减小(3)含有弱酸根离子或弱碱阳离子的盐(促进水的电离):在纯水中加入含有弱酸根离子或弱碱阳离子的盐,由于它们能跟水电离出的H+和OH―结合生成难电离物,使水的电离平衡右移,水的电离程度增大(4)加入活泼金属(促进水的电离):向纯水中加入金属钠,由于活泼金属能与水电离的H+直接作用,产生氢气,促进水的电离H2O H++OH-ΔH>0改变条件平衡移动方向c(H+) c(OH-) 水的电离程度K w升高温度右移增大增大增大增大加入HCl(g) 左移增大减小减小不变加入NaOH(s) 左移减小增大减小不变加入NaHSO4(s) 左移增大减小减小不变加入金属Na 右移减小增大增大不变5、水的离子积适用范围:K W不仅适用于纯水(或其他中性溶液),也适用于酸、碱、盐的稀溶液,不管是哪种溶液,由水电离出的c(H+)与c(OH-)一定相等6、水的离子积表达式的应用:在水溶液中,均存在水的电离平衡,因此在表达式中,c(H+)、c(OH―)表示整个溶液总物质的量浓度,K W=c(H+)溶液·c(OH-)溶液(1)纯水中:K W=c(H+)水·c(OH-)水(2)酸溶液中:K W=[c(H+)酸+c(H+)水]·c(OH-)水,由于c(H+)酸>>c(H+)水,故忽略水电离出的H+即:K W=c(H+)酸·c(OH-)水,但由水电离出来的:c(H+)水=c(OH-)水例:计算25℃,0.1mol/L的HCl中,c(H+)酸=,c(H+)水=,c(OH-)水=,由水电离出的c(H+)水·c(OH-)水=____________(3)碱溶液中:K W=c(H+)水·[c(OH-)碱+c(OH-)水],由于c(OH-)碱>>c(OH-)水,故忽略水电离出的OH-即:K W=c(H+)水·c(OH-)碱,但由水电离出来的:c(H+)水=c(OH-)水例:计算25℃,0.1mol/L的NaOH中,c(H+)水=,c(OH-)碱=,c(OH-)水=,由水电离出的c(H+)水·c(OH-)水=____________【微点拨】①在不同溶液中,c(H+)、c(OH-)可能不同,但任何溶液中由水电离出的c(H+)与c(OH-)一定相等②对于酸、碱、盐的稀溶液中,c(H2O)也可认为是定值。
水的电离平衡

水的电离与溶液的PH一、水的电离1.电离方程式水是一种极弱的电解质,其电离方程式为:H2O H++OH-2.水的离子积(1)表达式:25℃时K W=c(OH-)·c(H+)=10-14(2)影响因素:K W只与温度有关,温度升高,K W增大。
(3)适用范围:K W不仅适用于纯水,也适用于稀的酸、碱、盐溶液。
注:酸性溶液加水稀释时,由于H+浓度减小,但K W不变,故OH-浓度增大;同理碱性溶液稀释时,H+浓度增大;中性溶液稀释时,H+和OH-的浓度都不变。
3.外界条件对水电离的影响(1)促进水的电离①升高温度水的电离程度增大,H+和OH-浓度同等程度的增大,K W增大,但水溶液的酸碱性不变。
②加入可水解的盐水的电离程度增大:若盐水解呈酸性,c(H+)>c(OH-);若盐水解呈碱性,c(H+)<c(OH-),但溶液中K W不变。
(2)抑制水的电离①加入酸由于H+浓度增大,使水的电离平衡左移,c(H+)>c(OH-),溶液呈酸性,此时,水的电离程度减小,K W不变。
②加入碱由于OH-浓度增大,使水的电离平衡左移,c(OH-)>c(H+),溶液呈碱性,此时,水的电离程度减小,K W不变。
③加入可水解的盐(如FeCl3、Na2CO3),水的电离程度增大,K W不变。
4.水电离出的c(H+)或c(OH-)的计算(25℃时)(1)中性溶液:c(H+)=c(OH-)=1.0×10-7 mol/L.(2)溶质为酸的溶液H+来源于酸电离和水电离,而OH-只来源于水.如计算pH=2的盐酸中水电离出的c(H+):方法是先求出溶液中的c(OH-)=10-12 mol/L,即水电离出的c(H+)=c(OH-)=10-12 mol/L. (3)溶质为碱的溶液OH-来源于碱电离和水电离,而H+只来源于水。
如pH=12的NaOH溶液中,c(H+)=10-12 mol/L,即水电离产生的c(OH-)=c(H+)=10-12 mol/L.(4)水解呈酸性或碱性的盐溶液H+和OH-均由水电离产生。
水的电离平衡常数表达式

练一练
3.写出下列物质的电离方程式:
(1)氢氧化钙____C_a_(O_H__)2__=_C_a_2_+_+_2_O_H_-_________
(2)氢氧化铜_____C_u_(O__H_)_2 ________C_u_2_+_+_2_O_H_-__
(3)次氯酸______H__C_lO_________H_+_+_C_lO_-_________
与4个水分子结合。为了书写 方便,通常仍写成H+和OH-
水的电离平衡常数表达式:
K=
ቤተ መጻሕፍቲ ባይዱ
H OH-
H2O
K[H2O] =[H+][OH-]
K与[H2O]都是常数,其乘积也必然是常数,因此
[H+][OH-]也是常数:
KW= [H+][OH-]
KW称为水的离子积常数,简称水的离子积。
表3-1-1不同温度下水的离子积常数
A.HCl溶液中无 OHB.NaOH溶液中无H+ C.NaCl溶液中既无H+也无OHD.常温下,任何物质稀的水溶液中都有H+和
OH- ,且KW= [H+] [OH-]=1.0×10-14mol2 ·L-2
练一练
2.向纯水中加入NaHSO4 (温度不变),则溶
液的 ( B )
A. [H+]不变 B.酸性增强 C.水中[H+]与[OH-]乘积增大 D. [OH-]不变
二、电解质在水溶液中的存在形态
P74:电解质溶液的导电能力一样吗(实验) 讨论: 1.电解质溶液导电的本质是什么? 2.以上水溶液导电能力有所不同的原因是什么? 3.氯化氢、醋酸等电解质在溶于水的过程中发生 了哪些变化?它们最终以何种状态存在?
水的电离平衡

加入盐:加入某些盐如氯化钠、硫酸钠等可以改变溶液的离子强度从而影 响水的电离平衡 加入其他电解质:加入其他电解质如氯化钾、硫酸钾等可以改变溶液的离 子强度从而影响水的电离平衡
水的电离平衡的实验研究
实验目的与原理
实验目的:研究水的 电离平衡了解水的电 离过程和影响因素
水的离子积常数
水的离子积常数: 水的电离平衡常 数表示水的电离 程度
水的离子积常数 表达式: Kw=c(H+)·c(O H-)
水的离子积常数 值:25℃时 Kw=10^-14
水的离子积常数 与温度关系:温 度升高Kw增大 反之则减小
酸碱度与氢离子浓度
酸碱度:溶液中氢 离子浓度的负对数 pH值
氢离子浓度:溶液 中氢离子的浓度影 响酸碱度
测量初始温度记录数据
绘制pH-温度曲线分析实验结果
实验结果与数据分析
实验目的:验证水的电离平衡 实验方法:使用pH计测量溶液的pH值 实验结果:在不同温度下水的pH值不同 数据分析:pH值随温度的升高而升高说明水的电离平衡受温度影响
THNK YOU
汇报人:
汇报时间:20XX/XX/XX
YOUR LOGO
改变温度:温度对水的电离度也有影响可以通过改变温度来调节水的电离 度
调节温度的方法
加热:提高温度促进水的电离 平衡
冷却:降低温度抑制水的电离 平衡
恒温:保持温度恒定使水的电 离平衡保持稳定
温度梯度:利用温度梯度调节 水的电离平衡
调节压力的方法
改变温度:升高温度电离平衡向右移动;降低温度电离平衡向左移动
计时器:记录实验时间
水:纯净水或蒸馏水
pH计:测量溶液pH值
《水溶液中的离子反应与平衡》课件

解题方法: 溶质的类别
酸
碱
抑制
小于纯水的电离
酸
水 解
碱
的
促进
性
盐
大于纯水的电离
已知25 ℃时在等体积的①pH=0的H2SO4溶液②0.05 mol/L的Ba(OH)2溶液③pH= 10的Na2S溶液④pH=5的NH4NO3溶液
①pH=0
(H2SO4)
:
c(H+)溶液=1mol/L
c(OH-)溶液=
酸性区:
2.看线——增减性
Kw1
纵坐标<横3坐.标看点——起点、交点、
拐点、极值点 即c(H+)<c(OH-)
碱性区:
Kw2
酸酸性性区区
c(cH(O+)H/m-)o/ml·oLl-·L1-1
电
知解
识
质 在
框水
架中 的
行
为
二、电解质在水中的行为
1.可溶性盐的水解本质
H2O
H++OH-
盐
体系变化 条件
【设问角度2】:已知水的电离程度,问溶液酸碱性 例:常温下,由水电离的c(H+)=1×10-13 mol·L-1的溶
液 该溶中液:C的a酸2+碱、性K+?、溶C液l-的、pHHC值O?3-能大抑量制共存。( × )。
酸:pH=1 碱:pH=13
【设问角度3】:已知溶液酸碱性,问水的电离程度
例:常温下,某碱性溶液(不考虑弱酸弱碱盐)pH=9,
平衡移 动方向
正向
逆向
逆向 逆向 逆向
正向 正向 正向
KW
增大 减小 不变 不变 不变
不变
水的电 离程度
增大 减小
减小 减小 增大
高二化学-水的电离平衡

高二化学-水的电离平衡第2讲水的电离和溶液的ph考点一水的电离水就是极弱的电解质,水的电离方程式为h2o+h2o或h2o2.水的离子积常数kw=c(h(1)室温下:kw=1×10(2)影响因素;只与kw减小。
(3)适用范围:kw不仅适用于纯水,也适用于稀的电解质水溶液。
(4)kw揭示了在任何水溶液中均存在h和oh,只要温度不变,kw不变。
3.影响水电离平衡的因素(1)增高温度kw减小。
(2)加入酸或碱kw不变。
(注意区分:电离程度、kw)(3)加入可水解的盐(如fecl3、na2co3)kw不变。
深度思考1.水的离子内积常数kw=c(h)·c(oh)中h和oh一定就是水电离出的吗?答案不一定。
c(h)和c(oh)均指溶液中的h或oh的总浓度。
这一关系适用于于任何叶唇柱水溶液,即为任何叶唇柱水溶液中都存有这一关系。
因此,在酸溶液中酸本身电离出的h可以遏制水的电离,而在碱溶液中,碱本身电离出的oh也可以遏制水的电离。
2.在ph=2的盐酸溶液中由水电离出来的c(h)与c(oh)之间的关系是什么?(1)溶液呈现出酸、碱性的实质就是c(h)与c(oh)的相对大小,无法只看看ph,一定温度之下ph=6的溶液也可能将显出中性,也可能将显出酸性,应当特别注意温度。
(2)采用ph试纸时无法用蒸馏水润湿。
(3)25℃时,ph=12的溶液不一定为碱溶液,ph=2时溶液也不一定为酸溶液,还可能为能水解的盐溶液。
(1)水的离子内积常数kw=c(h)·c(oh),其实质就是水溶液中的h和oh浓度的乘积,不一定就是水电离出来的h和oh浓度的乘积,所以与其说kw就是水的离子内积常数,不如说是水溶液中的h和oh的离子内积常数。
即kw不仅适用于于水,还适用于于酸性或碱性的叶唇柱溶液。
不管哪种溶液均存有c(h)h2o=c(oh)h2o。
(2)水的离子积常数显示了在任何水溶液中均存在水的电离平衡,都有h和oh共存,只是相对含量不同而已。
水的电离平衡

水的电离平衡一.水的电离平衡1.实验证明,纯水有微弱的导电性,是极弱的电解质:要点1:水是一种极弱的电解质:H2O H++OH-在一定温度下,c(H+)与c(OH-)的乘积是一个常数,即K W=c(H+)·c(OH-),K W叫水的离子积常数,简称水的离子积.要点2:水的电离是吸热过程,所以,升高温度,可使水的电离平衡向电离的方向移动,因此c(H+)和c(OH-)都增大,故K W也会增大.如100℃的纯水中:K W=c(H+)·c(OH-)=1×10-6·1×10-6=1×10-12,若没有指定温定,则可认为是在常温下,即25℃时K W=1×10-14要点3:水的离子积(K W)揭示了任何溶液中都存在的水的电离平衡.因此K W只受温度影响,不受溶液的浓度的影响.不管是在酸性,碱性,还是中性溶液中,只要是在常温下,K W都可认为是1×10-14.要点4:对于c(H+)很小的稀溶液,用c(H+)的数值来表示溶液的酸碱性强弱很不方便.为此采用c(H+)的负对数来表示,称为溶液的PH,即PH=-lg{c(H+)}.由此式可知PH每增大1个单位,c(H+)就减为原为原来的1∕10;PH每减小1个单位,c(H+)就增大为原来的10倍.2.用电离平衡理论来研究水的电离(因为水是一种极弱的电解质);也可用归纳小结来学习PH的有关计算纯水中存在如下平衡:H2O H++OH--Q,当改变条件时,填写表中各项内容.改变条件平衡移动方向PH 水电离出的c(H+) K W升温→右移减小增大变大通入HCl气体←左移减小减小不变加入NaOH固体←左移增大减小不变加入NH4Cl固体→右移减小增大不变加入金属钠→右移增大增大不变练习1.向纯水中加少量NaHSO4(溶液温度不变),则溶液的( )A.PH升高B.酸性增强C.K W增大D.c(OH-)减少练习2.水是一种极弱的电解质,在室温下每n个水分子中只有1个分子发生电离,则n值是( )A.107B.55.6×107C.1×10-14D.55.6练习3.实验表明,液态时,纯硫酸电离能力强于硝酸,纯硫酸导电性也显著强于纯水.已知液态纯酸都能像水那样进行自身电离H2O+H2O H3O++OH-而建立平衡,且在一定温度下都有各自离子积常数,据此回答:(1)纯硫酸在液态时自身电离的方程式是(2)在25℃时,液态纯H2SO4的离子积常数K(H2SO4)比1×10-14(填“大”、“小”或“相等”)(3)在纯硫酸和纯硝酸的液态混合酸中,存在的阴离子主要是,这是因为混合酸中不仅存在硫酸和硝酸各自电离的两个电离平衡,而且还因硫酸的酸性大于硝酸,又在无水条件下,混酸中必然发生(写离子方程式) 反应而造成的.3.影响离子积Kw的因素(1)Kw与溶液中[H+]、[OH—]无关,与温度有关。
第23课时 水的电离平衡常数和KW

△H>0
c(H2O) · K电离 = C(H+) ·c(OH-) 室温下 Kw 水的离子积 Kw = 1×10-14 室温下55.6mol H2O中 1000 g -7 有1×10 mol H2O电离, 18 g· mol-1 因此c(H2O)可视为常数。 c(H2O)=
1L
影响水的电离平衡的因素 分析表格中的数据,有何规律,并解释之。
c(H+) 蒸馏水 加酸后 10-7 10-1↑ c(OH-) 10-7 c(H+) 和 c(OH-) 大小比较 c(H+) = c(OH-) c(H+) > c(OH-) 酸= 1×10-14 不变
c(OH-)水 酸溶液中Kw = c(H+)酸 · =c(H+)水
把矛盾的双方和谐地统一于一公式之中 3、加入酸或碱,抑制水的电离,Kw不变
4、在稀酸或稀碱溶液中H+和OH-浓度之积在 一定温度下为一常数。
— 例1计算下列酸溶液中的c(OH )
1、0.1mol/L HCI溶液 2、 0.001mol/L HCI溶液 3、0.005 mol/L H2SO4溶液
例2计算下列碱溶液中的c(H+)
c(H+)水 =
1×10-14 = 1×10-5 mol/L = 1×10-9 mol/L
溶液的酸碱性
与 c(H+)、c(OH-)的关系
c(OH-) 溶液酸、 c(H+) c(OH-) c(H+)与c(OH-) C(H+)· 碱 性 (mol/L) (mol/L) 的大小比较 (25℃) 酸性 >10-7 <10-7 c(H+)>c(OH-) 1×10-14
探究实验
灵敏电流计
第3章 微专题11 水的电离平衡曲线及溶液中水电离出c平(H+)的计算

微专题11水的电离平衡曲线及溶液中水电离出c平(H+)的计算一、水的电离平衡曲线(图像)水的电离的影响因素、水的离子积(K w)、溶液酸碱性判断是高考及平时考查中的热点,常结合图像综合考查。
在分析图像时,要注意以下四点:(1)曲线上的任意点K w均相同,即c平(H+)·c平(OH-)相同、温度相同。
(2)曲线外的任意点与曲线上任意点的K w不同,两点的温度不同。
(3)实现曲线上点之间转化时,温度不变,改变的是溶液的酸碱性。
(4)要实现曲线上点到曲线外另一点的转化,改变的是温度。
例1如图表示不同温度下水溶液中c 平(H+)与c平(OH-)的关系,下列判断正确的是()A.两条曲线上任意点均有c平(H+)·c平(OH-)=K wB.T<25 ℃C.b点和c点pH均为6,溶液呈酸性D.只采用升温的方式,可由a点变成d点答案 A解析在任何温度下的水溶液中,溶液中的c平(H+)·c平(OH-)=K w,其中K w只与温度有关,故A正确;c点c平(H+)·c平(OH-)=10-12 mol2·L-2>10-14 mol2·L-2,则T>25 ℃,故B错误;常温下b点pH为6,溶液呈酸性,c点对应的温度下c平(H+)=c平(OH-),此时pH为6,说明溶液显中性,故C错误;a点溶液为中性,d点溶液为碱性,只采用升温的方式无法实现从a点变成d点,故D错误。
【考点】溶液的酸碱性和pH【题点】水的电离平衡图像二、溶液中水电离出c平(H+)或c平(OH-)的计算(25 ℃)1.中性溶液c平(H+)=c平(OH-)=1.0×10-7mol·L-1。
2.溶质为酸的溶液H+来源于酸的电离和水的电离,而OH-只来源于水的电离。
如计算0.01 mol·L-1的盐酸中水电离出的c平(H+)。
方法是先求出溶液中的c平(OH-)。
第八章 第2讲水的电离平衡(高三)

知识梳理
递进题组
返回
递进题组 题组一
1 2
题组二
3
4
题组一 影响水电离平衡的因素及结果判断 1.25 ℃时,相同物质的量浓度的下
解析
列溶液:①NaCl ③H2SO4
分析四种物质可知 ②NaOH、 ④(NH4)2SO4, 其中水 ③H2SO4 抑 制 水 的 电 离 ,
②NaOH
的电离程度按由大到小顺序排 ①NaCl 不影响水的电离平衡, ④(NH4)2SO4 促 进 水 的 电 离 列的一组是 ( C ) + (NH 4 水解),在②③中 H2SO4 A.④>③>②>① + 为二元强酸,产生的 c(H )大 B.②>③>①>④ 于 NaOH 产生的 c(OH-),抑 C.④>①>②>③ 制程度更大,故顺序为 D.③>②>①>④ ④>①>②>③。
- + -
-
+
-7
mol·L
-1
考点一
知识梳理
递进题组
返回
递进题组 题组一
1 2
题组二
3
4
方法技巧
②实例 如计算 pH=2 的盐酸溶液中水电离出的 c(H+), 方法是先求出溶 液中的 c(OH-)=(Kw/10-2) mol· L-1=10-12 mol· L-1,即水电离出 的 c(H+)=c(OH-)=10-12 mol· L-1。
考点一
即(1.0×10-14)∶(1.0×10-13) ∶ (1.0×10-12)∶(1.0×10-11)= 1∶10∶100∶1 000。
知识梳理
递进题组
返回
递进题组 题组一
水的电离平衡

1.纯水在25 ℃时的氢离子浓度与90 ℃ 时的氢离子浓度的关系是( ) A.大于 B.等于 C.小于 D.不能肯定
[例1]25 ℃时,水的电离达到平衡:H2O(l) OH-(aq) ΔH>0,下列叙述正确的是( )
H+(aq)+
[答案]B
A.向水中加入稀氨水,平衡逆向移动,c(OH-)降低 B.向水中加入少量固体硫酸氢钠,c(H+)增大,Kw不 变 C.向水中加入少量固体CH3COONa,平衡逆向移 动,c(H )降低 D.将水加热,Kw增大,pH不变
[答案](1)1×10-12mol2·L-2 高于 曲 线Ⅱ所代表的水的离子积比曲线Ⅰ的小, 由于水的电离过程是吸热过程,温度越高, 离子积越大,故曲线Ⅱ代表的温度低 (2)10
(2007)氯气溶于水达到平衡后,若其他条件 不变,只改变某一条件,下列叙述正确的 是 c( H ) A.再通入少量氯气, c(ClO ) 减小 B.通入少量SO2,溶液漂白性增强 C.加入少量固体NaOH,一定有 c(Na+)=c(Cl-)+c(ClO-) D.加入少量水,水的电离平衡向正反应 方向移动
[答案]D
4.下列说法正确的是( ) A.酸式滴定管和量筒都没有“0”刻度线
B.使用pH试纸时,不能润湿,否则一定 会使测定结果不准确 C.若用水润湿过的pH试纸去测pH相等 的H2SO4和H3PO4,H3PO4的误差更大 D.pH试纸在酸性较强的环境中显红色, 在碱性较强的环境中显蓝色 [答案]D
3.下列叙述正确的是( ) A.无论是纯水,还是酸性、碱性或中性稀溶 液,在常温下,其c(H+)×c(OH-)=1×10-14 B.c(H+)等于1×10-7 mol·L-1的溶液一定是 中性溶液 C.0.2 mol·L-1 CH3COOH溶液中的c(H+)是 0.1 mol·L-1 CH3COOH溶液中的c(H+)的2倍
化学管理--水溶液中的四大平衡
c0
0
0
c0-cHAc
cH+
cAc-
KaccH 0ccA Hc
c2 H
c0cH
cHKa
Ka24Kac0 2
KaΘ是酸式电离平衡常数
根据电离度的定义式,也可将KaΘ表示如下:
HAc === H+ + Ac-
t = 0 时 c0
0
0
平衡时 c0(1-α)
c0α
c0α
Ka
2 1
c0
1
K
a
c0
cH c0
[
cIn c
[
c HIn c
]
]
cIn (紫红色) cHIn(无色)
Ka cH
c
酸碱指示剂的变色范围 肉眼能观察到颜色变化的pH值范围
[HIn]:[In-] = 1中间颜色,此点称为理论变色点 [HIn]:[In-] ≥ 10 无色(酸色) [HIn]:[In-] ≤ 10 紫红色(碱色)
酸碱指示剂的变色范围:
pOHpKb
lgc0,(碱) c(盐)
例题:缓冲溶液的组成是1.00mol·L-3的NH3·H2O和 1.00mol·L-3的NH4Cl,求: 1)缓冲溶液的pH值; 2 ) 将 1.0cm31.00mol·L-3NaOH 溶 液 加 入 到 50.0cm3 该缓冲溶液中引起的pH值变化; 3)将同量的NaOH加入到50.0Cm3纯水中引起的pH 值变化。
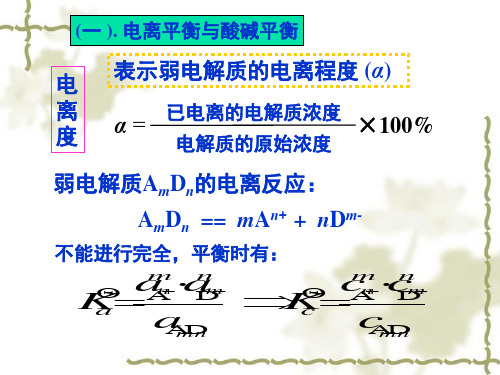
(一 ). 电离平衡与酸碱平衡
电 表示弱电解质的电离程度 (α)
离 度
α = 已电离的电解质浓度 ×100%
电解质的原始浓度
弱电解质AmDn的电离反应:
AmDn == mAn+ + nDm-
关于水的电离与平衡的研究性报告

关于水的电离与平衡的研究性报告水是一种极弱的电解质,在常温下能电离出极少量的H+和OH-,存在着电离平衡。
具体阐述如下:1.Kw=c(H+)·c(OH-),纯水中c(H+)=c(OH-),纯水总是呈电中性的。
2.不能认为c(H+)或c(OH-)等于10-7mol/L或pH=7的溶液就一定是中性溶液,即不能把pH=7作为判断一切溶液酸、碱性的分界线,而应比较c(H+)和c(OH-)两者的相对大小。
溶液呈酸碱性的本质是c(H+)≠c (OH-)。
3.已知水电离产生的c(H+)或c(OH-)并不能最终确定溶液的酸碱性,因为这既可能是酸(或酸性)溶液,也可能是碱(或碱性)溶液。
例如,由水电离出的c(H+)=1×10-13mol/L的溶液,其pH等于1或13。
4.水电离平衡的破坏和移动(1)外加酸、碱可以打破水的电离平衡,促使水的电离平衡逆向移动,导致c(H+)≠c(OH-),水的电离受到抑制。
酸溶液的pH表示的c(H+)为溶质酸电离产生的,通过Kw=c(H+)·c(OH-)水可以计算出水电离的c(OH -)水,而c(H+)水=c(OH-)水。
碱溶液的pH表示的c(H+)则为水电离出的c(H+)水,因为碱本身不能电离出H+。
(2)温度会影响水的电离平衡。
水的电离是吸热过程,温度升高,促进水的电离,Kw增大,pH减小,但仍存在c(H+)水=c(OH-)水。
在常温时Kw=10-14,100℃时,Kw=10-12。
(3)能发生水解的盐可以促进水的电离,从而打破水的电离平衡。
只有一种弱酸根阴离子(或弱碱阳离子)水解,则c(H+)≠c(OH-);若所加盐发生双水解,则两种离子的浓度可能相等,也可能不相等。
水解呈酸性的盐溶液pH表示的是水电离的c(H+)水(与碱溶液相同),水解呈碱性的盐溶液的pOH{pOH=-lgc(OH-)}表示的是水电离的c(OH-)水(与酸溶液相同)。
5.对于极稀的酸、碱溶液,水的电离则不可忽视。
水的电离平衡影响因素

水的电离平衡影响因素水的电离平衡,听起来像是科学家们的专属秘密,其实不然,咱们生活中随处可见。
想象一下,水里就像一个热闹的市场,水分子在这里东奔西跑,跟离子们互相调侃,一会儿变成氢离子,一会儿又变成氢氧根离子。
你可能会问,这水的电离到底受什么影响呢?哎呀,别急,咱们慢慢聊。
温度就像个调皮的小孩,能让这个市场变得热火朝天。
想象一下,温度一升高,水分子们像喝了兴奋剂,活蹦乱跳,电离的速度自然加快,离子们的数量也随之增加。
这就好比你在夏天喝了冰镇饮料,瞬间感到无比畅快,活力四射。
反之,温度一低,水分子们就像被施了定身术,变得慢吞吞,电离速度减缓,市场也冷清了不少。
谁还想在冰冷的地方闲逛呢?咱们来说说压力。
这可真是个不容小觑的家伙。
想象一下,水分子在压力下就像被逼着加速跑步,没得休息。
压力越大,水分子们越紧凑,电离反应就越快。
就像一个忙碌的职场,压力越大,效率越高。
但要小心哦,太大的压力也可能让分子们崩溃,这可不是个好事。
然后,水的pH值也是一个关键的角色。
你看,水的酸碱度就像个调酒师,调配着不同的离子。
如果水里酸性很强,氢离子多得让人咋舌,电离就会更容易发生。
反之,碱性水里氢氧根离子占了上风,这又是另一番景象。
就像一场离子的拔河比赛,谁的力量大,谁就能占据主导地位。
再说说盐类的加入。
想象一下,水就像一个聚会,平时清清爽爽,突然来了几个新朋友——盐离子。
咱们的水分子们可就得忙活起来,互相搭配,形成新的平衡。
盐的浓度越高,水的电离平衡就越复杂。
这就好比你在家聚会,来了个大胃王,瞬间气氛变得热烈无比,大家的互动也多了不少。
光说这些还不够,咱们再来聊聊离子的种类。
不同的离子就像不同性格的人,互动方式千差万别。
有的离子很温和,跟水分子合作得天衣无缝;而有的离子则像个狂热分子,四处捣乱,影响电离平衡。
就像朋友聚会,有的人聊得火热,有的人却在角落里默默无闻。
每种离子都在以自己的方式影响着这个水的电离平衡。
除了这些,环境中的其他物质也是个变数。
水的电离平衡

水的电离平衡
水的电离平衡指的是水分子在特定条件下向氢离子(H+)和羟基离子(OH-)离解的过程。
水是一种极弱的电解质,极难电离,
1、在常温常压下,水的电离平衡式为:
H2O+H2O⇌H3O++OH-或H2O⇌H++OH-
一般情况下使用H2O⇌H++OH-进行分析应用。
2、水的离子积常数
Kw=c(H+)•c(OH-),只与温度有关,因为水的电离过程是吸热过程ΔH>0,因此温度升高,水的离子积常数变大,25℃Kw=10-14,100℃Kw=10-12。
这个平衡常数被称为自离子积常数(Kw),其值为 1.0×10-14,在25°C下保持不变。
当水中的氢离子和羟基离子浓度相同时,即pH值为7,这种情况下水被称为中性的。
如果氢离子浓度高于羟基离子,则水被称为酸性的;而如果羟基离子浓度高于氢离子,则水被称为碱性的。
水的电离平衡对于许多化学和生物过程都具有重要影响,如酸碱中和、缓冲溶液、生化反应等。
水电离平衡常数

水电离平衡常数1. 水的电离方程式- 水是一种极弱的电解质,能发生微弱的电离,其电离方程式为H_{2}O⇌H^++OH^-。
- 在一定温度下,对于水的电离平衡H_{2}O⇌ H^++OH^-,其电离平衡常数K = frac{c(H^+)· c(OH^-)}{c(H_{2}O)}。
- 由于水的电离程度非常小,在计算时,纯水中c(H_{2}O)可视为常数,其值约为55.6mol/L(1L水的物质的量为(1000g)/(18g/mol)≈55.6mol)。
- 所以K_{w}=c(H^+)· c(OH^-),K_{w}称为水的离子积常数,简称水的离子积。
1. 温度的影响- 水的电离是吸热过程。
升高温度,促进水的电离,K_{w}增大。
- 例如,在25^∘C时,K_{w}=1×10^-14;在100^∘C时,K_{w}=1×10^-12。
2. 酸、碱的影响- 酸或碱的加入会抑制水的电离。
- 在酸溶液中,H^+主要来自酸的电离,c(H^+)增大,根据K_{w}=c(H^+)· c(OH^-),c(OH^-)减小,水的电离平衡向左移动。
- 在碱溶液中,OH^-主要来自碱的电离,c(OH^-)增大,c(H^+)减小,水的电离平衡也向左移动。
3. 盐的影响- 强酸弱碱盐、强碱弱酸盐会促进水的电离。
- 例如,NH_{4}Cl溶液中,NH_{4}^+会结合水电离出的OH^-,使c(OH^-)减小,水的电离平衡向右移动。
- CH_{3}COONa溶液中,CH_{3}COO^-会结合水电离出的H^+,使c(H^+)减小,水的电离平衡向右移动。
1. 计算溶液中的H^+或OH^-浓度- 已知某温度下K_{w}的值,在酸性溶液中,可根据K_{w}=c(H^+)· c(OH^-),由c(H^+)计算c(OH^-)(c(OH^-)=frac{K_{w}}{c(H^+)});在碱性溶液中,可由c(OH^-)计算c(H^+)(c(H^+)=frac{K_{w}}{c(OH^-)})。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
PH稀PH原n
练习
• 7、将pH=6的CH3COOH溶液加水稀释 1000倍后,溶液中的 CD( )
• A.pH=9 • B.c(OH-)≈10-5mol·L-1. • C.pH≈7 • D.c(OH-)≈10-7 mol·L-1.
• 8、体积相同,pH也相同的HCl、HNO3、 CH3COOH分别与足量的NaHCO3反应,产 生CO2的体积 (CD)
c(H+)>c(OH-)的操作是
(C )
• A.向水中投入一小块金属钠 .
• B.将水加热煮沸.
• C.向水中通入二氧化碳气体.
D.向水中加食盐晶体
• 3.用蒸馏水稀释1 mol·L-1醋酸时,始终
保持增大趋势的是
(D )
• A.溶液中的c(CH3COO-) • B.溶液中的c(H+).
• C.溶液中的c(CH3COOH). D.溶液中的c(OH-)
6.95℃时,水中的H+的物质的量浓度为
10-6 mol·L-1,若把0.01 mol的NaOH固体溶 解于95℃水中配成1 L溶液,则溶液的pH为 ( B)
• A.4
B.10
• C.2
D.12
考点3溶液PH值的计算
• 基本关系式:
• ①pH=-lgc(H+) • ②c(H+)=10-pH mol·L-1 • ③任何水溶液中,由水电离产生的c(H+)与 • c(OH-)总是相等的,即:c水(H+)=c水(OH-). • ④常温(25℃)时,c(H+)·c(OH-)=1×10-14
1、强酸、强碱溶液的PH值
原则:酸按酸,碱按碱 (1)酸:先求出c(H+),再求PH值
(2)碱:
a:先求出c(OH-),再利用Kw求出c (H+),再求PH值
b :也可以先求出POH值,再求PH值 PH = 14 - POH
2、弱酸、弱碱溶液PH值求算
利用电离度求出
弱酸的c(H+)即c(H+)=c 酸α
• 3、判断溶液的酸碱性一定要看H+和OH-的 相对大小,不能一味的用PH值来判断
练习
• 5、25℃时,pH=2的HCl溶液中,由
水电离出的H+浓度是
B(
).
• A.1×10-7mol·L-1
• B.1×10-12mol·L-1.
• C.1×10-2mol·L-1
• D.1×10-14mol·L-1.
因素 离度
能力 性
升高 温度
中性
加 HCl
酸性 不变
加
NaOH
碱性 不变
加醋 酸钠
碱性 不变
练习
• 1.常温下,在0.1 mol·L-1 CH3COOH溶
液中,水的离子积是
( A)
• A.1×10-14
B.1×10-13.
• C.1.32×10-14 D.1.32×10-15.
• 2.能影响水的电离平衡,并使溶液中的
• c(OH-)水=c(OH-)溶液
• 3、水的离子积
当水达到电离平衡时c(H+)和c(OH-)的浓度 的乘积,叫做水的电离平衡常数, 简称水的离子积。符号:Kw
4、计算公式
K电离=c(H+).c(OH-)/c(H2O)
所以, c(H+).c(OH-) =K电离. c(H2O) =Kw
• 5、Kw 的影响因素:Kw与溶液的酸碱性无
• A.同样多 • B.HCl最多. • C.HCl、HNO3一样多 • D.CH3COOH最多.
ቤተ መጻሕፍቲ ባይዱ
• 9.把pH=3的H2SO4溶液和pH=10的NaOH 溶液混合,两者恰好中和,则两种溶液的
或者
弱碱的c(OH-),即c(OH-)= c 碱α,再
求其PH值
3、同强混合计算
(1)两种强酸混合求PH值
(2)两种强碱混合求PH值
4、异强相混看过量
(1)强酸与强碱恰好完全反应溶液呈中性 PH=7
(2)酸过量
(3)碱过量
(4)PH之和为14的一强一弱等体积混合显 弱者性
(5)物质的量浓度相同的一元酸与一元碱等 体积混合显强者性
• 1、酸溶液中:酸电离出H+,OH-是水电离的, 故c(H+)水=c(OH-)溶液
• 2、碱溶液中:碱电离出OH-,H+是水电离出 的,故c(H+)水=c(H+)溶液
• 3、盐溶液中
• (1)呈酸性时,H+是由H2O电离的 • c(H+)水= c(H+)溶液 • (2)呈碱性时,OH-是由水电离出来的
5、无限稀释“7”为限
(1)强酸每稀释10n倍c ( H ) 减为原来的1 1 0 n
PH稀PH原n
(2)强酸每稀释10n倍c(O H )减为原来的 1 1 0 n PH稀PH原n
(3) 强酸、强碱无限稀释时,不能忽略水 的电离,故PH接近7
(4)弱酸稀释时 c ( H ) 减小的程度比强酸小, 每稀释 1 0 n 倍 PH稀PH原n
• (1)酸、碱:
在纯水中加入酸或碱,均抑制水的电离
• (2、温度:
水电离吸热,升温将促进水的电离,故平衡右移 • (3)易水解的盐: 加入能水解的盐,不论水解后溶液显什么性, 均促进水的电离
• (4)其它因素: 如向水中加入活泼金属,由于与水电离出的H+ 直接作用,因而促进了水的电离。
注意:关于水电离出H+浓度和 溶液中c(H+)的判断
• 4、下列溶液一定是碱性的是 • A.溶液中c(OH-)>c(H+). • B.滴加甲基橙后溶液显红色. • C.溶液中含有OH-. • D.滴加甲基橙后溶液显黄色.
(A )
考点2溶液的酸碱性和PH值
注意:
• 1、并非PH=7溶液一定呈中性,只有在常 温的条件下,才呈中性
• 2、常温下,PH=0时,并不表示溶液中没 有H+,只是此时H+浓度是1mol/L;同样, PH=14时OH-的浓度为1mol/L
电离平衡
水的电离和溶液的酸碱性 (第一课时)
复习与回顾
• 1、pH和体积都相同的醋酸和硫酸,分别与 足量的Na2CO3溶液反应,在相同条件下
• 放出二氧化碳气体的体积是 (B )
• A.一样多
B.醋酸比硫酸多.
• C.硫酸比醋酸多 D.无法比较
考点1 水的电离及水的离子积常数
2、影响水电离的因素
关,只与 温度有关。
• 升高温度,水的电离度增大,Kw 增大
• 如:25℃ Kw = c(H+).c(OH-)
•
=1×10-7 ×1×10-7 =10-14
• 100℃ Kw = c(H+).c(OH-)
•
=1×10-6 ×1×10-6 =10-12
填表:
影响 水的电 n(H+) C(H+) 导电 酸碱 Kw
