考研必备_100种有机化学反应
考研必备_100种有机化学反应2(51-100)
MgSO4 或 MgCl2 催化,起还原作用的甲酸经常是过量,每摩尔羰基化合物需 2~4mol 甲
酸。
54. Lieben 碘仿试验 P289
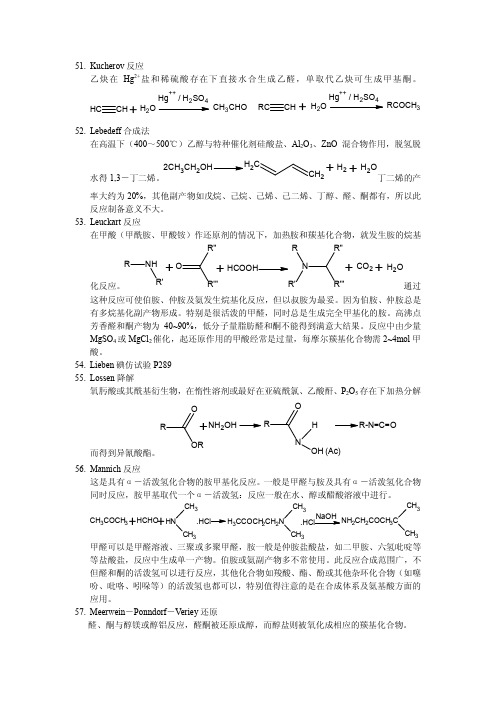
55. Lossen 降解
氧肟酸或其酰基衍生物,在惰性溶剂或最好在亚硫酰氯、乙酸酐、P2O5 存在下加热分解
O
O
R
+NH2OH
R
H
R-N=C=O
OR 而得到异氰酸酯。
67. Prins 反应
在酸催化下,甲醛与烯烃加成,生成 m-二噁烷类和 1,3-二醇类。反应中也可生成不饱
H3C
CH2 CH3
CH2O, H+ H3C H2O
CH2 CH2
H3C OH H3C
H3C
OH
CH2 CH2
和醇。
2CH2O, H+
O
O
CH2
稀硫酸是最好的催化剂。
磷酸、BF3 也可用。叔基取代烯烃和不对称烯烃,如丙烯或 1-丁烯最容易反应,m-二 噁烷通过酸解可以转变成 1,3-二醇类,再经脱水即可形成共轭二烯类。 68. Reformatsky 合成法 P322 69. Reimer-Tiemann 合成法
在碱性水溶液中,苯酚与氯仿作用,产生邻、对位取代醛类。两种产物的比例取决于取 代基和溶剂,如果在吡啶中进行,仅产生邻位醛,产率 20~30%,很少超过 50%。酚本
OH
OH
HO
+ CHCl3
身可得到 60%水杨醛。
CHO 苯环上有吸电
子取代基,如-SO3H、-CN、-COOH、-NO2 能使苯环钝化,产率大约降为 25%。 只有含有游离酚式羟基的化合物,才能转变成醛。溴仿、碘仿及三氯乙酸同氯仿一样,
100种有机化学反应

R -MgXOC OMgX H5C2O
2H5
O R R
13. Chichibabin 胺化反应 含氮杂环碱类,如吡啶,喹啉或其衍生物与金属胺基化物在一起加热,则起胺化反应, 生 成 氨 基 衍 生 物 。 产 率 一 般 为 50 % ~ 100 % 。
NaNH2 溶剂 105- 110℃, 66- 76% N N H2O 水解 NHNa N NH2
R
+RCl
AlCl 3
+ HCl
烷基化试剂除卤代烷外,醇类、烯烃、甲
苯 磺 酸 烷 基 酯 亦 可 。 各 种 路 易 斯 酸 的 催 化 效 应 : AlCl3>FeCl3> SbCl5>SnCl4>BF3>TiCl4>ZnCl2。醇类至少需 1mol 路易斯酸作催化剂。因为反应中生成 的水使等摩尔的催化剂失去活性,对于卤代烷和烯烃来说,催化量就已足够。酚类的反 应较令人满意(P258~259) ,而低碱度的芳烃如硝基苯、吡啶都不能反应。 32. Fries 重排 在当量数 AlCl3 存在下,加热脂肪或芳香羧酸苯基酯,酰基发生重排反应,脂肪酸苯基 酯比芳香酸苯基酯更易进行。根据反应条件,重排可以到邻位,也可以到对位。在低温 (100℃以下)时主要形成对位产物,在高温时一般得到邻位产物。
CH2Cl ZnCl 2
+ HCHO + HCl
+ H2O
对于取代烃类, 取代基
的性质对反应能力影响很 亲电取代,烷基,烷氧基一般使反应速度增加,而卤素、 羧基特别是硝基 用乙醛得到氯乙基化。在某些情况下用相应当醛可有氯丙基 代 替 HCl,溴甲基化以及在特殊情况下的碘甲基化都可发生。氯甲基化试剂除 HCHO/HCl 外,也可用 H2C(OMe)2/HCl 或 MeOCH2Cl 来代替。这个反应在有机合成上甚为重要, 因导入氯甲基后进一步可转化为-CH2OH,-CHO,-CH2CN,-CH2NH2 及-CH3 等基团。 7. Bouvealt 合成法 N,N-二烷基甲酰胺与一分子格氏试剂在干醚的存在下发生作用,生成的中间产物再经水 解,可得醛类化合物,R’MgX 中 R’基团越大,醛的产率越高。
2020年有机化学反应的96种反应类型精品版

有机化学反应机理一、Arbuzov 反应二、Arndt-Eister 反应三、Baeyer-villiger 反应四、Beckmann 重排五、Birch 还原六、Bouveault-Blanc 还原七、Bucherer 反应八、Bamberger,E. 重排九、Berthsen,A.Y 吖啶合成法十、Cannizzaro 反应十一、Chichibabin 反应十二、Claisen 酯缩合反应十三、Claisen-Schmidt 反应十四、Claisen 重排十五、Clemmensen 还原十六、Combes 喹啉合成法十七、Cope 消除反应十八、Cope 重排十九、Curtius 反应二十、Crigee,R 反应二十一、Dakin 反应二十二、Elbs 反应二十三、Edvhweiler-Clarke 反应二十四、Elbs,K 过硫酸钾氧化法二十五、Favorskii 反应二十六、Favorskii 重排二十七、Friedel-Crafts 烷基化反应二十八、Friedel-Crafts 酰基化反应二十九、Fries 重排三十、Fischer,O-Hepp,E 重排三十一、Gabriel 合成法三十二、Gattermann 反应三十三、Gattermann-Koch 反应三十四、Gomberg-Bachmann 反应三十五、Hantzsch 合成法三十六、Haworth 反应三十七、Hell-Volhard-Zelinski反应三十八、Hinsberg 反应三十九、Hofmann 烷基化四十、Hofmann 消除反应四十一、Hofmann 重排(降解)四十二、Houben-Hoesch 反应四十三、Hunsdiecker 反应四十四、Kiliani 氯化增碳法四十五、Knoevenagel 反应四十六、Koble 反应四十七、Koble-Schmitt 反应四十八、Kolbe,H.Syntbexis of Nitroparsffini 合成四十九、Leuckart 反应五十、Lossen 反应五十一、Mannich 反应五十二、Meerwein-Ponndorf 反应五十三、Michael 加成反应五十四、Martius,C.A. 重排五十五、Norrish Ⅰ和Ⅱ型裂五十六、Oppenauer 氧化五十七、Orton,K.J.P 重排五十八、Paal-Knorr 反应五十九、Pschorr 反应六十、Prileschajew,N 反应六十一、Prins,H.J 反应六十二、Pinacol 重排六十三、Perkin,W.H 反应六十四、Pictet-Spengler异喹啉合成法六十五、Reformatsky 反应六十六、Reimer-Tiemann 反应六十七、Reppe 合成法六十八、Robinson 缩环反应六十九、Rosenmund 还原七十、Ruff 递降反应七十一、Riley,H.L 氧化法七十二、Sandmeyer 反应七十三、Schiemann 反应七十四、Schmidt 反应七十五、Skraup 合成法七十六、Sommelet-Hauser 反应七十七、Stepen 还原-氰还原为醛七十八、Stevens 重排七十九、Strecker 氨基酸合成法八十、异喹啉合成法八十一、Schiemann,G. 反应八十二、Schmidin,J. 乙烯酮合成八十三、Tiffeneau-Demjanov 重排八十四、Tischenko,V.反应八十五、Thorpe,J.F. 缩合八十六、Tollens,B. 缩合八十七、Ullmann 反应八十八、Urech,F.羟腈合成法八十九、Vilsmeier 反应九十、Van Ekenstein,W,A 重排九十一、Williamson 合成法九十二、Wacker 反应九十三、Wagner-Meerwein 重排九十四、Wittig 反应九十五、Wittig-Horner 反应九十六、Wohl 递降反应Arbuzov 反应亚磷酸三烷基酯作为亲核试剂与卤代烷作用,生成烷基膦酸二烷基酯和一个新的卤代烷:卤代烷反应时,其活性次序为:R'I >R'Br >R'Cl。
有机化学方程式(70个)

有机化学基础反应方程式汇总1. 甲烷(烷烃通式:C n H 2n +2)甲烷的制取:CH 3CaO △2CO 3+CH 4↑(1)氧化反应甲烷的燃烧:CH 4+2O 2 点燃CO 2+2H 2O甲烷不可使酸性高锰酸钾溶液及溴水褪色。
(2)取代反应CH 4+Cl 光照3Cl(一氯甲烷)+HClCH 3Cl+Cl 光照2Cl 2(二氯甲烷)+HClCH 2Cl 2+Cl 光照3(三氯甲烷)+HCl (CHCl 3又叫氯仿)CHCl 3+Cl 光照4(四氯化碳)+HCl(3)分解反应甲烷分解:CH 高温22. 乙烯(烯烃通式:C n H 2n )乙烯的制取:CH 3CH 2浓硫酸170℃2=CH 2↑+H 2O(消去反应)(1)氧化反应乙烯的燃烧:CH 2=CH 2+3O 点燃2+2H 2O乙烯可以使酸性高锰酸钾溶液褪色,发生氧化反应。
(2)加成反应与溴水加成:CH 2=CH 2+Br 2Br —CH 2Br与氢气加成:CH 2=CH 2+H 2催化剂CH 3CH 3 与氯化氢加成:CH 2=CH 2+HCl 催化剂CH 3CH 2Cl 与水加成:CH 2=CH 2+H 2O催化剂CH 3CH 2OH(3)聚合反应 乙烯加聚,生成聚乙烯:n CH 2=CH 2催化剂 [CH 2—CH 2 ] n 适当拓展:CH 3CH =CH 2+Cl 3׀ Cl CH -׀ ClCH 2 CH 3CH =CH 2+H 2催化剂CH 3CH 2CH 3 CH 3CH =CH 2+HCl 催化剂CH 3CH 2CH 2Cl 或CH 3׀ ClCHCH 3 CH 3CH =CH 2+H 2O 催化剂CH 3CH 2CH 2OH 或CH 3׀ OHCHCH 3 n CH 2=CH -CH 3催化剂 [CH 2—׀ CH 3CH ] n (聚丙烯) 3. 乙炔(炔烃通式:C n H 2n-2)乙炔的制取:CaC 2+2H 2 CH ↑+Ca(OH)2(1)氧化反应乙炔的燃烧:HC ≡CH+5O 点燃2+2H 2O乙炔可以使酸性高锰酸钾溶液褪色,发生氧化反应。
山东省考研化学复习资料有机化学反应机理梳理

山东省考研化学复习资料有机化学反应机理梳理有机化学反应机理是山东省考研化学复习中的重要内容之一。
掌握有机化学反应的机理和规律,对于理解有机化学的基本原理和解决实际问题至关重要。
本文将对一些常见的有机化学反应机理进行梳理,以帮助考生全面复习和准备考试。
一、烷烃与卤代烷基反应机理烷烃与卤代烷基反应是有机化学中最基础的反应之一,也是考研化学中的常见考点。
这类反应的典型代表是取代反应和消除反应。
1. 取代反应取代反应是指烷烃中的氢原子被卤代烷基取代的反应。
这类反应一般遵循亲电取代机理,包括亲核试剂的进攻和负离子的离去两个关键步骤。
常见的取代反应有卤代烷基的亲电取代反应、S_N1和S_N2反应等。
2. 消除反应消除反应是指烷烃中的两个邻接碳原子之间的一个或多个碳-碳键被断裂,生成多个不饱和化合物和/或环状化合物的反应。
常见的消除反应有β-消除反应、醇的去水反应和醇酸的脱水反应等。
二、醇的反应机理醇是有机化学中常见的官能团,其反应机理的掌握对深入理解有机化学的基本概念和解决问题至关重要。
下面将介绍一些常见的醇的反应机理。
1. 醇的氧化反应醇的氧化反应是指醇被氧化剂氧化形成醛、酮或羧酸的反应。
常见的氧化剂有酸性高锰酸钾(KMnO4)、高铬酸盐等。
氧化反应的机理通常涉及醇的质子化和酸碱中心的形成,然后进行氧化。
2. 醇的酯化反应醇的酯化反应是指醇和酸发生酯键的形成反应。
酯化反应的机理涉及醇的质子化和酸碱中心的形成,然后进行酯键形成。
三、醛和酮的反应机理醛和酮是有机化学中常见的官能团,其反应机理的掌握对于理解有机化学的基本原理和解决实际问题具有重要意义。
下面将介绍一些常见的醛和酮的反应机理。
1. 加成反应加成反应是指醛或酮中的羰基碳与亲核试剂发生加成的反应。
常见的加成反应有羟醛的生成反应、胺的加成反应等。
2. 氧化还原反应醛和酮的氧化还原反应是指醛或酮中的羰基碳上的氢原子在一定条件下被氧化剂或还原剂氧化或还原的反应。
有机化学反应公式

有机化学反应公式
有机化学反应式是一个比较广泛的题目,因为有机化学反应式包括了很多不同的反应类型和反应条件。
以下是一些常见的有机化学反应式,但请注意,这并不是完整的有机化学反应式列表。
烷烃的燃烧反应:CH4 + 2O2 →CO2 + 2H2O
烷烃的氯代反应:CH4 + Cl2 →CH3Cl + HCl
烯烃的加成反应:CH2=CH2 + H2 →CH3CH3
烯烃的氧化反应:CH2=CH2 + O2 →CH3CHO
烯烃的聚合反应:nCH2=CH2 →-[-CH2-CH2-]n-
苯的硝化反应:C6H6 + HNO3 →C6H5NO2 + H2O
苯的磺化反应:C6H6 + H2SO4 →C6H5SO3H + H2O
醇的酯化反应:CH3OH + CH3COOH →CH3COOCH3 + H2O
酮的还原反应:2CH3COCH3 + H2 →CH3CH(OH)CH3
醛的氧化反应:CH3CHO + O2 →CH3COOH
以上只是有机化学反应式的一部分,有机化学是一个非常广泛和复杂的领域,有许多其他的反应和机制。
常见的化学反应

常见的化学反应有机化学反应主要有:取代反应、加成反应、消去反应、氧化反应、还原反应、聚合反应、水解反应、酯化反应等,考查的方式有:对陌生的有机反应类型的判断;根据各类有机反应的机理书写有机化学反应方程式。
常见的有机化学反应类型如下:一、取代反应有机物分子里某些原子或原子团被其它原子或原子团所替代的反应。
1、卤代反应:如甲烷、苯的卤代反应。
2、硝化反应:例如苯、甲苯硝化反应。
3、水解反应:卤代烃的水解、酯的水解、油脂的水解(包括皂化反应)、二糖和多糖的水解、蛋白质的水解。
4、酯化反应:酸和醇促进作用分解成酯和水的反应。
注意点:①取代与置换不同,置换中一定有单质参加反应,并生成一种新的单质,而取代则不一定有单质参加反应或生成。
②被取代的一定是有机物分子中的原子或原子团,而用来取代的原子或原子团可以是有机物分子中的原子或原子团,也可以是无机物分子中的原子或原子团。
二、加成反应有机物分子中不饱和碳原子跟其它原子和原子团结合生成新物质的反应。
通常不饱和碳原子主要指c=c、c=o(一般不含羧酸或酯中的c=o)、碳碳叁键以及具有一定不饱和性的苯环。
1、在催化剂的促进作用下,烯烃、炔烃、苯和苯的同系物、醛、酮及油脂及氢气出现的加成反应。
2、常温下含有不饱和碳原子的有机物与卤素单质、卤代氢的加成反应:如烯、炔、油脂等有机物。
如乙烯→氯乙烷。
3、与水的加成反应:烯、炔等所含不饱和碳原子有机物在催化剂促进作用下,可以跟水出现加成反应。
例如乙烯水化分解成乙醇。
注意点:①发生加成反应的主体都是含有不饱和键的有机物,加成的物质往往是非金属单质(h2、cl2等)或小分子化合物(h2o、hx等)。
②不饱和键是发生加成反应的前提条件下,不饱和键含碳碳之间的双键、三键,还有碳氧之间的双键、碳氮之间的三键。
三、解出反应有机物在适当的条件下,从一个分子内脱去小分子(如水、hx等),生成不饱和(双键或叁键)化合物的反应。
1、醇的解出:例如实验室用乙醇制备乙烯。
天津市考研化学复习资料有机化学重点反应机理解析

天津市考研化学复习资料有机化学重点反应机理解析在天津市考研化学复习资料中,有机化学是考生们需要特别重点关注的一部分。
有机化学是化学的一个重要分支,主要研究有机物的结构、性质、合成和反应机理。
下面将针对天津市考研化学复习资料中的有机化学重点反应机理进行解析。
一、取代反应取代反应是有机化学中比较常见的一类反应,它是指有机物中的一个原子或基团被另一个原子或基团取代的过程。
1. 氯代烃的取代反应氯代烃的取代反应是有机化学中最基础的反应之一。
常见的取代反应包括卤代烃的亲电取代反应和亲核取代反应。
亲电取代反应中,亲电试剂攻击卤代烃,将其取代出去。
常见的亲电试剂有氢氧根离子(OH-),称为亲电试剂的亲核试剂。
例如,氯乙烷和氢氧化钠反应得到乙醇:CH3CH2Cl + NaOH → CH3CH2OH + NaCl亲核取代反应中,亲核试剂攻击卤代烃,将其取代出去。
常见的亲核试剂有氨(NH3)和胺。
例如,氯乙烷和氨反应得到乙胺:CH3CH2Cl + NH3 → CH3CH2NH2 + HCl2. 醇的取代反应醇的取代反应是指醇中的羟基(-OH)被其他原子或基团取代的反应。
常见的醇的取代反应包括酸催化烷基化反应和酯化反应。
酸催化烷基化反应中,醇通过酸催化作用,羟基被烷基取代。
例如,甲醇和溴乙烷反应得到乙醚:CH3OH + CH3CH2Br → CH3OCH2CH3 + HBr酯化反应中,醇和酸反应生成酯。
例如,甲醇和乙酸反应得到乙酸甲酯:CH3OH + CH3COOH → CH3COOCH3 + H2O二、加成反应加成反应是指有机化合物中两个或多个原子或基团以共价键结合的方式结合在一起。
1. 烯烃的加成反应烯烃的加成反应是烯烃分子中两个或多个双键上的碳原子被其他原子或基团加成的反应。
常见的烯烃的加成反应包括氢化反应和卤素加成反应。
氢化反应是将烯烃中的双键与氢气加成生成烷烃。
例如,乙烯和氢气反应得到乙烷:CH2=CH2 + H2 → CH3-CH3卤素加成反应是将烯烃中的双键与卤素加成生成卤代烃。
有机化学方程式汇总

有机化学方程式汇总有机化学反应方程式汇总1.甲烷与氯气的反应:CH4 + Cl2 → CH3Cl + HClCH3Cl + Cl2 → CH2Cl2 + HClCH2Cl2 + Cl2 → CCl4 + HCl(分步取代)燃烧:CH4 + 2O2 → CO2 + 2H2O2.烷烃的燃烧通式:CnH2n+2 + (3n+1)O2 → nCO2 + (2n+2)H2O3.甲烷的热分解:CH4 高温 C + 2H24.烷烃的热分解:C4H10 → C2H4 + C2H6C4H10 → CH4 + C3H65.乙烯实验室制法:XXX H2SO4 → CH2=CH2 ↑(浓硫酸为催化剂和脱水剂)点燃:CH2=CH2 + 3O2 → 2CO2 + 2H2O6.乙烯的燃烧:CH2=CH2 + 3O2 → 2CO2 + 2H2O7.乙烯通入溴水中:CH2=CH2 + Br2 → CH2BrCH2Br8.乙烯和氢气加成:催化剂:CH3CH=CH2 + H2 → CH3CH2CH39.乙烯和HCl的反应:催化剂:CH2=CH2 + HCl → CH3CH2Cl10.乙烯水化制乙醇:CH2=CH2 + H2O → CH3CH2OH11.乙烯催化氧化制备乙醛:催化剂:2CH2=CH2 + O2 → 2CH3CHO加热加压:CH2―CH2―n―CH2―CH―12.乙烯的加聚反应:催化剂:n CH2=CH2 → (-CH2-CH2-)n13.制取聚丙烯:催化剂:n CH3CH=CH2 → (-CH2-CH(CH3)-)n14.1,3-丁二烯的加成反应:1,2加成:CH2=CH-CH=CH2 + Cl2 → CH2Cl-CH(Cl)-CH=CH2 Cl + Cl2 → Cl21,4加成:Cl完全加成+ 2Cl2 → Cl3CCCl315.1,3-丁二烯的加成反应:n CH2=C-CH=CH2 → (-CH2-C=CH-CH2-)n-CH316.乙炔的制取:CaC2 + 2H2O → C2H2 ↑ + Ca(OH)2点燃:2C2H2 + 5O2 → 4CO2 + 2H2O18.乙炔的燃烧公式为O(l) + 2600 kJ,表示在氧气存在下,乙炔会燃烧并释放出2600千焦的能量。
有机化学方程式汇总

有机化学方程式汇总
有机化学是研究有机化合物的合成、结构、性质和反应等方面的学科。
下面是一些有机化学方程式的汇总,供参考。
1.醇的酸催化脱水反应:
醇+酸催化剂→烯烃+水
2.醇的氧化反应:
醇+氧气→酮+水
3.乙醇的酸催化羟醛反应:
乙醇+酸催化剂→乙醛+水
4.乙烯的加成反应:
乙烯+HCl→1,2-二氯乙烷
5.乙酸的脱羧反应:
乙酸→乙烯+二氧化碳
6.酯的酸催化水解反应:
酯+酸催化剂+水→酸+醇
7.酮的还原反应:
酮+还原剂→醇
8.烷烃的卤代反应:
烷烃+卤素→卤代烷
9.烯烃的氢化反应:
烯烃+氢气→饱和烃
10.碳烯的环化反应:
碳烯+碳烯→环烃
11.二酮的恶英酮合成反应:
二酮+烯醇→恶英酮
12.烯烃的氧化反应:
烯烃+氧气→带有双键氧官能团的化合物
13.炔烃的氢化反应:
炔烃+氢气→烯烃
14.进行芳香族亲电取代反应的芳香烃:
芳香烃+亲电试剂(例如:卤素、硝酸、酸酐等)→取代芳香烃
15.进行求核取代反应的芳香烃:
芳香烃+强求核试剂(例如:亚硝酸钠、乙酰氯等)→取代芳香烃
16.逆反应(加甲基):
CH3O-+CH3Cl→CH3OH+Cl-
17.卤酸与酸酐反应生成酸:
HBr+CH3COOH→CH3COOH+Br-
以上是一些常见有机化学方程式的汇总,供参考。
有机化学方程式种类繁多,需要根据具体情况进行研究和应用。
有机化学反应方程式汇总
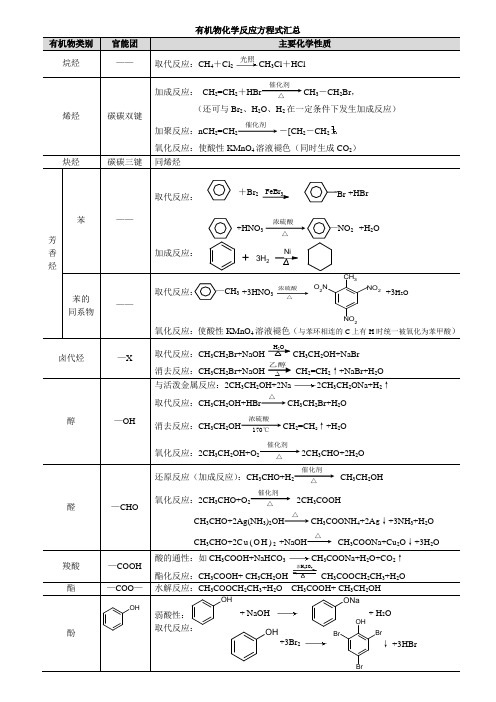
浓硫酸△ 有机物化学反应方程式汇总有机物类别官能团 主要化学性质 烷烃——取代反应:CH 4+Cl 2CH 3Cl +HCl烯烃碳碳双键加成反应: CH 2=CH 2+HBr催化剂 △CH 3-CH 2Br ,(还可与Br 2、H 2O 、H 2在一定条件下发生加成反应)加聚反应:nCH 2=CH 2催化剂-[CH 2-CH 2氧化反应:使酸性KMnO 4溶液褪色(同时生成CO 2)炔烃碳碳三键同烯烃 芳香烃苯——取代反应: FeBr 3加成反应:苯的 同系物——取代反应:氧化反应:使酸性KMnO 4溶液褪色(与苯环相连的C 上有H 时统一被氧化为苯甲酸)卤代烃 —X取代反应:CH 3CH 2Br+NaOHH 2OCH 3CH 2OH+NaBr消去反应:CH 3CH 2Br+NaOH CH 2=CH 2↑+NaBr+H 2O 醇—OH与活泼金属反应:2CH 3CH 2OH+2Na 2CH 3CH 2ONa+H 2↑取代反应:CH 3CH 2OH+HBr△CH 3CH 2Br+H 2O 消去反应:CH 3CH 2OH浓硫酸 170℃CH 2=CH 2↑+H 2O氧化反应:2CH 3CH 2OH+O 2催化剂 △2CH 3CHO+2H 2O醛—CHO还原反应(加成反应):CH 3CHO+H 2催化剂 △CH 3CH 2OH氧化反应:2CH 3CHO+O 2催化剂 △2CH 3COOHCH 3CHO+2Ag(NH 3)2OH△CH 3COONH 4+2A g ↓+3NH 3+H 2OCH 3CHO+2C u (O H )2 +NaOH△CH 3COONa+Cu 2O ↓+3H 2O羧酸 —COOH 酸的通性:如CH 3COOH+NaHCO 3CH 3COONa+H 2O+CO 2↑酯化反应:CH 3COOH+ CH 3CH 2OH 浓H 2SO 4CH 3COOCH 2CH 3+H 2O 酯—COO —水解反应:CH 3COOCH 2CH 3+H 2OCH 3COOH+ CH 3CH 2OH酚弱酸性:取代反应: 光照+HNO 3—NO 2 +H 2O浓硫酸 △OHOH + NaOH ONa + H 2O OH+3Br 2OHBrBrBr+3HBr↓ 乙醇+HBr+Br 2 Br —CH 3 +3HNO 3 CH 3NO 2O 2N NO 2+3H 2O +3H 2Ni反应试剂有机物类别或官能团反应类型反应方程式举例X2氯气、液溴CH4+Cl2CH3Cl+HCl浓溴水苯酚取代反应溴水或溴的四氯化碳溶液“C=C”或“C≡C”加成反应H2C=CH2 + Br2 BrH2C-CH2BrHX “C=C”或“C≡C”加成反应H2C=CH2+HBr催化剂△H3C-CH2Br醇取代反应CH3CH2OH+HBr△CH3CH2Br+H2OH2O “C=C”或“C≡C”加成反应H2C=CH2+H2O催化剂△H3C-CH2OH酯水解反应CH3COOCH3+H2O催化剂△CH3COOH+CH3OHNa 醇、苯酚、—COOH置换反应2CH3CH2OH+ 2Na 2CH3CH2ONa+H2↑NaOH 苯酚、—COOH中和反应HCOOH+NaOH HCOONa+H2O酯水解反应CH3COOCH3+ NaOH CH3COONa+CH3OH卤代烃取代反应CH3CH2Br+NaOH△CH3CH2OH+NaBr消去反应CH3CH2Br+NaOH CH2= CH2↑+NaBr+H2ONa2CO3苯酚、—COOH复分解反应NaHCO3—COOH 复分解反应HCOOH+NaHCO3==HCOONa+CO2↑+H2OH2“C=C”或“C≡C”加成反应H2C=CH2+H2催化剂△H3C-CH3苯环加成反应羰基、醛基加成反应(还原反应)CH3CHO +H2催化剂△CH3CH2OH银氨溶液、新制Cu(OH)2醛、葡萄糖氧化反应略O2醛、醇氧化反应2CH3CHO+O2催化剂△2CH3COOH 大多数有机物氧化反应大多数有机物可燃烧生成CO2和H2O酸性KMnO4溶液醛、醇、酚、“C=C”、“C≡C”苯的同系物氧化反应略乙醇OH+3Br2OHBrBrBr+3HBr↓光照取代反应烷烃、苯环+3H2Ni。
100种有机化学人名反应(有机化学)

1. ArndtEistert反应醛、酮与重氮甲烷反应失去氮并重排成多一个CH2基的相应羰基化合物这个反应对于环酮的扩环反应很重要。
OCH2N2O-CH2NNN2重排O2. BaeyerVilliger氧化应用过氧酸使酮氧化成酯。
反应中在酮的羰基和相邻的碳原子之间引人一个氧原子。
如由樟脑生成内酯OCH3CH3CH3OOCH3CH3H2SO5有时反应能生成二或多过氧化物但环状酮转变为内酯能得到单一的预期产物。
合适的酸为过硫酸Caro’s 酸、过氧苯甲酸、三氟过氧乙酸。
除环酮外无环的脂肪、芳香酮也可发生此反应。
二酮生成酸酐类、α、β不饱和酮得到烯醇酯类。
3. Bechamp还原可用于工业制备在铁、亚铁盐和稀酸的作用下芳香族硝基化合物能还原成相应的芳香胺。
C6H5-NO2 2Fe 6HCl C6H5-NH2 2FeCl3 2H2O。
当某些盐FeCl2、FeCl3、FeSO4、CaCl2等存在时所用酸无论是过量还是少量甚至在中性溶液中都能够进行这种还原。
此方法适用于绝大部分各种不同结构的芳香族化合物有时也用来还原脂肪族硝基化合物。
4. Beckmann重排醛肟、酮肟用酸或路易斯酸处理后最终产物得酰胺类。
单酮肟重排仅得一种酰胺混酮肟重排得两种混合酰胺。
但一般质子化羟基的裂解和基团R的转移是从相反的位置同时进行的。
NOHRRRNHRONRROHRNHRO 无论酯酮肟和芳酮肟都会发生此反应。
环酮肟重排得内酰胺这在工业生产上很重要利用此反应可帮助决定异构酮肟的结构。
5. Beyer喹啉类合成法芳香伯胺与一分子醛及一分子甲基酮在浓盐酸或ZnCl2存在下反应生成喹啉类化合物。
NH2NHRRHNRRRCHORCOCH3HCl H2这是对Doebner-Miller喹啉合成法的改进。
Doebner-Miller合成法由芳胺和不饱和醛或酮反应得到喹啉衍生物。
NH2NHCH3HNCH3 H2CH3O2CH3CHO 6. Blanc氯甲基化反应芳香族化合物苯、萘、蒽、菲、联苯及衍生物在ZnCl2或NH4Cl、AlCl3、SnCl4、H2SO4、H3PO4 存在下用甲醛和极浓盐酸处理发生芳香化合物的氯甲基化反应。
(完整版)有机化学反应方程式汇总

浓硫酸△ 有机物类别官能团 主要化学性质 烷烃——取代反应:CH 4+Cl 2CH 3Cl +HCl烯烃碳碳双键加成反应: CH 2=CH 2+HBr催化剂 △CH 3-CH 2Br ,(还可与Br 2、H 2O 、H 2在一定条件下发生加成反应)加聚反应:nCH 2=CH 2催化剂-[CH 2-CH 2氧化反应:使酸性KMnO 4溶液褪色(同时生成CO 2)炔烃碳碳三键同烯烃 芳香烃苯——取代反应: FeBr 3加成反应:苯的 同系物——取代反应:氧化反应:使酸性KMnO 4溶液褪色(与苯环相连的C 上有H 时统一被氧化为苯甲酸)卤代烃 —X取代反应:CH 3CH 2Br+NaOHH 2OCH 3CH 2OH+NaBr消去反应:CH 3CH 2Br+NaOH CH 2=CH 2↑+NaBr+H 2O 醇—OH与活泼金属反应:2CH 3CH 2OH+2Na 2CH 3CH 2ONa+H 2↑取代反应:CH 3CH 2OH+HBr△CH 3CH 2Br+H 2O 消去反应:CH 3CH 2OH浓硫酸 170℃CH 2=CH 2↑+H 2O氧化反应:2CH 3CH 2OH+O 2催化剂 △2CH 3CHO+2H 2O醛—CHO还原反应(加成反应):CH 3CHO+H 2催化剂 △CH 3CH 2OH氧化反应:2CH 3CHO+O 2催化剂 △2CH 3COOHCH 3CHO+2Ag(NH 3)2OH△CH 3COONH 4+2A g ↓+3NH 3+H 2OCH 3CHO+2C u (O H )2 +NaOH△CH 3COONa+Cu 2O ↓+3H 2O羧酸 —COOH 酸的通性:如CH 3COOH+NaHCO 3CH 3COONa+H 2O+CO 2↑酯化反应:CH 3COOH+ CH 3CH 2OH 浓H 2SO 4CH 3COOCH 2CH 3+H 2O 酯—COO —水解反应:CH 3COOCH 2CH 3+H 2OCH 3COOH+ CH 3CH 2OH酚弱酸性:取代反应: 光照+HNO 3—NO 2 +H 2O浓硫酸 △OHOH + NaOH ONa + H 2O OH+3Br 2OHBrBrBr+3HBr↓ 乙醇+HBr+Br 2 Br —CH 3 +3HNO 3 CH 3NO 2O 2N NO 2+3H 2O +3H 2Ni反应试剂有机物类别或官能团反应类型反应方程式举例X2氯气、液溴CH4+Cl2CH3Cl+HCl浓溴水苯酚取代反应溴水或溴的四氯化碳溶液“C=C”或“C≡C”加成反应H2C=CH2 + Br2 BrH2C-CH2BrHX “C=C”或“C≡C”加成反应H2C=CH2+HBr催化剂△H3C-CH2Br醇取代反应CH3CH2OH+HBr△CH3CH2Br+H2OH2O “C=C”或“C≡C”加成反应H2C=CH2+H2O催化剂△H3C-CH2OH酯水解反应CH3COOCH3+H2O催化剂△CH3COOH+CH3OHNa 醇、苯酚、—COOH置换反应2CH3CH2OH+ 2Na 2CH3CH2ONa+H2↑NaOH 苯酚、—COOH中和反应HCOOH+NaOH HCOONa+H2O酯水解反应CH3COOCH3+ NaOH CH3COONa+CH3OH卤代烃取代反应CH3CH2Br+NaOH△CH3CH2OH+NaBr消去反应CH3CH2Br+NaOH CH2= CH2↑+NaBr+H2ONa2CO3苯酚、—COOH复分解反应NaHCO3—COOH 复分解反应HCOOH+NaHCO3==HCOONa+CO2↑+H2OH2“C=C”或“C≡C”加成反应H2C=CH2+H2催化剂△H3C-CH3苯环加成反应羰基、醛基加成反应(还原反应)CH3CHO +H2催化剂△CH3CH2OH银氨溶液、新制Cu(OH)2醛、葡萄糖氧化反应略O2醛、醇氧化反应2CH3CHO+O2催化剂△2CH3COOH 大多数有机物氧化反应大多数有机物可燃烧生成CO2和H2O酸性KMnO4溶液醛、醇、酚、“C=C”、“C≡C”苯的同系物氧化反应略乙醇OH+3Br2OHBrBrBr+3HBr↓光照取代反应烷烃、苯环+3H2Ni。
有机化学方程式总结

有机化学方程式总结有机化学是一门研究有机化合物的组成、结构、性质和变化的科学。
在有机化学的学习中,掌握各种有机化合物的化学反应方程式是非常重要的一部分。
下面是对一些常见有机化学反应方程式的总结:1、烷烃的取代反应CH4 + Cl2 → CH3Cl + HCl2、烯烃的加成反应CH2=CH2 + H2 → CH3CH33、炔烃的加成反应CH≡CH + 2H2 → CH3CH34、醇的氧化反应2CH3CH2OH + O2 → 2CH3CHO + 2H2O5、酮的氧化反应2RCOCH3 + O2 → 2RCOCHO + 2H2O6、羧酸的酯化反应CH3COOH + CH3CH2OH → CH3COOCH2CH3 + H2O7、酯的水解反应CH3COOCH2CH3 + H2O → CH3COOH + CH3CH2OH8、醛的还原反应R-CHO + H2 → R-CH2OH9、酮的还原反应R-CO-R' + H2 → R-CH2-R' + H2O10、酰胺的水解反应NH2CO-R + H2O → NH3 + R-COOH以上仅是一些常见的有机化学反应方程式,但它们是学习有机化学的基础。
通过理解和记忆这些反应方程式,可以更好地理解有机化学的原理和应用。
对于一些复杂的有机化学反应,需要更加深入的学习和理解。
真空泄污系统自控系统是一种高效、环保的自动化设备,专门设计用于处理和减少废物排放。
此系统利用真空技术,自动抽取和处理废气、废液等污染物,达到国家环保排放标准。
真空泵:用于产生负压,从污染源抽取污染物。
传感器:检测污染物的种类和浓度,以便控制系统能够做出相应的调整。
控制系统:根据污染物的种类和浓度,自动调整真空泵的工作状态和净化设备的运行。
净化设备:对抽取的污染物进行过滤、吸附、化学反应等处理,降低或消除污染。
排放系统:经过处理的污染物被安全地排放到大气中。
自动检测:系统自动检测污染物的种类和浓度,实时调整处理策略。
有机化学重要化学反应知识点及例题(含答案)

一些重要有机化学反应类型【知识梳理】1.取代反应(1)概念:有机物分子里的原子或原子团被其他的原子或原子团代替的反应叫做取代反应,判断时抓住“取而代之”的特征。
(2)取代反应包括:卤代反应、酯化反应、硝化反应、水解反应、磺化反应等反应。
①卤代反应:CH 4+Cl2HCl+CH3Cl②酯化反应:③卤代烃水解:④酯的水解:⑤醇与HX反应:⑥成醚:⑦硝化反应:⑧磺化:2.加成反应(1)概念:有机物分子里不饱和碳原子和其它原子或原子团直接结合而生成新物质的反应叫做加成反应,判断时抓住“断键相连”的特征。
(2)加成反应:①加氢:CH2=CH2+H2CH3CH3②加卤素:③加水:CH2=CH2+H2O CH3CH2OHCH≡CH+ H2O CH3CHO④加HX:⑤乙炔加成加聚乙烯12 14加成加聚3.消除反应(1)概念:在适当条件下,有机物分子内脱去小分子而生成含“双键”或“叁键”化合物的反应叫做消除反应,判断时抓住“生成不饱和键加小分子”的特征。
(2)消除反应:如乙醇制乙烯CH3—CH2—OH CH2=CH2↑+H2O 卤代烃消去4.氧化反应和还原反应(1)概念:有机反应中的“氧化反应”和“还原反应”,一般从分子中氧原子或氢原子的“得”或“失”来理解的。
有机分子得氧或失氢为氧化反应,失氧或得氢为还原反应。
如:乙醛(CH3CHO)→乙醇(CH3CH2OH),加氢,还原反应。
乙醛(CH3CHO)→乙酸(CH3COOH),加氧,氧化反应。
(2)说明:有机反应中的“氧化反应”、“还原反应”,与无机反应中的“氧化还原反应”,两种说法并不矛盾,只是侧重点不一样。
前者侧重于反应物中的“有机物”发生的具体反应(氧化反应或还原反应),突出有机物的化学性质。
后者,则侧重于表现“氧化还原反应”中“氧化反应”、“还原反应”对立统一的关系,旨在突出氧化反应、还原反应是一个反应的两个方面,同时发生、缺一不可,统一在同一个化学反应中,并且伴随整个反应过程。
常见有机化学反应方程式总结

常见有机化学反应方程式总结有机化学是研究碳和其它元素之间的化学反应的科学领域。
有机化学反应方程式描述了有机化合物之间发生的化学变化,是有机化学研究的基本工具。
下面是一些常见的有机化学反应方程式的总结:1. 取代反应(Substitution reactions):-卤素代替反应:R-X+Y→R-Y+X-核磁代替反应:R-H+X→R-X+H2. 加成反应(Addition reactions):-单一加成反应:R=CH2+X-Y→R-CH2-X-Y-烯烃加成反应:R=CH2+H-CH=CH2→R-CH2-CH-CH33. 消除反应(Elimination reactions):-水解反应:R-X+H2O→R-OH+HX-甲醇酯化反应:R-COOH+CH3OH→R-CO-O-CH34. 氧化反应(Oxidation reactions):-伯醇氧化反应:R-CH2-CH2-CH2-OH→R-CH2-CH=CH2-OH-异醛氧化反应:R-CHO+[O]→R-COOH5. 还原反应(Reduction reactions):-烯烃还原反应:R-CH=CH-R→R-CH2-CH2-R-酮还原反应:R-CO-R→R-CH2-R6. 缩合反应(Condensation reactions):-酯缩合反应:R-COOH+R'-COOH→R-COO-R'+H2O-罗宾逊缩合反应:R-CHO+R'-COOH→R-CH=CH-CO-R'7. 加氢反应(Hydrogenation reactions):-炔烃加氢反应:R-CH=CH-R+H2→R-CH2-CH2-R8. 多聚反应(Polymerization reactions):-乙烯聚合反应:nCH2=CH2→-(-CH2-CH2-)n-9. 光化学反应(Photochemical reactions):-阳光下的氯代烃分解反应:R-CH2-Cl→R-CH2•+Cl•10. 还原消除反应(Reductive elimination reactions):-醇酸脱水反应:R-COOH→R-CO•+H2O以上仅是有机化学反应方程式的一小部分,还有许多其他种类的反应。
