牺牲阳极
牺牲阳极简介

牺牲阳极简介牺牲阳极是指电解池理论金属做阳极情况下,阳极(金属)随着流出的电流而逐渐消耗,故称为牺牲阳极。
牺牲阳极通常仅经济地应用在保护电流需要量小的构筑物上和低土壤电阻率环境中。
锌阳极铝阳极镁阳极牺牲阳极工作原理根据电化学原理,把不同电极电位的两种金属置于电解质体系内,当有导线连接时就有电流流动,这时,电极电位较负的金属为阳极、利用两金属的电极电位差作阴极保护的电流源。
这就是牺牲阳极法的基本原理。
牺牲阳极材料的要求:1、要有足够负的稳定电位;2、自腐蚀速率小且腐蚀均匀,要有高而稳定的电流效率;3、阳极材料的电容量要大;4、必须有高的电流效率;5、工作中阳极极化要小,溶解均匀,产物易脱落;6、腐蚀产物不污染环境,无公害;7、材料来源广,加工容易,价格低廉。
牺牲阳极材料分类常用的牺牲阳极材料主要有镁和镁合金、锌和锌合金、铝合金三大类。
在个别工程项目中,由于情况特殊而采用了铁阳极或锰阳极作为牺牲阳极进行阴极保护。
1.铝合金牺牲阳极:多用于海洋或容器(储罐)内阴极保护。
钢桩码头安装铝阳极2.锌合金牺牲阳极:用于海水或低电阻率的土壤中,应用条件土壤电阻率≤15Ω·m。
3.镁合金牺牲阳极:多用于土壤环境,应用条件土壤电阻率≥15Ω·m。
由这三种金属材料又生产出多种形状、类型的不同的牺牲阳极。
我们立博防腐工程有限公司生产的种类繁多,其中包括:锌带、船体常用锌合金牺牲阳极、压载水舱常用锌合金牺牲阳极、海洋工程常用锌合金牺牲阳极、储罐内常用锌合金牺牲阳极、储罐内常用铝合金阳极、港工设施铝合金牺牲阳极、镯式铝合金牺牲阳极、高电位镁合金牺牲阳极、镯式镁合金牺牲阳极、镁带等多种环境适用型号。
牺牲阳极的优缺点优点:1.不需要外部电源,容易安装;2.一次性投资费用低,在运行过程中很少维护;3.无杂散电流干扰,适用于厂区和无电源的长输管道,以及小规模的分散管道保护;4.保护电流的利用率较高,不会产生过保护;5.多数情况下易于增加阳极;6.提供均匀的电流分配;缺点:1.较低的驱动电压/电流,保护范围小;2.对于劣质涂层的结构物需要较多的阳极;3.在高电阻的土壤环境下受限制,即土壤电阻率大于50Ω.m时,一般不宜选用牺牲阳极保护法;5.有效阴极保护年限受牺牲阳极寿命的限制,需要定期更换;。
阴极保护中各类牺牲阳极种类及其特点

阴极保护中各类牺牲阳极种类及其特点工程中常用的牺牲阳极材料主要有镁和镁合金、锌和锌合金、铝合金三大类。
在个别工程项目中,由于情况特殊而采用了铁阳极或锰阳极作为牺牲阳极进行阴极保护。
镁基牺牲阳极因具有很负的开路电位和很大的驱动电压等性能而广泛的应用于土壤、海水、海泥及工业水中对金属结构物进行阴极保护。
但它的电流效率低,是一大缺点。
锌基牺牲阳极的开路电位不如镁基阳极那么负,驱动电压不大,但它仍能在低电阻率土壤、海水、海泥环境中广泛用于牺牲阳极保护。
铝基牺牲阳极的开路电位比锌基阳极略负,它的理论电容量远高于锌基和镁基阳极,具有独特的性能。
但是它是易于钝化的金属材料,在其表面容易产生致密、附着性好的连续氧化膜,甚至产生一层高电阻硬壳,阻碍金属的活化溶解。
目前铝基阳极广泛应用于海水中保护船舶、平台、码头等海洋结构物,在海泥(海底管道)、盐水系统也获得了成功的应用,但尚不能应用于土壤环境中。
镁是典型的轻金属,原子序数12,相对原子质量24.31,密度1.74g/cm,化合价2,熔点651℃.镁的标准电极电位-2.37(SHE)。
镁的特点是:密度小具有较高的化学活泼性;电极电位很负;极化率低;驱动电位大,对铁的驱动电位可达0.6V以上;理论电容量大。
在镁阳极表面不易形成屏蔽性保护膜。
镁和镁合金系列牺牲阳极,电流效率很低一般只有50%左右。
在镁表面易形成较为强烈的腐蚀原电池作用,导致自溶解速率较大。
此外,这种材料如遇碰撞易产生火花等特点,也限制了它在高安全区性能区域的应用,例如:油轮、敏感的易燃易爆区等特定场所。
锌是一种普通的重金属,原子序数30,相对原子质量65.37,密度7.14g/cm,化合价2,熔点420℃。
锌的标准电极电位为-0.76V(SHE),高纯锌在海水中的稳定电位为-0.82V (SHE)。
这是一种较活泼的金属,相对于钢铁及常用的金属结构材料而言是负电性的。
锌阳极在高电阻的土壤中或淡水中不太适用,通常多用于海水,、某些化学介质和低电阻率的土壤或滩涂地。
牺牲阳极的定义

中级定义
定义4:由于该金属的腐蚀对原有腐蚀电池提供保护,加快了自身的腐蚀,因此称为牺牲阳极.牺牲阳极材料应能满足下列要求:(l)要有足够的负电位,而且很稳定。 定义5:牺牲阳极法牺牲阳极(:sacrificialanode)由电位较负的金祸材料制成,当它与被保护的管道连接时,自身发生优先离解,从而抑制了管道的腐蚀,故称为牺牲阳极.牺牲阳极应有足够负的稳定电位,以保持足够大的驱动电压:同时有较大的理论发生电量,还要有高而稳 牺牲阳极
高级定义
定义8:该电位较负的电极称为牺牲阳极,因为随着电流的不断流动,阳极材料不断消耗掉.作为牺牲阳极材料,金属或合金必须满足以下条件[1]:(1)电位足够负,可供应充分的电子使被保护金属设备发生阴极极化
应用
例如:钢闸门的保护,有的就应用这种方法。它是用一种更为活泼的金属,如锌等,连接在钢闸门上。这样,当发生电化学腐蚀时,被腐蚀的就是那种比铁更活泼的金属,而铁被保护了。通常在轮船的尾部和在船壳的水线以下部分,装上一定数量的锌块,来防止船壳等的腐蚀,就是应用的这种方法。 目前,电化学保护法的应用除海水或河道中钢铁设备的保护外,还应用于防止电缆、石油管道、地下设备和化工设备等的腐蚀。
牺牲阳极
初级定义
定义1:阳极随着流出的电流而逐渐消耗,所以,称为牺牲阳极,这种阳极消耗快,安设位置及方法必须便于更换.低电位金属材料有镁、镁合金、纯锌、锌合金、铝合金等。 定义2:这种方法称牺牲阳极法阴极保护这类活泼金属或合金则称为牺牲阳极.牺牲阳极法阴极保护是应用最早的一种电化学保护技术。 牺牲阳极
牺牲阳极的工作原理

牺牲阳极的工作原理牺牲阳极,也称为非铂类阳极(Non-platinum anode, NPA),是指在金属腐蚀保护领域中,一种通过牺牲自身来延缓金属腐蚀速度的电化学保护方法。
它是利用一种与被保护金属失效电位更负的金属制成的阳极,在外加电流的作用下牺牲自身来保护被保护金属。
牺牲阳极的工作原理是基于电化学原理,主要包括两个方面:电势差和阳极溶解。
首先,电势差是牺牲阳极的存在和有效工作的前提条件。
在自然环境中或工业过程中,当两种不同金属接触时,会因为两种金属的化学性质和晶体结构的不同而产生一定的电位差。
在这种接触状态下,一种金属的电位相对于另一种金属是失效电位。
牺牲阳极的作用就是使被保护金属的电位相对于牺牲阳极更正电位,从而使被保护金属从活动状态转为失效状态,从而达到减缓腐蚀的目的。
其次,阳极溶解是牺牲阳极工作的主要过程。
当牺牲阳极与被保护金属接触并受到外加电流的作用时,它会开始溶解,并释放金属离子(阳离子)到电解质中。
这些金属离子随着电解质的流动,经过一系列的电化学反应,重新组合成金属离子,并与电解质中的阴离子结合形成相应的金属化合物。
牺牲阳极溶解的速度与腐蚀速度成正比。
这是因为牺牲阳极所含金属与被保护金属的电位差决定了牺牲阳极牺牲的程度,即牺牲阳极的失效程度。
电位差越大,牺牲阳极的失效程度越高,溶解速度也越快。
因此,通过选择合适的牺牲阳极材料,可以控制腐蚀速度。
牺牲阳极的选择要根据被保护金属的腐蚀、电位差和环境条件来确定。
一般来说,牺牲阳极应具备以下特点:与被保护金属之间差异较大的电位差,较低的自蚀速率,足够的机械强度和可加工性,以及易获取和低成本等。
牺牲阳极的工作原理在许多领域得到了广泛应用。
其中最常见的就是钢铁结构的防腐蚀措施。
在海洋环境中,以铝或锌制成的牺牲阳极被广泛用于船舶、海洋平台等大型钢结构的防腐蚀。
在石油、化工、电力等行业,以铝或镁制成的牺牲阳极也被广泛应用于储罐、管道、锅炉等设备的防腐蚀。
牺牲阳极的阴极保护原理

牺牲阳极的阴极保护原理在阴极保护技术中,牺牲阳极是一种常见的阴极保护原理。
牺牲阳极阴极保护是利用一种更容易腐蚀的金属来代替受保护金属作为阳极,从而保护受保护金属不受腐蚀。
在这种原理下,受保护金属成为阴极,而牺牲阳极则成为阳极,通过电化学反应来保护受保护金属。
牺牲阳极阴极保护原理的关键在于牺牲阳极材料的选择。
通常情况下,牺牲阳极材料应该具有更负的标准电极电势,以便能够更容易地被氧化。
常用的牺牲阳极材料包括锌、铝、镁等。
这些金属在自然环境中更容易被氧化,因此可以更好地保护受保护金属。
牺牲阳极阴极保护原理的工作原理是通过在受保护金属表面形成一个保护性的氧化膜,阻止了金属的继续腐蚀。
当牺牲阳极被氧化时,产生的电子通过外部电路流向受保护金属,使其成为阴极,从而减缓受保护金属的腐蚀速度。
这样,牺牲阳极不断被腐蚀,而受保护金属得到保护。
牺牲阳极阴极保护原理的应用非常广泛,特别是在海洋工程、管道、船舶和钢结构等领域。
在海洋工程中,海水中的氯离子容易引起金属腐蚀,而牺牲阳极可以有效地保护海洋结构。
在管道和船舶中,牺牲阳极也可以延长金属的使用寿命,减少维护成本。
然而,牺牲阳极阴极保护原理也存在一些问题。
首先,牺牲阳极需要定期更换,这会增加维护成本。
其次,牺牲阳极的性能受环境因素的影响较大,需要根据具体情况进行设计和选择。
最后,牺牲阳极的保护效果受到电流分布的影响,需要合理布置阳极以确保保护效果。
综上所述,牺牲阳极阴极保护原理是一种有效的防腐蚀技术,通过选择合适的牺牲阳极材料,可以有效地保护受保护金属不受腐蚀。
然而,在实际应用中需要注意材料选择、维护更换和电流分布等因素,以确保牺牲阳极阴极保护技术的有效性和可靠性。
牺牲阳极防腐原理

牺牲阳极防腐的基本原理牺牲阳极防腐是一种常用的金属防腐方法,它利用电化学原理,在金属结构表面形成一层保护膜,从而防止金属的腐蚀。
其基本原理涉及到电化学反应、阳极和阴极的作用以及电流的流动。
电化学反应电化学反应是指在电解质溶液中,由于电流的作用,阳极和阴极上发生的化学反应。
在牺牲阳极防腐中,电化学反应主要涉及金属的氧化和还原反应。
以铁为例,当金属表面暴露在含有氧气和水的环境中时,会发生以下反应:1.阳极反应:Fe → Fe2+ + 2e-在阳极上,铁原子失去电子,转化为二价铁离子。
2.阴极反应:O2 + 2H2O + 4e- → 4OH-在阴极上,氧气和水与电子结合,生成氢氧根离子。
阳极和阴极的作用在牺牲阳极防腐中,阳极和阴极起到了不同的作用。
1.阳极:牺牲阳极牺牲阳极是一种较为活泼的金属,如锌、铝等,它们具有较低的电极电位。
当牺牲阳极与金属结构接触时,牺牲阳极会优先发生氧化反应,将电子释放给金属结构,从而保护金属结构不被腐蚀。
以锌为例,当锌作为牺牲阳极与铁结构接触时,发生如下反应:锌阴极反应:Zn → Zn2+ + 2e-铁阳极反应:Fe → Fe2+ + 2e-可以看出,锌的电极电位较铁低,因此锌更容易氧化,而铁则相对稳定。
2.阴极:金属结构金属结构是被保护的对象,它充当了阴极的角色。
在阴极上发生的还原反应消耗了来自阳极的电子,从而减缓了金属的氧化速度。
阴极上的还原反应可以通过以下反应来表示:Fe2+ + 2e- → FeOH- → 1/2H2O + 1/2O2 + 2e-这些反应将阴极上的电子消耗掉,并使金属结构得到保护。
电流的流动在牺牲阳极防腐过程中,电流的流动起到了至关重要的作用。
电流的流动是通过电解质溶液中的离子完成的,其中阳极离子向阴极流动。
在牺牲阳极防腐中,锌或其他牺牲阳极的金属通过电流的流动,将电子释放给金属结构,从而发生氧化反应。
同时,金属结构上的阴极反应消耗了来自阳极的电子,实现了金属结构的保护。
牺牲阳极安装图纸
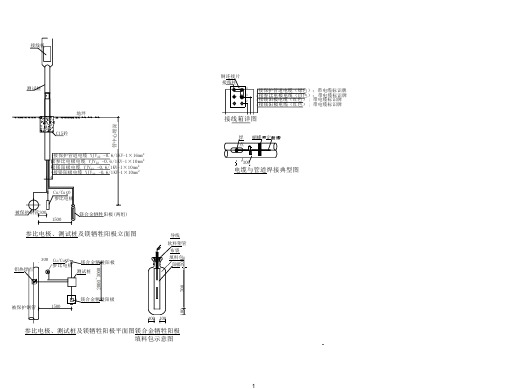
测试桩
地坪 C15砼
1接保护管道电缆 YJV22 -0.6/1KV-1×16mm2 接2 参比电极电缆 YJV22 -0.6/1KV-1×10mm2
接3 镁阳极电缆 YJV22 -0.6/1KV-1×10mm2
4接镁阳极电缆 YJV22 -0.6/1KV-1×10mm2 14
Cu/Cu O 参比电极
被保护钢管300 1500
镁合金牺牲阳极(两组)
参比电极、测试桩及镁牺牲阳极立面图
铝热焊点
300 Cu/Cu O 镁合金牺牲阳极 参比电极 测试桩
导线
软料塑管 布袋 填料包 阳极
被 100
参比电极、测试桩及镁牺牲阳极平面图镁合金牺牲阳极 填料包示意图
铜连接片
接线柱
1
4
3 2
1接保护管道电缆(绿色); 带电缆标识牌 2 接参比电极电缆(白色); 带电缆标识牌 3 接镁阳极电缆(红色) ; 带电缆标识牌 4 接镁阳极电缆(红色) ; 带电缆标识牌
接线箱详图
焊 蝴蝶 定 点
30 300
电缆与管道焊接典型图
1
管道牺牲阳极保护的是什么

管道牺牲阳极保护的是什么
牺牲阳极是一种阴极保护技术,通过将被保护金属(如管道)与一种电位更负的金属或合金(即牺牲阳极)相连接,利用牺牲阳极的优先腐蚀来保护被保护金属免受腐蚀。
在这种保护系统中,牺牲阳极作为电子供体,会自发的发生腐蚀反应,从而消耗自身,以此来保护被保护的管道金属。
这种保护技术通常应用于土壤、海水等潮湿、腐蚀性环境中,以防止管道金属因电化学腐蚀而损坏。
牺牲阳极材料的选择主要依据环境条件和管道金属的材质,常用的牺牲阳极材料包括镁、锌、铝等。
值得注意的是,管道牺牲阳极保护系统需要定期检查和维护,以确保其有效运行。
此外,为了充分发挥牺牲阳极的保护效果,还需要合理设计阳极的数量和位置,以及优化阳极与管道的连接方式。
牺牲阳极是一种经济、有效的防腐措施,能够延长管道的使用寿命,确保管道的安全运行。
镁合金牺牲阳极的使用寿命会受到多种因素的影响,因此很难给出一个确切的数值。
其寿命主要取决于镁合金的腐蚀情况,以及所处环境的温度、湿度、溶液的pH值、溶液的性质、合金的成分等因素。
在一些恶劣的环境下,阳极的消耗会加速,因此需要及时更换或添加阳极保护剂。
而为了提高镁阳极材料的使用寿命,可以选择提高镁阳极的耐腐蚀性能,例如通过优化合金元素、杂质元素、相组成和微结构等方法来实现。
同时,镁阳极表面处理技术的研究也为提升镁阳极的耐腐蚀性提供了一定的帮助。
另外,需要注意的是,虽然镁合金牺牲阳极本身有一定的寿命,但在使用它进行阴极保护时,整个保护系统的使用寿命可能会受到其他因素的影响,如阳极的安装位置、数量、与被保护物体的连接方式等。
因此,为了确保保护效果和系
统稳定性,需要定期检查和维护阴极保护系统。
牺牲阳极原理

牺牲阳极原理牺牲阳极原理是一种电化学方法,常用于金属腐蚀防护和电池工艺中。
在牺牲阳极原理中,通过使用一个更容易腐蚀的金属来保护另一个金属,实现了防腐蚀的效果。
本文将详细介绍牺牲阳极原理的工作原理、应用领域以及优缺点。
牺牲阳极原理是一种电化学保护方法,通过将一个金属作为牺牲阳极与另一个金属(被保护金属)接触,使其成为电池的阳极,从而使被保护金属成为电池的阴极。
在这种情况下,牺牲阳极将会被腐蚀,而被保护金属则不会受到腐蚀。
这种方法的原理是利用了电流流向阴极的规律,将腐蚀的过程从被保护金属转移到了牺牲阳极上。
牺牲阳极原理常用于金属腐蚀防护。
在海洋环境中,钢铁结构容易受到腐蚀,为了延长结构寿命,可以在结构上添加铝或锌等金属作为牺牲阳极。
这些牺牲阳极会优先被腐蚀,而保护结构不受腐蚀。
类似地,钢铁油罐、管道等设备也可以采用牺牲阳极原理进行防腐蚀处理。
此外,牺牲阳极原理还可以应用于船舶、桥梁、建筑物等领域,保护金属结构不受腐蚀。
牺牲阳极原理的优点是简单易行,成本较低。
相比于其他防腐蚀方法,牺牲阳极不需要依赖外部电源,只需将牺牲阳极与被保护金属直接接触即可实现防腐蚀效果。
此外,在一些特殊环境中,如深海、高温、高压等条件下,其他防腐蚀方法很难实施,而牺牲阳极原理却具有较好的适应性。
然而,牺牲阳极原理也存在一些缺点。
首先,牺牲阳极的寿命有限,一旦牺牲阳极被完全腐蚀,保护效果就会消失。
因此,需要定期更换牺牲阳极,增加了维护成本。
其次,牺牲阳极原理对环境要求较高,如在一些酸性或碱性环境中,牺牲阳极的效果会受到影响。
此外,牺牲阳极的防腐蚀效果也受到电解液的浓度、温度等因素的影响。
牺牲阳极原理是一种常用的电化学保护方法,通过将一个金属作为牺牲阳极,来保护另一个金属免受腐蚀。
牺牲阳极原理在金属腐蚀防护和电池工艺中有着广泛的应用。
尽管牺牲阳极原理存在一些局限性,但其简单易行、成本低等优点使其仍然是一种有效的防腐蚀方法。
铝合金牺牲阳极标准

铝合金牺牲阳极标准
铝合金牺牲阳极标准是指在防腐蚀处理中使用的铝合金,通过牺牲阳极的方式保护基底金属免受腐蚀的标准规范。
根据国际标准,一般来说,铝合金牺牲阳极的标准要求如下:
1. 铝合金牺牲阳极的化学组成应符合相关标准。
通常情况下,铝合金的主要成分应为铝,同时可能包含少量的其他金属元素。
2. 铝合金牺牲阳极的表面处理应符合相关标准。
表面处理通常包括阳极氧化、化学镀铝等方式,以增加阳极保护层的质量和耐腐蚀性。
3. 铝合金牺牲阳极的性能参数应符合相关标准。
包括阳极的平均保护电位、保护电流密度、耐蚀电势等。
4. 铝合金牺牲阳极的使用寿命和效果应符合相关标准。
通常要求阳极能够在一定时期内提供有效的防腐蚀保护,同时不对基底金属造成明显损害。
不同国家和地区可能会有各自的标准和规范,具体的铝合金牺牲阳极标准应根据当地的相关法规和技术要求进行确定。
铝合金牺牲阳极的工作原理

铝合金牺牲阳极的工作原理
铝合金牺牲阳极是一种防腐蚀的方法,它利用了金属阳极(常用的是铝)比其它金属更容易被腐蚀的特性。
其工作原理可以概括如下:
1. 金属阳极:铝合金牺牲阳极通常由纯铝或铝合金制成。
在金属硬件中作为阳极的纯铝或铝合金将会优先腐蚀,而保护被防腐的金属。
2. 电化学反应:当金属硬件与电解液(通常是水和盐)接触时,电化学反应会发生。
水中的H+离子将氧化金属阳极,同时金属阴极还原。
3. 阳极腐蚀:在电化学反应中,金属阳极会逐渐腐蚀。
这是因为离子反应在阳极上发生,阳极释放氧气,将自身逐渐溶解。
4. 金属阴极保护:当金属阳极腐蚀时,金属阴极将受到保护,因为电流优先传递到阳极上,从而保护阴极不会被腐蚀。
通过使用铝合金牺牲阳极,可以延长金属硬件的使用寿命,因为金属阴极得到了保护。
然而,牺牲阳极的效果是有限的,因为随着时间的推移,铝阳极会被逐渐耗尽而需要更换。
牺牲阳极标准

牺牲阳极的标准包括以下几点:
1. 电位足够负,但不宜太负,以免阴极区产生析氢反应。
2. 阳极的极化率要小,电位极电流输出要稳定。
3. 阳极材料的电容量要大。
4. 必须有高的电流效率。
5. 溶解均匀且容易脱落。
6. 材料价格低廉,来源充分。
7. 产生的腐蚀产物应是无毒无害,不污染环境,无公害之虞。
此外,为了确保牺牲阳极保护的有效性和安全性,还需要注意:
1. 选择合适的牺牲阳极,根据被保护金属的种类和使用环境,确保其活泼度和耐蚀性符合要求。
2. 安装正确,牺牲阳极的安装位置和数量应根据被保护金属的形状和大小、使用环境等因素决定,确保覆盖面积和密度适当。
3. 监测保护效果,定期进行检测和维护。
以上内容仅供参考,如需更多信息,可咨询材料工程师。
铝合金牺牲阳极介绍及优缺点

铝合金牺牲阳极介绍及优缺点铝合金牺牲阳极是一种有效的防腐技术,广泛应用于各种金属设施的防腐蚀保护。
它利用了不同金属在电化学中的差异,使铝合金作为阳极受到腐蚀,从而保护了其他金属不受腐蚀。
铝合金牺牲阳极具有许多优点,使得它在许多领域得到广泛应用。
以下是铝合金牺牲阳极的主要优点:1. 高电化学性能:铝合金牺牲阳极具有优良的电化学性能,可在较为苛刻的条件下稳定工作。
它的电极电位较负,电流效率高,可以提供持续而稳定的电流输出。
2. 良好的热稳定性:铝合金牺牲阳极在高温环境下仍能保持稳定的性能,适用于需要较高温度的工作环境。
3. 良好的耐腐蚀性:铝合金牺牲阳极具有较好的耐腐蚀性,可以在各种腐蚀介质中稳定工作,有效保护与之相连的金属结构免受腐蚀。
4. 易于安装和维护:铝合金牺牲阳极重量轻、体积小,安装简便,同时维护成本较低,可以有效地降低整个系统的维护成本。
5. 长寿命:铝合金牺牲阳极的使用寿命较长,可以有效降低更换频率和成本。
6. 环境友好:铝合金牺牲阳极在生产和使用过程中对环境的影响较小,是一种环保型的金属材料。
7. 广泛的适用范围:铝合金牺牲阳极可以应用于石油、化工、电力、船舶、海洋工程、环保等领域,具有广泛的应用前景。
铝合金牺牲阳极的制造方法通常包括铸造成型、挤压成型和锻造成型等。
其中,铸造成型的生产效率高,但产品性能相对较差;挤压成型的制品具有较高的抗拉强度和屈服强度,但生产效率较低;锻造成型的制品具有较好的综合性能,但生产成本较高。
根据不同的使用场合和要求,可以选择不同的制造方法来生产铝合金牺牲阳极。
然而,铝合金牺牲阳极也存在一些缺点。
例如,在某些高腐蚀介质中,铝合金牺牲阳极的腐蚀速率较快,需要定期更换和维护。
此外,铝合金牺牲阳极的使用寿命受到多种因素的影响,如介质浓度、温度、流速等。
为了提高其使用寿命,需要在使用过程中进行定期检测和维护。
总之,铝合金牺牲阳极是一种有效的防腐技术,具有广泛的应用前景。
牺牲阳极原理

牺牲阳极原理
在电化学中,阳极是指接受电子的电极,通常被氧化。
牺牲阳极原理是指在防止金属腐蚀和保护基底金属的过程中,使用一种比基底金属更容易氧化的金属作为牺牲阳极。
当两种金属同时暴露在电解质中时,牺牲阳极首先遭受腐蚀,将消耗部分电流并稳定基底金属的电位。
此原理的应用广泛,在许多领域均有实际应用。
一些典型的案例包括船舶和海洋平台上的防腐保护、管道和设备的防腐、以及冶金和化工工业中的腐蚀保护。
以船舶为例,船体是常接触海水的,容易受到腐蚀。
为了保护船体,可以在船底附近安装一些铝或锌制成的牺牲阳极。
当这些阳极暴露在海水中时,它们将吸引腐蚀产生的电流,以自身为牺牲,并减缓或阻止船体腐蚀。
这样就保护了船体的金属结构,延长了船舶的使用寿命。
在管道和设备的防腐中,可以通过将一种锌或铝合金的牺牲阳极连接在金属管道的外侧,以防止腐蚀。
当发生电解质腐蚀时,阳极将被腐蚀而不是管道本身,从而延长管道的使用寿命。
在冶金和化工工业中,腐蚀对设备的安全和性能具有重要影响。
通过使用牺牲阳极,可以保护设备的金属结构,减少维护成本,延长设备的使用寿命。
总的来说,牺牲阳极原理是一种有效的腐蚀保护方法。
通过引
入一个更容易被腐蚀的金属,该方法可以保护基底金属免受腐蚀。
这是一种经济实用的方法,被广泛应用于许多领域。
牺牲阳极的阴极保护原理

牺牲阳极的阴极保护原理
阳极保护是一种常用的金属腐蚀控制方法,其原理是通过将金属材料中的阳极(活动性较高的金属)牺牲掉,以保护金属结构的阴极(活动性较低的金属)部分不受腐蚀的影响。
在阴极保护系统中,通常使用一种可牺牲的阳极材料,如镁、锌或铝合金等。
这些阳极材料的电位要远低于被保护金属的电位,所以它们会先被电化学腐蚀而牺牲掉,而将腐蚀的过程从金属结构转移到了阳极上。
当阳极被电化学腐蚀时,它会释放出一个或多个电子,在阴极保护系统中形成一个阳极电流。
这个电流会在金属结构的阴极部分表面流动,形成一层电子流密度较高(即电流密度较小)的“保护电场”。
这个电场会阻止金属结构上的氧化、还原反应,从而降低腐蚀的发生。
通过控制阳极材料与被保护金属之间的电位差和电流密度,可以实现对金属结构的有效保护。
阳极保护系统通常需要根据被保护金属的性质和环境条件进行设计和调节,以确保阴极的保护效果达到最佳。
总之,牺牲阳极的阴极保护原理是通过将金属结构中的阳极材料牺牲掉,形成一个保护电场,以保护阴极不受腐蚀的影响。
这种方法在许多金属腐蚀控制领域得到广泛应用,如船舶、石油管道、水处理设备等。
电化学牺牲阳极的阴极保护法

电化学牺牲阳极的阴极保护法电化学牺牲阳极的阴极保护法,乍一听是不是觉得好像听不懂的高科技词汇?别急,今天咱们就来聊聊这个话题,带点轻松的语气,把复杂的技术搞得简单又有趣。
想象一下,你家的金属管道,年复一年被风吹日晒,水流冲刷,最终会被腐蚀成什么样子?一旦腐蚀了,管道就会漏水,甚至直接坏掉,得不偿失对吧?这时候,如果有一种方法可以让管道“不死”,甚至能把腐蚀引开,让它们继续坚强地活下去,那该多好!电化学牺牲阳极的阴极保护法,正是通过这种方式保护金属不受腐蚀侵害。
别看名字这么复杂,咱们把它拆开来看。
首先“电化学”是啥意思?简单来说,就是电和化学的结合。
你想想,腐蚀不就是金属在电解质中“自杀”吗?这时候电化学就派上了用场。
而牺牲阳极呢?说白了,就是“替死鬼”。
你是不是觉得牺牲这俩字很有戏?没错,就是这个意思!牺牲阳极会先受腐蚀,把坏事都揽到自己身上。
它在电化学反应中做了个“替代品”的角色,保护了其他重要的金属部分。
反正就是给其他部分挡住了“祸水”,自己先挂了,给管道“续命”。
你要问我,牺牲阳极咋就那么牛?好吧,咱从金属的电位来聊聊。
电化学上每种金属都有个“电位”,就是它在电场中的“身份地位”。
有的金属像铁那样,电位比较高,容易“挑事”,有的像锌、镁,它们的电位比较低,反而容易被腐蚀。
于是,在这种情况下,锌、镁这些金属就成了牺牲阳极的最佳人选。
当它们和铁、钢等管道连接时,锌和镁会抢着去腐蚀自己,结果管道里的铁、钢等就安然无恙。
你可以把它想象成一群“保镖”,它们为了保卫主子,拼命地跟敌人搏斗,最后自己“壮烈牺牲”了。
你看,牺牲阳极就这么简单又奇妙,像是一个“大无畏”的英雄,甘心为更重要的东西去“挡刀”。
这个保护方法其实并不新鲜,历史上早就有了。
从古代到现代,几乎所有需要防腐蚀的地方都会用到它。
比如船体、油气管道、电力设施等地方,没少用这个方法。
你可能会觉得,放一个锌或镁块去保护一个大铁管,怎么能起作用?其实原理可简单了。
预包装镁合金牺牲阳极的组成及作用

预包装镁合金牺牲阳极的组成及作用
预包装镁合金牺牲阳极是由特定成分的镁合金材料制成的,其主要作用是在金属结构的防腐蚀过程中发挥牺牲阳极的作用。
具体来说,预包装镁合金牺牲阳极通常包含高纯度的镁金属,以及适量的锌、铝、锰等合金元素,这些元素的加入可以改善镁合金的电化学性能,提高其牺牲阳极的效率。
其原理是基于电化学腐蚀的原理。
在金属结构中,特别是埋地或浸水的金属结构,如管道、储罐、船舶等,容易发生电化学腐蚀。
电化学腐蚀是由于金属表面的不同部位存在电位差,导致电流的流动,从而引起金属的溶解和破坏。
牺牲阳极通过与被保护的金属结构形成一个电化学电池,牺牲阳极的电位比被保护金属的电位更负,因此在电化学电池中,牺牲阳极会优先被腐蚀,从而保护了被保护金属结构免受腐蚀。
预包装镁合金牺牲阳极的优点在于其高电化学活性和较低的电位,使其在多种环境中都能有效地发挥保护作用。
此外,镁合金牺牲阳极的使用成本相对较低,且具有良好的耐腐蚀性能,因此在海洋工程、石油管道、电力设施等领域得到了广泛应用。
为了进一步提高牺牲阳极的性能和使用寿命,预包装镁合金牺牲阳极通常会进行特殊的包装处理。
这种包装可以防止镁合金在使用过程中与周围环境直接接触,从而减少不必要的腐蚀,延长其使用寿命。
同时,包装材料的选择也需要考虑其对电化学反应的影响,确保不会对牺牲阳极的性能产生负面影响。
总之,预包装镁合金牺牲阳极通过其独特的组成和作用,为金属结构的防腐蚀提供了有效的解决方案,广泛应用于各种工业领域,保障了金属结构的安全和稳定运行。
牺牲阳极法的电极反应方程式

牺牲阳极法的电极反应方程式
在牺牲阳极法中,主要包括以下电极反应方程式:
1. 阳极氧化反应
阳极氧化反应是牺牲阳极法中的主要反应之一。
在这个反应中,阳极材料失去电子,被氧化成离子状态,进入电解质溶液中。
这个反应的化学方程式可以表示为:
阳极:Me →Me^{n+} + n e^(-)
其中,Me表示阳极材料,n表示化合价变化,e^(-)表示电子。
2. 氧化剂还原反应
在牺牲阳极法中,氧化剂在阴极上得到电子,发生还原反应。
这个反应的化学方程式可以表示为:
阴极:氧化剂+ ne^(-) →还原产物
其中,氧化剂表示为氧化还原反应中的氧化剂,还原产物表示氧
化剂被还原后的产物。
3. 溶液中离子放电反应
在牺牲阳极法中,电解质溶液中的离子也会在电极上放电。
这个反应的化学方程式可以表示为:
放电反应:ion + ne^(-) →生成物
其中,ion表示电解质溶液中的离子,ne^(-)表示电子。
4. 氢离子放电反应
在牺牲阳极法中,氢离子也可能会在电极上放电。
这个反应的化学方程式可以表示为:
阴极:H^{+} + e^(-) →H
其中,H^{+}表示氢离子,H表示氢原子。
5. 金属离子还原反应
在牺牲阳极法中,金属离子也可能会在电极上发生还原反应。
这个反应的化学方程式可以表示为:
阴极:Me^n+ + ne^(-) →Me + nH^+^
其中,Me^n+表示金属离子,Me表示金属原子,n表示化合价变化,H^+^表示氢离子。
牺牲阳极的阴极保护原理

牺牲阳极的阴极保护原理在阴极保护技术中,牺牲阳极是一种常用的防护原理。
牺牲阳极是指在金属结构中,通过将一种更容易腐蚀的金属制成阳极,以保护更重要的金属结构不被腐蚀。
这种原理在海洋工程、船舶、海岸设施等领域得到了广泛的应用。
牺牲阳极的阴极保护原理是基于电化学原理的。
在金属结构中,当两种不同金属接触并与电解质接触时,会形成一个电化学电池。
在这个电化学电池中,更容易腐蚀的金属将成为阳极,而不容易腐蚀的金属将成为阴极。
通过在阴极保护系统中加入外部电流,可以使阳极得到保护,从而延缓或阻止金属结构的腐蚀。
牺牲阳极的阴极保护原理是通过选择更容易腐蚀的金属作为阳极材料,将其与被保护金属结构连接,并将其埋入到被保护结构所在的电解质中。
当金属结构处于电解质中时,阳极金属开始发生电化学腐蚀,而被保护金属结构则成为阴极,从而得到保护。
在这个过程中,阳极金属不断地释放出阳极保护电流,从而保护着被保护金属结构不被腐蚀。
在实际应用中,牺牲阳极的阴极保护原理具有一些优点。
首先,相对于其他阴极保护方法,牺牲阳极的阴极保护方法更加简单、易于操作。
其次,牺牲阳极的阴极保护方法具有良好的稳定性和可靠性,可以长期保护金属结构不被腐蚀。
此外,牺牲阳极的阴极保护方法还可以在一定程度上补偿金属结构中的缺陷和损坏,提高金属结构的使用寿命。
然而,牺牲阳极的阴极保护方法也存在一些局限性。
首先,牺牲阳极的阴极保护方法需要定期更换阳极材料,增加了维护成本。
其次,牺牲阳极的阴极保护方法对于大型金属结构的保护效果可能不如其他阴极保护方法。
此外,牺牲阳极的阴极保护方法在一些特殊环境下可能会受到影响,需要进行定期检查和维护。
总的来说,牺牲阳极的阴极保护原理是一种简单而有效的防护方法,广泛应用于海洋工程、船舶和海岸设施等领域。
在实际应用中,需要根据具体情况选择合适的阴极保护方法,并进行定期检查和维护,以确保金属结构得到有效的保护。
牺牲阳极镁合金牺牲阳极的介绍

牺牲阳极镁合金牺牲阳极的介绍
牺牲阳极是由高度活跃的金属材料构成的,用于防止较不活跃的金属表面腐蚀,比如钢铁。
它的自然电位比被保护的金属更负,从而取代它所保护的金属腐蚀,这就是为什么它被称为“牺牲”阳极的缘故。
牺牲阳极有各种形状和大小,但它们的工作原理是相同的,必须通过“电”连接到被保护船体,通常是通过金属与金属相连,与船上需要保护的贵重金属部件相连。
因此,如果靠近船舶,你会看到有金属片连接到舵、舷外发动机和传动轴等。
牺牲阳极构成电池的负极,并与要保护的金属电连接。
因为牺牲阳极的金属电活性更强,它是被损耗的,在电解液中形成电池的负极(阳极)。
例如,在海水中,阳极与其他需要保护的金属相连,并完全浸泡在水里,因此阳极总是会被腐蚀。
“电池”的正极一定是被保护的金属(阴极),例如传动轴、螺旋桨、发动机等。
水质越咸或污染越严重,其导电性就越强,牺牲阳极被腐蚀的速度就越快。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
腐蚀电极反应
• 任何一种按电化学机理进行的腐蚀反应至少包含一个阳极反应和一个阴极反应,并伴 随有金属内部的电子流动和介质中离子的定向迁移。 • 阳极反应:Fe→Fe+2+2e • 阴极反应:2H++2e→H2↑ • 总反应: Fe+2H+→Fe+2+H2↑ • 阳极: 在电化学反应中发生氧化反应的电极, • 阴极: 在电化学反应中发生还原反应的电极, • 电解质: 含有离子的溶液等,一般指土壤、水、潮气等, • 导体: 电子迁移的途径(金属导体)。
镁牺牲阳极(铸造镁阳极)
镁牺牲阳极(挤压阳极)
第四章 牺牲阳极阴极保护系统安装
1. 阳极沿被保护结构分布,一般竖直安装,要求埋设在冻土 层以下。 2. 对于管道的阴极保护,阳极顶端一般与管道底部水平。 3. 在土壤中应用时,一般要使用回填料,埋设时,要将其浸 湿。填料的作用是保证阳极均匀消耗,提高电流输出以及 阳极效率。 4. 在水环境下安装阳极时,其分布要尽量均匀,将其焊接或 铆接在被保护结构上。也可用阳极电缆悬挂或放在海底、 河床沿结构分布。 5. 保护埋地管道时,根据保护电流的需求量,阳极的间隔由 几米到几公里。 6. 阳极距离被保护结构一般为1 – 1.5 米。几支阳极可以成 组安装。
腐蚀发生的过程
• • • • • • • • • • • 1. 金属的腐蚀大多为电化学过程,金属表面与电解质接触, 如: 在大气环境下,含盐的水蒸气,当金属浸在淡水、海水、或埋 在土壤中时,电解质是含盐的水, 形成腐蚀电池。 2. 阴、阳极在金属表面的分布取决于金属的内部结构及外部环境。 电极电位较负的为阳极、电位较正的为阴极,电子将离开阳极 向阴极移动,而位于阳极区的金属原子由于失去电子而成为带 正电的离子、进入电解质。 3. 在阳极区,带正电的金属离子与周围电解质中的负离子发生反 应而形成腐蚀产物,金属发生腐蚀。 4. 在阴极区,由于存在多余的电子,金属不会发生腐蚀,化学反 应在电解质中发生,如:析氢反应。
从技术可行性上讲,阴极保护必须具备三个使用条件: 1. 管道纵向连续导电,确保阴极保护电流畅通,是阴 极保护的必要条件之一。法兰、丝扣部位需要电缆跨接。 2. 具有足够绝缘电阻的管道覆盖层。覆盖层的主要作 用是隔离土壤介质,阻止形成腐蚀电池。覆盖层绝缘电阻 愈大,需要的阴极保护电流愈小。 3. 管道与其他非保护构筑物之间电绝缘。电绝缘可以 防止阴极保护电流流失,减轻杂散电流干扰等。
管道防腐——牺牲阳极
天长市徐矿天然气有限公司
第一章:发生腐蚀的原因
• • • • • • • • • • 将金属放入电解质后,金属不同的部位,电极电位是不同的,从 而形成腐蚀电池。电极电位的不同是金属自身或环境状况不同所引起 的。 1、微观腐蚀电池 (1)金属化学成分的不均匀性、金相组织的不均匀性、表面物理 状态的不均匀性等; (2)金属表面有杂屑、划痕、受过碰撞; (3)金属表面均可形成无数微阴极和微阳极,构成微观腐蚀电池。 2、宏观腐蚀电池 (1)不同的金属与同一电解质相接触; (2)同一种金属接触不同的电解质; (3)不同的金属接触不同的电解质均可构成宏观腐蚀电池。
牺牲阳极可以单独埋设,也可以成组埋设
西气东输管道公司牺牲阳极使用情 况:
1、小口径短距离支线使用数组块状镁阳极进行阴极 保护,如杨子杨巴、东望支线; 2、淮武线定向钻穿越河流两端使用块状镁阳极组、 在钢筋混凝土套管内使用锌带作为补充阴极保护 措施; 3、使用镁带作为管道临时阴极保护; 4、使用锌接地电池进行绝缘接头防雷保护。
当管道与镁阳极连接在一起时,管道表面电位负移(阴极极化), 直到管道表面不再存在阳极或阴极,所以,消除了管道表面电流在阴、 阳极之间的流动,从而抑制了腐蚀。
牺牲阳极阴极保护,依靠外加阳极不断溶解所产生的电流实现阴 极保护。电位较负的阳极材料随着电流的流动而不断地消耗。 牺牲阳极材料所应具备的条件; 1.电位足够负,但不宜太负,以免阴极区产生析氢反应; 2.阳极的极化率要小,电位及电流输出要稳定; 3.阳极材料的电容量要大; 4.必须有高的电流效率; 5.溶解均匀,容易脱落; 6.材料价格低廉,来源充足。 常用的牺牲阳极材料有三类:镁和镁合金、锌和锌合金、铝和铝 合金。镁阳极电位更负、极化率小、发电量大,但电流效率低,适用 于敷设范围大、电阻率高和淡水中金属的保护;锌阳极要求有较高的 纯度(99.9%);铝是自钝化金属,但通过合金化可以破坏其保护膜, 获得满意性能,铝阳极电位较较正,但价格低廉。
第三章 牺牲阳极
牺牲阳极阴极保护: 根据金属在电动势序列中相对位置的不较活性的 金属流向较惰性的金属,为较惰性的金属提供保护。 该方法是利用电化学反应提供电流。通过将被保护结构与较活性 的金属连接在一起,使被保护金属结构变成阴极;而较活性的金属变 成阳极。 利用这一原理,将金属管道与较活泼的金属连接,使金属管道得 到保护电流。 常用的活泼金属包括: 1. 镁、锌,铝。(由于很难保证铝阳极表面的活性,所以,铝阳 极仅应用于海水环境)。 2. 由于在提供保护的同时,阳极被消耗掉,所以,这些阳极又被 称为牺牲阳极
发生腐蚀的必要条件
发生腐蚀必须满足以下 4 个条件: 1. 阳极和阴极必须同时存在,(阳极、阴极组成腐蚀电池); 2. 阴、阳极之间必须有电位差; 3. 阴、阳极之间必须有电气连接; 4. 阴、阳极必须处于电解质中。 去除四个条件中的任何一个,腐蚀就会停止。
第二章 阴极保护原理
• 阴极保护定义: 通过采取措施,使被保护金属表面在电化学电池 中为阴极而减缓其腐蚀的技术。 • 强制电流从周围电介质中流向被保护结构表面,使金属表面全部 处于阴极状态,就可抑制阴极区金属表面电子释放。施加的电流越大, 产生的阴极极化越强,直到腐蚀原电池的阴阳极达到等电位,消除结 构表面的阳极区,腐蚀得到抑制。 • 实现这一目的有两个途径,即:外加电流和牺牲阳极阴极保护。 • 从理论上讲,如果涂层是完整、无缺陷的,那么,涂层自己就可 以完成防腐任务。然而,要做到涂层无缺陷,实际上是很困难或不经 济的。因此,涂层与阴极保护的结合,99%的防腐任务由防腐层承担、 阴极保护对防腐层缺陷处进行保护,是最经济、有效的防腐措施。
应用范围:适用于保护范围相对简单、防腐层性能好且 与非保护设施有效绝缘隔离的金属结构。 优点:不需外部电源,应用灵活、易于安装、运行维护 简单. 对附近非保护金属构筑物无干扰。 缺点: 输出电流小(一般小于1A) 、仅用于保护电流需 求小的场合。驱动电压低,运行电位不可调,受环境因素 影响较大,仅用于低土壤电阻率环境(小于50 ohm.m , 一般不超过100 ohm.m )。
