CNAS-GL29:2010《标准物质_标准样品定值的一般原则和统计方法》
实验室认可相关文件

实验室认可规范文件清单日期:2011-1-20序号 文件类别文件名称编号发布日期 实施日期原文件名称编号原文件发布日期原文件实施日期备注注:如果文件被修订,则为最新修订文件的发布和实施日期1通用认可规则 CNAS-R01:2010《认可标识和认可状态声明管理规则》2010-11-18 2011-1-1 CNAS-R01:2006《认可标识和认可状态声明管理规则》2006-6-1 2006-7-12007-4-152007-4-15第一次修订2 CNAS-R02:2006《公正性和保密规则》 2006-6-1 2006-7-1 制定3 CNAS-R03:2010《申诉、投诉和争议处理规则》2010-11-18 2010-11-18 CNAS-R03:2006《申诉、投诉和争议处理规则》2006-6-1 2006-7-12008-6-16 2008-6-16 换版修订4实验室专用认可规则 CNAS-RL01:2007《实验室认可规则》(2008年第1次修订)2008-7-15 2008-7-15 CNAS-RL01:2006《实验室和检查机构认可规则》2007-4-16 2008-1-1 修订5 CNAS-RL02:2010《能力验证规则》 2010-12-30 2011-02-01 CNAS-RL02:2006《能力验证规则》 2006-6-1 2006-7-12007-4-30 2007-4-30 第一次修订6 CNAS-RL03:2009《实验室和检查机构认可收费管理规则》 2009-1-14 2009-1-14 CNAS-RL03:2006《实验室和检查机构认可收费管理规则》2006-6-1 2006-7-1 修订7 CNAS-RL04:2009《境外实验室和检查机构受理规则》 2009-3-1 2009-3-1 CNAS-RL04:2006《境外实验室和检查机构受理规则》2006-6-1 2006-7-1 修订8 CNAS-RL05:2008《实验室生物安全认可规则》2008-8-1 2008-8-1 CNAS-RL05:2006《实验室生物安全认可规则》2006-6-1 2006-7-1 修订9 CNAS-RL06:2010《能力验证提供者认可规则》2010-12-31 2011-02-01 制定10 CNAS-RL07:2010《标注物质/标准样品生产者能力认可规则》2010-12-30 2011-01-01 制定1 / 7序号 文件类别文件名称编号发布日期 实施日期原文件名称编号原文件发布日期原文件实施日期备注注:如果文件被修订,则为最新修订文件的发布和实施日期11 实验室基本认可准则 CNAS-CL01:2006《检测和校准实验室能力认可准则》(ISO/IEC17025:2005)2006-6-1 2006-7-1 制定12实验室基本认可准则 CNAS-CL02:2008《医学实验室质量和能力认可准则》(ISO 15189:2007)2008-6-16 2008-12-1 CNAS-CL02:2006《医学实验室质量和能力认可准则》(ISO 15189:2003)2006-6-1 2006-7-1 修订13 CNAS-CL03:2010《能力验证提供者认可准则》(ISO/IEC 17043:2010) 2010-12-31 2011-01-01 CNAS-CL03:2006《能力验证计划提供者认可准则》(ILAC G13:2000)2006-6-1 2006-7-1 修订14 CNAS-CL04:2010《标准物质/标准样品生产者能力认可准则》(ISO Guide34:2009) 2010-12-30 2011-01-01 CNAS-CL04:2007《标准物质/标准样品生产者能力认可准则》2007-8-1 2007-8-1 修订15 CNAS-CL05:2009《实验室生物安全认可准则》(GB19489-2008) 2009-6-30 2009-7-1 CNAS-CL05:2006《实验室生物安全认可准则》(GB19489-2004)2006-6-1 2006-7-1 修订16 CNAS-CL36:2007《医学实验室安全认可准则》(ISO 15190:2003)2007-4-16 2007-4-30 制定17实验室认可应用准则 CNAS-CL06:2006《量值溯源要求》(2007年第1次修订)2007-4-16 2007-4-30 CNAS-CL06:2006《量值溯源要求》 2006-6-1 2006-7-1 修订18 CNAS-CL07:2006《测量不确定度评估和报告通用要求》(2007年第1次修订) 2007-4-16 2007-4-30 CNAS-CL07:2006《测量不确定度评估和报告通用要求》2006-6-1 2006-7-1 修订19 CNAS-CL09:2006《检测和校准实验室能力认可准则在微生物检测领域的应用说明》(2007年第1次修订) 2007-4-16 2007-4-30 CNAS-CL09:2006《实验室能力认可准则在微生物检测领域的应用说明》2006-6-1 2006-7-1 修订2 / 7序号 文件类别文件名称编号发布日期 实施日期原文件名称编号原文件发布日期原文件实施日期备注注:如果文件被修订,则为最新修订文件的发布和实施日期20 CNAS-CL10:2006《检测和校准实验室能力认可准则在化学检测领域的应用说明》(2007年第1次修订) 2007-4-16 2007-4-30 CNAS-CL10:2006《实验室能力认可准则在化学检测领域的应用说明》2006-6-1 2006-7-1 修订21实验室认可应用准则 CNAS-CL11:2006《检测和校准实验室能力认可准则在电气检测领域的应用说明》(2007年第1次修订)2007-4-16 2007-4-30 CNAS-CL11:2006《实验室能力认可准则在电子和电气检测领域的应用说明》2006-6-1 2006-7-1 修订22 CNAS-CL12:2006《实验室能力认可准则在医疗器械检测领域的应用说明》2006-6-1 2006-7-1 制定23 CNAS-CL13:2006《实验室能力认可准则在汽车和摩托车检测领域的应用说明》2006-6-1 2006-7-1 制定24 CNAS-CL14:2010《检测和校准实验室能力准则在无损检测领域的应用说明》 2010-9-1 2010-10-1 CNAS-CL14:2006《实验室能力认可准则在无损检测领域的应用说明》2006-6-1 2006-7-1 修订25 CNAS-CL15:2006《实验室能力认可准则在电声检测领域的应用说明》2006-6-1 2006-7-1 制定26 CNAS-CL16:2006《检测和校准实验室能力认可准则在电磁兼容检测领域的应用说明》(2007年第1次修订) 2007-4-16 2007-4-30 CNAS-CL16:2006《实验室能力认可准则在电磁兼容检测领域的应用说明》2006-6-1 2006-7-1 修订27 CNAS-CL17:2006《检测和校准实验室能力认可准则在玩具检测领域的应用说明》(2007年第1次修订) 2007-4-16 2007-4-30 CNAS-CL17:2006《实验室能力认可准则在玩具检测领域的应用说明》2006-6-1 2006-7-1 修订3 / 7序号 文件类别文件名称编号发布日期 实施日期原文件名称编号原文件发布日期原文件实施日期备注注:如果文件被修订,则为最新修订文件的发布和实施日期28 CNAS-CL18:2006《检测和校准实验室能力认可准则在纺织检测领域的应用说明》(2007年第1次修订) 2007-4-16 2007-4-30 CNAS-CL18:2006《实验室能力认可准则在纺织检测领域的应用说明》2006-6-1 2006-7-1 修订29实验室认可应用准则 CNAS-CL19:2010《检测和校准实验室能力认可准则在金属材料检测领域的应用说明》2010-12-30 2011-04-01 CNAS-CL19:2006《实验室能力认可准则在金属材料检测领域的应用说明》2006-6-1 2006-7-1 修订30 CNAS-CL20:2006《检测和校准实验室能力认可准则在信息技术软件产品检测领域的应用说明》(2007年第1次修订) 2007-4-16 2007-4-30 CNAS-CL20:2006《实验室能力认可准则在信息技术软件产品检测领域的应用说明》2006-6-1 2006-7-1 修订31 CNAS-CL21:2006《检测和校准实验室能力认可准则在卫生检疫领域的应用说明》(2007年第1次修订) 2007-4-16 2007-4-30 CNAS-CL21:2006《实验室能力认可准则在卫生检疫领域的应用说明》2006-6-1 2006-7-1 修订32 CNAS-CL22:2006《检测和校准实验室能力认可准则在动物检疫领域的应用说明》(2007年第1次修订) 2007-4-16 2007-4-30 CNAS-CL22:2006《实验室能力认可准则在动物检疫领域的应用说明》2006-6-1 2006-7-1 修订33 CNAS-CL23:2006《检测和校准实验室能力认可准则在植物检疫领域的应用说明》(2007年第1次修订) 2007-4-16 2007-4-30 CNAS-CL23:2006《实验室能力认可准则在植物检疫领域的应用说明》2006-6-1 2006-7-1 修订34 CNAS-CL24:2006《检测和校准实验室能力认可准则在贵金属、珠宝检测领域的应用说明》(2007年第1次修订) 2007-4-16 2007-4-30 CNAS-CL24:2006《实验室能力认可准则在黄金、珠宝检测领域的应用说明》2006-6-1 2006-7-1 修订35 CNAS-CL25:2006《检测和校准实验室能力认可准则在校准领域的应用说明》(2007年第1次修订) 2007-4-16 2007-4-30 CNAS-CL25:2006《实验室能力认可准则在校准领域的应用说明》2006-6-1 2006-7-1 修订4 / 7序号 文件类别文件名称编号发布日期 实施日期原文件名称编号原文件发布日期原文件实施日期备注注:如果文件被修订,则为最新修订文件的发布和实施日期36 CNAS-CL26:2007《检测和校准实验室能力认可准则在感官检验领域的应用说明》2007-4-16 2007-4-30 制定37 CNAS-CL27:2010《检测和校准实验室能力认可准则在电子物证检验领域的应用说明》2010-01-20 2010-01-20 制定38实验室认可应用准则 CNAS-CL28:2010《检测和校准实验室能力认可准则在法医物证DNA检测领域的应用说明》2010-01-20 2010-01-20 制定39 CNAS-CL29:2010《检测和校准实验室能力认可准则在微量物证检验领域的应用说明》2010-01-20 2010-01-20 制定40 CNAS-CL30:2010《标准物质/标准样品证书和标签的内容》(ISO Guide 31:2000)2010-12-30 2011-01-01 制定41实验室认可指南 CNAS-GL01:2006《实验室认可指南》(2007年第1次修订)2007-4-16 2007-4-30 CNAS-GL01:2006《实验室认可指南》 2006-6-1 2006-7-1 修订42 CNAS-GL02:2006《能力验证结果的统计处理和能力评价指南》2006-6-1 2006-7-1 制定43 CNAS-GL03:2006《能力验证样品均匀性和稳定性评价指南》2006-6-1 2006-7-1 制定44 CNAS-GL04:2006《量值溯源要求的实施指南》(2007年第1次修订)2007-4-16 2007-4-30 CNAS-GL04:2006《量值溯源要求的实施指南》2006-6-1 2006-7-1 修订45 CNAS-GL05:2006《测量不确定度要求的实施指南》(2007年第1次修订) 2007-4-16 2007-4-30 CNAS-GL05:2006《测量不确定度要求的实施指南》2006-6-1 2006-7-1 修订5 / 7序号 文件类别文件名称编号发布日期 实施日期原文件名称编号原文件发布日期原文件实施日期备注注:如果文件被修订,则为最新修订文件的发布和实施日期46 CNAS-GL06:2006《化学分析中不确定度的评估指南》2006-6-1 2006-7-1 制定47 CNAS-GL07:2006《电磁干扰测量中不确定度的评估指南》2006-6-1 2006-7-1 制定48实验室认可指南 CNAS-GL08:2006《电器领域不确定度的评估指南》2006-6-1 2006-7-1 制定49 CNAS-GL10:2006《材料理化检验测量不确定度评估指南及实例》2006-12-1 2006-12-1 制定50 CNAS-GL11:2007《检测和校准实验室能力认可准则在软件和协议检测领域的应用指南》2007-4-16 2007-4-30 制定51 CNAS-GL12:2007《实验室和检查机构内部审核指南》2007-4-16 2007-4-30 制定52 CNAS-GL13:2007《实验室和检查机构管理评审指南》2007-4-16 2007-4-30 制定53 CNAS-GL14:2007《医学实验室安全应用指南》2007-4-16 2007-4-30 制定54 CNAS-GL16:2007《最佳测量能力评定指南》2007-6-15 2007-8-1 制定55 CNAS-GL17:2007《医学实验室质量和能力认可准则在实验室信息系统的实施指南》2007-5-15 2007-5-15 制定56 CNAS-GL18:2008《量值溯源要求在医学测量领域的实施指南》2008-10-08 2008-10-08 制定57 CNAS-GL19:2008《医学实验室质量和能力认可准则在临床血液学检验领域的指南》 2008-12-01 2008-12-01 CNAS-CL27:2007《医学实验室质量和能力认可准则在临床血液学检验领域的应用说明》2007-4-16 2007-4-30 修订6 / 7序号 文件类别文件名称编号发布日期 实施日期原文件名称编号原文件发布日期原文件实施日期备注注:如果文件被修订,则为最新修订文件的发布和实施日期58 CNAS-GL20:2008《医学实验室质量和能力认可准则在体液学检验领域的指南》 2008-12-01 2008-12-01 CNAS-CL28:2007《医学实验室质量和能力认可准则在临床体液学检验领域的应用说明》2007-4-16 2007-4-30 修订59 CNAS-GL21:2008《医学实验室质量和能力认可准则在临床生物化学检验领域的指南》 2008-12-01 2008-12-01 CNAS-CL29:2007《医学实验室质量和能力认可准则在临床生物化学检验领域的应用说明》2007-4-16 2007-4-30 修订60实验室认可指南 CNAS-GL22:2008《医学实验室质量和能力认可准则在临床免疫学检验领域的指南》2008-12-01 2008-12-01 CNAS-CL30:2007《医学实验室质量和能力认可准则在临床免疫学检验领域的应用说明》2007-4-16 2007-4-30 修订61 CNAS-GL23:2008《医学实验室质量和能力认可准则在临床微生物学检验领域的指南》 2008-12-01 2008-12-01 CNAS-CL31:2007《医学实验室质量和能力认可准则在临床微生物学检验领域的应用说明》2007-4-16 2007-4-30 修订62 CNAS-GL24:2008《医学实验室质量和能力认可准则在输血医学领域的指南》 2008-12-01 2008-12-01 CNAS-CL32:2007《医学实验室质量和能力认可准则在输血医学领域的应用说明》2007-4-16 2007-4-30 修订63 CNAS-GL25:2008《医学实验室质量和能力认可准则在病理学检查领域的指南》 2008-12-01 2008-12-01 CNAS-CL33:2007《医学实验室质量和能力认可准则在病理学检验领域的应用说明》2007-4-16 2007-4-30 修订64 CNAS-GL26:2008《医学实验室质量和能力认可准则在基因扩增检验领域的指南》 2008-12-01 2008-12-01 CNAS-CL34:2007《医学实验室质量和能力认可准则在基因扩增检验领域的应用说明》2007-4-16 2007-4-30 修订65 CNAS-GL27:2009《声明检测或校准结果及与规范符合性的指南》 2009-09-28 2009-09-28 CNAS-CL08:2006《评价和报告测试结果与规定限量符合性的要求》2006-6-1 2006-7-1 制定66 CNAS-GL28:2010《石油石化领域理化检测测量不确定度评估指南及实例》2010-04-09 2010-04-09 制定67 CNAS-GL29:2010《标准物质/标准样品定值的一般原则和统计方法》(ISO Guide35:2006)2010-12-30 2011-01-01 制定7 / 7。
标准物质标准样品生产者能力认可规则

标准物质/标准样品生产者能力认可规则1。
目的与范围1。
1 中国合格评定国家认可委员会(CNAS)依据国家相关法律法规和国际规范开展认可工作,遵循的原则是:客观公正、科学规范、权威信誉、廉洁高效。
1。
2 认可规则是CNAS认可工作公正性和规范性的重要保障。
CNAS依据《中国合格评定国家认可委员会章程》制定本规则。
1。
3 本规则规定了CNAS标准物质/标准样品生产者(英文缩写:RMP)认可体系运作的程序,包括认可条件、认可流程、暂停、恢复、撤销、注销认可以及CNAS和RMP的权利和义务,是CNAS的RMP能力认可活动相关方应遵循的程序规则。
2。
引用文件下列文件中的条款通过引用而成为本文件的条款。
以下引用文件,注明日期的,仅所引用版本适用;未注明日期的,适用于其最新版本(包括任何修订)。
2。
1《中国合格评定国家认可委员会章程》2。
2 ISO/IEC 17011:20XX《合格评定—认可机构通用要求》2。
3 APLAC TC008 《APLAC关于RMP评价方法和认可结果描述的指南》2。
4 CNAS-R01 《认可标识和认可状态声明管理规则》2。
5 CNAS-R02 《公正性与保密规则》2。
6 CNAS-R03 《申诉、投诉和争议处理规则》2。
7 CNAS-RL01 《实验室认可规则》2。
8 CNAS-RL02 《能力验证规则》2。
9 CNAS-RL03 《实验室和检查机构认可收费管理规则》2。
10 CNAS-RL04 《港澳台及国外机构受理政策》2。
11 CNAS-CL06 《量值溯源要求》2。
12 CNAS-CL07 《测量不确定度评估和报告通用要求》3。
术语和定义本规则引用ISO/IEC17000、ISO/IEC17011和ISO指南30系列文件中的有关术语并采用下列定义:3。
1 认可:正式表明获准认可机构具备实施特定合格评定工作的能力的第三方证明。
3。
2 认可条件:申请人为获得认可资格必须满足的全部要求。
大米中T-2毒素质控样品的研制

分析检测大米中T-2毒素质控样品的研制邓皇翼,刘海虹,刘耀慧,罗志浩,蔡若纯*(广东省食品检验所,广东广州 510435)摘 要:目的:采用研磨的方式制备以大米为基质的T-2毒素质控样品。
方法:将不含T-2毒素的大米经研磨过筛、添加标准物质,再次进行研磨混匀,置于无菌采样袋中密封分装。
用液相色谱-串联质谱对质控样进行含量检测,参照CNAS-GL003:2018《能力验证样品均匀性和稳定性评价指南》对样品进行均匀性和稳定性分析,采用与6家实验室协作定值的方式确定质控样的参考值。
结果:单因素方差分析中,F<F0.05,表明制备的T-2毒素质控样品在样品间不存在显著性差异;t检验中,t<t0.05,表明样品中的分析物在12个月内是稳定的。
最终确定大米中T-2毒素的定值结果为8.79 μg·kg-1。
结论:该方法制得的质控样品可用于粮食中T-2毒素污染情况质量监控、能力验证、快检产品评价等领域,并为进一步研制粮食中其他毒素质控样提供技术支持。
关键词:大米基质;T-2毒素;质控样品;均匀性;稳定性;定值Preparation of T-2 Toxin Quality Control Samples in RiceDENG Huangyi, LIU Haihong, LIU Yaohui, LUO Zhihao, CAI Ruochun*(Guangdong Institute for Food Inspection, Guangzhou 510435, China)Abstract: Objective: To prepare quality control sample of T-2 toxin based on rice by grinding. Method: The rice without T-2 toxin was grinded, sieved, added with T-2 toxin standard materials, grinded again, and then packed in sterile sampling bags. The content of the quality control samples was detected by liquid chromatography-tandem mass spectrometry. According to CNAS-GL003:2018, the uniformity and stability of T-2 toxin quality control samples were evaluated and cooperated with 6 laboratories to definite value. Result: In the one-way analysis of variance, F<F0.05, indicating that there was no significant differences among the prepared control samples. In the t-test method, t<t0.05, indicating that the stability of the samples during the 12 month storage period was good. Finally, the standard value of T-2 toxin quality control samples was determined 8.79 μg·kg-1. Conclusion: The quality control samples obtained by this method can be applied to quality monitoring of T-2 toxin contamination in grain, ability verification, product evaluation and other fields, and provide technical support for the further development of the quality control samples of other toxin.Keywords: rice matrix; T-2 toxin; quality control sample; uniformity; stability; fixed value粮食安全是关系国家经济发展、社会稳定的全局性重大战略问题。
ISO导则35标准样品定值的一般原则和统计方法

ISO 导则35 标准样品定值的般原则和统计方法CNAS-GLXX目次前言GB/T 15000 在《标准物质/ 标准样品工作导则》的总标题下,目前共有9个部分,即:GB/T 15000.1—1994标准物质/标准样品工作导则(1)在技术标准中陈述标准物质/标准样品的一样规定GB/T 15 000.2—1994 标准物质/标准样品工作导则(2)标准物质/标准样品常用术语及定义GB/T 15000.3—200X 标准物质/标准样品工作导则(3)标准物质/标准样品定值的一样原则和统计方法GB/T 15000.4—2003 标准物质/标准样品工作导则(4)标准物质/标准样品证书和标签的内容GB/T 15000. 5—1994 标准物质/标准样品工作导则(5)化学成分标准物质/标准样品技术通则GB/T 15000.6—1996 标准物质/标准样品工作导则(6)标准物质/ 标准样品包装通则GB/T 15000.7—2001 标准物质/标准样品工作导则(7)标准物质/标准样品生产者能力的通用要求GB/T 15000.8—2003 标准物质/标准样品工作导则(8)有证标准物质/标准样品的使用GB/T 15000.9 —2004 标准物质/标准样品工作导则(9)分析化学中的校准和有证标准物质/标准样品的使用本部分是其中的第3部分。
本部分等同采纳ISO导则35: 2006《标准物质/标准样品定值的一样原则和统计方法》,为GB/T 15000. 3—1994《标准物质/标准样品工作导则标准物质/标准样品定值的一样原则和统计方法》的修订版。
本部分与ISO导则35:2006的不同点在于:一一对ISO导则35:2006规范性引用的国际标准,本部分用等同采纳相应国际标准的国家标准代替;一一用“本部分”代替“本导则”;一一删除了ISO导则35:2006中的前言等资料性概述要素。
本部分与GB/T 15000.3—1994相比,要紧变化如下:——修改了RM 和CRM 的定义;——增加了与RM 有关的13个术语;——对标准物质/标准样品定值、平均性研究和稳固性研究给出了新的要求。
CNAS-CL04:2010《标准物质_标准样品生产者能力认可准则》

CNAS-CL04标准物质/标准样品生产者能力认可准则Accreditation Criteria for the Competence of Reference Material Producers( ISO Guide34:2009)中国合格评定国家认可委员会目次前言 (2)引言 (3)1 范围 (4)2 规范性引用文件 (4)3 术语和定义 (4)4 组织和管理要求 (7)4.1 管理体系要求 (7)4.2 组织和管理 (9)4.3 文件和信息控制 (9)4.4 要求、标书和合同的评审 (10)4.5 分包方的选用 (11)4.6 服务和供应品的采购 (11)4.7 客户服务 (11)4.8 投诉 (12)4.9 不符合工作和/或标准物质/标准样品的控制 (12)4.10 纠正措施 (12)4.11 预防措施 (13)4.12 改进 (13)4.13 记录 (13)4.14 内部审核 (14)4.15 管理评审 (15)5 技术和生产要求 (15)5.1 总则 (15)5.2 人员 (16)5.3 分包方 (16)5.4 生产策划 (17)5.5 生产控制 (18)5.6 设施和环境条件 (18)5.7 材料的处置和贮存 (19)5.8 材料制备 (20)5.9 测量方法 (20)5.10 测量设备 (20)5.11 数据评估 (21)5.12 计量溯源性 (21)5.13 均匀性评估 (23)5.14 稳定性评估 (24)5.15 测定 (24)5.16 特性值及其不确定度的确定 (25)5.17 提供给客户的证书或文件 (26)5.18 分发服务 (26)附录A(资料性附录)标准物质/标准样品标准值的计量溯源性 (27)附录B(资料性附录)标准物质/标准样品的互换性 (29)附录C(资料性附录)ISO/IEC 17025与ISO指南34的交叉对照表 (31)参考文献 (35)本准则等同采用ISO Guide34:2009 General requirements for the competence of reference material producers,作为CNAS对标准物质/标准样品生产者(RMP)能力认可的基本准则。
校准品质控品技术审评规范(2017版)-20171103征求意见

生化分析用校准物、质控物产品技术审评规范(2017版)本规范旨在指导注册申请人对校准物、质控物产品注册申报资料的准备及撰写,同时也为技术审评部门对注册申报资料的技术审评提供参考。
本规范是对校准物、质控物产品的一般要求,申请人应依据具体产品的特性对注册申报资料的内容进行充实和细化,并依据产品特性确定其中的具体内容是否适用。
本规范是对申请人和审查人员的指导性文件,但不包括注册审批所涉及的行政事项,亦不作为法规强制执行,如果有能够满足相关法规要求的其他方法,也可以采用,但需要提供详细的研究资料和验证资料。
应在遵循相关法规的前提下使用本规范。
本规范是在现行法规和标准体系以及当前认知水平下制定的,随着法规和标准的不断完善,以及科学技术的不断发展,本规范相关内容也将进行适时调整。
一、适用范围本规范适用于依据《体外诊断试剂注册管理办法》(国家食品药品监督管理总局令第5号)(以下简称《办法》)管理类别为第二类的校准物和质控物。
具体的,本规范适用于在生化分析仪上使用,用于检测系统校准的校准物,不适用于生化分析仪电解质模块用校准物。
适用于在生化分析仪上使用,用于适配试剂或检测系统质量控制的质控物,不适用于正确度质控物。
作为独立注册单元申报的校准物和质控物应执行本规范,作为试剂盒组分与试剂合并申报的校准物和质控物可参照执行。
依据《办法》,与第一类体外诊断试剂配合使用的校准物、质控物,按第二类产品进行注册;与第二类、第三类体外诊断试剂配合使用的校准物、质控物单独申请注册时,按与试剂相同的类别进行注册;多项校准物、质控物,按其中的高类别进行注册。
二、注册申报资料要求(一)综述资料综述资料主要包括产品预期用途、产品描述、有关生物安全性的说明、研究结果的总结评价以及同类产品上市情况介绍等内容,应符合《办法》和《关于公布体外诊断试剂注册申报资料要求和批准证明文件格式的公告》(国家食品药品监督管理总局公告2014年第44号)的相关要求。
国际参考实验室能力验证样品的均匀性评价

国际参考实验室能力验证样品的均匀性评价林海标;黄小亭;张乔轩;韩丽乔;王建兵;柯培锋;黄宪章;庄俊华【摘要】Objective To evaluate the homogeneity of the proficiency test samples to verify whether it meets the requirements of the comparison in international reference laboratory.Methods According to the Guidance on Evaluating the Homogeneity and Stability of Samples Used for Proficiency Testing (CNAS-GL03),14 biochemical indexes includingALT,AST,ALP,GGT,CK,LDH,TP,T-Bil,Urea,Cr,UA,Glu,TG and TC in the past three years (from 2014 to 2016)were tested by the Roche detection system Modular P800 Biochemical analyzer.The mean ((x)),standard deviation (s)and coefficient of variation (CV)of the samples were calculated.One-way analysis of variance (ANOVA)was performed and the guideline of Ss ≤0.3σ was used to evaluate the between-bottle differences.Results The results showed that the CVs of AST in RELA 2014A and B were higher than2.0%.The CVs of CK were over 2% in all tests except for RELA 2016B.The results of ANOVA for RELA samples demonstrated that the F value of CK was over the critical value 4.39,which was statistically significant (P <0.05).The F values of the ALT and T-Bil in 2015B and the Cr in 2014A were also over 4.39 (P < 0.05) respectively,while the F values of other measurements were less than the critical value of F,indicating there was no statistical significance (P > 0.05).The CK measurement data Ss >0.3σ in all the samples by the guideline of Ss ≤ 0.3σ,suggesting that there was a between-bottle difference in CK.The other indexes were Ss ≤ 0.3σ,showi ngno between-bottle difference in those items.Conclusion There were significant differences between the bottles of the CK item in the past three years,and the homogeneity of all the other items in the samples could meet the requirements of Proficiency Testing for the international reference laboratory.%目的评价国际参考实验室能力验证样品(RELA-A/B)的均匀性是否满足参考实验室比对的要求.方法参照CNAS-GL03《能力验证样品均匀性和稳定性评价指南》,用Roche Modular P800生化分析仪测量2014至2016年连续3年RELA-A/B的14个项目,即丙氨酸氨基转移酶(A LT)、天冬氨酸氨基转移酶(AST)、碱性磷酸酶(ALP)、L-γ-谷氨酰基转移酶(GGT)、肌酸激酶(CK)、乳酸脱氢酶(LDH)、总蛋白(TP)、总胆红素(T-Bil)、尿素(Urea)、肌酐(Cr)、尿酸(UA)、葡萄糖(Glu)、三酰甘油(TG)、总胆固醇(TC).计算测量结果均值((x))、标准差(s)和变异系数(CV),用单因素方差分析和Ss≤0.3σ准则分析评价其瓶间差异.结果 RELA 2014A和2014B样品AST测量结果CV>2.0%.除RELA 2016B样品CK测量结果CV<2.0%外,其他样品CK测量结果CV均>2%.单因素方差分析结果显示,所有样品中CK测量结果F均>临界值4.39,差异有统计学意义(P <0.05);2015B样品ALT和T-Bil,2014A样品Cr测量结果F均>临界值4.39,差异有统计学意义(P<0.05);其他测量结果F均<临界值4.39,差异无统计学意义(P>0.05).Ss≤0.3σ准则分析结果显示,所有样品CK测量结果Ss >0.3σ,CK测量结果存在瓶间差异;其他项目测量结果Ss均≤0.3σ,其他项目测量结果无瓶间差异.结论国际参考实验室能力验证样品CK项目存在瓶间差异,值得注意;其他项目均匀性能满足参考实验室能力验证要求.【期刊名称】《临床检验杂志》【年(卷),期】2017(035)009【总页数】4页(P696-699)【关键词】肌酸激酶;均匀性;参考实验室;能力验证【作者】林海标;黄小亭;张乔轩;韩丽乔;王建兵;柯培锋;黄宪章;庄俊华【作者单位】广东省中医院检验医学部,广州510120;广州中医药大学第二临床医学院,广州510120;广东省中医院检验医学部,广州510120;广东省中医院检验医学部,广州510120;广东省中医院检验医学部,广州510120;广东省中医院检验医学部,广州510120;广东省中医院检验医学部,广州510120;广东省中医院检验医学部,广州510120【正文语种】中文【中图分类】R446Abstract: Objective To evaluate the homogeneity of the proficiency test samples to verify whether it meets the requirements of the comparison in international reference laboratory. Methods According to the Guidance on Evaluating the Homogeneity and Stability of Samples Used for Proficiency Testing (CNAS-GL03), 14 biochemical indexes including ALT, AST, ALP, GGT, CK, LDH, TP, T-Bil, Urea, Cr, UA, Glu, TG and TC in the past three years (from 2014 to 2016)were tested by the Roche detection system ModularP800 Biochemical analyzer. The mean(), standard deviation (s)and coefficient of variation (CV)of the samples were calculated. One-way analysis of variance (ANOVA)was performed and the guideline of SS≤0.3σ was used to evaluate the between-bottle differences. Results The results showed that the CVs of AST in RELA 2014A and B were higher than 2.0%.The CVs of CK were over 2% in all tests except for RELA 2016B. The results of ANOVA for RELA samples demonstrated that the F value of CK was over the critical value 4.39, which was statistically significant (P<0.05). The F values of the ALT and T-Bil in 2015B and the Cr in 2014A were also over4.39 (P<0.05)respectively, while the F values of other measurements were less than the critical value of F, indicating there was no statistical significance (P> 0.05). The CK measurement data SS> 0.3σ in all the samples by the guideline of SS≤0.3σ, suggesting that there was a between-bottle difference in CK. The other indexes were SS≤0.3σ, sho wing no between-bottle difference in those items. Conclusion There were significant differences between the bottles of the CK item in the past three years, and the homogeneity of all the other items in the samples could meet the requirements of Proficiency Testing for the international reference laboratory.Key words: creatine kinase; homogeneity; reference laboratory; coefficientof variation参考实验室能力验证计划是保证各参考实验室测量结果准确性的重要途径。
能力验证物品的均匀性检验和和评定程序
5.5.1.1 按照 QP-PTP-015《能力验证物品处置、存储、包装、标识和分发管理程序》储存
条件规定最高和最低的温度和湿度,随机抽取能力验证样品进行均匀性检验与评定分析,
以证实储存条件对其影响,并记录在 FM-PTP009-01《能力验证样品均匀性检验记录和评
5.1.1 比对能力验证样品的一致性对利用实验室间比对进行开展能力验证。在实施能力验
证计划时,能力验证中心确保能力验证中出现的不满意结果不归咎于能力验证样品之间或
样品本身的变异。
5.1.2 基于不均匀性和不稳定性的能力验证样品对能力验证参加者评定产生很大影晌,能
Logo
文件编号
QP-PTP-009
设计与开发,主要包括:样品所用材料的要求与特性,样品特性值及量值范围,样品特性
要求,样品应当符合和满足本轮能力验证指定或参考的标准所规定试验方法或测试程序。
5.2.2.2 委托定制生产的厂家应当对能力验证样品设计值具有待测能力, 对分包方要求应
当符合和满足 QP-PTP-024《能力验证分包管理程序》。在能力验证样品生产加工过程中
验证样品符合均匀性要求。
5.2.1.2 分批生产材料制备的能力验证样品,其设计值一样,应当各批的能力验证样品集
中在一起进行检验能力验证样品的特性值,评定能力验证样品的均匀性。
5.2.2 委外分包的均匀性检验
5.2.2.1 必要情况下,能力验证中心的能力验证样品可以选择委托分包进行定制生产,能
力验证中心按照 QP-PTP-007《能力验证物品制备和评定管理程序》对能力验证样品进行
版本/版次
B/0
页码
3/13
ISO导则35标准样品定值的一般原则和统计方法

2018 年 3 月 1 日 实施
CNAS-GL017:2018
第 1 页 共 68 页
目次
前 言 .......................................................................................................................................... 3 引 言(ISO) ............................................................................................................................ 4 1 范围 .......................................................................................................................................... 5 2 规范性引用文件........................................................................................................................ 5 3 术语和定义 ............................................................................................................................... 6 4 符号 ..........................................
ISO导则35标准样品定值的一般原则和统计方法-中国合格评定国家

CNAS-GL45标准物质/标准样品证书和标签的内容Contents of certificates and labels(ISO Guide31:2015, IDT)中国合格评定国家认可委员会目次ISO引言 (3)1 范围 (4)2 规范性引用文件 (4)3 术语和定义 (4)4 总则 (5)5 产品说明书或标准物质/标准样品证书的内容 (5)5.1 总则 (5)5.2 标准物质/标准样品文件所需的信息 (7)5.2.1 标准物质/标准样品文件的标题 (7)5.2.2 标准物质/标准样品的唯一性标识 (7)5.2.3 标准物质/标准样品的名称 (7)5.2.4 标准物质/标准样品生产者的名称及联系信息 (7)5.2.5 预期用途 (7)5.2.6 最小取样量 (8)5.2.7 有效期 (8)5.2.8 互换性 (8)5.2.9 贮存信息 (9)5.2.10 处置和使用说明 (9)5.2.11 页数 (9)5.2.12 文件版本 (9)5.3 标准物质/标准样品证书要求的信息 (9)5.3.1 标准物质/标准样品的描述 (9)5.3.2 涉及的特性、特性值及其不确定度 (9)5.3.3 计量溯源性 (10)5.3.4 依赖方法的被测量测量方法 (10)5.3.5 标准物质/标准样品生产者批准人员的姓名及职务 (10)5.4 其他有用信息 (10)5.4.1 健康及安全信息 (10)5.4.2 分包方 subcontractor (10)5.4.3 信息值 (11)5.4.4 法律告知 (11)5.4.5 定值报告引用的参考文献 (11)6 标签 (11)参考文献 (12)ISO引言国际标准化组织标准物质/标准样品委员会(ISO/REMCO)分别于1981年和2000年出版了本指南的第一版和第二版。
自第二版出版以来,标准物质/标准样品生产及其使用的数量和种类均已有相当大的增长。
各界对由分析技术取得的结果可靠性的需求提高了,特别是在法律要求、环境和临床应用方面日益收到关注。
标准样品定值的一般原则和统计方法

GB/T15000.2-1994中的25个术语
有关样品方面的术语(7) 有关定值和发布方面的术语(3)
样品 标准样品 有证标准样品 测定 均匀性 稳定性 有效期 有关测定和试验方面的术语(5) 标准值 参考值 不确定度 准确度 实验室间试验 有关方法方面的术语(1) 标准方法
ISO Guide 35简介
1981年ISO Committee on Reference Materials
(REMCO)会议决定制定该指南文件;
1985年发布第1版; 1989年发布第2版; 2006年发布第3版。
ISO Guide 35
1989版
2006版
1 Scope 2 Definitions 3 The role of reference materials in measurement science 4 Measurement uncertainty 5 Homogeneity of materials 6 General principles of certification 7 Certification by a definitive method 8 Certification by interlaboratory testing 9 Certification based on a metrological approach
由全国标准样品技术委员会负责组织制定。 1994年发布了5个系列国标,分别是: GB/T15000.1-1994 在技术标准中陈述标准样品的一般规定 GB/T15000.2-1994 标准样品常用术语及定义 GB/T15000.3-1994 标准样品定值的一般原则和统计方法 GB/T15000.4-1994 标准样品证书内容的规定 GB/T15000.5-1994 化学成分标准样品技术通则 1996年发布了第6个系列国标 GB/T15000.6-1996 标准样品包装通则 2001年发布了第7个系列国标 GB/T15000.7-2001 标准样品生产者能力的通用要求 2003年发布了第8个系列国标,并且发布新的GB/T15000.4 GB/T15000.8-2003 有证标准样品的使用 GB/T15000.4-2003 标准样品证书和标签的内容 2008年发布新的GB/T15000.3,替代GB/T15000.3-1994和GB/T15000.5-1994 GB/T15000.3-2008 标准样品定值的一般原则和统计方法
CNAS实验室认可规范文件清单
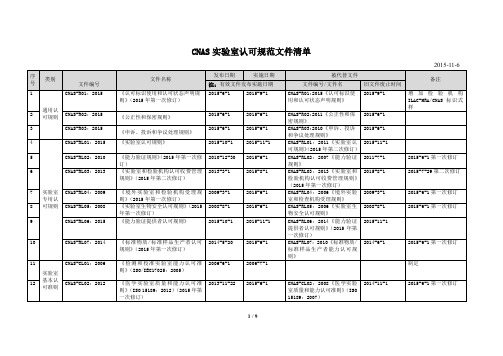
2014-7-1 2014-4-1 2014-4-1
2016-1-1 2015-6-1 2015-6-1 2015-6-1 2015-6-1
《司法鉴定/法庭科学机构能力认 可准则在微量物证鉴定领域的应用 说明》(2015 年第一次修订) 《标准物质/标准样品证书和标签 的内容》(ISO Guide 31:2000)(2015 年第一次修订) 《内部校准要求》(2015 年第一次修 订) 《检验医学领域参考测量实验室的 特定认可要求》(2015 年第一次修 订)
2015-6-1 2015-6-1 2015-6-1 2015-6-1 2015-6-1 2015-6-1
《检测和校准实验室能力认可准则 2014-1-1 在微生物检测领域的应用说明》 (2015 年第一次修订)
2015-6-1
《检测和校准实验室能力认可准则 2012-6-11 在化学检测领域的应用说明》(2015 年第一次修订)
2015-6-1 第一次修订 2011-11-1 第一次修订 2015-6-1 第二次修订 2015-6-1 第一次修订
2015-6-1 第一次修订
2007 年第一次修订 2015-6-1 第一次修订 2015-6-1 第一次修订
CNAS-CL13:2011《检测和校 准实验室能力认可准则在汽 车和摩托车检测领域的应用 说明》(2015 年第一次修订)
备注 2015-6-1 第一次修订 2015-6-1 第一次修订 2015-6-1 第一次修订 2015-6-1 第一次修订
CNAS-CL06:2011《量值溯源 要求》 CNAS-CL07:2011《测量不确 定度的要求》
2014-11-1 2011-11-1
CNAS-CL09:2006《检测和校 2015-12-30 准实验室能力认可准则在微 生物检测领域的应用说明》 (2007 年第 1 次修订) CNAS-CL10:2006《检测和校 2014-6-10 准实验室能力认可准则在化 学检测领域的应用说明》 (2007 年第 1 次修订) CNAS-CL11:2006《实验室能 2007-4-30 力认可准则在电子和电气检 测领域的应用说明》
BCR-ABL1候选参考物质的研制及测量不确定度评定

BCR-ABL1候选参考物质的研制及测量不确定度评定于书平;袁丹丹;崔明;景蓉蓉;王惠民【摘要】目的构建慢性粒细胞白血病(CML)融合基因断裂点簇集区-埃布尔森小鼠白血病病毒癌基因1(BCR-ABL1)候选参考物质.方法采用分子克隆技术构建含有BCR-ABL1基因的重组质粒,测序验证后采用紫外分光光度法初步测定浓度,并采用数字聚合酶链反应(dPCR)进行浓度定值,实时荧光定量聚合酶链反应(RQ-PCR)进行均匀性和稳定性研究,最终应用《测量不确定度表示指南》评定测量不确定度.结果质粒候选参考物质拷贝数浓度为(2.50±0.35)×106拷贝/μL,有较好的均匀性和稳定性.结论建立了制备BCR-ABL1候选参考物质的方法,构建了均匀稳定的BCR-ABL1候选参考物质.【期刊名称】《检验医学》【年(卷),期】2019(034)008【总页数】6页(P752-757)【关键词】断裂点簇集区-埃布尔森小鼠白血病病毒癌基因1;参考物质;测量不确定度;数字聚合酶链反应;紫外分光光度法【作者】于书平;袁丹丹;崔明;景蓉蓉;王惠民【作者单位】南通大学附属医院医学检验科,江苏南通 226001;南通大学附属医院医学检验科,江苏南通 226001;南通大学附属医院医学检验科,江苏南通 226001;南通大学附属医院医学检验科,江苏南通 226001;南通大学附属医院医学检验科,江苏南通 226001【正文语种】中文【中图分类】R446.1慢性粒细胞白血病(chronic myeloid leukemia,CML)的特征性分子标志物是由埃布尔森小鼠白血病病毒癌基因1(abelson murine leukemia viral oncogene homolog 1,ABL1)和断裂点簇集区(breakpoint cluster region,BCR)易位形成的BCR-ABL1融合基因[1],因断裂位点不同形成了多种BCR-ABL1亚型,e14a2是最常见的亚型之一[2]。
CNAS-GL29:2010《标准物质_标准样品定值的一般原则和统计方法》

CNAS-GL29
标准物质/标准样品定值的 一般原则和统计方法
Reference materials - General and statistical principles for certification (ISO Guide35:2006)
中国合格评定国家认可委员会
2010 年 12 月 30 日 发布 2015 年 06 月 01 日第一次修订 2015 年 06 月 01 日 实施
CNAS-GL29:2ຫໍສະໝຸດ 10第 1 页 共 69 页
目 次
前 言.......................................................................................................................................................... 4 引 言(ISO)........................................................................................................................................... 5 1 范围..........................................................................................................
实验室管理相关标准汇编

实验室管理相关标准汇编法规法规名称⽂号实施⽇期国家认可机构监督管理办法??国家认监委国认可(2002)20号2002-05-01国家认证认可监督管理委员会实施认证认可⾏政处罚若⼲规定国家认监委(2003)17号公告2003-12-09认证机构、检查机构、实验室取得境外认可机构认可备案管理办法国家认监委(2004)4号公告2004-02-20认证证书和认证标志管理办法质检总局令(2004)63号2004-08-01认证培训机构管理办法质检总局令(2005)81号2005-11-01认证咨询机构管理办法质检总局令(2005)82号2005-11-01认证技术规范管理办法国家认监委(2006)3号公告2006-03-01实验室能⼒验证实施办法国家认监委(2006)9号公告2006-05-01农药良好实验室考核管理办法农业部(2006)739号2006-12-01实验室资质认定评审员管理办法国家认监委(2007)24号公告2007-12-01⾷品检验机构资质认定管理办法(修订)质检总局令(2015)165号2015-06-19认证认可申述投诉处理⽅法国家认监委(2011)1号公告2011-01-11认证机构管理办法质检总局令(2011)141号2011-09-01检验检测机构资质认定管理办法质检总局令(2015)163号2015-08-01认证机构管理办法(修订)质检总局令(2015)164号2015-08-01 GB标准名称实施⽇期GBT 27025-2008 检测和校准实验室能⼒的通⽤要求2008-08-01GBT 20001.4-2015 标准编写规则第4部分:试验⽅法标准2016-01-01GBT 21785-2008 实验室玻璃器⽫密度计2008-09-01GBT 21785-2008 实验室玻璃器⽫密度计2008-09-01 GBT 22272-2008 良好实验室规范建议性⽂件建⽴和管理符合良好实验室规范原则的档案.2009-04-01 GBT 22273-2008 良好实验室规范建议性⽂件良好实验室规范原则在体外研究中的应⽤2009-04-01 GBT 22274.1-2008 良好实验室规范监督部门指南第1部分:良好实验室规范符合性监督程序指南2009-04-01 GBT 22274.2-2008 良好实验室规范监督部门指南第2部分:执⾏实验室检查和研究审核的指南2009-04-01 GBT 22274.3-2008 良好实验室规范监督部门指南第3部分:良好实验室规范检查报告的编制指南2009-04-01 GBT 22275.1-2008 良好实验室规范实施要求第1部分质量保证与良好实验室规范2009-04-01GBT 22275.2-2008 良好实验室规范实施要求第2部分:良好实验室规范研究中项⽬负责⼈的任务和2009-04-01职责GBT 22275.3-2008 良好实验室规范实施要求第3部分:实验室供应商对良好实验室规范原则的符合2009-04-01情况GBT 22275.4-2008 良好实验室规范实施要求第4部分:良好实验室规范原则在现场研究中的应⽤2009-04-01 GBT 22275.5-2008 良好实验室规范实施要求第5部分:良好实验室规范原则在短期研究中的应⽤2009-04-01GBT 22275.6-2008 良好实验室规范实施要求第6部分:良好实验室规范原则在计算机化的系统中的2009-04-01应⽤GBT 22275.7-2008 良好实验室规范实施要求第7部分:良好实验室规范原则在多场所研究的组织和2009-04-01管理中的应⽤GBT 22276-2008 良好实验室规范建议性⽂件在另⼀国家中要求和执⾏检查与研究审核2009-04-01 GBT 22277-2008 良好实验室规范建议性⽂件在良好实验室规范原则的应⽤中委托⽅的任务和职责2009-04-01 GBT 22278-2008 良好实验室规范原则2009-04-01GBT 25915.2-2010 洁净室及相关受控环境第2部分:证明持续符合GBT 25915.1的检测与监测技术2011-06-01条件GBT 25915.6-2010 洁净室及相关受控环境第6部分:词汇2011-05-01 GBT 25915.8-2010 洁净室及相关受控环境第8部分:空⽓分⼦污染分级2011-06-01 GBT 27401-2008 实验室质量控制规范动物检疫2008-10-01 GBT 27402-2008 实验室质量控制规范植物检疫2008-10-01 GBT 27403-2008 实验室质量控制规范⾷品分⼦⽣物学检测2008-10-01 GBT 27404-2008 实验室质量控制规范⾷品理化检测2008-10-01 GBT 27405-2008 实验室质量控制规范⾷品微⽣物检测2008-10-01 GBT 27406-2008 实验室质量控制规范⾷品毒理学检测2008-10-01 GBT 27410-2010 消费类产品中有毒有害物质检测实验室技术规范2011-07-01 GBT 29471-2012 ⾷品安全检测移动实验室通⽤技术规范2013-07-31 GBT 32146.1-2015 检验检测实验室设计与建设技术要求第1部分:通⽤要求2016-07-01 GBT 32146.3-2015 检验检测实验室设计与建设技术要求第3部分:⾷品实验室2016-07-01 NY、SC、SN标准名称实施⽇期NYT 1493-2007 农药残留试验良好试验室规范2008-03-01 NYT 718-2003 农药毒理学安全性评价良好实验室规范2004-03-01 SCT 7019-2015 ⽔⽣动物病原微⽣物实验室保存规范2015-05-01 SNT 1482-2004 实验室内部质量控制⽅法 MR统计合并动态跟踪监控技术2005-04-01 SNT 2294.1-2009 检验检疫实验室管理第1部分总则2009-09-01 SNT 2294.2-2009 检验检疫实验室管理第2部分信息系统2009-09-01 SNT 2294.3-2009 检验检疫实验室管理第3部分分类2010-03-16 SNT 2294.4-2011 检验检疫实验室管理第4部分事故处理规程2012-04-01 SNT 2294.5-2011 检验检疫实验室管理第5部分危险化学品安全管理指南2012-04-01 SNT 2294.6-2011 检验检疫实验室管理第6部分放射源安全管理指南2012-04-01 SNT 2723.1-2010 实验室能⼒验证第1部分总则2011-05-01 SNT 2723.2-2010 实验室能⼒验证第2部分名词和术语2011-05-01 SNT 2723.3-2010 实验室能⼒验证第3部分能⼒验证报告的格式和内容2011-05-01 SNT 2984-2011 检验检疫动物病原微⽣物实验活动⽣物安全要求细则2012-04-01 SNT 2989-2011 出⼊境动物检疫实验室能⼒验证技术规范2012-04-01 SNT 2990-2011 质量控制与质量评价实验室过程与测试能⼒指数评定⽅法2012-04-01 SNT 3092-2012 实验室应对公共安全事件能⼒规范2012-11-16 SNT 3509-2013 实验室样品管理指南2013-09-16 SNT 3590-2013 化学分析实验室中的职责和质量控制指南2014-03-01 SNT 3591-2013 实验室标准物质管理指南2014-03-01 CNAS标准名称实施⽇期CNAS-CC01:2011 管理体系认证机构要求2011-07-01 CNAS-CC03:2014 ⼈员认证机构通⽤要求2014-10-01 CNAS-CC11:2010 基于抽样的多场所认证2010-09-01 CNAS-CC12:2008 已认可的管理体系认证的转换2008-12-14 CNAS-CC13:2008 ⾼级监督和再认证程序2008-09-15 CNAS-CC131:2014 质量管理体系审核及认证的能⼒要求2014-05-01 CNAS-CC14:2008 计算机辅助审核技术在获得认可的管理体系认证中的使⽤2008-09-15 CNAS-CC15:2013 管理体系审核时间(QMS、EMS、OHSMS)2014-01-01 CNAS-CC18:2014 ⾷品安全管理体系认证机构要求2015-01-01 CNAS-CC21:2006 产品认证机构通⽤要求2006-07-01 CNAS-CC22:2007《产品认证机构通⽤要求》应⽤指南(IAF GD5:2006)2007-12-08 CNAS-CC31:2010《⼈员认证机构通⽤要求》应⽤指南2010-04-01 CNAS-CC41:2006 职业健康安全管理体系认证机构通⽤要求2006-07-01 CNAS-CC42:2006 《职业健康安全管理体系认证机构通⽤要求》应⽤指南2006-07-01 CNAS-R01 认可标识和认可状态声明管理规则2007-04-15 CNAS-R01:2010 认可标识和认可状态声明管理规则2011-01-01 CNAS-R02:2011 公正性和保密规则2011-04-01 CNAS-R03:2010 申诉、投诉和争议处理规则2010-11-08 CNAS-RC01:2013 认证机构认可规则2013-10-30 CNAS-RC02:2013 认证机构认可资格处理规则2013-10-30 CNAS-RC03:2013 认证机构信息通报规则2013-07-01 CNAS-RC04:2013 认证机构认可收费管理规则2013-10-30 CNAS-RC05:2014 多场所认证机构认可规则2014-09-04 CNAS-RC07:2011 具有境外关键场所的认证机构认可规则2011-04-28 CNAS-RI01:2007 检查机构认可规则2008-01-01 CNAS-Rl05:2008 实验室⽣物安全认可规则2008-08-01 CNAS-RL01:2011 实验室认可规则(2013修订版)2013-09-01 CNAS-RL02:2010 能⼒验证规则2011-02-01 CNAS-RL03:2013 实验室和检查机构认可收费管理规则2013-03-01 CNAS-RL04:2009 境外实验室和检查机构受理规则2009-03-01 CNAS-RL06:2014 能⼒验证提供者认可规则2014-05-01 CNAS-RL07:2014 标准物质标准样品⽣产者认可规则2014-06-01CNAS-AL07:2011 CNAS能⼒验证领域和频次2011-02-12表CNAS-AL08:2011 能⼒验证机构备案要求及2011-02-12项⽬确认需提交资料清单CNAS-CI01:2012 检查机构能⼒认可准则2013-06-01CNAS-CI02:2006 检查机构认可准则应⽤说明2006-07-01CNAS-CL01:2006 检测和校准实验室能⼒认2006-07-01可准则CNAS-CL02:2012 医学实验室质量和能⼒认2014-11-01可准则CNAS-CL03:2010 能⼒验证提供者认可准则2011-01-01CNAS-CL04:2010 标准物质标准样品⽣产者2011-01-01能⼒认可准则CNAS-CL05:2009 实验室⽣物安全认可准则2009-07-01 CNAS-CL07:2011 测量不确定度的要求2011-05-01CNAS-CL09:2013 检测和校准实验室能⼒认2015-06-01可准则在微⽣物检测领域的应⽤说明CNAS-CL10-2012 检测和校准实验室能⼒认可2013-01-01准则在化学检测领域的应⽤说明CNAS-CL21:2015 检测和校准实验室能⼒认2016-10-01可准则在卫⽣检疫领域的应⽤说明(2016-10-1实施)CNAS-CL22:2015 检测和校准实验室能⼒认2016-10-01可准则在动物检疫领域的应⽤说明(2016-10-1实施)CNAS-CL23:2015 检测和校准实验室能⼒认2016-10-01可准则在植物检疫领域的应⽤说明(2016-10-1实施)CNAS-CL26:2014 检测和校准实验室能⼒认可2015-01-01准则在感官检测领域的应⽤说明CNAS-CL30:2010 标准物质标准样品证书和2011-01-01标签的内容CNAS-CL31:2011 内部校准要求2011-07-01 CNAS-EC-016:2009 不予受理认证机构认可2009-08-12申请和暂停、撤销认证机构认可资格有关规定的说明CNAS-EC-017:2009 认证机构认可风险分级2009-04-22管理办法CNAS-EC-021:2007 GB/T 19001-2000/ISO2007-07-25 9001:2000应⽤说明CNAS-EC-028:2009 认证机构实施依据2009-03-01 GB/T19001-2008的质量管理体系认证的认可转换说明CNAS-EC-031:2011 CNAS-CC01:2011-02-15 2011《管理体系认证机构要求》过渡转换安排的说明》CNAS-EC-033:2011 ⾷品安全管理体系认证2012-01-01机构认可说明CNAS-EC-035:2013 基于PAC-TECH-003 对2013-06-01⾷品安全管理体系认证机构的认可说明CNAS-EC-035:2014 ⾷品安全管理体系认证2015-01-01机构认可说明CNAS-EC-041:2014 ⾷品安全管理体系认证2014-07-15机构依据新版专项技术规范实施认证的认可转换说明CNAS-GC02:2014 管理体系认证结合审核的2014-10-27应⽤指南CNAS-GC11:2011 质量管理体系认证机构认2015-12-16证业务范围能⼒管理实施指南(2015年第⼆次修订)CNAS-GC12:2013 环境管理体系认证机构认2013-07-01证业务范围能⼒管理实施指南CNAS-GC13:2011 职业健康安全管理体系认2011-07-01证机构认证业务范围能⼒管理实施指南CNAS-GC18:2013 ⾷品安全管理体系认证机2013-06-01构认证业务范围管理实施指南CNAS-GC21:2013 ⼀般⼯业产品认证业务范2013/10-30围管理实施指南CNAS-GC31:2006 环境管理体系认证机构认2006-07-01证业务范围管理实施指南CNAS-GC41:2006 职业健康安全管理体系认2006-07-01证机构认证业务范围管理实施指南CNAS-GI01:2006 检查机构认可指南2007-04-30CNAS-GL02:2014 能⼒验证结果的统计处理2014-09-15和能⼒评价指南CNAS-GL03:2006 能⼒验证样品均匀性和稳CNAS-GL03:2006 能⼒验证样品均匀性和稳2006-07-01定性评价指南CNAS-GL04:2011 量值溯源要求的实施指南2011-03-15CNAS-GL05:2011 测量不确定度要求的实施2011-05-01指南CNAS-GL06:2006 化学分析中不确定度的评2006-07-01估指南CNAS-GL09:2014 实验室认可评审不符合项2014-05-20分级指南CNAS-GL12-2007 实验室和检查机构内部审核2007-04-30指南CNAS-GL13-2007 实验室和检查机构管理评审2007-04-30指南CNAS-GL-26:2014 感官检验领域实验室认可2014-07-01技术指南CNAS-GL29:2010 标准物质标准样品定值的2011-01-01⼀般原则和统计⽅法CNAS-SC16:2014 良好⽣产规范(GMP)认2015-12-16证机构认可⽅案(2015年第⼆次修订)CNAS-SC21:2014 良好农业规范(GAP)认2014-05-01证机构认可⽅案CNAS-SC22:2014 实施有机产品认证的认证2014-05-01机构认可⽅案。
体外诊断试剂校准品测量不确定度的评定

体外诊断试剂校准品测量不确定度的评定吕磊【期刊名称】《临床检验杂志》【年(卷),期】2011(029)005【总页数】2页(P331-332)【关键词】校准品;溯源;测量不确定度【作者】吕磊【作者单位】四川迈克生物科技股份有限公司参考系统部,成都611731【正文语种】中文【中图分类】O213.2测量不确定度,是表征合理地赋予被测量值的分散性的与测量结果相联系的参数。
为了表征这种分散性,测量不确定度用标准差表示。
近年来,测量不确定度的概念被引入临床检验领域。
ISO 15195文件[1]中指出,参考测量实验室应证明它们的测量结果可通过一条不间断的比较链溯源至现有的最高级别的参考物质或参考测量程序报告的每一个测量结果附有按GUM评定和表示的不确定度。
中国实验室国家认可委员会按ISO/IEC 17025《校准和检测实验室能力的通用要求》[2]对校准和检测实验室认可时,也有测量不确定度的评定要求。
作为医学检验界最高水平的室间质量评价活动——国际参考实验室室间质量评价(RELA)活动的回报结果也需附有不确定度。
GUM(JJF 1059)《不确定度的评定与表示》[3]指出:一切测量结果都不可避免地具有不确定度。
当一个测量结果用于下一个测量时,其不确定度可作为下一个测量结果不确定度的分量,即它们是可以传播的。
体外诊断试剂生产厂商生产的校准品是检验科校准检测系统、测量病人标本结果的计量学来源。
校准品的不确定度要传递给病人的检测结果,从某种意义上讲校准品赋值的可靠性决定了医院检验报告结果的准确性;而校准品的测量不确定度是衡量校准品赋值可靠性的定量指标,真实有效地评定和表示校准品测量不确定度是关系到病人检测结果准确性的关键因素之一。
根据国家标准GB/T 21415(ISO 17511)《体外诊断试剂校准品和质控品的计量学溯源》[4]规定,“制造厂商的计量学溯源责任从产品校准品的定值,到二级参考物质或二级参考测量程序”。
标准样品定值的一般原则和统计方法

GB/T15000.3/5-1994简介
GB/T15000.3-1994《标准样 GB/T15000.5-1994 《化学成分标准
品定值的一般原则和统计方法》
参照采用了ISO Guide 35:1989
的部分内容
共分5章,分别是:
1 主题内容与适用范围 2 引用标准 3 定值的一般原则 4 一个实验室试验定值 5 多个实验室协作试验定值
GB/T15000.3-2008简介
2008年3月7日发布,2008年8月1日实施。
等同采用了ISO Guide 35:2006,包括范围、规范
性引用文件、术语和定义、符号、项目设计、测量 不确定度评估、均匀性研究、稳定性研究、特性值 测定、数据及不确定度评估、证书11个章节和2个 资料性附录。 代替GB/T15000.3-1994《标准样品定值的一般原 则和统计方法》和GB/T15000.5-1994《化学成分 标准样品技术通则》。
ISO Guide 35简介
1981年ISO Committee on Reference Materials
(REMCO)会议决定制定该指南文件;
1985年发布第1版; 1989年发布第2版; 2006年发布第3版。
ISO Guide 35
1989版
2006版
1 Scope 2 Definitions 3 The role of reference materials in measurement science 4 Measurement uncertainty 5 Homogeneity of materials 6 General principles of certification 7 Certification by a definitive method 8 Certification by interlaboratory testing 9 Certification based on a metrological approach
检测实验室质量控制

对存留物品进行再检测或再校准;
分析一个物品不同特性结果的相关性。 注:选用的方法应当与所进行工作的类型和工作量相适应。
CNAS-CL01:2006《检测和校准实验室能力认可准则》
*
5.9.2 应分析质量控制的数据,当发现质量控制数据将要超出预先确定的判据时,应采取有计划的措施来纠正出现的问题,并防止报告错误的结果。
抽(采)样应确保科学、公正。所得样品应具有代表性或可获性,并保持完整。
抽(采)样应按标准规定方法进行。对于食物中毒、污染的产(商)品的采样,应注意具有可获性;对于其它产品(商品)的卫生监督或质量评估的采样,一般按标准以随机的原则进行,所取样品应对总体具有充分代表性。采样容器应符合要求(如洁净无菌等)。
CNAS-CL10:2006《检测和校准实验室能力认可准则在化学检测领域的应用说明》
5.9 检测和校准结果质量的保证 实验室应根据有证标准物质的来源情况、检测或校准的特性和范围以及实验室人员的多少来制定内部质量控制计划,该计划须包括可疑结果的判断准则。适当时,内部质量控制计划所采用的技术可包括,但不限于:
CNAS-CL10:2006《检测和校准实验室能力认可准则在化学检测领域的应用说明》
*
质量控制的分类
*
外部质量控制
内部质量控制
外部质量控制
*
02
能力验证
03
测量审核
实验室间比对
01
外部质量控制
注意: 结果的评定 常用方法: 能力验证:稳健Z比分数 测量审核:按En值评定 按临界值(CD值)评定 按专业标准方法规定评定 参考: CNAS-GL02:2006《能力验证结果的统计处理和能力评价指南》 GB/T 15483-1999《利用实验室间比对的能力验证》
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
CNAS-GL29:2010
第 1 页 共 69 页
目 次
前 言.......................................................................................................................................................... 4 引 言(ISO)........................................................................................................................................... 5 1 范围.......................................................................................................................................................... 6 2 规范性引用文件......................................................................................................................................6 3 术语和定义..............................................................................................................................................7 4 符号.......................................................................................................................................................... 8 5 定值项目设计..........................................................................................................................................9 5.1 总则...................................................................................................................................................... 9 5.2 项目定义.............................................................................................................................................. 9 5.3 运输.................................................................................................................................................... 10 5.4 原材料收集........................................................................................................................................ 10 5.5 可行性研究........................................................................................................................................ 10 5.6 要求的使用寿命和有效期................................................................................................................ 11 5.7 样品制备............................................................................................................................................ 11 5.7.1 概述................................................................................................................................................. 11 5.7.2 人工合成材料.................................................................................................................................11 5.7.3 混合................................................................................................................................................. 11 5.7.4 加料................................................................................................................................................. 12 5.7.5 均匀化与分装.................................................................................................................................12 5.8 均匀性研究........................................................................................................................................ 12 5.9 稳定性研究........................................................................................................................................ 13 5.10 测量方法选择.................................................................................................................................. 14 5.11 证书.................................................................................................................................................. 15 5.12 项目设计小结.................................................................................................................................. 15 6 测量不确定度评估............................................................................................................................... 15 6.1 CRM/RM 特性值不确定度评估基础............................................................................................... 15 6.2 批测定的基本模式............................................................................................................................ 16 6.3 不确定度来源.................................................................................................................................... 18 6.4 分布函数问题.................................................................................................................................... 18 6.5 比率的运用.....................
