2020-2021学年高三化学一轮复习知识点第11讲 铁及其重要化合物
第11讲 铁及其化合物(教师版)-2020-2021学年高一化学必修第一册同步培优精品讲义
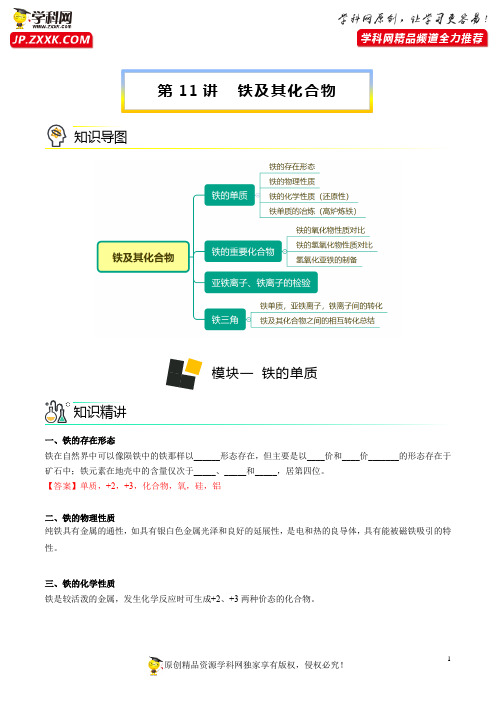
第11讲铁及其化合物知识导图模块一铁的单质知识精讲一、铁的存在形态铁在自然界中可以像陨铁中的铁那样以______形态存在,但主要是以____价和____价_______的形态存在于矿石中;铁元素在地壳中的含量仅次于_____、_____和_____,居第四位。
【答案】单质,+2,+3,化合物,氧,硅,铝二、铁的物理性质纯铁具有金属的通性,如具有银白色金属光泽和良好的延展性,是电和热的良导体,具有能被磁铁吸引的特性。
三、铁的化学性质铁是较活泼的金属,发生化学反应时可生成+2、+3两种价态的化合物。
资料卡片——生铁与纯铁的抗腐蚀性能1.Fe与非金属反应:(横线上填化学方程式)2.Fe与酸反应:(横线上填氧化产物及还原产物)3.Fe与水反应(1)反应原理:_____________________________________________。
【答案】3Fe + 4H2O(g) =====高温Fe3O4 + 4H2(2)实验装置思考与交流【答案】1.提供水蒸气;2.检验反应中生成的H2;3.铁与水反应是有条件的,铁在高温条件下与水蒸气反应,铁不与冷、热水反应,故可以用铁壶盛水。
纯铁的抗腐蚀性能比生铁好。
原因是生铁中含有碳等物质,在有电解质溶液(比如雨水等)情况下会形成原电池,铁作为负极被加速腐蚀。
1.湿棉花的作用:______________________________________________________。
2.肥皂液的作用:______________________________________________________。
3.铁与水可以发生反应,为什么还可以用铁壶来盛水呢?4.铁与盐溶液反应:(横线上填化学方程式)5.常温下,铁在浓硫酸或浓硝酸中会发生钝化。
资料卡片——钝化原理归纳总结——铁的还原性四、铁单质的冶炼(高炉炼铁)铁单质冶炼的原理就是利用还原剂将铁从矿石中还原出来。
高三化学一轮复习《铁及铁的化合物》PPT课件

4.铁遇冷浓硝酸表面钝化,可保护内部不被腐蚀
√
(2010· 北京高考T6-B)
5.钢管与铜管露天堆放在一起,钢管不易被腐蚀
×
(2010· 北京高考T6-C)
【课前热身】 1. 写出下列化学反应的方程式
(1) Fe粉与硫粉混合后共热 (2) Fe与稀硫酸反应 (3) Fe丝在Cl2中燃烧 (4) Fe与稀HNO3反应 (5) Fe与水蒸气在高温下反应
铁粉,然后过滤
D.Fe3+与KSCN溶液产生红色沉淀
三、铁的氢氧化物
化学式 色态
Fe(OH)2
白色固体
Fe(OH)3
红褐色固体
与盐酸反 应
Fe(OH)2+2H+ === Fe2++2H2O
Fe(OH)3+3H+ === Fe3++3H2O
受热
2Fe(OH)3= =△= = =
分解
Fe2O3+3H2O
4.与盐溶液的反应
(1)与CuSO4溶液:
Fe+Cu2+ ===F来自2++Cu .(2)与FeCl3溶液: Fe+2Fe3+ === 3Fe2+ .
1.能否用铁制容器盛放热的浓H2SO4? 提示:不能,铁与热浓H2SO4反应.
2.下列反应后一定有+3价铁生成的是( C )
①过量的Fe与Cl2反应 ②Fe与过量稀H2SO4反应后,再向其中
化学式 制法
Fe(OH)2
Fe(OH)3
可溶性亚铁盐与碱反应
Fe2++2OH- ===
可溶性铁盐与碱反应
Fe3++3OH- ===
Fe(OH)2↓↓
Fe(OH)3↓↓
空气中,Fe(OH)2能够非常迅速地被氧气氧化成Fe(OH)3
二者的关 ,现象是白色沉淀迅速变成 灰绿色,最后变成 红褐
高考化学一轮复习第三章金属元素及其重要化合物第11讲铁及其重要化合物学

学习资料第11讲铁及其重要化合物一、铁的存在与性质1.铁在地壳中的含量仅次于氧、硅和铝,居第错误!四位,主要以错误!+2和错误!+3价化合物的形式存在。
2.铁的物理性质颜色状态导电、导热性、延展性特性银白色固体良好被磁铁吸引(1)铁单质性质活泼,有较强的还原性。
①与非金属单质反应:Fe与S反应:错误!Fe+S错误!FeS.②与水的反应:常温下铁与水不反应,在高温条件下与水蒸气反应:错误!3Fe+4H2O(g)错误!Fe3O4+4H2。
(2)与酸的反应(3)与某些盐溶液的反应①与CuSO4溶液反应的离子方程式:错误!Fe+Cu2+===Fe2++Cu。
②与FeCl3溶液反应的离子方程式:错误!2Fe3++Fe===3Fe2+.二、铁的氧化物和氢氧化物1.铁的氧化物Fe3O4中的3个Fe原子的化合价2个为+3价,1个为+2价,可表示为FeO·Fe2O3,平均价态为+错误!价。
在发生氧化还原反应时,对应价态的铁参与相关反应,如Fe3O4与HNO3反应时只有+2价铁被氧化。
2.铁的氢氧化物1.亚铁盐含有Fe2+的溶液呈错误!浅绿色,既有氧化性,又有还原性。
(1)氧化性:Fe2+与Zn反应的离子方程式:错误!Zn+Fe2+===Fe+Zn2+。
(2)还原性①向FeCl2溶液中滴入几滴KSCN溶液,再加入氯水(或通入Cl2),若溶液变红色,证明Fe2+具有还原性。
反应原理:错误!2Fe2++Cl2===2Fe3++2Cl-。
②向少量酸性KMnO4溶液中加入FeCl2溶液,若溶液紫红色褪去,证明Fe2+具有还原性。
反应原理:错误!MnO错误!+5Fe2++8H+===5Fe3++Mn2++4H2O。
2.铁盐(1)特性:含有Fe3+的盐溶液遇到错误!SCN-时变成红色。
(2)氧化性:含Fe3+的溶液呈错误!棕黄色,Fe3+具有较强的氧化性。
①向FeCl3溶液中滴入几滴KSCN溶液,再加入过量活泼金属(如Fe),若溶液红色褪去,证明Fe3+具有氧化性。
2020-2021学年高三化学一轮复习知识点第11讲 铁及其重要化合物

第11讲铁及其重要化合物【考情分析】1.了解铁的主要性质及其应用。
了解铁的重要化合物及其应用。
2.掌握铁及其重要化合物的制备方法。
【核心素养分析】1.宏观辨识与微观探析:认识铁及其化合物的性质及应用,能以“铁三角”转化关系理解变价元素的转化条件。
2.科学态度与社会责任:利用铁及其化合物的性质,科学认识铁及其化合物的提纯和制备工艺流程,形成严谨求实的科学态度和崇尚真理的意识。
3.科学探究与创新意识:能提出有价值的氢氧化亚铁及其他铁的化合物的制备方案,并进行实验探究。
【重点知识梳理】知识点一铁及其重要化合物的性质1.铁铁位于元素周期表中第4周期Ⅷ族,是一种应用最广泛的过渡金属元素;铁元素是一种典型的变价金属元素。
(1)结构(2)铁的物理性质银白色固体,熔点较高,具有良好的导热、导电、延展性,能被磁铁吸引。
(3)铁的化学性质铁元素性质活泼,有较强的还原性,主要化合价为+2价和+3价。
①与非金属单质的反应②与水的反应常温下铁与水不反应,在高温条件下与水蒸气反应:3Fe +4H 2O(g)=====高温Fe 3O 4+4H 2。
③与酸的反应④与某些盐溶液反应Fe +Cu 2+===Fe 2++Cu 、Fe +2Fe 3+===3Fe 2+ 【归纳总结】①Fe 与Cl 2反应无论用量多少都生成FeCl 3,而Fe 与盐酸反应生成FeCl 2。
②铁在潮湿的空气中生成的铁锈的主要成分是Fe 2O 3,而铁在纯氧中燃烧的产物是Fe 3O 4。
③铁与一般氧化剂(如S 、HCl 、FeCl 3、CuSO 4、I 2等)反应时被氧化为Fe 2+,铁与强氧化剂(如Cl 2、Br 2、HNO 3、浓H 2SO 4等)反应时被氧化为Fe 3+。
④在电化学中铁作负极时电极反应式为Fe -2e -===Fe 2+。
(3)铁的冶炼冶炼原理:Fe 2O 3+3CO=====高温2Fe +3CO 2 2.铁的氧化物3.铁的氢氧化物(1)Fe(OH)2是白色絮状物,易被空气中的氧气氧化生成Fe(OH)3,颜色由白色变为灰绿色,最后变为红褐色,方程式为4Fe(OH)2+O 2+2H 2O===4Fe(OH)3。
高三化学一轮复习金属及其化合物铁及其重要化合物全解PPT学习教案

基基础础知自理识主梳梳理
典例解析方 法
考点能力突 破
(3)与酸反应
(4)与盐反应 Fe 与 CuSO4、FeCl3 溶液反应的化学方程式分别为 Fe+CuSO4 FeSO4+Cu、Fe+2FeCl3 3FeCl2。
第4页/共45页
基基础础知自理识主梳梳理
典例解析方 法
考点能力突 破
铁与其他物质反应时,何时生成+2 价铁的化合物?何时生成+3 价铁的化合物? 提示:当铁遇到氧化性较弱的氧化剂,如:S、I2、盐酸、稀硫酸、CuSO4 等时, 将生成+2 价铁的化合物;当铁遇到强氧化剂,如 Cl2、HNO3、浓硫酸等时, 将生成+3 价铁的化合物。
高三化学一轮复习金属及其化合物铁及 其重要化合物全解
会计学
1
最新考试说明要求
1
.
了解金属铁的主要性质及应用
2
.
掌握铁的重要化合物的主要性质及应
用
命题热点预测
1
.
铁及其化合物之间的转化关系
2
.Fe
3+、
Fe
2+的氧化性与还原性
3
.Fe(OH)
胶体、
Fe(OH)
3
制备实验
2
第1页/共45页
基基础础知自理识主梳梳理
已知:Ksp[Fe(OH)3]=4.0×10-38 回答下列问题:
(1)FeCl3蚀刻铜箔反应的离子方程式为 。 (2)过程Ⅰ加入铁屑的主要作用是 , 分离得到固体的主要成分是 ,从
固体中分离出铜需采用的方法是
。
(3)过程Ⅱ中发生反应的化学方程式为
。
(4)过程Ⅱ中调节溶液的pH为5,金属离子浓度为
《高三化学复习课件》铁及其化合物

①
,②加水溶解③加氯化钡溶液,
沉淀④过滤(其余步骤省略)
在在过上滤层前清,液需中要继检续验滴是加否氯沉化淀钡完溶全液,,其观操察作有是无沉淀产生
1、下列图示中能较长时间看到Fe(OH)A.2①白②③色④沉⑤淀B的.是①②(③ )。
⑤ C.①②③④ D.②③ ④⑤
B
X XYm XYn 置换 化合 化合 D
取少量溶液1于试管中,加入硫酸酸化,再加入高锰 酸钾溶液,溶液颜色从紫色变为棕黄色,则含有Fe2+
例:某研究性学习小组进行H2还原Fe2O3的实验,加热少许时间便停 止加热,冷却,请回答:
猜想硬质玻璃管内的固体可能有哪些?
该小组利用硬质玻璃管中的混合物设计如下方案制备FeCl3溶液,
该小组又对硬质玻璃管中的混合物进行实验和探究,实验证明该混合 物具有铁磁性,假设该混合物没有正三价铁元素,请你设计实验验证 产物中是否有FeO,(限选试剂:浓硫酸、1.0mol/LHNO3、 1.0mol/L盐酸、1.0mol/LNaOH、3%H2O2、0.1mol/LKI、 0.1mol/LCuSO4、20%KSCN、澄清石灰水、氧化铜、蒸馏水)
实验,加热
时间便停止加热,
冷却,请回答:
猜想硬质玻璃管内的固体可能有哪些?
例:某研究性学习小组进行H2还原Fe2O3的实验,加热少许时间 便停止加热,冷却,请回答:
㈠猜想硬质玻璃管内的固体可能有哪些?
㈡该小组利用硬质玻璃管中的混合物设计如下方案制备FeCl3溶
液,
足量H2SO4
A
混合物
溶液1
FeCl3溶液
D.XYm与XYn的相互转化是可逆反应
元素X的单质及X与Y形成的化合物能按下 图所示的关系发生转化:下列说法不正 确的是( )
高考化学一轮复习第3章金属及其重要化合物第11讲镁铝铜及其重要化合物金属冶炼训练含解析新人教版

高考化学一轮复习:第11讲镁、铝、铜及其重要化合物金属冶炼一、选择题1.(2021·北京西城区高三测试)我国出土的文物呈现了瑰丽的历史文化。
下列文物中,主要成分属于合金的是( )A.西夏佛经纸本B.西汉素纱禅衣C.唐兽首玛瑙杯D.东汉青铜奔马解析:选D A项错误;西汉素纱禅衣是丝绸的一种,主要成分不属于合金,故B项错误;唐兽首玛瑙杯的主要成分是二氧化硅,不属于合金,故C项错误;东汉青铜奔马是铜合金,主要成分属于合金,故D项正确。
2.中华人民共和国勋章使用铜胎镀金材质,主要元素为国徽、五角星、中国结、如意、兰花等,主色调为红色和金色。
下列关于金属材料的说法正确的是( ) A.铁是人类在生产、生活中最早使用的金属材料B.金、银、铜是应用最广泛的金属材料C.钛被誉为“21世纪的金属”,应用前景很广阔D.铜是导电性、导热性最好的有色金属解析:选C。
铜是人类最早使用的金属材料,A错;铁、铝及其合金是应用最广泛的金属材料,B错;银的导电性比铜好,D错。
3.下列关于铝及其化合物的说法不正确的是( )A.Al既可用于食品包装,也可用作建筑材料B.Al2O3既可用来冶炼金属Al,也可用作耐火材料C.明矾[KAl(SO4)2·12H2O]既可用作净水剂,也可用作消毒剂D.Al(OH)3既可用作治疗胃酸过多的药物,也可用来制备一些铝盐解析:选C。
A项,金属铝具有良好的延展性,因此铝可以制成铝箔用于食品包装,金属铝也可用作建筑材料,如铝合金门窗等,正确;B项,电解熔融的Al2O3可冶炼金属Al,由于Al 2O 3具有耐高温的性质,也可用作耐火材料,正确;C 项,明矾[KAl(SO 4)2·12H 2O]溶于水后,Al 3+能发生水解反应,生成的Al(OH)3胶体具有吸附作用,可用作净水剂,但 Al(OH)3 并不具有消毒作用,错误;D 项,Al(OH)3与胃酸中的盐酸反应生成氯化铝和水,正确。
2024届高三化学高考备考一轮复习专题:铁及其重要化合物

4.以黄铁矿(主要成分是FeS2,含少量SiO2)和软锰矿(主要成分是 MnO2,含少量Fe2O3、Al2O3)为原料制备MnSO4·H2O的工艺流程如下。下 列说法错误的是( C )
A.金属Fe具有导热性,可用于制造炊具 B.纳米Fe3O4颗粒呈黑色,可用作磁性材料 C.Fe(OH)3胶体具有吸附性,可用作净水剂 D.FeCl3溶液具有氧化性,可用于蚀刻铜制品
3.用FeSO4溶液与不含O2的蒸馏水配制的NaOH溶液反应制备Fe(OH)2。
(1)用硫酸亚铁晶体配制上述FeSO4溶液时还需要加入
Fe(OH)3
可溶性亚铁盐与碱溶液反 应: Fe2++2OH- Fe (OH)2↓
可溶性铁盐与碱溶液反应: Fe3+
+3OH-
Fe(OH)3↓
在3成,空现红气象褐中是,色F白e,(反O色H应絮)的状2能化沉够学淀非方迅常程速迅式变速为成地被4灰F氧e绿(气O氧H色化),成2+最FO后e(2变+OH) 2H2O 4Fe(OH)3
1.下列有关铁及其化合物的说法中不正确的是( D )
A.工业上在高温下用CO还原含Fe2O3的铁矿石炼铁 B.铁在纯氧中燃烧或高温下和水蒸气反应均能得到Fe3O4 C.工业上可用铁制容器储存、运输浓硝酸、浓硫酸 D.氯化铁溶液有较强氧化性,故可用作净水剂
2.下列铁及其化合物的性质与用途不具有对应关系的是( B )
(3)KMnO4的性质
热稳定性差,通常保存在棕色试剂瓶中:4KMnO4+2H2O
4MnO2↓+
3O2↑+4KOH。
①在酸性介质中,MnO4−具有强氧化性,可以氧化Fe2+、Cl-、H2C2O4、H2O2
等,本身被还原为Mn2+。
如:MnO4−+5Fe2++8H+ Mn2++5Fe3++4H2O。 ②在碱性、中性或微弱酸性溶液中,MnO4−仍旧是氧化剂,本身被还原为MnO2。 2MnO4−+I-+H2O 2MnO2↓+IO3−+2OH-。 ③在强碱性溶液中,当MnO4−过量时,还原产物是MnO42−,2MnO4−+SO32−+ 2OH- 2MnO42−+SO42−+H2O。
高考一轮复习必修124铁及其重要化合物共77页文档

2.(2009年江门质检)某学生设计了如图所示的方法,鉴 定盐A的组成成分。由此分析,下列结论中正确的是( )
解析:A 中加入适量硝酸酸化的 AgNO3溶液后产生浅黄色沉淀 B, 说明 A 中含 Br-,C 溶液中加入 KSCN 溶液后生成血红色溶液 D,说 明 C 中一定有 Fe3+,由于 A 中加入了 HNO3,因此无法确定 A 中是 否含有 Fe3+,A 可能是 FeBr3,可能是 FeBr2,也可能是 FeBr3 和 FeBr2 的混合物,只有 B 正确。
欲证明某溶液中不含 Fe3+可能含有 Fe2+,进行如下实验操作时最
佳顺序为( )
①加入少量氯水 ②加入少量 KMnO4 溶液 ③加入少量 KSCN 溶液
A.①③
B.③②
C.③①
D.①②③
【解析】 Fe3+与 KSCN 溶液反应变血红色,Fe2+与 KSCN 溶液不反应,但加入氧化剂后 Fe2+被氧化成 Fe3+,使 KSCN 变血 红色。所以应先加入 KSCN 溶液,如果溶液不变色,再加入氯水, 溶液变成血红色,则可证明溶液中不含 Fe3+含有 Fe2+。
二、铁的氧化物
“铁三角”及其重要应用
2.转化中的主要化学反应 (1)常见 Fe2+转化成 Fe3+的离子方程式: 2Fe2++Cl2(Br2)===2Fe3++2Cl-(Br-) 4Fe2++4H++O2===4Fe3++2H2O 3Fe2++4H++NO- 3 ===3Fe3++NO↑+2H2O 2Fe2++H2O2+2H+===2Fe3++2H2O 5Fe2++8H++MnO- 4 ===5Fe3++Mn2++4H2O (2)常见 Fe3+转化成 Fe2+的离子方程式: 2Fe3++Cu===2Fe2++Cu2+ 2Fe3++Fe===3Fe2+ 2Fe3++2I-===2Fe2++I2 2Fe3++S2-===2Fe2++S↓ 或 2Fe3++H2S===2Fe2++S↓+2H+ 2Fe3++SO2+2H2O===2Fe2++SO24-+4H+ (3)Fe2+、Fe3+转化成单质铁:
2020-2021 年新高三化学一轮复习讲解《铁及其化合物》

2020-2021 年新高三化学一轮复习讲解《铁及其化合物》【知识梳理】一、铁铁位于第四周期第Ⅷ族,原子结构示意图为: 。
铁是地壳中最丰富的元素之一, 含量为 4.75%,在金属中仅次于铝。
铁分布很广,能稳定地与其他元素结合,常以氧化物 的形式存在,有赤铁矿(主要成分是 Fe 2O 3)、磁铁矿(主要成分是 Fe 3O 4)、褐铁矿(主要成分是 Fe 2O 3·3H 2O )、菱铁矿(主要成分是 FeCO 3)、黄铁矿(主要成分是FeS 2)、钛铁矿(主要成分是FeTiO 3)等。
土壤中也含铁 1%~6%。
铁是具有银白色金属光泽的过度元素,密度大,熔沸点高,延展性、导电性和导热性较好,能被磁铁吸引。
铁是较活泼的金属,铁原子的最外层电子数为 2 个,可失去 2 个或 3 个电子而显+2 价或+3 价,但+3 价的化合物较稳定。
1. 与非金属反应:3Fe + 2O 2Fe 3O 42Fe + 3C122FeCl 3Fe + SFeS温馨提示:铁丝在氯气中燃烧时,生成棕黄色的烟,加水振荡后,溶液显黄色;不论铁的量多少,与氯气反应产物都是氯化铁;铁跟氯气、硫反应时,分别生成+2 价和+3 价的铁,说明氧化性:氯气>硫。
2. 与酸反应:(1) 与非氧化性酸(如稀盐酸、稀H 2SO 4 等)的反应: Fe + 2H += Fe 2++ H 2↑(2) 常温下,铁遇浓硫酸、浓硝酸发生钝化。
所以可用铁制容器盛装浓硫酸或浓硝酸。
(3) 加热时,铁与热浓硫酸、浓硝酸反应:2Fe +6H 2SO 4(浓)Fe 2(SO 4)3+3SO 2↑+6H 2O(4) 铁与稀硝酸反应不产生 H 2。
当 HNO 3 过量时,铁元素的存在形式为 Fe 3+。
反应原理:Fe +4HNO 3===Fe(NO 3)3+NO↑+2H 2O ,当 Fe 过量时,铁元素的存在形式为 Fe 2+。
反应原理:3Fe +8HNO 3===3Fe(NO 3)2+2NO↑+4H 2O ,当1< n Fe <3时:铁元素的存在形式4 n HNO 3 8 为 Fe 2+和 Fe 3+。
2023届高考化学一轮复习:《第11讲 铁及其重要化合物》课件

思维导图
名师备考建议
“思维方法”是思维的品质、方式和能力的综合,是个体高质量地解决生 活实践或学习探索情境中的各种问题的基础。含铁化合物的制备及性质探 究体现《中国高考评价体系》中学科素养“思维方法”涉及的“科学思 维”、“创新思维”,要求采用严谨求真的、实证性的逻辑思维方式应对 各种问题,要求运用开放性、创新性的思维方式应对问题情境,组织相关 的知识与能力,注重独立性、批判性、发散性的思考,提出新视角、新观 点、新方法、新设想,设计含铁化合物的制备实验方案,并解决物质制备 及性质探究过程中出现的各种问题。
2. (2022年6月浙江卷)下列物质属于强电解质的是
A. HCOOH
B. Fe
√C. Na2CO3
D. C2H2
解析:A.HCOOH是弱酸,在水溶液中只能部分电离,属于弱电解质,A不合 题意; B.Fe是单质,不是电解质,B不合题意; C.Na2CO3是盐,在水溶液中能够完全电离,故属于强电解质,C符合题意; D.C2H2是有机物,在水溶液和熔融状态下均不导电,属于非电解质,D不合题 意;
真题再现·辨明考向
1. (2022年1月浙江选考)下列说法正确的是 A. 铁与碘反应易生成碘化铁
√B. 电解ZnSO4溶液可以得到Zn
C. 用石灰沉淀富镁海水中的Mg2+,生成碳酸镁 D. SO2通入BaCl2溶液中生成BaSO3沉淀 解析:I2属于弱氧化剂,与Fe反应生成FeI2,A错误;电解一定浓度的硫酸锌溶 液,Zn2+在阴极得电子析出Zn,B正确;石灰沉淀Mg2+生成的沉淀是Mg(OH)2, C错误;SO2通入BaCl2溶液中不能生成BaSO3沉淀,因为H2SO3酸性比HCl弱, 该复分解反应不能发生,D错误;
通常元素化合物知识分散在高考题的不同题型中:在选择题中,一般直接 考查金属元素及其化合物的基本性质和应用。在填空题中一般有两种考查 方式:一是直接考查元素及其化合物的性质,通常以化学式的书写、化学 方程式的书写、微粒的检验和鉴别等形式出现;二是与基本概念和基本理 论结合考查,如与氧化还原反应、电化学、物质在水溶液中的行为、实验、 计算等综合考查,对于铁及其化合物的复习备考,提醒各位注意以下三点:
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
2020-2021学年高三化学一轮复习第11讲铁及其重要化合物【考情分析】1.了解铁的主要性质及其应用。
了解铁的重要化合物及其应用。
2.掌握铁及其重要化合物的制备方法。
【核心素养分析】1.宏观辨识与微观探析:认识铁及其化合物的性质及应用,能以“铁三角”转化关系理解变价元素的转化条件。
2.科学态度与社会责任:利用铁及其化合物的性质,科学认识铁及其化合物的提纯和制备工艺流程,形成严谨求实的科学态度和崇尚真理的意识。
3.科学探究与创新意识:能提出有价值的氢氧化亚铁及其他铁的化合物的制备方案,并进行实验探究。
【重点知识梳理】知识点一铁及其重要化合物的性质1.铁铁位于元素周期表中第4周期Ⅷ族,是一种应用最广泛的过渡金属元素;铁元素是一种典型的变价金属元素。
(1)结构(2)铁的物理性质银白色固体,熔点较高,具有良好的导热、导电、延展性,能被磁铁吸引。
(3)铁的化学性质铁元素性质活泼,有较强的还原性,主要化合价为+2价和+3价。
第 1 页共20 页第 2 页 共 20 页①与非金属单质的反应②与水的反应常温下铁与水不反应,在高温条件下与水蒸气反应:3Fe +4H 2O(g)=====高温Fe 3O 4+4H 2。
③与酸的反应④与某些盐溶液反应Fe +Cu 2+===Fe 2++Cu 、Fe +2Fe 3+===3Fe 2+ 【归纳总结】①Fe 与Cl 2反应无论用量多少都生成FeCl 3,而Fe 与盐酸反应生成FeCl 2。
②铁在潮湿的空气中生成的铁锈的主要成分是Fe 2O 3,而铁在纯氧中燃烧的产物是Fe 3O 4。
第 3 页 共 20 页③铁与一般氧化剂(如S 、HCl 、FeCl 3、CuSO 4、I 2等)反应时被氧化为Fe 2+,铁与强氧化剂(如Cl 2、Br 2、HNO 3、浓H 2SO 4等)反应时被氧化为Fe 3+。
④在电化学中铁作负极时电极反应式为Fe -2e -===Fe 2+。
(3)铁的冶炼冶炼原理:Fe 2O 3+3CO=====高温2Fe +3CO 2 2.铁的氧化物3.铁的氢氧化物(1)Fe(OH)2是白色絮状物,易被空气中的氧气氧化生成Fe(OH)3,颜色由白色变为灰绿色,最后变为红褐色,方程式为4Fe(OH)2+O 2+2H 2O===4Fe(OH)3。
(2)Fe(OH)3是红褐色、难溶于水的固体,在空气中久置会部分失水生成铁锈(Fe 2O 3·x H 2O),受热易分解,方程式为2Fe(OH)3=====△Fe 2O 3+3H 2O ;制取Fe(OH)3用可溶性铁盐与碱反应,离子方程式:Fe 3++3OH -===Fe(OH)3↓。
4.亚铁盐(1)Fe 2+的氧化性和还原性含有Fe 2+的溶液呈浅绿色,Fe 2+处于铁的中间价态,既有氧化性,又有还原性,其中以还原性为主,如:遇Br 2、Cl 2、H 2O 2、NO -3(H +)等均表现为还原性。
Fe 2+的酸性溶液与H 2O 2反应的离子方程式:2Fe 2++H 2O 2+2H +===2Fe 3++2H 2O 。
(2)可水解第 4 页 共 20 页Fe(OH)2是弱碱,含Fe 2+的盐(如硫酸亚铁)溶液呈酸性。
配制硫酸亚铁溶液时常加少量硫酸抑制Fe 2+的水解,加少量铁屑防止Fe 2+被氧化。
5.铁盐的性质及应用(1)氧化性:含有Fe 3+的溶液呈棕黄色,Fe 3+处于铁的高价态,遇Fe 、Cu 、HI 、H 2S 等均表现为氧化性。
①Fe 3+与S 2-、I -、HS -、SO 2-3等具有较强还原性的离子不能大量共存。
②Fe 3+可腐蚀印刷电路板上的铜箔,反应的离子方程式为2Fe 3++Cu===Cu 2++2Fe 2+。
(2)易水解:Fe(OH)3是很弱的碱,且溶度积很小,因而Fe 3+极易水解,只能存在于酸性较强的溶液中。
①利用Fe 3+易水解的性质,实验室可用FeCl 3滴入沸水中制取氢氧化铁胶体,反应的化学方程式:FeCl 3+3H 2O=====△Fe(OH)3(胶体)+3HCl 。
②利用Fe 3+易水解的性质,工业上常用调节pH 方法除去溶液中的铁离子。
③利用Fe 3+易水解的性质,实验室配制氯化铁溶液,通常将氯化铁固体先溶于较浓的盐酸中,然后再稀释至所需浓度。
④Fe 3+与HCO -3、[Al(OH)4]-、CO 2-3、ClO -等水解呈碱性的离子不能大量共存。
知识点二 Fe 2+和Fe 3+的检验 1.亚铁盐(1)Fe 2+的氧化性和还原性含有Fe 2+的溶液呈浅绿色,Fe 2+处于铁的中间价态,既有氧化性,又有还原性,其中以还原性为主,如遇Br 2、Cl 2、H 2O 2、NO -3(H +)、MnO -4(H +)等均表现为还原性。
Fe 2+的酸性溶液与H 2O 2反应的离子方程式:2Fe 2++2H ++H 2O 2===2Fe 3++2H 2O向FeCl 2溶液中滴加酸性KMnO 4溶液,溶液褪色。
反应的离子方程式:MnO -4+5Fe 2++8H +===5Fe 3++Mn 2++4H 2O 。
(2)可水解Fe 2+的盐(如硫酸亚铁)溶液因水解呈酸性。
2.铁盐第 5 页 共 20 页(1)氧化性:含有Fe 3+的溶液呈黄色,Fe 3+处于铁的高价态,遇Fe 、Cu 、HI 、H 2S 等均表现为氧化性。
如用FeCl 3溶液腐蚀印刷电路板上的铜箔,反应的离子方程式2Fe 3++Cu===2Fe 3++Cu 2+。
(2)易水解:Fe 3+极易水解,只能存在于酸性较强的溶液中。
3.Fe 2+、Fe 3+的检验方法 (1)Fe 2+的检验 样品溶液―――――――――→加入K 3[Fe CN 6]溶液生成蓝色沉淀,证明含有Fe 2+(2)Fe 3+的检验 (3)混合溶液中Fe 3+、Fe 2+的检验 ①Fe 3+的检验 a.混合溶液――→滴加KSCN 溶液溶液变血红色,说明含有Fe 3+ b.混合溶液――→淀粉/KI 试纸试纸变蓝色,说明含有Fe 3+②Fe 2+的检验a.混合溶液――→滴加酸性KMnO 4溶液KMnO 4溶液褪色,说明含有Fe 2+b.混合溶液――→滴加溴水溴水褪色,说明含有Fe 2+ c.混合溶液――→滴加K 3[Fe (CN )6]溶液生成蓝色沉淀,说明含有Fe 2+4.亚铁盐、铁盐性质应用 (1)盐溶液的配制与保存第 6 页 共 20 页(2)物质的制备(3)判断离子能否共存 Fe 2+不共存NO -3(H +)、ClO -、MnO -4(H +) Fe 3+不共存S 2-、I -、SO 2-3Fe 3+不共存HCO -3、CO 2-3等水解相互促进的离子 【典型题分析】高频考点一 铁及其化合物的性质例1.(高考组合题)下列有关物质性质的叙述错误的是( ) A. (2018·江苏卷) 向FeCl 2溶液中滴加NH 4SCN 溶液,溶液不显红色 B .(2019·天津卷)将废铁屑加入FeCl 2溶液中,可用于除去工业废气中的Cl 2 C .(2010·江苏卷)室温下,Fe 与浓H 2SO 4反应生成FeSO 4D. (2018·江苏卷)Cu 与FeCl 3溶液反应可生成CuCl 2 【答案】C【解析】FeCl 2溶液中含Fe 2+,NH 4SCN 用于检验Fe 3+,向FeCl 2溶液中滴加NH 4SCN 溶液,溶液不会显红色,A 正确;铁和亚铁能将氯气还原为氯离子,从而除去工业废气中的氯气,B 正确;室温下,铁在浓硫酸中发生钝化,C 错误; Cu 与FeCl 3溶液反应生成CuCl 2和FeCl 2,反应的化学方程式为Cu+2FeCl 3=CuCl 2+2FeCl 2,D 正确。
第 7 页 共 20 页【变式探究】(高考组合题)下列观点的叙述正确的是( ) A.(2017·江苏卷)无色透明的溶液中:Fe 3+、Mg 2+、SCN –、Cl – B.(2017·江苏卷)Fe FeCl 2Fe(OH)2C.(2018·江苏卷)D.(2017·新课标II 卷)向2 mL 0.1 mol·L-1的FeCl 3溶液中加足量铁粉,振荡,加1滴KSCN 溶液,黄色逐渐消失,加KSCN 溶液颜色不变,说明还原性:Fe>Fe 2+【解析】Fe 3+和SCN −会发生反应生成血红色的配合物,A 错误;铁与氯气反应只能生成氯化铁,B 错误;Al 与Fe 2O 3高温发生铝热反应生成Al 2O 3和Fe ,Fe 与HCl 反应生成FeCl 2和H 2,第二步反应不能实现,C 错误;加入过量的铁粉,黄色消失,加入KSCN 溶液,溶液不变色,说明Fe 3+完全被消耗,即Fe +2Fe 3+=3Fe 2+,根据氧化还原反应规律,还原剂的还原性大于还原产物得还原性,Fe 元素化合价升高,Fe 为还原剂,Fe 2+即使还原产物又是氧化产物,因此还原性Fe>Fe 2+,D 正确。
【答案】D高频考点二 铁及其化合物的计算例2.(2020·陕西咸阳一中调研)有一块铁的氧化物样品,用140mL5.0mol·L-1盐酸恰好将其完全溶解,所得溶液还能吸收0.025molCl 2,恰好使其中的Fe 2+全部转变为Fe 3+,则该样品可能的化学式为( )A .Fe 2O 3B .Fe 3O 4C .Fe 4O 5D .Fe 5O 7 【答案】D【解析】根据2Fe 2++Cl 2===2Fe 3++2Cl -可知,铁的氧化物样品用盐酸溶解后所得溶液中n (Fe 2+)=0.025mol×2=0.05mol ,根据电荷守恒得2n (Fe 2+)+3n (Fe 3+)=n (Cl -),则n (Fe 3+)=0.2mol ,故n (Fe 2+)∶n (Fe 3+)=0.05∶0.2=1∶4,故该氧化物可表示为FeO·2Fe 2O 3,即Fe 5O 7。
【方法技巧】确定铁的氧化物组成的基本方法 设铁的氧化物中铁元素与氧元素的质量比为m ∶n ,2Cl−−−→点燃NaOH(aq)−−−−−→第 8 页 共 20 页则氧化物中n (Fe)∶n (O)=m 56∶n16=a ∶b , 若a ∶b =1∶1,则铁的氧化物为FeO ; 若a ∶b =2∶3,则铁的氧化物为Fe 2O 3;若a ∶b =3∶4,则铁的氧化物为Fe 3O 4或FeO 与Fe 2O 3按物质的量之比为1∶1的混合物或FeO 、Fe 2O 3、Fe 3O 4的混合物(其中FeO 、Fe 2O 3的物质的量之比为1∶1,Fe 3O 4为任意值)。
