最新山东省泰安市胖城一中高二化学课件 第3节 分子晶体PPT课件
合集下载
2013年山东省泰安市鲁科版选修3高二化学课件第3章第3节分子晶体

2. 据报道,科学家用一束激光将置于铁室中石 墨靶上的碳原子炸松,与此同时用一个射频 点火花喷射氮气,此时碳、氮原子结合成 碳化物的薄膜。据称,这种化合物比金刚 石更坚硬,其原因可能是( A)
A.碳、氮原子构成空间网状结构的原子晶体 B.碳氮键比金刚石中的碳碳键更长 C.碳、氮都是非金属元素,且位于同一周期 D.碳、氮的单质的化学性质均不活泼
一、分子晶体
干冰
冰
硫磺 冰糖
自主学习
一、分子晶体
1.概念 分子间通
过
分子间作用力
_______________
结
合
而成的晶体。
2.结构特点
由于分子间作用力不具有________, 所方以向分性子晶体在堆积排列时尽可能
的利用空间采取紧密堆积的方式。
3.物理性质
(1)分子晶体由于以比较弱的分子间作用力相结合,
__________以及大多数____________形成的晶体
大氢都属化于物分子晶二体氧。化碳
有机化合物
几种典型的分子晶体比较
单质碘
干冰
冰
晶胞或结 构模型
微粒间作 用力
晶胞微粒 数
配位数
范德华力 4
范德华力 4 12
范德华力和氢 键
4
结密思论堆考积:只:型存,一在个范分德子华周力围的紧分邻子晶12体,个结分构子呈.
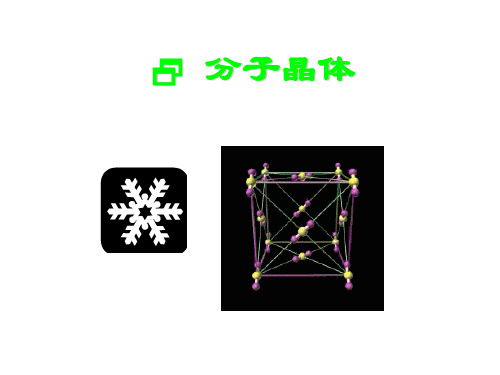
3. 在干冰晶体中,平均每个晶胞(如图)占 有CO2分子的个数为____4,每个CO2分子周 围有_____个12与之紧邻且等距的CO2分子.
物质熔沸点比较
离子晶体(晶格能) 金属晶体(金属键)
二、石墨晶体 1.结构特点 石墨晶体是层状结构,在每一层内,碳原子排列 成____平__面__正__六__边__形,一个个六边形排列成平面的 网状结构,每一个碳原子都跟其他____________ 相结合三。个在碳同原一子个层内,相邻的碳原子以共价键 相结合,层与层之间以_____________相结合(如 图)。 范德华力
分子晶体和原子晶体分子晶体课件人教版高中化学选修三

a.分子间作用力越__大__,物质的熔、沸点越__高__; 具有氢键的分子晶体熔、沸点反常地_高___。如 Hb.2组O成__>和__结H2构Te相__似>__的H2分Se子__晶>__体H,2S。相对分子质量越_大__ ,熔、沸点越_高__,如 SnH4__>__GeH4__>__SiH4__>__CH4。 c.组成和结构不相似的物质(相对分子质量接近),分 子的极性越大,其熔、沸点越高,如CO>N2, CH3OH>CH3CH3。 d.同分异构体,支链越多,熔、沸点越低。
例外:金刚石、晶体硅、晶体硼、石墨等 (3)部分非金属氧化物:CO2,NO2,P4O6, P4O10
例外:二氧化硅等 (4)几乎所有的酸:H2SO4,HNO3,H3PO4 (5)绝大多数有机物:乙醇,冰醋酸,蔗糖
3 . 2 . 1 分子晶体和原子晶体 分子晶体 课件 人教版高中化学选修三
3 . 2 . 1 分子晶体和原子晶体 分子晶体 课件 人教版高中化学选修三
一、分子晶体 4.分子晶体的结构特征
大多数分子晶体的结构子晶体和原子晶体 分子晶体 课件 人教版高中化学选修三
氧(O2)的晶体结构
C60的晶胞
3 . 2 . 1 分子晶体和原子晶体 分子晶体 课件 人教版高中化学选修三
分子的密堆积 (1)干冰
1.一个干冰晶胞中平均有几个 CO2分子?
思考 分子晶体的物理性质是由什么决定的?如何 比较分子晶体熔、沸点的高低? 分子晶体是通过分子间相互作用力构成的,晶体 在熔化时,破坏的只是分子间作用力,一般不需要 破坏分子内的化学键,所以只需要外界提供较少的 能量。因此,分子晶体的熔点通常较低,硬度也较 小,有较强的挥发性。当然,分子间作用力越强, 分子晶体的熔、沸点越高,硬度越大。
例外:金刚石、晶体硅、晶体硼、石墨等 (3)部分非金属氧化物:CO2,NO2,P4O6, P4O10
例外:二氧化硅等 (4)几乎所有的酸:H2SO4,HNO3,H3PO4 (5)绝大多数有机物:乙醇,冰醋酸,蔗糖
3 . 2 . 1 分子晶体和原子晶体 分子晶体 课件 人教版高中化学选修三
3 . 2 . 1 分子晶体和原子晶体 分子晶体 课件 人教版高中化学选修三
一、分子晶体 4.分子晶体的结构特征
大多数分子晶体的结构子晶体和原子晶体 分子晶体 课件 人教版高中化学选修三
氧(O2)的晶体结构
C60的晶胞
3 . 2 . 1 分子晶体和原子晶体 分子晶体 课件 人教版高中化学选修三
分子的密堆积 (1)干冰
1.一个干冰晶胞中平均有几个 CO2分子?
思考 分子晶体的物理性质是由什么决定的?如何 比较分子晶体熔、沸点的高低? 分子晶体是通过分子间相互作用力构成的,晶体 在熔化时,破坏的只是分子间作用力,一般不需要 破坏分子内的化学键,所以只需要外界提供较少的 能量。因此,分子晶体的熔点通常较低,硬度也较 小,有较强的挥发性。当然,分子间作用力越强, 分子晶体的熔、沸点越高,硬度越大。
鲁科版高二化学选修三3.3原子晶体与分子晶体课件(29张)
思考:a克金刚石含共价键的数目?
N(c)=(a/12)NA N(共价键)=2(a/12)NA
二氧化硅SiO2
(1)结构:正四面体空间网状结构的原子晶体。 1个Si原子同4 个O原子形成共价键, 1个O原子同2个Si原子形成共价键。 1mol SiO2晶体中约含4NA个Si—O 共价键。构成一个最小的环需要12个 原子,o-si-o键109.5o :H2O,H2S,NH3,CH4,H –酸:H2SO4,HNO3,H3PO4 –部分非金属单质:X2,O2,H2, S8,P4, C –部分非金属氧化物: CO2, SO2, NO2,
P4O6, P4O10 –大多数有机物:乙醇,冰醋酸,蔗糖
• 分子晶体结构特征
只有范德华力,无分子间氢键——分子密堆积
分子的非密堆积
氢键具有方向性
冰中1个水分子周围有4个水分子
冰的结构
思考与交流
• CO2和SiO2的一些物理性质如下表所示,通过 比较试判断SiO2晶体是否属于分子晶体。
• 碳元素和硅元素处于元素周期表中同一主族, 为什么CO2晶体的熔、沸点很低,而SiO2晶体 的熔沸点很高?
2 原子晶体
二.原子晶体(共价晶体)
共价键键能越大,键长越短,(原子半径) 熔沸点越高 (C > SiO2 > SiC > Si);
(2)离子晶体的决定因素: 离子键的强弱:比较离子半径,离子电荷;
(3)金属晶体: 金属键的强弱,比较金属离子的半径及 金属阳离子的电荷数。
(4)分子晶体的决定因素:范氏力,结 构组成相似时比较相对分子质量;分子 量相同,比较分子的极性(CO > N2) 和分子的结构(正戊烷>异戊烷>新戊 烷;邻二甲苯>间二甲苯>对二甲苯)
点、导电性等)
1.
N(c)=(a/12)NA N(共价键)=2(a/12)NA
二氧化硅SiO2
(1)结构:正四面体空间网状结构的原子晶体。 1个Si原子同4 个O原子形成共价键, 1个O原子同2个Si原子形成共价键。 1mol SiO2晶体中约含4NA个Si—O 共价键。构成一个最小的环需要12个 原子,o-si-o键109.5o :H2O,H2S,NH3,CH4,H –酸:H2SO4,HNO3,H3PO4 –部分非金属单质:X2,O2,H2, S8,P4, C –部分非金属氧化物: CO2, SO2, NO2,
P4O6, P4O10 –大多数有机物:乙醇,冰醋酸,蔗糖
• 分子晶体结构特征
只有范德华力,无分子间氢键——分子密堆积
分子的非密堆积
氢键具有方向性
冰中1个水分子周围有4个水分子
冰的结构
思考与交流
• CO2和SiO2的一些物理性质如下表所示,通过 比较试判断SiO2晶体是否属于分子晶体。
• 碳元素和硅元素处于元素周期表中同一主族, 为什么CO2晶体的熔、沸点很低,而SiO2晶体 的熔沸点很高?
2 原子晶体
二.原子晶体(共价晶体)
共价键键能越大,键长越短,(原子半径) 熔沸点越高 (C > SiO2 > SiC > Si);
(2)离子晶体的决定因素: 离子键的强弱:比较离子半径,离子电荷;
(3)金属晶体: 金属键的强弱,比较金属离子的半径及 金属阳离子的电荷数。
(4)分子晶体的决定因素:范氏力,结 构组成相似时比较相对分子质量;分子 量相同,比较分子的极性(CO > N2) 和分子的结构(正戊烷>异戊烷>新戊 烷;邻二甲苯>间二甲苯>对二甲苯)
点、导电性等)
1.
高中化学 3.3原子晶体与分子晶体课件 鲁科版选修3(共41张PPT)

等。
6.分子晶体的结构特征 (1)如果分子间作用力只是范德华力 分子密堆积,即以一个分子为中心,其周围通常可以有 _1_2_个紧邻的分子。 (2)分子间还有其他作用力 水分子之间的主要作用力是_氢__键__,在冰的晶体中每个水 分子周围只有__4_个紧邻的水分子。
7.(1)每个CO2分子周围离该分子最近且距离相等的CO2有 _1_2_个。 (2)每个晶胞中有_1_2_个原子(4个CO2分子)。
第三节 原子晶体与分子晶体
1.了解金刚石和干冰的宏观性质及其区别,理解原子晶体和 分子晶体的空间结构特点及微粒的堆积方式,认识原子晶 体和分子晶体的区别。
2.学会运用模型方法和类比方法,掌握区分不同类型晶体的 方法。
1.共价键是指成键原子之间靠_共__用__电__子__对__形成的化学键; 按原子轨道重叠方式分为__σ___键和___π__键;按_共__用__ _电__子__对__在成键原子之间的位置,分为极性键和_非__极__性___ 键。
4.原子晶体的物理性质 (1)原子晶体中,各原子间均以共价键相结合,原子晶体 熔化时必须破坏其中的共价键,而共价键的键能相对较大, 破坏它需要很高的温度,所以熔点都很高。对结构相似的 原子晶体,原子半径越小,键长越短,键能越大,晶体的 熔点越高。 (2)硬度大,不导电,难溶于一般溶剂。
5.典型的原子晶体 (1)金刚石晶体:在金刚石晶体中,每个碳原子被周围_4__ 个碳原子包围,以共价键跟__4_个碳原子结合形成_4_个__共___ _价__单__键__,其C—C—C夹角为_1_0_9_._5_°_,每个碳原子都采取 _s_p_3_杂化。
原子个数比为 1∶4×12=1∶2。故
SiO2 晶体中并不存在单个的 SiO2 分子,而是由 Si 原子和 O 原子按 1∶2 的比例所组成的立体网状的晶体。在 SiO2 晶体中,最小的环为由 6 个 Si 原子和 6 个 O 原子组成的
6.分子晶体的结构特征 (1)如果分子间作用力只是范德华力 分子密堆积,即以一个分子为中心,其周围通常可以有 _1_2_个紧邻的分子。 (2)分子间还有其他作用力 水分子之间的主要作用力是_氢__键__,在冰的晶体中每个水 分子周围只有__4_个紧邻的水分子。
7.(1)每个CO2分子周围离该分子最近且距离相等的CO2有 _1_2_个。 (2)每个晶胞中有_1_2_个原子(4个CO2分子)。
第三节 原子晶体与分子晶体
1.了解金刚石和干冰的宏观性质及其区别,理解原子晶体和 分子晶体的空间结构特点及微粒的堆积方式,认识原子晶 体和分子晶体的区别。
2.学会运用模型方法和类比方法,掌握区分不同类型晶体的 方法。
1.共价键是指成键原子之间靠_共__用__电__子__对__形成的化学键; 按原子轨道重叠方式分为__σ___键和___π__键;按_共__用__ _电__子__对__在成键原子之间的位置,分为极性键和_非__极__性___ 键。
4.原子晶体的物理性质 (1)原子晶体中,各原子间均以共价键相结合,原子晶体 熔化时必须破坏其中的共价键,而共价键的键能相对较大, 破坏它需要很高的温度,所以熔点都很高。对结构相似的 原子晶体,原子半径越小,键长越短,键能越大,晶体的 熔点越高。 (2)硬度大,不导电,难溶于一般溶剂。
5.典型的原子晶体 (1)金刚石晶体:在金刚石晶体中,每个碳原子被周围_4__ 个碳原子包围,以共价键跟__4_个碳原子结合形成_4_个__共___ _价__单__键__,其C—C—C夹角为_1_0_9_._5_°_,每个碳原子都采取 _s_p_3_杂化。
原子个数比为 1∶4×12=1∶2。故
SiO2 晶体中并不存在单个的 SiO2 分子,而是由 Si 原子和 O 原子按 1∶2 的比例所组成的立体网状的晶体。在 SiO2 晶体中,最小的环为由 6 个 Si 原子和 6 个 O 原子组成的
高三化学分子晶体原子晶体PPT优秀课件

下列属于分子晶体的一组物质是( B )
A、CaO、NO、CO
B、CCl4、H2 O2、He C、CO2、SO2、NaCl D、CH4、O2、Na2 O
晶体分子结构特征
(1)只有范德华力,无分子间氢键-分子密 堆积(每个分子周围有12个紧邻的分子,如: C60、干冰 、I2、O2)
(2)有分子间氢键-不具有分子密堆积特征 (如:HF 、冰、NH3 )
③1mol SiO2中含4mol Si—O键
观察·思考
• 对比分子晶体和原子晶体的数据,原子 晶体有何物理特性?
原子晶体的物理特性
– 熔点和沸点高 – 硬度大 – 一般不导电 – 且难溶于一些常见的溶剂
原因:在原子晶体中,由于原子间以 较强的共价键相结合,而且形成空间 立体网状结构
练习
2、根据下列性质判断,属于原子晶体的是( B )
A、熔点2700 ℃ ,导电性好,延展性强
B、无色晶体,熔点3550 ℃ ,不导电,质硬,难溶于 水和有机溶剂
C、无色晶体,能溶于水,质硬而脆,熔点为800 ℃ , 熔化是能导电
D、熔点-56.6℃,微溶于水,硬度小,固态或液态时不 导电
3、分析下列物质的物理性质,判断其晶体类型:
A、碳化铝,黄色晶体,熔点2200℃,熔融态 不导电;________________
金刚石的结构特征
在金刚石晶体里
①每个碳原子都采取SP3杂化,被相邻的4个碳原子包围,以共价 键跟4个碳原子结合,形成正四面体,被包围的碳原子处于正四 面体的中心。
②这些正四面体向空间发展,构成一个坚实的,彼此联结的空间 网状晶体。
③金刚石晶体中所有的C—C键长相等,键角相等(109°28’);
④晶体中最小的碳环由6个碳组成,且不在同一平面内;
高二化学选修3第三章第3节分子晶体与原子晶体

教学ppt
15
4、水分子间存在着氢键的作用,使 水分子彼此结合而成(H2O)n。在 冰中每个水分子被4个水分子包围形 成变形的正四面体,通过“氢键”相 互连接成庞大的分子晶体,其结构如 图:试分析:
①1mol 冰中有 2 mol氢键?
②H2O的熔沸点比H2S高还是低?为
什么? 氢键
教学ppt
16
讨论
教学ppt
21
109º28´
教学ppt
共价键
22
思考:
(1)在金刚石晶体中,C采取什 么杂化方式?每个C与多少个C成 键?最小碳环由多少个碳原子组 成?它们是否在同一平面内?
(2)在金刚石晶体中,C原子 个数与C—C键数之比为多少?
(3)12克金刚石中C—C键数 为多少NA?
教学ppt
23
7、典型的原子晶体
分子与四面体顶角方向的4个相邻水分子相互吸引。这一
排列使冰晶体中的水分子的空间利用率不高,留有相当大
的空隙。当冰刚刚融化为液态水时,热运动使冰的结构部
分解体,水分子间的空隙减小,密度反而增大,超过4℃
时,才由于热运动加剧,分子间距离加大,密度渐渐减小。
教学ppt
18
可燃冰
教学ppt
19
二、原子晶体
③1mol SiO2中含4mol Si—O键
教学ppt
29
学与问
1、怎样从原子结构角度理解金刚石、硅 和锗的熔点和硬度依次下降?
解释:结构相似的原子晶体,原子半径越 小,键长越短,键能越大,晶体熔点越高 金刚石>硅>锗
教学ppt
14
科学视野:天然气水合物—一种潜在的能源 许多气体可以与水形成水合物晶体。最早发现
这类水合物晶体的是19世纪初的英国化学家戴维 ,他发现氯可形成化学式为Cl2·8H20的水合物 晶体。20世纪末,科学家发现海底存在大量天然 气水合物晶体。这种晶体的主要气体成分是甲烷
高中化学第三章晶体结构与性质1分子晶体课件选修3高二选修3化学课件

12/11/2021
第十五页,共二十九页。
二、分子晶体熔沸点的比较 1.分子晶体熔、沸点的特点 分子晶体是分子在分子间作用力的作用下形成的晶体,熔化 时,只破坏分子间作用力不破坏化学键。分子晶体的熔、沸点的 高低是由分子间作用力决定的,而分子间作用力与化学键相比是 一种较弱的作用,所以分子晶体在熔、沸点上表现出共性,即熔、 沸点均较低,有些分子晶体具有易挥发、升华的性质。
第2节
分子晶体 与原子晶体 (jīngtǐ)
( jīngtǐ)
第1课时 分子晶体
12/11/2021
第一页,共二十九页。
学习目标导航
12/11/2021
第二页,共二十九页。
1.初步了解分子晶体的结构粒子及粒子间的作用力;了解 分子晶体的特征。
2.了解晶体结构模型及分子晶体的性质。
12/11/2021
12/11/2021
第二十一页,共二十九页。
下列说法中,正确的是( ) A.构成分子晶体的粒子一定含有共价键 B.在结构相似的情况下,原子晶体中的共价键越强,晶体 的熔、沸点越高 C.分子晶体中共价键的键能越大,该分子晶体的熔、沸点 一定也越高 D.分子晶体中只存在分子间作用力而不存在任何化学键, 所以其熔、沸点一般较低
【答案】 B
12/11/2021
第二十七页,共二十九页。
2021/12/11
第二十八页,共二十九页。
内容 总结 (nèiróng)
第2节 分子晶体与原子(yuánzǐ)晶体
No Image
12/11/2021
第二十九页,共二十九页。
第三页,共二十九页。
知识网络整合
12/11/2021
第四页,共二十九页。
一、分子晶体 1.概念 只含___分_子__(f_ēn的zǐ)晶体,称为分子晶体。 2.粒子间的作用力 分 子 内 的 原 子 间 以 __共__价_键____ 结 合 , 而 相 邻 分 子 靠 分子__(f_ēn_z_ǐ)间__作_用_力_相互吸引。 3.分子晶体的物理性质 由于分子晶体中相邻分子靠__分_子_(_fē_nz_ǐ)_间_作_用_力相互吸引,因此分 子晶体有熔点_低___、硬度__小___、易___升__华___的特性。
321分子晶体-高二化学课件(人教版2019选择性必修2)

4.分子晶体的物理特性 (3)分子晶体的溶解性一般符合“相似相溶”规律
→H2O是极性溶剂,SO2、H2S、HBr等都是极性分子,它们在水中的溶 解度比N2、O2、CH4等非极性分子在水中的溶解度大。
→苯、CCl4是非极性溶剂,则Br2、I2等非极性分子易溶于其中, 而水则不溶于苯和CCl4中。
分子晶体熔沸点的比较规律
×
应用体验
A 1.下列物质形成的晶体中,属于分子晶体的是( )
A.CCl4 C.金刚石
B.NaOH D.KCl
应用体验
2.冰晶胞中水分子的空间排列方式与金刚石晶胞类似,其晶胞结构如图所示。
D 下列有关说法正确的是( )
A.冰晶胞内水分子间以共价键结合 主要以氢键结合 B.每个冰晶胞平均含有4个水分子 4+1/8×8+6×1/2=8
①组成和结构相似的物质(且不含氢键的分子晶体),相对分子质量越大, 范德华力越大,熔沸点越高。 如:HI>HBr>HCl。
②相对分子质量相等或相近,极性分子的范德华力大,熔沸点高。 如:CO>N2
③含有分子间氢键的分子晶体,熔沸点较高。 如:H2O>H2Te>H2Se>H2S,HF>HCl,NH3>PH3
相邻的水分子相互吸引。
③水分子以氢键相连接,含1 mol H2O的冰中,最多可形成_2_ mol“氢键”
→冰的硬度和干冰相似,而熔点比干冰的熔点高得多。
【思考与讨论】1 为什么干冰的熔沸点比冰低,而密度却比冰大?
冰存在分子间氢键,CO2之间只存在范德华力, ∴ 干冰的熔沸点比冰低。
由于干冰中的CO2之间只存在范德华力,一个分子周 围有12个紧邻分子,∴密度比冰的高。
粒子间相互作用:范德华力及氢键
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
三个碳原子
范德华力
•2.所属类型
•石墨中既有共价键,又有范德华力,同时还有 _金_属_键______的特性,是一种混合型晶体。
•3.物理性质 •由于石墨结构的特殊性,使其熔点____很__高,有良好 的_______,导电可性做_______、__电_极______、 __润_滑_剂______、原子反铅应笔堆芯中的中子减速剂等。
每个分子周围有12个紧邻的分子
冰的结构
冰融化成水
思考: 1.冰和水中,水分子中存在几种作用力? 2.在冰中一个水分子周围有几个水分子? 3.冰融化后,水分子间的空隙怎样变化? 4.为什么冰的密度比水的小?
为什么冰的密度小于水? 在冰的晶体中,水分子之间的主要作用力是氢键(范德华力为次)。这会对冰晶体的
交流与研讨 1、怎样从原子结构角度理解金刚石、硅和锗的熔点和硬度依次下降?
解释:结构相似的原子晶体,原子半径越小,键长越短,键能越大,晶体熔点越 高 金刚石 > 碳化硅 > 晶体硅
2、“具有共价键的晶体叫做原子晶体”。这种说法对吗?为什么?
二、分子晶体
干冰
冰
硫磺 冰糖
一、分子晶体 1.概念 分子间通过_______________结合而成的晶体。 2由.于结分构子特间点作用力不具有_______分_,子所间以作分用子力晶体在堆积排列时尽可能的利 用空间采取紧密堆积的方式。
•4.常见物增强质
升高
•几乎所<有的酸,部分< 非金属单质、非金属的___、 __________以及大多数____________形成的晶体 大都属于分子晶体。
氢 化物 氧化物
有机化合物
•几种典型的分子晶体比较
单质碘
干冰
冰
晶胞或结 构模型
微粒间作 用力
晶胞微粒 数
配位数
范德华力 4
范德华力
4 12
为什么水在40C时的密度最大? 当冰刚刚融化成液态水时,热运动使冰的结构部分解体,水分子的空隙减小,密度
增大。超过40C时,由于热运动加剧,分子间距离加大,密度逐渐减小,所以40C时水的 密度最大。
归纳总结:分子晶体与原子晶体比较 (见资料46页专题一)
晶体类型
分子晶体
原子晶体
构成粒子
分子
粒子间的作用 范德华力或氢键
山东省泰安市胖城一中高二化 学课件 第3节 分子晶体
109º28´
共价键 在金刚石晶体里,每个碳原子都被相邻的4个碳原子所包围,以共价键跟这4 个碳原子结合,形成正四面体。最小的碳环上有6个碳原子。
金刚石里的C-C键的键长很短(154pm),键能很大(347.7KJ/mol),所以 金刚石在所有晶体中硬度最大,而且熔点也很高(>35500C)。
3. 在干冰晶体中,平均每个晶胞(如图)占 有CO2分子的个数为__4__,每个CO2分 子周围有__12___个与之紧邻且等距的CO2 分子.
商品房买卖合同及补充
协议条款培训
主讲人:陈莉莉 日期:2015年12月16日
练习1:金刚石晶体是一种立体的空间网状结构,
试分析;
(1)晶体中最小碳环由 个C原子组成?
(2)晶体中每个C原子参与了 条C—C键的
形成?(3)原子个数与C—C键数之比
为
?
6
4
1:2
2.原子晶体的物理特性
在原子晶体中,由于原子间以较强的共价键相结合,而且形成空间立体网状 结构,所以原子晶体的 (1)熔点和沸点高 (2)硬度大 (3)一般不导电 (4)且难溶于一些常见的溶剂
硬度
小
熔、沸点
很低
导电性 溶解性
不导电 与分子的极性有关
原子 共价键
大 很高 一般不导电
一般不溶解
物质熔沸点比较
离子晶体(晶格能) 金属晶体(金属键)
•二、石墨晶体 •1.结构特点 •石墨晶体是层状结构,在每一层内,碳原子排列成 ______________,一个个六边形排列成平面的网状结 构,每一个碳原子都跟其他____________相结合。在 同一个平面层正内六,边形相邻的碳原子以共价键相结合,层与层之间 以_____________相结合(如图)。
2. 据报道,科学家用一束激光将置于铁室中 石墨靶上的碳原子炸松,与此同时用一个射 频点火花喷射氮气,此时碳、氮原子结合 成碳化物的薄膜。据称,这种化合物比金 刚石更坚硬,其原因可能是( A )
A.碳、氮原子构成空间网状结构的原子晶体 B.碳氮键比金刚石中的碳碳键更长 C.碳、氮都是非金属元素,且位于同一周期 D.碳、氮的单质的化学性质均不活泼
结构造成什么样的影响呢?
每个水分子的周围只有4个紧邻的水分子。这 一排列使冰晶体中的水分子的利用率不高,留有 相当大的空隙。
分子非密堆积
氢键具有方向性
为什么冰的密度小于干冰? 干冰晶体内只存在范德华力,一个分子周围有12个紧邻分子。形成分子密堆积。在
冰晶体中分子间作用力主要是氢键,一个水分子周围只有4个紧邻的水分子,形成分子非 密堆积。所以干冰的密度大于冰的密度。
思考感悟
•2.石墨与金刚石互为同素异形体,它们之间有哪些性质上 的差异? •【提示】 (1)硬度:金刚石>石墨 •(2)导电性:石墨导电,金刚石不导电 •(3)熔点:金刚石<石墨
练一练:
BC
1.下列性质适合于分子晶体的是 ( ) A.熔点1070℃,易溶于水,水溶液能导电 B.熔点10.31℃,液态不导电,水溶液能导C.能溶于CS2,熔点110.8℃,沸点444.6℃ D.熔点97.81℃,质软,导电,密度为0.97g/cm3
方向性
•3.物理性质
•(1)分子晶体由于以比较弱的分子间作用力相结合,因 此一般熔点_________,硬度_较_低____。
•(较2)小对组成和结构______,晶体中又不含氢键的物质来 说,随着相对分子质量的相似增大,分子间作用力______, 熔、沸点_______。如熔点:HCl____HBr____HI。
范德华力和氢 键
4
结论:只存在范德华力的分子晶体,结构呈密堆积型,一个分子周围紧邻
思考: 1.上述几种分子晶体中,分子间的作用是什么?一个分子周12 围有几个紧邻的分子? 2.上述分子晶体中分子的排列有何特点?
个分子.
分子晶体结构有何特征? (1)只有范德华力,无分子间氢键-分子密堆积
如果分子间作用力只是范德华力,若以一个分子为中心,其周围通常可以有12个紧邻 的分子。分子晶体的这一特征称为分子密堆积。
范德华力
•2.所属类型
•石墨中既有共价键,又有范德华力,同时还有 _金_属_键______的特性,是一种混合型晶体。
•3.物理性质 •由于石墨结构的特殊性,使其熔点____很__高,有良好 的_______,导电可性做_______、__电_极______、 __润_滑_剂______、原子反铅应笔堆芯中的中子减速剂等。
每个分子周围有12个紧邻的分子
冰的结构
冰融化成水
思考: 1.冰和水中,水分子中存在几种作用力? 2.在冰中一个水分子周围有几个水分子? 3.冰融化后,水分子间的空隙怎样变化? 4.为什么冰的密度比水的小?
为什么冰的密度小于水? 在冰的晶体中,水分子之间的主要作用力是氢键(范德华力为次)。这会对冰晶体的
交流与研讨 1、怎样从原子结构角度理解金刚石、硅和锗的熔点和硬度依次下降?
解释:结构相似的原子晶体,原子半径越小,键长越短,键能越大,晶体熔点越 高 金刚石 > 碳化硅 > 晶体硅
2、“具有共价键的晶体叫做原子晶体”。这种说法对吗?为什么?
二、分子晶体
干冰
冰
硫磺 冰糖
一、分子晶体 1.概念 分子间通过_______________结合而成的晶体。 2由.于结分构子特间点作用力不具有_______分_,子所间以作分用子力晶体在堆积排列时尽可能的利 用空间采取紧密堆积的方式。
•4.常见物增强质
升高
•几乎所<有的酸,部分< 非金属单质、非金属的___、 __________以及大多数____________形成的晶体 大都属于分子晶体。
氢 化物 氧化物
有机化合物
•几种典型的分子晶体比较
单质碘
干冰
冰
晶胞或结 构模型
微粒间作 用力
晶胞微粒 数
配位数
范德华力 4
范德华力
4 12
为什么水在40C时的密度最大? 当冰刚刚融化成液态水时,热运动使冰的结构部分解体,水分子的空隙减小,密度
增大。超过40C时,由于热运动加剧,分子间距离加大,密度逐渐减小,所以40C时水的 密度最大。
归纳总结:分子晶体与原子晶体比较 (见资料46页专题一)
晶体类型
分子晶体
原子晶体
构成粒子
分子
粒子间的作用 范德华力或氢键
山东省泰安市胖城一中高二化 学课件 第3节 分子晶体
109º28´
共价键 在金刚石晶体里,每个碳原子都被相邻的4个碳原子所包围,以共价键跟这4 个碳原子结合,形成正四面体。最小的碳环上有6个碳原子。
金刚石里的C-C键的键长很短(154pm),键能很大(347.7KJ/mol),所以 金刚石在所有晶体中硬度最大,而且熔点也很高(>35500C)。
3. 在干冰晶体中,平均每个晶胞(如图)占 有CO2分子的个数为__4__,每个CO2分 子周围有__12___个与之紧邻且等距的CO2 分子.
商品房买卖合同及补充
协议条款培训
主讲人:陈莉莉 日期:2015年12月16日
练习1:金刚石晶体是一种立体的空间网状结构,
试分析;
(1)晶体中最小碳环由 个C原子组成?
(2)晶体中每个C原子参与了 条C—C键的
形成?(3)原子个数与C—C键数之比
为
?
6
4
1:2
2.原子晶体的物理特性
在原子晶体中,由于原子间以较强的共价键相结合,而且形成空间立体网状 结构,所以原子晶体的 (1)熔点和沸点高 (2)硬度大 (3)一般不导电 (4)且难溶于一些常见的溶剂
硬度
小
熔、沸点
很低
导电性 溶解性
不导电 与分子的极性有关
原子 共价键
大 很高 一般不导电
一般不溶解
物质熔沸点比较
离子晶体(晶格能) 金属晶体(金属键)
•二、石墨晶体 •1.结构特点 •石墨晶体是层状结构,在每一层内,碳原子排列成 ______________,一个个六边形排列成平面的网状结 构,每一个碳原子都跟其他____________相结合。在 同一个平面层正内六,边形相邻的碳原子以共价键相结合,层与层之间 以_____________相结合(如图)。
2. 据报道,科学家用一束激光将置于铁室中 石墨靶上的碳原子炸松,与此同时用一个射 频点火花喷射氮气,此时碳、氮原子结合 成碳化物的薄膜。据称,这种化合物比金 刚石更坚硬,其原因可能是( A )
A.碳、氮原子构成空间网状结构的原子晶体 B.碳氮键比金刚石中的碳碳键更长 C.碳、氮都是非金属元素,且位于同一周期 D.碳、氮的单质的化学性质均不活泼
结构造成什么样的影响呢?
每个水分子的周围只有4个紧邻的水分子。这 一排列使冰晶体中的水分子的利用率不高,留有 相当大的空隙。
分子非密堆积
氢键具有方向性
为什么冰的密度小于干冰? 干冰晶体内只存在范德华力,一个分子周围有12个紧邻分子。形成分子密堆积。在
冰晶体中分子间作用力主要是氢键,一个水分子周围只有4个紧邻的水分子,形成分子非 密堆积。所以干冰的密度大于冰的密度。
思考感悟
•2.石墨与金刚石互为同素异形体,它们之间有哪些性质上 的差异? •【提示】 (1)硬度:金刚石>石墨 •(2)导电性:石墨导电,金刚石不导电 •(3)熔点:金刚石<石墨
练一练:
BC
1.下列性质适合于分子晶体的是 ( ) A.熔点1070℃,易溶于水,水溶液能导电 B.熔点10.31℃,液态不导电,水溶液能导C.能溶于CS2,熔点110.8℃,沸点444.6℃ D.熔点97.81℃,质软,导电,密度为0.97g/cm3
方向性
•3.物理性质
•(1)分子晶体由于以比较弱的分子间作用力相结合,因 此一般熔点_________,硬度_较_低____。
•(较2)小对组成和结构______,晶体中又不含氢键的物质来 说,随着相对分子质量的相似增大,分子间作用力______, 熔、沸点_______。如熔点:HCl____HBr____HI。
范德华力和氢 键
4
结论:只存在范德华力的分子晶体,结构呈密堆积型,一个分子周围紧邻
思考: 1.上述几种分子晶体中,分子间的作用是什么?一个分子周12 围有几个紧邻的分子? 2.上述分子晶体中分子的排列有何特点?
个分子.
分子晶体结构有何特征? (1)只有范德华力,无分子间氢键-分子密堆积
如果分子间作用力只是范德华力,若以一个分子为中心,其周围通常可以有12个紧邻 的分子。分子晶体的这一特征称为分子密堆积。
