化工热力学剩余性质推导
化工热力学公式

热力学是以热力学第一、第二定律及其他一些基本概念理论为基础,研究能量、能量转换以及与转换有关的物质性质相互之间关系的科学。
有工程热力学、化学热力学、化工热力学等重要分支。
化工热力学是将热力学原理应用于化学工程技术领域。
化工热力学主要任务是以热力学第一、第二定律为基础,研究化工过程中各种能量的相互转化及其有效利用,研究各种物理和化学变化过程达到平衡的理论极限、条件和状态。
热力学的研究方法,原则上可采用宏观研究方法和微观研究方法。
以宏观方法研究平衡态体系的热力学称为经典热力学。
体系与环境:隔离体系,封闭体系,敞开体系流体的P-V-T关系在临界点C :临界点是汽液两相共存的最高温度和最高压力,即临界温度Tc,临界压力Pc。
纯流体的状态方程(EOS) 是描述流体P-V-T性质的关系式。
由相律可知,对纯流体有:f( P, T, V ) = 0混合物的状态方程中还包括混合物的组成(通常是摩尔分数)。
状态方程的应用(1)用一个状态方程即可精确地代表相当广泛范围内的P、V、T实验数据,借此可精确地计算所需的P、V、T数据。
(2)用状态方程可计算不能直接从实验测定的其它热力学性质。
(3)用状态方程可进行相平衡和化学反应平衡计算。
压缩因子(Z)即:在一定P,T下真实气体的比容与相同P,T下理想气体的比容的比值.理想气体方程的应用(1 )在较低压力和较高温度下可用理想气体方程进行计算。
(2 )为真实气体状态方程计算提供初始值。
(3 )判断真实气体状态方程的极限情况的正确程度,当或者时,任何的状态方程都还原为理想气体方程。
维里方程式Virial系数的获取( 1 ) 由统计力学进行理论计算目前应用很少( 2 ) 由实验测定或者由文献查得精度较高( 3 ) 用普遍化关联式计算方便,但精度不如实验测定的数据两项维里方程维里方程式Z=PV/RT=1+ B/P (1)用于气相PVT性质计算,对液相不能使用;(2)T<Tc, P<1.5MPa, , 用两项维里方程计算,满足工程需要;温度更高时,压力的范围可以更大些。
化工热力学-第3章(自学考试参考)

把压缩因子的普遍化式子代入到剩余焓和剩余熵普 遍化后的式子,就可得到:
H RfTr, P r, SRfTr, P r,
44
(2)计算方法
两种方法——普维法和普压法
1) 普维法 是以两项维里方程为基础计算 在恒压下对T求导:
Z 1 BP RT
Z TP
PTB
R T
P
RPT1TBP
TB2
B
f(T)
25
dH cpdT
H dH
=
H
0
T T0
C
p
dT
H
*
H
* 0
C
* p
dT
同理:
S* S0
T CpdTRln p
T T0
p0
H * , S * — 所求状态(T,p)的H和S,理想气体;
H0*, S0* — 任意选择的基准态(T0,P0)所对应H和S。
26
⒊ H R 和 S R 的计算式
1 V V T p
∴ V V
T p
19
有了H,S的基本计算式就可以解决热力 学其它函数的计算问题。
如:
U=H-PV A=U-TdS=H-PV-TS G=H-TS
20
计算原理及方法(Clculative Pinciple and Method of Thermodynamic Properties)
HR0pVRdpT0PVTRPdP (恒T)
SR
P 0
VR T
dP P
(恒T)
35
▪做图
VR
p
V R dp
0
P求
P
36
VR P1 P2 P3
V R T
化工热力学考试重点终极版整理
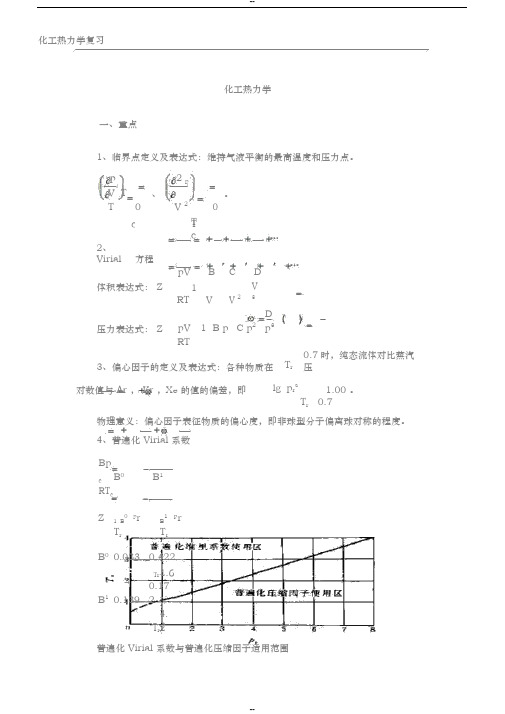
化工热力学复习 化工热力学一、重点1、临界点定义及表达式:维持气液平衡的最高温度和压力点。
p 0 、 2 p 0 。
V T T V 2c T Tc2、Virial 方程体积表达式: Z pV B CD RT 1V 2 V 3V 压力表达式: Z pV 1 B p C p 2 Dp 3RT3、偏心因子的定义及表达式:各种物质在 T r 0.7时,纯态流体对比蒸汽压 对数值与 Ar , Kr ,Xe 的值的偏差,即lg p r s 1.00 。
T r 0.7物理意义:偏心因子表征物质的偏心度,即非球型分子偏离球对称的程度。
4、普遍化 Virial 系数BpcB 0B 1 RT cZ 1 B 0 p r B 1 p r T r T r B 0 0.083 0.422 Tr 1.6B 1 0.139 0.172T r 4.2普遍化 Virial 系数与普遍化压缩因子适用范围1化工热力学复习5、Prausnitz 混合规则Tcij T ci T cj0.5 1 k ij1 1 3 V ci 3 V cj 3 Vcij2ZcijZci Z zj 2p cij Zcij RT cij Vcij ciji j 26、熵的表达式的推导 第一 dS 方程当 S S T ,V 时,则有dS SdT S dV T VVT因C V Q T d SS T T V TV T V得 S C VT V TS又V T p T V所以 dS dT pd VC V T TV积分得到S S 0 TVS C V d ln T T 0 V 0p dV T V第二 dS 方程当S S T , p 时,则有SdT SdSdp T p p T2化工热力学复习因S C p S VT p T p T T p所以 dS C p dT Vdp T T p积分得到TpS S0S C p d ln T T0p0第三 dS 方程V dp T p当S S p,V 时,则有dS S SdpdV p V V p因为SpS V VpTpTVVpSTSTT C VV p V TT C pp VpTC V T C p TdSp dp d VT V T V p 积分得到S S0p C V T V C p T dV T p VdpT VpV0p7、焓的表达式推导利用刚刚导出的三个dS 方程来得到三个 dH 方程。
化工热力学3-1Chapter3纯流体的热力学性质计算(1-2)

热力学的四个基本公式
对热力学四个基本公式的说明: (1) 虽然在四个基本公式的推导过程中采用了可逆过程,
如 d Qr = TdS 和 d W膨胀 = pdV ,但这些公式适用于包括可逆过
程和不可逆过程在内的任何过程。这是因为公式中的物理量皆 为状态函数,其变化值仅取决于始态和终态。
注意:只有在可逆过程中,上述公式中的 TdS 才代表热效 应,pdV 才代表膨胀功。若是不可逆过程,则根据热力学第二
y
(3 6)
02:12
11
§3.1 热力学性质间的关系 Chapter3.纯流体的热力学性质计算
3.1.2 点函数间的数学关系式
(1)全微分关系式与偏微分原理——Green定律
式(3-5)、(3-6)即为Green定律,其意义:
①若x、y、Z都是点函数,热力学即为状态函数或称 系统性质,且Z是自变量x、y的连续函数,则Z必有 全微分式且存在式(3-6);
dU=TdS-pdV (3-1) dH=TdS+Vdp (3-2) dA=SdTpdV (3-3) dG=SdT+Vdp (3-4)
注意基本微分方程的应用条件及其含义:
定量、定组成、单相、无非体积功的体系!
定量——封闭体系或稳流体系;
只有
定组成——无化学反应;
状态
单相——无相变
变化
02:12
无需 可逆 条件
dH=T·dS+V ·dp 等温时两边除dp (H/p)T=V+T (S/p)T
S p
T
V T
p
H p
T
V
T V T
p
H
T2 T1
cpdT
p2 p1
V
化工热力学讲义-3-第三章-纯流体的热力学性质

第三章 纯流体的热力学性质3.1热力学性质间的关系3.1.1单相流体系统基本方程 根据热力学第一、二定律,对单位质量定组成均匀流体体系,在非流动条件下,其热力学性质之间存在如下关系: pdV TdS dU -=;Vdp TdS dH +=pdV SdT dA --=;Vdp SdT dG +-=上述方程组是最基本的关系式,所有其他的函数关系式均由此导出。
上述基本方程给我们的启示是:p-V-T 关系数据可以通过实验测定,关键是要知道S 的变化规律,若知道S 的变化规律,则U 、H 、A 、G 也就全部知道了。
下面所讲主要是针对S 的计算。
3.1.2点函数间的数学关系式对于函数:()y x f z ,=,微分得:dy y z dx x z dz xy ⎪⎪⎭⎫ ⎝⎛∂∂+⎪⎭⎫⎝⎛∂∂=如果x 、y 、z 都是点函数,且z 是自变量x 、y 的连续函数,Ndy Mdx +是z (x ,y )的全微分,则M 、N 之间有:该式有两种意义:①在进行热力学研究时,如遇到(1)式,则可以根据(2)式来判断dz 是否全微分,进而可判定z 是否为系统的状态函数;②如已知z 是状态函数,则可根据(2)式求得x 与y 之间的数学关系。
以下循环关系式也经常遇到:3.1.3Maxwell 关系式由于U 、H 、A 和G 都是状态函数,将(2)式应用于热力学基本方程,则可获得著名的Maxwell 方程:V S S p V T ⎪⎭⎫ ⎝⎛∂∂-=⎪⎭⎫ ⎝⎛∂∂;p S S V p T ⎪⎭⎫⎝⎛∂∂=⎪⎪⎭⎫ ⎝⎛∂∂ T V V S T p ⎪⎭⎫ ⎝⎛∂∂=⎪⎭⎫ ⎝⎛∂∂;Tp p S T V ⎪⎪⎭⎫ ⎝⎛∂∂-=⎪⎭⎫⎝⎛∂∂能量方程的导数式:T S H S U pV =⎪⎭⎫⎝⎛∂∂=⎪⎭⎫ ⎝⎛∂∂;p V A V U T S -=⎪⎭⎫ ⎝⎛∂∂=⎪⎭⎫⎝⎛∂∂V p G p H TS =⎪⎪⎭⎫ ⎝⎛∂∂=⎪⎪⎭⎫ ⎝⎛∂∂;S T A T G V p -=⎪⎭⎫ ⎝⎛∂∂=⎪⎭⎫ ⎝⎛∂∂ 在实际工程应用中,Maxwell 方程应用之一是用易于实测的某些数据来代替或计算那些难于实测的物理量。
化工热力学重点难点考点剖析

第一章绪论(1) 明确化工热力学的主要任务是应用经典热力学原理,推算物质的平衡性质,从而解决实际问题,所以物性计算是化工热力学的主要任务。
(2) 掌握热力学性质计算的一般方法(3) 热力学性质计算与系统有关。
大家必须明确不同系统的热力学性质计算与其热力学原理的对应关系,这一点对于理解本课程的框架结构十分重要。
第二章流体的P-V-T关系(4) 应该理解状态方程不仅可以计算流体的p-V-T性质,而且在推算热力学性质中状态方程是系统特征的重要模型。
(5) 熟悉纯物质的P-V-T相图及其相图上的重要概念,如三相点、临界点、汽化线、熔化线、升华线、等温线、等压线等容线、单相区、两相共存区、超临界流体区等。
能在p-v图和p-T图中定性表达出有关热力学过程和热力学循环。
(6) 掌握由纯物质的临界点的数学特征约束状态方程常数的方法。
(7) 理解以p为显函数和以V为显函数的状态方程的形式,以及它们在性质计算中的区别。
(8) 能借助于软件用PR和SRK方程进行p-V-T性质计算,清楚计算时所需要输入的物性常数及其来源。
对于均相混合物性质的计算,需要应用混合法则,了解相互作用参数的含义和取值。
(9) 理解对应态原理的概念,掌握用图表和三参数对应态原理计算物性的方法,了解偏心因子对应态原理。
(10) 能够通过查寻有关手册,估算蒸汽压、饱和气液相摩尔体积、汽化焓等物性,清楚它们之间的关系。
第三章纯流体热力学性质的计算(11) 均相封闭系统的热力学原理给出了热力学性质之间的普遍化依赖关系,结合表达系统特征的模型就能获得不同热力学性质之间的具体表达式。
在物性推算中应该明确需要给定的独立变量,需要计算的从属变量,以及从属变量与独立变量之间的关系式。
另外,还必须输入有关模型参数,结合一定的数学方法,才能完成物性推算。
(12) 清楚剩余性质的含义,能用剩余性质和理性气体热容表达状态函数的变化。
能够用给定的状态方程推导出剩余性质表达式。
化工热力学纯流体的热力学性质

习
题
Байду номын сангаас
2.解:始态1→终态2的焓变为ΔHT H2=H1+ΔHT 或者采用剩余焓HR计算
H1
状态1 T1,p1 理想气体
ΔHT
状态2 T1,p2 真实气体
H2
因为p1较 低,故可 以视为id.g
ΔH
id
HR
=0
ΔH T = ΔH id + H R = H R
理想气体 T1,p2
H2=H1+ΔHT=H1+HR
Chemical Engineering Thermodynamics
第三章 纯流体的 热力学性质
通过本章的学习,可以实现:由一个状态方程 EOS和Cpid 的信息推算任意状态下的热力学性 质(有些性质是基于参考态的相对值)。 真实气体热力学性质的计算方法一般有两种 偏离函数法(偏差函数法) 剩余性质法(残余函数法) 依据:H, U和S均为状态函数,与路程无关
ΔH = ∫ C dT = ∫ (0.571 + 0.0009T )dT
' 12 T2 T1 l p 9.4 88
ΔH’12=-48.33 kcal/kg≠0
与ΔH=0不符,说明必然有汽化发生 假设节流后为饱和蒸汽,则焓变为 ΔH”12= ΔH’12+ ΔHV ΔHV可根据克-克方程求出
ΔH V dp S = dT T (V V − V L )
⎛ dB 0 dB1 ⎞ SR = − pr ⎜ ⎟ ⎜ dT + ω dT ⎟ R r ⎠ ⎝ r
(3 - 62)
得到:
H1R = -2690.6 J/mol S1R = -4.668 J/mol.K
●过程二:理想气体变化过程
化工热力学复习总结

第2章流体的P-V-T 关系1.掌握状态方程式和用三参数对应态原理计算PVT 性质的方法。
2.了解偏心因子的概念,掌握有关图表及计算方法。
1. 状态方程:在题意要求时使用该法。
① 范德华方程:常用于公式证明和推导中。
② R —K 方程: ③ 维里方程:2. 普遍化法:使用条件:在不清楚用何种状态方程的情况下使用。
三参数法:① 普遍化压缩因子法② 普遍化第二维里系数法3、Redlich-Kwong (RK )方程3、Soave (SRK )方程4、Peng-Robinson (PR )方程()22a 0.45724c r cR T T P α=0.0778c cRT b P =§2-5高次型状态方程5、virial 方程 virial 方程分为密度型:和压力型:第3章 纯物质的热力学性质1、热力学性质间的关系dU TdS pdV =-H=U+PV d H T d S V d =+A=U-TS d A S d Tp d V =--G=H-TS d G S d TV d =-+ Maxwell 关系式S V T P V S ∂∂⎛⎫⎛⎫=- ⎪ ⎪∂∂⎝⎭⎝⎭ S P T V P S ∂∂⎛⎫⎛⎫= ⎪ ⎪∂∂⎝⎭⎝⎭ V T P S T V ∂∂⎛⎫⎛⎫= ⎪ ⎪∂∂⎝⎭⎝⎭ P TV S T P ∂∂⎛⎫⎛⎫=- ⎪ ⎪∂∂⎝⎭⎝⎭ 转换公式: 1Z X YX Y Z Y Z X ∂∂∂⎛⎫⎛⎫⎛⎫=- ⎪ ⎪ ⎪∂∂∂⎝⎭⎝⎭⎝⎭3.2计算H ∆和S ∆的方法1.状态方程法: P P V d H C d T V T d PT ⎡⎤∂⎛⎫=+- ⎪⎢⎥∂⎝⎭⎣⎦ P PC V d S d T d PT T ∂⎛⎫=- ⎪∂⎝⎭ 2.剩余性质法:①普遍化压缩因子图()()1R R RTC C CH H HRT RT RT ω=+ ()()01R R RTS S S R RRω=+②普遍化的第二维里系数方法0101R T r r r C r r H dB dB P B T B T RT dT dT ω⎡⎤⎛⎫=-+-⎢⎥ ⎪⎝⎭⎣⎦ 01R T r r r S dB dB P R dT dT ω⎛⎫=-+ ⎪⎝⎭0 1.60.4220.083r B T =-14.20.1720.139r B T =-导出: 0 2.60.675r r dB dT T = 15.20.772r rdB dT T = 第6章 化工过程能量分析热力学第一定律一、功 Wp dVδ=-外不可逆过程: 2112W P dV =-⎰外体可逆过程: 21V rev V W p dV =-⎰体体规定:体系吸热为正,放热为负;对外做功为负,接受功为正。
化工热力学复习总结

ideal solution
chapter6
GE RT
ln i
Wid ,EX
热力学第二定律
chapter7
相平衡、化学反应平衡
动力循环、制冷循环
教材的结构
此处未考虑到电、磁、核、界面等方面的影响
chapter1
(p,V,T,x)关系
chapter2
热力学基本方程
dG=-SdT+Vdp
chapter6
分子的大小和形状影响因素
✓分子内和分子间的相互作用力 ✓分子的对称性和分子结构的均一性 ✓无定形和结晶区域内大分子的排列方式
➢ Flory-Huggins密堆积晶格模型理论
Gt At H t TSt RT n1 ln 1 n2 ln 2 n12
St Rn1 ln 1 n2 ln 2
➢ 混合物相平衡关系(温度T、压力p、与各相的组成)的确定 ➢ 汽液相平衡计算类型与方法:T,p,x,y相互推算及双重迭代循环计算方
法 ➢ 气液平衡计算 ➢ Gibbs-Duhem方程应用于汽液平衡数据的热力学一致性校验 ➢ 液-液平衡计算
含恒(共)沸物特征:汽液两相组成相等,即xi=yi
工程热力学篇:热力学第一定律 与第二定律及其工程应用
➢ Rankine循环的热力学分析方法,热效率、气耗率的概念与计 算,以及Rankine改进方法。
➢ 逆Carnot循环与蒸汽压缩制冷循环的基本组成,制冷系数和 单位工质循环量的计算;
➢ 热泵的基本概念和在工业生产中的应用;
核心是采用第一定律及其效率(热机效率)对各热力过 程进行分析与评价
若采用第二定律及其效率(热力学效率或有效能效率)进行评 价将更为复杂一些。
➢系统(system)与系统的性质:
化工热力学_Chapter3-02

Mar. 25, 2011主要内容3.1 热力学性质间的关系3.2 热力学性质的计算3.3 逸度与逸度系数3.4 两相系统的热力学性质及热力学图表关键:剩余焓H R和剩余熵S R的计算!计算方法:①根据p-V-T实验数据计算②状态方程法③普遍化关系法3.2.4 气体热力学性质的普遍化关系面临难题:实际工程计算中,如计算高压下热力学函数,通常缺乏所需的p-V-T实验数据及所需物质的热力学性质图表。
策略:借助近似的方法处理,即将压缩因子的普遍化方法扩展到对剩余性质的计算。
特点:¾对比态原理可以作为高压下的热力学函数的近似计算方法;¾根据具体条件,选择普遍化维里系数法或普遍化压缩因子法;¾普遍化方法适用性广,既可用公式计算,也可采用图表估算,但精度低。
(1)普压法1Z Z Zω=+要点:采用式(2-38)计算方法——普维法和普压法微分后代入普遍化式(3-57)、(3-58),整理后得到相关H R 、S R 计算式。
(3)注意点¾普遍化关系式(普维法,普压法)仅适用于极性较弱,非缔合物质,不适用于强极性和缔合性物质;¾选择算式之前,一定要进行判据,图2-9中曲线上方或Vr≧2用普维法,否则,需采用普压法。
()mol/J .HHHH H H R R v 3407685822056413402175421=−++=++−+==∗ΔΔΔ()()K mol /J .....SSSS S S R R v ⋅=−++=++−+==∗27883814142287210647921ΔΔΔ63340767100.28151032106/U H pV J mol−=−=−×××=例3-7 确定过热水蒸汽在473.15K 和9.807 ×105Pa时的逸度和逸度系数。
()1.9612879.0/9.652/ii p kPa H kJ kg S kJ kg K ∗∗∗===⋅解: 根据附表中473.15K时的最低压力,并假设蒸汽处于该状态时为理想气体,则从蒸汽表中查出如下的基准态值:例3-8 计算1-丁烯蒸气在473.15K,7MPa下的f 和φ。
化工热力学公式

热力学是以热力学第一、第二定律及其他一些基本概念理论为基础,研究能量、能量转换以及与转换有关的物质性质相互之间关系的科学。
有工程热力学、化学热力学、化工热力学等重要分支。
化工热力学是将热力学原理应用于化学工程技术领域。
化工热力学主要任务是以热力学第一、第二定律为基础,研究化工过程中各种能量的相互转化及其有效利用,研究各种物理和化学变化过程达到平衡的理论极限、条件和状态。
热力学的研究方法,原则上可采用宏观研究方法和微观研究方法。
以宏观方法研究平衡态体系的热力学称为经典热力学。
体系与环境:隔离体系,封闭体系,敞开体系流体的P-V-T关系在临界点C :临界点是汽液两相共存的最高温度和最高压力,即临界温度Tc,临界压力Pc。
纯流体的状态方程(EOS) 是描述流体P-V-T-性质的关系式。
由相律可知,对纯流体有:f( P, T, V ) = 0混合物的状态方程中还包括混合物的组成(通常是摩尔分数)。
状态方程的应用(1)用一个状态方程即可精确地代表相当广泛范围内的P、V、T实验数据,借此可精确地计算所需的P、V、T数据。
(2)用状态方程可计算不能直接从实验测定的其它热力学性质。
(3)用状态方程可进行相平衡和化学反应平衡计算。
压缩因子(Z)即:在一定P,T下真实气体的比容与相同P,T下理想气体的比容的比值.理想气体方程的应用(1 )在较低压力和较高温度下可用理想气体方程进行计算。
(2 )为真实气体状态方程计算提供初始值。
(3 )判断真实气体状态方程的极限情况的正确程度,当或者时,任何的状态方程都还原为理想气体方程。
维里方程式Virial系数的获取( 1 ) 由统计力学进行理论计算目前应用很少( 2 ) 由实验测定或者由文献查得精度较高( 3 ) 用普遍化关联式计算方便,但精度不如实验测定的数据斜率曲率两项维里方程维里方程式Z=PV/RT=1+ B/P(1)用于气相PVT性质计算,对液相不能使用;(2)T<Tc, P<1.5MPa, , 用两项维里方程计算,满足工程需要;温度更高时,压力的范围可以更大些。
化工热力学总结

① 恒温恒压 ② 广度性质 ③ 随组份i摩尔数的变化率
2015年1月23日星期五 17
偏摩尔性质的说明: 1、偏摩尔性质的物理意义是:在T,p和组成量均不变 情况下,向无限多的溶液中加入1摩尔的组分i所引起的 一系列热力学性质的变化; 2、只有广度性质才有偏摩尔性质,而偏摩尔性质是强 度性质; 3、纯物质的偏摩尔性质就是它的摩尔性质; 4、任何偏摩尔性质都是T、p和组成x的函数。 ① 对于纯组分 ② 对于溶液 xi=1,
2015年1月23日星期五 3
计算焓变和熵变 (1)以T、P为自变量的状态方程
dB S = p dT 二阶舍项维里方程计算剩余焓和剩余熵的公式
dB H = pB T dT T
R
R
(2)以T、V为自变量的状态方程
∂p H = pV RT + T p dV ∫ V →∞ ∂T
R V
∂p dV V S =∫ dV + R ∫ V →∞ V →∞ ∂T V V
M 1 M x2 dM dx2
M 1 M x2
dM dx1
M 2 M x1
dM dx1
M 2 M x1
dM dx2
多元系
M M i M xk x k i k
2015年1月23日星期五
T , p , x j i ,k
( nH ) i [ ]P , nS , n j i ni
( nA ) ]T , nV , n j i ni
偏摩尔内能:在T、P和其它 组分量nj均不变情况下,向 无限多的溶液中加入1mol的 组分i所引起的内能变化。
i Hi
i Ai
Hi [ ( nH ) ]T , P , n j i ni
化工热力学 简答题

1. 剩余性质: 指气体真实状态下的热力学性质M 与同一T ,P 下当气体处于理想状态下热力学性质M* 之间的差额。
2. 偏心因子: 表示分子与简单的球形流体(氩,氪、氙)在形状和极性方面的偏心度。
3. 偏摩尔性质在T 、P 和其它组分量n j 均不变情况下,向无限多的溶液中加入1mol 的组分i 所引起的一系列热力学性质的变化。
4. 由热力学第二定律,对P 相C 个组分体系,相平衡条件是,μiα= μi β= μi γ= …… = μi P (i = 1,2,3,……,C )用逸度可表示为,^f iα=^f i β=^f iγ= …… =^f iP(i = 1,2,3,……,C )5. 超额性质的定义是 M E= M –Mid,表示相同温度、压力和组成下,真实溶液与理想溶液性质的偏差。
ΔM E与M E意义相同。
其中G E是一种重要的超额性质,它与活度系数相关。
6. 理想溶液有二种模型(标准态):^f i id = X i f i (LR ) 和^f i id= X i k i (HL )有三个特点:同分子间作用力与不同分子间作用力相等,混合过程的焓变化,内能变化和体积变化为零,熵变大于零,自由焓变化小于零。
7.活度的定义是, 或活度的物理意义是,活度是相对逸度,对理想溶液活度就是浓度,对非理想溶液活度 是校正浓度。
8. 理想朗肯Rankine 循环有哪四个设备组成?简述该循环的工作原理.蒸汽动力循环主要由水泵、锅炉、透平机和冷凝器组成。
9. .试述理想功的定义,给出稳流过程理想功的计算式。
理想功是指体系从一状态变化到另一状态过程中,在一定的环境下,以完全可逆方式 进行时,理论上可能产生的最大功或理论上必须消耗的的最小功。
稳流过程理想功的计算式是,W id = H 2 – H 1 – T 0(S 2 –S 1 ) 式中1—系统进口状态,2--系统出口状态。
锅炉透平水泵冷凝器过热器23413 → 4水在水泵中被压缩升压。
化工热力学总结

∑ (m s )
j
j j out
> ∑ ( m is i ) in
i
对于可逆绝热过程, 对于可逆绝热过程, ∆Sg = 0,则有: ,则有:
∑ (m s )
j
j j out
= ∑ (misi )in
i
三、温熵图
1
P1 P2
T
2 T 3 6 4
T2/ T2
2/ 2
5
S 图4-9 节流膨胀过程
S 图4-10 等熵膨胀过程
三、液体热力学性质: 液体热力学性质: 流体体积膨胀系数β的定义: 流体体积膨胀系数 的定义: 的定义
1 ∂V β= V ∂T p
dH = C p dT + V (1 − β T )dp
dS = C
p
dT − β Vdp T
第四章重点内容
1.闭系非流动过程的能量平衡 1.闭系非流动过程的能量平衡: 闭系非流动过程的能量平衡
第六章重点内容
一、理想功和损耗功
Wid = −∆H + T0 ∆S
对于化学反应来说
Wid = −∆H + T0 ∆S
θ
θ
θ
= − ∆H − T0 ∆S = −∆G
θ
(
θ
)
WL = Wid − Ws
高乌—斯托多拉公式 高乌 斯托多拉公式
W L = T0 ∆ S t 或 W L = T0 ∆ S g
TH 273.15 + 90 ω= = = 4.035 TH − TL 90 − 0
最大供热量为: 最大供热量为:
QH = ω Ws = 4.035 ×10 = 40.35kJ / s
从环境吸收的热量为: 从环境吸收的热量为:
化工热力学72.1 剩余性质
主讲教师:吕京宁
B
xW
xF
3x D
节能 能量分析 H,S计算
H、S的基本关系式
HT,P
H参比态
T
C pdT
参比态
P
[V
参比态
T
V T
]dP p
ST ,P - S0
p C p dT 0T
p V
0
( T
) p ]dp
要计算流体的H,S,首先必须具备下列两类数据:
H H0ig HP0 HT H R
T
H P0 CP dT; HT 0
T0
理想气体 等压焓变
理想气体 等温焓变
S S0ig SP0 ST S R
T
P
SP0
CP T
dT;
S气体 等压熵变
理想气体 等温熵变
实际结果=理想结果+校正
化学热力学 的方法
建立模型
气体 Z (压缩因子) 气体 (逸度系数)
溶液 γi(活度系数)
M M ig M R
真实气 体状态
理想气 体状态
•对理想气体函数的校正, •取决于PVT数据
M R M M ig
理想气体的MR=?
在等温的条件下将上式对 P 微分
③ H H0ig HP0 HT H R
HR
SR
S S0ig SP0 ST S R
剩余性质Residual Property
M R M M ig
T、P 真实气体状态
T、P 理想气体状态 (虚拟状态)
M=V,U,H,S,A,G,CP,CV
化工热力学6剩余性质

M0R=0;Mig项是理想气体从某参考态变化到温度为
T、压力为P的理想状态,由理想气体状态方程和CPig
计算;
19
3.2.3 真实气体热力学性质计算
1)剩余性质定义
第三项MR可认为是实际气体对理想气体压 力校正项。
M M0 M ig M R
M R M M ig
20
在等温下由定义式对P微分
P
dP
SR
P
0
R P
V T
P
dP
377.66K 0.38337 0.18766 0.12248 0.07041 0.04429 0.03107 0.02654
33
V V ig V R RT V R V R V R
13
3.2.3 真实气体热力学性质计算
1)剩余性质定义 注意:
➢ ⑴ 剩余性质的引入是为了计算真实气体的热 力学性质服务的,是一个假想的概念,是一 种处理问题的方法,目的是找出真实状态与 假想的理想状态间的差额,从而计算真实状 态下的热力学性质。
➢ ⑵M ig 和M分别为体系处于理想状态和真实状
态、且具有相同压力和温度时,每Kmol或每 摩尔mol性质的数值。
(Ⅱ)利用VR图解积分
积分式的求取
V R V V ig V RT P
V RT V R P
微分
V T
P
R P
V R T
P
30
3)剩余性质的计算方法
⑴由气体PVT实验数据计算——图解积分法
将上式代入积分式,得(恒温)
HR
P
剩余性质

z x 或 1/ x y z y
2、欧拉连锁式(循环关系式或链条关系)
Y 1 Z X
3、热容关系式
V P 理气 C p CV T R T P T V
M R M M*
T、 P 真实气体状态 T、 P 理想气体状态 (虚拟状态)
M=V,U,H,S,A,G,CP,CV
19
必须注意:M-广度性质。
既然气体在真实状态下,那么在相同T和P下,气体状态不 可能处于理想状态。 所以剩余性质是一个假想的概念,用此概念找出真实状态 与假想的理想状态之间热力学性质的差额。 这是热力学处理问题的方法。
U TS H PV G PV
自由能 A=U-TS
自由焓 G=H-TS
TS A
5
dU TdS PdV dH TdS VdP dA SdT PdV dG SdT VdP
如何计算U,H,A、G?
( 1) ( 2)
( 3)
( 4)
1)由公式知U,H,A,G =f(P,V,T,S) 2)P、V、T、 S中只有两个是独立变量。S 不能直接测定, 以(T, P )和( T ,V) 为自变量最有实际意义。
2P CV T 2 V T T V
2V C P T 2 P T T P
13
3.2 以T、P为变量的焓变和熵变计算 焓(Enthalpy)的普遍关系
1.焓随温度的变化
H T P
给出能量有效利用极限 焓平衡H, U, S,G(难测)
由P-V-T,X得到(易测) 经验型
汽相
剩余性质法计算熵变

剩余性质法计算熵变、焓变计算剩余性质的基本公式由定义式∆M'=M'-M得M=M'-∆M'M'的计算:对理想气体从理想气体标准态T0,p0升始,积分到理想气体状态T和p得真实气体焓和熵的计算方程式为在恒温条件下,式∆M'=M'-M 对p微分对于焓和熵;当p*→0(∆H')* =0 (∆S')*=0对理想气体,焓只是温度的函数,所以而理想气体∆H*和∆S*是理想气体过程的焓变和熵变a、由实验数据计算:恒温由pVT数据作V-T曲线,当T=cons.时,图解求不同p时曲线切线的斜率,图解微分,即得b、由R-K方程解ΔH'或ΔS'(已知P\T)c.由压缩因子法计算剩余焓和剩余熵恒温下:在pVT数据时,可以求出p为参数时的Z-T曲线,图解微分,求出曲线切线的斜率对p作图,图解积分。
例题:已知1-丁烯的焓和熵的值在0℃的饱和液体时为零,求205℃和68atm时1-丁烯气体的V、U、H、S。
已知:Tc=420K,Pc=39.7atm,Tb=267K,ω=0.187,Cp'=3.909+62.848×10-3T-19.617×10-6T2(T单位为K)解:(1)先求VT,p己知,求V,采用普遍化方法:计算T r=T/T c=(205+273)/420=1.14P r=P/P c=68/39.7=1.71由(P r,T r)查图2-13知,该点位于曲线下方,由普遍化压缩因子关系计算由(P r,T r) 查图2-14,2-15得:Z0=0.51,Z1=0.13Z=Z0+ωZ1=0.53 V=ZRT/P=0.305m3/kmol(2)根据题目要求,要计算以0℃的饱和液体焓和熵为零时1-丁烯气体在205℃和68atm时的H、S的值,实际上是要计算这两个过程间的焓变和熵变,这样,就要设计过程进行计算。
1-丁烯在0℃时的饱和蒸气压为未知,由C-C方程:将正常沸点(267K,1atm)和临界点(420K,39.7atm)的数值代入方程解方程组得常数A、B的值,A=10.1 B=2697.20℃时的饱和蒸气压lnp s=10.1-2697.2/273解得p s=1.25atm过程一:计算正常沸点汽化潜热T m=T n/T c=267/420=0.636所以ΔH n=19.79×267=5284cal/mol0℃时的汽化潜热△H v△H v=(0.35/0.364)0.38×5284=5206cal/mol△S v=5206/273=19.07cal/molK过程二:T r=T/T c=0.650,p r=1.25/39.7=0.031查图2-13,该点在曲线之上,由普遍化第二维里系数法计算ΔH1'=81cal/mol ,ΔS1'=0.21cal/molK过程三:理想气体过程将已知的C p’表达式代入上两式,积分,得ΔH*=5058cal/mol,ΔS*=5.62cal/molK过程四:T r=T/T c=478/420=1.14 ,P r=68/39.7=1.71,查图2-13,该点在曲线之下,由普遍化压缩因子关系计算-△H2’= -2.14×1.987×420= -1785cal/mol -△S2’= -1. 45×1.987= -2.88cal/molKH=△H=△H v+△H1'+△H*一△H2'=5206+81+5958-1785=8560cal/molS=△S=△S v+△S1'+△S*-△S2'=19.07+0.21+5.62-2.88=22.0cal/molKU=H-pV=8506-68×0.305×24.2=8058cal/mol内能、焓、熵的微分表达式:。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
K e w o d : h m ia h r o yn m is r sd a p o et ; i d p n e t a ib e y r s c e c l em d a c ; e i u l r p ry n e e d n r l t v a
2 1 年 第 5期 01
2 4 5 www.d h m .o g c e c m
第 3 卷 总第 2 7 8 1 期
化 工 热 力 学剩 余 性质 推 导
胡光 辉 , 潘 湛 昌,魏 志 钢
( 广东工业大学 轻工化工学院 ,广东 广州 500 ) 06 1
【 要】 绍 了剩 余性 质 的概念 及其 数 学表达 ,在 以压 力 、温 度为 独 立变量 的剩 余性 质公 式 的基础 上 ,推 导 了以温 度 、体 积 为独立 变 量 的剩 摘 介 余 性质 公 式 。由于 多数热 力 学状态 方程 以压力 为显 函数 ,即 p pT ) = ( ,V ,因此推 导 以温度 、体 积为 独立 变量 的剩 余性 质公 式具 有应 用意 义 。 【 词】 工热 力学 ;剩余 性 质 ;独立 变量 关键 化 [ 图分类 号] 4 中 G [ 献标 识码 】 文 B [ 章 编 ̄] 716(0 1 50 5—1 文 -m0—8 52 1) 。2 40 o
:
[] ] : 导 + 。 筹 r
‘ 6 ’
l —筹 f] 筹 l 筹一: ]
P ) 一
在 恒定温度条件 下 ,公式() 以如下变化 : 3可
1 以压 力 和 温 度 为 独 立 变 量 的剩 余 性 质
根据热力学性质基 本关系 :
d =V p S G d dT ・ G =H —T S
G :
f( j (D ff v P w: v 一 v
l P n n 一 _ Ⅳ f
G= 而 f ) Rf R ( d V = v
‘
吉布斯 函数 G是温度 的函数 ,故 :
【 )T 熹 而(—r熹d 导 R rRV S) T R= T = d R R 丁 1d Tp T 旦 d , 苦咖 熹
=
式中 V 为理 想气体 的摩尔体积 。 压力看成 是温度与体 把 积 的函数 ,则公式() 8进一步推导如下 :
De duci n o sdua o r yo h m i a to fRe i l Pr pe t fC e c l The m o yna is r d m c
Hu Gu n h i P n Z a c a g W e h g n a g u, a h n h n , i ia g Z
Ab t a t twa nr d c d t a o c p fr sd a p o e t n t m ah m ai x r s in Ba e n e u to s o e i u lp o e t i r su e a d s r c :I s ito u e h tc n e t o e i u l r p ry a d i t e t e p e so s c s d o q ai n fr sd a r p ry w t p e s r n h tm p r t r si d p n e t a ib e w ed d c d t e e p e so f e i u l r p r t e e au ea d v l me a n e e d n ai be Be a s f r s u ea e ea u e a n e e d n ra l, e u e x r s i n o sd a p o et wi t mp r t r n o u si d p n e t ra l. c u e o e s r sa v h r y h v p
化 工 热 力 学 性 质 u,H,A,G,S函 数 的 绝对 值 是 多 少 , 在实 际应用 t我们并不关心 , t t 只要能得到它们随状态 的变化值 就够 了。 计算热力学函数变化时 , 常用到剩余性质或者偏离 函 数 的概念 _ J I 。剩余性质是指在相 同温度 、压力下 ,真实气体 与理 想气体 的热力学性质 的差值 ; 偏离 函数与剩余性质 的差异 主要是作参考态 的理想气体压力 不同。 文章主要讨论 用状态 方 程法计算热力学性质 时,剩余性质 的计算公 式推导 。
e pi t u c o f e p rtr n o mei mo th r d n mi s t e u t n ,h t a = ( , ) i w s a igu e uቤተ መጻሕፍቲ ባይዱefr l o s u l r p r x l i fn t no m ea ea dv l s temo y a c t e q ai s ta w s p TV ,t a nn fl od d c omua f e i a po et c i t u u n a o p me t r d y
(a ut f h mia E gn eiga dLg tn ut , u n d n i ri f e h oo y F c l o e cl n ier n ih d s y G a g o g y C n I r Unv syo c n lg , e t T
G ag h u5 0 6 C ia u n z o 1 0 , hn ) 0
