第四章 亲核取代反应
有机化学之亲核取代反应40页PPT

SN2 反应的影响因素
3) Nucleophile (亲核试剂 )
The nucleophile can be neutral or negatively charged as long as it has an unshared pair of electrons. So it is also a Lewis base(路易斯碱).
CH3Br + HO-
CH3O H+ Br-
progress of the reaction
SN2 反应的影响因素
1) Substrate(底物) —— Steric Effects
SN2 反应的影响因素
1) Substrate(底物) —— Steric Effects
H
C H
H
Br
H3C
C H
steriochemistry two stereoisomers
R-OH + HX
80% EtOH + HOreaction order k /10-5mol-1 L s-1
----
2nd-order
4.75 170
2140
inversion of configuration
预示两种不同的机理
两种不同的亲核取代反应机理 — SN1 和 SN2
H
Br
H3C
H3C C H
Br
H3C
H3C C H3C
Br
SN2反应活性: methyl > 10 > 20 > 30
SN2 反应的影响因素
亲核取代

R C C X R C C X
R C C R+ C C C+ C
+
R C+ C
R
R 为H, alkyl, aryl时,易发生重排,并可能 形成非经典碳正离子。 当R为R2N、Ph、R、CO2-、Br等基团时, 易发生邻基参与反应。
A Unified Theory of Aliphatic Nucleophilic Substitution
C…X
C…Y
C+ Y+Reaction coordinate
SN2反应为bimolecular反应,表现为二级 动力学方程,动力学方程为: rate=k[Nu][RX] 但是,观察不到二级动力学并不意味着反应不 按双分子基元反应进行,如溶剂解反应。 SN1反应为非基元反应,通常碳正离子的 形成为rate-determining:
Rate = k[HO-][R3N+R']
CH3 HOH3C N+ CH3 CHPh2 Ph2CHOH + N(CH3)3
Rate = k[Ph2CHN(CH3)3+]
SN2(Substitution Nucleophilic Bimolecular) SN1(Unimolecular)
[Y…C…X]
k1k2 [RX][Nuc-] k-1
虽然为二级动力学反应,但不是SN2反应。例如 Ph3CHCl在苯中与甲醇的反应。不过这种情况 很少。
在上述历程中,关键的问题是离去基团的离去 和亲核试剂的进攻的时机(timing)。在溶剂解反 应中,这一问题由于溶剂的亲核参与而变得更 为复杂。为了评价溶剂的电离能力,Grunwald & Winstein 用t-BuCl的溶剂解反应为基准,建立 了溶剂电离能力的线性自由能关系。
亲核取代
CH2C6H5 C CH3 H OH TsCl
CH2C6H5 C CH3 H O H Cl
O S O Me
A R
R
AcO B
CH 2 C 6 H 5 AcO C H
S
CH 2 C 6 H 5 OH HO C H
S
CH 3
C
CH 3
H Br H OH CH3 CH3 H H
Br H CH3 CH3 Br CH3 CH3 H Br H CH3 Br
H Br
-
CH3
OH
H Br H OH CH3 CH3 H H
Br H CH3 CH3 Br CH3 Br H CH3 Br
-
H CH3 Br H
CH3
OH
内消旋体
第
六
章
饱和碳原子上的亲核取代反应
NMe 3 NMe 3
R
R
第
六
章
饱和碳原子上的亲核取代反应
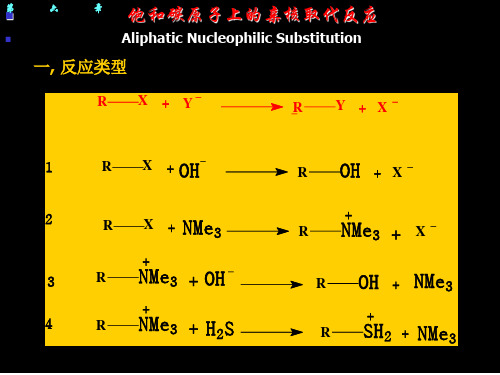
Aliphatic Nucleophilic Substitution
如:
第
六
章
饱和碳原子上的亲核取代反应
Aliphatic Nucleophilic Substitution
二. 反应机理与反应中的立体化学 1 SN1与SN2机理 (1).单分子亲核取代(SN1)
CH 2 ph CH 3 a=( + OAc B a=( CH
33
o
OH )
TsCl A CH 2 ph
CH 2 ph CH 3 CH OTs a=( + 31.1o ) OH C CH 3 a=( CH 2 ph CH
4卤代烷 亲核取代反应

-
V=[(CH3)3CBr] 特点: 特点:①单分子反应 ②反应是分步进行的 ③有活性中间体正碳离子生成。 有活性中间体正碳离子生成。
第一步: 第一步:
CH3 CH3 C Br CH3 CH3
[ CH3
Cδ
+
δ Br
]
CH3 CH3 C
+
+ Br
-
CH3
CH3
第二步: 第二步:
CH3 CH3 C
+
共轭效应本质上是电子离域效应, 电子离域效应 共轭效应本质上是电子离域效应,电子密度 从高往低跑. 从高往低跑.
(2)共轭体系的分类 ) 共轭: ①π-π共轭: 共轭 CH2=CH-CH=CH2 1,3-丁二烯 , 丁二烯
π
π
共轭: ②p -π共轭:
..
=CHCH2=CH-Cl
氯乙烯
=CHCH2=CH-CH2·
一、亲核取代反应
Br
CH3O
-
O
和卤代烷起作用的是OH OH¯ CN¯ 1. 和卤代烷起作用的是OH 、CN 、和 :NH3 等负离子或带有未共用电子对的分子,它们具 负离子或带有未共用电子对的分子, 有亲核性质。 有亲核性质。 2. 含这些负离子的试剂或含未共用电子对 分子的物质叫亲核试剂。 分子的物质叫亲核试剂。 亲核试剂 3. 由亲核试剂的进攻而引起的取代反应叫 亲核取代反应,简写作S 亲核取代反应,简写作SN。
H C CH2 C H CH2
结构式: 结构式: H2C=CH-CH=CH2
1,3-丁二烯分子中的大 键 , 丁二烯分子中的大 丁二烯分子中的大π键
2. 共轭二烯烃的特点 (1)键长平均化 共轭体系能量降低,分子稳定。 (2)共轭体系能量降低,分子稳定。 3. 共轭效应 (1)概念 在共轭体系中,各原子之间相互影响, 在共轭体系中,各原子之间相互影响,使得体 电子云密度和键长趋向平均化 键长趋向平均化、 系电子云密度和键长趋向平均化、体系趋于稳 的电子效应称为共轭效应 共轭效应。 定的电子效应称为共轭效应。
第四章亲核取代反应
(2)周期表中同一周期的元素所产生的同类型试剂, 电负性大,亲核性小,碱性也小。如:
NH2- > HO->F-
R3C- > R2N- > RO- > F-
(2) 溶剂效应
溶剂效应对亲核取代反应所起的作用,不仅是重要的, 而且是复杂的,主要是通过影响过渡态的稳定性从而影 响反应活化能,以达到影响反应速率。
表3 1-苯基乙酯和卤化物溶剂解反应的相对速率
离去基团
k相对
离去基团
k相对
CF3SO3-
p-硝基苯磺酸根
离子
p- 甲 苯 磺 酸 根 离 子
CH3SO3- I- Br-
1.4×108 4.4×105
3.7×104
3.0×104 91 14
CF3C2- Cl- F- p-硝基苯甲酸 根离子
CH3CO2-
NaBr
CH3CH2CHCH3 Br
CH3CH2C+ HCH2Br-
(4) 空间效应
SN2反应理想的过渡态,具有五配位中心碳原子上 的三角双锥几何形状,空间因素对反应有显著影响:
Nu:- + C L
δ
δ+ δ -
Nu C
L
Nu C
+ L:-
T .S
显然,反应中心碳原子上烷基数目越多,烷基体积越 大,过渡态的中心碳原子周围的拥挤程度就越严重, 必然会显著地降低反应速率。对于SN2历程的反应,α 或β碳上有分支、空间位阻愈大,都使反应速率减慢。
7
4
5
3
1
6
+ 2
(1)同烯丙基非经典碳正离子:同烯丙基非经典碳 正离子中的荷正电的碳原子与双键之间有一个碳原
高等有机第四章+饱和碳原子上的亲核取代反应

Nu + R'CH2 L
δ
H H
δ
Nu C L R'
R'CH2 Nu +L-
1、P533 SN2立体化学(Walden转化)发展历史
2、SN2的进攻方式 进攻试剂从C——X键的反面进攻,电子首先进入C——X键 的反键轨道,在过渡态中,分子呈直线性。
Nu
C
L
P534~535磺酸酯分子间反应,证明直线性反应
苏型
外消旋体
机制:
H H CH 3 S Br R OH 的构型为2R,3S,其稳定构象是 CH 3 CH 3 H S Br R H HO CH 3 H3C 即 Br H HO H CH 3
H3C Br
H HO H + HBr CH 3
H3C
H Br H2O H CH 3 S Br R Br CH 3 +Br CH 3
CH3 CH3
Cl
Cl
烯丙型和苄基型卤代烃的SN2速度加快。
当烯丙型和苄基型卤代烃以SN2历程进行时,由于键的存在, 可以和过渡态电子云交盖,形成p-π共轭,使过渡态能量降 低,从而有利于SN2反应。
X
HO CH2 CH CH2
Cl
H H
OH
烯丙基氯 的SN2反应
k1
CH 2SEt
SEt + SCN CH 2SCN
S- 1-氯苯乙烷
H
O
S Ph C Cl H3C O
+ HCl
在乙醚中,HCl不溶,挥发掉。
H O Ph H3C H C O S Ph C Cl H3C O Cl S O H C + SO2 Ph Cl H3C R-1-氯苯乙烷 (构型保持)
亲核取代反应

当中心碳原子与苯基或乙烯基直接相连时, 生成的C+稳定,------共轭
SN1反应速率增大, 反应活性增大。
当中心碳原子与杂原子直接相连时(R-ZCH2-L),SN1反 应速率明显增大:
SN 1反应速率
C2H5OCH2Cl 109
C-C-C-C-Cl 1.0
C2H5O-CH2CH2Cl 0.2
正碳离子因共轭效应而被稳定。
1、对于 SN1 反应:
影响反应速率的重要因素: 反应物解离的难易程度 生成的C+的稳定性
①电子效应
C+ 的稳定性 C+越稳定,对SN1 越有利。
所有使C+稳定的因素,都能使 SN1 的反应速率增大: 电子效应 ------主要的
3°C+ > 2°C+ > 1°C+ > CH3+
σ ,p - 超共轭效应
α 碳上有分支
丙酮 R-Br + KI
反应物 CH3Br 相对速度 150
CH3CH2Br 1
R-I + HBr ( SN2 反应 )
(CH3)2CHBr (CH3)3-CBr
0.01
0.001
HH I C Br
H
H CH3 I C Br
H
CH3 CH3 I C Br
H
CH3 CH3 I C Br
H CH3OH + Br
反应进程 SN2 反应进程中的能量变化
按 SN 2 机理进行的底物特征: 不被共轭体系稳定的仲卤代烷及其衍生物,伯卤代烷。
R' CH R X
SN1反应与SN2反应的区别
SN1 单分子反应 V = K [ R-X ] 两步反应
亲核取代反应

10% NaOH 350-400℃,20-30MPa
ONa
+ NaCl + H2O
Cl + 2NaOH NO 2 Cl NO 2 + 2NaOH NO 2
10% NaOH 160℃,0.6MPa
NO 2 ONa
+ NaCl + H2O
10% NaOH 100℃,常压
NO 2
NO 2 + NaCl + H2O
双分子历程(SN2)
Nu : + R-X
亲核试剂
[Nu··R··X] ·· ·· ·· ··
过渡态
Nu-R + X
-
离去基团
H OH-: + H C X H
慢
H H δHO C X
δ-
H
HO C H + X: H
H
单分子历程(SN1)
第一步 R-X
慢
+ R +X
快
第二步
+ R + Nu :
R-Nu
2.3 亲核取代反应
反应通式: R-H + ZR-H + Z-Y R-Z + HR-Z + H-Y
脂肪族化合物的亲核取代 芳香族化合物的亲核置换
芳环上氢的亲核取代
2.3.1 脂肪族化合物的亲核取代反应
反应历程:双分子历程 单分子历程
反应的影响因素:作用物结构
被取代离去基团 亲核试剂 溶剂
2.3.1.1 反应历程
2.3.3.1 反应历程
双分子历程
X + Y
X
Y
Y
慢
. - . .. . . .
置换反应及亲核取代反应

置换反应及亲核取代反应化学反应是物质转化的过程,其中置换反应和亲核取代反应是两种常见的反应类型。
本文将介绍这两种反应的定义、机理和应用,并探讨它们在化学领域的重要性。
一、置换反应1. 定义置换反应是指化学反应中,原子、离子或基团在分子中发生替代与取代的过程。
在置换反应中,原子、离子或基团从一个化合物中被替换出来,并被另一个原子、离子或基团取代。
置换反应的常见类型包括单置换反应、双置换反应和亚稳化反应。
2. 机理在置换反应中,通常存在着反应物和产物之间的键断裂和生成。
在单置换反应中,一个原子、离子或基团被替换。
双置换反应则涉及到两个原子、离子或基团的替换。
亚稳化反应是指反应物中的原子、离子或基团在反应中不稳定,容易发生转化。
3. 应用置换反应在化学合成、有机合成和无机合成中具有重要地位。
例如,金属离子的置换反应可以进行金属离子的提取和分离。
有机合成中,通过置换反应可以构建复杂的有机分子结构,如药物和天然产物的合成。
置换反应也用于催化反应和材料制备等方面。
二、亲核取代反应1. 定义亲核取代反应是有机化学中一种常见的反应类型,其特点是由一个亲核试剂取代了一个原有的基团。
亲核试剂可以是阴离子亲核试剂或中性亲核试剂。
亲核取代反应也包括了单亲核取代反应和双亲核取代反应。
2. 机理亲核取代反应的机理通常包括亲核试剂的攻击和反应物中原有基团的离解。
在单亲核取代反应中,亲核试剂攻击反应物中一个部分,取代其中一个基团。
双亲核取代反应则涉及到两个亲核试剂的取代。
3. 应用亲核取代反应在有机合成化学中具有广泛的应用。
例如,酯的水解反应是一种常见的亲核取代反应,可以用于合成醇。
其他亲核取代反应还包括卤代烷烃的取代反应、酮的加成反应等。
通过亲核取代反应,可以构建出各种有机化合物,拓展了有机合成的范围。
结论置换反应和亲核取代反应是化学反应中常见的两种类型。
置换反应涉及到原子、离子或基团的替换,具有重要的应用价值。
亲核取代反应则是有机合成中常见的反应类型,通过亲核试剂的取代,可以合成出多种有机化合物。
亲核取代反应

AcO AcO
2
hv H C OAc MeCN-H O 2
AcO AcO
2
CH
碳正离子为平面结构或近于平面结构。桥头碳原子不能形成平 面结构,因此,桥头上的SN1反应不能或极难进行。 1-氯莰烷 (1-chlorocamphane)在80%乙醇溶液中与30%KOH一起回流21h 也不能起反应。
Cl 二苯基氯甲烷在液态 SO2溶液中分别与各种浓度的 F、 吡啶和 三乙胺反应,虽然试剂的亲核性不同,其反应速率差不多是一 样的,说明在决定反应速率的步骤中没有亲核试剂的参加。 SO2 Nu Ph CHNu + Ph2CHCl Ph2CH Cl 2
O CHCH3 O2S SO2 O CHCD3 O2S SO2 O CHCD3 O2S SO2 O CHCH3 O2S SO2
CH3 25%
CD3 25%
CH3 25%
CD3 25%
在这里分子内反应之所以不易进行,是因为Nu、 中心碳原子C 和离去基X没法在一条直线上。因此,在SN2反应中, Nu、 中 心碳原子和离去基X在一条直线上是最容易进行的。
慢 快
因为中间体碳正离子为平面结构,亲核试剂从平面两边进攻的几 率应相等,即中心碳原子构型反转和保持的机会相等。如中心碳 原子是手性碳,经SN1反应应得完全外消旋化的产物。但实验结果 比较复杂。反应动力学为一级的亲核取代反应中生成完全外消旋 化产物的例子不少,但也有部分构型反转和部分构型保持的例子。
(-)-HO2CCH2CHClCO2H AgOH
(-)-氯代丁二酸
KOH PCl5
(-)-HO2CCH2CH(OH)CO2H KOH PCl5
(+)-HO2CCH2CH(OH)CO2H AgOH
亲核取代反应

亲核取代反应一.亲核取代反应机理。
亲核取代反应是指有机分子中的与碳相连的原子或原子团被作为亲核试剂的某原子或原子团取代的反应。
反应分为SN1型(单分子取代反应),与SN2型双分子取代反应。
1.SN1型(单分子取代反应)第一步是碳原子上正电荷增加,离去基团负点性增加,经过过渡态(1)并最终解离,生成活性中间体碳正离子与离去基团负离子。
由于这一步反应的活化能较高,速率较慢,所以这一步是反应的决速步。
第二步是活性中间体的碳正离子与亲和试剂作用,生成反应产物。
这一步仅需少量能量,速率很快。
反应特点:(1)SN1反应的决速步是中心碳原子与离去基团之间化学键的异裂。
反应速率只取决于一种分子的浓度,因此,它在动力学上是一级反应。
(2)一般是一个两步反应。
第一步生成的碳正离子采取SP2杂化,是平面构型。
故若反应物的中心碳原子是手性碳,反应产物一般是一对等量的对映异构体的混合物——外消旋体。
(3)反应中间体生成的碳正离子导致反应有重排的趋势。
2.SN2型(双分子取代反应)反应中,离去基团离开中心碳原子的同时,亲核试剂与中心碳原子发生部分键合,无中间体生成。
有机反应中,将两种分子参与决速步的亲核取代反应陈伟双分子亲核取代反应。
反应特点:(1)SN2反应是一步反应,只有一个过渡态。
(2)在SN2反应中,亲核试剂进攻中心碳原子是总是从离去基团溴原子的背面沿着碳原子和离去基团连接的中心线方向进攻。
这个过程会使得碳原子与三个未参与反映的键发生翻转,这种翻转称为瓦尔登翻转,又称构型翻转。
二.影响亲核取代反应的因素1.烃基结构的影响。
对SN1反应,主要考虑碳正离子的稳定性。
对SN2反应,主要取决于过渡态形成的难易,也就是空间效应的影响。
2.离去基团的影响。
离去基团的性质对SN1和SN2将产生相似的影响:离去基团的离去能力越强,亲核取代反应越易进行。
对于离去基团:键能越弱,离去基团的稳定性越好,该离去基团的离去能力就越强。
3.亲核试剂的影响仅对SN2有影响。
亲和取代反应总结

亲核取代反应总结1、反应定义:亲核取代反应(Nucleophilic Substitution Reaction)是指有机分子中与碳相连的某原子或基团被作为亲核试剂的某原子或基团取代的反应。
在反应过程中,取代基团提供形成新键的一对电子,而被取代的基团则带着旧键的一对电子离去.2、反应意义:这类反应是有机化学中非常重要的一类反应,不论在理论研究中还是在有机合成实际中都是极其有用的一类反应.3、反应分类:亲核取代反应的主要类型为脂肪族饱和碳上的亲核取代反应,即饱和卤代烃与亲核试剂的取代反应,较特殊结构的有苄基卤代物、烯丙基卤代物亲核反应。
其他类型还包括与酰氯、磺酸酯、磺酰卤、卤代苯等的取代反应.从电荷类型来分,亲核取代反应只能有四种类型:(1)中性底物和负离子亲核试剂反应(2)中性底物和中性亲核试剂反应(3)正离子底物和负离子亲核试剂反(4)正离子底物和中性亲核试剂反应亲核试剂包括有机和无机两类分子或离子:无机类亲核试剂:OH—、CN-、X—、H2O、NH3等有机类亲核试剂:ROH、RO—、PhO-、RS—、RMgX、RCOO-等4、反应机理类型分类:(1)双分子亲核取代反应(S N2)有两种分子参与了决定反应速率关键步骤的亲核取代反应称为双分子亲核取代反应。
反应过程中,亲核试剂从反应物离去基团的背面向与它连接的碳原子进攻,先与碳原子形成比较弱的键,同时离去基团与碳原子的键有一定程度的减弱,两者与碳原子成一条直线,碳原子上另外三个键逐渐由伞形转变成平面,这需要消耗能量,即活化能,当反应进行和达到能量最高状态即过渡态后,亲核试剂与碳原子之间的键开始形成,碳原子与离去基团之间的键断裂,碳原子上三个键由平面向另一边偏转,整个过程犹如大风将雨伞由里向外反转一样,这时就要释放能量,形成产物,S N2反应机理一般式表示为:Nu-+R X[Nuδ-···R···Xδ- ] NuR+X—例如,溴甲烷与OH—的水解反应:(2)单分子亲核取代反应(S N1)只有一种分子参与了决定反应速率关键步骤的亲核取代反应称为单分子亲核取代反应,反应中,反应物首先解离成碳正离子与带负电荷的离去基团,这个过程需要能量,是控制反应速率的一步,即慢的一部.当分子解离后,碳正离子马上与亲核试剂结合,速率极快,是快的一步。
亲核取代反应及其影响因素

亲核取代反应及其影响因素航03班 林三春 2010011556摘要:本文分为四部分。
第一部分论述了亲核取代反应的组成部分:亲核试剂、离去基团、反应底物,特地列出了常见的亲核试剂、常见的离去基团。
第二部分论述了亲核取代反应机理,主要论述了四种:SN1、SN2、离子对机理和邻近基团参与机理,其中还包括各种机理的实验现象验证,以及对反应产物的影响,如对构型的影响。
第三部分论述了亲核反应的影响因素,主要有烃基、离去基团、溶剂和亲核试剂四种,详细地说明了这四种因素如何影响反应。
给出了判断离去基团的好坏,以及比较亲核试剂的亲核性的方法。
最后一部分论述了亲和取代反应与消除反应的竞争关系,其中包括SN1与E1竞争,SN2与E2竞争。
主要以卤代烃为例阐述的。
在论述的同时,还附有适当的图示,以及实验数据,通过比较等手段,使得论述更加有说服力。
全文通过这四个部分,详细、全面地介绍了亲核取代反应。
正文:亲核取代反应,简称SN 亲核取代反应,通常发生在带有正电或部分正电荷的碳上,碳原子被带有负电或部分负电的亲核试剂(Nu:-)进攻而取代。
一、亲核取代反应的重要组成成分:亲核取代反应中涉及到的三个重要组成成分为:亲核试剂、离去基团、反应底物。
称为反应底物。
进攻反应底物的试剂CH30Na (或CH3O —)是带着电子对与碳原子结合成键的,它本身具有亲核性,称为亲核试剂,一般用Nu 表示。
这类反应之所以称为亲核取代也正是因为它是由亲核试剂进攻反应底物而引起的取代反应。
反应底物上的溴原子带着电子对从碳原子上离去,所以Br-;称为离去基团,一般用L 表示。
该取代反应是在与溴相连的那个碳原子上进行的,常称该碳原子为中心原子,或反应中心。
.一般的亲核取代反应可以用如下的通式表示: 。
其中R —L 为反应底物,L —为离去基团,Nu —为亲核试剂,弯箭头表示电子转移的方向。
1、亲核试剂:亲核性是指:带负电荷或孤对电子的试剂即亲核试剂对亲电子原子的进攻的能力。
亲和取代反应总结

亲核取代反应总结1、反应定义:亲核取代反应(Nucleophilic Substitution Reaction)是指有机分子中与碳相连的某原子或基团被作为亲核试剂的某原子或基团取代的反应。
在反应过程中,取代基团提供形成新键的一对电子,而被取代的基团则带着旧键的一对电子离去。
2、反应意义:这类反应是有机化学中非常重要的一类反应,不论在理论研究中还是在有机合成实际中都是极其有用的一类反应。
3、反应分类:亲核取代反应的主要类型为脂肪族饱和碳上的亲核取代反应,即饱和卤代烃与亲核试剂的取代反应,较特殊结构的有苄基卤代物、烯丙基卤代物亲核反应。
其他类型还包括与酰氯、磺酸酯、磺酰卤、卤代苯等的取代反应。
从电荷类型来分,亲核取代反应只能有四种类型:(1)中性底物和负离子亲核试剂反应(2)中性底物和中性亲核试剂反应(3)正离子底物和负离子亲核试剂反(4) 正离子底物和中性亲核试剂反应亲核试剂包括有机和无机两类分子或离子:无机类亲核试剂:OH -、CN -、X -、H 2O 、NH 3等有机类亲核试剂:ROH 、RO -、PhO -、RS -、RMgX 、RCOO -等4、反应机理类型分类:(1)双分子亲核取代反应(S N 2)有两种分子参与了决定反应速率关键步骤的亲核取代反应称为双分子亲核取代反应。
反应过程中,亲核试剂从反应物离去基团的背面向与它连接的碳原子进攻,先与碳原子形成比较弱的键,同时离去基团与碳原子的键有一定程度的减弱,两者与碳原子成一条直线,碳原子上另外三个键逐渐由伞形转变成平面,这需要消耗能量,即活化能,当反应进行和达到能量最高状态即过渡态后,亲核试剂与碳原子之间的键开始形成,碳原子与离去基团之间的键断裂,碳原子上三个键由平面向另一边偏转,整个过程犹如大风将雨伞由里向外反转一样,这时就要释放能量,形成产物,S N 2反应机理一般式表示为:Nu -+ R X [Nuδ-···R···X δ- ] NuR + X -例如,溴甲烷与OH -的水解反应:(2)单分子亲核取代反应(S N 1)只有一种分子参与了决定反应速率关键步骤的亲核取代反应称为单分子亲核取代反应,反应中,反应物首先解离成碳正离子与带负电荷的离去基团,这个过程需要能量,是控制反应速率的一步,即慢的一部。
亲核取代反应

取代反应是指化合物的原子或原子团被其它原子或原 子团所取代的反应。
(1)亲核取代 (2)亲电取代 亲核取代反应: (A)中性底物 + 中性亲核体
(3)游离基取代
R X + Y : R Y + + X : -
(B)中性底物 + 负离子亲核体 R X + Y : - R Y + X : -
(b)位于α位的双键、叁键及芳基的影响
X ,
X , A r X
无论SN1或SN2 都很慢或不反应。
原因之一:是由于SP杂化碳原子和SP2杂化碳原 子的电负性高,对电子有较大的引力,在亲核 取代作用中离去原子团带着它的一对成键电子 离去,因此SP3杂化碳原子相对来说比SP2杂化 碳原子及SP杂化碳原子更容易失去离去原子团 和电子对。
原子上,则生成的醇构型与反应物卤代烷的构型 正好相反。如(S)-2-溴辛烷与氢氧化钠的乙醇 水溶液反应得到(R)-2-辛醇。
H13 C6
CBr+NaO H
H C H3
S
C6 H13
H O C +NaBr
H
R C H3
[α]=-34.6°
[α]=+9.9°
S N 2 反应机理:
NNNNuuNuuNNuNuNuuu
在SN2反应中,卤代烷的活性次序为: CH3X伯卤代烷仲卤代烷叔卤代烷
-碳上的基团体 积
较小,进攻试 剂接近-碳
原子的阻力较小
-碳上取代基增加, 进攻试剂接近
-碳原子的阻力增 加
RBr+ I 丙酮 R I+ Br
H 烃基结H 构对SN2速C 率H3 的影响 C H3
第四章(亲核取代反应.2011研)

Same rate for X = Cl,Br,I.
溶剂效应
R-L
→〔 Rδ+…… ..Lδ- 〕→ R+ + LCH3 溶剂 H3C C OR + HCl CH3
CH3 H3C C Cl + ROH CH3
溶剂(水 乙醇 乙醇) 溶剂 水/乙醇 活性
0 /100 40 / 60 1 100
80 / 20 14,000
50% Retention of Configuration
Practice Problem
H Me C Cl Ph OH H2O
-
H C+ Me Ph
OH H2O
-
H Me Ph OH + HO
H Me Ph
49% Retention
51% Inversion
CH2CH3 CH2CH3 CH2CH3 H2O + Me OH Me Ethanol HO Me C Cl CH2CH2CH2CH3 CH2CH2CH2CH3 CH2CH2CH2CH3 (R)-5-Chloro -5-methylheptane 60% S Inversion 40% R Retention
反应机理
O R OH R H O S Cl Cl H+ O
+
Cl
S
R
O S Cl
O
R
+
SO 2 Cl -
R
+
SO Cl
-
2
R
Cl
+
SO
2
4.5. 邻基参与
亲核试剂和离去基团处同一分子中 分子内亲核取代反应/分子内S 分子内亲核取代反应/分子内SN2
化学反应中的亲核取代与亲电取代机理解析

化学反应中的亲核取代与亲电取代机理解析化学反应是研究物质之间相互作用和转化的过程。
在化学反应中,亲核取代和亲电取代是常见的反应机理。
本文将对化学反应中的亲核取代和亲电取代机理进行详细解析。
一、亲核取代机理亲核取代是指通过亲核试剂攻击电子不足的反应物中的正电荷中心,从而形成新的化学键。
亲核试剂通常是具有孤对电子的化合物,例如氢氧根离子(OH-)和氯化根离子(Cl-)。
亲核取代机理遵循以下几个关键步骤:1.核子亲和性:亲核试剂与电子不足的反应物之间发生亲和性相互作用。
亲核试剂中的孤对电子与反应物中的正电荷中心相结合。
2.解离:亲核试剂与反应物形成的化合物不稳定,发生解离。
这个解离步骤导致反应物中的正电荷中心被替换为亲核试剂。
3.生成产物:解离导致反应物中的原子被亲核试剂取代。
最终形成的产物中,亲核试剂与原反应物的连接位置是通过正电荷中心进行的。
亲核取代机理常见的反应类型包括亲核取代反应和亲核加成反应。
亲核取代反应通常发生在含有活泼的亲核试剂的条件下,例如碱金属(如钠和钾)和有机碱(如乙胺和丙胺)。
亲核加成反应则是指亲核试剂加成到双键上的反应,例如酸碱中和反应和Michael加成反应。
二、亲电取代机理亲电取代是指通过电子富余的反应物中的正电荷中心攻击亲电试剂,从而形成新的化学键。
亲电试剂通常是不具有孤对电子的化合物,例如溴和硝基(NO2)。
亲电取代机理遵循以下关键步骤:1.电子亲和性:亲电试剂与电子富余的反应物之间发生亲和性相互作用。
亲电试剂中的正电荷与反应物中的孤对电子或双键相结合。
2.解离:亲电试剂与反应物形成的中间体不稳定,发生解离。
这个解离步骤导致反应物中的正电荷中心被替换为亲电试剂。
3.生成产物:解离导致反应物中的原子被亲电试剂取代。
最终形成的产物中,亲电试剂与原反应物的连接位置是通过反应物中的正电荷中心进行的。
亲电取代机理常见的反应类型包括酯醇亲电取代反应、芳香族取代反应和亲电加成反应。
酯醇亲电取代反应通常通过酯与醇在酸性条件下反应,形成醚和酯类产物。
亲核取代反应的机理及影响因素

教学目标:掌握各种因素对亲核取代反应机理的影响。
教学重点:烷基结构、亲核试剂、溶剂等因素对S N1和S N2反应的影响教学安排:H i, H3— >H4; 40min基本概念:溶剂解:溶剂作为亲核试剂的亲核取代反应,称为溶剂解或溶剂解反应。
溶剂解反应可根据所用的溶剂是水、乙醇还是乙酸,分别称为水解、乙醇解,乙酸解等。
卤代烷的亲核取代反应,既可按S N2亦可按S N1机理进行,但究竟按何种机理进行呢?这与卤代烷结构,离去基团亲核试剂和溶剂的性质等诸因素有关,下面分别讨论。
一、烷基结构的影响1.烷基的结构对S N2反应的影响在卤代烷的 S N2反应中,如果中心碳原子上连接的取代烷基(支链)越多,它们对亲核试剂从碳卤键背后进攻中心碳原子的空间位阻就越大,使得发生有效碰撞的概率大为下降;而在过渡态时众多的支链与中心碳原子要保持在同一个平面内,其张力是很大的,这就使形成过渡态需要有非常高的活化能,这些都将导致卤代烷进行S N2反应的活性下降,反应速率减小。
例如,I-与下面各溴代烷的丙酮溶液中于25 C发生S N2反应时的相对反应速率为:相对转化速CSI2)CfeBr > CaHsBr〉(CHa) sCHBr > (CHoJjCBr$0 1 a 4210^ 】尸如果在卤代烷的俟碳原子上连有支链烷基时,对S N2反应的速率也有明显的影响,即卤代烷中心碳(a碳)原子上连接的烷基体积越大,其空间位阻越大,不利于亲核试剂的攻击。
例如,在C2H5OH溶剂中C2H5ONa与下面各溴代烷于 55C发生 S N2反应的相对反应速率为:反应物CH3CH 2B CH3CH2CH2B (CH 3)2CHCH 2B (CH 3)3CCH 2B r r r r相对速率100 28 3.0 4.2 X O-4综上所述,卤代烷进行S2反应时,在其它条件相同时,不同结构卤代烷的反应活性次序为:RX的亲核取代轲性:;(%X > i°RX > 2°RX >S H2反应时立体隹阻2.烷基的结构对S N1反应的影响在S N1反应中,由于决定反应速率的步骤是碳正离子的生成。
亲核取代反应的机理

CH3C CH2CH3 CH3
LOGO
迁移动力:生成更稳定的碳正离子
迁移趋势: 1°C+→2°C+→3°C+
有重排产物生成也是SN1 机理的重要判据之一
LOGO
例2:
CH CH CH 33 3
CH CH CH3 33 C H55OH OH H C2H5C OH 22 C H 2 5ONa CH CH Br C CH Br 3C 2 2 Br 3 CH C CH 3 2 CH3 CH3 CH3
反应速率 = k [(CH3)3CBr]
LOGO
(一)双分子亲核取代反应(SN2)
SN2 = Substitution Nucleophilic Bimolecular
一步机理
HO + δ HO δ Br
C
Br
C 过渡态
HO C
+ Br
五原子过渡态
LOGO
卤代烷
亲核取代反应的机理
亲核取代 反应
亲核取 代反应 机理
亲核取 代反应 立体化 学
LOGO
两种不同的亲核取代反应机理
双分子亲核取代机理(SN2)
单分子亲核取代机理(SN1)
LOGO
一、亲核取代反应机理
CH3Br
(1) 80%乙醇水溶液 反应速度很慢。
(2)80%乙醇水溶液+NaOH,水解速度随之增加。 并且,反应速度与溴甲烷和碱的浓度成正比。
反应速率 =k [CH3Br][OH-]
LOGO
(CH3)3C-Br
80%乙醇水溶液中的反应速度比溴甲烷快, 但其速度不随氢氧化钠的加入而增加,卤化 物浓度的改变是唯一的影响因素。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
A. 当进攻原子为同一原子时,亲核性强度与碱性一致: RO- > HO- >> RCO2- > ROH > H2O CH3O- > PhO- > CH3CO2- > NO2碱性是试剂与质子结合的能力;亲核性是试剂与带 有部分正电荷的碳原子结合的能力。
请思考:
H3C
H
CH3 Br
H2O SN 1
?
四. 影响反应活性的因素
影响亲核取代反应活性的主要因素是: • 底物的结构 •亲核试剂的浓度与反应活性 •离去基团的性质 •溶剂效应
1、底物结构的影响 SN 2反应: 卤代烷的反应活性顺序是:
甲基 > 伯 > 仲 > 叔
原因:烷基的空间效应
R X
R k2 CH3 30
2) 成键原子的可极化度越大,离去基团越易离去。
X 的溶剂解的相对速率为:
R I > R Br > R Cl > R F
F Cl Br I
可极 化度 依次 增大
4、溶剂效应
溶剂的性质: 介电常数 ε越大,溶剂的极性越大。
介电常数是衡量溶剂隔离正负离子的能力,即: 溶剂稳定离子的能力。
非极性溶剂:CCl4,, CS2, (μ= 0) 质子型:EtOH, H2O, 氢原子键合在电负性 CH3COOH 较大的原子上。 非质子型:THF, Et2O, DMF, DMSO, HMPT
Nu
+
C L
Nu C L
δ
δ
Nu C
Walden 转化
由于试剂从离去基团的背后进攻中心碳原子,所以 产物发生构型转化-Walden转化。
Nu:
L
Nu
+ L-
构型
C6H13 C Br CH3
(R) - (-) - 2 - 辛烷 [α]25D= -34.25° 对映体的纯度=100%
翻转
C6H13 C H CH3
C2H5NH2 > (C2H5)2NH > (C2H5)3N
亲核性依次减弱,碱性依次增强。
3、离去基团 (Leaving groups)
C L
SN2 SN1
C C
+
L
-
Nu:
离去基团带着一对电子 离开中心碳原子,成为 负离子。
Nu
+ L
接受负电荷的能力越强,亲核取代反应速率越大。 1) 较好的离去基团是强酸的共轭碱:
极性溶剂 (μ≠ 0)
质子型溶剂
非质子型溶剂
通过氢键缔合 R O H 通过偶极与偶极相互作用
Nu
极性溶剂可以稳定正离子,也可稳定负离子。 SN1反应:
R L [R
δ
L] 慢
δ
R+ LNu
一个中性化合物离解为两个带电荷的离子,溶剂极 性的提高,将稳定正碳离子,使反应速率加快。
SN2反应:
Nu
-
R L
二级反应
其反应机理为:
δ
H H C L R'
δ
Nu- + R'CH2 L
Nu
R'CH2 Nu +L-
亲核试剂背后-从离去基团的背面接近中心碳原 子与此同时离去基团也正在逐步地离开底物分子
新键的形成与旧键的断裂是同时发生的,旧键断裂 时所需的能量,是由新键形成所放出的能量提供的。 两者达到平衡时,体系能量最高。其状态为过渡态 T.OHH2O源自H C+OH-
H C OH Ph
49%
H HO C CH3 Ph
51%
CH3 Ph
CH3
消旋化 (Racemization)
事实上,SN1反应往往伴随构型转化产物:
H Ph C CH3 Br
CH3OH HBr
H CH3O C Ph + CH3
73% 消旋化产物
27 % 构型转化
当C+不是足够稳定时,由于L 的屏蔽效应,Nu:从 L 背后进攻中心碳原子的机会增大,故构型转化增多
Nu-
SN2
R
Nu
X(CH3)3C 0
CH3CH2 1
(CH3)2CH 0.03
新戊基卤代烷几乎不发生SN 2反应:
转变过程中,中心 Nu C L C X 碳原子由底物同4个 H 基团相连转变为由 H 过渡态的同5个碳原 子相连,空间拥挤程 当底物中心碳原子连有较大基团时, 度增大。 Nu:难于从背后接近底物。
(S) - (-) - 2 - 辛醇 [α]25D= -9.90° 对映体的纯度=100%
H
NaOH SN 2
HO
SN1机理
L-
C L Nu-
C+
Nu-
C Nu + Nu C
50 % 50 %
试剂从正碳离子的两面进攻中心碳原子,形成一对外消旋产物 正碳离子越稳定,消旋化程度越大
H C CH3 Ph Cl
[Nu
δ
C
L]
δ
Nu R L
在过渡态中不产生新的电荷,而且还使电荷分散,溶 剂的极性增加,不利于电荷的分散,使反应速率稍有降低。
O H Nu R O H R H O R
在质子型溶剂中:亲核试剂与溶剂形成氢键,由 此降低了试剂的亲核性,不利于反应进行。 在质子型溶剂中:试剂的亲核性强度顺序为: SH- > CN- > I- > OH- > N3- > Br- > CH3CO2- > Cl - > F- > H2O
R L + Nu
-
R Nu + L
-
ν = k1 R
L
第一步 正碳离子的生成:
R L
慢
δ
R
δ
L
R+ + L
第二步 亲核试剂进攻正碳离子:
R
+
+ Nu-
快
R
Nu
第一步是决定 反应速率的一步
例如: 二苯基氯甲烷在丙酮的水解反应:
Ph2CH Cl
Ph2CH
+
丙酮 慢
Ph2CH + Cl
OH
+
H2O
Ph2CH
A
共轭酸 1
H +B
共轭碱 2
A +B
共轭碱 1
H
共轭酸 2
强酸的共轭碱是 弱碱
重要的离去基团是 pKa < 5的酸的共轭碱,如:I- 是强酸 HI的共轭碱。
R
OH
Br
R
Br
Br
CH3
TsCl
O S O
OH
TsOH
O
R
O S O
OTs
O2N
O
TsO
CH3 S O
O
MsO-
CF3SO3- 是最好的离去基团。
构型翻转
翻转(主要)
转化(消旋化) (消旋化产物)
三个阶段: ⑴ 解离的正负离子形成紧密的离子对,整个离子对被溶剂化 ⑵ 溶剂介入离子对后,正负离子被溶剂隔开。 ⑶ 离解的离子为自由离子。 亲核试剂可以进攻四种状态的底物,从而得到不同的产物
三. 反应的立体化学
反应的立体化学与反应机理相关
SN2机理:
当中心碳原子与杂原子直接相连时(R-ZCH2-L), SN 1反应速率明显增大:
C2H5OCH2Cl
SN 1反应 速率
C-C-C-C-Cl 1.0
C2H5O-CH2CH2Cl 0.2
109
当杂原子与中心碳原子相连时,所形成的碳正 子,因共轭效应而被稳定。
B. 空间效应
与SN 2反应相反,底物上的取代基的空间效应使SN1 反应速率加快: RBr在水中的溶剂解相对速度
CH3 > O O > O Cl > NO2
O
当试剂中进攻的原子不同时,试剂的亲核性强度 顺序与碱性有时不同: 碱性: C2H5O- > I亲核性: I- > C2H5O-
B. 同周期的元素,电负性越大,试剂的亲核性越弱, 负电荷越分散,亲核性越弱: H2N- > OH- > FC. 试剂中的进攻原子为同族原子时,原子的可极化度 越大,试剂的亲核性越强: F- < Cl- < Br- < IR - O - < R - S - < R - Se -
N, N-二甲基甲酰胺
DMF
二甲亚砜 DMSO
六甲基磷酰胺 HMPT (Hexamethyl phosphorictriamide)
(Dimethylformamide)
(Dimethylsulfoxide)
在极性非质子型溶剂中,X F - > Cl - > Br - > I -
-
的反应活性顺序为:
S
N
2 反应机理:
Nu Nu NuNu NuNu Nu Nu Nu
C C C C C C
LL L L LL L
L L
Nu
C
L
在过渡态中,亲核试剂的 孤对电子所占有的轨道与中心 碳原子的 p轨道交盖的程度与 离去基团与中心碳原子的 p轨 道的交盖程度相同
按 SN 2 机理进行的底物特征:
R' CH X R
第四章 饱和碳原子上亲核取代反应
(Aliphatic Nucleophilic Substitution)
一. 反应类型 二. 反应机理 (Reaction Mechanism) 三. 立体化学 四. 影响反应活性的因素 五. 邻基参与作用
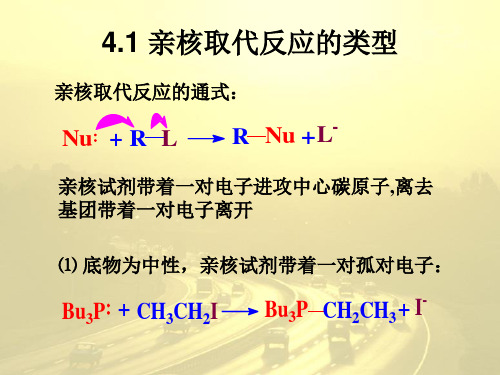
一. 亲核取代反应类型
亲核取代反应的通式:
Nu + L-
