络合滴定中酸度的选择与控制缓冲溶液和辅助试剂
第六节 终点误差和准确滴定的条件.

pMSP
1 2
(
pCM
,SP
lg
K
MY
)
pMep lg K'MInlgM lg KMIn lgIn(H) lgM
从公式可见:K'MY ,CM,SP , Et ; pM', Et
4
若金属离子不发生副反应,则:
Et
10pM 10pM CM ,SP K 'MY
100%
(林邦公式)
式中 ΔpM=pMep-pMsp
解:查表得lgKCaY=10.7,lgKZnY=16.50。pH=5.0 时, lgαY(H) =6.45, lgαZn(OH) =0。pH=10.0 时,lgαY(H) =0.45, lgαCa(OH) =0。cCa,SP=cZn,Sp=10-2.00mol•L-1, Ca2+、Zn2+均无络
合效应,αY =αY(H) 。 根据 lgKMY´= lgKMY-lgαY
pH=5.0 时, lgKCaY´= 10.7-6.45=4.25,lg cCa,SP KCaY´=2.25<6
lgKZnY´= 16.5-6.45=10.05,lg cZn,Sp KZnY´=8.05>6
pH=10.0 时,lgKCaY´= 10.7-0.45=10.25,lg cCa,SP KCaY´=8.25>6 结果表明,在pH=5.0 时,可以准确滴定Zn2+;在pH=10.0 时,
100%
100.6 100.6 100% 0.01% 102.00 1010.95
6
二、直接准确滴定金属离子的条件
在络合滴定中,一般都采用In指示ep的到达,即使 ep与sp一致,人眼仍然有△pM′=0.2~0.5的出入。
第四章络合滴定

即:pM' = lgK'MY - 3.0
pM=lgK´MY- 6 - pCsp(M)
影响滴定突跃的主要因素:
KMY越大,滴定突跃范围越大
CSP(M)越大,滴定突跃范围越大
2019/8/7
EDTA滴定不同浓度的金属离子
pM´
10 8 6 4 20
2019/8/7
100 滴定百分数
实际上常用Cu-PAN作指示剂: CuY+PAN。 在含有待测离子的溶液中,加入少量CuY,并滴加PAN,溶 液显紫红色。
M + CuY + PAN = MY + Cu-PAN
滴加EDTA与M定量反应后,稍微过量的EDTA就夺取Cu- PAN 中的Cu2+使PAN游离出来,溶液变为黄色达到终点。
Cu-PAN + Y = PAN + CuY CuY量在反应前后没有变化,不影响滴定结果。
pMgt lgK'mgEBT lgK mgEBT lgαEBT(H) 7.0 1.6 5.4
设想pH为10.0的氨性缓冲溶液中的Zn2+, 其pZnt为多少?
pZn t lgK'Zn EBT lgK Zn EBT lgαEBT(H) lgαZn(NH 3 )
M + Y = MY
K(MY) = [MY] [M][Y]
sp时:[M]= [Y]; [M]+[MY]= cSP(M)
M'sp = Y'sp =
csp M K' MY
或:
pM'sp
=
(pY)sp
=
1 2
lgK'MY +pcsp M
分析化学:络合滴定之二

滴定Fe3+ 时,最可能发生干扰的是 Al3+,而
△lgKMY = 25.1-16.3 = 8.8 > 5, 故不会产生干扰。 根据酸效应曲线及考虑Fe的水解,滴定Fe3+的适
宜 pH 范围应为 1~2.2。
2020/11/27
Analitical Chemistry
9
例13 ,Ca2+溶液中滴定Pb2+
2020/11/27
Analitical Chemistry
5
4.4 混合金属离子的选择性滴定
4.4.1 控制酸度分步滴定 M+N
M+ Y
= MY
H+
N
HiY NY
Y(H) Y(N)
K(MY)>>K(NY)
忽略其它副反应,只讨论共存离 子之间的副反应和酸效应
2020/11/27
Analitical Chemistry
(不考虑αM) lgKMY -lgαY(H)≥8, 有 lgαY(H) ≤lgK MY - 8 对应的pH即为pH低,
例如: lgK BiY =27.9 lgY(H)≤19.9 pH≥0.7
lgKMgY=8.7 lgY(H)≤0.7 pH≥9.7
lgK ZnY =16.5 lgY(H)≤8.5 pH≥4.0
例:Pb+2-Bi+3合金中Bi3+、Pb2+的连续测定
lgK(BiY)=27.9, lgK(PbY)=18.0 △lgK=9.9>6 ,可以滴定Bi3+
Y(Pb)=1+10-2.0+18.0=1016.0 lg Y(H)= lg Y(Pb) = 16.0时, pH =1.4, Bi3+水解,影响滴定
影响四大滴定终点误差重要因素

络合滴定一、终点误差:终点误差的意义:Et== 设在终点时,加入的滴定剂Y的物质的量为CY,epVep,溶液中金属离子M的物质的量为CM,epVep,通过推导可得2、林邦终点误差公式:公式中== ,决定误差的正负。
为按计量点时体积计算的金属离子的浓度。
公式表明:当一定时,KMY值越大,络合滴定突跃越大,终点误差越小。
若金属离子未发生副反应,则用代替计算.二、直接准确滴定金属离子的条件:影响络合反应的因素:⑴、待测金属离子的浓度CM(也与滴定剂的浓度)有关⑵、络合物的条件形成常数KMY⑶、对滴定准确度的要求(Et的大小)⑷、指示剂的选择(决定的大小和检测终点的敏锐性)三、络合滴定中酸度的选择与控制:(1)、缓冲溶液和辅助络合剂的作用:M + H2Y ===MY + 2H 随着滴定剂与金属离子反应生成相应的络合物,溶液的酸度会逐渐增高,减小了MY 的条件常数,降低滴定反应的完全程度;而且还可能影响指示剂的变色点和自身的颜色,导致终点误差变大,因此酸度对络合滴定的影响是多方面的,需要加入缓冲溶液予以控制。
常用的缓冲体系:酸性:HAc-NaAc,(CH2)6N4–HCl 碱性:NH3-NH4Cl 当在较低的酸度下滴定时,常需加入辅助络合剂如氨水、酒石酸和柠檬酸等,但同时又引起络合效应,应注意控制其浓度。
注意:选择缓冲溶液时,不仅要考虑它的缓冲范围和缓冲容量,还要注意可能引入的副反应。
(2)、单一金属离子滴定的最高酸度和最低酸度:1、最高酸度:(最低PH值)由知当CM一定时,K至少应达到某一数值(最小值),才有可能对该金属离子直接准确滴定。
由于酸效应时影响络合滴定最主要的因素,假如金属离子不发生副反应,则KMY仅受酸效应的影响,其大小由决定,也就是说溶液的酸度存在着一个高限,这一最高允许酸度称为最高酸度①、lg (max)==lgKMY-lgKMY(min)②、当CM,sp==0.010mol/L,== 0.2时,由得lgKMY(min)==8 ()lg (max)==lgKMY-8 ③、酸效应曲线(林邦曲线):横坐标用lg (lgKMY)表示,纵坐标是各金属离子对应的滴定最高酸度。
大学化学实验思考题答案

实验一络合滴定法测定水的硬度一、思考题及参考答案:1、因为EDTA与金属离子络合反应放出H+,而在络合滴定中应保持酸度不变,故需加入缓冲溶液稳定溶液的pH值。
若溶液酸度太高,由于酸效应,EDTA的络合能力降低,若溶液酸度太低,金属离子可能会发生水解或形成羟基络合物,故要控制好溶液的酸度。
2、铬黑T在水溶液中有如下:H2In-↔ HIn2-↔ In3-(pKa2=6.3 pKa3=11.55)紫红兰橙从此估计,指示剂在pH<6.3时呈紫红色,pH>11.55时,呈橙红色。
而铬黑T 与金属离子形成的络合物显红色,故在上述两种情况下,铬黑T指示剂本身接近红色,终点变色不敏锐,不能使用。
根据实验结果,最适宜的酸度为pH 9~10.5,终点颜色由红色变为蓝色,变色很敏锐。
3、Al3+、Fe3+、Cu2+、Co2+、Ni2+有干扰。
在碱性条件下,加入Na2S或KCN掩蔽Cu2+、Co2+、Ni2+,加入三乙醇胺掩蔽Al3+、Fe3+。
实验二原子吸收法测定水的硬度一、思考题参考答案:1.如何选择最佳的实验条件?答:通过实验得到最佳实验条件。
(1)分析线:根据对试样分析灵敏度的要求和干扰情况,选择合适的分析线。
试液浓度低时,选最灵敏线;试液浓度高时,可选次灵敏线。
(2)空心阴极灯工作电流的选择:绘制标准溶液的吸光度—灯电流曲线,选出最佳灯电流。
(3)燃助比的选择:固定其他实验条件和助燃气流量,改变乙炔流量,绘制吸光度—燃气流量曲线,选出燃助比。
(4)燃烧器高度的选择:用标准溶液绘制吸光度—燃烧器高度曲线,选出燃烧器最佳高度。
(5)狭缝宽度的选择:在最佳燃助比及燃烧器高度的条件下,用标准溶液绘制吸光度—狭缝宽度曲线,选出最佳狭缝宽度。
2.为何要用待测元素的空心阴极灯作光源?答:因为空心阴极灯能够发射出待测元素的特征光谱,而且为了保证峰值吸收的测量,能发射出比吸收线宽度更窄、强度大而稳定、背景小的线光谱。
(完整版)5-配位滴定习题答案讲解

第五章配位滴定法习题答案练习题答案1.EDTA与金属离子形成螯合物时,其螯合比一般为_______。
(1:1)2.EDTA与金属离子络合时,一分子的EDTA可提供________个配位原子。
(6)3.在非缓冲溶液中,用EDTA滴定金属离子时溶液的pH值将降低4.当M与Y反应时,溶液中有另一络合剂L存在,若αM(L)=1表示________。
(M 与L没有副反应)5.两种金属离子M和N共存时,只有稳定常数的差值满足Δlgk≥5时才可用控制酸度的方法进行分别滴定6.以下表达式中正确的是:( B )A K MY’=C MY/C M C YB K MY’=[MY’]/([M]+ ∑[ML i])( [Y]+ ∑[H i Y])C K MY’=[MY’]/([MY]+ ∑[ML i])( [Y]+ ∑[H i Y])D K MY’=[MY]/([M]+ ∑[ML i])( [Y]+ ∑[H i Y]+[MY])7. 在pH=10.0的氨性溶液中,已计算出αZn(NH3)=104.7,αZn(OH)=102.4,αY(H)=100.5,已知lgK ZnY=16.5;在此条件下,lgK ZnY’为__________。
(11.3)8.络合滴定中,若封闭现象是由被测离子引起的,则可采用回滴定法进行9.络合滴定法直接滴定Zn2+,铬黑T In-作指示剂,其滴定终点所呈现的颜色实际上是:(D)A. ZnIn的颜色B. In-的颜色C. ZnY的颜色D. ZnIn和In-的颜色10.在EDTA法中,当MIn溶解度较小时,会产生(B )A 封闭现象B 僵化现象C 掩蔽现象D 络合效应和酸效应11.当K MIn>K MY时,易产生(A )A 封闭现象B 僵化现象C 掩蔽现象D 络合效应和酸效12.下列指示剂中,全部适用于络合滴定的一组是:(C )A 甲基橙、二苯胺磺酸钠、EBTB 酚酞、钙指示剂、淀粉C 二甲酚橙、铬黑T、钙指示剂D PAN、甲基红、铬酸钾13.在金属离子M和N等浓度的混合液中,以HIn为指示剂,用EDTA标准溶液直接滴定其中的M,要求(C)A pH=pK’MYB K’MY<K’MInC lgK MY –lgK NY≥5D NIn和HIn的颜色应有显著差别14.在氨性缓冲液中,用EDTA滴定Zn2+至化学计量点时,以下关系正确的是:(D)A [Zn2+]=[Y4-]B [Zn2+‘]=[Y’]C [Zn2+]2=[ZnY]/K ZnYD [Zn’2+]2=[ZnY]/K’ZnY15.在pH=5.0的乙酸缓冲溶液中,用0.002mol/L的EDTA滴定同浓度的Pb2+。
络合滴定中酸度的控制

当CM CY 0.02mol L1,Et 0.1%,△pM 0.2时
由判别式,lg
C
sp M
k
' MY
6,得
lg Y(H) lg k MY 8
(3-22a)
查表 最低pH
1
EDTA酸效应曲线的用途:
(1)方便地查出滴定M的最高 酸度。如滴定:Ca、Mg。 pH=10,NH3-NH4Cl,EBT 滴定Bi3+,pH=1,XO.
(2.0
16.3)
0.2
6
故不能选择滴定Zn2+
(2).C
sp F
1 37 100 10 3
0.27mol.L1
AlF63 : lg 1 lg 6 : 6.13,11.15,15.00,17.75,19.37,19.84.
据C
sp F
及
可
i
初
步判
断AlF52
7
§3-7提高络合滴定选择性的途径
一、络合掩蔽法
1、常用的掩蔽剂 (1)KCN(NaCN)
碱性条件下使用pH>8 酸性溶液中产生HCN↑ 应用: 掩蔽Cu2+、Co2+、Ni2+、Zn2+、Cd2+、Hg2+、Ag+、
Fe2+、Fe3+等
强碱性:掩蔽Mn2+ Mn 2 H 2O2 CN [Mn(CN )6 (H 2O2 )]3
为
主
要形
式
。
14
[F]sp 0.27 0.01 5 0.22mol.L1
当pH 5.5时. F(H)
5.2 络合滴定法

尽量使: pM’ep=pMsp
三、金属指示剂在使用中存在的问题
(一)指示剂的封闭现象
有时某些指示剂能与某些金属离子生成极 为稳定的络合物,但这些络合物较对应的 MY 络合物更稳定,以致到达计量点时滴入 过量EDTA,也不能夺取指示剂络合物(MIn) 中的金属离子,指示剂不能释放出来,看不 到颜色的变化,这种现象叫指示剂的封闭现 象。
目前,合成金属指示剂达300种以上,经 常有新的金属指示剂问世。
(一)铬黑T
铬 黑 T 属 O,O’- 二 羟 基 偶 氮 类 染 料 , 简 称 EBT 或 BT ,其化学名称是: 1-(1- 羟基 -2- 萘偶 氮)-6-硝基-2-萘酚-4-磺酸钠。
铬黑 T 的钠盐为黑褐色粉末,带有金属光泽, 使用时最适宜的 pH范围是9—11,在此条件下, 可用EDTA直接滴定Mg2+、Zn2+、Cd2+、Pb2+、 Hg2+ 等 离 子 。 对 Ca2+ 不 够 灵 敏 , 必 须 有 MgEDTA 或 Zn-EDTA 存在时,才能改善滴定终点。 一般滴定Ca2+和Mg2+的总量时常用铬黑T作指示 剂。
金属指示剂大多数是具有许多双
键的有色化合物易被日光氧化、空气
和氧化剂所分解。有些指示剂在水溶 液中不稳定,日久会变质。
举
例
如铬黑T、钙指示剂的水溶液均易氧化变质,所
以常配成固体混合物或用具有还原性的溶液来配
制溶液。
分解变质的速度与试剂的纯度也有关。一般纯度
较高时,保存时间长一些。
四、常用金属指示剂简介
(2) 酸度减小,对滴定有利,但酸度 太小,金属离子可能水解,影响滴 定,所以要控制溶液酸度。
分析化学第五版第6章 络合滴定法 酸度控制 选择性 应用3

1
2
化时的酸度,视为滴定M的
适宜酸度。
lg
25 20 15 10 5 0 0
25
lgY
滴定M的适宜酸度: pHa:
lg Y(N)
2 4 6
lg Y(H)
8 10 12 14 pH
αY(H) αY(N) 1 K NY C N
pHb:
[OH ] n
sp
lg K 'MY 20
15 10 5 0 0 2 4 6 8 10 12 14 pH
pM = 0 最佳酸度
pH
由此看出,在络合滴定中: 酸度的确定比指示剂的选择更重要。
6.6.2 分别滴定的酸度控制
lg
25 20 15 10 5 0 0
25
设M-被测离子,N-共存离子, 且△lgKC ≥ 5
lg Y(N)
2 4 6
lgY
K′MY与酸度的关系: 1.
lg Y(H)
8 10 12 14 pH
b. 用氧化剂或还原剂改变N离子的价态。
c. 选择其它的络合剂作滴定剂。
6.7.1 络合掩蔽法
常用掩蔽剂:P203 举例: 教材P202,具体实施方法:
主要是用于设计络合滴定实验方案。
使用络合掩蔽剂注意问题:P203 例题21,22(自学)
6.7.2 沉淀掩蔽法
例: 自来水 (含Ca2+、Mg2+)中Ca2+的测定: pH > 12,Mg(OH)2,EDTA可滴定Ca2+
4. 滴定M的最佳酸度
pMep=pMsp
1 1 sp sp pCM ) (lg K MY lg Y(H ) pCM pM sp (lg K MY ) 2 2
络合滴定中选择性滴定的酸度控制问题的探讨

相 同 , 高酸度控制 由下式 决定 : gyH =1 K, 一1 R 最低 酸度好为其 水解 酸度 :O ] 最 1 a () r g  ̄ : g [ H一
=
( s[ O n / N . K v N( H) ]C ) 这点 多数分析化 学教科 书 阐述 比较清 楚 , 在此 不作 赘述 , 而主 要探
主 , gYH =I K y K 对 应的酸度值为最高 酸度值 . 中 I K 由林 邦误差公式 ( t I a() M —I g g 其 g E= 1△ M一1 一 p / K c ×10 , 0p 0 △ M ( ) 0 %)及所 要求 的 E 值 、 M 值决定 . t Ap
维普资讯
4 0
l. 司
赣 南 师 范 学 院 学 报
20 0 2焦
另外 , 存 体 系 I 1 2中 , 果 a () 于 或 等 于 允 许 的 a 共 .. 如 YN大 y最 高 值 ( 由滴 定 的 准 确 度 决 定 )说 明 N 的 干扰 严 重 , 加 入 掩 蔽 剂 L掩 蔽 N, 时选 择 性 滴 定 M 的最 高 酸 度 控 制 法 和 I , 应 此 .
李 蕾 , 曾小梅 , 晓 绮 赖
( 南 师 范学 院 化 学系 , 西 赣 州 3 10 ) 赣 江 4 00
摘 要 : 合性 滴 定 中 , 定 准确 性很 大程 度 上 受 酸 度控 制 的 影 响 , 其 是 选择 性络 合 滴定 , 络 滴 尤
本文 就 国 内一些 分析 化 学教科 书 中选择 性 滴 定 的 酸度 控 制 的 问题 进 行探 讨 , 为全 面、 较 系统 的 分
1I . 相同. Z 、d 如 n C 共存( =c c 器=000 0 o/ )测 Z 时加入 I .1 0 m l , n L 掩蔽 C ( t ± d E≤
八、络合滴定中酸度的控制
八、络合滴定中酸度的控制为什么要控制酸度?①络合滴定过程中指示剂的使用有合适的酸度范围;②滴定剂EDTA存在酸效应;③金属离子与OH-会发生副反应,甚至生成沉淀而影响络合滴定。
通常采用酸碱缓冲溶液控制络合滴定的pH值。
1.单一离子络合滴定的适宜酸度范围为什么要控制最高酸度?酸度太高,Y的酸效应太大,条件稳定常数较小,pM′突跃小,终点误差大,因此,要控制酸度的上限值。
最高酸度为多少?准确滴定的条件:log K’MY≥ 8忽略金属离子的副反应,当pH < 12时,存在酸效应时:lg K’MY=lg K MY-lg αY(H)lg αY(H) = lg K MY-lg K’MY= lg K MY –8由教材表可查得lg K MY对应的最低pH值,即滴定各种金属离子时所允许的最小pH值。
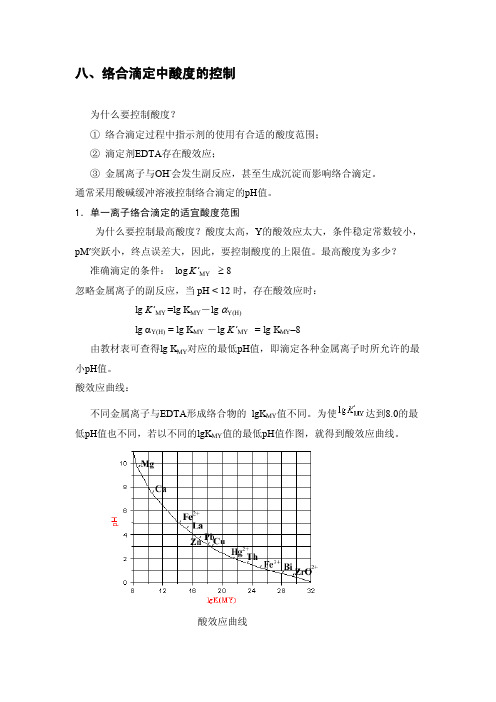
酸效应曲线:不同金属离子与EDTA形成络合物的lg K MY值不同。
为使达到8.0的最低pH值也不同,若以不同的lg K MY值的最低pH值作图,就得到酸效应曲线。
酸效应曲线为什么要控制最低酸度?大多金属离子,在酸度过低的情况下易发生水解甚至形成Mn(OH)n 沉淀,也会使条件稳定常数降低,因此,络合滴定过程中需控制一个最低酸度。
最低酸度为多少?最低酸度是防止生成沉淀M(OH)n沉淀,可由溶度积求得为金属离子(M)的初始浓度。
2. 最佳酸度从滴定反应考虑,在pH低~ pH高范围内进行滴定,可以达到一定的值而又不致生成沉淀。
但滴定的终点误差不仅决定于值,还与值有关,。
由反应体系自身决定,当时,pM sp值相对于pH作图得一上升的曲线。
由于EDTA和指示剂的酸离解常数不同,和随pH值变化的速率不同,导致pM sp和pM ep随pH值变化的速率不同,两变化曲线相交一点,此点所对应的pH值即为用指示剂确定终点时滴定的最佳酸度,此时:必须指出,由于络合物形成常数,特别是与金属指示剂有关的平衡常数目前还不齐全,有的可靠性还较差。
03第6章-络合滴定法-滴定酸度控制

pH < 1, 或 pH > 1,
强酸或强碱自身缓冲体系
缓冲溶液的选择与配制:
1. 合适的缓冲pH范围: pH≈pKa
2. 足够的缓冲能力: 缓冲物质浓度计算
3. 不干扰金属离子的测定:
缓慢,且逆向反应同样是
缓慢的,即AlY 一旦形成 就很稳定,故实际上可用 Zn2+作返滴定剂。
置换滴定法
• 置换出金属离子: 被测离子与EDTA形成络合物不稳定
例:Ag+的测定 lg K AgY = 7.3 那么
若 C(Ag+ ) = 0.01 mol /L
lg( cK ' ) 6
2 4
难以直接滴定。一般采用的方案是
最佳酸度
pM = pM ep pM sp
1 pM sp = ( lg K MY' pCM, 2
pM = 0 pZnsp
1 lg K MY lg Y(H ) pCM, sp ) = ( 2
sp
)
pMep = pM t = lg K MIn lg In(H)
9 pM pM 8 7 6 5 4 4
六、络合滴定中的酸度控制
(一)单一金属离子滴定的适宜pH范围 最高酸度---最低pH 保证准确滴定的K´MY.
最低酸度---最高pH
以不生成氢氧化物沉淀为限.
1. 最高允许酸度 (pH低限) 若 pM=±0.2, 要求 Et≤±0.1%
则 lg(csp· KMY)≥6
即 lgKMY≥8.0 (csp= 0.01mol· L-1) 只考虑酸效应 , lgKMY= lgKMY lgY(H)≥8.0 有 lgY(H) ≤lgK(MY) – 8.0 对应的pH 即为pHL. KMY不同,所对应的最高酸度也不同。
lmq第六节终点误差和准确滴定的条件

[OH- ]= Ksp = 10-16.92 = 10-7.61mol/L
c 2+ Zn
0.02
pOH=7.61 pH=6.39
因此滴定Zn2+的适宜酸度范围为pH=4.0~6.39。由于二甲酚 橙 应 在 pH<6.0 的 酸 度 下 使 用 , 故 此 时 滴 定 Zn2+ 应 在 pH=4.0~6.0之间进行。 有关计算值列入表中(P184页)。 计 算 和 实 验 表 明 , 使 ︱ Et︱ 不 大 于 0 . 1 % 的 酸 度 范 围 应 为 pH=5.1~6.0
pZn sp=1/2(p cZn,sp + lg KZnY) =1/2(2.00+10.95)=6.48 查表, 得用铬黑T作指示剂时, pH=10.0的pZnt= 12.2
pZn ep= pZn t=pZn t-lgZn=12.2-5.10=7.1 pZn sp (6.48)与pZn ep (7.1)比较接近, 且在指示剂的适宜酸度 范围内, 变色敏锐,故选择铬黑T作指示剂是适宜的。
一、 终点误差
Et
=
滴定剂Y过量或不足的物质的量 金属离子的物质的量
设在终点(ep) 时,加入的滴定剂 Y的物质的量为c 溶液中金属离子M的物质的量为c M,ep V ep,
Y,ep
V
ep
,
Et = c Y,ep V ep - c M,ep Vep c Y,ep - c M,ep
c M,ep Vep
lgK’MY≥8
例:用0.02000mol/LEDTA滴定0.020mol/L的Ca2+,必须在 pH=10.0( 氨 性 缓 冲 溶 液 ) 而 不 能 在 pH=5.0( 六 亚 甲 基 四 胺-HCl缓冲溶液)的溶液中进行,但滴定 Zn2+(浓度同 Ca2+),则可以在pH=5.0时进行,为什么?
第三章络合滴定法

终点误差公式的其他应用
1.求稳定常数
例:pH = 5.0时,用0.02000 mol/L EDTA滴定20.00 mL 0.02000 mol/L 的M溶液,当加入的EDTA体积分 别为19.96 mL和20.04 mL 时,用电位法测得pM分别 为4.7和 7.3。试求出M与EDTA络合物的稳定常数。
3.3 副反应系数及条件稳定常数
1.理解:酸效应、共存离子效应、络合效应、水解效应, 及其定义式. 举例: 2.理解M、Y的副反应对主反应不利, 而MY的副反应对主反应有利. 3.各种副反应系数的计算
Y的副反应系数
Y (H )
[H ] [H ] [H ] 1 ... K a6 K a6 K a5 K a 6 K a5 ...K a1
pM
K
' MY
CM
SP
' SP K MY C M
ep与sp接近,当 M有副反应时Msp Mep ∴ pM pM′ △PM= PMep - PMsp
指示剂的变色点 (题给)
由公式先求出 pM sp
' pM sp PMSP log M
思考:pM′ 如何求?
P110例题13
[L]---溶液中游离态络合剂L的平衡浓度. 例: 在PH=10.0的氨性缓冲溶液中, 用0.01mol/L EDTA滴定0.01mol/LCu2+ 和0.01mol/L Ca2+混 和溶液中的Cu2+ ,如NH3+NH4+的总浓度为 0.1mol/L,计算αCu(NH3).
M (OH ) 1 1[OH ] 2OH ] ... n [OH ]
pM sp
pM pM
分析化学实验课后习题答案(第四版)

实验四铵盐中氮含量的测定(甲醛法)思考题:1.铵盐中氮的测定为何不采用NaOH直接滴定法?答:因NH4+的K a=5.6×10-10,其Ck a<10-8,酸性太弱,所以不能用NaOH直接滴定。
2. 为什么中和甲醛试剂中的甲酸以酚酞作指示剂;而中和铵盐试样中的游离酸则以甲基红作指示剂?答:甲醛试剂中的甲酸以酚酞为指示剂用NaOH可完全将甲酸中和,若以甲基红为指示剂,用NaOH滴定,指示剂变为红色时,溶液的pH值为4.4,而甲酸不能完全中和。
铵盐试样中的游离酸若以酚酞为指示剂,用NaOH溶液滴定至粉红色时,铵盐就有少部分被滴定,使测定结果偏高。
3.NH4HCO3中含氮量的测定,能否用甲醛法?答:NH4HCO3中含氮量的测定不能用甲醛法,因用NaOH溶液滴定时,HCO3-中的H+同时被滴定,所以不能用甲醛法测定。
实验五混合碱的分析(双指示剂法)思考题:1.用双指示剂法测定混合碱组成的方法原理是什么?答:测混合碱试液,可选用酚酞和甲基橙两种指示剂。
以HCl标准溶液连续滴定。
滴定的方法原理可图解如下:2.采用双指示剂法测定混合碱,判断下列五种情况下,混合碱的组成?(1) V 1=0 V 2>0(2)V 1>0 V 2=0(3)V 1>V 2(4)V 1<V 2(5)V 1=V 2①V 1=0 V 2>0时,组成为:HCO 3- ②V 1>0 V 2=0时,组成为:OH - ③V 1>V 2时,组成为:CO 32-+ OH - ④V 1<V 2时,组成为:HCO 3- +CO 32- ⑤ V 1=V 2时,组成为: CO 32-实验六 EDTA 标准溶液的配制与标定思考题:1.络合滴定中为什么加入缓冲溶液?答:各种金属离子与滴定剂生成络合物时都应有允许最低pH 值,否则就不能被准确滴。
而且还可能影响指示剂的变色点和自身的颜色,导致终点误差变大,甚至不能准确滴定。
第6章络合滴定法(7)

+
+
CH2COO
-
CH2COOH
H4Y
1分子乙二胺四乙酸,可由2个氨 N和4个羧 O提供六基配位体
4
2、乙二胺四乙酸性质
(1)溶解性 难溶于水、酸及一般有机溶剂,易溶于碱生成 乙二胺四乙酸二钠(Na2H2Y , EDTA) (2)酸性 在pH<1的强酸性溶液中,它的两个羧基可再 接受两个H+,形成H6Y2+ 六元酸
-
aZn (NH3)=1+β1[NH3]+β2[NH3]2+...+β4[NH3]4
[NH3]=0.10 Zn(NH3)2 + Zn(OH) . . 查附录, Zn-NH3的lgβ1~lgβ4分别为 . . aZn (NH3)=105.49 2.27, 4.61, 7.01, 9.06 . . 2+ Zn(NH3)4 查附录, pH=10时, lgaZn(OH)=2.4
即
aY=aY(H)+ aY(N)-1
19
二、金属离子M的副反应系数aM
M
+
Y
MY
L ML ML2 . . . MLn
a M ( L)
[ M ] [M ]
由于其它络合剂L的存在使M 参加主反应能力降低的现象, 称为络合效应 [M']=[M]+[ML]+[ML2]+...+[MLn] 没有与Y络合的M的总浓度
即
=1+β1[L]+β2[L]2+...+βn[L]n
aM(L) =1+β1[L]+β2[L]2+...+βn[L]n
20
如果溶液中的OH-与M形成络合物使M参加主反应 能力降低,则称为羟基络合效应,用aM(OH)表示 附录表12列出了部分金属离子的lgaM(OH) 可查
第六章 络合滴定法 (2)

3、 累积形成常数:络合物的逐级形成常数的乘积称为累积 形成常数,用表示。
==K1= == K1K2…Kn = 又称为络合物的总形成常数K形 运用各级累积形成常数,可以比较方便地计算溶液中各级络合物型体的 平衡浓度 [ML]== [M][L] [ML2 ]== [M][L]2
[MLn ]== [M][L]n
结论:对于一定的络合剂,络合效应系数是溶液中游离配位体浓度[L] 的函数。[ L]愈大,值愈大,M的络合效应越严重,[M]也越小,这样对 主反应的影响也就愈大了。
{ ①、[L]的计算:[L]==C 如:L为NH3,则[NH3]==CNH ,L与C和溶液的酸度有关。 ②、有副反应存在时,M各种型体的平衡浓度的计算 [MLi]==C==[M‘] ==
㈠、EDTA的结构:在水溶液中,其以双偶极离子存在。
HOOC-CH2
CH2-COO-
N+-CH2-CH2-N+
-OOC-CH2
H
H
CH2-COO
㈡、性质:通常用H4Y表示。
1 溶解度小
2 难溶于酸和有机溶剂,易溶于碱。所以常用EDTA的二钠盐。
(Na2H2Y·2H2O)
3 以双极分子存在。在强酸溶液中,结合两个H+而形成六元酸
6、金属指示剂的作用原理及选择原则,熟悉常用金属指示剂 7、掌握准确滴定的条件和滴定结果的计算 8、络合滴定酸度的选择及最高酸度和最低酸度的计算 9、混合离子分步滴定的判据
重点、难点:
1、络合平衡中有关各型体的浓度的计算方法 2、副反应对络合平衡的影响,掌握表观形成常数的有关计算。 3、滴定过程中金属离子浓度的变化规律 4、准确滴定的条件和滴定结果的计算 5、络合滴定酸度的选择及最高酸度和最低酸度的计算
络合滴定中酸度的控制

N
α Y(H)
α Y( N)
α Y = α Y(H) + α Y( N) 1
pH与 lg α Y 的关系图(右)
15 10 5 0 0
lgαY
lgα Y(N)
2 4 6 8
lgα Y(H)
10 12 14 pH
(1)若α Y ( H ) >> α Y ( N ) 时α Y ≈ α Y ( H )
pH
12 11 10 9 8 7 6 5 4 3 2 1 0 lgk
Mg
Ca
Mn Al Zn Pb Cu Fe Bi 8 10 12 14 16 18 20 22 240
2
4
6
8
10 12 14 16 18 20 22 24
lgαY(H) α
2
2、最低酸度 、
[OH ] =
lg α Y ( H ) = lg k MY lg k 'MY
查表
(3-22) - )
pH(最低 最低) 最低
当C M =C Y = 0.02mol L1,E t ≤ ± 0.1%,△pM ′ = ±0.2时
由判别式, C sp k 'MY ≥ 6,得 lg M
lg α Y ( H ) = lg k MY 8
酒石酸,EBT 酒石酸 EDTA滴定 滴定
Cu (CN ) 2 4 Zn(CN ) 2 4 PbY 红-蓝(V1mL) )
Cu (CN ) 2 4 Zn 2+ PbY
EDTA滴定 滴定
红-蓝(V2mL) )
wPb =
(CV1 ) EDTA M Pb 1000m s
w Zn
(CV2 ) EDTA M Zn = 1000m s
终点误差与准确滴定的条件(终)

C C ,sa pC Z ,sn p 1 2 .0 0 m 0/l,o Y lY H
根据 lgK', M YlgKMYlg Y
pH 1.0时lg, K'CaY1.0 70.45 1.0 2, lgCC,a spK'CaY8.26 表明p, H 1在 .0时,可以C准 2a 确滴定
M O H M On H
由Ksp [M][OH]n
OH n K spM (OH)n
M
最低酸度 pH14pOH
某金属离子进行络合滴定的最高酸度~最低 酸度之间的酸度范围称为适宜酸度范围。
(只提供了准确滴定的可能性)
pMsp, pMt完全相符或接近,就有可能使滴定误差
达到最小,这是进行络合滴定的最佳酸度。
三、络合滴定中酸度的选择与控制
1.缓冲溶液和辅助络合剂的作用 ⑴缓冲溶液
EDTA= H2YNa2
M + H2Y
MY + 2H+
α Y(H) ↑ ,K’MY↓ ,主反应程度↓ [H+] ↑
α Y(H) ↑ ,指示剂变色不敏锐
络合滴定中常用的缓冲溶液
( XO) pH 5 ~ 6
(EBT) pH 8~10
lg K Zn 1 Y6 p K s . p 5 1,6.9
lgY(H m ) alxg cZ,snp KZn Y 6
2.0 01.5 668.5
查表4可知最高酸度 pH4.0
由Ksp[Zn2][OH -]2确定最低
[O ] H K sp [Z 2 ]n 1 7 .0 61
2
) 6
N
4
–HCl缓冲溶液,不能选择HAc-NaAc缓冲溶
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
5 5
pKa :
EDTA: -pH图
H 6Y 2、H5Y 、H 4Y、H3Y 、H 2Y 2、HY 3、Y 4
0.9 1.6 2.0 2.67 6.16 10.26
1.酸度是影响络合物稳定性的一个重要因素
2.EDTA溶液的配制:乙二胺四乙酸二钠盐Na2H2Y·2H2O
泰山学院化学系分析化学教研室 第六第章十络章合吸滴光定法光度法
剂
2、逐级平衡常数相差不大,络合
配
物组成不固定,无法确定计量关
体
系和滴定终点
有机配体 N (CH2COOH )2
泰山学院化学系分析化学教研室
优点:1、多齿配体,形成鳌合物,
络合物的络合比固定,2、鳌合物
稳定高,络合反应完全程度高;
可以得到明显的滴定终点
4
第六第章十络章合吸滴光定法光度法
4
二、乙二胺四乙酸(EDTA)及其二钠盐的性质
MLn1
L 噲垐Kn垎垐 K1
MLn
Kn
[MLn ] [ MLn 1 ][ L]
K1
[ MLn 1 ][ L] [MLn ]
K1 1 Kn , K2 1 Kn1 , , Kn 1 K1
泰山学院化学系分析化学教研室 第六第章十络章合吸滴光定法光度法
9 9
2、络合物的累积形成常数(b)和总形成常数(bn) 络合物的逐级形成常数的乘积称为累积形成常数
11 11
3、络合剂的质子化常数
络合剂可以与金属离子络合,也可以与H+结合,络 合剂的酸效应。在络合平衡中,常将酸作为氢络合物来 处理,即将络合剂与H+的反应视为络合物的形成反应
NH3
H
噲垐K垎H垐 Ka
NH
4
KH
1 Ka
Kb Kw
104.74 1014.00
109.26
泰山学院化学系分析化学教研室 第六第章十络章合吸滴光定法光度法
1 Ka1
泰山学院化学系分析化学教研室 第六第章十络章合吸滴光定法光度法
13 13
Y 3H ƒ H3Y
b3H
[H3Y ] [Y ][H ]3
[HY ] [Y ][H ]
[H2Y ] [HY ][H ]
[H3Y ] [H2Y ][H ]
K1H
K
H 2
K3H
biH
K1H
K
H 2
K3H
KiH
8 8
(二) MLn(1:n)型络合物 1、络合物的逐级形成(解离)常数
M L 噲垐 K垎1垐 ML Kn
K1
[ML] [M ][L]
K
n
[M ][L] [ML]
ML L 噲垐KKn垐垐21?? ML2
K2
[ML2 ] [ML][L]
K
n1
[ML][L] [ML2 ]
gggggg
gggggg
gggggg
[HiY ] [Y ][H ]i
HOOCH2 OOCH2
NCH2CH2N
H
H
CH2COO CH2COOH
H 4Y 双偶极离子结构
HOOCCH2 HOOCCH2
NCH2CH2N
H
H
CH2COOH CH2COOH
H6Y 2
H6Y 2、H5Y 、H4Y、H3Y 、H2Y 2、HY 3、Y 4
泰山学院化学系分析化学教研室 第六第章十络章合吸滴光定法光度法
1 1
第一节 概 述
配合物
中心离子
配位键
配位原子
配位数
配位体
鳌合物 多齿(基)配体
泰山学院化学系分析化学教研室 第六第章十络章合吸滴光定法光度法
2 2
一、络合滴定中的滴定剂 络合滴定法:以络合反应为基础的滴定分析方法
对
一、形成的络合物要相当稳定,否则不易
络
得到明显的滴定终点
合
反
二、在一定反应条件下,配位数必须固定
10 10
b1
K1
[ML] [M ][L]
[ML] b1[M ][L]
b2
K1K2
[ML2 ] [M ][L]2
[ML2 ] b2[M ][L]2
bn
K1K2
Kn
[MLn ] [M ][L]n
[MLn ] bn[M ][L]n
[MLi ] bi[M ][L]i
泰山学院化学系分析化学教研室 第六第章十络章合吸滴光定法光度法
12 12
对于EDTA的各级质子化常数:
Y H 噲垐K1垎H垐 HY Ka6
HY H 噲垐K2垎H垐 Ka5
H 2Y
K1H
[HY ] [Y ][H ]
1 Ka 6
K2H
[H2Y ] [HY ][H ]
1 Ka 5
H5Y
H
噲垐K6垎H垐 Ka1
H6Y
K6H
[H6Y ] [H5Y ][H
]
6 6
三、金属离子-EDTA 络合物的特点
EDTA:Y (Y4-) 目标金属离子:M 络合物:MY
MY络合物特点:
1. 络合比简单(1:1)
2. 络合物稳定,反应完全程度高
3. 反应速度快 (Al,Cr,Ti等除外)
4. EDTA与无色M络合,络合物无色
EDTA与有色M络合,络合物颜色更深
7
泰山学院化学系分析化学教研室 第六第章十络章合吸滴光定法光度法
M L ƒ ML ML L ƒ ML2
M 2L ƒ ML2
b1 K1
b2
K1 K 2
[ML] [ML2 ] [M ][L] [ML][L]
[ML2 ] [M ][L]2
M nL ƒ MLn
bn
K1K2
Kn
[MLn ] [M ][L]n
bi
K1K2
Ki
[MLi ] [M ][L]i
泰山学院化学系分析化学教研室 第六第章十络章合吸滴光定法光度法
应
(即只形成一种配位数的络合物)
的
三、反应速度要快
要 求
四、要有适当的方法确定滴定的终点
泰山学院化学系分析化学教研室 第六第章十络章合吸滴光定法光度法
3 3
Ag 2CN ƒ Ag(CN )2
CN Ag , Ni2
无机配体 Hg2 Cl , SCN Ag[ Ag(CN )2 ]
络 掩蔽剂、辅 缺点:1、单齿配体,络合物稳定 合 助络合剂 性不高,络合反应进行不够完全;
7
第二节 溶液中各级络合物型体的分布
一、络合物的形成常数 (一) ML(1:1)型络合物
M n H 2Y 2 ƒ MY (N 4) 2H
K离
[M ][Y ] [MY ]
M Y ƒ MY
K MY
[MY ] [M ][Y ]
对于1:1型络合物: K离 1 KMY
泰山学院化学系分析化学教研室 第六第章十络章合吸滴光定法光度法
本章主要内容
6.1 概述 6.2 溶液中各级络合物型体的分布 6.3 络合滴定中的副反应和条件形成常数 6.4 EDTA滴定曲线 6.5 络合滴定指示剂 6.6 终点误差和准确滴定的条件 6.7 提高络合滴定选择性的方法 6.8 络合滴定的方式和应用
泰山学院化学系分析化学教研室 第六第章十络章合吸滴光定法光度法
