上海交通大学无机与分析化学第十章ppt演示文稿
合集下载
上海交通大学2005-2006学年《无机与分析化学》补考试题(节选)

9.( )已知下列反应在标准状态下,皆正向自发进行:
2Fe2+ + Cl2 =2Fe3+ + 2Cl-
2Fe3+ + 2I- = 2Fe2+ + I2
则有关ϕΘ 的大小顺序正确的是:
A、ϕΘI2/I->ϕΘFe3+/Fe2+> ϕΘCl2/Cl-
B、ϕΘFe3+/Fe2+>ϕΘI2/I-> ϕΘCl2/Cl-
反应
Δ r Hmθ/ kJ·mol-1
Δ r Smθ/ J·mol-1·K-1
① CaCO3 (s)
CaO(s) + CO2 (g)
177.85
164.04
② N2 (g) + 3H2 (g)
2NH3 (g)
-92.38
-201.38
2. 已知[Ni(CN)4]2-是反磁性的,而[Ni(H2O)4]2+是顺磁性的;[Fe(CN)6]3-仅有一个单电子, 而[Fe(H2O)6]3+有五个单电子。试画出示意图和运用相关理论来进行解释。
(A)指示剂为有色物质。
(B)指示剂为弱酸或弱碱。
(C)指示剂为弱酸或弱碱,且其酸式或碱式结构具有不同颜色。
(D)指示剂在酸、碱溶液中可呈现不同的颜色。
6.( )在含有大量固体 CaSO4 的溶液中,能使 Ca2+进入溶液的最有效方法是:
(A)加入过量的 H2SO4;
(B)加入过量的 HNO3;
(C)加入 BaCl2 溶液;
11.(
)在下列配离子中,其中分裂能最大的是:
(A)Fe(SCN)63-;(B)Fe(CN)63-;(C)Fe(CN)64-;(D)FeCl4-
二、是非题
( )1. 催化剂能显著的提高反应速率,而且还能改变反应的焓变。
无机与分析化学 PPT课件
第41页/共64页
•从动力学的角度来看,决定反应速率 的一步是氮分子在催化剂表面的吸附分 解反应,这一步所需要的活化能相当高, 反应速率慢。 •而催化剂表面的氨的脱附所需要的活化能 很低,因而反应速率快。
第42页/共64页
化学吸附 表面反应
脱附
N2 2(Fe) 2N(Fe) H2 2(Fe) 2H(Fe) N(Fe) H(Fe) NH(Fe) (Fe) NH(Fe) H(Fe) NH2(Fe) (Fe) NH2(Fe) H(Fe) NH3(Fe) (Fe) NH3(Fe) NH3 (Fe)
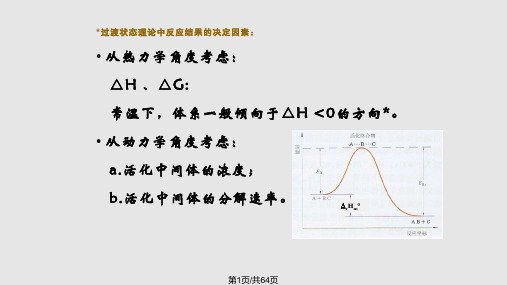
• 焓减、熵减、体积减少的反应;
*从热力学角度考虑:应高压、低温为佳。
• 但该反应的活化能Ea=326.4kJ.mol-1,反应速率在常温下非常慢,无可操作 性;
• 高压对成本的要求较高,能耗大;
第37页/共64页
有关的热力学数据:
组分
fHm0(kJ.mol-1) 温度S与m氨o(产J率.K之-间1.的m关o系l:-1)
二氧化硫的反应等; • 多相催化:反应物与催化剂不同相,一般催化剂为固相。 *多相催化的过程较复杂,含吸附、反应、解吸等过程;与复杂的吸附机理、
传质速率、反应活性等诸多因素有关。
第30页/共64页
第31页/共64页
催化反应举例:
• 2SO2+O2
2SO3 无催化剂参加的反应,活化能较大;
• 若用NO为催化剂,则上述反应可认为分成下列两个活化能较小、反应速率 较快的反应:
15.3
81.5
86.5
89.9
95.4
98.3
2.2
52
64.2 71
84.2
92.6
0.4
25.1
•从动力学的角度来看,决定反应速率 的一步是氮分子在催化剂表面的吸附分 解反应,这一步所需要的活化能相当高, 反应速率慢。 •而催化剂表面的氨的脱附所需要的活化能 很低,因而反应速率快。
第42页/共64页
化学吸附 表面反应
脱附
N2 2(Fe) 2N(Fe) H2 2(Fe) 2H(Fe) N(Fe) H(Fe) NH(Fe) (Fe) NH(Fe) H(Fe) NH2(Fe) (Fe) NH2(Fe) H(Fe) NH3(Fe) (Fe) NH3(Fe) NH3 (Fe)
• 焓减、熵减、体积减少的反应;
*从热力学角度考虑:应高压、低温为佳。
• 但该反应的活化能Ea=326.4kJ.mol-1,反应速率在常温下非常慢,无可操作 性;
• 高压对成本的要求较高,能耗大;
第37页/共64页
有关的热力学数据:
组分
fHm0(kJ.mol-1) 温度S与m氨o(产J率.K之-间1.的m关o系l:-1)
二氧化硫的反应等; • 多相催化:反应物与催化剂不同相,一般催化剂为固相。 *多相催化的过程较复杂,含吸附、反应、解吸等过程;与复杂的吸附机理、
传质速率、反应活性等诸多因素有关。
第30页/共64页
第31页/共64页
催化反应举例:
• 2SO2+O2
2SO3 无催化剂参加的反应,活化能较大;
• 若用NO为催化剂,则上述反应可认为分成下列两个活化能较小、反应速率 较快的反应:
15.3
81.5
86.5
89.9
95.4
98.3
2.2
52
64.2 71
84.2
92.6
0.4
25.1
上海交通大学致远学院2014年秋季学期《无机与分析化学实验(1)》课程教学说明【模板】

**大学致远学院2014年秋季学期
《无机与分析化学实验(1)》课程教学说明
一.课程基本信息
1.开课学院(系):化学化工学院
2.课程名称:《无机与分析化学实验(1)》
3.学时/学分:64学时/ 2学分
4.先修课程:无
5.上课时间:周五6-10
6.上课地点:化学A楼二楼
7.任课教师:陈虹锦,chenhj@
8.办公室及电话:化学楼A楼,********
9.助教:未定
二.课程主要内容(中英文)
1.无机与化学分析基本实验操作技能训练;
2.化学热力学、动力学有关实验(反应速率及平衡常数测定);
3.无机合成实验;
4.综合实验(化合物的合成及组分与含量测定);
5.基本实验仪器的使用练习(电导率仪、pH计、电子天平、分光光度计等)
6.设计实验(兼考核)
三.课程教学进度安排(中英文)
无机与分析化学实验(1)——致远学院(2014)大纲及进度
四.课程考核方式及说明
80%为平时成绩(操作、预习、实验报告等)
20%为考试成绩
五.教材与参考书
实验化学(上)第二版——科学出版社,陈虹锦主编。
无机与分析化学课件

稳定。
例外:Pt,W
三、核外电子的排布和元素周期系
➢电子的分布
按三原则,利用能级图的填充顺序,写出原子的电子排布式 能级组由低(n,l)至高(n,l)、由左至右的次序填入诸能级。 然后在各轨道符号的右上角用数字表示该轨道上的电子数,没有 填入电子的全空轨道则不必列出。 例如,基态钛原子(Z=22)的电子分布为(右上角数字为填入 的电子数):
周期
短周期(一,二,三) 长周期(四,五,六,七)
•按照各元素原子核外电子排布的顺序排列就形成了元素周期表
族
周
期 IA
0
H 1 氢 IIA
Li Be 2 锂铍
He
s区
p区
IIIA IVA VA VIAVIIA 氦
B C N O F Ne
d区
f区
硼碳 氮氧氟氖
Na Mg 3 钠 镁 IIIB IVB VB VIBVIIB VIII
0
1 ⅡA
Ⅲ A Ⅳ A ⅤA ⅥA Ⅶ A
2
3
Ⅲ B ⅣB ⅤB Ⅵ B Ⅶ B ⅦB ⅠB ⅡB
4 s区
5
ns1-ns2
6
d区 (n-1)d1-8 ns2
ds区 (n-1)d10 ns2
p区 ns2 np1-6
7
镧系
锕系
f 区 (n-2)f1-14 (n-1)d0-1 ns2
例 写出下列各原子序数的电子层构型,并指出元素所在周期 表中的周期、族、元素名称及元素符号。 (1) Z = 18;(2) Z = 24;(3) Z = 29;(4) Z = 80
24Cr:1s22s22p63s23p63d54s1,为第四周期ⅥB族、d区元 素;
29Cu:1s22s22p63s23p63d104s1,为第四周期ⅠB族、ds区元素
《无机与分析化学》PPT课件

H+:OH- + :NH3 (H2O)
以H+为标准时,OH-的碱性强于NH3
Ag+:OH- + 2:NH3
[Ag(NH3)2]+ + :OH-
以Ag+为标准时,NH3的碱性强于OH-
4.1.1 酸碱质子理论(proton theory of acids and bases)
1. 相关概念
酸和碱不是彼此分隔的,而是统一在对质子的关系上:
⑶ 盐的水解
H+
H 2 O (l ) (a A q H c ) A O c (H a
H+
N 4 (H a q H 2 O ( l ) H 3 O (a q N 3 ( )H a
H+
C2 O u ) 4 2 ( H H 2 O (H l3 ) O (a q C)u2 O (3 O ( a ))H q
2. 酸碱强度
• 酸碱强度与溶剂有关
HAc在水中是弱酸,而在液氨溶剂中是强酸。这是因 为NH3比H2O接受质子的能力强得多。
H+
HA H c 2 O ( a (H l q 3 O ) ()a q ) ( a ) A q c
H+
HA N c 3 (( l H ) a N 4 q (H a ) q A ( a ) ) c q
HA + H2O = H3O+ + A-
(半反应) (半反应)
(酸碱反应)
H+ + A-(碱1) = HA(酸1) H2O(酸2) = HO-(碱2) + H+
A- + H2O = HO- + HA
(半反应) (半反应)
上交大基础化学电子课件第10章氧化还原反应和氧化还原滴定法

学习提示
在氧化还原反应的任一瞬间能迅速建立平衡,其实际 电势与Nernst公式计算值基本相符的电对称为“可逆电 对”,反之则为不可逆电对。
一般来说,两个电对的条件电极电势之差大于0.20 V时, 突跃范围才明显,才有可能进行滴定。差值在0.20~0.40 V时可采用电极电势法确定终点;差值大于0.40 V,可选用 氧化还原指示剂(当然也可以用电极电势法)指示终点。
10.5 常用的氧化还原滴定方法
4. 碘量法的应用示例
(1)维生素C片中维生素C含量的测定
例10-8
例10-8 称取维生素C片0.124 4 g,加新煮沸过的冷纯 化水100 mL和2.00 mol·-1L 的醋酸10.00 mL,溶解后,加 淀粉指示剂1 mL,立即用碘标准溶液(0.050 1 mo-1l·L )滴 定至溶液显浅蓝色为终点。终点时,消耗碘标准溶液11.66 mL。计算维生素C片中维生素C的含量。
10.1.2
10.1氧化还原反应的基本概 念和氧化还原方程式的配平
氧化还原反应方程式的配平
1. 氧化数法
(1)标出相关原子的氧化数。 (2)计算氧化数的改变量并找出基本系数。 (3)反应式中按原则配上系数。 (4)检查反应式两边的氢原子数和氧原子数 是否相等,不等则补充H2O等,或根据已知 条件判断式子两边的缺项。
10.1 氧化还原反应的基本概 念和氧化还原方程式的配平
2. 氧化数
元素的氧化数也称氧化值或氧化态,是按一定规则给 元素指定一个数字,以表征元素在各物质中的表观电荷 (又叫形式电荷)数。确定氧化数的规则如下:
(1)在单质中,元素的氧化数为零。 (2)在中性分子中,各元素的氧化数的代数和等于 零,单原子离子中元素的氧化数等于离子所带电荷数,在 复杂离子中各元素的氧化数的代数和等于离子的电荷数。 (3)一些元素在化合物中的氧化数:
在氧化还原反应的任一瞬间能迅速建立平衡,其实际 电势与Nernst公式计算值基本相符的电对称为“可逆电 对”,反之则为不可逆电对。
一般来说,两个电对的条件电极电势之差大于0.20 V时, 突跃范围才明显,才有可能进行滴定。差值在0.20~0.40 V时可采用电极电势法确定终点;差值大于0.40 V,可选用 氧化还原指示剂(当然也可以用电极电势法)指示终点。
10.5 常用的氧化还原滴定方法
4. 碘量法的应用示例
(1)维生素C片中维生素C含量的测定
例10-8
例10-8 称取维生素C片0.124 4 g,加新煮沸过的冷纯 化水100 mL和2.00 mol·-1L 的醋酸10.00 mL,溶解后,加 淀粉指示剂1 mL,立即用碘标准溶液(0.050 1 mo-1l·L )滴 定至溶液显浅蓝色为终点。终点时,消耗碘标准溶液11.66 mL。计算维生素C片中维生素C的含量。
10.1.2
10.1氧化还原反应的基本概 念和氧化还原方程式的配平
氧化还原反应方程式的配平
1. 氧化数法
(1)标出相关原子的氧化数。 (2)计算氧化数的改变量并找出基本系数。 (3)反应式中按原则配上系数。 (4)检查反应式两边的氢原子数和氧原子数 是否相等,不等则补充H2O等,或根据已知 条件判断式子两边的缺项。
10.1 氧化还原反应的基本概 念和氧化还原方程式的配平
2. 氧化数
元素的氧化数也称氧化值或氧化态,是按一定规则给 元素指定一个数字,以表征元素在各物质中的表观电荷 (又叫形式电荷)数。确定氧化数的规则如下:
(1)在单质中,元素的氧化数为零。 (2)在中性分子中,各元素的氧化数的代数和等于 零,单原子离子中元素的氧化数等于离子所带电荷数,在 复杂离子中各元素的氧化数的代数和等于离子的电荷数。 (3)一些元素在化合物中的氧化数:
无机与分析化学ppt课件 第一篇 化学反应原理

体解积:分以数CH。4的分体积、体积分数为例。
解法一:思路,
V(CH4)
n(CH4)RT, p总
需先求出n(CH4a)
19
n(CH4) = x(CH4)·n总
47.0
100m ol= 94.0m ol
47.0+ 2.0+ 0.80+ 0.20
9 4 .0 m o l 8 .3 1 4 k P aL K -1m o l-1 2 9 8 K
➢定压过程:始态、终态压力相等,并且过程中始终保 持这个压力。p1=p2
➢定容过程:始态、终态容积相等,并且过程中始终保 持这个容积。V1=V2
a
37
途径: 系统从始态变为终态所经历的过程总和,被称为途径。
状态函数的特点是: 其变化值只取决于系统的起始状态和终了状态,而与系
统变化所经历的具体途径无关。
p=98.70kPa V=2.50L
298K时,p(H2O)=3.17kPa
Mr (Zn)=6a5.39
15
(98.703.17)kPa2.50L n(H2) = 8.314JK-1mol-1298K
=0.0964mol
Zn(s) + 2HCl ZnCl2 + H2(g)
65.39g
1mol
m(Zn)=?
n =n1+ n2+
p
nRT V
a
10
分压的求解:
pB
nBRT V
p
nRT V
pB p
nB n
xB
pB
nB n
pxBp
x B B的摩尔分数
a
11
例题:某容器中含有NH3、O2 、N2等气 体的混合物。取样分析后,其中
解法一:思路,
V(CH4)
n(CH4)RT, p总
需先求出n(CH4a)
19
n(CH4) = x(CH4)·n总
47.0
100m ol= 94.0m ol
47.0+ 2.0+ 0.80+ 0.20
9 4 .0 m o l 8 .3 1 4 k P aL K -1m o l-1 2 9 8 K
➢定压过程:始态、终态压力相等,并且过程中始终保 持这个压力。p1=p2
➢定容过程:始态、终态容积相等,并且过程中始终保 持这个容积。V1=V2
a
37
途径: 系统从始态变为终态所经历的过程总和,被称为途径。
状态函数的特点是: 其变化值只取决于系统的起始状态和终了状态,而与系
统变化所经历的具体途径无关。
p=98.70kPa V=2.50L
298K时,p(H2O)=3.17kPa
Mr (Zn)=6a5.39
15
(98.703.17)kPa2.50L n(H2) = 8.314JK-1mol-1298K
=0.0964mol
Zn(s) + 2HCl ZnCl2 + H2(g)
65.39g
1mol
m(Zn)=?
n =n1+ n2+
p
nRT V
a
10
分压的求解:
pB
nBRT V
p
nRT V
pB p
nB n
xB
pB
nB n
pxBp
x B B的摩尔分数
a
11
例题:某容器中含有NH3、O2 、N2等气 体的混合物。取样分析后,其中
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
例1:配平酸性介质下KMnO4溶液与Na2SO3的反应 [解] 先写出相应的离子反应式:
MnO4- + SO32- + H+ Mn2+ + SO42写出半反应: SO32- SO42- + 2e (反应物缺氧)
MnO4- + 5e Mn2+ (生成物缺氧) 配平半反应:
SO32- + H2O SO42- + 2H+ + 2e (1) MnO4- + 8H+ + 5e Mn2+ + 4H2O (2) 得失电子数相等:(1) 5 + (2) 2得
S2O32-
O -O S O-
S的氧化数为+2, S
+4, (+6) 0, (-2)
• 氧化数是按一定规则指定的形式电荷的数值,它可以是负 数、正数,也可以是分数或零;(原子价一般为整数)
• 在化合物中,某一元素的氧化数是该元素的平均氧化数;
• 需要指出的是氧化数的概念并非人为的形式规定,它是有 实验事实为依据的。例如:实验证实,使1 mol MnO4- 还 原为MnO2 时,需得到 3 mol 电子;而还原为 Mn2+ 时, 需5 mol 电子,它们相应的氧化数变化分别是:(+7) – (+4) = 3 及 (+7) – (+2) = 5。
上海交通大学无机与分析化学 第十章ppt演示文稿
优选上海交通大学无机与分析 化学第十章ppt
基本概念
原子价和氧化数:
1. 原子价的概念:
元素原子能够化合或置换1价原子(H)或1价 基团(OH-)的数目。
2.氧化数的概念(Oxidation Number):
1970年,IUPAC 对氧化值作了以下定义: 氧化数是某元素一个原子的荷电数,这种荷电数由假 设把每个键中的电子指定给电负性更大的原子而求得 (电子偏移情况的“形式电荷”数)。 由于化合物中组成元素的电负性不同,原子结合时, 电子对总是要移向电负性大的一方,从而使化合物中 组成元素原子带有正或负电荷,这些所带的形式电荷 就是该原子的氧化数。 氧化数就是化合物中每元素所带的形式电荷,只说明 现象,不一定符合本质。
氧化还原作用: •氧化还原反应:使某些元素的氧化态发生改变的反应。 其本质是就是电子的得失,(氧化剂与还原剂之间的 反应) •氧化(oxidation):氧化数升高的过程 •还原(reduction):氧化数降低的过程 •氧化剂:氧化数降低的反应物 •还原剂:氧化数升高的反应物 这两种物质相互依存、这两个过程也相互依存,在同 一个反应中同时发生。
2个 “e” 的转 移
共价键
“形式电荷” +1 -2 (电子偏移情况的反映)
称为“氧化数”
规则: 化合物中各元素氧化数的代数和为零。
1)单质中,元素的氧化数等于零。(N2 、H2 、O2 等) 2)二元离子化合物中,与元素的电荷数相一致。 NaCl CaF2
+1,-1 +2,-1
3) 共价化合物中,成键电子对偏向电负性大的元素。
配平原则:氧化剂和还原剂得失电子数相等
方法要点: 1)根据实验,确定产物、反应物在溶液体系中的存在 形式,写出相应的离子反应式(弱电解质、有机物、气 体以分子式表示) 2)将反应物分成两个半反应,即氧化剂的还原反应和 还原剂的氧化反应 3)按物料、电荷平衡原则配平两个半反应 4)根据得失电子数相等的原则确定各个半反应的系数 5)根据反应条件确定反应的酸碱介质,分别加入H+、 OH-、H2O,使方程配平
可见:氧化态与还原态是建立在得失电子的关系上得 电子的物质:氧化数降低、是氧化剂、本身被还原失 电子的物质: 氧化数升高、是还原剂、本身被氧化 氧化还原反应是两个或两个以上氧化还原电对共同作 用的结果,所有的氧化还原反应都可以找到相应的氧 化还原电对。
氧化还原方程式的配平
氧化还原反应方程式的配平 (1)氧化数法(中学学过) (2)离子电子法--本法适用于溶液中的反应
2MnO4- + 5SO32- + 16H+ + 5H2O = 2Mn2+ + 8H2O + 5SO42- + 10H+
氧化态:同一元素高氧化态物质称为氧化态 还原态:同一元素低氧化态物质称为还原态
歧化反应:氧化剂与还原剂是同一种物质
同一种元素不同氧化数的两种物质构成的氧化 还原体系,称氧化还原电对。 表示形式:氧化态/还原态 如:Cu2+/Cu, Fe3+/Fe2+,MnO4-/Mn2+……
共轭关系:
氧化态 + ne = 还原态
且可为分数、零,它只要求化合物的形式电荷为 零即可。
• 原子价只是用于较简单的分子,对于复杂分子,
不知道结构就无法知晓其原子价。而氧化数只是
一种形式电荷,不必知道分子结构。
氧化还原的特征
化学反应分类: 非氧化还原反应:在反应过程中,元素的氧化 数不变,如:酸碱反应、沉淀反应、配合反 应、复分解反应。 氧化还原反应:在反应过程中,反应物与生成 物中有的元素的氧化数发生变化。
运用上述定义时,须遵循以下几条规则:
在离子型化合物中,元素原子的氧化数等于该原子的 离子电荷数; 在共价型化合物中,共用电子对偏向于电负性大的元 素原子后,在两原子中留下的表观电荷数即为它们的 氧化数。 分子或离子的总电荷数等于各元素的氧化数的代数和, 分子的总电荷数为零。
氧化数与电子转移
Fe + Cu2+ = Fe2+ + Cu H2 + 0.5 O2 H 2 O
• 氧化数反映了元素在化合物中的氧化态,因此氧化数又往 往被称为“氧化态”。
• 引入氧化数是为了利于讨论氧化还原反应。
原子价与氧化数: • 理论基础:原子价——离子键与共价键(共享电
子对的概念、表征形成单键的能力); 氧化数——电负性和现代价键理论;
• 两者之间的联系: 原子价一般不变;而氧化数为形式电荷,可变
O: -2 (H2O 等); -1 (H2O2); -0.5 (KO2 超氧化钾) H: +1, 一般情况; -1, CaH2 、NaH
思考题: 确定氧化数
(1)Na2S2O3
Na2S4O6
+2
+2.5
(2)K2Cr2O7 CrO5
+6
+10
(3)KO2
KO3
-0.5 -1/3
注意:1) 同种元素可有不同的氧化数; 2) 氧化数可为正、负和分数等; 3) 氧化数不一定符合实际元素的电子转移情况。
