3发展中的化学电源
发展中的化学电源

第2课时发展中的化学电源[学习目标定位] 1.知道干电池、充电电池、燃料电池等发展中的化学电源的特点。
2.认识提高燃料的燃烧效率、开发高能清洁燃料和研制新型电池的重要性。
3.能正确书写简单化学电源的电极反应式。
一常见的化学电源1.锌锰干电池(1)锌锰干电池是以锌筒为负极,石墨棒为正极,在石墨棒周围填充糊状的MnO2和NH4Cl作电解质。
(2)锌锰电池是一次性电池,放电之后不能充电,内部的氧化还原反应是不可逆的。
负极发生的电极反应为Zn-2e-===Zn2+,正极发生的电极反应为2MnO2+2NH+4+2e-===Mn2O3+2NH3↑+H2O。
(3)锌锰干电池电量小,而且在放电过程中容易发生气涨或漏液,会导致电器设备的腐蚀。
改进措施:①在外壳套上防腐金属筒或塑料筒制成防漏电池;②将电池内的电解质NH4Cl换成湿的KOH,并在构造上进行改进,制成碱性锌锰电池。
2.充电电池(1)充电电池又称二次电池。
充电电池在放电时所进行的氧化还原反应,在充电时又逆向进行,生成物重新转化为反应物,使充电、放电可在一定时期内循环进行。
充电电池中能量的转化电能。
关系是化学能放电充电(2)常见的充电电池①铅蓄电池常作汽车电瓶,电压稳定,使用方便安全。
负极是Pb,正极是PbO2,电解质溶液是硫酸溶液;②镍镉电池以Cd为负极,NiO(OH)为正极,以KOH为电解质,寿命比铅蓄电池长,但镉是致癌物质,废弃镍镉电池如不回收,会严重污染环境;③碱金属中的Li是最轻的金属,活动性极强,是制造电池的理想物质。
锂离子电池是新一代可充电的绿色电池。
3.燃料电池(1)燃料电池是通过燃料气体与氧气分别在两个电极上发生氧化还原反应,将化学能直接转化为电能的装置。
(2)燃料电池与火力发电相比,其燃料的利用率高、能量转化率高。
与干电池或者蓄电池的主要差别在于反应物不是储存在电池内部,而是由外设装备提供燃料和氧化剂等。
(3)以30%的KOH溶液为电解质溶液的氢氧燃料电池的电极反应如下:负极:2H2+4OH--4e-===4H2O(氧化反应);正极:O2+2H2O+4e-===4OH-(还原反应);总反应:2H2+O2===2H2O。
发展中的化学电源教案

发展中的化学电源教案教案:发展中的化学电源一、教学目标:1.了解化学电源的发展历程及作用;2.了解目前常见的化学电源种类;3.掌握化学电源的原理和构成;4.能够根据实际情况选择合适的化学电源,并了解其使用注意事项;5.培养学生的合作能力和实践操作能力。
二、教学过程:1.导入(10分钟)介绍电池的概念,并与学生进行互动交流。
询问学生有哪些常见的电池,以及它们的特点。
2.知识阐释(30分钟)2.1化学电源的发展历程讲解化学电源的发展历程,从伏塔电池、干电池、碱性电池、锂电池到燃料电池的发展,并结合实例进行具体说明。
2.2化学电源的种类介绍目前常见的化学电源种类,包括镍镉电池、镍氢电池、锌锰电池、锂聚合物电池、锂离子电池、燃料电池等,并让学生进行区分和归纳。
2.3化学电源的原理和构成详细讲解化学电源的原理和构成,包括正负极材料的选择、电解质的作用、电池的工作原理、电池内部的化学反应等。
3.实验操作(40分钟)3.1实验前准备准备不同种类的化学电源,如碱性电池、锂离子电池等,并准备测试仪器(如电流表、电压表等)。
3.2实验流程3.2.1分组合作,每组选取一个化学电源进行测试。
3.2.2连接电路,测量电流和电压。
3.2.3记录测量结果,并进行数据分析和比较。
3.3实验总结学生根据实验结果,总结各种化学电源的特点和优缺点,并进行交流和讨论。
4.拓展延伸(20分钟)4.1探索不同用途的化学电源让学生根据所学知识,探索不同用途的化学电源,如手机电池、电动汽车电池等,并了解其在应用中的工作原理和特点。
4.2组织小组竞赛组织学生分小组进行电池构建比赛,要求学生根据实际情景和需求,选择合适的化学电源,并构建一个能够满足特定要求的电池组。
5.总结归纳(10分钟)总结化学电源的发展历程、种类和原理,并让学生进行知识检测和回答问题。
三、教学评价:1.学生的参与度和实验操作能力;2.学生对化学电源的理解程度和运用能力;3.学生在小组竞赛中的表现。
发展中的化学电源

(3)纽扣电池 (Ag-Zn电池)
总反应: Ag2O+ Zn =ZnO+ 2Ag 用途:电子手表、液晶显示的计算器 或一个小型的助听器等
2、充电电池
1、充电电池:氧化还原反应在充电时可以逆向进行。
2、充电电池又称二次电池,能够重复使用至一定的周期。
放电
化学能
电能
充电
手机专用电池
摄 像 机 专 用 电 池 笔记本电脑专用电池
池
用途:广泛用于收录机、无线对讲机、电子闪光灯、 电动剃须刀等。
电极反应:(KOH为电解液)
放电
2NiO(OH) + 2H2O + Cd
充电
2Ni(OH)2+ Cd(OH)2
镉有致癌作用,有被镍氢电池取代的趋势。
H2+NiO(OH)2
放电 充电
Ni(OH)2+H2O
电池中含有大量的重金属如锌、铅、镉、汞、 锰等。据专家测试,一节纽扣电池能污染60 万升水;一节一号电池烂在地里,能使一平 方米的土地失去利用价值。若将废旧电池混 入生活垃圾一起填埋,渗出的重金属物质就 会渗透土壤、污染地下水,进而进入鱼类、 农作物等,破坏人类的生存环境,间接威胁 到人类的健康,有的还能致癌。所以我们不 要乱扔电池,要及时回收。
特点:海洋电池本身不含电解质溶液 和正极活性物质,不放入海洋 时,铝极就不会在空气中被氧 化,可以长期储存。
PH值降低
总反应:CH4 + 2O2 + 2OH- === CO32- + 3H2O
练习:写出甲烷燃料电池(电解质溶液为氢氧化钾溶液)的总方程式: 反应后溶液的pH如何变化?
一、化学电池的分类
1、a是 负 极,
发展中的化学电源

充电
2PbSO4 + 2H2O
Pb+ SO42- -2e- = P43; + SO42- +2e- =PbSO4+2H2O PbO
电池工作一段时间后,电解质溶液的PH 升高
(2)镍镉充电电池: 它是一种体积少,具有残留性记忆的充电电池,可 重复使用500次以上。它以Cd为负极,NiO(OH)为正极, KOH为电解液。广泛用于收录机、无线对讲机、电子闪光 灯、电动剃须刀等,但有毒,废旧电池要回收处理,防 止污染环境。 放电
2H2+4OH--4e-=4H2O
O2+2H2O+4e-=4OH-
KOH
特点:环境友好,外加设备供给氧化剂,高效(理 论利用率达85-90%,实际40-60%)
氢 氧 燃 料 电 池
介质 电池反应: 2H2 +O2 = 2H2O
酸性
负极
正极
2H2 - 4e- = 4H+ O2 + 4H+ + 4e-= 2H2O 2H2 - 4e- = 4H+ O2 + 2H2O + 4e- = 4OH2H2 +4OH-- 4e- = 4H2O
BD )
下列有关爱迪生蓄电池的推断错误的是( A.放电时,Fe是负极,NiO2是正极
B.蓄电池的电极可以浸入某种酸性电解质溶液中 C.蓄电池的电极可以浸入KOH溶液中 D.放电时,电解质溶液中的阴离子向正极方向移动
氢氧燃料电池是一种新 3、氢氧燃料电池 型的化学电池,其构造 总反应:O2+2H2 =2H2O 如图示:两个电极均由 多孔性碳制成,通入的 气体由孔隙逸出,并在 电极表面放电。 电解质溶液为KOH溶液
发展中的化学电源[页3]
![发展中的化学电源[页3]](https://img.taocdn.com/s3/m/cd19e3b0a0116c175e0e4805.png)
发展中的化学电源[页3]发展中的化学电源发展中的化学电源提出问题:甲醇、甲烷燃料电池有什么缺陷,你想如何改进?思考交流:大量化石燃料的燃烧会生成大量的二氧化碳,造成温室效应,开发绿色、清洁燃料。
提出问题:你认为什么燃料最清洁?思考交流:氢气是最清洁、无污染的燃料。
导出:氢、氧燃料电池思考交流:分析正、负极和电子流动方向。
归纳小结并板书:[板书设计]:1.干电池负极锌(失电子)发生氧化反应正极碳棒(得电子)发生还原反应2.充电电池负极铅(失电子)发生氧化反应正极氧化铅(得电子)发生还原反应3.燃料电池负极燃料(失电子)发生氧化反应正极氧气(得电子)发生还原反应归纳总结交流:1.干电池负极锌(失电子)发生氧化反应正极碳棒(得电子)发生还原反应2.充电电池负极铅(失电子)发生氧化反应正极氧化铅(得电子)发生还原反应3.燃料电池负极燃料(失电子)发生氧化反应正极氧气(得电子)发生还原反应[布置作业]:分小组制作“化学电源——环境污染——清洁能源”图片展,倡导学生自觉组织在校园内设置废旧电池回收箱,定时回收废旧电池。
六、学习效果评价设计学生学习评价设计:发展中的化学电源课堂评价量规内容评价要求优良需努力1.学习态度在角色转换中踊跃发言的次数963次及以下2.学习方法在角色转换中分析问题的视角在角色转换中能够站在主要矛盾的分析问题视角。
在老师的适当铺垫下能够站在主要矛盾的分析问题视角。
被老师牵着鼻子走,没有自己的思路。
3.综合能力评价思路清晰、顺畅,能清晰地分析化学电源的正负极,电子流向,在角色转换中,思维活跃,切入点准确,提高了对环境保护的认识。
思路比较清晰、顺畅,基本能清晰地分析化学电源的正负极,电子流向,能够在限定的时间内进行角色转换,并有清晰的思路,提高了对环境保护的认识。
思路不够清晰,不能独立地对化学电源的正负极,电子流向进行准确的分析,在限定的时间内进行角色转换时,被别人牵着鼻子走。
高中化学-发展中的化学电源

• (2)碱性锌锰干电池
电极:Zn为负极,碳棒为正极(MnO2) 电解液:KOH溶液
Zn +2MnO2+2H2O=2MnO(OH)+Zn(OH)2
负极:Zn +2OH- -2e-= Zn(OH)2 正极:2MnO2+2H2O+2e-=MnO(OH)+ 2OH-
2. 铅蓄电池
Pb+PbO2+4H++2SO42-←放充→电电2PbSO4+2H2O
总反应式: Zn+Ag2O+H2O=2Ag+Zn(OH)2
铝——空气——海水电池
1991年,我国首创以铝-空气-海水为材 料组成的新型电池,用作航海标志灯.以 取之不尽的海水为电解质 负极:4Al -12e- = 4Al3+ 正极:3O2 + 6H20 + 12e- = 120H-
电池总反应式为: 4Al+3O2+6H20=4Al(OH)3
2、甲烷燃料电池: (-)CH4 | H+ | O2(+)
ห้องสมุดไป่ตู้
注意:燃料电池总反应式一般为燃 烧方程式(去“点燃”);但当生成物 有后续反应时,加和后续反应.
总反应式: CH4 + 2O2 = CO2 + 2H2O 负极:CH4 - 8e- + 2H2O = 8H+ + CO2
正极:2O2 + 8e- + 8H+ =4H2O (-)CH4 | OH- | O2(+)
中国电池的年产量180多亿只,占世 界电池总产量的30%以上,年消费量 达70-80亿只,但回收率却不足2%。
4、新型燃料电池
发展中的化学电源
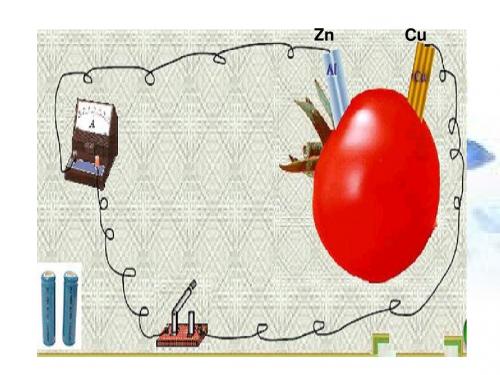
பைடு நூலகம்
1、锌锰干电池
常见有酸性 和碱性两种。 早期为酸性的, 1860年发明。 但放电时间短、 酸液腐蚀外壳。 已逐渐被淘汰。 酸性见右图:
酸性锌锰干电池的负极是Zn,正极是C与MnO2, 电解质NH4Cl其电极反应为: 负极:Zn - 2e- ===Zn2+ 正极:2NH4+ + 2e- === 2NH3 + H2
特点:比普通锌锰电池性能好,比能量和 储存时间均有提高,可适合大电流和连续放 电。
正极:MnO2 + 2e- + 2H2O == Mn(OH)2+ 2OH-
第二节化学能与电能
普通干电池
碱性锌锰电池
锌银纽扣电池
锂离子电池—— 高能、体积小、 重量轻、质能比高
小型高性能燃料电 池
常 见 化 学 电 池
一次电池:如普通干电池、碱性锌锰电池、 锌银纽扣电池等。(只放不充,环境污染)
二次电池:如铅蓄电池、锌银蓄电池、镉镍 电池、锂离子电池等。放电为原电池,充 电为电解池。 (可放可充,发展方向) 燃料电池:如氢氧燃料电池、甲烷燃料电池、 甲醇燃料电池等。(能量很高,前景远大) 其他电池:如海水电池、心脏起搏电池等。
Zn2+ + 2NH3 == Zn(NH3)22+ 2MnO2 +H2 == Mn2O3 + H2O
+
碳棒 MnO2 KOH 锌
碱性锌锰干电池克服了酸性锌 锰干电池的两个缺点。 碱性锌锰干电池的负极是Zn, 正极是C与MnO2,电解质是KOH, 其电极反应为:
—
负极:Zn — 2e- + 2OH- == ZnO + H2O 电池总反应式: Zn + MnO2 + H2O = ZnO + Mn(OH)2
发展中的化学电源

发展中的化学电源在我们的日常生活中,化学电源无处不在。
从小小的手机电池到电动汽车的动力之源,从便携式电子设备到大规模的储能系统,化学电源的发展深刻地改变了我们的生活方式和社会运行模式。
化学电源,简单来说,就是通过化学反应将化学能转化为电能的装置。
它的发展历程可以追溯到很久以前。
早期的化学电源主要是干电池,如常见的锌锰干电池。
这种电池结构简单,价格低廉,但储存的电量有限,而且不能充电重复使用。
随着科技的进步,可充电的化学电源逐渐崭露头角。
其中,铅酸蓄电池是一种经典的可充电电池。
它在汽车启动电源和一些储能领域发挥了重要作用。
铅酸蓄电池的优点是技术成熟、成本相对较低,但它也存在着重量大、能量密度低等缺点。
镍镉电池是另一种曾经广泛应用的可充电电池。
它具有较好的充放电性能和较长的循环寿命。
然而,由于镉是一种有毒金属,对环境有较大危害,镍镉电池逐渐被性能更优、更环保的镍氢电池所取代。
锂离子电池的出现则是化学电源发展的一个重要里程碑。
锂离子电池具有高能量密度、长循环寿命、自放电率低等诸多优点。
这使得它在手机、笔记本电脑、数码相机等便携式电子设备中得到了广泛应用。
近年来,随着技术的不断进步,锂离子电池在电动汽车领域也取得了巨大的成功。
电动汽车的续航里程不断增加,充电时间逐渐缩短,这都离不开锂离子电池性能的不断提升。
在锂离子电池的发展过程中,科研人员一直在努力寻找新的电极材料和电解质,以进一步提高电池的性能。
例如,三元锂电池和磷酸铁锂电池就是两种常见的锂离子电池类型。
三元锂电池能量密度较高,但安全性相对较低;磷酸铁锂电池安全性较好,但能量密度略逊一筹。
除了锂离子电池,还有一些新兴的化学电源技术也在不断发展。
钠离子电池就是其中之一。
钠在地球上的储量丰富,成本相对较低,如果钠离子电池的性能能够得到进一步优化,有望在大规模储能领域发挥重要作用。
燃料电池也是化学电源领域的一个重要发展方向。
燃料电池通过燃料与氧化剂的化学反应产生电能,其效率高、排放低。
发展中的化学电源

失2e+4 0 放电 充电 +2
PbO2+Pb+2H2SO4
得2e-
2PbSO4+2H2O
返回目录
新课导入
课前导学
要点突破
科海泛舟
三、氢氧燃料电池(新型环保电池) 氢氧燃料电池(新型环保电池)
负极:2H2-4e-=4H+ 负极:
失4×e× 0 0 0 -2
返回目录
新课导入
课前导学
要点突破
科海泛舟
我国生产的锌锰干电池, 防腐剂则加入汞的化合物。 我国生产的锌锰干电池, 防腐剂则加入汞的化合物。 科学研究结果表明,汞是严重污染环境的元素, 科学研究结果表明,汞是严重污染环境的元素,具有明显的 神经毒性,对内分泌系统、免疫系统等都有严重影响。 神经毒性,对内分泌系统、免疫系统等都有严重影响。 因此,废旧电池的随意乱扔将给环境留下长期的、 因此,废旧电池的随意乱扔将给环境留下长期的、潜在 的危害, 废旧电池必须回收,一是资源的回收利用, 的危害, 废旧电池必须回收,一是资源的回收利用,变废为 二是防止环境污染。 宝;二是防止环境污染。
NH4Cl NaOH
返回目录
新课导入
课前导学
要点突破
科海泛舟
二、充电电池 充电电池又称 二次 电池,它在放电时所进 电池 它在放电时所进 行的氧化还原反应,在充电时可以逆向进行 在充电时可以逆向进行,使电 行的氧化还原反应 在充电时可以逆向进行 使电 池恢复到放电前的状态。 池恢复到放电前的状态。
科海泛舟
1.了解常用的化学电池。 2.理解燃料电池的工作原理。 3.认识研制新型电池的重要性。
发展中的化学电源

2- 总反应式为:CH4+2O2+2OH-===CO3 +3H2O
若为酸性介质(电解质为稀 H2SO4)电极反应为:
- + 负极: CH + 2H O - 8e ===CO + 8H 4 2 2 + - 正极:2O2+8H +8e ===4H2O
锌锰电池
,负极是 锌 ,正极是 。此类锰电池是一
石墨棒
,糊状填充物是
MnO2 和 NH4Cl 糊
次性电池的原因是 内部的氧化还原反应不可逆 。
特别提醒:糊状是为了增大阴阳离子在两个电极的迁移速率。
锌锰干电池
2.碱性锌锰电池:为了延长电池寿命和提高其性能,人们 将电池内的电解质 NH4Cl换成湿的 KOH,并在构造上作了改 造,制成了碱性锌锰电池。
Hale Waihona Puke 常见化学电源简介举例 一次性电池 干电池 铅蓄电池 负极 锌筒 Pb Cd Li H2 O2 KOH 正极 石墨棒 PbO2 NiO(OH) 电解质 NH4Cl H2SO4 KOH
二次电池
镍镉电池 锂电池
燃料电池
氢氧燃料电池
几种电池的特点 名称 干电池 (一次电池) ①活性物质(发 生氧化还原反应 的物质)消耗到 一定程度后,不 能再使用 ②电解质溶液为 胶状,不流动 普通的锌锰电 池、碱性锌锰电 池、银锌电池等 充电电池 (二次电池) ①放电后可 再充电使活 性物质获得 再生 ②可以多次 充电,重复使 用 铅蓄电池、 锂电池、镍 镉电池等 燃料电池 ①电极本身不包含活性 物质,只是一个催化转换 元件 ②工作时,燃料和氧化剂 连续地由外部供给,在电 极上不断地进行反应,生 成物不断地被排出 氢氧燃料电池、CH4 燃 料电池、CH3OH 燃料电 池等
课件11:2.2.2 发展中的化学电源

卡式录音机、闪光灯、电动玩具、袖珍电视机等
干电池
酸性锌锰电池
碱性锌锰电池 锂锰电池
锌银电池
二、充电电池
充电电池又称二次电池,能够重复使用至一定的周期。
充电电池:氧化还原反应在充电时可以逆向进行。
化学能
放电 充电
电能
笔
摄 像 机 专 用 电 池
记 本 电 脑 专 用 电 池
手机专用电池
1. 铅蓄电池
氢氧燃料电池工作原理:
总反应:2H2 + O2 ==2H2 O
通入的气体在电极表面放电,电池只是作为一个反应器。 与其它电池区别:反应物不是储存在电池内。
氢氧燃料电池的电极反应
介质 酸性(H2SO4)
中性 碱性(KOH)
负极 正极 负极 正极 负极 正极
电池反应: 2H2 +O2 == 2H2O
废电池混在垃圾中,国不的仅很造多成商金店属要资求源顾的客浪在费购。买(据电报池道时,,全同国的电池年消耗量 为30亿只,因疏于回时收要而把丢废失旧铜电7池40交吨回,商锌店1.6;万日吨本,的锰分粉类9.垃7万吨。)而且普通干 电池里含有的镉和汞圾两箱种里元有素一会种污专染门环放境废(污旧染电土池壤的和黄水色源垃)圾。(若进入人类的食物 链,就会发生“水俣箱病,”垃(汞圾中箱毒的)投和入“口痛有痛三病个”,(镉分中别毒标),有这普两种工业公害病, 都在日本发生过,造通成电很池多、人纽死扣亡电。池为和防其止他悲电剧池重。演,) 所以我们应该把废旧电 池与其他垃圾分开,集中回收。
电池的历史
发 明
批
生 产镍 氢锂砷化 镓薄 Nhomakorabea世界
第 一 个 电 池
可量可
充 电 铅 酸 电 池
高一化学必修2_《发展中的化学电源》精品课件

化学
4、科学家近年来研制出一种新型细菌燃料电池,
利用细菌将有机物转化为氢气,氢气进入以磷酸为
C 电解质的燃料电池发电.电池负极反应为( )
A.H2 -2e-+2OH-=2H2O B.O2+4H++4e-=2H2O
C.H2 - 2e- =2H+
罪魁祸首就是汞,汞进入海洋的主要途径是工业废水、 含汞农药的流失以及含汞废气的沉降。科学试验证实, 人体血液中汞的安全浓度为1微克/10毫升,当到达5-10 微克/10毫升时,就会出现明显中毒症状。
三、废电池对环境的危害和处理
化学
“血铅污染事件”
铅能够引起神经衰弱、手足麻木,消化不良,血液中 毒和肾损伤等症状。“血铅污染事件”的起因一方面是部 分用铅企业长期忽视污染治理、导致铅污染物未经处理流 入大气、水、土壤,造成严重的铅污染;另一方面,大量 的废旧铅蓄电池缺乏较环保的处理方法,容易铅酸外泄, 造成严重的环境污染。
三、废电池对环境的危害和处理
化学
电池中含有汞、镉、铅等有毒金属。随意丢 弃废电池会对环境造成严重的污染。
上世纪50年代,震惊世界的日本“水俣病”就是因汞中 毒引起的。
三、废电池对环境的危害和处理
化学
1956年,日本水俣湾附近发现了一种奇怪的病。 症 状表现为轻者口齿不清、步履蹒跚、面部痴呆、手足麻 痹、感觉障碍、视觉丧失、震颤、手足变形。重者神经 失常,或酣睡,或兴奋,身体弯弓,直至死亡。
1、干电池(锌锰电池)
化学
该电池的特点: (1)开路电压为1.55V~1.70V; (2)原材料丰富,价格低廉; (3)便于携带,使用方便。 缺点 :电量小,放电过程中容易产生胀气或漏液。 不能提供稳定电压。低温性能差,在-20℃即不能 工作。
