2017年医疗器械经营企业飞行检查情况汇总表
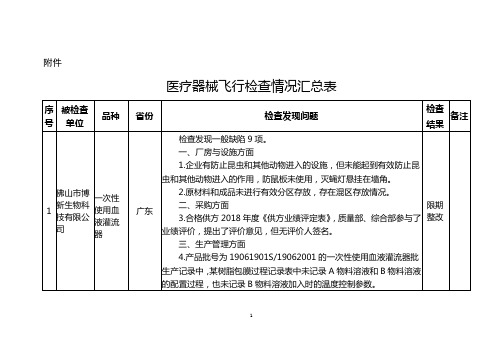
医疗器械飞行检查情况汇总表
五、生产管理方面
8.现场运行中的立式注塑机,正在进行滤网注塑成型,注塑机操作屏幕显示实际注塑时间为4秒,企业操作人员记录为5秒,记录与实际运行时间不符。
六、销售和售后服务方面
附件
医疗器械飞行检查情况汇总表
பைடு நூலகம்序号
被检查
单位
品种
省份
检查发现问题
检查结果
备注
1
佛山市博新生物科技有限公司
一次性使用血液灌流器
广东
检查发现一般缺陷9项。
一、厂房与设施方面
1.企业有防止昆虫和其他动物进入的设施,但未能起到有效防止昆虫和其他动物进入的作用,防鼠板未使用,灭蝇灯悬挂在墙角。
2.原材料和成品未进行有效分区存放,存在混区存放情况。
3.质量手册(编号YQ/QM-D/00)P9的07节质量手册发放部门清单中发放部门/人员包括总经理、管理者代表、副总经理、生产部、技术质量部、总经办、综合部,在P24的05规定手册的发放对象为总经理、管理者代表、质量技术部、生产部长、综合部,前后不一致;在P25的4节规定发放《质量手册》时填写发放号,在公司的文件和资料发放登记表(编号YQ/QR4.2.4-01)中质量手册发放记录没有发放号,公司现场提供的受控质量手册上也没有发放号,且发放记录为总经理、管理者代表、生产部、技术质量部、总经办,与前述规定不一致。
9.2019年5月《医疗器械销售记录表》(编号QWGSMKJ-4/SOR-XS-019)中无购货单位地址、联系方式等内容。
七、不合格品控制方面
10.企业未制定报废产品处置制度。
2017年医疗器械企业飞行检查不合格项盘点

现场发现洁净区人员裸手操作,仅使用一种消毒剂。
公司对手消毒间隔时间及消毒
29
剂种类更换要求无文件规定;洁净区内个别操作人员留有长指甲,直接接触产品。
公司规定洁净区生产人员穿连体洁净工作服,现场发现部分员工穿着未包覆膝盖以
30
下的参观服,公司解释这些员工为新入职员工,其洁净工作服尚未定制完成。
生产部经理为大专学历,不符合《员工任职基本要求》(文件编号MA-HR-06-01)31
中规定的生产部负责人应为本科及以上学历的要求。
、厂房和设施序号不合格项描述
10 12 13 17 18 21
22 企业生产体外诊断试剂产品具有不连续性,空气净化系统停机时间较长,企业尚未对不同停机时间后再次开启空气净化系统所需采取的措施进行相应的验证和规定。
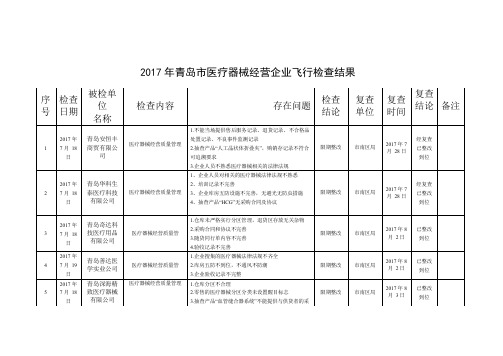
2017年青岛医疗器械经营企业飞行检查结果
序 检查 号 日期
2017 年 1 7 月 18 日
被检单 位 名称
青岛安恒丰 商贸有限公 司
检查内容
存在问题
1.不能当场提供售后服务记录、退货记录、不合格品
检查 结论
复查 单位
复查 复查 结论 备注 时间
经复查 已整改 到位
医疗器械经营质量管理
处置记录、不良事件监测记录 2.抽查产品“人工晶状体折叠夹”,购销存记录不符合 可追溯要求 3.企业人员不熟悉医疗器械相关的法律法规 1、企业人员对相关的医疗器械法律法规不熟悉 限期整改 市南区局
青岛立菲生 物技术有限 公司 青岛医潞曙 医疗管理有 限公司 青岛英力医 疗设备有限 公司 黄岛区美洁 明眼镜店 青岛创新视 界眼镜有限 公司 青岛高产贸 易有限公司 青岛宏昌顺 经贸有限公 司 青岛森泽生 物科技有限 公司 青岛西海岸 润康商贸有
医疗器械经营质量管理
经复查 已整改 到位
2017 年 8 月 4日
经复查已整改 到位 经复查 已整改 到位 经复查
医疗器械经营质量管理
限期整改
黄岛区局
已整改 到位 经复查 已整改 到位 经复查 已整改 到位 经复查 已整改 到位 经复查 已整改 到位 经复查 已整改
日
限公司 青岛华博医 疗器械有限 公司 东丽医疗科 技(青岛)股 份有限公司
3、有特殊温度求的器械库房,没有使用有效的监测 设备 1.企业经营各种质量管理制度未修订。 医疗器械经营质量管理 2.主管检验师不在岗。 3.库房温度(现场显示 32℃) 、湿度不符合医疗器械 储存条件。 1.公司维修记录记载维修内容符合医疗器械不良事件 医疗器械经营质量管理 上报要求,经查该企业未上报不良事件。 2.由于该企业仓库设立在开发区未进行检查。 1.公司提供不出人员档案、培训档案和相关质量管理 制度。 限期整改 即墨区局 限期整改 即墨区局
2017年4月医疗器械飞检缺陷项目总结

2017年4月国家局共飞检了6家医疗器械单位,其中5家为体外诊断试剂企业,现将这5家体外诊断试剂的缺陷项进行了汇总分析:5家单位的缺陷项目一共有72条,其中机构与人员7条、厂房与设施11条、设备12条、文件管理7条、设计开发5条、采购8条、生产管理8条、质量控制10条、销售和售后服务1条、不合格品控制1条、不良事件监测、分析和改进2条。
机构与人员的缺陷除了体检外,其他项目不论是培训还是人员操作均体现在与规定不符,可以挂靠到培训不到位,实际上还是在管理中没有做到写我所做,做我所写。
厂房与设施的缺陷除了硬件上的设计缺陷外,还体现在文件缺失和管理职责不明,需要各企业首先按照法规的要求对硬件设施进行维护与管理,并在日常管理时制定明确的文件制度,有效的对厂房和设施进行管控。
设备的缺陷一个是初中效的压差监控,好多企业都有遗漏,另外一个主要是计量和验证,尤其是计量院出具的计量报告,需要对计量结果进行有效性确认,因为报告一般不会明确是否合格,只是给你一个偏差范围,其次的验证主要体现在方法验证和效果验证,就是说需要对你文件规定的方法出具一个合理的数据分析报告,表明你的文件规定和方式方法可以达到你的预期效果,每个规定都要有出处(如空调停机后恢复的评估、消毒效果)。
文件管理的缺陷有两条都跟收集外来文件有关,需要时刻关注新的法规标准更新,其次就是文件管理的规定一定要细化,该如何进行文件升级、如何进行文件上内容的修改,如何回收作废文件和记录,并且对细化的内容培训到位,能够良好的实施。
设计开发的缺陷主要为设计评审的缺失,该有的文件一定要有,该有的记录一定要存在,针对冻融次数这个问题,我们需要明确,在工艺中不论是时限还是次数,对产品质量属性存在直接影响的,都应该有测试或者验证,来表明我们这个参数的制定是合理的。
采购的缺陷除了两条为缺失文件标准外,另外的几条均是文件与实际不匹配,没有按照规定的程序或者标准执行。
生产管理的缺陷为关键工序或者特殊工序的影响因素评估不到位,近效期物料的使用未评估,其他内容也是与文件规定的操作方式不一致。
2017年(下半年)四川省医疗器械飞行检查结果统计表

检查中发现该院购进验收记录中个别品种记录事项不全,记录中缺少产品注册证号,规格等。
第八条
该院对冷链产品的验收中存在缺陷,验收记录中未记录冷链产品的起运温度、在途温度和到达温度。
成都顺雅医疗用品有限公司
《医疗器械生产质量管理规范》
第六条
未查见管理评审资料和记录,参会人员未签到。
第十一条
抽查5人健康体检证明已于2017年3月21日到期后,至检查之日未进行健康体检。
成都华信高科医疗器械有限责任公司
《医疗器械生产质量管理规范》及相关附录
第八条
查看了质量部部长冉定君的培训记录,未见YY/T0316-2016、YY/T 0287-2017及国家新颁布实施的相关法律法规的学习记录。
无菌附录(2.1.4)
在洁净区女二更发现已使用和未使用洁净服混放,无法有效区分。
无菌附录(2.2.16)
第三十二条
发热丝绕圈工艺更改,作业指导书未体现变更后的操作示例。
第六十二条
销售记录全,销售出库单上发货人,审核人未签字。
第六十六条
对顾客反馈的信息收集不全,统计表数据与收集记录数据相差明显,如9月份收集顾客反馈信息记录60例,而统计表数据为269例。
第六十九条
2015年湖北省、辽宁省2批次省级抽验不合格,企业收集到有不合格品报告,但未及时按体系文件要求进行整改。
第十七条
原料库未设置不合格品区(证据见照片),原材料仓库内设置的待检区,实为保管员办公区,摆放有办公桌、电脑、文件等物品。
第四十七条
未对义齿中间品超声清洁做验证。
第五十七条
该企业检验使用的卡尺无检定标识。
第六十九条
销售到医疗机构发现产品不合格时,企业未采取召回措施。
南海区医疗器械经营企业双随机飞行检查结果
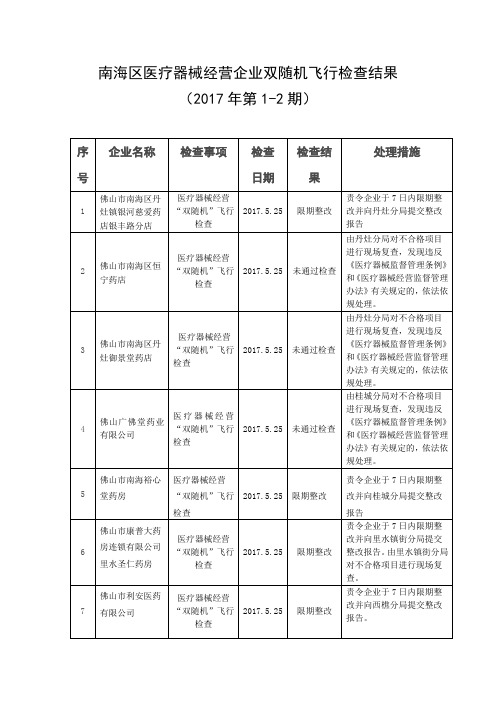
2017.1.5
通过检查
无
24
佛山杨掌柜医药有限公司南海万科金域国际花园分公司
医疗器械经营“双随机”飞行检查
2017.1.5
限期整改
责令企业于7日内限期整改并向桂城分局提交整改报告
25
佛山市福济民医药有限公司南海桂城夏东分店
医疗器械经营“双随机”飞行检查
2017.1.5
限期整改
责令企业于7日内限期整改并向桂城分局提交整改报告
8
珠海嘉伦药业集团光彩大药房连锁有限公司健杰分店
医疗器械经营“双随机”飞行检查
2017.5.25
未通过检查
由西樵镇街分局对不合格项目进行现场复查,发现违反《医疗器械监督管理条例》和《医疗器械经营监督管理办法》有关规定的,依法依规处理。
9
佛山市南海金鑫药房
医疗器械经营“双随机”飞行检查
2017.5.25
医疗器械经营“双随机”飞行检查
2017.1.5
限期整改
责令企业于7日内限期整改并向里水分局提交整改报告
39
广东林和药业连锁有限公司元岗大药房
医疗器械经营“双随机”飞行检查
2017.1.5
通过检查
无
40
佛山市大和谐开心大药房有限公司
医疗器械经营“双随机”飞行检查
2017.1.5
通过检查
无
41
佛山大参林连锁药店有限公司南海丹灶横江分店
4
佛山广佛堂药业有限公司
医疗器械经营“双随机”飞行检查
2017.5.25
未通过检查
由桂城分局对不合格项目进行现场复查,发现违反《医疗器械监督管理条例》和《医疗器械经营监督管理办法》有关规定的,依法依规处理。
医疗器械经营企业飞行检查现场记录表

医疗器械供货方的随货同行单信息不全。现场抽查医疗器械“一次 性末梢采血针”,未能提供有该医疗器械信息的配送单。
※5.38.1 药店未对到货医疗器械(主要是连锁门店间调剂医疗器械)进行逐
批验收。现场抽查医疗器械“一次性末梢采血针”,未对该产品进行
5.38.2
验收直接上柜销售。 未如实查验医疗器械的检验报告及其他证明文件。现场抽查医疗器
主要缺陷和问题及其判断依据
本表中所列出的缺陷和问题,只是本次飞行检查的发现,不代表企业缺陷
和问题的全部。建立与本企业生产/经营产品特点相适应的质量管理体系并保持
其有效运行,是医疗器械生产、经营企业的法定责任。
依据条款
缺陷和问题描述
规范现场 指导原则
检查发现以下一般缺陷 2 项,严重缺陷 1 项:
5.36.2
——
检查目的和范围 飞行检查
检查依据
《药品医疗器械飞行检查办法》 、 《医疗器械经营质量管理规范》
姓名
单
位
பைடு நூலகம்
观察员
龚泽洪
江川区市场监督管理局
企业主要现场 配合人员
姓 名 职务 刘雪娇 店长
余艳华 企业质量
负责人
职称 无
执业药师
所在部门
云南鸿翔一心堂药业(集团) 股份有限公司江川湖滨路连 锁店 云南鸿翔一心堂药业(集团) 股份有限公司江川湖滨路连 锁店
械“一次性末梢采血针”,现场无配送单、无检验报告、无注册证。
检查组成员 签字 企业
负责人或其 授权人签字
组员 组长
观察员
企业负责人签字(盖章) 年月日
医疗器械经营企业飞行检查现场记录表
企业名称 经营地址 仓库地址 检查日期 经营方式
医疗器械飞行检查情况汇总表【模板】

七、不合格品控制方面
10.企业未制定报废产品处置制度。
限期
整改
4
滁州国康医疗仪器有限公司
高电位治疗仪
安徽
检查发现一般缺陷12项。
一、厂房与设施方面
1.辅料仓库中电解电容货位卡记录的结存数量为31个,现场清点实际存放的电解电容为62个,记录与实际不符。
六、质量控制方面
10.医用泄漏电流测试仪(规格型号:MS2621G-1)检定证书显示该设备2017年检定有效期为2017年11月21日至2018年11月20日,2018年检定有效期为2018年12月4日至2019年12月3日,查该设备使用记录,曾于2018年11月22日被使用。
二、文件管理方面
2.《文件控制程序》(编号GK/CX-001-2016)未对部分体系文件的保存期限进行规定。
3.企业未能提供成品库温湿度记录。
三、设计开发方面
4.《设计和开发控制程序》(编号GK/CX-008-2016)中无风险管理要求内容。
5.针对2018年度国抽不合格情况,企业对产品进行了设计更改,但未提供设计更改记录。
9.企业未按照公司制定的《不良事件控制程序》要求对2018年全年度的医疗器械不良事件监测情况进行数据分析。
限期
整改
2
**市西耐德医疗器械有限公司
牙科光固化机
广东
检查发现一般缺陷12项。
一、机构与人员方面
1.个别接触产品的生产工人无健康档案。
二、厂房与设施方面
2.公司物品贮存记录中的锂电池记录数量与库房中实际贮存数量不一致。
三、文件管理方面
2017年医疗器械经营企业飞行检查情况汇总表

26.
武汉宝林顺医疗器械有限公司
武汉市蔡甸区珠山湖大道230号奥福多工业园1栋4层
武汉市蔡甸区珠山湖大道230号奥福多工业园1栋4层
熊智林
1、企业管理人员对新的医疗器械监督管理法律法规不熟悉;
2企业对质量负责人和相关岗位人员进行培训的内容及记录不完整;
3、企业直接接触医疗器械的新入职员工未进行体检;
武汉经济技术开发区东风大道66号,宏松大酒店一楼
武汉经济技术开发区东风大道66号,宏松大酒店一楼
陈磊
1、采购记录未列明部分医疗器械的注册证号或备案凭证号;
2、冷藏医疗器械,未在冷库内待验,销售凭证未列明储运条件;
3、进货查验记录不真实,查该公司2017年7月31日,养护记录显示需要冷藏的,医疗器械,TBA总胆汁酸检测试剂盒(循环酶法)在库数量为四盒但该公司不能提供2017年7月31日冷库运行记录及温湿度监测数据;
武汉市洪山区书城路170号,鸿城家园六号楼0706室
武汉市洪山区书城路170号,鸿城家园六号楼0706室
汪训平
1、进货查验记录不完整;
2、通过询问发现,企业负责人质量负责人对医疗器械法规不熟悉;
*3、未收集供货商授权委托书未收集部分供货商资质;
*4、现场未见企业原始采购记录,(仅见供货商应税务劳清单);
3、企业对质量负责人及各岗位人员进行培训内容及记录不完整,未达到预期效果;
4、企业库房分区不合理,待验区库放有办公桌椅;
5、医疗器械贮存作业区与生活区分隔不明显。
限期整改
20.
武汉双好药业有限公司
武汉市江汉区青年路153号嘉鑫大厦15层B1501、B1502室
湖北省武汉市黄陂临空经济开发区临空北路3号鸿鹄工业园3号楼三层302
精选干货-2017年医疗器械飞行检查不合格项盘点(下)

42*
42*
43 44 45 46 47 48 49 50 51 52 53* 54* 55 56 57 58 59 60 61 62 63 64 65 66 67 68 69 70
1)抽查组件20170418批“软管”《注塑、移印、挤(吹)塑工序流转卡》,使用PVC导管料(输 血(液)器具用软聚氯乙烯塑料)原料批号为170101,查看该批原材料进货检验报告、出入库 台账等记录,显示2017年仅购进一批PVC导管料,账面库存8700公斤,实际现场没有。现场仓库 存放PVC导管料批号为170418,无相应原料检验记录、无对应发放、使用记录。 2)抽查组件20170405批“调节轮”《注塑、移印、挤(吹)塑工序流转卡》,使用聚乙烯原料 批号为170102,情况同上,账面库存4500公斤,实际现场未发现。现场仓库存放聚乙烯批号为 170312,无相应原料检验记录、无对应发放、使用记录。 3)抽查组件20170405批“穿刺器”《注塑、移印、挤(吹)塑工序流转卡》,使用ABS的原料批 号为170116,情况同上,显示账面库存5500公斤,实际现场未发现。现场仓库存放ABS批号为 170326和170308,无相应原料检验记录、无对应发放、使用记录。 2. 查看一次性使用输液器带针(批号:20170510)批生产记录、灭菌记录、成品请验单等显示 该批批量为100箱,现场存放在解析库,但在环氧乙烷灭菌柜(设备编号A07-03)内,发现额外 16箱上述批号半成品,不能追溯来源。 成品检验紫外吸收光谱仅做单一波长吸光度值,未按标准要求进行连续扫描并评价。 成品放行单未包括生产中不合格、紧急放行等情形处置、产品标签/说明书内容、版本审核等内 留样观察室未装满的留样产品均无留样标识(如:压力延长管,一次性使用输注泵等)。 万级电子天平操作台无防震措施,影响天平正常使用。 1.检验用滴定管、刻度吸管、容量瓶等计量器具均未提供检定校准证书;女二更压差计无检定 2.查现场,微粒分析仪放置于普通环境。 查170524批检验记录,无硫代硫酸钠、高锰酸钾标准滴定溶液的配制记录。 查留样室,未配备温湿度计。 查《工艺用水管理制度》(文件编号:C.KT/7.5(C1)-01),要求纯化水电导率应小于2μs/cm,查 纯化水全性能检测报告,未见原始记录;查现场,碱性碘化汞钾(生产日期:2014年8月4日)试 剂瓶底部有絮状物,已变质。 洁净区内暂存库未划分区域;酒精存放库房未按《酒精管理制度》的要求进行每日的仓库温度 记录监控。 吸附剂为白色微小微粒(50目),网布亦为白色,冲水环境下无法有效观察网布上是否吸附颗 一次性使用输液器带针(生产批号20170321)批准放行签署时间2017年3月23日,批检验报告出 具时间为2017年4月6日。 企业的无菌、微生物限度、阳性对照间共用一套空调系统。阳性对照室检测使用超净工作台。 编号为Z-1的细菌培养箱中的温度计无编号未检定,并且直接放置在培养箱的内壁;电子天平未 按规定放置在防震工作台。 企业未明确其中间品的存储环境和存放时间。 一次性使用输液器带针(生产批号20170321)实际留样数量为36套,但留样台帐显示为35套。 未查见生产批号20150118、型号规格HJZ-03的一次性使用无菌活检针的留样观察样品。 生物准备室冰箱内放置的营养琼脂培养基(生产批号20140221-00,有效期至2017-02-20)已失 化学实验室台面放置的酚酞指示剂、铅标准液已于2016年10月13日失效,甲基红指示液已于 2016年12月7日失效。 企业提供的输液针微粒实验原始记录未保存微粒分析仪测定的原始数据。 未制定物理试验室使用的通风橱试验设备的使用方法。 洁净区一更外压力表(编号:ID-JCS-66和ID-JCS-42)校准有效期在2014年7月过期。洁净区的空 调系统初、中效过滤器压力表未校准。 纯化水检测规程(编号:ID-GL-SZGL-4)未规定每次检测均包含总送水口、总回水口及管路最远 端取样点。 AET/QP7.6(C)—01光学测量仪(经济型三次元)首次确认报告评估内容与仪器的实际功能不一 TC4供应商提供了原材料成分、晶相等第三方检验报告,但企业未对检验机构的第三方检验资质 进行确认,也未说明相关检验结论能否作为成品检验的相关分项结果。 未按成品检验规程要求进行成品表面缺陷的评价并制定内控标准。 成品放行程序中未包括生产中不合格、紧急放行、返工返修处置和产品标签说明书版本审核等 内容。 制水车间的压力表( 2个)未进行校准。 查工艺用水制水间的操作间,用于盛装检验水样的容器无明显标识,无法区分纯化水和注射用 水。
2016、2017年医疗器械飞检统计清单
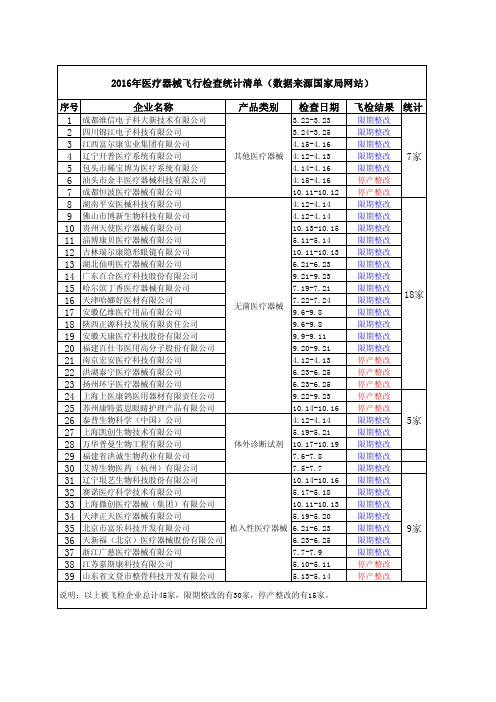
1 2 3 4 5 6 7 8 9 10 11 12 13 14 15 16 17 18 19 20 21 22 23 24 25 26 27 28 29 30 31 32 33 34 35 36 37 38 39
成都维信电子科大新技术有限公司 3.22-3.23 四川锦江电子科技有限公司 3.24-3.25 江西富尔康实业集团有限公司 4.15-4.16 辽宁开普医疗系统有限公司 其他医疗器械 4.12-4.13 包头市稀宝博为医疗系统有限公 4.14-4.16 汕头市金丰医疗器械科技有限公司 4.15-4.16 成都恒波医疗器械有限公司 10.11-10.12 湖南平安医械科技有限公司 4.12-4.14 佛山市博新生物科技有限公司 4.12-4.14 贵州天使医疗器械有限公司 10.13-10.15 淄博康贝医疗器械有限公司 5.11-5.14 吉林瑞尔康隐形眼镜有限公司 10.11-10.13 湖北仙明医疗器械有限公司 6.21-6.23 广东百合医疗科技股份有限公司 9.21-9.23 哈尔滨丁香医疗器械有限公司 7.19-7.21 天津哈娜好医材有限公司 7.22-7.24 无菌医疗器械 安徽亿维医疗用品有限公司 9.6-9.8 陕西正源科技发展有限责任公司 9.6-9.8 安徽天康医疗科技股份有限公司 9.9-9.11 福建百仕韦医用高分子股份有限公司 9.20-9.21 南京宏安医疗科技有限公司 4.12-4.13 洪湖泰宁医疗器械有限公司 6.23-6.25 扬州环宇医疗器械有限公司 6.23-6.25 上海上医康鸽医用器材有限责任公司 9.22-9.23 苏州康特蓝思眼睛护理产品有限公司 10.14-10.16 泰普生物科学(中国)公司 4.12-4.14 上海凯创生物技术有限公司 5.19-5.21 万华普曼生物工程有限公司 体外诊断试剂 10.17-10.19 福建省洪诚生物药业有限公司 7.6-7.8 艾博生物医药(杭州)有限公司 7.5-7.7 辽宁垠艺生物科技股份有限公司 10.14-10.16 赛诺医疗科学技术有限公司 5.17-5.18 上海微创医疗器械(集团)有限公司 10.11-10.13 天津正天医疗器械有限公司 5.19-5.20 北京市富乐科技开发有限公司 植入性医疗器械 6.21-6.23 天新福(北京)医疗器械股份有限公司 6.23-6.25 浙江广慈医疗器械有限公司 7.7-7.9 江苏嘉斯康科技有限公司 5.10-5.11 山东省文登市整骨科技开发有限公司 5.13-5.14
2017年山东省医疗器械使用单位飞行检查结果
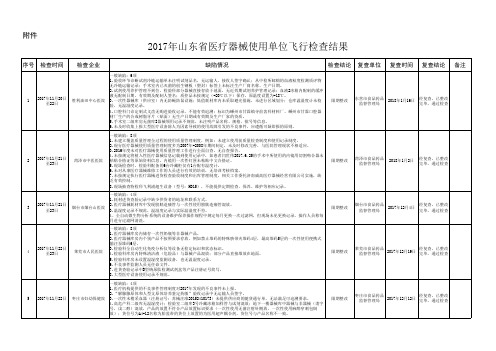
8.大型医疗设备使用记录不规范。
限期整改
莱芜市食品药品 监督管理局
2017年12月19日
经复查,已整改 完毕,通过检查
Hale Waihona Puke 一般缺陷:4项1.医疗机构提供的不良事件管理制度对2017年发现的不良事件未上报。
5
2.“解腺腺原体和人型支原体培养鉴定药敏”验收记录中无运输人员签字。 2017年11月22日 枣庄市妇幼保健院 3.一次性末梢采血器(注册证号:苏械注准20152410173)未提供供应商的随货通行单,无法满足可追溯要求。
3.2016年度未对医疗器械使用质量管理工作进行全面自查,无自查报告。
2
2017年11月21日 至23日
菏泽市中医医院
4.未按规定将植入性医疗器械信息记载到使用记录中,如患者闫世伟2017.6.25的手术中所使用的内镜用切割吻合器未 粘贴合格证等原始资料信息,内镜用一次性钉匣未粘贴中文合格证。 5.现场检查时,检验科配备的6台冷藏柜仅有1台配有温度计。
序号 检查时间 检查企业
缺陷情况
检查结论 复查单位 复查时间 复查结论 备注
一般缺陷:10项
1.一次性器械库(供应室)内温湿度计未校验,无温湿度记录;低值耗材库无防鼠防蝇设施。
2.牙种植体AnKylos C/X 批号B160009965购进验收记录无复核人签字,随货同行单无供货单位盖章。
3.手术室二级库内奥斯迈HC型接骨螺钉(26盒)规格3.5*24、 5.0*34、5.0*30、5.0*26、3.5*22、3.5*44等无购进验
附件
2017年山东省医疗器械使用单位飞行检查结果
序号 检查时间 检查企业
缺陷情况
检查结论 复查单位 复查时间 复查结论 备注
2017年医疗器械经营企业飞行检查情况汇总表

1、产品进货出货的记录未设计产品编号内容;
2、现场提问企业负责人吴桂花不熟悉医疗器械监督管理的法律法规等于有关知识;
3、开展了有关培训,但未制定年度培训计划和无医疗器械相关知识方面培训;
4、随货通行单无产品编号;
5、出库复核,无产品编号。
限期整改
17.
武汉赛尔利斯科技贸易有限公司
青山区38街特一号康答大厦2单元1101室
2、冷藏的医疗器械未在冷库待验、验收;
3、冷库和保温箱的温湿度监测记录可更改。
限期整改
10.
武汉思扬开拓商贸有限公司
武汉市洪山区北港村武昌府二期西区5号商业幢B单元九层十三十四十五十六号
武汉市洪山区北港村武昌府二期西区五号商业幢b单元九层十三十四十五十六号
吕露
1、进货查验记录不准确,不规范
2、从业人员健康体检证明仅见2015年度
2、医疗器械采购记录未列明注册证号,备案凭证号和规格型号;
3、无医疗器械验收记录和销售记录。
限期整改
8.
武汉市易欣医疗器械有限公司
武汉市新洲区阳逻街新光小区军安路
武汉市新洲区阳逻街新光小区军安路
屈万鹏
1、该公司医疗器械经营许可证,标示的住所经营场所和库房地址均为武汉市新洲区阳逻街新光小区军安路,但该地址不存在该公司;
肖文
1、采购记录未记录产品规格型号;
2、验收记录未记录产品规格型号;
3、年度健康体检已过期;
4、企业法人负责人及质量负责人对医疗器械法规规章有关知识熟悉度不够。
限期整改
武汉万锦康鸿科技有限公司
武汉市青山区冶金大道(中国一冶高新技术产业园)七号办公楼栋1-6层,203
武汉市青山区冶金大道(中国一冶高新技术产业园)七号办公楼栋1-6层,203
食品生产企业单位飞行检查结果公示表(2017年度10月)
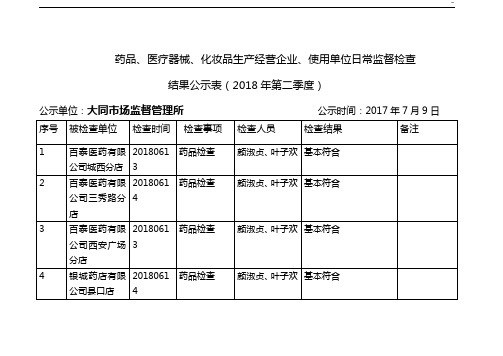
结果公示表(2018年第二季度)
公示单位:大同市场监督管理所公示时间:2017年7月9日
序号
被检查单位
检查时间
检查事项
检查人员
检查结果
备注
1
百泰医药有限公司城西分店
20180613
药品检查
颜淑贞、叶子欢
基本符合
2
百泰医药有限公司三秀路分店
20180614
药品检查
颜淑贞、叶子欢
基本符合
3
百泰医药有限公司西安广场分店
20180613
药品检查
颜淑贞、叶子欢
基本符合
4
银城药店有限公司县口店
20180614
药品检查
颜淑贞、叶子欢
基本符合
5
银城药店有限公司中山店
20180614
药品检查
颜淑贞、叶子欢
基本符合
6
银城药店有限公司城西店
20180613
药品检查
颜淑贞、叶子欢
基本符合
填表说明:1.检查事项分别为:药品检查、医疗器械检查、化妆品检查。
2.检查结果分别为:符合、基本符合、不符合。
3.如有其它需要说明的事项,请填写在备注栏。
2018.6.12
药品检查
吴福森、沈继禄
基本符合
33
安泰堂药局有限公司同安大同店
2018.06.26
药品检查
吴福森、沈继禄
基本符合
34
济元医药有限公司凤山店
2018.06.27
药品检查
吴福森、沈继禄
基本符合
35
鸿善堂药业有限公司
2018.6.25
医疗器械经营企业飞行检查现场记录表

医疗器械经营企业飞行检查现场记录表企业名称云南鸿翔一心堂药业(集团)股份有限公司江川德馨苑小区连锁店经营地址云南省玉溪市江川区大街街道五岔路口以西德馨苑延街组团11幢2单元102室仓库地址无检查日期2018年6月8日经营方式□批发□批零兼营□专营 药店兼营经营范围I、II类医疗器械许可证号及备案证号无(多证合一改革,未在备案)发证日期——检查目的和范围飞行检查检查依据《药品医疗器械飞行检查办法》、《医疗器械经营质量管理规范》观察员姓名单位龚泽洪江川区市场监督管理局企业主要现场配合人员姓名职务职称所在部门曹菠店长无云南鸿翔一心堂药业(集团)股份有限公司江川德馨苑小区连锁店李丽企业质量负责人执业药师云南鸿翔一心堂药业(集团)股份有限公司江川德馨苑小区连锁店主要缺陷和问题及其判断依据本表中所列出的缺陷和问题,只是本次飞行检查的发现,不代表企业缺陷和问题的全部。
建立与本企业生产/经营产品特点相适应的质量管理体系并保持其有效运行,是医疗器械生产、经营企业的法定责任。
依据条款缺陷和问题描述规范现场指导原则5.36.2※5.38.1检查发现以下一般缺陷1项,严重缺陷1项:医疗器械供货方的销售单据信息不全。
现场抽查医疗器械“一次性末梢采血针”,未能提供有该医疗器械信息的配送单。
药店未对到货医疗器械(主要是连锁门店间调剂医疗器械)进行逐批验收。
现场检查发现“精油贴”生产厂家:山东生物科技有限公司,批号:20170301,为同区域内连锁门店间调剂商品,但该医疗器械调剂至该店后,未进行验收直接上柜销售。
检查组成员签字组员组长观察员企业负责人或其授权人签字企业负责人签字(盖章)年月日。
2017年医疗器械SFDA飞行检查汇总

深圳XXX科技有限公司2018.01.15❝一、概述1.抽检产品种类2.处理措施3.缺陷项排名前十的条例4.无菌附录、植入附录和IVD附录出现次数排名前三的条款❝二、飞检常见问题汇总❝一、概述❝截至1月10号,根据总局的报道,2017年共展开飞行检查104次,共飞检了76家医疗期器械生产企业,28家医疗器械经营企业。
◦去年是总局第一次对经营企业展开现场检查,主要检查对象是III类或者II、III类兼营的企业。
28家企业共4家体系问题严重被停业整改,主要的问题还是缺乏年度培训计划、培训记录;仓库划分不符合规范、产品混放;记录表单内容设置不全或者无销售、采购等记录表;与供应商无采购协议,缺乏供货资质审核等。
对生产企业的飞检,根据总局发布的飞行检查结果来看,共检查无菌医疗器械企业34家,植入类医疗器械16家,体外诊断试剂7家,其他产品19家,无菌医疗器械是检查的重中之重。
就飞检的处理结果来看,停产整改19家,限期整改49家,处于停产状态的8家,一般有严重缺陷项就会面临停产整改。
对各个被飞检的企业缺陷项进行整理归纳,缺陷项排名前十的条例如下:❝排名前三的《医疗器械生产质量管理规范》条款出现次数26~28次,近40%被查企业都犯了这几条规定,属于常见问题项,需要大家关注。
❝第二十七条企业应当建立记录控制程序,包括记录的标识、保管、检索、保存期限和处置要求等,并满足以下要求:❝(一)记录应当保证产品生产、质量控制等活动的可追溯性;❝(二)记录应当清晰、完整,易于识别和检索,防止破损和丢失;❝(三)记录不得随意涂改或者销毁,更改记录应当签注姓名和日期,并使原有信息仍清晰可辨,必要时,应当说明更改的理由;❝(四)记录的保存期限应当至少相当于企业所规定的医疗器械的寿命期,但从放行产品的日期起不少于2年,或者符合相关法规要求,并可追溯。
❝第十七条仓储区应当能够满足原材料、包装材料、中间品、产品等的贮存条件和要求,按照待验、合格、不合格、退货或者召回等情形进行分区存放,便于检查和监控。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
武汉经济技术开发区东风大道36号附11
武汉经济技术开发区东风大道36号附11
李建平
1、未按规定进行管理评审;
2、在采购前未审核购货者的资质,未获得供货商公章的资质证明文件;
3、采购记录未列明产品注册号和备案凭证号;
4、未按品种特性要求,将医疗器械放于相应待验区。
限期整改
6.
湖北和诚润泽贸易有限公司
武汉经济技术开发区东风大道66号,宏松大酒店一楼
武汉经济技术开发区东风大道66号,宏松大酒店一楼
陈磊
1、采购记录未列明部分医疗器械的注册证号或备案凭证号;
2、冷藏医疗器械,未在冷库内待验,销售凭证未列明储运条件;
3、进货查验记录不真实,查该公司2017年7月31日,养护记录显示需要冷藏的,医疗器械,TBA总胆汁酸检测试剂盒(循环酶法)在库数量为四盒但该公司不能提供2017年7月31日冷库运行记录及温湿度监测数据;
4、供货商武汉润达商检医疗器械科技有限公司销售出库单上无该公司验收人员署名签字。
约谈被检查单位、限期整改
7.
武汉市兴康医疗器械有限责任公司
武汉阳逻经济开发区阳逻港华中国际产业园C-F8单元三层一号房
武汉阳逻经济开发区阳逻港华中国际产业园C-F8单元三层一号房
陈道军
1、未定期进行质量内部审核和管理评审;
武汉市洪山区书城路170号,鸿城家园六号楼0706室
武汉市洪山区书城路170号,鸿城家园六号楼0706室
汪训平
1、进货查验记录不完整;
2、通过询问发现,企业负责人质量负责人对医疗器械法规不熟悉;
*3、未收集供货商授权委托书未收集部分供货商资质;
*4、现场未见企业原始采购记录,(仅见供货商应税务劳清单);
武汉市江夏区藏龙岛长咀村黎明机电产业园二期一栋二单元八层,九号
鲍南山
现场检查无此公司。
注销备案
13.
2、医疗器械采购记录未列明注册证号,备案凭证号和规格型号;
3、无医疗器械验收记录和销售记录。
限期整改
8.
武汉市易欣医疗器械有限公司
武汉市新洲区阳逻街新光小区军安路
武汉市新洲区阳逻街新光小区军安路
屈万鹏
1、该公司医疗器械经营许可证,标示的住所经营场所和库房地址均为武汉市新洲区阳逻街新光小区军安路,但该地址不存在该公司;
武汉东湖开发区光谷大道111号光谷芯中心一期1-01幢2层203号
易银亮
1、企业的质量管理制度未按医疗器械监督管理的新法规进行修订;
2、企业负责人、质量管理人员对医疗器械监督管理法律法规不够熟悉;
3、库房配备设备设备与经营范围不相适应;
4、库房温度湿度监测记录不完整。
限期整改
3.
武汉奇致激光技术股份有限公司
2、该公司于2017年7月15日整体搬迁至武汉市新洲区阳逻街工人村66号金三角商贸广场,K栋KB4层,但截止日前该公司未办理变更手续;
3、现场检查时该公司仅有质量管理员屈万鹏和销售员郭威在厂查该公司人员花名册显示有8名工作人员现场只能看到屈万鹏、郭威、陈谧三人的劳务合同,未见仓储部章丽、财务部刘萌等人的劳务合同;
4、医疗器械出库单内容缺少注册证号项。
限期整改
4.
武汉迈高医药有限公司
武汉经济技术开发区沌阳街民营科技工业园西区一区H栋二楼
武汉经济技术开发区沌阳街民营科技工业园西区一区H栋二楼
童红军
1、采购记录中部分医疗器械未列名注册证号或备案凭证号;
2、验收记录中,部分医疗器械未登记产品批号或序列号。
限期整改
5.
武汉东湖开发区光谷大道3号激光工程设计总部二期研发部06幢06单元3-5层、07幢07单元3-4层
武汉东湖开发区光谷大道3号激光工程设计总部二期研发部06幢06单元5层513-517室
周江
1、企业制定的质量管理制度内容不全;
2、企业对相关人员岗前培训和继续培训缺少职责及岗位操作规程等内容;
3、库房配套设施设备与经营范围不相适应;
4、查该公司计算机管理系统及购销记录台帐显示至2017年7月1日以后公司未开展医疗器械经营活动。
约谈被检查单位、限期整改
9.
武汉乾康新医疗器械有限公司
武汉市新洲区邾城街北工业园腾飞路2号1厂房301室
武汉市新洲区邾城街北工业园腾飞路2号1厂房301室
郭益东
1、销售随货同行单未注明启运条件,购进随货同行单位未注明到达的温度;
2017年医疗器械经营企业飞行检查情况汇总表
编号
单位名称
经营地址
仓库地址
法定代表人(负责人)
违背《医疗器械经营质量管理规范》主要存在问题
处理措施
武汉市
1.
武道818号武汉高科医疗器械园B区9栋4层4号403、404厂房
武汉市东湖新技术开发区高新大道818号武汉高科医疗器械园B区9栋4层4号403、404厂房
3、诊断试剂冷库部分时段温度超标(如2017年7月24日15:56-17:06 7月25日14:31-16:26 7月27日13:51-15:36 7月28日10:11-11:26 7月31日14:06-15:51 8月4日8:46-10:11 8月7日11:31-13:41)。
限期整改
11.
武汉医之家医疗设备有限公司
5、对应售后的医疗器械未及时入库登记(仅见两个品种);
6、库房不通风,且堆放有杂物,库房过于拥挤,分类,不合理;
7、未记录库房温湿度;
*8、销售医疗器械,给武冈万康医院,未收集其资质等证明文件。
约谈被检查单位;立案查处。
12.
武汉山辉医用科技有限公司
武汉市江夏区藏龙岛长咀村黎明机电产业园二期一栋二单元八层,九号
2、冷藏的医疗器械未在冷库待验、验收;
3、冷库和保温箱的温湿度监测记录可更改。
限期整改
10.
武汉思扬开拓商贸有限公司
武汉市洪山区北港村武昌府二期西区5号商业幢B单元九层十三十四十五十六号
武汉市洪山区北港村武昌府二期西区五号商业幢b单元九层十三十四十五十六号
吕露
1、进货查验记录不准确,不规范
2、从业人员健康体检证明仅见2015年度
胡汉民
1.直接接触产品人员健康档案收集不全;
2.仓库保管和出库复核管理制度中“温度控制”制定不合理;
3.库房中合格品区、不合格品区、发货区、待验区分区不合理;
4.与上游企业签订的质量保证协议未签字,质量保证协议中未约定售后服务责任。
限期整改
2.
武汉联袂复兴义齿科技有限公司
武汉东湖开发区光谷大道111号光谷芯中心一期1-01幢2层203号
