金属腐蚀与防护课后答案
金属的腐蚀与防护(讲义)含答案

金属的腐蚀与防护(讲义)一、知识点睛1.金属的腐蚀(1)定义金属表面与周围物质发生_________或因________作用而遭到破坏的过程。
(2)实质金属失去电子被_________的过程,其过程可表示为:M-n e-M n+。
2.金属腐蚀类型(1)化学腐蚀金属跟接触到的物质(如O2、Cl2、SO2等)直接发生_______而引起的腐蚀。
(2)电化学腐蚀①定义两种金属_________且又同时暴露在______空气里或与_____________接触时,由于形成________而发生的腐蚀。
②实质被腐蚀金属成为原电池的______而被溶解。
③分类:a.吸氧腐蚀(以铜板上的铁铆钉为例)通常情况下水膜呈____性或___性,正极上____参加反应。
负极:_____________;正极________________;总反应:__________________________。
b.析氢腐蚀(以铜板上的铁铆钉为例)特殊情况下水膜呈___性,正极上___参加反应。
负极:____________;正极:____________;总反应:__________________________。
注:①纯金属只会发生化学腐蚀,不会发生电化学腐蚀;不纯的金属可能发生化学腐蚀,也可能发生电化学腐蚀,腐蚀类型取决于是否接触到电解质溶液。
②在金属腐蚀中,以电化学腐蚀为主,而电化学腐蚀中又以吸氧腐蚀为主。
3.金属腐蚀的影响因素(1)金属本性①金属越活泼,越易____电子而被腐蚀;②两极材料的活动性差别越大,较活泼金属被腐蚀的速率越______。
(2)介质①金属在潮湿的空气或电解质溶液中,容易腐蚀;②强电解质>弱电解质>非电解质。
(3)环境温度温度越高,金属腐蚀速率越____。
(4)金属腐蚀快慢的一般规律(同一种金属的腐蚀)电解池的阳极>原电池的负极>化学腐蚀>原电池的正极>电解池的阴极4.金属的防护(1)本质:阻止金属发生_________反应。
高中化学(新人教版)选择性必修一课后习题:金属的腐蚀与防护(课后习题)【含答案及解析】

金属的腐蚀与防护课后篇素养形成必备知识基础练1.下列与金属腐蚀有关的说法不正确的是()A.钢铁在潮湿空气中生锈属于电化学腐蚀B.电化学腐蚀一般可分为吸氧腐蚀和析氢腐蚀C.金属腐蚀的本质是金属原子失去电子被氧化D.铝具有很强的抗腐蚀能力,是因为其不易与氧气发生反应项,铝具有很强的抗腐蚀能力,是因为铝易被空气中的氧气氧化生成一层致密的氧化物保护膜,使内部金属不被腐蚀。
2.如图装置中,小试管内为红墨水,具支试管内盛有pH=4的雨水和生铁片。
观察到:开始时导管内液面下降,一段时间后导管内液面回升,略高于小试管液面。
以下有关解释合理的是()A.生铁片中的碳是原电池的负极,发生还原反应B.雨水酸性较强,生铁片仅发生析氢腐蚀C.墨水回升时,碳极反应式为O2+2H2O+4e-4OH-D.具支试管中溶液pH逐渐减小解析发生原电池反应时,生铁片中的碳是原电池的正极,A错误;雨水酸性较强,开始时铁片发生析氢腐蚀,产生氢气,导管内液面下降,一段时间后铁片发生吸氧腐蚀,吸收氧气,导管内液面上升,B错误;导管内液面上升时,铁片发生吸氧腐蚀,碳为正极,正极电极反应式为O2+2H2O+4e-4OH-,C正确;铁片无论是发生析氢腐蚀还是吸氧腐蚀,具支试管内溶液pH均增大,D错误。
3.为探究钢铁的吸氧腐蚀原理设计了如图所示的装置,下列有关说法错误的是()A.正极的电极反应式为O2+2H2O+4e-4OH-B.将石墨电极改成Mg电极,难以观察到铁锈生成C.若向自来水中加入少量NaCl(s),可较快地看到铁锈D.分别向铁、石墨电极附近吹入O2,前者铁锈出现得快,失电子被氧化成Fe2+;在正极氧气得电子发生还原反应生成OH-,故向石墨电极附近吹入O2的腐蚀速率比向铁电极附近吹入O2的腐蚀速率大;向自来水中加入NaCl(s),可使电解质溶液的导电能力增加,增大腐蚀速率;若将石墨电极换成Mg电极,则负极为Mg,Fe被保护,难以看到铁生锈。
4.一定条件下,碳钢腐蚀与溶液pH的关系如下:下列说法不正确的是()A.在pH<4的溶液中,碳钢主要发生析氢腐蚀B.在pH>6的溶液中,碳钢主要发生吸氧腐蚀C.在pH>14的溶液中,碳钢腐蚀的正极反应为O2+4H++4e- 2H2OD.在煮沸除氧气后的碱性溶液中,碳钢腐蚀速率会减小解析C项,在pH>14的溶液中,碳钢腐蚀的正极反应为O2+2H2O+4e- 4OH-。
金属腐蚀与防护课后习题及实验答案

金属腐蚀与防护课后习题及实验答案课后习题1.什么是金属腐蚀?请简要说明。
金属腐蚀是指金属在与外界环境接触的过程中,由于化学或电化学作用导致金属表面逐渐失去其原有的金属性质的一种现象。
金属腐蚀主要由电子传递过程和离子传递过程构成。
2.列举几种常见的金属腐蚀类型。
•电化学腐蚀•化学腐蚀•氧化腐蚀3.金属腐蚀的影响主要体现在哪些方面?金属腐蚀的主要影响包括: - 金属材料的破坏和失效 - 资源浪费 - 生态环境污染4.请列举几种常见的金属腐蚀防护方法。
•表面涂覆防护•电化学防护•材料选择防护5.什么是阴极保护?它是如何实现的?阴极保护是一种主动防护措施,通过在金属表面引入外部电流,使金属表面成为阴极,从而抑制金属腐蚀的一种方法。
实现阴极保护的关键是保证外部电流的输入和金属结构的良好接触。
常见的阴极保护方法包括外加电流阴极保护和阳极保护。
实验答案实验一:金属腐蚀观察实验目的:观察不同金属在某种腐蚀剂作用下的腐蚀现象。
实验步骤: 1. 准备实验器材和试剂,包括不同金属样品、腐蚀剂。
2. 将不同金属样品分别放入不同的容器中。
3. 向不同容器中添加适量的腐蚀剂。
4. 观察金属样品在腐蚀剂中的变化,记录下观察结果。
实验结果:观察不同金属样品在腐蚀剂中的变化,记录下观察结果。
金属样品腐蚀剂腐蚀现象铁盐酸表面产生气泡铝硝酸表面逐渐变薄铜硫酸表面出现绿色物质实验结论:根据实验结果可以得出以下结论: - 铁在盐酸中会发生气泡,产生氢气。
- 铝在硝酸中会逐渐被腐蚀,表面变薄。
- 铜在硫酸中会生成绿色物质,表明发生了腐蚀反应。
实验二:金属腐蚀防护实验目的:通过表面涂覆防护来延缓金属腐蚀的过程。
实验步骤: 1. 准备实验器材和试剂,包括金属样品、防护涂层材料。
2. 将金属样品分别涂覆上防护涂层材料。
3. 将涂好防护涂层的金属样品放入腐蚀介质中。
4. 观察金属样品在腐蚀介质中的变化,记录下观察结果。
实验结果:观察涂有防护涂层的金属样品在腐蚀介质中的变化,记录下观察结果。
第17练 电解原理及其应用 金属腐蚀与防护(解析版)
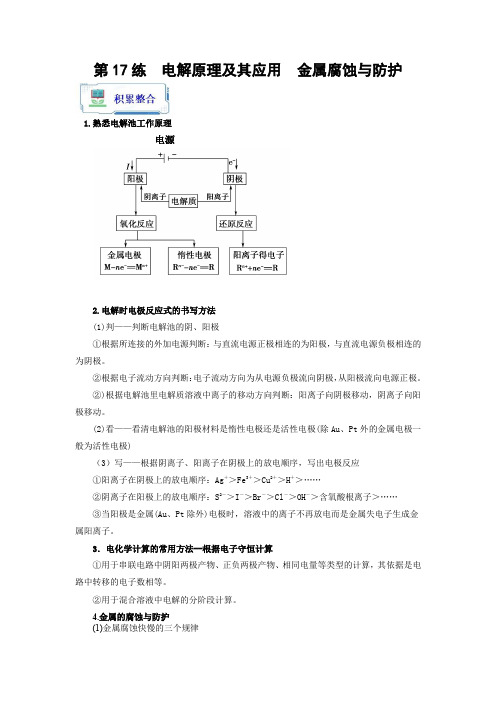
第17练电解原理及其应用金属腐蚀与防护1.熟悉电解池工作原理电源2.电解时电极反应式的书写方法(1)判——判断电解池的阴、阳极①根据所连接的外加电源判断:与直流电源正极相连的为阳极,与直流电源负极相连的为阴极。
②根据电子流动方向判断:电子流动方向为从电源负极流向阴极,从阳极流向电源正极。
②)根据电解池里电解质溶液中离子的移动方向判断:阳离子向阴极移动,阴离子向阳极移动。
(2)看——看清电解池的阳极材料是惰性电极还是活性电极(除Au、Pt外的金属电极一般为活性电极)(3)写——根据阴离子、阳离子在阴极上的放电顺序,写出电极反应①阳离子在阴极上的放电顺序:Ag+>Fe3+>Cu2+>H+>……②阴离子在阳极上的放电顺序:S2->I->Br->Cl->OH->含氧酸根离子>……③当阳极是金属(Au、Pt除外)电极时,溶液中的离子不再放电而是金属失电子生成金属阳离子。
3.电化学计算的常用方法--根据电子守恒计算①用于串联电路中阴阳两极产物、正负两极产物、相同电量等类型的计算,其依据是电路中转移的电子数相等。
②用于混合溶液中电解的分阶段计算。
4.金属的腐蚀与防护(1)金属腐蚀快慢的三个规律①金属腐蚀类型的差异电解原理引起的腐蚀>原电池原理引起的腐蚀>化学腐蚀>有防护腐蚀措施的腐蚀。
①电解质溶液的影响a.对同一金属来说,腐蚀的快慢(浓度相同):强电解质溶液>弱电解质溶液>非电解质溶液。
b.对同一种电解质溶液来说,电解质浓度越大,腐蚀越快。
①活泼性不同的两金属,活泼性差别越大,腐蚀越快。
(2)两种腐蚀与三种保护①两种腐蚀:析氢腐蚀、吸氧腐蚀(关键在于电解液的pH)。
①三种保护:电镀保护、牺牲阳极的阴极保护法、外加电流的阴极保护法。
1.(2023·湖北·校联考模拟预测)科研团队开创了海水原位直接电解制氢的全新技术(如图所KOH侧的水蒸气压力差使海水自发蒸发,并示)。
高中化学选择性必修1 第四章 第三节 金属的腐蚀与防护同步练习含详解答案

金属的腐蚀同步练习(答题时间:40分钟)一、选择题1. 下列有关金属腐蚀的说法中正确的是( )A. 金属腐蚀指不纯金属与接触到的电解质溶液进行化学反应而损耗的过程B. 电化学腐蚀指在外加电流的作用下不纯金属发生化学反应而损耗的过程C. 钢铁腐蚀最普遍的是吸氧腐蚀,负极吸收氧气,产物最终转化为铁锈D. 金属的电化学腐蚀和化学腐蚀本质相同,但电化学腐蚀伴有电流产生2. 下列各种镀有金属保护层的铁板,镀层破损后在相同的环境中,铁板最易被腐蚀的是( )A. 镀锌铁(白铁)B. 镀锡铁(马口铁)C. 镀铜铁D. 镀银铁*3. 如图为模拟铁生锈的实验。
铁粉中均匀混有少量炭粉,撒入内壁已分别用氯化钠溶液和稀醋酸润湿过的甲、乙两个具支试管中,打开止水夹片刻后,下列有关该实验的说法合理的是( )甲 乙A. 甲装置导管口有气泡,乙装置导管内出现一段液柱B. 甲装置中发生的电化学腐蚀主要是析氢腐蚀C. 乙装置中发生的电化学腐蚀主要是吸氧腐蚀D. 乙装置导管口有气泡冒出4. 下列关于金属腐蚀的说法正确的是A. 金属在潮湿空气中腐蚀的实质是M +n H 2O =M (OH )n +2n H 2↑ B. 金属的化学腐蚀的实质是M -n e -=M n +,电子直接转移给氧化剂C. 金属的化学腐蚀必须在酸性条件下进行D. 在潮湿的环境中,金属的电化学腐蚀一定是析氢腐蚀下列说法不正确...的是A. 对比②③,可以判定Zn保护了FeB. 对比①②,K3[Fe(CN)6]可能将Fe氧化C. 验证Zn保护Fe时不能用①的方法D. 将Zn换成Cu,用①的方法可判断Fe比Cu活泼二、非选择题6. 如图所示,水槽中试管内有一枚铁钉,放置数天后观察:(1)铁钉在逐渐生锈,则铁钉的腐蚀属于________腐蚀(填“化学”或“电化学”)。
(2)若试管内液面上升,则原溶液呈__________性,发生________腐蚀,电极反应式分别为负极:______________;正极:__________________。
金属腐蚀与防护课后题答案

1.材料腐蚀的定义:腐蚀是材料受环境介质的化学、电化学和物理作用产生的损坏或变质现象。
腐蚀包括化学、电化学与机械因素或生物因素的共同作用。
2.腐蚀的特点:自发性/铁腐蚀变成以水和氧化铁为主的腐蚀产物,这些腐蚀产物在结构或形态上和自然界天然存在的铁矿石类似,或者说处于同一能量等级自发性只代表反应倾向,不等于实际反应速度普遍性/ 元素周期表中约有三、四十种金属元素,除了金和铂金可能以纯金属单体形式天然存在之外,其它金属都以它们的化合物(氧化物、硫化物)形式存在隐蔽性/ 应力腐蚀断裂管道:表面光亮如新,几乎不存在均匀腐蚀迹象,金相显微镜下,可观察到管道内部布满细微裂纹3.按材料腐蚀形态如何分类:全面腐蚀<均匀和不均匀腐蚀> 局部腐蚀{ 点蚀(孔蚀、)缝隙腐蚀及丝状腐蚀、电偶腐蚀(接触腐蚀)晶间腐蚀}选择性腐蚀4.按材料腐蚀机理如何分类:化学腐蚀、电化学腐蚀、物理溶解腐蚀5.按材料腐蚀环境如何分类:自然环境腐蚀、工业环境腐蚀、生物环境腐蚀1、名词解释物理腐蚀:是指金属由于单纯的物理溶解作用而引起的破坏电化学腐蚀:就是金属和电解质组成两个电极,组成腐蚀原电池。
电极电位:金属-溶液界面上建立了双电层,使得金属与溶液间产生电位差,这种电位差称为电极电位(绝对电极电位)非平衡电极电位:(在生产实际中,与金属接触的溶液大部分不是金属自身离子的溶液)当电极反应不处于平衡状态,电极系统的电位称为非平衡电位。
平衡电极电位:水合金属离子能够回到金属中去,水合-金属化过程速率相等且又可逆,这时的电极电位。
标准电极电位:金属在25℃浸于自身离子活度为1mol/L的溶液中,分压为1×105Pa时的平衡电极电位极化:电流流过电极表面,电极就会失去平衡,并引起电位的变化去极化:能降低电极极化的因素称为去极化因素过电位:是电极的电位差值,为一个电极反应偏离平衡时的电极电位与这个电极反应的平衡电位的差值。
活化极化:设电极反应的阻力主要来自电子转移步骤,液相传质容易进行,这种电极反应称为受活化极化控制的电极反应。
第3节金属的腐蚀与防护

第三节金属的腐蚀与防护课后·训练提升基础巩固1.铁锅表面覆盖有下列物质时,锈蚀最快的是()。
A.水B.食盐水C.食用油D.酒精答案:B解析:当形成电化学腐蚀,且铁作原电池的负极材料时,表面覆盖的溶液导电性越强,锈蚀越快。
食用油和酒精不能导电,不能形成原电池反应,而水的导电性没有食盐水强,所以锈蚀最快的是食盐水,故选B。
2.下列叙述不正确的是()。
A.锌与稀硫酸反应制取氢气,加入少量的硫酸铜能增大反应速率B.镀层破损后,白铁(镀锌的铁)比马口铁(镀锡的铁)更易被腐蚀C.钢铁表面常易被锈蚀生成Fe2O3·n H2OD.钢铁在发生析氢腐蚀和吸氧腐蚀时,完全相同的反应是负极反应答案:B解析:锌与CuSO4发生置换反应后,铜附着在锌的表面上,浸泡在稀硫酸中形成锌铜原电池,负极锌被氧化而加速反应,A项正确;镀锌的铁构成原电池时锌为负极,铁为正极,铁被保护,镀锡的铁构成原电池时铁作负极,锡作正极,加速了铁的腐蚀,B项不正确;钢铁的锈蚀主要是吸氧腐蚀,负极(Fe)反应为Fe-2e-Fe2+,正极(C)反应为2H2O+O2+4e-4OH-,形成Fe(OH)2,在空气中4Fe(OH)2+O2+2H2O4Fe(OH)3,久置后2Fe(OH)3Fe2O3+3H2O,所以铁锈的成分是Fe2O3·n H2O,C项正确;钢铁在发生析氢腐蚀和吸氧腐蚀时,负极反应相同,都是Fe-2e-Fe2+,但正极反应不同,分别是析出氢气和吸收氧气,D项正确。
3.下列说法中,不正确的是()。
A.钢铁表面水膜的酸性很弱或呈中性,发生吸氧腐蚀B.钢铁表面水膜的酸性较强,发生析氢腐蚀C.将锌板换成铜板对钢闸门保护效果更好D.钢闸门作为阴极而受到保护答案:C解析:当钢铁表面的水膜酸性很弱或显中性时,铁在负极放电,氧气在正极上放电,发生的是钢铁的吸氧腐蚀,A项正确;当钢铁表面的水膜酸性较强时,铁在负极放电,水膜中的氢离子在正极放电生成氢气,发生的是析氢腐蚀,B项正确;在原电池中,正极被保护,当将锌板换成铜板后,铜作正极被保护,钢闸门作负极被腐蚀,起不到对钢闸门的保护作用,C项错误;在电解池中,阴极被保护,故要保护钢闸门,就要使钢闸门作电解池的阴极,D项正确。
高中化学 金属的腐蚀与防护(解析版)

课时34 金属的腐蚀与防护1.关于金属腐蚀的叙述中,正确的是( )A .金属被腐蚀的本质是M +n H 2O===M(OH)n +n 2H 2↑ B .马口铁(镀锡铁)镀层破损后被腐蚀时,首先是镀层被氧化C .金属在一般情况下发生的电化学腐蚀主要是吸氧腐蚀D .常温下,置于空气中的金属主要发生化学腐蚀【答案】C【解析】金属腐蚀的本质主要是金属原子失电子被氧化,腐蚀的内因是金属的化学性质比较活泼,外因是金属与空气、水和其他腐蚀性的物质相接触,腐蚀主要有化学腐蚀和电化学腐蚀。
A 中金属腐蚀的本质应包括化学腐蚀和电化学腐蚀,为M -n e -===M n +;B 选项中Sn 、Fe 构成电化学腐蚀,主要是Fe -2e -===Fe 2+,铁先被腐蚀。
常温下,空气中的金属主要发生电化学腐蚀中的吸氧腐蚀,难以和非金属氧化剂(Cl 2、S)等反应,发生化学腐蚀。
2.下列叙述中正确的是( )A .原电池的负极发生还原反应B .电化学腐蚀的实质是金属单质失去电子形成阳离子,而电子直接转移给氧化剂C .金属在中性环境中主要发生析氢腐蚀D .钢铁在潮湿环境中锈蚀时,开始生成Fe(OH)2,而后逐渐变成Fe(OH)3和Fe 2O 3·xH 2O【答案】D【解析】不论是吸氧腐蚀还是析氢腐蚀,都是先生成Fe(OH)2,再逐渐转变成Fe(OH)3和Fe 2O 3·xH 2O 。
3.以下防腐措施中,属于电化学保护法的是( )A .用氧化剂使金属表面生成致密稳定的氧化物保护膜B .在金属中加入一些铬或者镍制成合金C .在轮船的船壳水线以下部分,装上一锌锭D .在金属表面喷漆【答案】C【解析】在轮船的船壳水线以下部分,装上锌能形成铁锌原电池,锌为负极,被腐蚀,铁被保护。
4.铜制品上的铝质铆钉,在潮湿空气中易发生腐蚀的主要原因可描述为( )A .形成原电池,铝作负极B.形成原电池,铜作负极C.形成原电池时,电流由铝经导线流向铜D.铝质铆钉发生了化学腐蚀【答案】A【解析】金属铝发生的是电化学腐蚀,铝比铜活泼,故金属铝是负极,电流的流动方向与电子的流动方向恰好相反,应是由铜经导线流向铝。
人教版高中化学选修1 第三章 第二节 金属的腐蚀和防护练习含答案

第二节金属的腐蚀和防护1.为什么钢铁在潮湿的环境中比在干燥的环境中更容易生锈?提示:不纯的金属或合金,在潮湿的空气中形成微小原电池而发生电化学腐蚀,主要发生吸氧腐蚀,加快了反应速率。
►综合拓展一、化学腐蚀和电化学腐蚀的比较二、吸氧腐蚀与析氢腐蚀的比较(以钢铁腐蚀为例)►尝试应用1.钢铁在很弱的酸性或中性条件下发生电化学腐蚀时,正极的反应式为(C)A.Fe-2e-===Fe2+B.2H++2e-===H2↑C.2H2O+O2+4e-===4OH-D.Fe-3e-===Fe3+解析:考查金属的电化学腐蚀的实质。
钢铁中含有多种杂质,在考虑钢铁的电化学腐蚀时,为了简化问题,主要讨论碳杂质问题,也就是以Fe为负极,C为正极的原电池反应。
在中性条件或弱酸性条件下发生的是吸氧腐蚀,原电池的正极为C,发生还原反应,即得电子反应,故A、D两项应排除,在B、C两项中,B项是析氢腐蚀的电极反应式,所以C项符合题意。
金属的防护2.镀锌铁与镀锡铁的镀层破损后,哪个更耐腐蚀?提示:镀锌铁更耐腐蚀,因为发生电化学腐蚀时,锌比铁活泼,因此适合作原电池的负极,失去电子被氧化,从而保护了铁。
而锡不如铁活泼,当镀锡铁镀层破损后,铁做负极,失去电子被氧化。
►综合拓展三、金属的防护1.保持金属表面清洁干燥。
2.金属表面涂抹油漆等保护层。
3.改变金属内部结构,如制成合金。
4.通过化学方法使其表面形成保护层,如电镀、形成氧化膜等。
5.电化学防护法——牺牲阳极的阴极保护法。
电化学防护法应用原电池原理,让被保护金属作为正极,另找一种活动性较强的金属作为负极。
例如在锅炉内壁、船舶外壳装上若干锌块,就可保护钢铁设备。
发生的电极反应:负极:2Zn-4e-===2Zn2+;正极:O2+2H2O+4e-===4OH-。
锌块不断被腐蚀,可定期拆换,使铁得到保护。
►尝试应用2.下列做法不能起防锈作用的是(A)A.保留铁制品上的铁锈B.在铁制品表面镀锌C.在金属机械上涂油D.在车、船的表面刷油漆解析:铁锈是比较疏松的氧化膜,容易保存一些水分,形成电解质溶液加速铁的腐蚀,不能起到防锈的作用。
高三化学金属的电化学腐蚀与防护试题答案及解析

高三化学金属的电化学腐蚀与防护试题答案及解析1.一定条件下,碳钢腐蚀与溶液pH的关系如下:A.在pH<4溶液中,碳钢主要发生析氢腐蚀B.存pH>6溶液中,碳钢主要发生吸氧腐蚀C.在pH>14溶液中,碳钢腐蚀的正极反应为O2+4H++4e-=2H2OD.在煮沸除氧气后的碱性溶液中,碳钢腐蚀速率会减缓【答案】C【解析】A、酸性条件下,碳钢发生析氢腐蚀,Fe-2e-= Fe2+,正确;B、当pH>6溶液中,碳钢主要发生吸氧腐蚀,负极电极反应式为:Fe-2e-=Fe2+,正极上电极反应式为:O2+2H2O+4e-=4OH-,正确;C.在pH>14溶液中,碳钢腐蚀的正极反应O2+2H2O+4e-=4OH-,错误;D.在煮沸除氧气后的碱性溶液中,正极上氧气生成氢氧根离子速率减小,所以碳钢腐蚀速率会减缓,正确,答案选C。
【考点】考查金属的电化学腐蚀的种类与发生条件的判断2.铜板上铁铆钉长期暴露在潮湿的空气中,形成一层酸性水膜后铁铆钉会被腐蚀,示意图如下。
下列说法不正确的是A.因铁的金属性比铜强,所以铁铆钉被氧化而腐蚀B.若水膜中溶解了SO2,则铁铆钉腐蚀的速率变小C.铜极上的反应是2H+ + 2e- ="=" H2↑,O2+ 4e- + 4H+ ="=" 2H2OD.在金属表面涂一层油脂,能防止铁铆钉被腐蚀【答案】B【解析】A、因铁的金属性比铜强,所以铁铆钉被氧化而腐蚀,正确;B、若水膜中溶解了SO2,使溶液酸性增强,氢离子浓度增大,则铁铆钉腐蚀的速率变大,错误;C、从图中可看出,铁同时发生析氢和吸氧腐蚀,铜极是正极,发生的反应是2H+ + 2e- ="=" H2↑,O2+ 4e- + 4H+ ="="2H2O ,正确;D、在金属表面涂一层油脂,隔绝氧气,能防止铁铆钉被腐蚀,正确,答案选B。
【考点】考查金属腐蚀原理及防护3.下列说法不正确的是:A.通过煤的干馏可获得苯、甲苯等芳香烃B.在海轮外壳装上锌块,可减缓船体的腐蚀速率C.电渗析法、离子交换法中,只有后者可以应用于海水的淡化D.我国城市推广使用清洁燃料是压缩天然气类和液化石油气类【答案】C【解析】A、煤干馏可得煤焦油,煤焦油中含有苯、甲苯等芳香烃,正确;B、在海轮外壳装上锌块,形成原电池时,Zn为负极,Fe为正极,可减缓船体的腐蚀速率,正确;C、电渗析法、离子交换法都可用于海水的淡化,错误;D、压缩天然气类主要成分是甲烷,液化石油气主要成分是丙烷、丙烯、丁烷、丁烯,燃烧时产生污染物较少,是我国城市推广使用的清洁燃料,正确。
金属防护与腐蚀习题解答

因不知icorr ,所以忽略a ,可用E0,a 估算 Ecorr ,即E0,a =Ecorr
EFe=E0Fe
0.029 Ecorr EFe E Fe lg106 2 0.44 (0.087) 0.527(V )
0
铜电极和氢电极(PH2=2atm)浸在Cu2+ 活度为1且pH=1的CuSO4溶液中 组成电池,25°C,求该电池的电动势,并判断电池的极性。
低碳刚在pH=1的无氧水溶液中,腐蚀电位 为-0.72V(相对饱和Cu/CuSO4电极)。对于同 样钢的氢过电位(单位为V)遵循下列关系:η =0.7+0.1lgi,式中i的单位为A· -2。假定所有 cm 钢表面近似作为阴极,计算腐蚀速度(g/m2· h)。
解: 已知pH=1, Ecorr = -0.72V(相对饱和Cu/Cu2+) 饱和Cu/Cu2+的E = + 0.32V 故Ecorr= -0.72 + 0.32 = -0.4 V(SHE) E 0,C = EH+/H2 = -0.059 pH=-0.0591=-0.059(V) ηC= Ecorr- E 0,C = -0.4 - (-0.059) = -0.341 (V) 根据η=0.7 + 0.1 lgi 可求出lgicorr
4
(icorr单位:µA•cm-2)
A Vt 3.27 10 icorr n 56 3 3.27 10 100 2 7.87 1.16(m m a 1 )
3
或Vt 8.76
1.04 8.76 7.87 1.16(m m a 1 )
V
aCd 2
KspCd (OH )2 a 2OH
2 1014 2 7 2 (1 10 )
21-22版:4.3 金属的腐蚀与防护(创新设计)

目录
2
课堂互动探究
一、金属电化学腐蚀的类型与条件 二、金属防护的原理与措施
目录
课堂互动探究
一、金属电化学腐蚀的类型与条件 ———————【实验探究】———————
创新设计
实验1:将经过酸洗除锈的铁钉,用饱和食盐水浸泡一下,放入下图所示的 具支试管中。一段时间后,观察导管中水柱和铁钉的变化。如图1。
01 02 03 04
目录
课堂小结·即时达标
创新设计
解析 黄铜(铜锌合金)制作的铜锣发生腐蚀时,铜作正极而受到保护,不易 产生铜绿,A错误;镀层破损后,镀锡铁中金属铁为负极,易被腐蚀,而镀 锌铁中铁是正极,被保护,故镀锡铁中铁的腐蚀速率更快,B错误;轮船的 船体水位线以下装锌块,由于Zn比Fe活泼,发生腐蚀时,Zn作负极被腐蚀, 船体作正极而受到保护,属于牺牲阳极法,C正确;不锈钢是把铬、镍等加 入普通钢中制成的合金,具有较强的抗腐蚀能力,并非在钢铁表面镀上了铬, D错误。
目录
新知自主预习
创新设计
解析 为避免船体遭受腐蚀,通常在船壳上镶嵌锌等比铁更活泼的金属, 发生腐蚀时形成原电池,船体作正极而受到保护,该方法称为牺牲阳极, A正确;金属M可以是锌、镁等比铁活泼的金属,但不能是锡等比铁活泼 性弱的金属,B错误;海水呈弱碱性,船壳在海水中发生吸氧腐蚀,C正 确;该方法中,M作负极发生氧化反应,电极反应式为M-ne-===Mn+, D正确。
01 02 03 04
目录
课堂小结·即时达标
创新设计
2.下列有关金属腐蚀与防护的说法正确的是( C )
A.黄铜(铜锌合金)制作的铜锣易产生铜绿 B.镀锡铁制品和镀锌铁制品的镀层破损时,镀锡铁中铁的腐蚀速率更慢 C.轮船的船体水位线以下常装有一些锌块,这是利用了牺牲阳极法 D.不锈钢有较强的抗腐蚀能力是因为在钢铁表面上镀上一层铬
(完整版)金属腐蚀与防护课后习题答案

腐蚀与防护试题1化学腐蚀的概念、及特点答案:化学腐蚀:介质与金属直接发生化学反应而引起的变质或损坏现象称为金属的化学腐蚀。
是一种纯氧化-还原反应过程,即腐蚀介质中的氧化剂直接与金属表面上的原子相互作用而形成腐蚀产物。
在腐蚀过程中,电子的传递是在介质与金属之间直接进行的,没有腐蚀电流产生,反应速度受多项化学反应动力学控制。
归纳化学腐蚀的特点在不电离、不导电的介质环境下反应中没有电流产生,直接完成氧化还原反应腐蚀速度与程度与外界电位变化无关2、金属氧化膜具有保护作用条件,举例说明哪些金属氧化膜有保护作用,那些没有保护作用,为什么?答案:氧化膜保护作用条件:①氧化膜致密完整程度;②氧化膜本身化学与物理稳定性质;③氧化膜与基体结合能力;④氧化膜有足够的强度氧化膜完整性的必要条件:PB原理:生成的氧化物的体积大于消耗掉的金属的体积,是形成致密氧化膜的前提。
PB原理的数学表示:反应的金属体积:V M = m/ρ m-摩尔质量氧化物的体积: V MO = m'/ ρ '用ϕ = V MO/ V M = m' ρ /( m ρ ' )当ϕ > 1 金属氧化膜具备完整性条件部分金属的ϕ值氧化物ϕ氧化物ϕ氧化物ϕMoO3 3.4 WO3 3.4 V2O5 3.2Nb2O5 2.7 Sb2O5 2.4 Bi2O5 2.3Cr2O3 2.0 TiO2 1.9 MnO 1.8FeO 1.8 Cu2O 1.7 ZnO 1.6Ag2O 1.6 NiO 1.5 PbO2 1.4SnO2 1.3 Al2O3 1.3 CdO 1.2MgO 1.0 CaO 0.7MoO3 WO3 V2O5这三种氧化物在高温下易挥发,在常温下由于ϕ值太大会使体积膨胀,当超过金属膜的本身强度、塑性时,会发生氧化膜鼓泡、破裂、剥离、脱落。
Cr2O3 TiO2 MnO FeO Cu2O ZnO Ag2O NiO PbO2 SnO2 Al2O3 这些氧化物在一定温度范围内稳定存在,ϕ值适中。
金属腐蚀与防护课后答案

《金属腐蚀理论及腐蚀控制》习题解答1.根据表1中所列数据分别计算碳钢和铝两种材料在试验介质中的失重腐蚀速度蚀深度V p,并进行比较,说明两种腐蚀速度表示方法的差别。
试验介质30% HNO, 25 C试样材料碳钢铝矩形薄板试样尺寸(mm) 20 40 3 30 40 5腐蚀前重W(g)浸泡时间t (hr) 45 45腐蚀后重W(g)解:由题意得:(1)对碳钢在30%HNO25 C)中有:7—二△ W /st=m? h又有d=m/v=20x 40 x =cm2? hVp二—/d= x =y对铝在30%HN3(25 °C)中有:"=△ W铝/std=m铝/v=30 x40x 5x =cmV-和年腐3说明:碳钢的V—比铝大,而Vp比铝小,因为铝的密度比碳钢小(2)对不锈钢在2O%HNO25 C)有:2 2表面积S=2n x o.oi5 + 2 n xx= m2"=△ W /st二 g/ m ? h试样体积为:V=nXX = cm3d=W/V== g/cm3Vp二—/d= x =y, 2 2对铝有:表面积S=2n x o.o2 + 2 n xx= m2"=△ W /st= g/ m? h试样体积为:V=n x 2 2 x = cm3d=W/V== g/cm3Vp二—/d= x =y试样在98% HN3(85 °C)时有:对不锈钢:"=△ W /st2=g/ m ? hVp=— /d= x =y对铝:V - =△ W /st= m2? hVp=— /d= x =y说明:硝酸浓度温度对不锈钢和铝的腐蚀速度具有相反的影响33.镁在L NaCI溶液中浸泡100小时,共放出氢气330cm。
试验温度25 C,压力760mmHg试样尺寸为20 20 (mm)的薄板。
计算镁试样的失重腐蚀速度V (在25 C时水的饱和蒸汽压为)解:由题意得:该试样的表面积为:6 62S=2X (20 x 20+ 20X + 20xx 10 =840x 10 m压力P= mmHg = mmHg二根据PV=nRT 则有放出的氢气的物质的量为:6n=PV/RT=x 330x 10 / x (25 + =2又根据Mg + 2 H —>Mg + HMg腐蚀的量为n(Mg)=所以:V =nM Mg)/St= x 840X 10 6 x 100= g/ m2? h查表得:d Mg= g/cm3有: Vp二—/d= x =y4. 表面积4cm2的铁试样,浸泡在5%盐酸溶液中,测出腐蚀电流为Icor = 。
金属腐蚀与防护课后习题 陈颖敏 李志勇编

阳极极化: -E(mV,对SCE) i(A/cm2)
360 47 350 57 72
406
404
3
第四章(P62)
9. 已知ECu2+/Cu=+0.34V(25oC),在溶液中,为什么铜可能发生耗 氧腐蚀,并不会发生析氢腐蚀?
解:因为EH+/H2= -0.059pH = -0.413(V) EO2/OH- =1.229 - 0.059 pH =+0.814(V )
(pH=7) (pH=7)
0.202 0.7 lg i 0.1
icorr 9.551010 A cm2 9.551010
A cm
2
Vt 3.27 103
3
A icorr n
56 9.5510 4 3.27 10 2 7.87 1.11105 m m a 1
解:已知E0Cu=+0.337V, aCu=1 0.059 ECu 0.337 lg1 0.337(V ) 2
已知PH2=2atm, pH=1(aH=10-1)
EH E
0 H
0.059lg
aH
PH 2
101 EH 0 0.059lg 0.0295 2
E电=+0.337-(-0.029)=+0.3665(V) 铜电极为正极,氢电极为负极。43;/Cu < E0 O2/H2O = +1.229 (V) Cu可能发生腐蚀。
金属腐蚀与防护课后习题答案 (1)

腐蚀与防护试题1化学腐蚀的概念、及特点答案:化学腐蚀:介质与金属直接发生化学反应而引起的变质或损坏现象称为金属的化学腐蚀。
是一种纯氧化-还原反应过程,即腐蚀介质中的氧化剂直接与金属表面上的原子相互作用而形成腐蚀产物。
在腐蚀过程中,电子的传递是在介质与金属之间直接进行的,没有腐蚀电流产生,反应速度受多项化学反应动力学控制。
归纳化学腐蚀的特点在不电离、不导电的介质环境下反应中没有电流产生,直接完成氧化还原反应腐蚀速度与程度与外界电位变化无关2、金属氧化膜具有保护作用条件,举例说明哪些金属氧化膜有保护作用,那些没有保护作用,为什么?答案:氧化膜保护作用条件:①氧化膜致密完整程度;②氧化膜本身化学与物理稳定性质;③氧化膜与基体结合能力;④氧化膜有足够的强度氧化膜完整性的必要条件:PB原理:生成的氧化物的体积大于消耗掉的金属的体积,是形成致密氧化膜的前提。
PB原理的数学表示:反应的金属体积:V M = m/? m-摩尔质量氧化物的体积: V MO = m'/ ? '用? = V MO/ V M = m' ? /( m ? ' )当? > 1 金属氧化膜具备完整性条件部分金属的?值氧化物?氧化物?氧化物?MoO3 WO3 V2O5Nb2O5 Sb2O5 Bi2O5Cr2O3 TiO2 MnOFeO Cu2O ZnOAg2O NiO PbO2SnO2 Al2O3 CdOMgO CaOMoO3 WO3 V2O5这三种氧化物在高温下易挥发,在常温下由于?值太大会使体积膨胀,当超过金属膜的本身强度、塑性时,会发生氧化膜鼓泡、破裂、剥离、脱落。
Cr2O3 TiO2 MnO FeO Cu2O ZnO Ag2O NiO PbO2 SnO2 Al2O3 这些氧化物在一定温度范围内稳定存在,?值适中。
这些金属的氧化膜致密、稳定,有较好的保护作用。
MgO CaO ?值较小,氧化膜不致密,不起保护作用。
(完整版)材料腐蚀与防护工程课后习题答案

五、忠考题1•秦见教材P4-5.2. 化学腐蚀包括金属在千燥气体(我高温%体)作用下的馬蚀和金属在非电解质溶液中的傳蚀•其反应过程的历栈特点是金属表面的原子与敦化制直揍发生直化还原反应而形成腐蚀产物,电子在金属和氧化刑之间直揍传递,无腐蚀电流产生。
电化学腐蚀是金属表而与电終质溶液发生电化学反应而弓起的砍坏•例如钢铁在土煨中的局蚀。
电化学局蚀的希点是腐蚀及应过桂中至少有一个阳极反应和阴极反应,在反宜过程中发生电荷转移,伴有电流产生。
金属在实际工程中出现的腐蚀大多數均为电化学腐蚀,金属点电化学和应力及微生扬共同作用下还会发生应力以蚀和微生扬腐蚀。
联系:二者均发生氧化还原反应。
3. 参见教材P11-12.第2章野—、滇空题1. 氢2•阳.阴3.紮密双电层结构樓型、扩敷双电展结的樓型、斯转恩双电孱樸型4•显若、较小5.电子、电极反应6.仅有一个电极反应、零、平衡电位二、判断题1. x2. x3. x4. x5. V6. V7. J三、名词解释腐蚀原电池:局蚀体系中形成的粗路原电池,祖:腐蚀金属麦它的一个电极。
氧浓差电池:由金屬与敦含叢不同的腐蚀外施相扶統时形成的浓差电池电极电位;电极及应早致农金属和溶液的界面上形成双电展,双电鸟两侧的电伎差,即为电极电位,又称为处•对电极电位。
平衡电位:当金属浸在同种金爲禹子的濬液中发生唯一的一种电极反应,且当电极反应达到动态平衡时,印金属的溶解速度等于金属离子的況积速度,将这种电位称为平衡电位戏可逆电位.腐蚀电位:材料在给定摘蚀依系*的电极电位。
非平衡电位:一个电极上同时发生两个或两个以上的电极反应,当动态平衡时,电极上不能出现粉质交换与电荷交换均达到平衡的悄况,此时的电极电位称非平衡电位。
极化:由于电极上有净电流通过,电极电位显著僞离了未通电时的开略电位(平虧电位或非平衡的稳态电位),这种现象通帑称为极化.过电位:某一极化电流下而叛生的电极电位E僞离于原电极平衡电位Ee的曼化值的址对值,称作该电极反应的过电位。
金属腐蚀与防护课后习题答案(精选)

第二章2. 某腐蚀体系的参数为:E 0a = -0.4V ,E 0c = 0.8V ,E cor = -0.2V 。
当R = 0时,I cor = 10mA ,该腐蚀电池属于什么控制类型?如果欧姆电阻R = 90Ω,那么I 'cor =? 腐蚀电池又属于什么控制类型?解:由题可知:当R=0时有: I cor =(Eoc-Eoa)/ (Pc+Pa )Pc+Pa=(Eoc-Eoa)/ I cor =(0.8+0.4)/10×210-=120ΩPc=(Eoc-Ec)/ I cor =(0.8+0.2)/10×310-=100Ω则有 Pa=120-100=20Ω因为Pc>>Pa ,所以该电池属于阳极极化控制。
当欧姆电阻R=90Ω时有:'Icor=(Eoc-Eoa)/(Pc+Pa+R)=(0.8+0.4)/(120+90)=5.71mA因为R 与Pc 接近,所以该腐蚀电池为欧姆电阻和阳极极化共同控制。
第四章5. 一个活化极化控制腐蚀体系,阴极反应和阳极反应的交换电流密度为0c i 、0a i ;Tafel斜率为b c 、b a ;腐蚀电位满足条件E ea <<E cor <<E ec 。
设加入阴极性缓蚀剂,使阴极反应受到抑制,阴极反应交换电流密度改变为)(0'c i 。
假定其他参数都不改变,此时腐蚀电位负移到E 'cor ,腐蚀电流密度下降到i 'cor 。
(1) 作加入缓蚀剂前后腐蚀体系的极化曲线图。
(2) 用图解法求腐蚀电流密度的变化r = i 'cor / i cor 和腐蚀电位的变化∆E = E 'cor – E cor 。
解:极化曲线如右图;由(1)的极化曲线利用图解法求解得:在△ABC 中,1.2直线段位两平行线,则有:ADCD bc DBCD ba ====αβtan ,tanba ,bc 分别为未加入缓蚀剂时阳极反应和加入缓蚀剂后阴极反应的Tafel 斜率:根据AB babc bc DB AB BDCD ADCD DC CDAB DBAD DB AB ABDB DB 11)(,)(--+=+=+==即由图可知有:10001)(lg|)|lg |'|(lg ,)'(lg|)|lg |'|(lg --=--==--=cc c c corcor cor cor i i i i AB i i i i DB,','lg'lg,)|||'|(lg)()'(lg111BD BDCD CD E E i i babc bc i i i i BDCD ADCD BD CDi i cor cor cc corcor c c corcor ⨯==-+=∴⨯+=--- 又0'lg'lg'cc cc cor cor i i bcba babc i i bcba bc ba E E E +=⨯+⨯=-=∆∴第四章6. 一个阳极反应受活化极化控制、阴极反应受浓度极化控制的腐蚀体系,阴极反应的极限扩散电流密度为i d ,腐蚀电位为E cor 。
高中化学 1.3.2 金属的腐蚀与防护配套 鲁科版选修4

二、金属腐蚀规律 1.不同类型腐蚀快慢的规律 电解原理引起的腐蚀>原电池原理引起的腐蚀>化学腐蚀>有 防护措施的腐蚀。
编辑课件
2.电化学腐蚀规律 (1)对同一种金属来说:强电解质溶液>弱电解质溶液>非电 解质溶液。 (2)对活动性不同的两种金属:活动性差别越大,活泼金属腐 蚀越快。 (3)对同一种电解质溶液来说:电解质溶液浓度越大,腐蚀越 快;氧化剂浓度越高,腐蚀越快。 (4)对于不同氧化剂来说:氧化性越强,金属腐蚀越快。
编辑课件
3.(2012·济宁高二检测)钢铁在潮湿的空气中往往因电化学过程 而被腐蚀,下列方程式在钢铁的电化学腐蚀过程中不存在的是
() A.Fe-2e-====Fe2+ B.2H2O+O2+4e-====4OH- C.2Fe+2H2O+O2====2Fe(OH)2 D.Fe-3e-====Fe3+ 【解析】选D。钢铁吸氧腐蚀时,负极反应为Fe-2e-====Fe2 +,不会生成Fe3+,正极反应为2H2O+O2+4e-====4OH-, 总反应式为2Fe+2H2O+O2====2Fe(OH)2,故选D。
3.电化学腐蚀中阳极的腐蚀速率更快些。( )
分析:电化学腐蚀为原电池反应,负极失电子,更易被腐蚀。
编辑课件
4.将轮船底部嵌入锌块,可有效地减缓轮船的锈蚀。( √ ) 分析:锌块与船体构成原电池,船体作为原电池的正极被保 护。 5.在铁中添加镍、锰等,是为了运用电化学原理形成原电池 减缓铁的锈蚀。( × ) 分析:在铁中添加镍、锰等,是改变了金属的内部结构而减 缓铁的锈蚀。
编辑课件
4.(2012·温州高二检测)下图容器中盛有海水,铁在其中被腐 蚀时由快到慢的顺序是( )
A.4>2>1>3 C.4>2>3>1
高二化学选修四第四章《金属的电化学腐蚀与防护》(含答案解析)

合金、金属的腐蚀与防护一、选择题(每题有1-2个选项符合题意)1.下列说法中不正确的是( )A.合金属于纯净物B.合金的硬度大于各成分金属C.合金的熔点低于各成分金属D.目前世界上用途最广的合金是钢2.下列关于镁铝合金的说法正确的是( )A.熔点比镁、铝都高B.熔点比镁、铝都低C.硬度比镁、铝都小D.硬度比镁、铝都大3.下列有关合金性质的说法正确的是( )A.合金与各成分金属相比,具有许多优良的物理、化学或机械的性能B.相同金属元素形成的合金,元素的含量有可能不同,但其性能是相同的C.镁铝合金在盐酸中能完全溶解D.合金具有各成分金属性质之和4.所谓合金必须是( )①通过熔合而成②由两种或两种以上金属或金属与非金属组成③耐腐蚀④耐高温⑤具有金属的特性⑥铸造性能良好A.①②④B.①②③C.①②⑤D.①②⑥5.钢笔的笔头是合金钢,钢笔笔头尖端是用机器轧出的便于使用的圆珠体。
铱金笔的笔头是用不锈钢制成的,为了改变笔头的耐磨性能,故在笔头尖端点上铱金粒,为区别钢笔而叫铱金笔。
金笔的笔头是黄金的合金。
下列说法错误的是( )A.钢笔的笔头不易被氧化,抗腐蚀性能好B.铱金笔的耐磨性能比钢笔要好C.金笔的笔头和笔尖都是用纯金制成的D.金笔经久耐磨,书写时弹性特别好,是一种很理想的硬笔6.用于飞机制造业的重要材料是( )A.Mg—Al合金B.Cu—Sn合金C.Cu—Zn合金D.不锈钢7.钛合金被认为是21世纪的重要材料,有很多优良的性能,如熔点高、密度小、可塑性好、易于加工,钛合金与人体有很好的“相容性”,根据它的主要性能,下列用途不切合实际的是( )A.用来做保险丝B.用于制造航天飞机C.用来制造人造骨D.用于制造船舶8.属于新型合金的是( )A.18K金B.不锈钢合金C.储氢合金D.硬铝合金9.以下现象与电化学腐蚀无关的是( )A.黄铜(铜锌合金)制作的铜锣不易产生铜绿B.生铁比软铁芯(几乎是纯铁)容易生锈C.铁质器件附有铜质配件,在接触处易生铁锈D.银质奖牌久置后表面变暗10.钢铁的锈蚀过程中,下列五种变化可能发生的是( )①Fe由+2价转化为+3价②O2被还原③H+被还原④有Fe2O3·H2O生成⑤杂质碳被氧化除去A.①②B.③④C.①②③④D.①②③④⑤11.钢铁生锈过程发生如下反应:①2Fe+O2+2H2O=2Fe(OH)2;②4Fe(OH)2+O2+2H2O=4Fe(OH)3;③2Fe(OH)3=Fe2O3+3H2O。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
金属腐蚀与防护课后答案《金属腐蚀理论及腐蚀控制》习题解答第一章1.根据表1中所列数据分别计算碳钢和铝两种材料在试验介质中的失重腐蚀速度V-和年腐蚀深度V p,并进行比较,说明两种腐蚀速度表示方法的差别。
解:由题意得:(1)对碳钢在30%HNO3(25℃)中有:Vˉ=△Wˉ/st=(18.7153-18.6739)/45×2×(20×40+20×3+40×30)×0.000001=0.4694g/m?h又有d=m/v=18.7154/20×40×0.003=7.798g/cm2?hVp=8.76Vˉ/d=8.76×0.4694/7.798=0.53mm/y对铝在30%HNO3(25℃)中有:Vˉ=△Wˉ铝/st=(16.1820-16.1347)/2×(30×40+30×5+40×5)×45×10-6=0.3391g/㎡?hd=m铝/v=16.1820/30×40×5×0.001=2.697g/cm3说明:碳钢的Vˉ比铝大,而Vp比铝小,因为铝的密度比碳钢小。
(2)对不锈钢在20%HNO(25℃)有:3表面积S=2π×2.0+2π×0.015×0.004=0.00179m2015Vˉ=△Wˉ/st=(22.3367-22.2743)/0.00179×400=0.08715g/ m2?h试样体积为:V=π×1.52×0.4=2.827cm3d=W/V=22.3367/2.827=7.901g/cm3Vp=8.76Vˉ/d=8.76×0.08715/7.901=0.097mm/y对铝有:表面积S=2π×2.0+2π×0.02×0.005=0.00314m202Vˉ=△Wˉ/st=(16.9646-16.9151)/0.00314×20=0.7882g/ m2?h试样体积为:V=π×22×0.5=6.28cm3d=W/V=16.9646/6.28=2.701g/cm3Vp=8.76Vˉ/d=8.76×0.7882/2.701=2.56mm/y试样在98%HNO3(85℃)时有:对不锈钢:Vˉ=△Wˉ/st=(22.3367-22.2906)/0.00179×2=12.8771g/m2?hVp=8.76Vˉ/d=8.76×12.8771/7.901=14.28mm/y对铝:Vˉ=△Wˉ/st=(16.9646-16.9250)/0.00314×40=0.3153g/m2?h Vp=8.76Vˉ/d=8.76×0.3153/2.701=1.02mm/y说明:硝酸浓度温度对不锈钢和铝的腐蚀速度具有相反的影响。
3.镁在0.5mol/L NaCl溶液中浸泡100小时,共放出氢气330cm3。
试验温度25?C,压力760mmHg;试样尺寸为20?20?0.5 (mm)的薄板。
计算镁试样的失重腐蚀速度V p。
(在25?C时水的饱和蒸汽压为23.8mmHg)解:由题意得:该试样的表面积为:S=2×(20×20+20×0.5+20×0.5)×610-m210-=840×6压力P=760mmHg-23.8mmHg=736.2mmHg=98151.9Pa根据PV=nRT则有放出的氢气的物质的量为:n=PV/RT=98151.9×330×610-/8.315×(25+273.15)=0.01307mol又根据Mg+2+HH—>+2Mg+2Mg腐蚀的量为n(Mg)=0.01307mol所以:Vˉ=nM(Mg)/St=0.01307×24.3050/840×610-×100=3.7817g/m2?h查表得:d Mg=1.74g/cm3有:Vp=8.76Vˉ/d=8.76×3.7817/1.74=19.04mm/y4.表面积4cm2的铁试样,浸泡在5%盐酸溶液中,测出腐蚀电流为Icor=0.55mA。
计算铁试样的腐蚀速度V-和V p。
解:由题意得:根据Vˉ=A/nF=i cor可知Vˉ=(A/nF)I cor/s=55.845×0.55×0.001/2×26.8×4×0.0001=1.4326g/m2?h 查表得d(Fe)=7.8g/cm3Vp=8.76Vˉ/d=8.76×1.4326/7.8=1.61mm/y即铁试样的腐蚀速度Vˉ=1.4326g/㎡*h Vp=1.61mm/y第二章1.将铜片和锌片插在3%NaCl溶液中,测得铜片和锌片未接通时的电位分别为+0.05V和–0.83V。
当用导线通过电流表把铜片和锌片接通,原电池开始工作,电流表指示的稳定电流为0.15mA。
已知电路的欧姆电阻为200Ω。
(1)原电池工作后阳极和阴极的电位差E c–E a=?(2)阳极极化值?E a与阴极极化值?E c的绝对值之和?E a+∣?E c∣等于多少?(3)如果阳极和阴极都不极化,电流表指示应为多少?(4)如果使用零电阻电流表,且溶液电阻可以忽略不计,那么电流达到稳态后,阳极与阴极的电位差E c–E a、阳极极化值与阴极极化值的绝对值之和?E a+∣?E c∣等于多少?电流表的指示又为多少?解:由题意得:(1):根据Ec-Ea=IR则有:Ec-Ea=IR=0.51mA×200欧=30mV=0.03V即原电池工作后阳极和阴极的电压差Ec-Ea=0.03V(2):△Ea=Ea-Eoa|△Ec|=Eoc-Ec△Ea+|△Ec|=Ea-Eoa+Eoc-Ec=(Eoc-Eoa)-(Ec-Ea)=0.05+0.83-0.03=0.85V即阳极极化值△Ea与阴极极化值△Ec的绝对值之和为0.85V。
(3):如果阳极和阴极都不极化,则有Pc=0,Pa=0I cor=(Eoc-Eoa)/R=(0.05+0.83)/200=0.0044A=4.4mA即电流表指示应为4.4mA。
(4):当使用零电阻电流表时有,阳极与阴极的电位差Ec=Ea,则有:电位差Ec-Ea=0由(2)知:△Ea+|△Ec|=(Ea-Ec)-(Eoa-Eoc)=0-(-0.83-0.5)=0.88V Pc+Pa=(Eoc-Ec+Ea-Eoa)/I cor=(0.88-0.03)/0.15×310-=5666.7ΩI=(Eoc-Eoa)/(Pc+Pa)=(0.05+0.83)/5666.7=0.000155A2.某腐蚀体系的参数为:E0a=-0.4V,E0c=0.8V,E cor=-0.2V。
当R=0时,I cor=10mA,该腐蚀电池属于什么控制类型?如果欧姆电阻R=90Ω,那么I'cor=?腐蚀电池又属于什么控制类型?解:由题可知:当R=0时有:I cor=(Eoc-Eoa)/(Pc+Pa)Pc+Pa=(Eoc-Eoa)/I cor=(0.8+0.4)/10×210-=120ΩPc=(Eoc-Ec)/I cor=(0.8+0.2)/10×310-=100Ω则有Pa=120-100=20Ω因为Pc>>Pa,所以该电池属于阳极极化控制。
当欧姆电阻R=90Ω时有:'Icor=(Eoc-Eoa)/(Pc+Pa+R)=(0.8+0.4)/(120+90)=5.71mA因为R与Pc接近,所以该腐蚀电池为欧姆电阻和阳极极化共同控制。
第三章1.在下列情况下,氧电极反应的平衡电位如何变化:(1)温度升高10?C(取Po2=1atm,pH=7)。
(2)氧压力增大到原来的10倍(温度25?C)。
(3)溶液pH值下降1单位(温度25?C)。
解:在中性溶液中,阴极的反应为:O2+2H2O+4-e=4OH-其平衡位则为Ee=E0(OH-/O2)+nF RT㏑(Po2/4OH a-)(1)当温度升高10℃后有:Ee=E0(OH-/O2)+nFT R)10(+×㏑(Po2/4OH a-)=E+nF RT㏑(Po2/4OH a)+nF R10㏑Po2/4OH a-则平衡电位变化量△Ee1=Ee’-Ee=nFR10㏑(Po2/4OH a-)=nF R10㏑Po2-nFR10㏑4OH a-又因㏑4OH a=2.3lg4OH a,则有lg OH a=pH -14所以:△Ee1=10×8.314/(4×96500)×㏑Po2-10×8.314/(4×96500)×4×2.3×(7-14)=0+0.01387=0.0139V>0即:温度升高10℃后平衡电位正移0.0139V。
(2)当氧压力增加到原来的10倍时''2Ee=E+nF RT㏑(10Po2/4OH a)=E+nF RT ln10+nFRT㏑(Po2/4OH a-)△E2=Ee’’-Ee=nF RT ln10=(8.314×298.15)/(4×96500)×2.3=0.0148V>0即氧压力增大到原来的10倍时有氧电极平衡电位正移0.0148V(3)当溶液pH值下降1时有'''3Ee=E+nF RT㏑(Po2/'4OH a-)=E+nF RT ln Po2-nF RT4㏑'OH a-ΔE3=Ee’’’-Ee=E+nF RT ln Po2-nF RT4㏑'OH a-(E+nF RT ln Po2-nF RT4㏑OH a)=nF RT 4- 2.3('PH-14)+nFRT4 2.3(pH-14)=F RT×2.3=965003.215.298315.8??=0.0591V>0即pH值下降1个单位,氧电压反应平衡电位正移0.0591V。
2.将铁置于饱和空气的碱溶液(pH=10)中,按阳极反应为(1)Fe+Fe2++2e。
