MDCK细胞介绍
低成瘤性MDCK单克隆细胞系的建立、成瘤性分析及应用研究

低成瘤性MDCK单克隆细胞系的建立、成瘤性分析及应用研究低成瘤性MDCK单克隆细胞系的建立、成瘤性分析及应用研究引言:近年来,肿瘤细胞系的建立和应用研究在肿瘤研究领域取得了巨大的进展。
然而,目前存在的一些传统肿瘤细胞系在体内表现出较高的成瘤性和恶性特征,限制了其在肿瘤研究和药物筛选方面的应用。
因此,需要建立一种低成瘤性的肿瘤细胞系,以更准确地模拟体内肿瘤发展过程,并用于更有效的药物研发和治疗策略的开发。
一、MDCK单克隆细胞系的建立1. 研究方法本研究基于MDCK(Madin-Darby Canine Kidney)细胞系,通过克隆形成单克隆细胞系。
首先,用限稀稀释法将MDCK细胞分散于培养基中,制备成单细胞悬浮液。
再将MDCK单细胞悬浮液均匀涂布于96孔培养板中,每个孔落仅含有一个细胞,并进行培养。
最后,挑选出生长正常、形成正常压膜和细胞结构完整的单克隆细胞株。
2. 建立的低成瘤性MDCK单克隆细胞系经过多次筛选和鉴定,我们成功建立了一株低成瘤性的MDCK单克隆细胞系。
通过形态观察、免疫组化染色和PCR等方法,确认该细胞系与传统MDCK细胞系在基因型和表型上存在一定差异。
低成瘤性细胞系具有更规则的形态、低迁移和侵袭能力,以及较低的增殖速率。
二、低成瘤性分析1. 形态学特征与传统MDCK细胞系相比,低成瘤性细胞系的细胞形态更规则,细胞间紧密排列,细胞大小均匀。
光镜下观察,细胞表面没有突起、伸展和口袋形成。
这些特征表明该细胞系在体内形成肿瘤的能力较低。
2. 体外功能特点通过胶原基质侵袭实验、Transwell迁移实验和MTT增殖实验,我们研究了低成瘤性细胞系在体外的功能特点。
与传统MDCK细胞相比,低成瘤性细胞系在胶原基质侵袭和细胞迁移能力方面表现较低,而在细胞增殖速率方面则较慢。
这些结果表明低成瘤性细胞系的肿瘤形成能力较差。
三、应用研究1. 肿瘤模型的构建在小鼠体内,将低成瘤性MDCK细胞系与其他传统MDCK细胞系注射到小鼠体内,观察两者在体内的生长和发展。
MDCK细胞库的建立及其生物学特性研究

MDCK细胞库的建立及其生物学特性研究王家敏;平玲;沈武玲;徐水林;魏园园;马忠仁;乔自林【摘要】分别从美国典型培养物保藏中心(ATCC)、中国典型培养物保藏中心(CCTCC)、北京协和细胞资源中心及某企业引进4株MDCK细胞系,扩大培养后液氮冻存,分别建立种子细胞库和工作细胞库.细胞复苏后分别对每株细胞进行了活力、形态、生长曲线、微生物污染、核型及荧光蛋白质粒转染表达等特性研究.结果表明,4个来源的MDCK细胞均呈上皮型,生长状态良好;生长曲线呈S型;细菌、真菌、支原体检测都为阴性;染色体2n=78;外源质粒在该细胞中能进行复制和表达.建立的细胞库为开展MDCK细胞及流感细胞基质疫苗的研究提供了基础理论依据和细胞资源.%Four cell lines were imported form ATCC, CCTCC, Xiehe Cell Resource Center of Beijing and a factory, and then these four cell lines were preserved with liquid nitrogen. Observations on morphology, dynamic growth, microbial contamination, analysis of karyotype and fluorescin plasmid transfeetion and expresstion were carried out. The results showed that all the cell lines were epithelioid and grew well. The growth curve of MDCK cells were all "S". The tests for bacteria, fungi, virus and mycoplasma were all negative. The chromosomes were 78. The exogenous plasmid could copy and express in the cell. Those results show that the MDCK cell bank is established successfully, which lays the foundation of the work bases for the research of MDCK cell and influenza vaccine.【期刊名称】《山西农业科学》【年(卷),期】2012(040)012【总页数】5页(P1231-1234,1261)【关键词】MDCK细胞系;细胞库;生物学特性【作者】王家敏;平玲;沈武玲;徐水林;魏园园;马忠仁;乔自林【作者单位】甘肃省动物细胞工程技术研究中心,甘肃兰州 730030;西北民族大学生命科学与工程学院,甘肃兰州 730030;西北民族大学生命科学与工程学院,甘肃兰州 730030;西北民族大学生命科学与工程学院,甘肃兰州 730030;甘肃省动物细胞工程技术研究中心,甘肃兰州 730030;兰州民海生物工程有限公司,甘肃兰州730010;西北民族大学生命科学与工程学院,甘肃兰州 730030;甘肃省动物细胞工程技术研究中心,甘肃兰州 730030;甘肃省动物细胞工程技术研究中心,甘肃兰州730030【正文语种】中文【中图分类】Q813.1+1MDCK细胞系(Madin-Darby canine kidney cells)是从犬肾组织中分离培养获得的上皮样贴壁细胞,该细胞系可连续传代[1]。
MDCK细胞分离流感病毒ppt课件

2021/5/30
其实过期
10
• 近来由于PCR技术突习猛进地发展,发现了 通过鸡胚所分离到的流感病毒,其抗原性与 原始标本的有所不同,而通过MDCK细胞分离 出的,其抗原性与原始标本的相似。近来由 于“O”相毒株的重现,MDCK等一些细胞对 “O”相毒株的敏感性大大超出鸡胚的敏感 性。因此,MDCK等一些细胞已成为各流感病 毒分离不可缺少的一种宿主系统。
1
一、组织培养概况
(一)组织培养定义
组织或细胞培养是指从机体中取 出组织或细胞,模拟机体内的生理条 件在体外进行培养,使之生存和生长。
2021/5/30
其实过期
2
(二)、组织培养的原理
组织培养主要是为病毒易感的组织细胞提供一个 良好的生存环境,使细胞对环境产生适应性,获得生 长繁殖的能力。
病毒在敏感细胞中繁殖,常可引起细胞代谢等方 面的变化,可出现细胞病变并释放病毒到维持液中, 这种情况可用细胞病变、色变法及检测维持液中病毒 抗原的方法,判定病毒的存在及滴度。
• 0.25%胰酶和Versene消化液
• 双抗(青、链霉素)或庆大霉素和抗真 菌素
• 胎牛或小牛血清
2021/5/30
其实过期
12
• (1)细胞生长液配制
90ml Eagle’s 液 + 含 终 浓 度 为 100u/ml青霉素和100ug/ml链霉素+10ml小 牛 血 清 +2ml 5.6%NaHCO3 PH 调 至 7.27.4。
• (6)收获及红细胞凝集活性(HA)检查:当CPE出现 +++~++++号时进行收获,由于CPE无法证实就是流感 病毒所造成。最后还得看维持液中是否有红细胞凝集 活 性 ( HA ) , 出 现 细 胞 凝 集 的 为 阳 性 标 本 , 收获所有的维持液进行病毒鉴定,也可暂冻存之 。
MDCK细胞培养技术
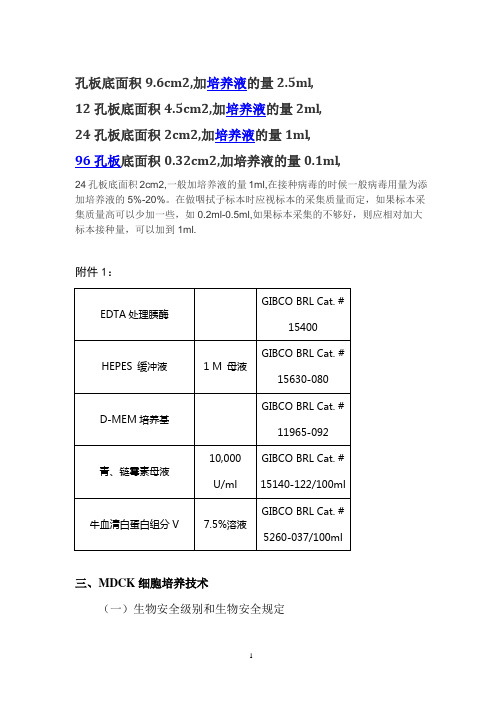
孔板底面积9.6cm2,加培养液的量2.5ml,12孔板底面积4.5cm2,加培养液的量2ml,24孔板底面积2cm2,加培养液的量1ml,96孔板底面积0.32cm2,加培养液的量0.1ml,24孔板底面积2cm2,一般加培养液的量1ml,在接种病毒的时候一般病毒用量为添加培养液的5%-20%。
在做咽拭子标本时应视标本的采集质量而定,如果标本采集质量高可以少加一些,如0.2ml-0.5ml,如果标本采集的不够好,则应相对加大标本接种量,可以加到1ml.附件1:三、MDCK细胞培养技术(一)生物安全级别和生物安全规定1. MDCK细胞培养实验室生物安全级别:正常MDCK细胞培养在生物安全二级实验室进行。
2. MDCK细胞培养实验室生物安全规定:遵守生物安全实验室相应的生物安全规定。
(二)MDCK细胞的传代培养步骤1. 细胞培养所需的材料(部分试剂在此列出生产厂家货号仅供参考,可自行选择):(1)生长成片的MDCK细胞;(2)T-75细胞培养瓶,颈口有倾角;(3)D-MEM培养液;(4)青、链霉素母液(10,000U/mL青霉素G;10,000µg/mL硫酸链霉素),分装后保存于-20℃;(5)HEPES缓冲液,1M母液;(6)胎牛血清;(7)EDTA-胰酶(0.05%胰酶;0.53mMEDTA·4Na)(Gibco CatNo. 25300-062),分装后保存于-20℃;(8)牛血清白蛋白组分V,7.5%溶液(GIBCO CatNo. 15260);(9)1mL和10mL无菌移液管等;(10)70%~75%的酒精。
建议:经常检查试剂使用的有效期和MDCK细胞的代数。
2. 培养基和试剂的准备:(1)500mL的D-MEM液中加入a) 青、链霉素母液5mL(终浓度达:100U/mL青霉素和100µg/mL 链霉素);b) H EPES缓冲液12.5mL(终浓度:25mM);c) 7.5%牛血清白蛋白组分V12.5mL。
MDCK无血清培养基说明书(2015.9.16)

MDCK细胞传代 1. 细胞长至融合度达到80%-90%时,弃去培养液,用PBS或不含钙镁的Hank’s液清洗 细胞2-3遍。 2. 加入适量0.25%的EDTA-胰酶,37℃,5%CO 2培养箱中孵育至细胞收缩变圆,轻拍培养 瓶可见细胞移动即可。 3. 加入无血清培养基终止消化,用吸管轻轻吹打,使细胞分散。 4. 细胞悬液转入离心管中,800 rpm离心5分钟,去除上清液,重新加保存 有效期12个月
产品特性
1. MDCK细胞无血清培养基化学成分限定,不含胎牛血清。 2. MDCK细胞无血清培养基培养MDCK细胞,连续传代50代,细胞特性无改变。 3. MDCK细胞无血清培养基培养MDCK细胞的倍增时间是17.1小时。
使用说明
MDCK细胞复苏 1. 从液氮罐中取出冻存管直接置于37℃温水中,并不断地轻轻摇动,使管中的液体迅速 融化。 2. 用吸管吸取10 ml 预温的MDCK无血清培养基到15 ml离心管中,冻存管用75%酒精擦拭 表面后,将细胞悬液吸到15 ml离心管中,混匀。 3. 800 rpm离心5分钟,除去上清液,用适量预温的无血清培养基重悬细胞,接种于细胞 培养瓶中。 4. 37℃,5%CO2培养箱中培养,次日更换一次培养液,继续培养1-2天至细胞铺满瓶底的 80%-90%进行传代。
2 5. 以(1-5)×10 cells/cm 接种于细胞培养瓶内,置37℃ 5%CO2 培养箱中培养,细胞长满 4 2
瓶底80%-100%后进行下一次传代(一般2-3天传代一次)。 MDCK细胞冻存 1. 选取融合度达80%的MDCK细胞用于冻存。 2. 依据传代方法把消化好的细胞收集于离心管并计数,800 rpm离心5分钟。 3. 去除上清液,加入商品化的细胞冻存液或无血清配制的冻存液(冻存液需要提前预冷), 冻存液中细胞的最终密度为(5-10)×10 cells/mL。用吸管轻轻吹打是细胞混匀,然后 分装至无菌冻存管中,每只冻存管加液1-1.5 mL。 4. 细胞经过程序降温后置于液氮中保存。 流感病毒的分离与培养 1. 选取融合度75%-90%的MDCK细胞,弃去培养液,PBS或不含钙镁的Hank’s液清洗 细胞2-3遍。 2. 加入200 uL的流感病毒标本,温和摇动数次。 3. 放于37℃、5% CO2培养箱中吸附1-2小时。 4. 加入6 mL流感病毒分离无血清培养基于培养瓶中。放置于35℃,5%CO2培养箱中培养。 5. 每日观察细胞病变情况。无血清培养基培养的MDCK细胞,病毒侵染后释放快,请及 时收获病毒。
不同代次MDCK细胞对流感病毒的敏感性比较

不同代次MDCK细胞对流感病毒的敏感性比较比较不同代次的狗肾传代(MDCK)细胞对流感病毒的敏感性差异。
方法选择生长状态及形态良好的、不同代次的MDCK细胞,在相同培养条件下同时接种流感样病例咽拭子标本,观察细胞病变,细胞收获后采用血凝试验测定病毒血凝效价和分离率;以参考流感病毒株测定TCID50值,比较不同代次MDCK细胞对流感病毒的敏感性。
结果3个不同代次的MDCK 细胞对流感样病例标本的分离阳性率、血凝效价相比差异无统计学意义,且3者TCID50 值相比,相差不超出1个Lg。
结论在相同实验条件以及细胞生长状态和形态良好的情况下,不同代次的MDCK细胞对流感病毒的敏感性无差异。
病毒分离培养是流感病原学监测的基础,是流感病毒诊断最常用和最可靠的方法之一[1]。
狗肾传代(MDCK)细胞成本低,对流感病毒较敏感[2],广泛应用于对流感病毒的常规监测中。
有资料表明,MDCK细胞的胞龄、密度等因素均会影响流感病毒分离的阳性率[3]。
之前有人对细胞种类、培养液中胎牛血清浓度等影响病毒分离的因素做了研究[4,5],但MDCK细胞传代次数是否会影响流感病毒的分离效果还未见报道。
研究旨在探讨代次相差较大的MDCK细胞对流感病毒的分离培养是否存在差异。
1 材料与方法1.1 主要试剂和耗材进口DMEM培养基,0.25%EDTA-胰蛋白酶,进口胎牛血清,1%豚鼠血红细胞,细胞培养板。
1.2 MDCK细胞及标本来源3个代次的MDCK细胞(P23、P45、P143)由四川省疾控中心微生物实验室日常传代保存,细胞生长状态和形态良好,细胞传代方法见参考文献[1];流感样病例标本采集自四川省流感监测哨点医院。
1.3 参考病毒株实验用参考流感病毒株(B/四川安岳/139/2011)分离自哨点医院流感样病例标本,由四川省疾控中心微生物实验室鉴定后经国家流感中心复核,血凝效价1:32,半数细胞感染量(TCID50)为6.0,-70℃冰箱保存。
什么是CHO细胞、MDCK细胞、Vero细胞和EB66细胞

CHO细胞,即中国仓鼠卵巢细胞(Chinese hamster ovary),该细胞具有不死性,可以传代百代以上,是目前生物工程上广泛使用的细胞。
全世界批准正式应用于人类疾病治疗或疾病预防的基因工程产品约有三十多种,其中只有一种(乙肝疫苗)是由酵母菌生产的,其余所有产品都是由CHO细胞和大肠杆菌生产的,大肠杆菌不能形成有活性的二聚体(如白介素2),也不具有糖基化的功能(如EPO),而CHO却具有如上的功能,因此CHO成为表达复杂生物大分子的理想宿主。
另外CH0细胞在基因工程使用中还有一个优点,该细胞属于成纤维细胞(fibroblast),是一种非分泌型细胞,它本身很少分泌CHO内源蛋白,因此对目标蛋白分离纯化工作十分有利。
MDCK细胞的来源:MDCK是S.H.MADIN于1958年9月建成,来源于考克斯班尼犬肾脏,该肾脏细胞原代培养时其形态类似于成纤维细胞,经过胰蛋白酶和EDTA混合消化液的连续6次消化法纯化而上皮样细胞,每次纯化间隔时间为7D。
培养中MDCK细胞具有远段肾小管与集合管,来源细胞的分化特性。
MDCK细胞株至少有两种细胞类型,一种命名为C5A,其在含I型胶原的培养物中生长时,能分泌液体,导致囊肿形成,但在塑料面的培养低物上培养时,能分泌液体,却不能形成囊肿,另一种细胞正好相反。
2.MDCK细胞的用途:MDCK细胞被广泛用作远曲小管或集合管的模型,还可用于代谢研究和Pg级药物与药物相互作用研究以及观察流感病毒株对细胞功能的影响。
3.MDCK细胞的培养,的确有的用DMEM培养基,有的用MEM培养基,培养某一类型细胞没有固定的培养条件。
在MEM中培养的细胞,很可能在DMEM或M199等培养基中同样很容易生长。
所以我认为你可以任意选择。
我过去比较喜欢用DMEM培养基。
4.高糖DMEM与低糖DMEM的区别是:高糖DMEM的葡萄糖含量是25.5mmol/L,而低糖DMEM的糖含量是5.5mmol/L,其中低糖DMEM的糖含量与一般的培养基相同,所以可以和其他一般培养基通用,而高糖DMEM主要用在肿瘤等特殊细胞的培养,如何选择需要依照要求而定。
MDCK细胞流感疫苗的安全性2讲课【40页】

第十八页,共40页。
18
1c. 细胞系特征 – 致瘤性
• 完整细胞: 在4周裸鼠研究6个月
阴性对照 101 MDCK, p98 103 MDCK, p98 105 MDCK, p98 107 MDCK, p98 107 MDCK, p56 (ATCC) 阳性对照 (107 HeLa)
发病率
0/26 0/26 0/26 18/26 30/30 23/26 25/26
规格: < 10 纳克/剂量
第三十二页,共40页。
生产规模 证实试验正在进行 (包
括含量和大小)
32
2. DSP – 总结
• 足够的纯化和试验,保证疫苗的安全性 • 根据最近的科学知识和管理手册,Solvay
公司正在进行申报
第三十三页,共40页。
33
MDCK细胞 安全性评价
1. 细胞系特征 2. 生产下游过程 3. 终产品的安全性
第十五页,共40页。
15
1b. 细胞系特征 – 外源因子
• 特异性检测自然感染的狗病毒
• 特异性检测对MDCK细胞敏感的病毒
在Solvay公司的 MDCK细胞中未发现有外来的病毒感染
第十六页,共40页。
16
1c. 细胞系特征 –致癌性
• 表型特征在动物模型上肿瘤形成 • 疫苗成品检测
– 完整细胞
传代用于疫苗生产
97: 制备延长的细胞库
传代用于安全性评估
14
第十四页,共40页。
1b. 细胞系特征 – 外源因子Adventitious agents
• 支原体
• 无细菌和真菌
• 在试管内在检测细胞系中共培养
• 在机体水平检测不同的种类 • 电镜检查 • 反转录病毒检测
MDCK细胞分离禽流感病毒

一、目的流感病毒的MDCK细胞分离方法是流感实验的关键技术,用于流感病毒的分离、培养。
本SOP是为确保MDCK细胞分离流感病毒的操作准确、规范和可靠而制定。
(二)材料1、75%~90%成片的MDCK细胞,选用合适大小的细胞培养瓶和细胞培养板来用做病毒分离2、胰酶(牛胰腺来源Ⅷ型)3、HEPES缓冲液,1M母液4、D-MEM培养基,Hank's液5、青、链霉素母液(10000U/mL 青霉素G;10000µg/mL硫酸链霉素6、牛血清白蛋白组分Ⅴ,7.5%溶液7、临床样品0.5mL8、1mL无菌移液管9、10mL无菌移液管10、15mL无菌离心管(三)实验步骤1、准备病毒生长液(1)细胞维持液准备500mL D-MEM液中加入①青、链霉素母液5mL(终浓度达:100U/mL青霉素;100µg/mL链霉素)②牛血清白蛋白组分Ⅴ12.5mL(终浓度:0.2%)③HEPES缓冲液12.5mL(终浓度:25mM)(2)病毒生长液每500mL细胞维持液中加入0.5mL的TPCK-胰酶(母液浓度为2mg/mL)使TPCK-胰酶的终浓度为2µg/mL。
2.流感病毒MDCK细胞分离步骤:(1)75%~90%成片细胞的准备,以选取T25细胞瓶为例。
①用40×物镜观察细胞生长状态。
②轻轻倒出细胞生长液,用10mL的无菌移液管吸取6mL Hank's液分别清洗细胞3遍。
(2)细胞培养瓶的接种①用无菌的移液管将清洗细胞的Hank's液从细胞培养瓶中移出。
②用无菌的移液管吸取适量临床标本置于细胞培养瓶中,温和摇动数次。
③然后放于37℃,5%CO2培养箱中吸附1~2h。
④吸出接种物,用10mL的无菌移液管吸取6mL Hank's液分别清洗细胞2遍。
然后加入6mL 病毒生长液于细胞培养瓶中。
⑤放置于33~35℃培养箱培养。
⑥每日观察细胞病变情况。
(细胞病变的特征是细胞肿胀圆化,细胞间隙增大,细胞核固缩或破裂,严重时细胞部分或全部脱落)。
哺乳动物细胞培养生产流感疫苗

哺乳动物细胞培养生产流感疫苗摘要动物细胞培养是模拟体内生理环境使分离的动物细胞在体外生存、增殖的一门技术。
动物细胞培养是现代生物制药的重要技术之一,不仅可以通过直接培养动物细胞制备相关药用产品,而且还可以将动物细胞作为宿主细胞表达生产原核细胞所不能生产的药用物质。
对于许多人用和兽用的重要蛋白质药物和疫苗,尤其是那些相对分子质量较大、结构较复杂或糖基化的蛋白质来说,动物细胞培养是首选的生产方式。
传统的流感疫苗生产多采用鸡胚培养,但该生产过程易受微生物污染、内毒素残余量高、对流感大流行应急能力差,因此基于哺乳动物细胞培养的病毒疫苗工业的发展变得尤为重要。
本文重点是MDCK细胞生产流感疫苗的研究以及临床应用现状。
研究背景动物细胞培养是在动物组织培养基础上发展起来的,起源于19世纪的某些胚胎学技术,奠基人是美国生物学家哈里森(Harrison)。
1907年,哈里森采用盖玻片覆盖凹窝玻璃悬滴培养法将蛙胚的神经组织培养在淋巴液中,使细胞存活了几周时间,并观察到细胞突起的生长过程,开创了动物组织培养的先河。
法国学者卡雷尔(Carrel)设计的卡氏培养瓶1923年用于培养鸡胚的心肌组织取得成功,极大地推动了动物细胞培养技术的建立。
流行性感冒(以下简称流感)是由流感病毒引起的急性呼吸道传染病,其临床特征是全身不适症状比一般感冒厉害,能引起心肌炎、肺炎和支气管炎等多种并发症,而且可以侵犯所有的年龄层。
由于流感病毒具有高度传染性,能在短期迅速蔓延,造成不同程度的流行,甚至世界范围内的大流行。
20世纪,甲型流感病毒曾引起过4次全球流行,1918-1919年的西班牙流感(H1N1),历时18个月,导致二千万至四千万人死亡,是历史上最严重的一次流感暴发。
进入21世纪,禽流感成为危害世界养禽业发展的重要因素。
2004年至今,由甲型H5N1流感病毒引起的禽流感病毒肆虐全球多个国家和地区,并且由染病禽类传染到人,累计造成250多人死亡。
[精品文档]MDCK细胞介绍
![[精品文档]MDCK细胞介绍](https://img.taocdn.com/s3/m/a28268c71eb91a37f0115c6e.png)
[精品文档]MDCK细胞介绍MDCK细胞介绍(MDCK Cells introduction)MDCK细胞系(MDCK Cell Lines)由Madin和Darby于1958年从美国Cocker Spaniel母曲架犬的肾脏组织分离培育建立,通常是以贴壁方式生长的上皮样细胞。
犬肾上皮连续细胞系MDCK (Madin-Daby canine kidney cells) 细胞株购买信息:ATCC MDCK cell lines。
目前,MDCK细胞系(MDCK Cell Lines)广泛用于多种病毒的扩增和纯化,如:呼肠孤病毒)、腺病毒、犬细小病毒、猫粒细胞缺乏症病毒)及禽流感病毒等。
由于其病毒感染效率高、增殖快,且不易变异,MDCK细胞系(MDCK Cell Lines)被公认为最适于甲、乙型流感病毒疫苗生产的3种细胞系之一。
传统的MDCK细胞培养大多采用有血清贴壁培养方式。
血清是由血浆去除纤维蛋白而形成的一种复杂混合物,其含有细胞生长所需的生长因子、激素、载体蛋白、贴壁因子、微量元素以及其他营养物质,可以有效地促进细胞生长和产物表达。
然而,血清的应用也存在许多问题:易受病毒、支原体或其他病原体的污染;批间差异造成产品批次间的质量难以严格控制;大量血清蛋白的存在增加了下游分离纯化的难度,部分蛋白难以通过分离纯化手段彻底去除,影响了产品的最终质量;此外,血清来源困难、价格昂贵,大规模动物细胞培养过程中使用血清将会大大增加生产成本。
犬肾细胞MDCK无血清培养基 UltraMDCK Serum-free Medium 产品介绍MDCK无血清培养基是一种在经过优化的基础培养基中只添加了重组人胰岛素蛋白和牛转铁蛋白的低蛋白含量的成分配制而成的SFM培养基。
与在含有血清生长环境中相比,在MDCK无血清培养基中生长的MDCK细胞较小并紧密成团。
在不更换培养基的条件下,MDCK细胞可以持续旺盛生长至少2周时间。
经过MDCK细胞的持续生长,从单层细胞形成球形结构,通常我们称这种球形结构为“漂浮物”。
用MDCK细胞生产灭活流感病毒疫苗

对于瘤性和成瘤性细胞作为细胞基质的担忧1,瘤性和成瘤性细胞可以形成肿瘤,有可能转化受体人群形成肿瘤。
解决方法:通过去除完整细胞来解决。
2,外源因子,可以诱导瘤性和成瘤性表型的外源因子可能存在于细胞中,瘤性和成瘤性细胞有更好的支持病毒生长的能力,所以可能存在外源物质。
解决方法:(1)通过限制瘤性和成瘤性细胞的使用,(2).扩大对致瘤性物质和其他相关物质的检测。
3,在瘤性和成瘤性细胞中存在的DNA可能是致瘤性或有感染性的物质。
解决方法:(1). 在动物体内对细胞基质DNA的致瘤性进行检测,(2).降低细胞残留DNA的含量,(3).降低功能性(分子大小和其他性质)残留DNA的含量。
4,病毒宿主和病毒细胞的相互作用,疫苗病毒包装的细胞DNA或者细胞成分是致瘤的。
解决方法:(1).证明最终的疫苗制品中不包含具有转化性质的DNA,(2).这对于细胞质中的RNA病毒(如流感病毒)不是问题,(3).通过灭活病毒方法制造疫苗。
5,用瘤性或者成瘤性细胞生产疫苗可能存在永生化和成瘤性相关的其他机制(致瘤性蛋白、RNA或其他可以诱导后天遗传改变的因子)对受体人群造成风险。
解决方法:(1).科学界的共识是这种其他机制存在的可能性不大,(2).使用弱成瘤性的细胞作为基质。
6,以前使用的成瘤性实验还不能充分确定成瘤性表型和使用成瘤性细胞的相关风险。
用MDCK细胞生产灭活流感病毒疫苗-VRBPAC meeting 2005-11-6流感的疾病影响:流感病毒每年冬季流行,约10-20%的世界人口被感染,在美国,2500万到5000万人被感染,导致2万人死亡和11万人住院,造成约120亿美元的健康负担。
世界范围的流感大流行有三次,1918-1919年西班牙流感流行导致2000万-4000万人死亡,1957年亚洲和1968年香港的流感流行导致150万人死亡。
流感疫苗需求:在美国常规免疫需要1.8亿人口的流感疫苗而且还在增加,目前鸡胚生产流感疫苗不能满足需求,也不能对变化的疫苗需求进行灵活应对。
MDCK-MDR1细胞药物体外吸收模型的建立及验证

2中的方法进行
最佳接种浓度和 培 养 时 间,按 照 1.
2的方法将最佳
接种浓 度 的 MDCK-MDR1 细 胞 接 种 于 培 养 板 上,
培养至最佳培养时间时,取出 3 孔细胞吸弃 DMEM
稀释成 0.
005、
0.
010、
0.
025、
0.
050 和 0.
100 mg/L 的
浓度,随后采用酶标 仪 测 量 不 同 浓 度 荧 光 黄 的 荧 光
强度(激发波长 427nm,发射波长 536nm),以荧光
强度为纵坐标,荧光黄浓度为横坐标,绘制荧光黄标
准曲线。
基(含有 1×10 U/L 青 霉 素/链 霉 素/两 性 霉 素 B、
(
AP)以 及 基 底 侧 (
BL)分 别 加 入 400、
600 μL 的
DMEM 高糖培养基,各组细胞均培养 7d,每天更换
DMEM 高糖培养基,分别 于 第 1、
3、
5 天 于 NIB620
FL 倒 置 显 微 镜 下 观 察 各 组 MDCK-MDR1 细 胞 的
形态变化情况。
1.
3 MDCK-MDR1 细胞增殖数量的测定
/L 谷氨酰胺和体积分数 0.
2 mmo
l
10 的 FBS)中,于
37 ℃ 、含有体积分数 0.
05CO2 的培养箱中培养。待
1.
5.
2 荧光黄转 运 实 验 根 据 1.
2~1.
4中的实验
结果,确 定 MDCK-MDR1 细 胞 形 成 单 层 膜 结 构 的
MDCK细胞致瘤性研究进展

2018年 第 48卷 ·第10期
lll—g综sh述u专zh论uan
照 , 以 鸡 胚 成 纤 维 细 胞 (CEF)和 幼 地 鼠 原 代 肾 细 胞 作 为 阴性 对 照 ,待 检 细胞 为完 整 活 细胞 , 或 者 为 完 整 活 细 胞 经 过 快 速 冻 融 (或 超 声 波 )裂 解 的 细 胞 碎 片 。 将 各 传 代 细 胞 系 按 代 次 (一 般 每 隔 5代 或 1O代 )分别 对 裸 鼠作 皮下 接 种 ,检 查 各 传 代 细 胞 接 种 裸 鼠后 有 无 肿 块 或 结 节 形 成 , 在 阳 性 和 阴 性 对 照 成 立 的 前 提 下 ,若 待 检 细 胞 接 种 裸 鼠后 无 肿 块 或 结 节 生 长 ,则 视 无 致 瘤 性 ; 若 待 检 细 胞 接 种 裸 鼠 皮 下 有 肿 物 或 结 节 生 长 , 并 经 病 理 组 织 解 剖 及 病 理 切 片 检 查 、 肿 瘤 鉴 定 和 裸 鼠 瘤 体 外 再 培 养 数 代 后 作 裸 鼠移 植 瘤 实 验 及 其 他 实 验 (软 琼 脂 中克 隆 形 成 实 验 等 )证 明为 恶 性 肿 瘤 的 ,则 视 为 致 瘤 性 细 胞 系 (株 )。 我 国 药 典 规 定 致 瘤 性 实 验 用 HeLa或 HeLa S3细 胞 或 其 他 已知 成 瘤 性 为 阳性 的 细 胞 ,每 只 裸 鼠接 种 l0 个 活 细 胞 ;用 人 二 倍 体 细 胞 作 为 阴 性 对 照 , 每 只 裸 鼠接 种 10 个 活 细 胞 ;待 检 细 胞 每 只裸 鼠 接 种 lOz个 活 细 胞 进 行 检 查 。 3 MDCK细胞 的致瘤性
国 帅口ng s综hu述 z专ht论kll lun Ill
2018年第48ห้องสมุดไป่ตู้·第1()期
MDCK细胞介绍

MDCK细胞介绍(MDCK Cells introduction)MDCK细胞系(MDCK Cell Lines)由Madin和Darby于1958年从美国Cocker Spaniel母曲架犬的肾脏组织分离培育建立,通常是以贴壁方式生长的上皮样细胞。
犬肾上皮连续细胞系MDCK (Madin-Daby canine kidney cells) 细胞株购买信息:ATCC MDCK cell lines。
目前,MDCK 细胞系(MDCK Cell Lines)广泛用于多种病毒的扩增和纯化,如:呼肠孤病毒(Reovius)、腺病毒(Adenovirus)、犬细小病毒(Canine parvovirus,CPV)、猫粒细胞缺乏症病毒(Feline panleukopenia virus,FPLV)及禽流感病毒(Avian influenza virus,AIV)等。
由于其病毒感染效率高、增殖快,且不易变异,MDCK细胞系(MDCK Cell Lines)被公认为最适于甲、乙型流感病毒疫苗生产的3种细胞系之一。
传统的MDCK细胞培养大多采用有血清贴壁培养方式。
血清是由血浆去除纤维蛋白而形成的一种复杂混合物,其含有细胞生长所需的生长因子、激素、载体蛋白、贴壁因子、微量元素以及其他营养物质,可以有效地促进细胞生长和产物表达。
然而,血清的应用也存在许多问题:易受病毒、支原体或其他病原体的污染;批间差异造成产品批次间的质量难以严格控制;大量血清蛋白的存在增加了下游分离纯化的难度,部分蛋白难以通过分离纯化手段彻底去除,影响了产品的最终质量;此外,血清来源困难、价格昂贵,大规模动物细胞培养过程中使用血清将会大大增加生产成本。
犬肾细胞MDCK无血清培养基 UltraMDCK Serum-free Medium 产品介绍MDCK无血清培养基是一种在经过优化的基础培养基中只添加了重组人胰岛素蛋白和牛转铁蛋白的低蛋白含量的成分配制而成的SFM培养基。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
MDCK细胞介绍(MDCK Cells introduction)
MDCK细胞系(MDCK Cell Lines)由Madin和Darby于1958年从美国Cocker Spaniel母曲架犬的肾脏组织分离培育建立,通常是以贴壁方式生长的上皮样细胞。
犬肾上皮连续细胞系MDCK (Madin-Daby canine kidney cells) 细胞株购买信息:ATCC MDCK cell lines。
目前,MDCK细胞系(MDCK Cell Lines)广泛用于多种病毒的扩增和纯化,如:呼肠孤病毒)、腺病毒、犬细小病毒、猫粒细胞缺乏症病毒)及禽流感病毒等。
由于其病毒感染效率高、增殖快,且不易变异,MDCK细胞系(MDCK Cell Lines)被公认为最适于甲、乙型流感病毒疫苗生产的3种细胞系之一。
传统的MDCK细胞培养大多采用有血清贴壁培养方式。
血清是由血浆去除纤维蛋白而形成的一种复杂混合物,其含有细胞生长所需的生长因子、激素、载体蛋白、贴壁因子、微量元素以及其他营养物质,可以有效地促进细胞生长和产物表达。
然而,血清的应用也存在许多问题:易受病毒、支原体或其他病原体的污染;批间差异造成产品批次间的质量难以严格控制;大量血清蛋白的存在增加了下游分离纯化的难度,部分蛋白难以通过分离纯化手段彻底去除,影响了产品的最终质量;此外,血清来源困难、价格昂贵,大规模动物细胞培养过程中使用血清将会大大增加生产成本。
犬肾细胞MDCK无血清培养基 UltraMDCK Serum-free Medium 产品介绍
MDCK无血清培养基是一种在经过优化的基础培养基中只添加了重组人胰岛素蛋白和牛转铁蛋白的低蛋白含量的成分配制而成的SFM培养基。
与在含有血清生长环境中相比,在MDCK 无血清培养基中生长的MDCK细胞较小并紧密成团。
在不更换培养基的条件下,MDCK细胞可以持续旺盛生长至少2周时间。
经过MDCK细胞的持续生长,从单层细胞形成球形结构,通常我们称这种球形结构为“漂浮物”。
通过离心我们可以收获这些球状结构的“漂浮物”,也可以加入新鲜MDCK无血清培养基让MDCK细胞贴壁继续生长成新的单层细胞。
在添加了血清成分的环境中培养出来的MDCK单层细胞很难被胰酶消化,但是在MDCK无血清培养基中生长的 MDCK单层细胞就很容易被胰酶消化。
UltraMDCK Medium is an optimized basal medium supplemented with only two proteins –recombinant human insulin and bovine transferrin, yielding a very low protein formulation. MDCK cells grown in UltraMDCK Medium are smaller and more densely packed than cells grown in the presence of serum. Cultures can stay confluent for at least two weeks without medium change. Cells will continue to grow from the monolayer forming spherical structures called “floaters”. “Floaters” can be harvested, pelleted by centrifugation and plated into fresh medium. They will reattach and grow into a new monolayer.
A monolayer of MDCK cells is difficult to trypsinize especially when grown in a serum-supplemented medium. However, when grown in UltraMDCK Medium, trypsinization becomes less difficult.。
