《氧化锆陶瓷》PPT课件
氧化锆陶瓷
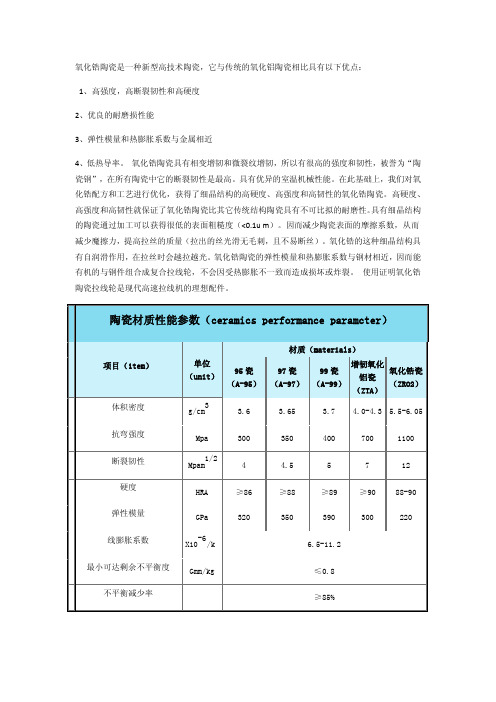
抗弯强度 断裂韧性
Mpa
300
1/2
Mpam
4
350
400
700
1100
4.5
5
7
12
硬度
HRA
≥86
≥88
≥89
≥90 88-90
弹性模量 线膨胀系数
GPa
320
-6 X10 /k
350
390
300
220
6.5-11.2
最小可达剩余不平衡度
Gmm/kg
≤0.8
不平衡减少率
≥85%
氧化锆陶瓷是一种新型高技术陶瓷,它与传统的氧化铝陶瓷相比具有以下优点:
1、高强度,高断裂韧性和高硬度
2、优良的耐磨损性能
3、弹性模量和热膨胀系数与金属相近
4、低热导率。 氧化锆陶瓷具有相变增韧和微裂纹增韧,所以有很高的强度和韧性,被誉为“陶 瓷钢”,在所有陶瓷中它的断裂韧性是最高。具有优异的室温机械性能。在此基础上,我们对氧 化锆配方和工艺进行优化,获得了细晶结构的高硬度、高强度和高韧性的氧化锆陶瓷。高硬度、 高强度和高韧性就保证了氧化锆陶瓷比其它传统结构陶瓷具有不可比拟的耐磨性。具有细晶结构 的陶瓷通过加工可以获得很低的表面粗糙度(<0.1u m)。因而减少陶瓷表面的摩擦系数,从而 减少魔擦力,提高拉丝的质量(拉出的丝光滑无毛刺,且不易断丝)。氧化锆的这种细晶结构具 有自润滑作用,在拉丝时会越拉越光。氧化锆陶瓷的弹性模量和热膨胀系数与钢材相近,因而能 有机的与钢件组合成复合拉线轮,不会因受热膨胀不一致而造成损坏或炸裂。 使用证明氧化锆 陶瓷拉线轮是现代高速拉线机的理想配件。
陶瓷材质性能参数(ceramics performance paramcter)
氧化锆陶瓷性能专题培训课件

二、氧化锆陶瓷的重要性能和机理
1、熔点 氧化锆的熔点为2715℃,较高的熔点以及化学惰性 使氧化锆可作为较好的耐火材料。
氧化锆耐火砖
Harbin Aurora Optoelectronics Technology Co.,Ltd.
应力作用图
三、氧化锆陶瓷应用对比与思考
1、氧化锆齿科应用
Harbin Aurora Optoelectronics Technology Co.,Ltd.
牙科氧化锆加工历史进程
软质到硬质
or
硬质到软质
?
Harbin Aurora Optoelectronics Technology Co.,Ltd.
Harbin Aurora Optoelectronics Technology Co.,Ltd.
5、Y-TZP Y-TZP为钇稳定四方氧 化锆陶瓷。ZrO2中掺杂 2%-3%(摩尔分数)的 Y2O3,抑制了氧化锆陶 瓷在室温下向单斜相的 转变,并且相对稳定地 保持四方相的形态。
Harbin Aurora Optoelectronics Technology Co.,Ltd.
氧化锆坩埚
2、硬度大、耐磨性好 由于氧化锆陶瓷具有较大的强度和较好的耐磨性,
所以其在冷成型工具、拉丝模等方面有所应用。
氧化锆陶瓷刀
Harbin Aurora Optoelectronics Technology Co.,Ltd.
氧化锆拉丝模
3、强度大、韧性大 氧化锆陶瓷具有的较大的强度(可达1500MPa),虽
? 为什么不一样
Harbin Aurora Optoelectronics Technology Co.,Ltd.
1.氧化锆陶瓷-讲义

2.1 氧化物结构材料-氧化锆陶瓷ZIRCONIA CERAMICS 结构陶瓷定义:所谓结构陶瓷,是指能作为工程结构材料使用的陶瓷。
它具有高强度、高硬度、高弹性模量、耐高温、耐磨损、耐腐蚀、抗氧化、抗热震等特性。
按组分分类,结构陶瓷又可分为:☐(1)氧化物陶瓷,如氧化铝陶瓷、氧化锆陶瓷、莫来石陶瓷、氧化镁陶瓷、氧化钙陶瓷、氧化铍陶瓷、锆英石陶瓷等;☐(2)氮化物陶瓷、如氮化硅陶瓷、赛龙(Sialon)、氮化铝陶瓷、氮化硼陶瓷等;☐(3)碳化物陶瓷:如碳化硅陶瓷、碳化钛陶瓷、碳化硼陶瓷以及碳化铀陶瓷☐(4)硼化物陶瓷,如硼化钛陶瓷、硼化锆陶瓷等。
ZrO2陶瓷(ZIRCONIA CERAMICS )概述由于按照应用性将陶瓷材料分为结构陶瓷和功能陶瓷量大类:结构陶瓷主要利用其力学及机械性能,通常指强度、塑性、韧性、蠕变、弹性、硬度、疲劳等。
氧化锆陶瓷材料有两方面的重要应用:一是结构方面二是功能方面陶瓷的结构应用是陶瓷的最早应用之一,但先进结构陶瓷的发展却相对较晚,起始于20世纪60~70年代。
为了满足迅速发展的宇航、航空、原子能等技术队材料的需要,特别是对高温材料的需要,人们把目光转向了陶瓷。
金属高温材料的耐热温度从20世纪40年代的约800℃发展到70年代的约1100℃,步履日见艰难,因为金属基体熔点的限制。
☐我国从20世纪50年代就开始了先进结构陶瓷的研究,目前研究成的Si3N4其变相陶瓷和SiC表面梯度复相陶瓷的强度达1GPa,断裂韧性分别为10MPa.m1/2和9 MPa.m1/2。
☐(断裂韧性度KIC)☐以上性能均可维持到1400℃,是空气中使用的两种最好的高温材料,是陶瓷发动机零件的最佳候选材料常用的高温氧化物结构陶瓷有:氧化铝、氧化锆、氧化镁、氧化铍等,它们的熔点一般都在2000℃以上。
不仅仅用于特殊冶金领域的熔炼坩埚、熔炼纯铂等,还广泛应用在原子能反应堆、火箭、导弹、磁流体发电、玻璃工业、高温模具、飞机工业、电炉等高温领域,最高温度可达3600℃,耐高温腐蚀、抗热冲击、耐磨性好、热稳定性好等优异的要求。
2014纳米材料课件 陶瓷(ZrO2)

利用该方法可制得<20nm的含钇的稳定四方相ZrO2纳米粉,粉体 分散性能好,分布窄,但生产过程较复杂,成本也较高。
氧化锆陶瓷性质与应用
Y稳定的TZP陶瓷由于具有良好的性能,因此在很多领域都有广泛 的应用。 • 磨介:Y-TZP相对于锆珠、氧化铝球、玻璃球和钢球而言,其 耐磨性最好,目前正逐步取代其他磨介,在涂料等行业中广泛 应用。用量最大的就是磨球,国内主要有深圳南玻等厂商在生 产。工艺路线为干压和等静压成形工艺,以等静压工艺为主。 磨介市场非常广阔,虽然普通的磨球市场已经饱合,但是各种 研磨罐、搅拌磨中的磨盘和磨头等由于制备工艺相对复杂,仍 主要以国外产品为主。
• 单一稳定剂的氧化锆陶瓷-Y-TZP:稳定剂Y2O3 特点:烧结温度低,烧结性能好,致密度高,力学性能和抗弯强度 都优良,还表现出良好的耐磨性,耐腐蚀性和生物相容性。 缺点:低温长期使用发生性能老化。
• Ce-TZP:稳定剂CeO2 特点:价格低廉,且能在较宽的范围内与氧化锆形成四方相固溶 区,较高的断裂韧度和良好的抗低温水热老化性能 缺点:硬度和强度偏低
ZrO2的结构与性能
ZrO2的晶体结构及晶型转变 ZrO2相变增韧
m-ZrO2:单斜晶系(<1170℃)
ZrO2的结构
t- ZrO2:四方晶系(1170~2370 ℃) c-ZrO2:立方晶系(2370~2715 ℃)
萤石(fluori)结构
在萤石结构中为了形成稳定的八配面体结构,晶体中的 阳离子半径与阴离子半径的比值应大于0.732,而锆氧 离子半径比为0.564。
氧化锆: 坚如钢,白如雪!
• 个人用品:氧化锆陶瓷耐磨性好,硬度高,可以抛光且外观美观,因此 可 作为手表带、表壳及其他装饰部件。陶瓷表源于瑞士雷达表,后来国内有优 尼克、潮州三环和北京建材院下属公司等一些企业开始生产。目前主要生产 表带,以黑和白为主,蓝、金和红等其他颜色也已开发出来,制备工艺以热 压铸和干压为主。
结构陶瓷—氧化锆陶瓷共37页文档

谢谢
11、越是没有本领的就越加自命不凡。——邓拓 12、越是无能的人,越喜欢挑剔别人的错儿。——爱尔兰 13、知人者智,自知者明。胜人者有力,自胜者强。——老子 14、意志坚强的人能把世界放在手中像泥块一样任意揉捏。——歌德 15、最具挑战性的挑战莫过于提升自我。——迈克尔·F·斯特利
33、如果惧怕前面跌宕的山岩,生命 就永远 只能是 死水一 潭。 34、当你眼泪忍不住要流出来的时候 ,睁大 眼睛, 千万别 眨眼!你会看到 世界由 清晰变 模糊的 全过程 ,心会 在你泪 水落下 的那一 刻变得 清澈明 晰。盐 。注定 要融化 的,也 许是用 眼泪的 方式。
35、不要以为自己成功一ห้องสมุดไป่ตู้就可以了 ,也不 要以为 过去的 光荣可 以被永 远肯定 。
结构陶瓷—氧化锆陶瓷
31、别人笑我太疯癫,我笑他人看不 穿。(名 言网) 32、我不想听失意者的哭泣,抱怨者 的牢骚 ,这是 羊群中 的瘟疫 ,我不 能被它 传染。 我要尽 量避免 绝望, 辛勤耕 耘,忍 受苦楚 。我一 试再试 ,争取 每天的 成功, 避免以 失败收 常在别 人停滞 不前时 ,我继 续拼搏 。
高性能氧化锆陶瓷.崔ppt

ZrO2 的晶体结构及性质
表1.1 ZrO2变体特征
晶系 晶体常数 比重
低温型 ZrO2
单斜
a0=5.194×10nm b0=5.206×10nm c0=5.308×10nm
β=80。48, 计算的比重 5.56 试验求出的平均比重 5.31
高温型 ZrO2
四方
a0=5.074×10nm c0=5.160×10nm
❖ ZrO2陶瓷的电性能随稳定剂的种类、含量和测试温 度 阻不高同达而10变15化Ω。·m纯。Z加rO入2是稳良定好剂的后绝,缘其体电,导常率温明比显电增 加。所以稳定ZrO2陶瓷,在高温下是离子导电陶瓷。
氧化锆陶瓷的应用
❖ 陶 的相断瓷变裂,增韧其韧性主Zr和要O抗是2陶弯利瓷强用是度Z一r,O种2使相极其变有具特发有性展优来前良提途的高的力陶新学瓷型性材结能料构, 低的导热系数和良好的抗热震性。
从图3曲线 可以得出, 当温度高于 550℃时,浸 出率可达到 最大值,即 反应基本完 全。
一、 ZrO2陶瓷的发展与研究现状
❖ 陶瓷材料虽然具有许多优越的特性,如高温力学 性能、抗化学侵蚀性能、电绝缘性能、较高的硬 度和耐磨性等。但由于其结构决定了陶瓷材料缺 乏像金属那样在受力状态下发生滑移引起塑性变 形的能力.陶瓷容易产生缺陷,存在裂纹,且易于 导致高度的应力集中,因而决定了陶瓷材料脆性 的本质.因此,各国学者都在高强度、高韧性陶瓷 领域进行了大量的研究。主要从两方面进行研究, 即提高其断裂韧性和塑性滑移系统。目前最有效 的途径是利用纤维(包括晶须)增强和利用ZrO2 相变增韧。但研究较多的,而且较有成效的是 ZrO2增韧陶瓷。
❖ 日本是中国氧氯化锆的主销市场,日本年期 求量约为3千吨,其生南及江苏省进口 产品,进口量逐年增大,仅河南省现在年出 口量约为l千吨。
最新二氧化锆陶瓷PPT课件

每个人的压力来源:
社会
工作场所
个人
社会 缺乏这个、那个(朋友、机会等),如果我 早生十年我一样会成功!
工作场所
失去的比得到的多,没有得到和应得 的,并没有拥有和别人一样的能力。我 失去工作、机会、金钱、失去、失 去…………
个人
受到背景、学历、家庭、公司的限制, 我是限制的牺牲品。
——三大悲哀
c-ZrO2大晶粒 c相
稳定剂 适宜温度
t-ZrO2小晶粒 t相
• 形成t、c双相组织结构。 • 可保存到室温。 • 在外力下会诱发 t 相到 m 相的马氏体相变并伴
随体积膨胀。耗散部分能量,抵消了部分外力
从而起到增韧作用,称为应力诱导相变增韧。
• 具有优良的高温热稳定性、低热导率、高强度 和韧性等优良的性能。
• 氧化锆(相变)增韧陶瓷(ZTC)
• 在不同陶瓷基体中加入一定量的 ZrO2 并使亚稳态 TZP均匀地分布在陶瓷基体中,利用氧化锆相变增 韧机制使陶瓷的韧性得到明显的改善。
• 具有优良的力学性能、低的导热系数和良好的抗 热震性。
四、氧化锆陶瓷在燃料电池上的应用
ZrO2 在功能陶瓷领 域的一个重要用途 是利用ZrO2作为固 体电解质来研制第 三代燃料电池—— 固体氧化物燃料电 池(Solid Oxide Fuel Cell, SOFC)。
注意:
游戏过程不能出声,手必须背着不能乱比划 喊:1、2、3、一起出。
——别人怎么对待我,我就怎样对待别人。
如果对我热情,我也对你热情。 如果你敬我一尺,我也敬你一尺。 如果你对我不仁,那么就别怪我不义。
“斯格托玛”效应:
希腊文指黑暗。指失去了部分视野、盲点 这里用来说明一个人看不见或在选择性认知中 有失盲的现象。
《氧化锆陶瓷》PPT课件

• 相变材料出现表面凸起。
• 相变过程伴随有9 %的体积膨胀。此膨胀表现出强烈的各向异性,b轴方向的膨胀可以忽 略,实质的膨胀主要发生在a轴和c轴方向上,同时晶格常数发生突变。
NaOH溶液处理 ZrO2粉体
5. 气相沉积法
Zr(OC3H7)4粉体蒸汽 320-450 ℃热分解 ZrO2超
细粉
ZrO2陶瓷粉体制备
单纯ZrO2很难生产ZrO2陶瓷 原因:晶型转变体积变化制品开裂
途径:加入稳定剂 Y2O3 CaO MgO et al.,
无异常膨胀/收缩稳定c-/t-ZrO2(Y2O3 8mol%)
抗折强度~35MPa 3-4mol%)
Y2O3-PSZ (Y2O3
抗折强度~140MPa PSZ: Partially Stabilized Zirconia
良好ZrO2陶瓷
稳定剂的加入量
• Y2O3 :2~40mol% • CaO:15~24mol% • MgO:16~20mol%
6. 部分稳定ZrO2粉体制备
p
(b)
图5-6 DTA分析中ln(β/Tp2)与1/Tp关系曲线:(a)t-ZrO2,(b)m-ZrO2
小结
•晶体结构、表面能及析晶活 化能三个方面均显示,低温 下纳米二氧化锆凝胶粉中的 亚稳t-ZrO2易先于m-ZrO2析 出并稳定存在
稳定的ZrO2
氧化锆的几个术语
• PSZ:部分稳定氧化锆,又叫陶瓷钢 • TZP:四方多晶氧化锆 • Y-TZP:掺Y2O3稳定剂的四方多晶氧化锆
氧化锆陶瓷应用及制备技术ppt课件

可编辑课件PPT
10
• 化学共沉淀法和以共沉淀为基础的沉淀乳 化法、微乳液沉淀反应法的主要工艺路线 是:以适当的碱液如氢氧化钠、氢氧化钾、 氨水、尿素等作沉淀剂(控制pH≈8~9),从 ZrOCl2·8H2O或Zr(NO3)4、Y(NO3)3(作 为稳定剂)等盐溶液中沉淀析出含水氧化 锆Zr(OH)4 (氢氧化锆凝胶)和Y(OH)3 (氢氧 化钇凝胶),再经过过滤、洗涤、干燥、煅 烧(600~900℃)等工序制得钇稳定的氧化锆 粉体。工艺流程图如图3.1所示:
可编辑课件PPT
13
• 解决方案:
• (1)改变沉淀时的温度,使氧化锆的溶解 度下降,这样可以降低原料的浓度,从而 使含水氧化锆和氢氧化钇的析出速率,从 而防止凝胶过大,形成团聚。
• (2)沉淀过程改为向高盐溶液中通氨气而 不是加入碱性溶液,这样通过控制氨气通 入的速度控制含水氧化锆和氢氧化钇的析 出,同时配合搅拌溶液使凝胶析出均匀。
可编辑课件PPT
5
图1.4 各种类型的陶瓷光纤插针
图1.5 陶瓷光纤套筒
可编辑课件PPT
6
图2.1 氧化锆氧传感器
可编辑课件PPT
8
• 此外还有固体氧化物燃料电池、高温发热 体、压电材料、保健纺织材料、 多晶氧化 锆宝石、 催化剂载体等多方面的应用。
可编辑课件PPT
9
3. ZrO2超细粉体的制备技术
• 锆英石的主要成分是ZrSiO4,一般均采用 各种火法冶金与湿化学法相结合的工艺, 即先采用火法冶金工艺将ZrSiO4破坏,然 后用湿化学法将锆浸出,其中间产物一般 为氯氧化锆或氢氧化锆,中间产物再经煅 烧可制得不同规格、用途的ZrO2产品,目 前国内外采用的加工工艺主要有碱熔法、 石灰烧结法、直接氯化法、等离子体法、 电熔法和氟硅酸钠法等。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
(b)
图5-6 DTA分析中ln(β/Tp2)与1/Tp关系曲线:(a)t-ZrO2,(b)m-ZrO2
小结
•晶体结构、表面能及析晶活 化能三个方面均显示,低温 下纳米二氧化锆凝胶粉中的 亚稳t-ZrO2易先于m-ZrO2析 出并稳定存在
稳定的ZrO2
氧化锆的几个术语
• PSZ:部分稳定氧化锆,又叫陶瓷钢 • TZP:四方多晶氧化锆 • Y-TZP:掺Y2O3稳定剂的四方多晶氧化锆
• ZrOCl2+H2O→ZrO2+HCl
4. 等离子体合成法
1)ZrSiO4粉体注入等离子弧反应室 ZrSiO4 ZrO2 + SiO2 + 2NaOH +
H2O (煮沸) ZrO2 + Na2SiO3 洗涤
ZrO2粉体 2)等离子体加热粉体至2100-2300 ℃
ZrSiO4 c-ZrO2(10-100nm) + SiO2(liq)
氧化锆稳定化时,一般用含量大于96%的单斜氧化锆 原料与稳定剂一起在瓷球磨筒内研磨混合8~24h,然后加入少 量结合剂,在60~100MPa压力下压成坯块,压块的目的是使颗 粒紧密接触,促进固相反应,有利于均匀稳定。
稳定化温度范围:1450~1800℃ 。
• 溶胶-凝胶制备的二氧化锆中, 在低温区析出t-ZrO2,这与传 统的t-ZrO2的稳定区间产生矛 盾
1) Y(OC3H7)3+ Zr(OC3H7)4 6mol%Y2O3
溶入有机溶剂
用三次蒸馏水水解/焙烧
部分稳定的c-ZrO2粉体(粒径~40nm)
2) YCl3 (0-18mol%)+ ZrO2 (82-100mol% ) + HCl
式中,得到rc=15.3 nm。即t-ZrO2稳定存在
的临界尺寸为30.6 nm
表面能
使用Scherrer公式,由图5-4的XRD衍射谱可以计算晶粒尺寸。
D 0.9 cos
D ——平均晶粒尺寸(nm) ——衍射角 ——2衍射峰的半高宽(弧度) =0.15418 nm
表面能
t-ZrO2和m-ZrO2的主衍射峰t(111)和m(-111)所对应的2 衍射角分别为30.5°和28°,由这二个主衍射峰计算不同温 度下t-ZrO2和m-ZrO2平均晶粒尺寸如表5-1所示。
12
15
Tp1 (℃) Tp2 (℃)
305.13 528.02
316.62 534.91
Tp1: t-ZrO2析晶放热峰温度 Tp2: m-ZrO2析晶放热峰温度
321.21 544.10
332.70 553.30
析晶活化能
• 根据JMA方程,等温条件下析晶体积分数可描 述为:
x =1-exp[-(kt)n] • 式中x为结晶体积分数,k为析晶动力学参数,
表5-1 不同温度下t-ZrO2与m-ZrO2的平均晶粒尺寸
热处理温度 (℃)
600
800
1000
t-ZrO2晶粒尺寸 (nm)
8.6
m-ZrO2晶粒尺寸 (nm)
9.4
17
-
15.5
33.8
• 从表5-1看到500、600和800 ℃热处理后t-ZrO2晶粒尺寸分别为5.1、8.6和17 nm, 处于表面能起决定作用的t-ZrO2稳定存在的尺寸范围内,因此亚稳t-ZrO2可在低温 稳定存在。至1000 ℃热处理后,m-ZrO2晶粒尺寸达到33.8 nm,而此时t-ZrO2已完 全消失,可知由于t-ZrO2此时晶粒尺寸已大于30.6 nm的保持稳定的临界尺寸,所以 失稳并完全转变为m-ZrO2。
• 原因:晶体结构、表面能、析 晶活化能
晶体结构
(-111)
(111)
(111)
t-ZrO 2
m-ZrO 2
1000oC,1h 800oC,1h
600oC,1h
400oC,1h
20 25 30 35 40 45 50 55 Degrees two theta (CuK)
图5-4 不同温度下二氧化锆凝胶粉的XRD衍射图
表面能
设ΔG(r)=0,则在正常t-ZrO2→m-ZrO2相变温度Tb下
的某一温度T,t-ZrO2的临界尺寸表示为:
rc
3 t m H 1 T Tb
ΔH——单位体积的相变热
将ΔH=2.82108 J/m3、Tb=1170 ℃、t-ZrO
2和m-ZrO2的表面能1.46和0.55 J/m2代入公
•
正由于氧化锆有晶型转变和体积突变的特点,
因此单用纯氧化锆就很难制造出烧结且又不开裂的
制品。当向氧化锆中加入一些与Zr4+离子半径相差
在12%以内的氧化物,如CaO、MgO、Y2O3、CeO2 等 ,经高温处理后就可以得到从室温直至2000℃以上
都稳定的立方晶型的氧化锆固溶体,从而消除了体
积突变。
• 1975年,澳大利亚R. G. Garvie以CaO为稳定剂制得部分 稳定的氧化锆,并首次利用陶瓷马氏体相变的增韧效应, 提高了其韧性和强度;
• 1982年,日本绝缘子公司和美国Cummins发动机公司共同 开发出节能柴油机缸套。
氧化锆陶瓷
ZrO2的性质
• 含锆的矿石:斜锆石(ZrO2),锆英石(ZrO2 ·SiO 2);
表面能
Garrie通过对热力学方程进行简单的处理, 计算出t-ZrO2稳定存在的临界尺寸。 球状晶体的自由能可描述为:
G
4 3
r 3
GV
4r 2
r——晶体半径
GV——单位体积的自由能 γ——晶体表面能
表面能
t-ZrO2与m-ZrO2的自由能之差为 :
Gr
4 3
r 3
GV
4r 2
t
m
ΔG(r)——单位体积的t-ZrO2和m-ZrO2自由能差 γt——t-ZrO2的表面能 γm——m-ZrO2的表面能
• 颜色:白色(高纯ZrO2); 黄色或灰色(含少量 杂质的ZrO2),常含二氧化铪杂质;
• 密度:5.65~6.27g/cm3;
• 熔点:2715℃。
ZrO2的晶型及其转化
单斜、四方、立方晶系3种
1170 ℃ 2370 ℃ 2715 ℃
m-ZrO2 t-ZrO2 c-ZrO2 liq-ZrO2
氧化锆陶瓷
ZrO2结构陶瓷
• ZrO2粉体的制备 • ZrO2陶瓷的制备 • ZrO2陶瓷的性质和用途
ZrO2粉体的制备
1. 锆英石加碳氯化法
ZrSiO4 + C + 4Cl2 ZrCl4 CO
+ SiCl4 + 4
) 57.6 ℃
>300 ℃(升华
(+H2O) ZrOCl2 氯氧化锆凝固150-180 ℃ ,与SiCl4分离
氧化锆 陶瓷
ZrO2陶瓷
• 4.1 概述 • 4.2 ZrO2的特征 • 4.3 ZrO2结构陶瓷 • 4.4 ZrO2气敏陶瓷 • 4.5 ZrO2导电陶瓷 • 4.6 ZrO2高温热敏陶瓷(NTC)
ZrO2的市场
• 2000 年世界ZrO2的销售额约为450 亿美元。
• 日本占41~42% • 美国占22%左右
冷却结晶/焙烧
ZrO2(粉体) + Cl2 或,ZrOCl2 + 2NH3 + 2H2O Zr(OH)4 + 2NH4Cl
热 分解 ZrO2超细粉
2. 高温碱解法
3. 水热法
• 工艺流程:
• 锆盐溶液的水热处理→过滤→干燥(70 ℃ ) →ZrO2 微粉/超细粉
• 水热反应条件:T>200℃,P=10MPa • 设备:高压釜 • 原料:锆盐(ZrOCl2)溶液 • 化学反应:
• 新相和母相之间存在一定的取向关系。
• 相变不是在一特定温度下进行的,而是有一定温度范围,其中开始相变的温度是重要参 数。
• 相变表现出大的热滞后现象,纯ZrO2正向加热m→t转变在1137 ℃左右发生,而反向降温 时t→m相变在850-1000 ℃发生。
• 相变是以声速进行的,它总是在一瞬间完成。
析晶活化能
Gel粉的DTA曲线如图5-5所示
在128.6 ℃处有较强的吸
热峰,是由于水解产物中 的游离水、有机溶剂挥发 或分解所致;在316 ℃有
一个放热峰,根据XRD衍 射谱可知,这是无定形Ge l中结晶析出t-ZrO2并释 放结晶潜热产生的;而53
4 ℃左右的放热峰则是亚 稳的t-ZrO2→m-ZrO2相变 形成的。
析晶活化能
ln(/T 2) p ln(/T 2) p
-10.0
-10.1
-10.2
-10.3
-10.4
-10.5
-10.6
-10.7 1.64 1.66 1.68 1.70 1.72 1.74 1000/T (K-1)
p
(a)
-10.6
-10.7
-10.8
-10.9
-11.0
-11.1
-11.2
-11.3 1.21 1.22 1.23 1.24 1.25 1.26 1000/T (K-1)
t为等温时间,n是反映析晶机理的指数。一般
情况k可表示为: k =νexp(-E/RT)
• 式中ν为频率因子(s-1),E为析晶活化能,T
为开氏温度,R为气体常数
析晶活化能
• 在非等温条件下应用此式,需要对JMA方程进行修正。由Bansal N P等人修正 后的方程为:
ln E ln(E / R) ln
• 相变的结构转变是无扩散的。母相通过切变来形成新相,通过原子的集体协调运动 来完成,相变后每个原子的近邻原子的种类不变,原子的运动小于一个原子间距, 仅仅是Zr、O原子的较小的移动。
