武汉大学版无机化学课后习题答案16硼族元素
武汉大学版无机化学课后习题答案(第三版)第15章p区元素

P区元素(1)1.试用分子轨道理论描述下列各物种中的键、键级和磁性(顺磁性、逆磁性)和相对稳定性。
(1)O2+(二氧基阳离子)(2)O2(3)O2-(超氧离子)(4)O22-(过氧离子)解:见下表物种分子轨道键键级磁性相对稳定性O2+KK(σ2s)2(σ2s*)2(σ2p)2(П2p)4(П2py*)11( П2pz*)0一个σ键一个二电子П键,一个三电子П键2.5 顺依次减小O2KK(σ2s)2(σ2s*)2(σ2p)2(П2p)4(П2py*)1( П2pz*)1一个σ键二个三电子П键2 顺O2-KK(σ2s)2(σ2s*)2(σ2p)2(П2p)4(П2py*)1( П2pz*)1一个σ键一个三电子П键1.5 顺O22-KK(σ2s)2(σ2s*)2(σ2p)2(П2p)4(П2py*)1( П2pz*)2一个σ键 1 逆2. 重水和重氧水有何差别?写出它们的分子式。
它们有何用途?如何制备?答:重水:D2O;重氧水: ;重水是核能工业常用的中子减速剂,重氧水是研究化学反应特别是水解反应机理的示踪剂。
3. 解释为什么O2分子具有顺磁性,O3具有反磁性?答:根据O2分子的分子轨道式KK(σ2s)2(σ2s*)2(σ2p)2(П2p) 4(П2py*)1( П2pz*)1分子中两个П2p反键轨道各有一单电子,因此它具有顺磁性。
在O3分子中,每个氧原子各用一个P轨道组成一个成键П轨道,一个反键П轨道,一个非键П轨道,其中4各P电子,两个进入成键П轨道,两个进入非键П轨道,П键键级为一,分子没有成单电子,所以分子具有反磁性。
4.在实验室怎样制备O3?它有什么重要性?5.答:在实验室里制备臭氧主要靠紫外光(<185nm)照射氧或使氧通过静电放电装置而获得臭氧与氧的混合物,含臭氧可达10%。
臭氧发生器的示意图见图13-10。
它是两根玻璃套管所组成的,中间玻璃管内壁镶有锡锚,外管外壁绕有铜线,当锡箔与铜线间接上高电压时,两管的管壁之间发生无声放电(没有火花的放电),02就部分转变成了036.7.油画放置久后为什么会发暗、发黑?为什么可用H2O2来处理?写出反应方程式。
第1516章 碳硼族元素习题.doc

D,不水解第15、16章 碳硼族元素习题一、选择题1. 硼的成键特征是()A, 共价性 B,缺电子性 C.多面体性 D,前三者均是 2. 硼成键为SP2杂化,且含三个单键,1个兀46键的化合物是()A. B 2O 3B. BF4-C. BO 33-D. B 2H 63. 硼的独特性质表现在()A. 能形成正氧化态化合物,如BN ,其它非金属则不能B. 能生成大分子C. 能形成负氧化态化合物,其它金属则不能D. 在简单的二元化合物中总是缺电子的4. 在a 菱形硼的Bn 单元中,表现出硼原子是缺电子原子性质的原子个数是()A. 3 个B. 6 个C. 9 个D. 12 个5. 下列分子或晶体,何者的结构表现出硼原子的缺电子性.( )A. B 2O 3B. NaBO 2C. H3BO3D. H3BO3E. B 2H 66, 下列关于单质硼化性的描述,错误的是( )A. 常温下不活泼,但高温下可与许多非金属反应B, 与碳相似,炽热的硼可与水蒸气反应C. 可与盐酸反应 D,可与碱反应7. 硼与浓NaOH 反应,所得的含硼产物是( )A. NaBO 2B. Na 3BO 3C. B 2O 3D. H3BO38. 硼与浓硝酸反应,所得的含硼产物是( )A. B (NO 3)3B. H3BO3C. BND. B 2O 39. 乙硼烷( )A. 是强氧化剂B.是强还原剂C10. 下列对硼酸性质的描述不正确的是( )A, 硼酸是三元酸 B.硼酸是一元路易斯酸C. 硼酸与多元醇反应,生成配合物,使酸性增强D. 硼酸的溶解度小11. 硼酸可缩合成( )A, 链状或环状多硼酸 B,笼状多硼酸C.蛛网状多硼酸D.片层状多硼酸12,在硼酸中加入下列何种物质,可以提高其酸性()A.NaOHB. H3PO4C. C2H5OH D,多羟基醇13.鉴别硼酸根时,可用的物质是()A.CH3OHB. CH3OCH3C. HOCH2CH2OHD. CH3CHO14.H2CO3 H3BO3 H2SiO3的酸性强度顺序是()A.H2CO3<H3BO3<H2SiO3B.H2CO3>H3BO3>H2SiO3C.H2CO3>H2SiO3>H3BO3D.H2CO3<H2SiO3<H3BO315.在H3BO3中加入Na2CO3可制得()A.Na3BC)3B. NaBC)2C. NaqBzOsD. N3.2840716.H3BO3与过量的强碱NaoH作用河得到()A.N^BOsB. NaBC)2C. NaqBzOsD. NazBqO?17.硼砂的水溶液呈()A,碱性B,中性C.酸性D.弱酸性18.用盐酸滴定硼砂水溶液至恰好中和时,溶液呈()A,中性B.弱酸性C.弱碱性D,强碱性19.105BA08 下列关于硼酸结构的叙述错误的是()A.硼酸为白色片状晶体,其结构单元为B(OH)3三角形B.硼原子通过SP3杂化轨道与氧原子成键C.分子间通过氢键形成接近于六角形的对称层状结构D.层与层间以范德华力联系20.在分析化学中,硼砂被用来作标准溶液是因为它,A,易水解B,在干燥空气中易风化C.溶融态时可溶解金属氧化物D,稳定,易提纯21.反应H3BO3+3C2H5OH = B(OC2H5)3+3H2O(案件浓硫酸点燃).用于()A.硼化物的定性分析B.硼酸的定量分析C,两者均是D,两者均否22.CO2泡末灭火器的反应原理是()A.HCCh-离子的水解B,A13+水解C,HCO3- A13+双水解,相互促进D,反应生成A1(HCO3)3,然后水解23.硼族元素最重要的特征是()A.共价性特征B.缺电子性特征)甲酸脱水 水蒸气与炽热的炭反应) C.加合性 D.极性C.共价性和缺电子性特征D.易形成配合物和自身聚合的特征 24.硼的缺电子性表现在( ) A,易形成缺电子多中心键及配合物 B,易形成含桥键的化合物C.易形成不同类型杂化,形成化合物D.易形成共价化合物 25. 硼族元素的原子都属缺电子原子,而硼原子的缺电子性在形成化合物时表现 得尤为突出,其原因是() A, 原子的半径最小,电离能最高 B.原子的半径最小,电负性最大C.原子的非金属性最强D.原子半径小,电负性大,有空2P 轨道 26. 某白色晶体X 微溶于水,其水溶液呈弱酸性.在水溶液中加入甘油酸性增强,将 X强热,得固体Y 和气体C,C 冷却后成无色液体.Y 在熔融时可溶解固体NiO, 在X 的水溶液中加甲醇和浓硫酸,点燃混合物.产生绿色火焰,X,Y 分别是 ( )A. H 2SiO 3B. B 2O 3C. H2C2O4D. H3BO3E. N3.2840727, 从碳到铅,当原子序数增加时,+2氧化态的稳定性()A,增强 B,减弱 C,无变化 D.无法确定28. 碳族元素中,碳和其它元素相比性质差异较大是因为() A,原子量最小B,核电荷最少 C. 原子半径最小,电负性最大,电离能最高,又没d 轨道 D. 原子半径最小29. 实验室里用哪个反应制备CO?( A,分解草酸 B. C.分解蹶基镣D. 30. CO 对人体的毒性,源于它的( A,氧化性 B,还原性31. 1下列气体中容易与过渡金属形成配合物的是( )A. NO,B. SO 2C. COD. CO 232, 最常用实验室制CO 2的反应是( )A. CaCO3+H 2SO4=CaSO 4+CO2+H 2OB. CaCO3+2HCl=CaCl 2+CO 2+H 2OC. 3CaCO 3+2H3PO4=Ca3(PO4)2+3CO 2+3H 2OD. CaCO 3=CaO+CO 233. 气体X 和红热的炭反应,得到一种无色气体Y,Y 和CuO 在加热条件下反应又得到X和Cu,则X和Y依次为()A. CO,CO2B. CO2,COC.田0(气)D. C)2,C034.CO通过PdCb溶液生成黑色沉淀,此法可检出CO,此时CO的作用是()A,氧化剂B,还原剂C.配位剂D.催化剂35.CO分子的偶极矩较小,几乎为零,是因为()A.碳和氧的电负性差值小B.碳原子存在孤对电子C.氧原子是兀配键电子对接受体D.氧原子既吸引o键电子对,又是兀配键电子对的给予体,使氧原子略带正电荷36.干冰不经熔化而升华成气体,此事实说明()A. C02热稳定性差B. C02的键能小C. C02的分子对称D.干冰是分子晶体37.CO能与一些过渡元素的金属原子M形成稳定的蹶合物,原因是()A.CO与M形成了共价参键B.CO与M形成了螯合的两个。
武汉大学版无机化学课后习题答案(第三版)第19章f区元素

F区元素1.按照正确顺序写出镧系元素和锕系元素的名称和符号,并附列它们的原子顺序。
解:镧系:元素名称镧铈镨钕钷钐铕钆铽镝钬铒铥镱镥La Ce Pr Nb Pm Sm Eu Gd Tb Dy Ho Er Tm Yb Lu5758 59 60 61 62 63 64 65 66 67 68 69 70 71锕系锕钍镤铀镎钚镅锔锫锎锿镄钔锘铑Ac Th Pa U Np Pu Am Cm Bk Cf Es Fm Md No Lr8990 91 92 93 94 95 96 97 98 99 100 101 102 1032.镧系元素的特征氧化态为+3,为什么铈、镨、铽、镝常呈现+4氧化态,而钐、铕、铥、镱却能呈现+2氧化态?答:镧系元素的特征氧化态都是+Ш ,这是由于镧系元素的原子第一、第二、第三电离势之和不是很大,成键时释放的能量足以弥补原子在电离时能量的消耗,因此它们的+Ш氧化态都是稳定的。
与+Ш特征氧化态发生差异的诸元素有规律的分布在La(+Ш)、Gd(+Ш)、Lu(+Ш)附近。
这可由原子结构规律变化得到解释。
La(+Ш)、Gd(+Ш)、Lu(+Ш)分别具有4f轨道全空、半满、全满的稳定电子层结构。
镧系元素的氧化态取决于其外围的6s电子,4f和5d电子数,当它们失去两个6s电子,进而再失去一个4f电子或一个5d电子时,所需的电离度不太高,因此表现出ШB族的特征氧化态(+3)。
铈、镨、铽、镝除了生成+3氧化态外,还可以再失去一个电子,4f轨道达到或接近全满或半满,成为稳定结构故它们也常出现+4氧化态。
而钐,铕,铥和镱,失去两个电子后,就可以使4f轨道达到或接近半满,或全满的稳定,而常呈现出+2氧化态。
3.解释镧系元素在化学性质上的相似性。
答:镧系元素的价电子层结构为4f1-145d0-16s2鉴于4f同5d的能量比较近,因此在失去3个电子形成特征的+3氧化态时所需要的能量相差不大,即使在水溶液中,由于它们的离子半径接近,使得离子的水合能也相差不大,因此无论是在电离能或电负性以及标准电极电势方面,镧系原素均较接近,说明它们的单质在任何状态下所表现出来的化学活性是相近的,在+3氧化态时,离子构型和离子半径也相近,所以Ln3+离子的性质也极为相似。
第12章 氮族碳族和硼族元素 习题参考答案

第12章氮族、碳族和硼族元素习题参考答案1. (1)解:3 + HClNH4Cl NH 3 + NH4HSO4(NH4)2SO4 NH 2O3 + N2 + 4H2O (NH4)2Cr2O7 Cr(2)解:2KNO3 2KNO2 + O2 2Cu(NO3)2 2CuO + 4NO2 + O22AgNO3 2Ag + 2NO2 + O25NO3- + 2Mn2+ + 3H2O2.解:(1) 5NO2-+ 2MnO4- + 6H+2? 3NO2-+ Cr2O7+ 8H+ →3NO3- +2Cr3++7H2O(2) 2NO2- + 2I- + 4H+(3) HNO2+NH33.解:(1) NH4Cl (NH4)2SO4(2)KNO2H2SO4 2NO↑+ I2 + 2H2O N2+ 2H2OBaCl2无现象产生白色沉淀(BaSO4)产生蓝色溶液(N2O3)、红棕色气体(NO2)无现象产生黄色沉淀(As2S3) KNO3(3)AsCl3SbCl3H2S产生橙红色沉淀(Sb2S3)产生黑色沉淀(Bi2S3) BiCl34.解:(1)S +2HNO3(浓) (2)4Zn + 10HNO3(很稀) (3)3CuS + 8HNO3 (4)PCl5+4H2OH2SO4 + 2NO↑4Zn(NO3)2 + NH4NO3 + 3H2O3Cu(NO3)2 + 3S↓ + 2NO↑ + 4H2OH3PO4+ 5HCl(5)2AsO33- + 3H2S + 6H+(6)AsO43- + 2I- + 5H+(8)Sb2S3 + 3S2-5.解:(1)NH4+NaOHH2SO4NH3O2Pt As2S3↓ + 6H2O H3AsO3 + I2 + H2O2MnO4- + 5Bi3+ + 5Na+ + 7H2O(7)2Mn2+ + 5NaBiO3 + 14H+ 2SbS33-NOO2 H2(Fe)纯O2高温高压燃烧N2NH3NO2Cu(浓HOHNO3)2Zn(稀HNO3)HNO3NH3N2OKIHNO2Cu(稀HNO3)NH4NO3H2SO4H2SO4(浓)NaOHO2NaNO2NaNO3H3AsO4H2S(HCl)As2S5Na2SHClNa3AsS4(2)AsCl3H2SNa3AsS3HClNa2SAs2S3H2O浓HClH3AsO3I2(pH=5~9)KI(pH<0.5)(3)Na3SbO3HCl(适量)NaOHSb(OH)3HClNaOH(过量)SbCl3H2SH2OHClNa2SHClSbOCl (4)Cl2(NaOH)NaBiO3Sb2S3Na3SbS3(NaOH)MnSO4 Cl2(HNO3)Bi(OH)3HNO3NaOHBi(NO3)3H2OHNO3BiONO36.解:A是AsCl3,B是AgCl,C是[Ag(NH3)2]Cl,D是As2S3,E是(NH4)3AsS4,F是As2S5,G是H2S。
大学无机化学第17章 硼族元素习题解答
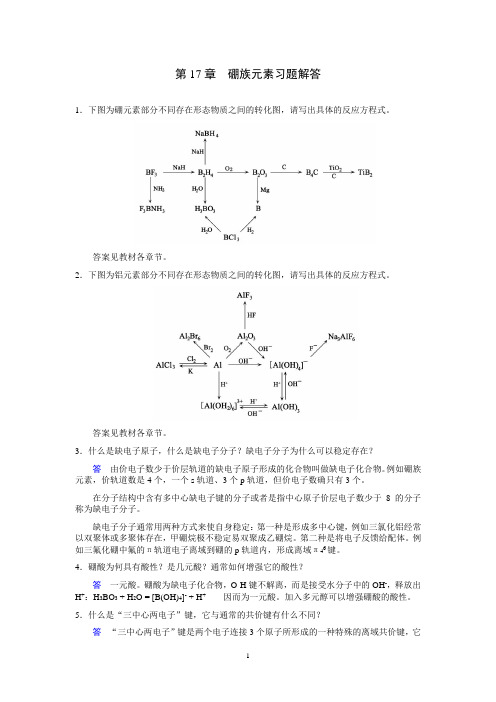
第17章硼族元素习题解答1.下图为硼元素部分不同存在形态物质之间的转化图,请写出具体的反应方程式。
答案见教材各章节。
2.下图为铝元素部分不同存在形态物质之间的转化图,请写出具体的反应方程式。
答案见教材各章节。
3.什么是缺电子原子,什么是缺电子分子?缺电子分子为什么可以稳定存在?答由价电子数少于价层轨道的缺电子原子形成的化合物叫做缺电子化合物。
例如硼族元素,价轨道数是4个,一个s轨道、3个p轨道,但价电子数确只有3个。
在分子结构中含有多中心缺电子键的分子或者是指中心原子价层电子数少于8的分子称为缺电子分子。
缺电子分子通常用两种方式来使自身稳定:第一种是形成多中心键,例如三氯化铝经常以双聚体或多聚体存在,甲硼烷极不稳定易双聚成乙硼烷。
第二种是将电子反馈给配体。
例如三氟化硼中氟的π轨道电子离域到硼的p轨道内,形成离域π46键。
4.硼酸为何具有酸性?是几元酸?通常如何增强它的酸性?答一元酸。
硼酸为缺电子化合物,O-H键不解离,而是接受水分子中的OH-,释放出H+:H3BO3 + H2O = [B(OH)4]- + H+因而为一元酸。
加入多元醇可以增强硼酸的酸性。
5.什么是“三中心两电子”键,它与通常的共价键有什么不同?答“三中心两电子”键是两个电子连接3个原子所形成的一种特殊的离域共价键,它是缺电子原子的一种成键特征。
它与通常的共价键的区别,在于它是一种缺电子的桥键,而一般的共价键是由两个原子共用两个电子所形成的。
6.铝在什么情况下生成致密的钝化膜,其应用如何?钝化膜又在什么情况下容易被破坏?答铝在空气中由于表面会生成致密的氧化膜而阻止进一步的反应,不易受到腐蚀,常被用来制造化学反应器、医疗器械、冷冻装置、石油精炼装置、石油和天然气管道等。
铝但遇到冷的浓硝酸或浓硫酸时,由于在金属表面生成薄而极其致密的氧化物薄膜,而发生钝化。
食盐可腐蚀铝表面的氧化膜,因此铝制器皿不宜长期存放咸的菜品等。
铝置于水中会生成紧密而很难溶解的氢氧化铝层。
第16章 硼族元素-1

后一种用途基于硼吸收中子的能力.
(2)酸法制备单质硼
Mg2B2O5•H2O + 2H2SO4 == 2H3BO3 + 2MgSO4 (3)热还原法 BBr3(g) + 3/2 H2(g)_1373~1573K B(s) + 3HBr(g)
16 - 1 - 2 硼的氢-2 硼的氢化物 物(硅烷)相似,所以硼的氢化物称为硼烷
有时称为土族元素,其中Al2O3为黏土的主 要成分,既难溶又难熔
0、+3 0、+3 0、+1 0、+1 0、+1 自然界没有游离硼, 在自然界没有独立的矿物,分散在 主要以铝矾土矿 (Al2O3· x H O) 存在 主要氧化数 熔点比人的体温还低 (30℃左右 2 +3 +3 (+3) ) 主要矿有 : 其它矿物中 , 都是软金属, 可用于生 原子半径 铝是银白色、有光泽的轻金属 液态镓的熔点、沸点相差大, 88 143 122 163 170 硼砂矿 (Na B O · 10H O) 、 /pm 产新型半导体材料 2 4 7 2 具有良好的导电性和延展性 可作高温温度计,与其它金属 离子半径 Tl 及其化合物均有毒 硼镁矿 (Mg B O · H O) 、 与其它金属可制低熔合金 27 50 80 88.6 3+ 2 2 5 2 r(M 广泛用来作导线、结构材料和器皿 )/pm 可制低熔合金62 方硼矿 (2Mg B O · MgCl ) 误食少量铊盐可使毛发脱落 -1 3 8 15 2 如含 25%In 的 合金 589 铝合金质轻又硬,用于飞机制造 I1/(kJ · mol ) 801 578 579 Ga 558 1.5 1.6 1.7 1.8 电负性( p ) 2.0 可用于自动灭火装置
16 无机化学 第十六章 硼族元素

④硼酸可溶合为链状或环状多硼酸xB2O3· 2O、酸 H 根(BO2)nn- 。在多硼酸结构中,有两种基本结构单 元:BO3 (平面三角形)、BO4 (四面体)。
二、硼酸盐
硼酸盐类似于硅酸盐,大多数难溶,可溶的硼酸盐讨 论的较多的是四硼酸钠,即硼砂。Na2B4O7· 2O也 10H 可写成: Na2B4O5(OH)4 · 2O ------见p787 8H
2Al+2OH-+6H2O=2Al(OH)4-+3H2↑
二、镓单质
Ga具有熔点与沸点相差甚远这一特点,302.8~2676K,即 液态温度范围很宽(拿到水中就可熔化,像水银),可用 来制高温温度计。 镓的另一特点是“热缩冷胀”,从液 体到固体,体积膨胀3%。 制铅字合金,使字更为清晰。
Ga、In多用于电子工业,作P型半导体的掺杂剂。 也可制 Ⅲ—Ⅴ族半导体化合物,如GaAs等,可用于 光电管中。
三、性质:
1、强还原性:
硼烷燃烧热很大,在空气中易燃,易水解,有剧毒, 制备时要注意保持反应处于无氧,无水气状态,做好 安全防护工作。
想一想:硼烷燃 烧的高能量,是 否可以用硼烷来 做火箭的燃料? 为什么?
B2H6(g)+3O2(g)=B2O3(s)+3H2O(g) △H = -2166KJ· -1 mol B2H6+6H2O=2H3BO3↓+6H2↑
+3价的Al有两种存在形式Al3+(酸性)、(AlO2)-或 Al(OH)4-(碱性) Al3+在水溶液中以八面体水合离子[Al(H2O)6]3+的 形式存在,在水中发生水解,溶液显酸性:
[Al(H2O)6]3++H2O==[Al(H2O)5(OH)]2+ + H3O+ [Al(H2O)5(OH)]2+ +H2O==[Al(H2O)4(OH)2]+ + H3O+ [Al(H2O)4(OH)2]+ +H2O==[Al(H2O)3(OH)3] + H3O+
无机化学第三版课后习题答案(武汉大学版) 很全面哦

2.2
2.0
0.0
0.2
0.4
0.6
0.8
1.0
1.2
P (105pa)
解
可得出一氯甲烷的相对分子质量是 50.495
12.(1)用理想气体状态方程式证明阿佛加德罗定律;
(2)用表示摩尔分数,证明xi = ν i V总
(3)证明
μ2
3kT
=
M
证明:(1)PV=nRT
当 p 和 T 一定时,气体的 V 和 n 成正比
同?为什么愚人金有金的光泽?为什么 ZnS(闪锌矿)呈白色﹑ HgS(朱砂)呈红色而 PbS(方铅矿) 呈黑色?天然的金刚石为什么有蓝﹑红﹑黄﹑绿色而并非全呈无色?请阅读:拿骚.颜色的物理和化学. 科学出版社,1991,168~ 182(注:“费密能”的定义在 166 页上)。请通过阅读测试一下自己的知识和 能力,以调整自己的学习方法预定目标与学习计划安排。最好阅读后写一篇小文(主题任选)。 12、解:金属键的另一种理论是能带理论。能带理论是分子轨道理论的扩展,要点有: (1)能带中的分子轨道在能量上是连续的。 (2)按能带填充电子的情况不同,可把能带分为满带、空带和导带三类。 (3)能带和能带之间存在能量的间隙,简称带隙,又称禁带宽度。 (4)能带理论能够对金属导电进行解释。 (5)能带理论是一种既能解释导体,又能解释半导体和绝缘体性质的理论。 (6)由此可见,按照能带理论,带隙的大小对固体物质的性质至关重要。 3-13 二层﹑三层为一周期的金属原子二维密置层的三维垛积模型只是最简单的当然也就是最基本的金 属堆积模型。利用以下符号体系可以判断四层﹑五层为一周期的密置层垛积模型是二层垛积和三层垛积 的混合:当指定层上下层的符号(A﹑B﹑C)相同时,该指定层用 h 表示,当指定层上下层的符号不相 同时,该指定层用 c 表示。用此符号体系考察二层垛积,得到…hhhhhh …,可称为 垛积,用以考察 三层垛积时,得到…cccccc…,可称为 c 堆积。请问:四层﹑五层为一周期的垛积属于什么垛积型?为 什么说它们是二层垛积和三层垛积的混合?(注: h 是六方——hexagonal ——的第一个字母;c 是 立方——cubic ——的第一个字母。) 13﹑解:四面垛积是…hchchch…,即 hc 垛积型,说明六方垛积和立方垛积各占 50%;五 层垛积是…hhccchhccchhccc…,即 hhccc 垛积型,说明六方垛积和立方垛积分别占 2/5 和 3/5。 3-14 温度足够高时,某些合金晶体中的不同原子将变的不可区分,Cu3Au 晶体中各原子坐标上铜原子和 金原子可以随机地出现。问:此时,该合金晶胞是什么晶胞? 14﹑解:面心立方晶胞。 3-15 温度升得足够高时,会使某些分子晶体中原有一定取向的分子或者分子中的某些基团发生自由旋 转。假设干冰晶体中的二氧化碳分子能够无限制地以碳原子为中心自由旋转,问:原先的素立方晶胞将 转化为什么晶胞? 15﹑解:面心立方晶胞。 3-16 试在金属密堆积的面心立方晶胞的透视图上画出一个二维密堆积层,数一数,在该密堆积层上每个 原子周围有几个原子,在该原子的上下层又分别有几个原子?(参考 3-54) 16﹑解:6;3。参考图解如图 3-53。 3-17 找一找,在六方最密堆积的晶胞里,四面体空隙和八面体空隙在哪里?已知纤维锌矿(ZnS)的堆 积填隙模型为硫离子作六方最密堆积,锌离子作四面体填隙,请根据以上信息画出其晶胞。 17﹑解:见:周公度.结构和物性.高等教育出版社,1993,274~293 3-18 有一种典型离子晶体结构叫做ReO3 型,立方晶胞,Re6+ 的坐标为 0,0,0;O2- 的坐标为 0,1/2, 0;1/2,0,0;0,0,1/2。请问:这种晶体结构中,铼的配位数为多少?氧离子构成什么多面体?如何 连接? 18﹑解:Re 的配位数为 6;八面体;全部以顶角相连。 3-19 实验测得金属钛为六方最密堆积结构,晶胞参数为 a=295.0,c=468.6pm ,试求钛的原子半径和密 度。 19、解:晶胞体积:V=abcsin120°=295.0×295.0×468.6×0.866×10-24= 3.53×10-16
张祖德《无机化学》笔记和考研真题详解(硼族元素)【圣才出品】

第16章硼族元素16.1 复习笔记一、硼及其化合物硼的化学性质与Si有某些相似之处(对角线相似原则),通常硼呈现+3氧化态,负氧化态的情况很少。
硼与金属形成非化学计量化合物,如等。
1.单质硼(1)单质硼的晶体结构单质硼有两种同素异形体。
无定形硼为棕色粉末,晶态硼呈黑灰色。
硼的熔沸点高,晶态硼的硬度很大,在单质中仅次于金刚石。
晶态硼有很多种复杂的结构,他们都以B12正二十面体为基本的结构单元(如图16-1所示)。
图16-1 硼的基本结构单元(2)单质硼的化学性质硼和硅一样,在常温下较惰性,仅与F2反应。
相对于单质硼而言,晶态硼惰性较大,无定形硼比较活泼。
①在高温下,硼与N2、O2、S、卤素等反应。
②硼能从许多稳定的氧化物(等)中夺取氧。
③硼不与盐酸反应,但与氧化性的酸反应,生成H3BO3。
④在有氧化剂存在时,硼与碱共熔得到偏硼酸盐。
(3)单质硼的制备①金属还原法②工业上的碱法碱法步骤如下:a.用浓碱溶液来分解硼镁矿,得到偏硼酸钠:b.通入CO2调节碱度,分离出硼砂:c.用H2SO4调节酸度,可析出溶解度小的硼酸晶体:d.加热,使硼酸脱水生成B2O3:e.用Mg或Al还原成粗硼:③工业上的酸法酸法用硫酸分解硼镁矿,一步制得硼酸。
此法虽然简单,但需要耐酸设备等条件,不如碱法好。
④精制粗硼可将碘化硼在灼热(1000~1300 K)的钽丝上热解,可得到纯度达99.95%的α-菱形硼。
2.硼的化合物(1)硼的氢化物硼的氢化物的物理性质相似于烷烃,故称硼烷。
多数硼烷的组成是,少数为。
但最简单的硼烷是B2H6。
①硼的氢化物的制备方法a.质子置换法b.氢化法c.氢负离子置换法②硼烷的结构硼烷是缺电子化合物,B原子采取sp3杂化,位于一个平面的BH2原子团,以二中心二电子键连接,位于该平面上、下且对称的H原子与硼原子分别形成三中心二电子键,即氢桥键,如图16-2所示。
图16-2 硼烷B2H6的结构③硼烷的物理性质常温下,为气体,至为液体,及其他高级硼烷都是固体。
无机化学第三版下册答案第二十一章第十六章硼族元素习题解答(1)

第十六章 硼族元素1. 下表中给出第二、三周期元素的第一电离能数据(单位kJ·mol 1 )试说明B,Al 的第一电离能为什么比左右两元素的都低? 答:因为B ,Al 元素基态原子的价电子层结构为:ns 2np 1,最外层np 轨道上的一个电子容易失去而形成np 0空轨道稳定状态。
所以B 和Al 的I 1比左右两元素都低。
2. 在实验室中如何制备乙硼烷,乙硼烷的结构如何? 答:实验室中制备乙硼烷:质子置换法: 2BMn + 6H + = B 2H 6 + 2Mn 3+氢化法: 2BCl 3 + 6H 2 = B 2H 6 + 6HCl氢负离子置换法 3LiAlF 4 + 4BF 3 2B 2H 6 + 3LiF +3AlF 3乙醚或 3NaBH 4 + 4BF 32B 2H 6 + 3NaBF 4乙醚C 2H6的结构:BBHHHHHH分子中的 2个B 原子采取sp 3杂化,C2H 6分子中有4条B-H σ键,2条 氢桥键。
3. 说明三卤化硼和三卤化铝的沸点高低顺序,并指出蒸汽分子的结构。
答:三卤化物的熔沸点顺序见课本P780。
三卤化硼的蒸气分子均为单分子,AlF 3的蒸气为单分子。
而AlCl 3的蒸气为二聚分子,其中Al 采取sp 3杂化。
其结构:4. 画出B 3N 3H 6(无机苯)的结构。
答:NB NB N B HHHHHB 和N 原子都采取sp 2杂化,分子中有3条N -H σ键(sp 2-s ),3条B ―H σ键(sp2-s ),6条B ―N σ键(sp 2-sp 2),一个66π离域键(N 原子提供电子对,B 原子提供空p 轨道)5.B 10H 14的结构中有多少种形式的化学键?各有多少个?答:B 10H 14有5种化学键:有10条B -H σ键(2C -2e 键),2条B -B σ键(2C -2e 键),4条 桥键(3C-2e 键),2条开口硼桥键(3C-2e 键),4条闭合硼桥键(3C-2e 键)。
第16章-硼族元素习题

第16章硼族元素习题1.选择题16-1硼族元素最重要的特征是…………………………………………………( ) (A) 共价性特征 (B) 缺电子性特征(C) 共价性和缺电子性特征 (D) 易形成配合物和自身聚合的特征16-2 硼成键为sp2杂化,且含三个单键, 1 个π46键的化合物是………….. ( )(A) B2O3(B) BF4-(C) BO33-(D) B2H616-3硼的独特性质表现在………………………………………………………( )(A) 能形成正氧化态化合物,如BN ,其它非金属则不能(B) 能生成大分子(C) 能形成负氧化态化合物,其它金属则不能(D) 在简单的二元化合物中总是缺电子的16-4在 菱形硼的B12单元中,表现硼原子是缺电子原子性质的原子个数是( )(A) 3个(B) 6个(C) 9个(D) 12个16-5 下列关于单质硼性质的描述,错误的是………………………………..( )(A) 常温下不活泼,但高温下可与许多非金属反应(B) 与碳相似,炽热的硼可与水蒸气反应(C) 可与盐酸反应 (D) 可与碱反应16-6 硼与浓NaOH反应,所得的含硼产物是………………………………..( )(A) NaBO2(B) Na3BO3(C) B2O3(D) H3BO316-7 硼与浓硝酸反应,所得的含硼产物是…………………………………( )(A) B(NO3)3(B) H3BO3(C) BN (D) B2O316-8 下列对硼酸性质的描述不正确的是…………………………………( )(A) 硼酸是三元酸(B) 硼酸是一元路易斯酸(C) 硼酸与多元醇反应,生成配合物,使酸性增强(D) 硼酸的溶解度小16-9 硼砂的水溶液呈…………………………………………………….( )(A) 碱性(B) 中性(C) 酸性(D) 弱酸性16-10用盐酸滴定硼砂水溶液至恰好中和时,溶液呈……………………( )(A) 中性(B) 弱酸性(C) 弱碱性(D) 强碱性16-11下列关于硼酸结构的叙述错误的是……………………………….( )(A) 硼酸为白色片状晶体,其结构单元为B(OH)3三角形(B) 硼原子通过sp3杂化轨道与氧原子成键(C) 分子间通过氢键形成接近于六角形的对称层状结构(D) 层与层间以范德华力联系16-12在分析化学中,硼砂被用来作标准溶液是因为它………………………( )(A) 易水解(B) 在干燥空气中易风化(C) 溶融态时可溶解金属氧化物(D) 稳定,易提纯16-13 CO2泡末灭火器的反应原理是…………………………………………..( )(A) HCO3-离子的水解(B ) Al3+水解(C) HCO3-Al3+双水解,相互促进(D) 反应生成Al(HCO3)3,然后水解16-14 下列物质中水解并放出H2的是………………………………………()(A) B2H6(B) N2H4(C) NH3 (D) PH316-15 硼的缺电子性表现在……………………………………………………( )(A) 易形成缺电子多中心键及配合物(B) 易形成含桥键的化合物(C) 易形成不同类型杂化,形成化合物(D) 易形成共价化合物16-16 可形成下面几种类型化合物的X元素是………………………………( ) (XH3)2;X2O3;XCl3;XO2-;XF3·HF(A) P (B) Al (C) B (D) S16-17铝在空气中燃烧时,生成……………………………………………….( )(A)单一化合物Al2O3 (B) Al2O3和Al2N3(C)单一化合物Al2N3 (D) Al2O3和AlN16-18下列含氧酸中属于三元酸的是…………………………………………. ( )(A) H3BO3(B) H3PO2(C) H3PO3(D) H3A s O416-19BF3通入过量的Na2CO3溶液,得到的产物是………………………()(A) HF和H3BO3(B) HBF4和B(OH)3(C) NaBF4和NaB(OH)4(D) HF 和B2O316-20 BF3,B2H6,Al2Cl6都是稳定的化合物,BH3,AlCl3则相对不稳定,其原因是……………………………………………………………………….( )(A) 前者形成大π键,后者缺电子(B) 前者通过大π键、多中心键、配位键补偿了缺电子,后者缺电子(C) 前者缺电子,后者有多中心键(D) 前者有配位键,后者缺电子16-21 铊可以生成氟化铊、氯化铊和碘化铊,Tl在这三种化合物中的氧化态是( )(A) 与F 结合为Tl(+III) (B)与Cl 结合为Tl(+III)(C) 与I 结合为Tl(+I)与F,Cl结合为Tl(+III) (D) 全部为Tl(+III)16-22 InCl2为反磁性化合物,其中In 的氧化数为…………………………….()(A) +1 (B) +2 (C) +3 (D) +1和+316-23三氯化铝经常以(AlCl3)2 形式存在。
化学奥赛无机元素化学习题--硼-族-元-素(含答案)

【高中化学奥林匹克竞赛辅导】无机元素化学习题第十一章硼族元素1。
下列为有关硼酸的一些反应的图解,试写出其反应方程式,并指出反应条件。
B2H6↑Mg2B2O5·H2O→Na2B4O7·10H2O→BF3→H[BF4]↓H2SO4B2O3←HBO2←H3BO3→BPO4CH2-O (CH3)3BO3HO-C B-OHCH2-O2. 试解释下列各术语:(1)缺电子化合物(2)三中心键3。
B2H6的结构怎样?此分子中呈现出什么类型的键?4. 为什么BN和BP都能形成石墨型的结构?5. 硼酸晶体为什么呈鳞片状?晶体中硼酸分子是怎样结合在一起的?6。
硼酸H3BO3有没有象磷酸那样的碱式盐?为什么?7。
用盐酸可以溶解难溶的碳酸盐(如碳酸钙),但如用醋酸(K=1。
8×10-5)或硼酸(K=7。
8×10-10)能溶解碳酸钙吗?为什么?8. 在焊接金属时,使用硼砂的原理是什么?用反应方程式表示硼砂和下列各氧化物共熔时所发生的化学反应:CaO,Fe2O3,NiO。
9. 为什么不能用AlC13·6H2O加热脱水制备无水的AlCl3?10。
铝与硫混合,当加热时会剧烈的反应,生成硫化铝,但是此硫化铝不能从混有铝离子和硫离子的溶液中得到,如何解释?写出硫化铝与水的化学反应方程式。
11。
按金属的电极电位,铝的还原性远大于氢,但它不能将水中的H+还原为H2,可是在氢离子浓度比水小得多的碱性溶液中,铝反而可以容易地取代出氢气来,为什么?12. 已知A12O3(s),Fe2O3(s),MnO2(s)和MgO(s)的标准生成焓分别为:-1672,-823。
5,-518。
3,-601.9kJ⋅mol-1(1) 试求生成1mol铁,铝热剂反应的热效应?(2) 若用MnO2来代替Fe2O3,要得到lmol Mn反应的热效应如何?(3) 如果用MgO来代替Fe2O3,此反应是放热还是吸热,Al能否把MgO还原到Mg?13. 铟能显示+l和+3价态,但没有+2价态,但是它的氯化物中有一种分子式为InCl2,如何解释?14. 为什么不能制得TlI3和Tl2S3?15. 虽然TlI与KI是同晶型的,但为什么TlI不溶于水?16。
武汉大学版无机化学课后习题答案(第三版)第17章d区元素

D区元素〔1〕1.钛的主要矿物是什么?简述从钛铁矿制取钛白得反响原理。
解:钛的主要矿物有钛铁矿FeTiO2反响原理:FeTiO3 + 2H2SO4 = TiOSO4 + FeSO4 + 2H2OTiOSO4 + 2H2O =TiO2•H2O↓ + H2SO4TiO2•H2O = TiO2 + H2O2.解释TiCl3和[Ti(O2)OH(H2O)4]+ 有色得原因。
解:TiCl3显色是因为产生了电核跃迁,[Ti(O2)OH(H2O)4]+有色是因为O22-离子变形性较强,d—d跃迁所引起。
3.完成并配平以下反响方程式。
(1)Ti + HF →(2)TiO2 + H2SO4→(3)TiCl4 + H2O →(4)FeTiO3 + H2SO4→(5)TiO2 + BaCO3→(6)TiO2 + C + Cl2→解:(1) Ti + 5HF = H2TiF6 + 2H2↑(2)TiO2 + H2SO4 = TiOSO4 + H2O(3)TiCl4 + 2H2O = TiO2 + 4HCl(4)FeTiO3 + 2H2SO4 = TiOSO4 + FeSO4 + 2H2O(5)TiO2+ BaCO3 = BaTiO3 + CO2↑(6)TiO2 + 2C + 2Cl2 = TiCl4+ 2CO↑4.完成以下反响(1)TiI4在真空中强热;(2)FeTiO3和碳得混合物在氯气中加热;(3)向含有TiCl-2得水溶液参加过量得氨;6(4) 向VCl 3的水溶液参加过量的氨;(5) 将VCl 2的固体加到HgCl 2水溶液中。
解:(1) TiI 4 = Ti + 2I 2(2) 2FeTiO 3 + 6C + 5Cl 2 = 2FeCl 3 + 2TiCl 4 + 6CO(3) TiCl 62- + NH 3 = [Ti(NH 3)6]4+ + 6Cl -(4) VCl 3 + Na 2SO 3 =(5) VCl 2 + HgCl 2=5. 根据以下实验写出有关的反响方程式:将一瓶TiCl 4翻开瓶塞时立即冒白烟。
武汉大学、吉林大学《无机化学》(第3版)笔记和课后习题(含考研真题)详解-第16~24章【圣才出品】

4.卤化物
(1)硼、铝的三卤化物
①三卤化硼均为共价化合物,熔沸点很低,并随分子量增大而递增,其挥发性随分子量
的增大而降低。
三氟化硼是无色、有窒息气味的气体,不能燃烧。
②三卤化铝中,出 AlF3 为离子性化合物外,其余为共价化合物。在气相或非极性溶剂
中,AlCl3、AlBr3、AlI3 为二聚的。
4 / 140
脱水产物或高温熔融产物为 NaAlO2
(3)镓、铟、铊
①Ga:具有银白色金属光泽的软金属,熔点 302.78 K(29.6 ℃),沸点 2343 K,是所
有金属中熔沸点差值最大(2042.22 K)的。凝固时体积膨胀,硬度与铅相近。
②常温下,镓和铟在干燥的空气中不起变化,但铊表面会生成一层灰色的氧化物膜。
5.含氧化合物 (1)硼氧化合物具有很高的稳定性。B2O3 易溶于水,生成硼酸 H3BO3,但在热的水 蒸气中或遇潮时则生成挥发性的偏硼酸 HBO2。 (2)硼珠实验:熔融的 B2O3 溶解金属氧化物得到有特征颜色的偏硼酸盐玻璃:
(2)铝
铝是一种银白色有光泽的金属,有良好的延展性和导电性。
①虽是活泼金属,但表面覆盖致密的氧化膜,故常温下稳定
②高温与氧等非金属反应
铝热还原法:冶炼难熔金属 Fe、Ni、Mn、V 等
③与稀酸反应,在浓 H2SO4、浓 HNO3 中发生钝化
④与强碱反应:2Al + 2NaOH + 6H2O = 2NaAl(OH)4 + 3H2↑
2.缺电子 价电子数 < 价层轨道数 +3 氧化态的化合物(如:BF3)为缺电子化合物,有较强的继续接受电子的能力。表 现在分子的自聚(2BH3→B2H6)及同电子对给予体形成稳定配合物(HBF4)等方面。
