酸碱中和滴定PPT课件
合集下载
《酸碱中和滴定》-(共21张PPT)

2、试剂 (1)标准液(1.0mol/L的盐酸) 待测液(NaOH溶液) (2)适当的指示剂 (3)蒸馏水
红
橙
黄
红
紫
蓝
无色
粉红
红
思考四 酸碱滴定管的特点和使用要求
精确度:0.01mL
你读得准吗?
答案: 25.60mL
初试锋芒
酸
碱
亲临体会
中
和
成果展示
滴
定
合作探究
用1.00mol/L的盐酸(标准液)滴定 NaOH(待测)为例
1、酸碱中和滴定的操作步骤
Байду номын сангаас
1、查漏
滴 2、洗涤、润洗(2~3次)
定
前 3、装液、排气泡 4、调节起始刻度、记录(两管)
的
准
5、注:向锥形瓶中加 入NaOH溶液20.00mL
备 6、加:加2~3滴指示剂
(并在瓶底衬一张白纸)
2、滴定过程 “三个动作” 左手控制旋塞, 右手摇晃锥形瓶, 眼睛注视锥形瓶内颜色的变化。
3、滴定终点的判断
• 最后一滴滴入时,溶液由红色变成无色, 且半分钟内不 恢复红色。
4、数据处理
用1.00mol/L的盐酸(标准液)滴定 NaOH(待测)为例
当恰好中和(指示剂变色)时有:
nHCl=nNaOH cHClVHCl=cNaOHVNaOH
cNaOH=
cHClVHCl VNaOH
操作2~3次取平均值代入公式计算:
酸碱中和滴定
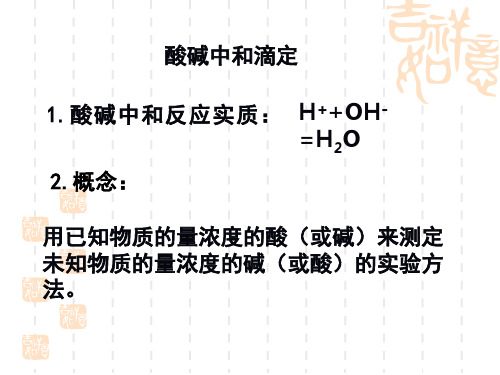
思考一:酸碱中和滴定原理? 1、目的: 用已知物质的量浓度的强酸或强碱来测 定未知物质的量浓度的强碱或强酸。
2、原理:
H+ + OH- = H2O
红
橙
黄
红
紫
蓝
无色
粉红
红
思考四 酸碱滴定管的特点和使用要求
精确度:0.01mL
你读得准吗?
答案: 25.60mL
初试锋芒
酸
碱
亲临体会
中
和
成果展示
滴
定
合作探究
用1.00mol/L的盐酸(标准液)滴定 NaOH(待测)为例
1、酸碱中和滴定的操作步骤
Байду номын сангаас
1、查漏
滴 2、洗涤、润洗(2~3次)
定
前 3、装液、排气泡 4、调节起始刻度、记录(两管)
的
准
5、注:向锥形瓶中加 入NaOH溶液20.00mL
备 6、加:加2~3滴指示剂
(并在瓶底衬一张白纸)
2、滴定过程 “三个动作” 左手控制旋塞, 右手摇晃锥形瓶, 眼睛注视锥形瓶内颜色的变化。
3、滴定终点的判断
• 最后一滴滴入时,溶液由红色变成无色, 且半分钟内不 恢复红色。
4、数据处理
用1.00mol/L的盐酸(标准液)滴定 NaOH(待测)为例
当恰好中和(指示剂变色)时有:
nHCl=nNaOH cHClVHCl=cNaOHVNaOH
cNaOH=
cHClVHCl VNaOH
操作2~3次取平均值代入公式计算:
酸碱中和滴定
思考一:酸碱中和滴定原理? 1、目的: 用已知物质的量浓度的强酸或强碱来测 定未知物质的量浓度的强碱或强酸。
2、原理:
H+ + OH- = H2O
酸碱中和滴定法3.ppt

NH4Cl弱酸性如果黄色变成橙色,可视为中 和滴定完全,此时HCl并不过量
酸滴定碱选酚酞,变色时PH=8.2为碱性,此时可能碱未 被完全中和。
③强碱滴定弱酸时用酚酞 NaOH + CH3COOH == CH3COONa + H2O
CH3COONa溶液为弱碱性,当酚酞由无色变 成粉红时,达到终点,碱不过量
解:V(HCl)=(30.51+30.50+30.49)/3=30.50ml
C(HCl)·V(HCl)=C(NaOH)·V(NaOH)
C(NaOH)=
C(HCl)·V(HCl) V(NaOH)
=
0.120×30.5 25
=0.146mol/L
三、酸碱中和滴定的主要仪器:
酸式滴定管 碱式滴定管 锥形瓶 容量瓶 滴定管夹 铁架台
3.不引起偏差的操作:
1)锥形瓶只用蒸馏水洗涤后,仍留有少量蒸 馏水;
2)量入待测液在锥形瓶内加入少量水稀释 待测液
(二) 杂质引起的误差
研究对象一般是在配制碱液时,所取固体碱中 混入了杂质。杂质不同所耗酸的体积不同.(等 质量的杂质与等质量的碱比较中和酸的能力)
1.用已知物质的量浓度的标准酸滴定未知物质的 量浓度的碱溶液(甲基橙作指示剂)
碱性:弱酸与强碱中和
例如:H3PO4+3NaOH==Na3PO4+3H2O 1 :3 即完全中和,,但溶液的PH>7 故酸碱完全中和指的是酸碱刚好完全反 应,n(H)=n(OH),而不是PH=7
二、酸碱中和滴定的定义及意义:
1、中和滴定的定义 用已知物质的量浓度的酸(或碱)来测定未 知物质的量浓度的碱(或酸)的方法叫酸碱 中和滴定
用Na2CO3溶液测定盐酸的量浓度时,如果杂质中含 NaHCO3,K2CO3,NaCl等杂质,所耗碱液体积偏多, 测出酸浓度偏高
酸碱中和滴定专业ppt课件.ppt

☆实验:酸碱中和滴定
1、原理(或定义):用已知浓度的酸(或碱)来测定未知浓 度的碱(或酸)的方法。
2、公式:c酸v酸=c碱v碱(一元酸和一元碱)
3、实验的关键: (1)准确测量参加反应的两种溶液的体积 (2)准确判断中和反应是否恰好完全反应
4、实验仪器
仪器:酸式滴定管、碱式滴定管、锥形瓶、 铁架台、 滴定管夹、烧杯、白纸(有时还需要移液管)
石蕊溶液
紫色
红5紫8蓝
a、甲基橙和酚酞的变色范围较小:4.4-3.1=1.3、10-8=2对 溶液的酸碱性变化较灵敏
b、溶液使指示剂改变颜色,发生化学变化。指示剂滴加太多将 消耗一部分酸碱溶液(一般为1→2滴)。
3、酸碱中和滴定中指示剂的选择:
a、强酸强碱间的滴定: 酚酞溶液、甲基橙
b、强酸滴定弱碱 两者正好完全反应,生成强酸弱碱盐,反应后溶
= 0.1233mol/L
答:测得NaOH的物质的量浓度为0.1233mol/L。
★三、误差分析:
❖ 例题:用标准盐酸滴定未知浓度的氢氧化钠溶液(氢氧 化钠放于锥形瓶中)下列操作(其它操作均正确),对 氢氧化钠溶液浓度有什么影响?
一、酸式滴定管
1、未用标准液(HCl)润洗酸式滴定管 偏高
2、滴定管内壁不干净,滴定后,酸式滴定管内壁挂水珠 偏高
4、赶气泡:使滴定管尖嘴部分充满溶液. 酸式滴定管:快速放液 碱式滴定管:橡皮管向上翘起
5、调液面:
调节滴定管中液面高度,
使液面等于“0”刻度或在 “0”刻度以下的某一位 置,并记下读数,记作起 始读数。
(二)滴定阶段
6、取液: ①从碱式滴定管中放出一定量氢氧化钠溶液于锥形瓶中。 ②滴入2滴酚酞试液,将锥形瓶置于酸式滴定管下方,并 在瓶底衬一张白纸。
1、原理(或定义):用已知浓度的酸(或碱)来测定未知浓 度的碱(或酸)的方法。
2、公式:c酸v酸=c碱v碱(一元酸和一元碱)
3、实验的关键: (1)准确测量参加反应的两种溶液的体积 (2)准确判断中和反应是否恰好完全反应
4、实验仪器
仪器:酸式滴定管、碱式滴定管、锥形瓶、 铁架台、 滴定管夹、烧杯、白纸(有时还需要移液管)
石蕊溶液
紫色
红5紫8蓝
a、甲基橙和酚酞的变色范围较小:4.4-3.1=1.3、10-8=2对 溶液的酸碱性变化较灵敏
b、溶液使指示剂改变颜色,发生化学变化。指示剂滴加太多将 消耗一部分酸碱溶液(一般为1→2滴)。
3、酸碱中和滴定中指示剂的选择:
a、强酸强碱间的滴定: 酚酞溶液、甲基橙
b、强酸滴定弱碱 两者正好完全反应,生成强酸弱碱盐,反应后溶
= 0.1233mol/L
答:测得NaOH的物质的量浓度为0.1233mol/L。
★三、误差分析:
❖ 例题:用标准盐酸滴定未知浓度的氢氧化钠溶液(氢氧 化钠放于锥形瓶中)下列操作(其它操作均正确),对 氢氧化钠溶液浓度有什么影响?
一、酸式滴定管
1、未用标准液(HCl)润洗酸式滴定管 偏高
2、滴定管内壁不干净,滴定后,酸式滴定管内壁挂水珠 偏高
4、赶气泡:使滴定管尖嘴部分充满溶液. 酸式滴定管:快速放液 碱式滴定管:橡皮管向上翘起
5、调液面:
调节滴定管中液面高度,
使液面等于“0”刻度或在 “0”刻度以下的某一位 置,并记下读数,记作起 始读数。
(二)滴定阶段
6、取液: ①从碱式滴定管中放出一定量氢氧化钠溶液于锥形瓶中。 ②滴入2滴酚酞试液,将锥形瓶置于酸式滴定管下方,并 在瓶底衬一张白纸。
《酸碱中和滴定实验》课件

消除方法:选择精度高的滴定管、控制滴定速度、准确判断滴定终点等
Part Four
滴定剂的配制和标 定
滴定剂的种类性质
酸碱指示剂: 酸碱滴定剂: 缓冲溶液:用 标准溶液:用
用于指示滴定 用于滴定反应, 于控制滴定反 于标定滴定剂
终点,如酚酞、 如盐酸、氢氧 应的pH值,
的浓度,如
甲基橙等
化钠等
如磷酸缓冲液、 0.1M的盐酸、
状况
监测工业排放: 检测工业排放 物酸碱度,判 断排放是否达
标
在食品检测中的应用
检测食品中的酸碱度
检测食品中的微生物含量
添加标题
添加标题
检测食品中的添加剂含量
添加标题
添加标题
检测食品中的重金属含量
Part Seven
酸碱中和滴定实验 的改进和发展趋势
实验方法的改进
自动滴定仪的应用:提高滴定精度和速度
指示剂变色误差:指示剂变色不明显, 导致滴定终点误差
温度影响:温度变化导致溶液体积变化, 影响滴定终点
滴定速度影响:滴定速度过快或过慢, 导致滴定终点误差
消除方法:使用准确读数的滴定管,选 择合适的指示剂,控制温度,保持稳定 的滴定速度。
Part Six
酸碱中和滴定实验 的应用
在化学分析中的应用
滴定终点的确定方法
指示剂变色法:通过观察指示剂颜色的变化来确定滴定终点 电位法:通过测量溶液的电位变化来确定滴定终点 滴定管法:通过观察滴定管中溶液的颜色变化来确定滴定终点 滴定管法:通过观察滴定管中溶液的颜色变化来确定滴定终点
滴定终点误差的来源和消除方法
滴定管读数误差:滴定管读数不准确, 导致滴定终点误差
滴定管改进:采用更精确的滴定管,提高滴定精度
Part Four
滴定剂的配制和标 定
滴定剂的种类性质
酸碱指示剂: 酸碱滴定剂: 缓冲溶液:用 标准溶液:用
用于指示滴定 用于滴定反应, 于控制滴定反 于标定滴定剂
终点,如酚酞、 如盐酸、氢氧 应的pH值,
的浓度,如
甲基橙等
化钠等
如磷酸缓冲液、 0.1M的盐酸、
状况
监测工业排放: 检测工业排放 物酸碱度,判 断排放是否达
标
在食品检测中的应用
检测食品中的酸碱度
检测食品中的微生物含量
添加标题
添加标题
检测食品中的添加剂含量
添加标题
添加标题
检测食品中的重金属含量
Part Seven
酸碱中和滴定实验 的改进和发展趋势
实验方法的改进
自动滴定仪的应用:提高滴定精度和速度
指示剂变色误差:指示剂变色不明显, 导致滴定终点误差
温度影响:温度变化导致溶液体积变化, 影响滴定终点
滴定速度影响:滴定速度过快或过慢, 导致滴定终点误差
消除方法:使用准确读数的滴定管,选 择合适的指示剂,控制温度,保持稳定 的滴定速度。
Part Six
酸碱中和滴定实验 的应用
在化学分析中的应用
滴定终点的确定方法
指示剂变色法:通过观察指示剂颜色的变化来确定滴定终点 电位法:通过测量溶液的电位变化来确定滴定终点 滴定管法:通过观察滴定管中溶液的颜色变化来确定滴定终点 滴定管法:通过观察滴定管中溶液的颜色变化来确定滴定终点
滴定终点误差的来源和消除方法
滴定管读数误差:滴定管读数不准确, 导致滴定终点误差
滴定管改进:采用更精确的滴定管,提高滴定精度
酸碱中和滴定ppt课件

作指示剂 B.溶液呈中性,只能选用石蕊作指示剂 C.溶液呈碱性,可选用 甲基橙或酚酞作指示剂 D.溶液呈碱性,只能选用酚酞作指示剂
四、实验步骤
1.滴定前准备
2.滴定操作 用左手控制滴定管活塞,逐滴放出溶液,右手摇动锥形瓶, 两眼注视锥形瓶内溶液颜色变化。
控制活塞
摇动锥形瓶
锥形瓶 内溶液颜色变化
3.终点判断 当滴入最后半滴×××标准溶液后,溶液由××色变成××色,
【课堂练习】
1.用已知浓度的NaOH溶液测定某H2SO4溶液的浓度,从下表中选出正确 选项( C )
序号
① ② ③ ④
锥形瓶中 滴定管中 选用指示 选用滴定
溶液
溶液
剂
管
碱
酸
石蕊
甲
酸
碱
酚酞
甲
碱
酸
甲基橙
甲
酸
碱
酚酞
乙
A.①② B.②③ C.③④ D.②④
2.用0.10mol/LNaOH溶液滴定未知浓度的CH3COOH溶液,恰好完全反应 时,下列叙述中正确的是( D ) A.溶液呈中性,可选用甲基橙或酚酞
带玻璃球 的橡胶管
注意: 酸式滴定管:酸性、强氧化性试剂 碱式滴定管:碱性试剂
【课堂练习】
1.下列所述仪器“0”刻度位置正确的是( B )
A.在量筒的上端
B.在滴定管上端
C.容量瓶上端
D.在托盘天平刻度尺的右边2.50ml的滴定管盛有
溶液,液面恰好在20.0处,若把滴定管中溶液全部
C 排出,则体积( )
液的碱式滴定管固定好,调节滴定管尖嘴使之充满溶液;D.取标准KOH
溶液注入碱式滴定管至“0”刻度以上2~3 mL;E.调节液面至“0”或“0”以
四、实验步骤
1.滴定前准备
2.滴定操作 用左手控制滴定管活塞,逐滴放出溶液,右手摇动锥形瓶, 两眼注视锥形瓶内溶液颜色变化。
控制活塞
摇动锥形瓶
锥形瓶 内溶液颜色变化
3.终点判断 当滴入最后半滴×××标准溶液后,溶液由××色变成××色,
【课堂练习】
1.用已知浓度的NaOH溶液测定某H2SO4溶液的浓度,从下表中选出正确 选项( C )
序号
① ② ③ ④
锥形瓶中 滴定管中 选用指示 选用滴定
溶液
溶液
剂
管
碱
酸
石蕊
甲
酸
碱
酚酞
甲
碱
酸
甲基橙
甲
酸
碱
酚酞
乙
A.①② B.②③ C.③④ D.②④
2.用0.10mol/LNaOH溶液滴定未知浓度的CH3COOH溶液,恰好完全反应 时,下列叙述中正确的是( D ) A.溶液呈中性,可选用甲基橙或酚酞
带玻璃球 的橡胶管
注意: 酸式滴定管:酸性、强氧化性试剂 碱式滴定管:碱性试剂
【课堂练习】
1.下列所述仪器“0”刻度位置正确的是( B )
A.在量筒的上端
B.在滴定管上端
C.容量瓶上端
D.在托盘天平刻度尺的右边2.50ml的滴定管盛有
溶液,液面恰好在20.0处,若把滴定管中溶液全部
C 排出,则体积( )
液的碱式滴定管固定好,调节滴定管尖嘴使之充满溶液;D.取标准KOH
溶液注入碱式滴定管至“0”刻度以上2~3 mL;E.调节液面至“0”或“0”以
酸碱中和滴定实验-PPT课件

22
(4)溶液变色因局部过量而实际未达终点,立即读数会造成 V(KMnO4)减小,故结果偏低。
答案:(1)把游码拨回零处 镊子 (2)酸式 滴入一滴酸 性 KMnO4 溶液,溶液由无色变为浅紫色,且半分钟不褪色
(3)26W7 mol·L-1 (4)偏低
23
•
感 谢 阅
读感 谢 阅
读
13
名师点拨:在滴定过程中,指示剂略多加了几滴,一般不 影响实验结果。NaOH 与 CH3COOH 恰好完全反应,生成的 CH3COONa 溶液呈碱性,而甲基橙的变色范围是在 pH 约为 3.1~4.4 中,当用甲基橙指示滴定终点时,还未完全反应,使 实验结果产生误差,应选用酚酞作指示剂。
答案:C
应用________拨动游码。
(2)若将 W g Na2C2O4 配成 100 mL 标准溶液,移取 20.00 mL 置于锥形瓶中,则酸性 KMnO4 溶液应装在 ________(填“酸式”或“碱式”)滴定管中。判断滴定达到终
点的现象是__________________________________________。
16
(2)用高锰酸钾标准溶液滴定被测试样,其反应的离子方程
式如下,请将相关物质的化学计量数及化学式填写在方框里。
□MnO
-
4
+
□H2O2
+
□H
+
□Mn2 + + □H2O +
□
(3) 滴定时,将高锰酸钾标准溶液注入________( 填“酸
式 ” 或 “ 碱 式 ”) 滴 定 管 中 。 滴 定 到 达 终 点 的 现 象 是 _____________________________________________________ _________________。
酸碱中和滴定法第1课时.ppt

碱性
(如NaOH、Na2CO3等)
碱式滴定管 碱性物质易腐蚀玻璃, (带橡皮管) 致使玻璃塞无法打开
二、酸碱中和滴定的主要仪器及使用方法
• (2)滴定管操作方法 ① 检漏:检查滴定管是否漏水。
② 润冼:加入酸碱反应液之前,滴定管要用待装液润冼2 -3遍。
③ 装液:将反应液加入相应的滴定管中,使液面位于“0” 刻度以上2-3mL.
注意: 1、温度:20℃ 2、体积:25mL或50mL 3、刻度:0刻度在上
最小刻度0.1 4、精确度:0.01mL
二、酸碱中和滴定的主要仪器及使用方法
• 2、酸碱式滴定管的使用方法 • (1)滴定管的选择
溶液性质
酸性、氧化性
(如酸、KMnO4等)
滴定管
原因
酸式滴定管 氧化性物质易腐蚀橡胶管 (带玻璃活塞)
• (2)用标准NaOH溶液滴定时,应将标准NaOH溶 液注入 乙 (选填“甲”或“乙”)中。
• (3)右图是碱式滴定管中液面在滴定前后的读数,
c(HCl)=____a(_V_2_-V_1_)/_V_____mol·L-1。
课后作业
• 1、预习酸碱中和滴定操作和误差分析。 • 2、思考:滴定终点是酸碱恰好中和的点吗? • 3、完成《金版学案》对应课时练习。
[问题情境]
• 实验室有一瓶盐酸 溶液,标签已被腐 蚀,浓度未知,你 能通过实验的方法 测出它的物质的量 浓度吗?
ห้องสมุดไป่ตู้
一、酸碱中和滴定的概念和原理
1、概念
利用中和反应,用已知浓度的酸(或碱)来 测定未知浓度的碱(或酸)的实验方法。
2、原理:
中和滴定以酸碱中和反应为基础,其实质为: H+ + OH- = H2O
3.2.3 酸碱中和滴定(课件)高二化学(人教版2019选择性必修1)

六、误差分析
1.分析依据
c待现在V标准 的大小。
任务四 数据处理及误差分析
六、误差分析
2.常见的误差分析(1)以用标准盐酸滴定待测氢氧化钠溶液为例:
步骤 洗涤 取液
操作 酸式滴定管未用标准溶液润洗 碱式滴定管未用标准溶液润洗
﹡类型 酸式滴定管(A):酸性、氧化性的试剂 碱式滴定管(B):碱性的试剂
任务一 准确测定酸或碱的浓度
二、主要仪器
待测液 NaOH 可取20.00mL
【思考交流】如何判断中和
反应什么时候“恰好”反应
标准液
完全(即判断滴定终点)?
0.1000mol/L HCl
V(HCl)=?
V(HCl)=?
方法:在待测溶液中加入
19.98 (少加半滴)
9.7
20.00 7
20.02 (多加半滴)
4.3
滴定时,每滴溶液的体积约为0.04 mL
任务二 探究滴定终点前后溶液的pH变化
三、滴定终点的确定
酸碱指示剂的颜色在pH突 12
变范围发生明显的改变,就能 10
pH
以允许的误差表示反应已完全, 8
6
即为滴定终点。
4
特别注意:石蕊颜色变化不
第三章 水溶液中的离子反应与平衡
第二节 水的电离和溶液的pH 第3课时 酸碱中和滴定
学习目标
1.通过对中和滴定的系统分析,体会中和滴定是一个精准的定量实验。 2.通过计算中和滴定终点前后溶液的pH,了解中和滴定pH突变特征和 选择指示剂的原则。 3.能通过酸碱中和滴定的方法测定酸或碱的浓度,掌握数据分析与处理 的方法,培养定量研究的意识。
变大
滴定
振荡锥形瓶时部分液体溅出 部分酸液滴出锥形瓶外
1.分析依据
c待现在V标准 的大小。
任务四 数据处理及误差分析
六、误差分析
2.常见的误差分析(1)以用标准盐酸滴定待测氢氧化钠溶液为例:
步骤 洗涤 取液
操作 酸式滴定管未用标准溶液润洗 碱式滴定管未用标准溶液润洗
﹡类型 酸式滴定管(A):酸性、氧化性的试剂 碱式滴定管(B):碱性的试剂
任务一 准确测定酸或碱的浓度
二、主要仪器
待测液 NaOH 可取20.00mL
【思考交流】如何判断中和
反应什么时候“恰好”反应
标准液
完全(即判断滴定终点)?
0.1000mol/L HCl
V(HCl)=?
V(HCl)=?
方法:在待测溶液中加入
19.98 (少加半滴)
9.7
20.00 7
20.02 (多加半滴)
4.3
滴定时,每滴溶液的体积约为0.04 mL
任务二 探究滴定终点前后溶液的pH变化
三、滴定终点的确定
酸碱指示剂的颜色在pH突 12
变范围发生明显的改变,就能 10
pH
以允许的误差表示反应已完全, 8
6
即为滴定终点。
4
特别注意:石蕊颜色变化不
第三章 水溶液中的离子反应与平衡
第二节 水的电离和溶液的pH 第3课时 酸碱中和滴定
学习目标
1.通过对中和滴定的系统分析,体会中和滴定是一个精准的定量实验。 2.通过计算中和滴定终点前后溶液的pH,了解中和滴定pH突变特征和 选择指示剂的原则。 3.能通过酸碱中和滴定的方法测定酸或碱的浓度,掌握数据分析与处理 的方法,培养定量研究的意识。
变大
滴定
振荡锥形瓶时部分液体溅出 部分酸液滴出锥形瓶外
《酸碱中和滴定》课件ppt

学习目标
掌握酸碱中和滴定实验的原理和操作方法, 通过对酸碱溶液的分析,了解溶液中数量变化对性质的影响,体会由量变到质变的过程。 了解化学定量分析的方法,体验化学在科学研究中的作用和地位,提高学生的科学素质。
一、酸碱中和滴定原理。
1、 定义:用已知物质的量浓度的强酸或强碱(标准溶液)来测定未知物质的量浓度的强碱或强酸(待测溶液或未知溶液)的方法叫做酸碱中和滴定。
红 橙 黄
红 紫 蓝
无色 粉红 红
2、 原理:以酸碱中和反应为基础, H+ + OH- = H2O 在滴定达到终点(即酸碱恰好反应)时:
1mol
1mol
有 n(H+) = n(OH-)
例题:用0.1032mol/L的HCl溶液滴定25.00mL未知浓度的NaOH溶液, 滴定完成时,用去HCl溶液27.84mL。通过中和滴定测得NaOH溶液的物质的量浓度是多少?
用0.1000mol/L的NaOH溶液,滴定20 .00ml 0.1000mol/L的HCl 溶液,求随V NaOH的增大,pH=?
滴定过程的pH变化
思考
VNaOH()
0.00
5.00
10.00
15.00
18.00
19.00
19.50
19.98
pH
1.00
1.22
1.48
1.84
3、酸碱中和滴定的关键
(1)准确测量参加反应的两种溶液的体积 (2)准确判断中和反应是否恰好完全反应
需要能在滴加溶液时准确表示所加溶液体积的仪器——滴定管 需要能指示酸碱反应完全的物质 ——酸碱指示剂
【思维探究】:要想测定的浓度结果更准确,你 认为实验的关键是什么?
酸碱中和滴定ppt课件.ppt

不同点有哪些认识?使用它们注意哪些事项?
问题导学
课前预习导学
课堂合作探究
KEQIAN YUXI DAOXUE
KETANG HEZUO TANJIU
当堂检测
答案:酸式滴定管:取酸液或强氧化性溶液,特征:玻璃活塞。碱式滴
定管:取碱液,特征:内有玻璃球的橡皮管。注意点:a.检查是否漏水,玻璃
活塞用左手指内扣转动。b.滴定前要洗涤:洗涤剂洗—自来水洗—蒸馏
课堂合作探究
KEQIAN YUXI DAOXUE
KETANG HEZUO TANJIU
预习引导
(4)取:从碱式滴定管中放出 25.00 mL 氢氧化钠溶液于锥形瓶中,
滴入 2 滴酚酞溶液,将锥形瓶置于酸式滴定管下方,并在瓶底衬一张白
纸。
(5)滴定:左手控制活塞,右手振荡锥形瓶,边滴入盐酸,边不断摇动锥
内含少量的氢氧化钾,用标准盐酸溶液进行滴定(偏低)
(2)同上情况,若氢氧化钠中含有少量的碳酸钠,结果如何(偏低)
问题导学
课前预习导学
课堂合作探究
KEQIAN YUXI DAOXUE
KETANG HEZUO TANJIU
当堂检测
迁移与应用
例 3 用标准盐酸滴定未知浓度的 NaOH 溶液时,若测得的结
目标导航
课前预习导学
课堂合作探究
KEQIAN YUXI DAOXUE
KETANG HEZUO TANJIU
预习引导
答案:①不能用量筒代替滴定管,因为计量的精确度不同。在量取液
体的体积时,量筒只能读至 0.1 mL,而滴定管可读至 0.01 mL。用滴定管
测量时有测定值的精确度较高,读数方便,操作简单等优点。
(4)滴定操作时,有少量盐酸滴于锥形瓶外(偏高)
问题导学
课前预习导学
课堂合作探究
KEQIAN YUXI DAOXUE
KETANG HEZUO TANJIU
当堂检测
答案:酸式滴定管:取酸液或强氧化性溶液,特征:玻璃活塞。碱式滴
定管:取碱液,特征:内有玻璃球的橡皮管。注意点:a.检查是否漏水,玻璃
活塞用左手指内扣转动。b.滴定前要洗涤:洗涤剂洗—自来水洗—蒸馏
课堂合作探究
KEQIAN YUXI DAOXUE
KETANG HEZUO TANJIU
预习引导
(4)取:从碱式滴定管中放出 25.00 mL 氢氧化钠溶液于锥形瓶中,
滴入 2 滴酚酞溶液,将锥形瓶置于酸式滴定管下方,并在瓶底衬一张白
纸。
(5)滴定:左手控制活塞,右手振荡锥形瓶,边滴入盐酸,边不断摇动锥
内含少量的氢氧化钾,用标准盐酸溶液进行滴定(偏低)
(2)同上情况,若氢氧化钠中含有少量的碳酸钠,结果如何(偏低)
问题导学
课前预习导学
课堂合作探究
KEQIAN YUXI DAOXUE
KETANG HEZUO TANJIU
当堂检测
迁移与应用
例 3 用标准盐酸滴定未知浓度的 NaOH 溶液时,若测得的结
目标导航
课前预习导学
课堂合作探究
KEQIAN YUXI DAOXUE
KETANG HEZUO TANJIU
预习引导
答案:①不能用量筒代替滴定管,因为计量的精确度不同。在量取液
体的体积时,量筒只能读至 0.1 mL,而滴定管可读至 0.01 mL。用滴定管
测量时有测定值的精确度较高,读数方便,操作简单等优点。
(4)滴定操作时,有少量盐酸滴于锥形瓶外(偏高)
酸碱中和滴定备PPT课件
CHCl=
—CN—aO—H .—V—NaO—H VHCl
用的氢氧化钠溶液滴定未知浓度的盐酸
一次滴定
二次滴定 三次滴定
终点读数 起点读数 用量差值
V标NaOH
a
V待HCl
V标NaOH
平均值
C待平均
误差分析的依据:
利用中和滴定原理:
C待= —C—标—. V—标— V待
❖滴定过程中任何错误操作都有可能导致C标、V标、V 待的误差
VNaOH(m L)
20.00
20.02
20.08
pH 7.00 9.70 10.30
20.10 10.40
21.00 11.38
25.00 12.05
30.00 12.30
35.00 12.44
中和滴定曲线
PH
12 10 8 6 4 2
酚酞 甲基橙 4.3
突变范围
0 10 20 30 40 V(NaOH)mL
平视 俯视 俯视 仰视
偏高 偏高 偏高 偏低
①上端标有: 温度 、 容积 、 0刻度 ;
25℃
25mL 50mL
②酸式滴定管:玻璃活塞,不能盛 碱性溶液; 碱式滴定管:橡胶管+玻璃球,不能盛 酸性和 强氧化性溶液。
③滴定管的最小刻度为 数的精确度为 mL。
,允许估计至 ,因此读
2、滴定管的使用方法
① 检漏:检查活塞是否漏水。 ② 洗涤:先用自来水或蒸馏水洗,然后润洗。 ③ 装液:把溶液注入滴定管中,使液面位于“0”刻度线以上 2cm~3cm处,再把滴定管固定在滴定管夹上,在滴定管下放一个 烧杯,调节活塞使滴定管的尖嘴部分充满溶液(不留气泡). ④调零:并使液面处在“0”或“0”以下某一刻度处,记下准 确读数V0 ⑤ 读数:滴加溶液反应完毕后记录读数V1,则反应消耗溶液的 体积为V1-V0
酸碱中和滴定实验ppt课件.ppt
C(酸)×V(酸) =化学计量数之比 C(碱)×V(碱)
讨论:运用这种方法的关键问题是什么?
4.关键: ①准确测出参加反应的两种溶液的体积。
②准确判断中和反应是否恰好进行完全。
思考:测定溶液体积的仪器有哪些? 量筒 滴定管:酸式滴定管和碱式滴定管
想一想:
1、如何判断酸式滴定管和碱式滴定管?
2、量筒和滴定管的“0”刻度位置是否一致?
思考:如果是强碱和弱酸中和滴定又该选择 什么指示剂?
结论:根据达到终点后溶液的酸碱性来选 变色范围尽可能与所生成盐的酸碱性范围一致 浅变深更好
练一练
1、酸碱恰好完全中和时,它们的( D)一定相等。
A、质量
B、物质的量
C、物质的量浓度
D、H+和OH-的物质的量
2、物质的量浓度相同、体积也相同的一元酸和一元
碱相互中时,溶液显什么性( D )
A、显酸性B、显碱性C Nhomakorabea显中性D、酸碱性无法判断
练一练
3.用已知物质的量浓度的NaOH溶液滴定未 知物质的量浓度的HCl溶液,一般选用(酚酞 ) 作指示剂,用已知物质的量溶液的HCl溶液滴 定未知物质的量浓度的NaOH溶液,一般选用 (甲基)橙作指示剂。
5、实验仪器
解: HCl 1mol
+
NaOH = NaCl+ H2O
1mol
c(HCl)•V[HCl(aq)] c(NaOH)•V[NaOH(aq)]
c(NaOH)= c(HCl ) •V[HCl (aq)] 1mol
V[NaOH (aq)] 1mol
= 0.1100mol / L 0.02900L
0.02300L
V[NaOH (aq)] 1mol
讨论:运用这种方法的关键问题是什么?
4.关键: ①准确测出参加反应的两种溶液的体积。
②准确判断中和反应是否恰好进行完全。
思考:测定溶液体积的仪器有哪些? 量筒 滴定管:酸式滴定管和碱式滴定管
想一想:
1、如何判断酸式滴定管和碱式滴定管?
2、量筒和滴定管的“0”刻度位置是否一致?
思考:如果是强碱和弱酸中和滴定又该选择 什么指示剂?
结论:根据达到终点后溶液的酸碱性来选 变色范围尽可能与所生成盐的酸碱性范围一致 浅变深更好
练一练
1、酸碱恰好完全中和时,它们的( D)一定相等。
A、质量
B、物质的量
C、物质的量浓度
D、H+和OH-的物质的量
2、物质的量浓度相同、体积也相同的一元酸和一元
碱相互中时,溶液显什么性( D )
A、显酸性B、显碱性C Nhomakorabea显中性D、酸碱性无法判断
练一练
3.用已知物质的量浓度的NaOH溶液滴定未 知物质的量浓度的HCl溶液,一般选用(酚酞 ) 作指示剂,用已知物质的量溶液的HCl溶液滴 定未知物质的量浓度的NaOH溶液,一般选用 (甲基)橙作指示剂。
5、实验仪器
解: HCl 1mol
+
NaOH = NaCl+ H2O
1mol
c(HCl)•V[HCl(aq)] c(NaOH)•V[NaOH(aq)]
c(NaOH)= c(HCl ) •V[HCl (aq)] 1mol
V[NaOH (aq)] 1mol
= 0.1100mol / L 0.02900L
0.02300L
V[NaOH (aq)] 1mol
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
0.023L00
.
7
CB CAVA VB
知C(A)量取VB,读出VA, 即可求出C(B)
4、酸碱中和滴定的关键 (1)准确测量两种溶液的体积 (2)准确判断中和反应什么时候“恰好”完 全(即滴定终点的判断)
.
8
二、酸碱中和滴定实验的主要仪器及使用
(一)滴定管的结构和使用方法
1、酸碱滴定管的结构
.
6
解: HCl
+
1mol
c(HCl)•V[HCl(aq)]
NaOH = NaCl+ H2O 1mol
c(NaOH)•V[NaOH(aq)]
c(NaOH)=
c(HC )•V l [HC (al)q]1mol V[NaO (aH )q]1mol
=
0.110m0o/Ll0.029L00
=0.1400mol/L
把滴定管固定在滴定管夹上,锥形瓶放在下面接 液体,滴定过程中用左手控制活塞,用右手摇动 锥形瓶,眼睛应注视锥形瓶中溶液颜色的变化
滴定终点判断: 当滴入最后一滴溶液时颜色发生变 化且半分钟内颜色不再发生变化即已 达终点。
.
17
滴定过程中PH值的变化和指示剂的选择 以用0.1mol/L的NaOH 滴定0.1mol/L的HCl 为例:(已知lg2=0.3 lg5=0.7) (1)取20mL的HCl,当加入20mL的NaOH
18.00 19.68 19.98 20.00 20.02 20.20 22.00 23.00 2.3 3.3 4.3 7.0 9.7 10.7 11.7 12.5
问题1:滴定终点消耗碱多少? PH等于多少?
问题2:滴定终点时多半滴和少半滴溶液性质发生怎样改变? PH发 生怎样改变?
问题3:如果以NaOH加入量为横坐. 标,以PH值变化为纵坐标,绘制19 中和滴定曲线
常见指示剂 甲基红 酚酞 甲基橙
石蕊
红 4.4 —橙— 6.2黄
无色 8.2 粉—红—10.0红 红 3.1 —橙—色 4.4 黄
红
5.0
紫
———
8.0
蓝色
强酸滴定强碱 甲基橙由黄 橙 酚酞由红 无色
就能恰好中和pH= 7 (2) 若多加半滴NaOH(体积为0.02mL)
溶液的pH= 9.7 (3)若少加半滴NaOH溶液的pH= 4.3
.
18
问题探究
讨论:滴定过程中溶液的pH变化 用0.100mol/LNaOH溶液滴定20.00mL0.100mol/L盐酸
加入 NaOH 0.00 (ml)
溶液 PH值 1.0
实际滴出的溶液体积=滴定后的读数-滴定前
的读数
.10滴定管Fra bibliotek量筒区别量取液体常用仪器:量筒、滴定管
❖量筒:粗量仪,10mL量筒最小分刻度为 0.1mL
读数精确到 0.1mL ,无“0”刻度
❖滴定管
▪标有温度、容积、“0”刻度在最高点
▪常用规格:25mL、50mL ▪最小分刻度:0.1mL ,读数精确到 0.01mL (精量仪可估读一位,粗量仪不能估读)
玻璃活塞
橡胶管 玻璃球
.
9
(1)酸式滴定用的是玻璃活塞,碱式滴定管 用的是橡皮管。(思考为什么?)
(2)滴定管的刻度从上往下标,下面一部分 没有读数,因此使用时不能放到刻度以下。
(3)酸式滴定管不能用来盛放碱溶液,碱式 滴定管不盛放酸溶液或会腐蚀橡胶的溶液 (如强氧化性的溶液)。
(4)滴定管的精确度为0.01mL,比量筒精 确;所以读数时要读到小数点后两位。
第二单元 溶液的酸碱性
3.2.2 酸碱中和滴定
.
1
.
2
思考:
今有500ml未知浓度的 NaOH溶液,你能想出多 少种测定其浓度的方法?
.
3
在一定量的碱中加入盐酸 会有什么样的定量关系?
.
4
一、酸碱中和滴定的原理
1、中和反应的实质:H++OH-=H2O 2、酸碱中和滴定
用已知物质的量浓度的酸(或碱)去滴定未知物质的 量浓度的碱(或酸),测定完全反应时消耗的酸(或碱) 来推算未知浓度的碱(或酸)的浓度的方法。
③润洗
④装液
⑤记录初读数
⑥取待测液
2.滴定阶段:
⑦加指示剂
⑧滴加标准液直至颜色发生明显 变化
⑨记录末读数
3.数据处理阶段:⑩计算待测液浓度
.
13
滴定操作:
把滴定管固定在滴定管夹上,锥形瓶放在下面接 液体,滴定过程中用左手控制活塞,用右手摇动 锥形瓶,眼睛应注视锥形瓶中溶液颜色的变化
滴定终点判断: 当滴入最后一滴溶液时颜色发生变 化且半分钟内颜色不再发生变化即已 达终点。
问:如果酸碱指示剂的颜色在此pH值突跃范围发生明显
的改变,误差很大吗? .
21
PH
12 10 8
7
6 4 2
0
中和滴定曲线
酚酞
颜色突变范围
10 20 30 40
.
V(NaOH)mL
22
PH
12 10 8
7
6 44.4 2
0
中和滴定曲线
甲基橙
颜色突变范围
10 20 30 40
.
V(NaOH)mL
23
3、酸碱中和滴定的原理
在滴定达到终点(即酸碱恰好反应)时:
n(H+)=n(OH-)
即:c (酸) V(酸) a = c (碱) V(碱) b
.
5
[课堂练习] 用0.1100mol/L的HCl溶 液滴定23.00mL未知浓度的NaOH溶液, 滴 定 完 成 时 , 用 去 HCl 溶 液 29.00mL 。 通 过 中 和 滴 定 测 得 NaOH 溶 液 的 物 质 的量浓度是多少?
.
14
酸碱中和反应过程演示
.
15
复习:
NaOH + HCl = NaCl + H2O
C标.V标= C待.V待 1.准备阶段: ①检查是否漏水
②水洗
③润洗
④装液
⑤记录初读数
⑥取待测液
2.滴定阶段:
⑦加指示剂
⑧滴加标准液直至颜色发生明显 变化
⑨记录末读数
3.数据处理阶段:⑩计算待测液浓度
.
16
滴定操作:
.
11
2、使用方法 检漏→ 洗涤→ 装液→ 调零 → 滴定
(二)锥形瓶
用于酸碱的中和反应,不得用待装液润洗, 但有水不影响结果。
△终点的判断(即指示剂的选择):
.
12
三、酸碱中和滴定的操作步骤
NaOH + HCl = NaCl + H2O
C标.V标= C待.V待 1.准备阶段: ①检查是否漏水
②水洗
数据处理 画出曲线 中和滴定曲线
pH
pH
pH
12
12
12
10
10
10
8 6
8
pH 8
6
值 突
6
4
4
变4
2
2
2
0
10
V 20 NaOH(mL) 0
10 . 20 VNaOH(mL) 0
10
V 20
Na2O0 H(mL)
曲线归一
PH
中和滴定曲线
12
10
8
突 变
6
反应终点
范
围
4
2
10
20
30
40 加入NaOH(ml)
