人教版高中化学选修5课件:3.1.1 醇优秀课件
合集下载
(新编)高中化学人教版选修5课件3.1.1醇

典例透析
IANLITOUXI
答案:C
点拨只有—OH在链的末端即含有—CH2OH时,才能被氧化成醛。 解答本题时可先将分子式改写成R—CH2OH的形式,R—有几种结 构,则氧化成的醛就有几种。
-22-
第1课时 醇
目标导航
Z Z D 知识梳理 HISHISHULI
重难聚焦
HONGNANJUJIAO
典例透析
+2H2O。
4.与氢溴酸反应
乙醇与浓氢溴酸混合加热发生取代反应时,断裂c键。化学方程
式为C2H5—OH+HBr
C2H5—Br+H2O。
特别提醒应用醇与金属钠的置换反应,可以测定醇分子中所含活
泼氢(或羟基)的数目,羟基数目与生成H2的对应关系是—
OH~
1 2
H2。
-18-
第1课时 醇
目标导航
Z Z D 知识梳理 HISHISHULI
-7-
第1课时 醇
目标导航
Z Z D 知识梳理 HISHISHULI
重难聚焦
HONGNANJUJIAO
典例透析
IANLITOUXI
一二
2.化学性质 醇的化学性质主要由羟基决定,氧原子吸引电子能力强于碳原子 和氢原子,所以碳氧键和氢氧键易断裂。以乙醇为例,可发生如下 反应:
-8-
第1课时 醇 一二
-13-
第1课时 醇 一二三
目标导航
Z Z D 知识梳理 HISHISHULI
重难聚焦
HONGNANJUJIAO
典例透析
IANLITOUXI
2.醇的催化氧化规律 醇分子中,—OH上的氢原子和与羟基相连的碳原子上的氢原子
结合外来的氧原子生成水,而醇本身形成了
人教版高中化学选修5课件:3.1.1醇3

OH CH3—CH2—CH—CH3
2-丁醇
CH2OH CHOH CH2OH
1,2,3-丙三醇 (或甘油、丙三醇)
醇的分类和命名
【即时巩固】
写出下列醇的名称。
OH ①3—CH—C—OH
CH2—CH3
2,3-二甲基-3-戊醇
醇的物理性质
【思考与交流】
断键位置 ① ①③ ②④ ①② ②
1.判断下列物质中不属于醇类的是
A.C2H5OH
OH
√B.
CH2OH C.
D. CH2—OH CH2—OH
2.下列各醇,能产生催化氧化生成醛的是
CH3 CH3—C—CH2OH
√A. CH3
CH3 ∣
B.CH3—C—OH ∣
CH3
C.CH3—CH—CH3 ∣
OH
CH3 ∣
乙醇的化学性质
探究实验 乙烯的制取
【实验】按如图装置制取乙烯,随反 应的进行液体逐渐变黑,为什么?导 气管通入NaOH溶液中,作用是什么?
【结交论:流浓与硫讨酸论具】有强氧化性、脱水性。 在应碳得它加生的是到热成单如的的碳质何黑条的使形色件单烧下质瓶成物,、内的质浓的C?是O硫液2①、什酸体浓友S么O和带硫2谊等?无上酸提多水了具种醒酒黑有物:精色强质反。氧,
无机物和有机物
乙醇的化学性质
由乙醇的结构,分析乙醇具有哪些化学性质? 根据水与钠反应的方程式,试写出乙醇跟金属钠 反应的化学方程式。 2H-O-H+2Na====2NaOH+H2↑ 2CH3CH2OH+2Na→2CH3CH2ONa+H2↑
比较乙醇与水中羟基上的H的活泼性强弱。
CH3CH2 O H
HOH
在科学上进步而道义上落后的人,不是前 进,而是后退。
人教版高中化学选修五课件3.1.1乙醇的组成、结构和性质(共74张PPT).pptx

答案 一、—OH C2H6O CH3—CH2—OH 二、1.无 特殊香味 液 小 酒精 任意比例 2.(1)2CH3CH2ONa+H2↑ C2H5Br+H2O CH3CH2—O—CH2CH3+H2O (2)2CO2+3H2O 2CH3CHO+2H2O (3)CH2===CH2↑+H2O 3.75% 4. 96% 99.5% 新制生石灰 蒸馏
(1)产生上述问题的主要原因是____________________ ______________________________。
(2)乙醇和浓硫酸在不同体积比的情况下乙烯产量的探 究:
由此可知,在相同实验条件下___________________ _______________________________。
2.了解逆合成分析法,通过简单化合物的逆合成分 析,巩固烃、卤代烃、烃的含氧衍生物的性质和转化关 系,并认识到有机合成在人类生活和社会进步中的重大意 义。
3.能结合生产、生活实际了解烃的含氧衍生物对环 境和健康可能产生的影响,讨论烃的含氧衍生物的安全使 用,关注烃的含氧衍生物对环境和健康的影响。
4.进一步学习科学探究的基本方法,初步学会运用 观察、实验、查阅资料等多种手段获取信息及加工信息的 能力。
1.乙醇的性质由乙醇的结构决定,从中理解事物 的因果关系。 情感、态度与价 2.通过乙醇在不同条件下脱水方式的差异性学 值观 习,加深外界条件对化学反应的影响的认识,培 养具体问题具体分析的思想观念。
自主学习
一、乙醇的组成和结构 乙醇是极性分子,官能团是________,分子式为 ________,结构简式__________________,分子中含有2 种类型的氢原子。
二、乙醇的性质和用途 1.物理性质 乙醇是________色、有________的________体,密度 比水________,俗称________,易挥发,能够溶解多种无 机物和有机物,能跟水以________互溶。
高中化学人教选修五课件:3.1 第1课时 醇

【答案】不是;能发生催化氧化的醇必须满足连接羟基的碳原子 上一定含有氢原子。
3.乙醇与浓硫酸的混合物在 170 ℃和 140 ℃两种条件下的反应类 型相同吗?
【答案】不同。前者为消去反应,后者为取代反应。
分子式为 C7H16O 的饱和一元醇的同分异构体有多种,下列为该醇 的几种同分异构体。
A.
烷
微思考 2 能否用甲醇或乙醇萃取溴水中的溴?为什么?
【答案】 不能;甲醇或乙醇等低级醇可以与水以任意比互溶,故不 能从溴水中萃取溴。
三、醇的化学性质 醇的化学性质主要由官能团羟基决定,由于氧原子吸引电子能力 比氢原子和碳原子强,O—H 键和 C—O 键的电子对偏向于氧原子,使 O —H 键和 C—O 键易断裂。
活动探究 1 醇的反应规律 1.所有的醇都能发生消去反应吗?
【答案】不是;从乙醇消去反应原理可知,在形成碳碳双键时,断 裂 C—O 键和羟基邻位碳上的 C—H 键。 故醇发生消去反应时必须满足 如下条件:(1)醇分子中至少有两个碳原子;(2)羟基的邻位碳原子上 必须有氢原子。
2.所有的醇都能发生催化氧化反应吗?
B. D.CH3CH2OH
【解析】含有苯环的化合物是芳香化合物,羟基与苯环上的碳原 子直接相连的有机物属于酚。A、D 两项属于醇,但不属于芳香化合 物;C 项属于酚。 【答案】B
2.在乙醇发生的下列反应中,乙醇分子中碳氧键断裂的是( A.乙醇在浓硫酸存在的情况下与乙酸发生酯化反应 B.乙醇与金属钠反应 C.乙醇与氢溴酸的取代反应 D.乙醇的催化氧化反应
①羟基(—OH) ②CH3CH2OH ③甘油 ④羟基 ⑤羟基 ⑥高于 ⑦升高 ⑧高 ⑨以任意比互溶 ⑩氢键 2CH3CH2OH+2Na 2CH3CH2ONa+H2↑ CH3CH2OH CH3CH2OH+HBr +H2O CH3CH2Br+H2O
高二化学人教版选修5课件:3.1.1 醇

重点难点探究
重要考向探究
随堂检测
例如:①
命名为 3-甲基-2-戊醇;
②
命名为 3,4-二甲基-2-戊醇。
重点难点探究
重要考向探究
随堂检测
二、醇的性质 1.物理性质
重点难点探究
重要考向探究
随堂检测
2.化学性质
重点难点探究
重要考向探究
随堂检测
考向一 醇的消去反应和取代反应 【例题1】 将浓硫酸和分子式为C4H10O的醇共热,所得到的有机 产物有( ) A.14种 B.13种 C.8种 D.7种
重点难点探究
重要考向探究
随堂检测
知识点拨 一、醇的定义、分类、命名 1.醇的结构特点 定义:羟基与烃基或苯环侧链上的碳原子相连的化合物 官能团:烃基
结构:
(R1、R2、R3 为 H 或烃基)
饱和一元醇通式:CnH2n+1OH或CnH2n+2O
重点难点探究
重要考向探究
随堂检测
2.分类
3.命名 选主链:选择含有与羟基相连的碳原子的最长碳链作为主链,根 据碳原子数目称为某醇。 编碳号:从距离羟基最近的一端给主链上的碳原子依次编号定位。 标位置:醇的名称前面要用阿拉伯数字表示羟基的位置;羟基的 个数用二、三……标出。
第三章烃的含氧衍生物
第一节 醇 酚
第1课时 醇
学
习 目 标
核
心 素 养 脉 络
1.了解醇的典型代 表物的组成、结构 特点及物理性质 2.以乙醇为例掌握 醇的主要化学性质 3.了解实验室制取 乙烯的注意事项
阅读思考
自主检测
任务一、阅读教材第48页到第49页,思考回答下列问题,自主学 习“醇”。 1.写出乙醇、2-丙醇、苯甲醇、苯酚、邻甲基苯酚的结构简式, 并综合分析,思考醇和酚在结构上有何不同?
高中化学 3.1.1 醇课件 新人教版选修5

高中化学·选修(xuǎnxiū)5·人教版
第三章 烃的含氧衍生物 第一节目标导航] 1.掌握乙醇的结构和性质。2.了解醇类的官能团、 结构特点、一般(yībān)通性和几种典型醇的用途。3.掌握实 验室由乙醇制乙烯的反应原理和实验方法。
第二页,共37页。
2.醇类断裂(duàn liè)C—O键,脱掉—OH时,可发生取代或 消去反应;若同时断裂(duàn liè)C—O键和H—C键时可发生 消去,若同时断裂(duàn liè)O—H键和C—H键则发生氧化反 应,要注意分析体会。
第三十五页,共37页。
变式训练2 二甘醇可用作溶剂、纺织助剂等,一旦进入人体 会导致急性肾衰竭,危及生命。二甘醇的结构(jiégòu)简式 是HO—CH2CH2—O—CH2CH2—OH。下列有关二甘醇的 叙述正确的是
第二十页,共37页。
变式训练1 下列有关实验的叙述,正确的是 ()
A.分馏石油时,温度计的末端必须插入液面下 B.用分液漏斗分离环己烷和水的混合液体(yètǐ) C.用NaOH溶液除去乙酸乙酯中混有的乙酸、乙醇,然后 分液 D.实验室制得的乙烯不含有能使澄清石灰水变浑浊的气体
第二十一页,共37页。
+H2O
第二十九页,共37页。
规律(guīlǜ)小结
第三十页,共37页。
【例2】 乙醇分子中各种化学键如图 所示,关于乙醇在各种反应中断裂(duàn liè) 键的说法不正确的是
() A.和金属钠反应时键①断裂(duàn liè) B.和浓H2SO4共热到170 ℃时键②和⑤断裂(duàn liè) C.和浓H2SO4共热到140 ℃时仅有键②断裂(duàn liè) D.在Ag催化下与O2反应时键①和③断裂(duàn liè)
二、醇的物理性质
第三章 烃的含氧衍生物 第一节目标导航] 1.掌握乙醇的结构和性质。2.了解醇类的官能团、 结构特点、一般(yībān)通性和几种典型醇的用途。3.掌握实 验室由乙醇制乙烯的反应原理和实验方法。
第二页,共37页。
2.醇类断裂(duàn liè)C—O键,脱掉—OH时,可发生取代或 消去反应;若同时断裂(duàn liè)C—O键和H—C键时可发生 消去,若同时断裂(duàn liè)O—H键和C—H键则发生氧化反 应,要注意分析体会。
第三十五页,共37页。
变式训练2 二甘醇可用作溶剂、纺织助剂等,一旦进入人体 会导致急性肾衰竭,危及生命。二甘醇的结构(jiégòu)简式 是HO—CH2CH2—O—CH2CH2—OH。下列有关二甘醇的 叙述正确的是
第二十页,共37页。
变式训练1 下列有关实验的叙述,正确的是 ()
A.分馏石油时,温度计的末端必须插入液面下 B.用分液漏斗分离环己烷和水的混合液体(yètǐ) C.用NaOH溶液除去乙酸乙酯中混有的乙酸、乙醇,然后 分液 D.实验室制得的乙烯不含有能使澄清石灰水变浑浊的气体
第二十一页,共37页。
+H2O
第二十九页,共37页。
规律(guīlǜ)小结
第三十页,共37页。
【例2】 乙醇分子中各种化学键如图 所示,关于乙醇在各种反应中断裂(duàn liè) 键的说法不正确的是
() A.和金属钠反应时键①断裂(duàn liè) B.和浓H2SO4共热到170 ℃时键②和⑤断裂(duàn liè) C.和浓H2SO4共热到140 ℃时仅有键②断裂(duàn liè) D.在Ag催化下与O2反应时键①和③断裂(duàn liè)
二、醇的物理性质
高中化学专题3.1.1醇课件新人教版选修5

2.醇的物理性质及其递变规律 (1)沸点 ①相对分子质量相近的醇和烷烃相比,醇的沸点远远高于烷烃。 其原因是醇分子之间形成了________。 ②饱和一元醇随分子中碳原子个数的增加,醇的沸点 ________。 ③碳原子数目相同时,羟基的个数越多,醇的沸点________。 (2)溶解性 甲醇、乙醇、丙醇、乙二醇、丙三醇等低级醇可与水以任意比 例互溶。这是因为这些醇与水形成了________。
提示:“-OH”称为“羟基”,是决定醇的化学特性的 官能团, 不能单独稳定存在, 是有机物分子中的结构“片断”,
· 呈电中性,其电子式是·O ×H,含一个未成对电子,故其具有
极高的化学活性。羟基与链烃基相连的物质称作醇。
· - “OH ”读作“氢氧根离子”,其电子式是[∶O ×H] ,它
。
(4)与氢溴酸反应 乙醇与浓氢溴酸混合加热发生取代反应时,断裂 c 键。化 △ 学方程式为:C2H5-OH+HBr――→C2H5-Br+H2O。
提示:应用醇与金属钠的臵换反应,可以测定醇分子中所 含活泼氢(或羟基)的数目,羟基数目与生成 H2 的对应关系是: 1 -OH~ H2。 2
2.醇类的有关反应规律 (1)醇的消去反应规律 ①醇分子中,连有-OH的碳原子的相邻碳原子上必 须连有氢原子时,才能发生消去反应而形成不饱和 键。
●新知导学 1.醇的定义、分类、命名 (苯环侧链 上的碳原子相连的化合 醇是羟基与_______
物,其官能团是羟基(-OH)。 (2)分类
CH3CH2OH
②根据羟基所连烃基的种类
(3)命名
羟基
羟基
例如:
3-甲基-2-戊醇 命名为___________________。
②若醇分子中与-OH相连的碳原子无相邻碳原子或 其相邻碳原子上无氢原子,则不能发生消去反应。 如CH3OH、(CH3)3CCH2OH不能发生消去反应生成 烯烃。
人教版高中化学选修五课件:3-1-1醇

解析 (1)因该醇发生消去反应时,生成两种单烯烃,这表明连有 —OH 的碳原子的相邻碳原子上应连有氢原子,且以—OH 所连碳为中心,分子不 对称。 (2)~(4)连有—OH 的碳上有 2 个氢原子时可被氧化为醛,有 1 个氢原子 时可被氧化为酮,不含氢原子时不能发生催化氧化。 (5)连有—OH 的碳上有氢原子时,可被酸性 KMnO4 溶液氧化为羧酸或 酮,它们都会使酸性 KMnO4 溶液褪色。
2.分子式为 C7H16O 的饱和一元醇的同分异构体有多种,在下列该醇的 同分异构体中,
D.CH3(CH2)5CH2OH
(1)可以发生消去反应,生成两种单烯烃的是________ ; C
D ; (2)可以发生催化氧化生成醛的是________ B ; (3)不能发生催化氧化的是________
(4)能被催化氧化为酮的有________ 2 种; (5)能使酸性 KMnO4 溶液褪色的有________ 种。 3
)
A.
D.CH3CH2OH 和 CH3CH2CH2OH
知识点二 醇的性质 1.物理性质 (1)沸点 ①相对分子质量相近的醇和烷烃相比:醇 高于 烷烃,如沸点: CH3CH2OH > CH3CH2CH3; ②饱和一元醇中碳原子数越多,沸点 越高 ; ③醇分子中羟基数越多,沸点 越高 。
(2)溶解性 甲醇、乙醇、丙醇、乙二醇、丙三醇等低级醇可与水以 任意比例 互溶。 这是因为这些醇与水形成了 氢键 。 2.化学性质 醇的化学性质主要由官能团 羟基 决定,由于氧原子吸引电子能力比 氢原子和碳原子强,O—H 键和 C—O 键的电子对偏向于氧原子,使 O—H 键和 C—O 键易断裂。
3.醇的取代反应规律 醇分子中,—OH 或—OH 上的 H 原子在一定条件下可被其他原子或原 子团替代。如
人教版高中化学选修五课件3-1-(1)醇.pptx

知识聚焦 难点突破
难点突破
第三章 烃的含氧衍生物
2.醇类断裂C—O键,脱掉—OH时,可发生取代或消去反 应;若同时断裂C—O键和H—C键时可发生消去,若同时断 裂O—H键和C—H键则发生氧化反应,要注意分析体会。
知识聚焦 难点突破
难点突破
第三章 烃的含氧衍生物
变式训练2 二甘醇可用作溶剂、纺织助剂等,一旦进入人体 会导致急性肾衰竭,危及生命。二甘醇的结构简式是HO— CH2CH2—O—CH2CH2—OH。下列有关二甘醇的叙述正确的 是
知识聚焦 难点突破
难点突破
第三章 烃的含氧衍生物
二、醇类的有关反应规律 1.醇的消去反应规律 (1)醇分子中,连有—OH的碳原子的相邻碳原子上必须连有
氢原子时,才能发生消去反应而形成不饱和键。
知识聚焦 难点突破
难点突破
第三章 烃的含氧衍生物
(2)若醇分子中与—OH相连的碳原子无相邻碳原子或其相邻 碳原子上无氢原子,则不能发生消去反应。如CH3OH、 (CH3)3CCH2OH不能发生消去反应生成烯烃。
2.加热混合液时,温度要迅速上升到并稳定于170℃左右, 因为在140℃时主要产物是乙醚。
知识聚焦 难点突破
难点突破
第三章 烃的含氧衍生物
3.由于反应物都是液体而无固体,所以要向烧瓶中加入碎 瓷片,以防液体受热时发生暴沸。
4.温度计的水银球要置于反应液的中央位置,因为需要测 量的是反应液的温度。
知识聚焦 难点突破
知识聚焦 难点突破
难点突破
第三章 烃的含氧衍生物
一、进行乙醇的消去反应实验时的注意事项
知识聚焦 难点突破
难点突破
第三章 烃的含氧衍生物
1.配制体积比为1∶3的乙醇与浓硫酸混合液时,要注意在 烧杯中先加入95%乙醇,然后滴加浓硫酸,边滴加边搅 拌,冷却备用(相当于浓硫酸的稀释),浓硫酸起催化剂和 脱水剂的作用。
3.1《醇》课件(人教版选修5)

反应 与金属钠反应 典型的反应方程式
2CH3CH2OH+2Na →2CH3CH2ONa+H2↑ 2CH3CH2OH+O2 CH3CH2OH 应
2CH3CHO+2H2O
浓H2SO4 170℃
CH2= CH2↑+H2O
CH3CH2OH+HBr
CH3CH2Br+H2O
动手练!
(4)取代反应 ①分子间脱水
CH3CH2-OH + HO-CH2CH3
浓H2SO4
140℃
②酯化反应
CH3CH2OH+CH3COOH
CH3CH2-O-CH2CH3 +H2O
浓H2SO4
Δ
CH3CH2OOCCH3+H2O
③与浓氢溴酸的反应
CH3CH2-OH+H-Br
CH3CH2-Br+H2O
醇的化学性质:
(1)与金属钠反应
2CH3CH2CH2OH+2Na →2CH3CH2CH2ONa+H2↑
H H H H H H
CH3―C―C―O―H
Na
CH3―C―C―ONa
H
H
1 醇的化学性质
(2)氧化反应
2CH3CH2OH+O2
H H H H H
Cu Δ
2CH3CHO+2H2O
H H H
H―C―C―O
H―C―C―O
1、交通警察检查驾驶员是否酒后驾车,利用
的反应原理属于:
A、取代反应
C
B、消去反应
C、氧化反应
D、酯化反应
动手练!
2、请写出CH3CH2CH2OH在浓硫酸催化下加热
的化学反应方程式。
课后练习!
请你尝试 1. 写出 2. 写出
2CH3CH2OH+2Na →2CH3CH2ONa+H2↑ 2CH3CH2OH+O2 CH3CH2OH 应
2CH3CHO+2H2O
浓H2SO4 170℃
CH2= CH2↑+H2O
CH3CH2OH+HBr
CH3CH2Br+H2O
动手练!
(4)取代反应 ①分子间脱水
CH3CH2-OH + HO-CH2CH3
浓H2SO4
140℃
②酯化反应
CH3CH2OH+CH3COOH
CH3CH2-O-CH2CH3 +H2O
浓H2SO4
Δ
CH3CH2OOCCH3+H2O
③与浓氢溴酸的反应
CH3CH2-OH+H-Br
CH3CH2-Br+H2O
醇的化学性质:
(1)与金属钠反应
2CH3CH2CH2OH+2Na →2CH3CH2CH2ONa+H2↑
H H H H H H
CH3―C―C―O―H
Na
CH3―C―C―ONa
H
H
1 醇的化学性质
(2)氧化反应
2CH3CH2OH+O2
H H H H H
Cu Δ
2CH3CHO+2H2O
H H H
H―C―C―O
H―C―C―O
1、交通警察检查驾驶员是否酒后驾车,利用
的反应原理属于:
A、取代反应
C
B、消去反应
C、氧化反应
D、酯化反应
动手练!
2、请写出CH3CH2CH2OH在浓硫酸催化下加热
的化学反应方程式。
课后练习!
请你尝试 1. 写出 2. 写出
人教版选修5 3.1 .1醇(共53张PPT)
人 教 版 选 修 5 3.1 .1醇(共 53张PPT)
人 教 版 选 修 5 3.1 .1醇(共 53张PPT)
(2)同一个碳原子上不能连接两个以上的 羟基。
否则:发生分子内自动脱水,生成醛基。
如:二氯甲烷在氢氧化钠水溶液中发生反
应:
注意:
卤代烃
和醇在
同分异
构体上
的区别。
人 教 版 选 修 5 3.1 .1醇(共 53张PPT)
方法:取一定质量的乙醇与足量的金属钠 反应,测量生成的气体的体积。 方程式:
2CH3CH2OH+2Na 2CH3CH2ONa+H2↑ 断键位置和接键形势 乙醇中羟基(—OH)中O—H键断裂,生 成乙醇钠和氢气。
反应类型 置换反应 还原反应 有时也说成取代反应
比较钠与水的反应:
分析乙醇与水分别与金属钠反应现象不 同的原因:
人 教 版 选 修 5 3.1 .1醇(共 53张PPT)
醇(第三课时) 一、化学性质 1、羟基部分 (一)、与钠的反应, 通式:2R—OH+2Na 2R—ONa+H2↑ 写出乙二醇和甘油分别与足量金属钠反应 的化学方程式:
人 教 版 选 修 5 3.1 .1醇(共 53张PPT)
人 教 版 选 修 5 3.1 .1醇(共 53张PPT)
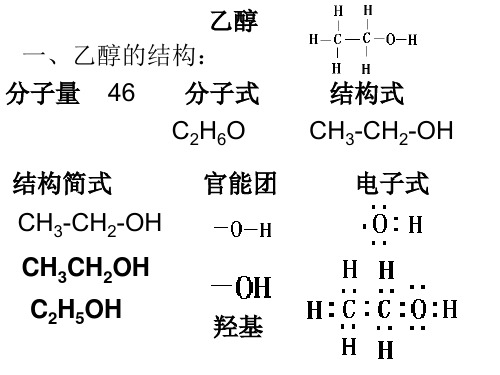
乙醇 一、乙醇的结构: 分子量 46 分子式
C2H6O
结构简式
官能团
CH3-CH2-OH
CH3CH2OH C2H5OH
羟基
结构式 CH3-CH2-OH
电子式
二、物理性质:
不用于鉴别
俗名 酒精 无色透明的液体,有特殊的香味,
比水轻,与水互溶, 沸点780C,易挥发。 乙醇在加热条件下发生反应常冷凝回流。
人 教 版 选 修 5 3.1 .1醇(共 53张PPT)
(2)同一个碳原子上不能连接两个以上的 羟基。
否则:发生分子内自动脱水,生成醛基。
如:二氯甲烷在氢氧化钠水溶液中发生反
应:
注意:
卤代烃
和醇在
同分异
构体上
的区别。
人 教 版 选 修 5 3.1 .1醇(共 53张PPT)
方法:取一定质量的乙醇与足量的金属钠 反应,测量生成的气体的体积。 方程式:
2CH3CH2OH+2Na 2CH3CH2ONa+H2↑ 断键位置和接键形势 乙醇中羟基(—OH)中O—H键断裂,生 成乙醇钠和氢气。
反应类型 置换反应 还原反应 有时也说成取代反应
比较钠与水的反应:
分析乙醇与水分别与金属钠反应现象不 同的原因:
人 教 版 选 修 5 3.1 .1醇(共 53张PPT)
醇(第三课时) 一、化学性质 1、羟基部分 (一)、与钠的反应, 通式:2R—OH+2Na 2R—ONa+H2↑ 写出乙二醇和甘油分别与足量金属钠反应 的化学方程式:
人 教 版 选 修 5 3.1 .1醇(共 53张PPT)
人 教 版 选 修 5 3.1 .1醇(共 53张PPT)
乙醇 一、乙醇的结构: 分子量 46 分子式
C2H6O
结构简式
官能团
CH3-CH2-OH
CH3CH2OH C2H5OH
羟基
结构式 CH3-CH2-OH
电子式
二、物理性质:
不用于鉴别
俗名 酒精 无色透明的液体,有特殊的香味,
比水轻,与水互溶, 沸点780C,易挥发。 乙醇在加热条件下发生反应常冷凝回流。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
醇分子间形成氢键
醇
交流讨论第 9 页
阅读表中数据,你能做出解释吗?
名称
乙醇 乙二醇 1-丙醇
分子中羟 基数目
1 2 1
1,2-丙二醇
2
1,2,3-丙三醇
3
沸点/℃ 78.5 197.3 97.2 188
259
沸点:乙二醇>乙醇; 1,2,3—丙三醇>1,2—丙二醇 >1—丙醇。 原因是:由于羟基数目增多,使得分 子间形成的氢键增多增强。
名称
甲醇 乙烷 乙醇 丙烷 丙醇 丁烷
结构简式
CH3OH C2H6 C2H5OH C3H8 C3H7OH C3H8
相对分子 质量
32 30 46 44 60 58
沸点/℃
64.7 -88.6 78.5 -42.1 97.2 -0.5
交流讨论第 8 页
结论:相对分子质量相近的醇和烷 烃相比,醇的沸点远远高于烷烃。
化学 ·选修5《有机化学基础》
醇、酚
醇
教学目第标2 页
❖掌握乙醇的结构和性质 ❖了解醇类的官能团、结构特点、一般通性和几种
典型醇的用途 ❖掌握实验室由乙醇制乙烯的反应原理和实验方法
醇
你了解乙醇吗?什么是醇?
你知道第吗3 页?
醇
温故知第新4 页
一、醇的结构与分类
1.醇的结构特点 烃分子中饱和碳原子上的氢原子被羟基取代形成的化合物。
CH3CH2OCH2CH3 + H2O
科学视第野13 页
醇
总结感第悟14 页
3.取代反应 C2H5OH + HBr △ C2H5Br + H2O
4.氧化反应 有机物分子中加入氧原子或失去氢原子的反应
2CH3CH2OH+O2
催化剂
△
2CH3CHO+2H2O
CH3CH2OH 氧化 CH3CHO 氧化 CH3COOH
浓硫酸
化学方程式为____C_H_3_C_H__2_C_H_2_O__H__1_7_0℃___C__H_3_C_H__=_C_H__2↑_+__H__2O_________。
A在铜作催化剂时,与氧气共热可以生成C,该氧化反应的化学方程式
Cu
为____2_C__H_3_C_H__2C__H_2_O__H_+__O_2___△_____2_C_H__3C__H_2_C_H__O_+__2_H__2O______________。
CHOH
CH2OH 1,2,3—丙三醇 (或甘油、丙三醇)
醇
科学视野第 7 页
饱和一元醇通式:CnH2n+1OH或CnH2n+2O 乙二醇和丙三醇都是无色、黏稠、有甜味的液 体,都易溶于水和乙醇,是重要的化工原料。
乙二醇
乙二醇可用于汽车作防冻剂,丙三醇可 用于配制化妆品。
丙三醇
醇
对比表中数据,你能得出什么结论?
乙醇
乙醛
乙酸
醇
反应
断键位置
与金属反应
①
催化氧化
①③
消去反应
②④
分子间脱水 与HX反应
①② ②
本课小第结15 页
⑤
H H② ①
H—C—C—O—H ③
④H H
醇
当堂巩第固16 页
1、乙醇分子中各种化学键如图所示,关于乙醇在各种反应中断裂键 的说法不正确的是( C )
A.和金属钠反应时键①断裂 B.和浓H2SO4共热到170 ℃时键②和⑤断裂 C.和浓H2SO4共热到140 ℃时仅有键②断裂 D.在Ag催化下与O2反应时键①和③断裂
CH3CH2OH
浓硫酸 170℃
CH2=CH2↑ + H2O
浓硫酸的作用:催化剂、脱水剂
反应原理:
—C—C— -H2O
—C—C—
H OH 相邻两个碳原子脱去H2O,形成双键。
对醇结构要求: 需有β—H(邻碳有氢)
—OH
浓硫酸
△
+ H2O
总结感第悟12 页
醇
乙醇的分子间脱水成醚
2CH3CH2OH
浓硫酸 140℃
3 、成功就像一座平衡的秤,一边是努力,一边是快乐;付出的多,收获的也多。 11 、一个能从别人的观念来看事情,能了解别人心灵活动的人,永远不必为自己的前途担心。一个人最大的破产是绝望,最大的资产是希望 。不要等待机会,而要创造机会。
7 、有时不合逻辑的举动却恰恰有助于应付变化多端的事态,而正常的逻辑有时却只能将自己带进一个死胡同。这就需要我们有逆反思维。 7 、面对人生的磨难,请用你的毅力创造生命的奇迹吧! 20 、想停下来深情地沉湎一番,怎奈行驶的船却没有铁锚;想回过头去重温旧梦,怎奈身后早已没有了归途。因为时间的钟摆一刻也不曾停顿 过,所以生命便赋予我们将在汹涌的大潮之中不停地颠簸。
16 、如果青春是醺人欲醉的海风,那么自信就是这和风前行的路标;如果青春是巍峨入云的高耸,那么拼搏就是这山脉层层拔高的动力;如果青 春是高歌奋进的谱曲,那么坚强就是这旋律奏响的最强音! 13 、如果有天我们湮没在人潮中,庸碌一生,那是因为我们没有努力要活的丰盛。 4 、成功离你很近,只要再多一点点坚持,你就会尝到胜利的果实。 8 、如果你的个性让很多人对你敬而远之,那么你的个性是失败的,个性的成功在于能吸引,而不是能排斥。 4 、只有一条路不能选择——那就是放弃的路;只有一条路不能拒绝——那就是成长的路。 10 、要想壮志凌云,就须脚踏实地。 3 、成功就像一座平衡的秤,一边是努力,一边是快乐;付出的多,收获的也多。 6 、遇难心不慌,遇易心更细。 4 、成功离你很近,只要再多一点点坚持,你就会尝到胜利的果实。 9 、随时保持自信,认识自己的价值,做一个能真正坚定自己的珍宝商。 7 、有时不合逻辑的举动却恰恰有助于应付变化多端的事态,而正常的逻辑有时却只能将自己带进一个死胡同。这就需要我们有逆反思维。 2 、在人生中只有曲线前进的快乐,没有直线上升的成功。只有珍惜今天,才会有美好的明天;只有把握住今天,才会有更辉煌的明天! 14 、人生就是生活的过程。哪能没有风、没有雨?正是因为有了风雨的洗礼才能看见斑斓的彩虹;有了失败的痛苦才会尝到成功的喜悦。
醇
当堂巩第固17 页
2、分子式为C3H8O的液态有机物A 1 mol,与足量的金属钠反应,可 以生成11.2 L H2(标准状况),则A分子中必含有一个__羟__基____(填官能
团的名称)。若该官能团位于碳链的一端,则A的结构简式为
__C_H__3C__H_2_C_H__2O__H______,A与浓硫酸共热170 ℃以上,发生消去反应的
醇
二、醇的性质
1.与金属钠的反应 可测定分子中羟基个数
2Na + 2ROH
2RONa 醇钠
+
H2↑
断键处 钠置换的是羟基氢
CH2OH + 2Na CH2OH
CH2ONa CH2ONa
+ H2↑
温故知第新10 页
醇
乙醇的消去反应与溴乙烷的消去反应有区别吗?
视频导第学11 页
醇
2.消去反应(分子内脱水)
吸 湿 性 , 护 肤
醇
科学史第话6 页
醇的命名 (1)选主链 选最长碳链,且含-OH (2)编号 从离-OH最近的一端起编
(3)写名称 取代基位置— 取代基名称 — 羟基位置— 母体名称(羟基位 置用阿拉伯数字表示;羟基个数用“二”、“三”等表示)
CH2OH CH2OH
乙二醇
CH2OH 苯甲醇
CH2OH
官能团:—OH(醇羟基)
羟基具有亲水性,低级醇都可溶于水。
2.醇的分类 按烃基种类分类
脂肪醇 CH3OH
芳香醇 —CH2OH
甲醇
苯甲醇
醇
根据醇分子中羟基的3OH 甲醇
(木精、木醇) 剧毒
用于能源领域
CH2CH2
OH OH
乙二醇
汽 车 用 抗 冻 剂
第5 页
三元醇
CH2CH CH2 OH OHOH 丙三醇(甘油)
醇
交流讨论第 9 页
阅读表中数据,你能做出解释吗?
名称
乙醇 乙二醇 1-丙醇
分子中羟 基数目
1 2 1
1,2-丙二醇
2
1,2,3-丙三醇
3
沸点/℃ 78.5 197.3 97.2 188
259
沸点:乙二醇>乙醇; 1,2,3—丙三醇>1,2—丙二醇 >1—丙醇。 原因是:由于羟基数目增多,使得分 子间形成的氢键增多增强。
名称
甲醇 乙烷 乙醇 丙烷 丙醇 丁烷
结构简式
CH3OH C2H6 C2H5OH C3H8 C3H7OH C3H8
相对分子 质量
32 30 46 44 60 58
沸点/℃
64.7 -88.6 78.5 -42.1 97.2 -0.5
交流讨论第 8 页
结论:相对分子质量相近的醇和烷 烃相比,醇的沸点远远高于烷烃。
化学 ·选修5《有机化学基础》
醇、酚
醇
教学目第标2 页
❖掌握乙醇的结构和性质 ❖了解醇类的官能团、结构特点、一般通性和几种
典型醇的用途 ❖掌握实验室由乙醇制乙烯的反应原理和实验方法
醇
你了解乙醇吗?什么是醇?
你知道第吗3 页?
醇
温故知第新4 页
一、醇的结构与分类
1.醇的结构特点 烃分子中饱和碳原子上的氢原子被羟基取代形成的化合物。
CH3CH2OCH2CH3 + H2O
科学视第野13 页
醇
总结感第悟14 页
3.取代反应 C2H5OH + HBr △ C2H5Br + H2O
4.氧化反应 有机物分子中加入氧原子或失去氢原子的反应
2CH3CH2OH+O2
催化剂
△
2CH3CHO+2H2O
CH3CH2OH 氧化 CH3CHO 氧化 CH3COOH
浓硫酸
化学方程式为____C_H_3_C_H__2_C_H_2_O__H__1_7_0℃___C__H_3_C_H__=_C_H__2↑_+__H__2O_________。
A在铜作催化剂时,与氧气共热可以生成C,该氧化反应的化学方程式
Cu
为____2_C__H_3_C_H__2C__H_2_O__H_+__O_2___△_____2_C_H__3C__H_2_C_H__O_+__2_H__2O______________。
CHOH
CH2OH 1,2,3—丙三醇 (或甘油、丙三醇)
醇
科学视野第 7 页
饱和一元醇通式:CnH2n+1OH或CnH2n+2O 乙二醇和丙三醇都是无色、黏稠、有甜味的液 体,都易溶于水和乙醇,是重要的化工原料。
乙二醇
乙二醇可用于汽车作防冻剂,丙三醇可 用于配制化妆品。
丙三醇
醇
对比表中数据,你能得出什么结论?
乙醇
乙醛
乙酸
醇
反应
断键位置
与金属反应
①
催化氧化
①③
消去反应
②④
分子间脱水 与HX反应
①② ②
本课小第结15 页
⑤
H H② ①
H—C—C—O—H ③
④H H
醇
当堂巩第固16 页
1、乙醇分子中各种化学键如图所示,关于乙醇在各种反应中断裂键 的说法不正确的是( C )
A.和金属钠反应时键①断裂 B.和浓H2SO4共热到170 ℃时键②和⑤断裂 C.和浓H2SO4共热到140 ℃时仅有键②断裂 D.在Ag催化下与O2反应时键①和③断裂
CH3CH2OH
浓硫酸 170℃
CH2=CH2↑ + H2O
浓硫酸的作用:催化剂、脱水剂
反应原理:
—C—C— -H2O
—C—C—
H OH 相邻两个碳原子脱去H2O,形成双键。
对醇结构要求: 需有β—H(邻碳有氢)
—OH
浓硫酸
△
+ H2O
总结感第悟12 页
醇
乙醇的分子间脱水成醚
2CH3CH2OH
浓硫酸 140℃
3 、成功就像一座平衡的秤,一边是努力,一边是快乐;付出的多,收获的也多。 11 、一个能从别人的观念来看事情,能了解别人心灵活动的人,永远不必为自己的前途担心。一个人最大的破产是绝望,最大的资产是希望 。不要等待机会,而要创造机会。
7 、有时不合逻辑的举动却恰恰有助于应付变化多端的事态,而正常的逻辑有时却只能将自己带进一个死胡同。这就需要我们有逆反思维。 7 、面对人生的磨难,请用你的毅力创造生命的奇迹吧! 20 、想停下来深情地沉湎一番,怎奈行驶的船却没有铁锚;想回过头去重温旧梦,怎奈身后早已没有了归途。因为时间的钟摆一刻也不曾停顿 过,所以生命便赋予我们将在汹涌的大潮之中不停地颠簸。
16 、如果青春是醺人欲醉的海风,那么自信就是这和风前行的路标;如果青春是巍峨入云的高耸,那么拼搏就是这山脉层层拔高的动力;如果青 春是高歌奋进的谱曲,那么坚强就是这旋律奏响的最强音! 13 、如果有天我们湮没在人潮中,庸碌一生,那是因为我们没有努力要活的丰盛。 4 、成功离你很近,只要再多一点点坚持,你就会尝到胜利的果实。 8 、如果你的个性让很多人对你敬而远之,那么你的个性是失败的,个性的成功在于能吸引,而不是能排斥。 4 、只有一条路不能选择——那就是放弃的路;只有一条路不能拒绝——那就是成长的路。 10 、要想壮志凌云,就须脚踏实地。 3 、成功就像一座平衡的秤,一边是努力,一边是快乐;付出的多,收获的也多。 6 、遇难心不慌,遇易心更细。 4 、成功离你很近,只要再多一点点坚持,你就会尝到胜利的果实。 9 、随时保持自信,认识自己的价值,做一个能真正坚定自己的珍宝商。 7 、有时不合逻辑的举动却恰恰有助于应付变化多端的事态,而正常的逻辑有时却只能将自己带进一个死胡同。这就需要我们有逆反思维。 2 、在人生中只有曲线前进的快乐,没有直线上升的成功。只有珍惜今天,才会有美好的明天;只有把握住今天,才会有更辉煌的明天! 14 、人生就是生活的过程。哪能没有风、没有雨?正是因为有了风雨的洗礼才能看见斑斓的彩虹;有了失败的痛苦才会尝到成功的喜悦。
醇
当堂巩第固17 页
2、分子式为C3H8O的液态有机物A 1 mol,与足量的金属钠反应,可 以生成11.2 L H2(标准状况),则A分子中必含有一个__羟__基____(填官能
团的名称)。若该官能团位于碳链的一端,则A的结构简式为
__C_H__3C__H_2_C_H__2O__H______,A与浓硫酸共热170 ℃以上,发生消去反应的
醇
二、醇的性质
1.与金属钠的反应 可测定分子中羟基个数
2Na + 2ROH
2RONa 醇钠
+
H2↑
断键处 钠置换的是羟基氢
CH2OH + 2Na CH2OH
CH2ONa CH2ONa
+ H2↑
温故知第新10 页
醇
乙醇的消去反应与溴乙烷的消去反应有区别吗?
视频导第学11 页
醇
2.消去反应(分子内脱水)
吸 湿 性 , 护 肤
醇
科学史第话6 页
醇的命名 (1)选主链 选最长碳链,且含-OH (2)编号 从离-OH最近的一端起编
(3)写名称 取代基位置— 取代基名称 — 羟基位置— 母体名称(羟基位 置用阿拉伯数字表示;羟基个数用“二”、“三”等表示)
CH2OH CH2OH
乙二醇
CH2OH 苯甲醇
CH2OH
官能团:—OH(醇羟基)
羟基具有亲水性,低级醇都可溶于水。
2.醇的分类 按烃基种类分类
脂肪醇 CH3OH
芳香醇 —CH2OH
甲醇
苯甲醇
醇
根据醇分子中羟基的3OH 甲醇
(木精、木醇) 剧毒
用于能源领域
CH2CH2
OH OH
乙二醇
汽 车 用 抗 冻 剂
第5 页
三元醇
CH2CH CH2 OH OHOH 丙三醇(甘油)
