高中化学萃取颜色变化及溶液颜色特征精编版
【高中化学】2021年高考化学知识点:化学颜色

【高中化学】2021年高考化学知识点:化学颜色本文主要为考生提供“2021年高考化学常用知识点”,希望对考生朋友有所帮助!
高考
化学知识点总结-颜色:
铁:铁粉是黑色的;一整块纯铁是银白色的。
Fe2+-浅绿色Fe3O4-黑色晶体
fe(oh)2——白色沉淀fe3+——黄色fe(oh)3——红褐色沉淀fe(scn)3——血红色溶液
FeO——黑色粉末Fe(NH4)2(SO4)2——浅蓝绿色Fe2O3——红棕色粉末FES——黑色固体
铜:单质是紫红色cu2+——蓝色cuo——黑色cu2o——红色cuso4(无水)—白色cuso4·5h2o——蓝色cu2(oh)2co3—绿色cu(oh)2——蓝色[cu(nh3)4]so4——深蓝色溶液
BaSO 4、BaCO 3、Ag 2CO 3、CaCO 3、AgCl、Mg(OH)2和三溴苯酚为白色沉淀
al(oh)3白色絮状沉淀h4sio4(原硅酸)白色胶状沉淀
Cl2,氯水-黄绿色F2-浅黄绿色气体Br2-深红棕色液体I2-紫黑色固体
hf、hcl、hbr、hi均为无色气体,在空气中均形成白雾
CCl4——无色液体,密度大于水,与水不溶于KMnO4——紫色MnO4——紫色
na2o2—淡黄色固体ag3po4—黄色沉淀s—黄色固体agbr—浅黄色沉淀
AgI-黄色沉淀O3-浅蓝色气体SO2-无色、刺激性有毒气体
so3—无色固体(沸点44.80c)品红溶液——红色氢氟酸:hf——腐蚀玻璃
N2O4,no--无色气体,NO2--红棕色气体,NH3--有刺鼻气味的无色气体。
高中化学萃取知识点_高中化学重点知识

高中化学萃取知识点_高中化学重点知识与物理相比,记忆在化学这一科中比重很大。
所要背的知识点也多,所以学化学要整的整理知识点。
下面是店铺为大家整理的高中化学萃取知识点,欢迎翻阅。
高中化学萃取知识点(一)1.溶质在两种互不相溶的溶剂中溶解度相差越大,萃取的效果就越好,溶质损失少,效率高.2.萃取剂不仅要溶质的溶解度大,而且沸点低.因为萃取的目的是为了蒸发提纯,而有的溶质易升华,所以用沸点较低的溶剂可减低蒸发温度,来减少蒸发时溶质的损失.3.两种溶剂不反应对于用四氯化碳萃取碘水中碘的实验,将碘水和四氯化碳加入分液漏斗中,关闭两活塞震荡,静置后可观察到上层为水层,颜色接近无色或略发黄,下层为四氯化碳,颜色为紫红色.打开下端活塞,将下层液体放出,当上层液体刚流过下端活塞时,关闭下端活塞,打开上端活塞,将上层液体从上口倒出.残留在下颈处的就不要了.然后蒸发碘的四氯化碳溶液,可得到纯净的碘单质.注意:1.若是苯、汽油等密度小于水的萃取剂,则水在下,萃取剂在上.2.等量的萃取剂,分次萃取效果优于一次萃取.高中化学萃取知识点(二)(1)将要萃取的溶液和萃取溶剂依次从上口倒入分液漏斗,其量不能超过漏斗容积的2/3,塞好塞子进行振荡。
(2)振荡时右手捏住漏斗上口的颈部,并用食指根部压紧塞子,以左手握住旋塞,同时用手指控制活塞,将漏斗倒转过来用力振荡,同时要注意不时地打开活旋塞放气。
(3)将分液漏斗静置,待液体分层后进行分液,分液时下层液体从漏斗口放出,上层液体从上口倒出。
例如用四氯化碳萃取溴水里的溴。
高中化学萃取知识点(三)萃取操作实验萃剂原液互不溶,质溶程度不相同。
充分振荡再静置,下放上倒切分明。
解释:1、萃剂原液互不溶,质溶程度不相同:“萃剂”指萃取剂;“质”指溶质。
这两句的意思是说在萃取操作实验中,选萃取剂的原则是:萃取剂和溶液中的溶剂要互不相溶,溶质在萃取剂和原溶剂中的溶解度要不相同(在萃取剂中的溶解度要大于在原溶液中的溶解度)。
高中化学萃取颜色问题教案

高中化学萃取颜色问题教案
主题:化学实验——萃取颜色问题
时间:1课时
教学目标:
1.了解溶剂的选择对于颜色萃取的影响。
2.掌握颜色萃取实验的操作方法。
3.能够分析实验数据,得出结论。
教学重点和难点:
1.理解颜色溶液的萃取原理。
2.掌握实验操作中的注意事项。
教学准备:
1.化学实验室
2.甲苯、酒精等溶剂
3.色谱仪
4.色素溶液
教学步骤:
1.导入:通过一个生活中的例子引入颜色萃取的概念,激发学生的兴趣。
2.实验操作:
a.将两种颜色相间的溶液滴在白纸上,观察混合颜色。
b.将该混合溶液分别加入甲苯和酒精中,摇匀后观察颜色变化。
c.使用色谱仪分析两种溶液中的各种色素成分。
3.实验分析:
a.通过实验数据和观察结果,引导学生讨论不同溶剂对于颜色萃取的影响。
b.帮助学生总结颜色萃取的原理,并得出结论。
4.实验总结:让学生回答一些问题,总结颜色萃取实验的重要性和应用。
5.课堂讨论:鼓励学生分享对于颜色萃取实验的思考和体会。
6.作业布置:要求学生结合实验结果,撰写一份实验报告。
教学延伸:
1.让学生自行设计颜色萃取实验,尝试使用其他不同的溶剂。
2.组织学生参与化学实验设计比赛,以颜色萃取为主题。
教学评价:
通过学生实际操作和讨论,考察学生对于颜色萃取实验的理解和实验操作能力。
并通过学生的实验报告评价他们的实验总结和分析能力。
从碘水中萃取碘的实验现象及结论

从碘水中萃取碘的实验现象及结论
实验现象:将碘水与一些物质(如淀粉溶液、硫糖溶液等)反应或添加还原剂(如亚硫酸钠溶液等),可以观察到以下现象:1. 碘水与淀粉溶液反应时,溶液从淡黄色变为暗蓝色或紫色,表明碘与淀粉形成了蓝紫色的物质。
2. 碘水与硫糖溶液反应时,溶液从淡黄色变为棕红色或蓝色,表明碘与硫糖形成了棕红色或蓝色的物质。
3. 在添加亚硫酸钠溶液后,碘水的颜色逐渐变淡。
实验结论:通过观察实验现象,可以得出以下结论:
1. 碘与淀粉形成物质,可以用作淀粉的检验方法。
2. 碘与硫糖形成物质,可以用作硫糖的检验方法。
3. 亚硫酸钠可以还原碘,使其从碘水中脱离,因此可以用亚硫酸钠溶液将碘从碘水中萃取出来。
高二化学知识点之化学颜色

高二化学知识点之化学颜色蓝色:新制Cu(OH)2固体、胆矾、硝酸铜、溶液中淀粉与碘变蓝、石蕊试液碱变蓝、pH试纸与弱碱变蓝等。
浅蓝色:臭氧、液氧等蓝色火焰:硫、硫化氢、一氧化碳的火焰。
甲烷、氢气火焰(蓝色易受干扰)。
⑤ 以绿色为色的物质浅绿色:Cu2(OH)2CO3,FeCl2,FeSO47H2O。
绿色:浓CuCl2溶液、pH试纸在约pH=8时的颜色。
深黑绿色:K2MnO4。
黄绿色:Cl2及其CCl4的萃取液。
⑥ 以紫色为基色的物质KMnO4为深紫色、其溶液为红紫色、碘在CCl4萃取液、碘蒸气、中性pH试纸的颜色、K+离子的焰色等。
⑦ 以黑色为基色的物质黑色:碳粉、活性碳、木碳、烟耽氧化铜、四氧化三铁、硫化亚铜(Cu2S)、硫化铅、硫化汞、硫化银、硫化亚铁、氧化银(Ag2O)。
浅黑色:铁粉。
棕黑色:二氧化锰。
⑧ 白色物质无色晶体的粉末或烟尘;与水强烈反应的P2O5;难溶于水和稀酸的:AgCl,BaSO3,PbSO4;难溶于水的但易溶于稀酸:BaSO3,Ba3(PO4)2,BaCO3,CaCO3,Ca3(PO4)2,CaHPO4,Al(OH)3,Al2O3,ZnO,Zn(OH)2,ZnS,Fe(OH)2,Ag2SO3,CaSO3等;微溶于水的:CaSO4,Ca(OH)2,PbCl2,MgCO3,Ag2SO4;与水反应的氧化物:完全反应的:BaO,CaO,Na2O;不完全反应的:MgO。
⑨ 灰色物质石墨灰色鳞片状、砷、硒(有时灰红色)、锗等。
(2)离子在水溶液或水合晶体的颜色① 水合离子带色的:Fe2+:浅绿色;Cu2+:蓝色;Fe3+:浅紫色呈黄色因有[FeCl4(H2O)2] 2-;MnO4-:紫色:血红色;:苯酚与FeCl3的反应开成的紫色。
②主族元素在水溶液中的离子(包括含氧酸根)无色。
运用上述规律便于记忆溶液或结晶水合物的颜色。
(3)主族金属单质颜色的特殊性ⅠA,ⅡA,ⅣA,ⅤA的金属大多数是银白色。
精选高二化学颜色知识点总结

精选高二化学颜色知识点总结
下面为大家整理了高二化学颜色知识点总结,希望大家在空余时间进行复习练习和学习,供参考。
铁:铁粉是黑色的;一整块的固体铁是银白色的。
Fe2+浅绿色Fe3O4黑色晶体
Fe(OH)2白色沉淀Fe3+黄色Fe(OH)3红褐色沉淀Fe(SCN)3血红色溶液
FeO黑色的粉末Fe(NH4)2(SO4)2淡蓝绿色Fe2O3红棕色粉末FeS黑色固体
铜:单质是紫红色Cu2+蓝色CuO黑色Cu2O红色CuSO4(无水)白色CuSO45H2O蓝色Cu2(OH)2CO3绿色Cu(OH)2蓝色
[Cu(NH3)4]SO4深蓝色溶液
BaSO4、BaCO3、Ag2CO3、CaCO3、AgCl、Mg(OH)2、三溴苯酚均是白色沉淀
Al(OH)3白色絮状沉淀H4SiO4(原硅酸)白色胶状沉淀
Cl2、氯水黄绿色F2淡黄绿色气体Br2深红棕色液体I2紫黑色固体
HF、HCl、HBr、HI均为无色气体,在空气中均形成白雾
CCl4无色的液体,密度大于水,与水不互溶KMnO4--紫色MnO4-紫色
Na2O2淡黄色固体Ag3PO4黄色沉淀S黄色固体AgBr浅黄色沉淀
AgI黄色沉淀O3淡蓝色气体SO2无色,有剌激性气味、有毒的气体
SO3无色固体(沸点44.80C)品红溶液红色氢氟酸:HF腐蚀玻璃
N2O4、NO无色气体NO2红棕色气体NH3无色、有剌激性气味气体
以上就是高二化学颜色知识点总结,希望能帮助到大家。
高中化学实验教案酸碱指示剂的颜色变化实验观察

高中化学实验教案酸碱指示剂的颜色变化实验观察高中化学实验教案-酸碱指示剂的颜色变化实验观察引言:实验证明,酸碱指示剂是一种广泛应用于化学和生物学实验中的试剂。
其通过颜色的变化来指示溶液的酸碱性质,从而提供了对溶液酸碱性质的判断依据。
本教案旨在通过实验观察,让学生掌握不同酸碱指示剂在不同酸碱溶液中的颜色变化规律。
实验目的:1. 了解不同酸碱指示剂的颜色特征;2. 观察不同酸碱溶液中酸碱指示剂的颜色变化规律;3. 掌握使用酸碱指示剂进行酸碱滴定实验的方法。
实验器材:1. 酸碱指示剂:苏丹红、酚酞、甲基橙、酚酞鳞片等;2. 酸性溶液:盐酸溶液;3. 碱性溶液:氢氧化钠溶液;4. 平底烧杯、滴管、试管架等。
实验步骤:1. 实验准备:a. 将酸性溶液倒入平底烧杯中;b. 将碱性溶液倒入试管中。
2. 实验操作:a. 取少量酸性溶液,加入几滴酸碱指示剂,搅拌均匀并观察颜色变化;b. 取少量碱性溶液,加入几滴酸碱指示剂,搅拌均匀并观察颜色变化。
实验结果与讨论:针对不同的酸碱指示剂和不同的酸碱溶液,我们观察到以下颜色变化现象:1. 苏丹红:a. 在酸性溶液中,苏丹红呈现红色;b. 在中性溶液中,苏丹红呈现橙色;c. 在碱性溶液中,苏丹红呈现黄色。
2. 酚酞:a. 在酸性溶液中,酚酞呈现红色;b. 在中性或碱性溶液中,酚酞呈现无色。
3. 甲基橙:a. 在酸性溶液中,甲基橙呈现红色;b. 在中性溶液中,甲基橙呈现橙色;c. 在碱性溶液中,甲基橙呈现黄色。
4. 酚酞鳞片:a. 在酸性溶液中,酚酞鳞片保持红色;b. 在碱性溶液中,酚酞鳞片逐渐变为无色。
通过观察以上实验结果,我们可以总结出以下规律:1. 不同酸碱指示剂对应的颜色变化范围不同;2. 酸性溶液中,酸碱指示剂呈现红色;3. 中性溶液中,酸碱指示剂的颜色变化较小;4. 碱性溶液中,酸碱指示剂呈现黄色或无色。
进一步讨论:酸碱指示剂的颜色变化是由于其分子结构的特殊性质导致的。
中学化学物质颜色及颜色反应总结

中学化学常见物质颜色一、常见物质的颜色的状态1、白色固体:MgO、P2O5、CaO、NaOH、Ca(OH)2、KClO3、KCl、Na2CO3、NaCl、无水CuSO4;铁、镁为银白色(汞为银白色液态)2、黑色固体:石墨、炭粉、铁粉、CuO、MnO2、Fe3O4▲KMnO4为紫黑色3、红色固体:Cu、Fe2O3、HgO、红磷▲硫:淡黄色▲Cu2(OH)2CO3为绿色4、溶液的颜色:凡含Cu2+的溶液呈蓝色(如:CuSO4溶液、CuCl2溶液、Cu(NO3)2溶液);凡含Fe2+的溶液呈浅绿色(如:FeSO4溶液、FeCl2溶液、Fe (NO3)2溶液);凡含Fe3+的溶液呈棕黄色(如:Fe2(SO4)3溶液、FeCl3溶液、Fe (NO3)3溶液),其余溶液一般为无色。
(高锰酸钾溶液为紫红色)5、沉淀(即不溶于水的盐和碱):①盐:白色↓:CaCO3、BaCO3(溶于酸)AgCl、BaSO4(也不溶于稀HNO3) 等②碱:蓝色↓:Cu(OH)2,红褐色↓:Fe(OH)3 ,白色↓:其余不溶性碱为白色。
6.颜色反应(燃烧)CO、H2S、H2、CH4、S、乙醇在空气中燃烧火焰的颜色均为淡蓝色。
(硫在氧气中燃烧呈蓝紫色火焰)。
二.褐色物质1.碘酒、溴苯中溶有溴均呈褐色或浅褐色。
2.煤焦油呈黑褐色。
3.Fe(OH)3胶体、Fe(OH)3沉淀呈红褐色。
三.火焰颜色1.铜,铁在氯气中燃烧产生棕色烟。
2.氢气在氯气中燃烧呈苍白色火焰。
四.灰色物质1.As、Sn、Fe3C为灰色。
2.Fe、Cr、Mn等的单质粉末状态一般为灰黑。
五.紫色物质和紫色反应(一)物质1.pH在5--8时石蕊试液、KMnO4溶液、I2的汽油或CCl4 溶液、苯酚与FeCl3溶液反应的产物呈紫色2.钾的焰色反应呈浅紫色3.氩气的灯光呈紫蓝色4、碘蒸气呈紫色(二)反应1、苯酚与FeCl3溶液反应的产物呈紫色。
2、I-与强氧化剂反应生成紫黑色的碘2I- +2e-==I2六.黄色物质和黄色反应(一)物质1.钠的焰色反应、AgI,Ag3PO4,蛋白质与浓硝酸反应的产物、pH>4.4时的甲基橙溶液、pH 在5-6时的pH试纸呈黄色。
高二数学_高二化学颜色知识点总结范文

高二数学_高二化学颜色知识点总结范文高二网权威发布高二化学颜色知识点总结,更多高二化学颜色知识点总结相关信息请访问高二网。
高二化学知识点总结:颜色
铁:铁粉是黑色的;一整块的固体铁是银白色的。
Fe2+——浅绿色Fe3O4——黑色晶体
Fe(OH)2——白色沉淀Fe3+——黄色Fe(OH)3——红褐色沉淀Fe (SCN)3——血红色溶液
FeO——黑色的粉末Fe(NH4)2(SO4)2——淡蓝绿色Fe2O3——红棕色粉末FeS——黑色固体
铜:单质是紫红色Cu2+——蓝色CuO——黑色Cu2O——红色CuSO4(无水)—白色CuSO4·5H2O——蓝色Cu2(OH)2CO3—绿色Cu(OH)2——蓝色[Cu(NH3)4]SO4——深蓝色溶液
BaSO4、BaCO3、Ag2CO3、CaCO3、AgCl、Mg(OH)2、三溴苯酚均是白色沉淀
Al(OH)3白色絮状沉淀H4SiO4(原硅酸)白色胶状沉淀
Cl2、氯水——黄绿色F2——淡黄绿色气体Br2——深红棕色液体
I2——紫黑色固体
HF、HCl、HBr、HI均为无色气体,在空气中均形成白雾
CCl4——无色的液体,密度大于水,与水不互溶KMnO4--——紫色MnO4-——紫色
Na2O2—淡黄色固体Ag3PO4—黄色沉淀S—黄色固体AgBr—浅黄色沉淀
AgI—黄色沉淀O3—淡蓝色气体SO2—无色,有剌激性气味、有毒的气体
SO3—无色固体(沸点44.80C)品红溶液——红色氢氟酸:HF——腐蚀玻璃
N2O4、NO——无色气体NO2——红棕色气体NH3——无色、有剌激性气味气体。
ccl4萃取溴水分层颜色

ccl4萃取溴水分层颜色溴水的分层颜色,可以帮助科学家们更好地理解物质的性质。
有时候,通过溴水的色谱分析可以帮助科学家确定一种物质的活性水平或数量。
通过对溴水萃取物的颜色分析,也可以了解物质的活性水平或数量。
CCl4(氯化碳)是一种有机溶剂,广泛用于有机化学反应。
它也被广泛用于溴水分层颜色,用于分析物质的组成。
为了进行溴水萃取,先将CCl4溶解在溴水中,获得混合溶液。
接下来,将混合溶液滴加到偏光片上,此时就可以看到溴水分层的颜色。
溴水分层颜色包括深蓝色、浅蓝色、淡黄色和橙色四种颜色。
这四种颜色也被称为“溴水色调”。
这四种颜色的产生是由于CCl4和溴水的反应而产生的,从而形成CCl4的络合物。
深蓝色表明有大量的CCl4,而浅蓝色表明较少的CCl4。
淡黄色表明少量的CCl4,而橙色表明没有CCl4。
由此可以看出,溴水分层颜色可以精确地表示CCl4在溴水中的浓度。
在溴水分层颜色中,深蓝色的CCl4分层比其他颜色多,而淡黄色,橙色和浅蓝色的CCl4分层比深蓝色少。
因此,根据溴水分层颜色可以精确地推断出CCl4在溴水中的浓度。
溴水分层颜色的结果不仅取决于CCl4的浓度,而且取决于CCl4的溶剂性。
如果CCl4的溶剂性较强,则浓度越大,分层颜色的变化也越剧烈。
溴水分层颜色中,深蓝色反映出物质中大量的CCl4,而淡黄色、橙色和浅蓝色揭示了CCl4浓度较少。
此外,CCl4溶剂性也会影响溴水分层颜色的结果。
因此,溴水分层颜色可以反映出CCl4的浓度和溶剂性。
溴水萃取技术可以用于科学家们对物质的组成、活性水平及数量进行准确的分析和测量,以便他们更加深入地理解物质的性质。
CCl4溴水萃取技术可以检测出CCl4的浓度,其分层颜色也可以反映出CCl4的溶剂性。
总之,溴水分层颜色是检测CCl4物质组成及活性水平的有效方法。
它可以准确地检测出CCl4的浓度和溶剂性,为科学家们了解物质的性质提供了有力的支持和依据。
此外,这种检测方法易操作、快速,可以满足大量的检测需求,是科学家检测物质性质的不二选择。
高中化学常用物质溶解性表及沉淀颜色

高中化学常用物质溶解性表及沉淀颜色Fe2O3+3H2SO4= Fe2(SO4)3+3H2O 铁锈溶解溶液呈黄色铁器除锈Al2O3+3H2SO4= Al2(SO4)3+3H2O 白色固体溶解CuO+H2SO4=CuSO4+H2O 黑色固体溶解溶液呈蓝色ZnO+H2SO4=ZnSO4+H2O 白色固体溶解MgO+H2SO4=MgSO4+H2O 白色固体溶解2NaOH+H2SO4=Na2SO4+2H2OCu(OH)2+H2SO4=CuSO4+2H2O 蓝色固体溶解Ca(OH)2+H2SO4=CaSO4+2H2OMg(OH)2+H2SO4=MgSO4+2H2O 白色固体溶解2Al(OH)3+3H2SO4=Al2(SO4)3+3H2O 白色固体溶解2Fe(OH)3+3H2SO4=Fe2(SO4)3+3H2O 红褐色沉淀溶解溶液呈黄色Ba(OH)2+ H2SO4=BaSO4+2H2O 生成白色沉淀不溶解于稀硝酸检验SO42的原理BaCl2+ H2SO4=BaSO4+2HCl 生成白色沉淀不溶解于稀硝酸检验SO42的原理Ba(NO3)2+H2SO4=BaSO4+2HNO3 生成白色沉淀不溶解于稀硝酸检验SO42的原理Na2O+2HNO3=2NaNO3+H2O 白色固体溶解CuO+2HNO3=Cu(NO3)2+H2O 黑色固体溶解溶液呈蓝色ZnO+2HNO3=Zn(NO3)2+ H2O 白色固体溶解MgO+2HNO3=Mg(NO3)2+ H2O 白色固体溶解CaO+2HNO3=Ca(NO3)2+ H2O 白色固体溶解NaOH+HNO3=NaNO3+ H2OCu(OH)2+2HNO3=Cu(NO3)2+2H2O 蓝色固体溶解Mg(OH)2+2HNO3=Mg(NO3)2+2H2O 白色固体溶解Al(OH)3+3HNO3=Al(NO3)3+3H2O 白色固体溶解Ca(OH)2+2HNO3=Ca(NO3)2+2H2OFe(OH)3+3HNO3=Fe(NO3)3+3H2O 红褐色沉淀溶解溶液呈黄色3NaOH + H3PO4=3H2O + Na3PO43NH3+H3PO4=(NH4)3PO42NaOH+CO2=Na2CO3+ H2O 吸收COO2H2中的CO22NaOH+SO2=Na2SO3+ H2O 2NaOH+SO3=Na2SO4+ H2O 处理硫酸工厂的尾气(SO2)FeCl3+3NaOH=Fe(OH)3+3NaCl 溶液黄色褪去有红褐色沉淀生成。
高中化学一萃取颜色汇总
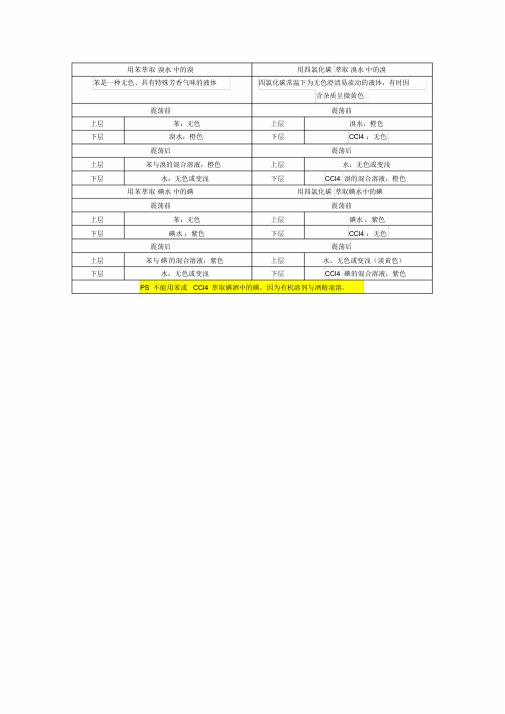
用苯萃取溴水中的溴用四氯化碳萃取溴水中的溴
苯是一种无色、具有特殊芳香气味的液体四氯化碳常温下为无色澄清易流动的液体,有时因
含杂质呈微黄色
震荡前震荡前
上层苯:无色上层溴水:橙色
下层溴水:橙色下层CCl4 :无色
震荡后震荡后
上层苯与溴的混合溶液:橙色上层水:无色或变浅
下层水:无色或变浅下层CCl4 溴的混合溶液:橙色用苯萃取碘水中的碘用四氯化碳萃取碘水中的碘
震荡前震荡前
上层苯:无色上层碘水:紫色
下层碘水:紫色下层CCl4 :无色
震荡后震荡后
上层苯与碘的混合溶液:紫色上层水:无色或变浅(淡黄色)下层水:无色或变浅下层CCl4 碘的混合溶液:紫色PS 不能用苯或CCl4 萃取碘酒中的碘,因为有机溶剂与酒精混溶。
化学颜色及现象大全

铁:铁粉是黑色的;一整块的固体铁是银白色的。
Fe2+——浅绿色Fe3O4——黑色晶体Fe(OH)2——白色沉淀Fe3+——黄色Fe (OH)3——红褐色沉淀Fe (S)3——血红色溶液FeO——黑色的粉末Fe (NH4)2(SO4)2——淡蓝绿色Fe2O3——红棕色粉末FeS——黑色固体铜:单质是紫红色Cu2+——蓝色CuO——黑色Cu2O——红色CuSO4(无水)—白色CuSO4*5H2O——蓝色Cu2 (OH)2CO3 —绿色Cu(OH)2——蓝色[Cu(NH3)4]SO4——深蓝色溶液BaSO4 、BaCO3 、Ag2CO3 、CaCO3 、AgCl 、Mg (OH)2 、三溴苯酚均是白色沉淀Al(OH)3 白色絮状沉淀H4SiO4(原硅酸)白色胶状沉淀Cl2、氯水——黄绿色F2——淡黄绿色气体Br2——深红棕色液体I2——紫黑色固体HF、HCl、HBr、HI均为无色气体,在空气中均形成白雾CCl4——无色的液体,密度大于水,与水不互溶KMnO4--——紫色MnO4-——紫色Na2O2—淡黄色固体Ag3PO4—黄色沉淀S—黄色固体AgBr—浅黄色沉淀AgI—黄色沉淀O3—淡蓝色气体SO2—无色,有剌激性气味、有毒的气体SO3—无色固体(沸点44.8 0C)品红溶液——红色氢氟酸HF——腐蚀玻璃N2O4、NO——无色气体NO2——红棕色气体NH3——无色、有剌激性气味气体三、现象:1、铝片与盐酸反应是放热的,Ba(OH)2与NH4Cl反应是吸热的;2、Na与H2O(放有酚酞)反应,熔化、浮于水面、转动、有气体放出;(熔、浮、游、嘶、红)3、焰色反应:Na 黄色、K紫色(透过蓝色的钴玻璃)、Cu 绿色、Ca砖红、Na+(黄色)、K+(紫色)。
4、Cu丝在Cl2中燃烧产生棕色的烟;5、H2在Cl2中燃烧是苍白色的火焰;6、Na在Cl2中燃烧产生大量的白烟;7、P在Cl2中燃烧产生大量的白色烟雾;8、SO2通入品红溶液先褪色,加热后恢复原色;9、NH3与HCl相遇产生大量的白烟;10、铝箔在氧气中激烈燃烧产生刺眼的白光;11、镁条在空气中燃烧产生刺眼白光,在CO2中燃烧生成白色粉末(MgO),产生黑烟;12、铁丝在Cl2中燃烧,产生棕色的烟;13、HF腐蚀玻璃:4HF + SiO2 =SiF4 + 2H2O14、Fe(OH)2在空气中被氧化:由白色变为灰绿最后变为红褐色;15、在常温下:Fe、Al 在浓H2SO4和浓HNO3中钝化;16、向盛有苯酚溶液的试管中滴入FeCl3溶液,溶液呈紫色;苯酚遇空气呈粉红色。
高中化学萃取颜色变化及溶液颜色特征

溶液的颜色都是因为里面有特殊有色离子的存在导致的
二价铜离子蓝色或者四蓝绿色
一价铜砖红色
二价铁(亚铁)淡绿色
三价铁黄色
高锰酸根离子紫红色
锰酸根离子绿色
二价锰离子淡粉色
四价锰(二氧化锰)黑色
重铬酸根离子橙色
铬酸根离子黄色
氯化铜浓溶液,硝酸铜浓溶液绿色
特殊的是石蕊酚酞遇酸碱变色就不说了
但是有一个特殊的是三价铁离子遇SCN-变为血红色(重点)
如果遇到什么溶液即可根据对应的有色离子判断颜色.
高考常见的是碘水和溴水的萃取分液
碘水本身是棕黄色,加入密度小于水的萃取剂,例如苯,则上层有机层为紫红色,下层水层为无色;若加入密度大于水的萃取剂,例如CCl4,则上层水层为无色,下层有机层为紫红色.
溴水本身是橙黄色,加入密度小于水的萃取剂,例如苯,则上层有机层为橙红色,浓度更大的话会呈现红棕色,下层水层为无色;若加入密度大于水的萃取剂,例如CCl4,则上层水层为无色,下层有机层为橙红色,浓度大也会呈现红棕色.。
高二化学物质颜色知识点总结-精选教育文档

高二化学物质颜色知识点总结
为了方便高二的同学们更好地学习掌握物理知识,小编在这里整理了高二化学物质颜色知识点总结,供大家参考学习,希望能对大家有帮助!
铁:铁粉是黑色的;一整块的固体铁是银白色的。
Fe2+——浅绿色Fe3O4——黑色晶体
Fe(OH)2——白色沉淀Fe3+——黄色Fe(OH)3——红褐色沉淀Fe(SCN)3——血红色溶液
FeO——黑色的粉末Fe(NH4)2(SO4)2——淡蓝绿色
Fe2O3——红棕色粉末FeS——黑色固体
铜:单质是紫红色Cu2+——蓝色CuO——黑色Cu2O——红色CuSO4(无水)—白色CuSO4·5H2O——蓝色Cu2(OH)2CO3—绿色Cu(OH)2——蓝色[Cu(NH3)4]SO4——深蓝色溶液
BaSO4、BaCO3、Ag2CO3、CaCO3、AgCl、Mg(OH)2、三溴苯酚均是白色沉淀
Al(OH)3白色絮状沉淀H4SiO4(原硅酸)白色胶状沉淀
Cl2、氯水——黄绿色F2——淡黄绿色气体Br2——深红棕色液体I2——紫黑色固体
HF、HCl、HBr、HI均为无色气体,在空气中均形成白雾CCl4——无色的液体,密度大于水,与水不互溶KMnO4--——紫色MnO4-——紫色
Na2O2—淡黄色固体Ag3PO4—黄色沉淀S—黄色固体AgBr—
浅黄色沉淀
AgI—黄色沉淀O3—淡蓝色气体SO2—无色,有剌激性气味、有毒的气体
SO3—无色固体(沸点44.80C)品红溶液——红色氢氟酸:HF——腐蚀玻璃
N2O4、NO——无色气体NO2——红棕色气体NH3——无色、有剌激性气味气体
以上就是查字典化学网为大家提供的高二化学物质颜色知
识点总结,更多精彩尽在查字典化学网,敬请关注!。
(完整版)高中化学一萃取颜色汇总
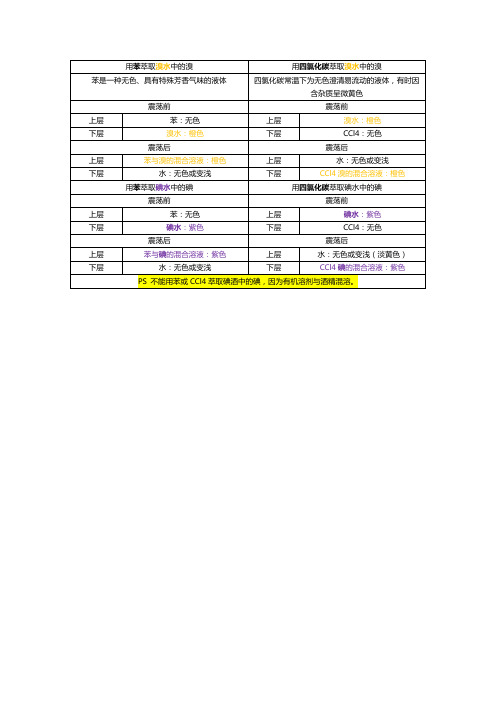
用四氯化碳萃取溴水中的溴
苯是一种无色、具有特殊芳香气味的液体
四氯化碳常温下为无色澄清易流动的液体,有时因含杂质呈微黄色
震荡前
震荡前
上层
苯:无色
上层
溴水:橙色
下层
溴水:橙色
下层
CCl4:无色
震荡后
震荡后
上层
苯与溴的混合溶液:橙色
上层
水:无色或变浅
下层
水:无色或变浅
下层
CCl4溴的混合溶液:橙色
用苯萃取碘水中的碘
用四氯化碳萃取碘水中的碘
震荡前
震荡前
上层ห้องสมุดไป่ตู้
苯:无色
上层
碘水:紫色
下层
碘水:紫色
下层
CCl4:无色
震荡后
震荡后
上层
苯与碘的混合溶液:紫色
上层
水:无色或变浅(淡黄色)
下层
水:无色或变浅
下层
CCl4碘的混合溶液:紫色
PS不能用苯或CCl4萃取碘酒中的碘,因为有机溶剂与酒精混溶。
探究萃取溴水后有机层颜色的差异与溴水浓度、体积的关系

探究萃取溴水后有机层颜色的差异与溴水浓度、体积的关系摘要:以煤油、四氯化碳、苯为不同溶剂对同体积不同浓度或同浓度不同体积的溴水进行萃取,探究萃取后有机层和水层颜色的差异与溴水浓度、体积之间的关系。
关键词:不同溶剂;萃取;浓度;体积;颜色差异萃取是利用物质在互不相溶的溶剂里溶解度的不同,用一种溶剂把物质从它与另一种溶剂所组成的溶液里提取出来[1];萃取实验操作的教学是高中化学常规的操作,也一直认为这个实验十分简单;直到有一次在学生分组实验教学观摩课上,学生完成了萃取溴水分组实验后学生发现,不同小组用不同有机溶剂萃取后有机层的颜色有较大差异。
有学生提出了二个问题:1.用同体积、不同的有机溶剂萃取同体积溴水时,萃取后有机溶剂层的颜色越深是否能说明原来溴水的浓度越大?2.用同体积、同一有机溶剂萃取同浓度溴水时,溴水体积越大,有机溶剂层的颜色是否会越深?为解决上述疑惑,笔者决定通过现有高中实验条件,设计课堂实验探究上述问题。
一、实验用品质量分数3%的溴水,质量分数0.5%的溴水,质量分数0.1%的溴水,煤油、四氯化碳、苯、烧杯、玻璃棒、试管(带塞)、量筒、分液漏斗(梨型)。
二、实验步骤1.在常温、常压下,探究同体积的不同溶剂萃取同体积质量分数为3%的溴水[2]实验1-3分析如下:三个实验所用的溴水浓度、体积均一致、萃取溶剂的体积也完全一致。
从实验后颜色来看,三种溶剂萃取溴水后水层的颜色比较接近,均呈淡黄色,这可能是因为溴水浓度较大,水中溶解少量溴的原因。
但萃取后有机溶剂层的颜色差异明显,选择CCl4萃取后有机溶剂层颜色最深,而选择煤油萃取后有机溶剂层的颜色最浅,且颜色的差异明显。
2.在常温、常压下,探究同体积的不同溶剂萃取同体积、浓度相同且较低的溴水由实验1、4、7(一组);2、5、8(一组);3、6、9(一组)等三组实验对比来看:选择同体积、同一有机溶剂萃取同体积、不同浓度溴水时,随着溴水浓度的降低,水层与有机溶剂的颜色都会呈现逐渐变浅趋势。
高中化学溶液颜色

高中化学溶液颜色
第一章高中化学溶液颜色
1.1 实验用原理
高中化学溶液的颜色受到很多因素的影响,如溶液中的化学强度、pH、温度等。
每条溶液都具有不同的颜色,每种溶液的颜色都受到它的组成所影响。
溶液的温度也会影响溶液的颜色,温度越高,溶液的颜色就越深。
1.2 测试结果
在实验中,我们使用不同的溶液进行实验,以观察不同的溶液的颜色。
(1)氢氧化钠溶液:淡黄色
(2)氯化钠溶液:淡黄色
(3)硫酸钠溶液:淡蓝色
(4)硝酸钠溶液:淡绿色
(5)氢氧化钙溶液:浅红色
(6)铁(II)氢氧化钾溶液:深紫色
(7)氯化钾溶液:淡蓝色
1.3 结论
实验中,不同的溶液具有不同的颜色,这与溶液的成分有关。
因此,我们可以从溶液的颜色确定溶液的成分。
- 1 -。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
高中化学萃取颜色变化及溶液颜色特征精编版 MQS system office room 【MQS16H-TTMS2A-MQSS8Q8-MQSH16898】
溶液的颜色都是因为里面有特殊有色离子的存在导致的
二价铜离子蓝色或者四蓝绿色
一价铜砖红色
二价铁(亚铁)淡绿色
三价铁黄色
高锰酸根离子紫红色
锰酸根离子绿色
二价锰离子淡粉色
四价锰(二氧化锰)黑色
重铬酸根离子橙色
铬酸根离子黄色
氯化铜浓溶液,硝酸铜浓溶液绿色
特殊的是石蕊酚酞遇酸碱变色就不说了
但是有一个特殊的是三价铁离子遇SCN-变为血红色(重点)
如果遇到什么溶液即可根据对应的有色离子判断颜色.
高考常见的是碘水和溴水的萃取分液
碘水本身是棕黄色,加入密度小于水的萃取剂,例如苯,则上层有机层为紫红色,下层水层为无色;若加入密度大于水的萃取剂,例如CCl4,则上层水层为无色,下层有机层为紫红色.
溴水本身是橙黄色,加入密度小于水的萃取剂,例如苯,则上层有机层为橙红色,浓度更大的话会呈现红棕色,下层水层为无色;若加入密度大于水的萃取剂,例如CCl4,则上层水层为无色,下层有机层为橙红色,浓度大也会呈现红棕色.。
